Oxidación Metabólica de la Glucosa: Consideraciones Termodinámicas para el Gasto de Energía Anaeróbico y Aeróbico
Zoran Djurisic2 y Christopher Scott1
1University of Southern Maine, Gorham, Estados Unidos.
2University of California, Berkeley, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2008.
Publicado 9 de enero de 2009
Resumen
Palabras clave: metabolismo, glucólisis, bioenergética, consumo de oxígeno, deuda de oxígeno
INTRODUCCION
La relación estequiométrica de la utilización de sustrato e intercambio gaseoso se conoce con detalle (Tabla1). La pregunta que nos planteamos es: ¿Por que existe una diferencia en los factores de conversión de 19,6 kJ y 21,1 kJ cuando el calor se expresa por litro de oxígeno consumido? A lo largo del presente análisis intentaremos desestimar en parte el concepto de eficiencia de sustrato como explicación, tal como se evidencia, por ejemplo, en la medición de una menor pérdida de calor con el incremento del VO2 (consumo de oxígeno) cuando se utilizan las grasas en comparación con la glucosa. En cambio la diferencia será analizada en términos de conceptos termodinámicos de intercambios energéticos aeróbicos y anaeróbicos a lo largo de las vías metabólicas. El sesgo humano es evidente teniendo en cuenta que el gasto de energía de todos los tipos, tanto aeróbico como anaeróbico, ha sido y frecuentemente continua siendo representado solamente a través de mediciones del consumo de oxígeno. Notablemente nuestro conocimiento referente al gasto de energía no comenzó con un enfoque diferente a este.

Tabla 1. Intercambio gaseoso (RER) y estequiometría de los sustratos.
Breve Historia acerca del Sesgo del Gasto Energético
Dos mil años atrás los griegos pensaban que el calor era un requisito previo para la vida (2). Setecientos años atrás, el investigador Belga Jean Baptiste van Helmont, afirmo lo contrario; la vida produce calor.
A manera de prueba citó el proceso de elaboración de vinos, donde se produce calor a partir del proceso de fermentación (la fermentación es por supuesto un proceso anaeróbico de degradación de la glucosa, no relacionado al oxígeno). Unos pocos cientos de años luego Luis Pasteur se dedicó al estudio de la fermentación y reconoció que el mismo era un proceso biológico (complejo) que se producía en la naturaleza y no un proceso de desintegración química como lo suponían los demás. Eduard Buchner recibió el Premio Nobel en 1907 cuando demostró que el complejo proceso de la fermentación, en condiciones apropiadas, podía ser llevado a cabo igualmente bien por las levaduras vivas o en un tubo de ensayo. A Harden y W.J Young fueron los primeros en reconocer la importancia del fosfato inorgánico (Pi) no tanto como parte del ATP si no como parte del proceso de fermentación (en 1913). Para 1940 la historia de la bioquímica fue literalmente escrita cuando se descubrió enteramente la vía metabólica de Embden- Meyerhoff. "De hecho, el desarrollo de la bioquímica y la delimitación de esta ruta metabólica fueron palmo a palmo" (p. 349) (3). La bioquímica tuvo orígenes anaeróbicos. Pero, a causa de lo importantes que fueron esos logros, la independencia del intercambio de energía de la glucólisis anaeróbica, fue rápidamente desplazada.
Para mediados del siglo 20, los estudios mitocondriales y las mediciones de consumo de oxígeno cobraron importancia rápidamente (4), ensombreciendo los descubrimientos anaeróbicos previos. Se sabe que los intercambios energéticos en animales y humanos responden a las leyes de la termodinámica, la producción de calor biológico y el consumo de oxígeno son proporcionales (bajo condiciones específicas) y las determinaciones del consumo de oxígeno se transformaron en la “metodología oficial” para estimar el gasto energético (5). Sucintamente, el intercambio de energía anaeróbico (glucolítico) perdió su protagonismo y la terminología siguió su ejemplo: el gasto de energía anaeróbico al comienzo del ejercicio fue descripto, no como un período de aportes metabólicos anaeróbicos, sino que por el contrario en el contexto de un déficit de oxígeno (6); el gasto de energía anaeróbico a lo largo de todo el ejercicio fue cuantificado como parte de una deuda de oxígeno (7).
La fosforilacion de sustrato anaeróbica (glucólisis) junto con la explicación esbozada por el brillante ganador del premio Nobel Peter Mitchells de la conversión quimio-eléctrica de la energía dentro de la mitocondria, dos metodologías muy diferentes de intercambio energético, continúan siendo representadas como una interpretación singular del intercambio de energía entre sustratos de 6 carbonos (ej. glucosa) y de 3 carbonos (piruvato, lactato). Esto es, a medida que un litro de oxígeno consumido genera 21,1 kJ (aprox. 5 kcal) de calor durante la oxidación de la glucosa o lactato.
De todas maneras, algunas formas de ejercicio (actividad) contienen componentes tanto del gasto de energía aeróbico como del anaeróbico. Como se observa en la Tabla 1; las interpretaciones del gasto de energía basadas solamente en el oxígeno pueden ser confusas. Los valores MET describen el gasto de energía en múltiplos de la tasa metabólica en reposo, medidos como consumo de oxígeno: 1 MET = 1 x gasto de energía en reposo; 2METs = 2 x gasto de energía en reposo; 3 METs = 3 x gasto de energía en reposo y así sucesivamente. Realizando un análisis más detallado, ¿es real que pintar al aire libre provoca un gasto de energía pico mayor que la calistenia (lagartijas, sentarse en cuclillas, y cosas por el estilo)? ¿Realmente el golf aumenta la tasa metabólica hasta un nivel más alto que la que se alcanza con eventos de gimnasia (ejercicios en el suelo, barras asimétricas, viga de equilibrio, saltos con apoyo, etc.) o ¿son afirmaciones que deben ser probadas? Si la Tabla 2 también incluyera una estimación de los equivalentes de energía anaeróbica (Tabla 3), entonces probablemente los valores MET serían más altos en aquellos ejercicios y actividades que contienen un componente anaeróbico (es decir, entrenamiento con sobrecarga, calistenia, gimnasia).
Está claro que la metodología de medir el consumo de oxígeno para estimar el gasto de energía en ejercicios de tipo aeróbico de larga duración con recuperación no puede ser utilizada para explicar el gasto de energía de ejercicios anaeróbicos de intensidad media a elevada de corta duración con recuperación (8).

Tabla 2. Valores en METs para ciertas actividades seleccionadas.
En el contexto anterior, los METs se presentan como un múltiplo de la tasa metabólica en reposo; es decir, como una “medida” relativa de intensidad. En otras descripciones los METs han sido traducidos como 1 kcal por minuto de manera que puede tomarse como que también poseen un componente de duración (27).
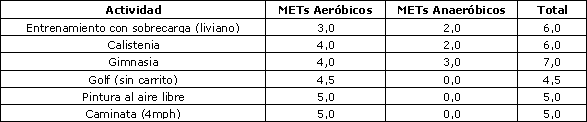
Tabla 3. Valores MET aeróbicos y anaeróbicos hipotéticos para las actividades seleccionadas.
Así como la oxidación metabólica de la glucosa contiene un componente de intercambio de energía anaeróbico, también lo hace el gasto de energía de los ejercicios y actividades breves de alta intensidad. La tabla anterior considera, al igual que la Tabla 1, los aumentos metabólicos pico y no la duración metabólica. La adición de un componente anaeróbico al valor MET aeróbico tradicional sirve para identificar este aumento en la intensidad metabólica. Estos valores anaeróbicos son hipotéticos y no verdaderas mediciones.
¿(In-)eficiencia de los Sustratos?
En el siglo 19 se demostró que el calor equivalente del consumo de oxígeno era mayor para los carbohidratos que para las grasas; 21,1 kJ/L O2 para la glucosa, y 19,6 kJ/L O2 para las grasas (ver 9). Sin embargo es importante entender que estas equivalencias fueron descubiertas un siglo antes que se establecieran las vías bioquímicas del metabolismo aeróbico y anaeróbico. Quizás como resultado, las explicaciones que se han proporcionado acerca de la diferencia en la liberación de calor a partir de la oxidación de grasas y carbohidratos a menudo se han planteado solamente en términos de la "eficiencia del sustrato" (10). Los carbohidratos son un combustible más económico que las grasas cuando se interpreta en términos de mediciones del consumo de oxígeno, aportando 7% más de energía por litro de oxígeno consumido:
Esta explicación que se proporciona para justificar la diferencia en la liberación de calor como eficiencia del sustrato no es completamente falsa. Como se demostrará, por litro de oxígeno consumido, la diferencia entre el metabolismo de las grasas y la glucosa también puede ser explicada analizando las vías metabólicas (bioquímicas) involucradas en la degradación de los sustratos y en el intercambio de energía del sistema y no sólo por la oxidación del sustrato en sí mismo.
Ecuación 1
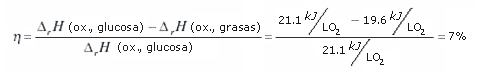
Dónde: η = eficiencia; ∆rH = entalpía del reactivo; ox = oxidación.
Intercambio de Energía Aeróbico y Anaeróbico
El término "anaeróbico" significa sin aire, erróneamente interpretado como sin oxígeno. Este punto necesita ser señalado porque en la actualidad la estimación del gasto de energía es realizada casi exclusivamente por las mediciones del consumo de oxígeno, no por la pérdida de calor. Cierta y fundamentalmente, la síntesis aeróbica de ATP mitocondrial utiliza oxígeno y provoca pérdida de calor que se debe a un intercambio de energía ineficiente (5). Así el intercambio de energía es un proceso imperfecto (e irreversible), tanto para el metabolismo aeróbico como para el metabolismo anaeróbico según lo establece la segunda ley de la termodinámica; siempre que se produzca intercambio de energía, se pierde energía hacia el medio ambiente. Los intercambios de energía de la síntesis de ATP a través de la fosforilación a nivel de sustrato en la glucólisis anaeróbica son ineficientes, y también son ineficientes en la síntesis de ATP mitocondrial (3, 11).
Los bioquímicos han reconocido durante mucho tiempo como un importante logro la cuantificación de los cambios en la energía de Gibbs (es decir, ∆G).
Los cambios en la energía de Gibbs identifican el potencial y la cantidad de intercambio de energía para las reacciones químicas y bioquímicas como un conjunto de cambios de entalpía (∆H) y entropía (∆S) (en los formatos más rigurosos la entropía esta relacionada con la temperatura, T∆S):
Ecuación 2
∆G= ∆H - ∆S
¿Entonces que es lo que "regula" los intercambios de energía de Gibbs durante la glucólisis? Las mediciones y cálculos de la energía de Gibbs (∆G), entalpía (∆H) y entropía (∆S) durante la degradación de la glucosa revelan que: "… la glucólisis está regulada principalmente por el término de la entropía [∆S; glucosa a piruvato] hasta el último paso y la reacción es regulada por el término de la entalpía [∆H; piruvato a lactato] " (11, pág. 460). Aquí hay un importante mensaje; los cambios en la entropía o en la entalpía o en ambas pueden llevar adelante una reacción (bio) química. Por ejemplo durante la degradación de glucosa a piruvato, el intercambio de energía anaeróbico se observa principalmente por el cambio global en la entropía (∆S) y no por el intercambio de calor. A diferencia del consumo de oxígeno y de la perdida de calor, los cambios de la entropía son calculados y no medidos; y por lo tanto generalmente no son considerados o aplicados a los costos de la vida (ej., ejercicio y actividad). Debido a que el calor sólo se produce con formación de lactato, la degradación de la glucosa a lactato se refleja en las mediciones de calor (es decir, el cambio en la entalpía, ∆H) (11). Tal como se demostrará, el reconocimiento y aplicación de los cambios producidos por la entalpía (∆H) y la entropía (∆S) durante la resíntesis de ATP en la glucólisis definen mejor el intercambio anaeróbico de energía, especialmente cuando se define como una medida del consumo de oxígeno (12):
Ecuación 3
∆G = H + ∆S; glucosa a piruvato
(regulado por la entropía).
Ecuación 4
∆G = ∆H + ∆S; piruvato a lactato
(regulado por la entalpía)
Los metabolismos anaeróbico y aeróbico son muy diferentes con respecto a los respectivos mecanismos de intercambio de energía. El intercambio de energía vía fosforilacion a nivel de sustrato anaeróbica (cambios y transferencias de fosfato que se producen durante la glucólisis) no tiene nada en común con el intercambio de energía aeróbico mitocondrial que involucra el ciclo de Krebs, la cadena de transporte de electrones, los gradientes quimio-osmóticos (H+) (gradiente de protones), y las ATPasas de membrana (aunque el ciclo de Krebs posee un paso de fosforilación a nivel de sustrato).
Como se observa en la mayoría de los textos de bioquímica, la oxidación completa de la glucosa comprende un metabolismo anaeróbico y aeróbico; la glucólisis anaeróbica se produce antes que la oxidación aeróbica del piruvato. Así, el intercambio de energía de la oxidación completa de la glucosa, cuando se evalúa a través de una medición del consumo de oxígeno, es mayor que el intercambio que uno podría inferir a partir del estudio de la parte aeróbica del proceso sola (i.e, respiración/oxidación mitocondrial). Nuevamente, las primeras mediciones del consumo de oxígeno y la producción de anhídrido carbónico no estuvieron asociadas con los análisis bioquímicos y termodinámicos (10), por lo que no se reconoce y a veces se ignora que la glucólisis anaeróbica proporciona una "extensión natural del gasto energético" al gasto de energía relacionado al oxígeno. La "extensión anaeróbica" a la oxidación mitocondrial del piruvato se presenta en forma de entropía.
La conversión habitual de 1 litro de O2 consumido a la liberación de energía de 21,1 kJ por litro O2 consumido durante la oxidación de la glucosa se debe en parte al componente anaeróbico de la degradación de la glucosa. Nuestra hipótesis de trabajo reconoce el componente metabólico anaeróbico de la glucosa reaccionante tanto si la glucólisis se representa como un cambio en la entropía (∆S) o si se representa como un cambio en la entalpía (∆H), respectivamente:
Ecuación 5

Ley de Thornton: Combustión
Cuando se expresa por unidad de oxígeno consumido, debería haber una pequeña variación (±5%) en la liberación de calor entre la oxidación aeróbica de la glucosa y las grasas. La combustión es un proceso completamente aeróbico y no tiene ningún componente anaeróbico. La relación entre el consumo de oxígeno y la producción de calor durante la combustión (es decir, la oxidación aeróbica total) fue publicada por primera vez en 1917 por William Thornton (13). Sus resultados, obtenidos a partir de una variedad de gases combustibles, describían una relación tan sencilla que comenzó a denominarse Ley de Thornton (o regla de Thornton).
Si bien los datos de Thornton describían la combustión de los gases, la regla se aplica a la mayoría de los líquidos y sólidos combustibles. Thornton reveló que la pérdida de calor de muchas substancias combustibles se correlaciona notablemente con la cantidad de oxígeno consumido (14). Entonces, a medida que se rompen las uniones químicas C-H (carbono-hidrógeno) y C-C (carbono -carbono) de los combustibles y se forman las uniones con oxígeno que originan el dióxido de carbono (CO2) y agua (H2O), se produce una cantidad similar de calor independientemente de cual es la fuente de los electrones; los datos poseen una dispersión de ± 5%. La ligera variación que se observa en la producción de calor en la combustión, a medida que se forman las uniones con oxígeno de las diferentes fuentes de combustible, depende de la proporción que haya de los diferentes tipos de uniones químicas dentro de las moléculas de combustible (por ejemplo, enlaces carbono-carbono simples o dobles, enlaces hidrógeno-carbono, enlaces carbono-oxígeno).
Mientras más grandes sean las moléculas (por ejemplo, las grasas), la proporción de los diferentes tipos de enlaces químicos será más constante. En las moléculas más pequeñas (por ejemplo, glucosa) la contribución relativa de una unión química a la energía química total de una molécula es mayor, y por lo tanto produce en una variabilidad mayor en la relación consumo de oxígeno – producción de calor.
Las ciencias que estudian la combustión utilizan la ley de Thornton para medir el consumo de oxígeno y estimar la energía consumida mediante la siguiente fórmula (14):
Ecuación 6
∆H = -450 ± 23 kJ por mol de O2
Ley de Thornton: Respiración
Hace aproximadamente 200 años Antoine Lavoisier sugirió que la respiración y la combustión eran procesos similares en lo referente a la producción de calor y al consumo de oxígeno. Esta afirmación nunca ha sido refutada y probablemente nunca lo sea.
En base a estudios de microcalorimetría en líneas celulares de mamíferos, el equivalente calórico del O2 en la respiración aeróbica completa (que no contiene ningún componente metabólico anaeróbico) es ligeramente más alto que en la combustión (Ecuación 7) (15-16):
Ecuación 7
ΔH = -470 ± 24 kJ por mol de O2
La diferencia de 20 kJ por mol del O2 (4%) entre la combustión (-450 kJ por mol de O2) y la respiración (-470 kJ por mol de O2) es el resultado de “reacciones secundarias” que provocan una notable producción de calor no relacionadas al ATP que se producen en el interior de los tejidos vivos (reacciones ácido-base por ejemplo) (15-16). Al igual que en la combustión, se piensa que el equivalente calórico del O2 durante la respiración (-470 kJ. mol O2–1) es notablemente constante (±5%) para diferentes tejidos vivos que realizan la respiración aeróbica completa.
Para utilizar el consumo de oxígeno medido para estimar el gasto de energía durante la oxidación biológica (respiración mitocondrial aeróbica completa), es más conveniente expresar el equivalente calórico del oxígeno por litro de oxígeno.
A 0°C y a presión atmosférica un mol de oxígeno ocupa 22,4 L. Utilizando la ley de los gases ideales, el equivalente calórico del oxígeno puede ser transformado en la regla de Thornton de la siguiente manera: (Ecuación 8) (17-18):
Ecuación 8
∆H = 19,6 kJ/L O2
La mayoría reconocería que la ecuación anterior se basa en la oxidación de las grasas. Si bien esto es cierto, esto aporta oxígeno a la ecuación del gasto de energía, que no contiene un componente de intercambio de energía anaeróbico; la oxidación de las grasas es completamente aeróbica.
Una estimación de intercambio de energía biológico basada en la oxidación de glucosa proviene de la re-síntesis de ATP por ambos componentes metabólicos; aeróbico (~32-33 moléculas de ATP) y anaeróbico (~2-3 moléculas de ATP); (~ 34-36 ATP en total por molécula de glucosa). Teniendo en cuenta esta información nosotros planteamos que el valor de 1,5 kJ de gasto de energía - como un conjunto de cambios de entropía y entalpía - por litro de oxígeno consumido está asociado no sólo con la diferente proporción de los tipos de uniones químicas encontrada entre la glucosa oxidada y las grasas, si no que también con la energía metabólica de la transformación de glucosa a piruvato en anaerobiosis (es decir, fosforilación anaeróbica del sustrato) (Ecuación 9):
Ecuación 9
19,6 kJ intercambio de energía aeróbico + 1,5 kJ intercambio de energía anaeróbico = 21,1 kJ (intercambio de energía total por L O2)
En la Tabla 2, los METs no se expresan como estimación del consumo de oxígeno sino que como un conjunto formado tanto por el gasto de energía aeróbico y anaeróbico como por la glucólisis anaeróbica que es una "extensión natural" al consumo de oxígeno de una de serie de ejercicio de corta duración (12).
Gasto de Energía durante el Ejercicio y la Recuperación
Como cualquier historiador de las ciencias del ejercicio podría recordar, el gasto de energía de la glucólisis anaeróbica ha sido tradicionalmente e incorrectamente descripto como la zona del consumo de oxígeno durante la recuperación dónde 1 L O2 = 21,1 kJ (i.e; metodología de la deuda de oxígeno).
Debido a las dificultades para explicar el gasto de energía anaeróbico, los científicos que estudian el ejercicio normalmente recurren a la medición de uno solo o dos de los tres componentes del gasto de energía total:
- Gasto de energía durante el ejercicio aeróbico – falta las mediciones referentes al ejercicio anaeróbico y a la recuperación aeróbica.
- Gasto de energía durante los ejercicios aeróbicos y anaeróbicos – falta la medición de la recuperación aeróbica.
- Gasto de energía durante el ejercicio aeróbico y la recuperación aeróbica – falta la medición del ejercicio anaeróbico.
El gasto de energía aeróbico puede ser estimado más sencillamente como una medida del consumo de oxígeno, pero es necesario considerar seriamente que el calor (energía en kJ) es la referencia estándar, y que la entropía también está asociada con los intercambios de energía. Mediante una variedad de líneas celulares de mamíferos, Gnaiger y Kemp midieron un aumento proporcional en la entalpía que acompañaba a la producción de lactato (la reacción de piruvato a lactato es regulada por la entalpía) (16).
¿Las mediciones del lactato explican el gasto de energía de la glucólisis anaeróbica?
Muchos fisiólogos del ejercicio contemporáneos observaron previamente que las concentraciones de lactato en el músculo y en sangre no pueden ser utilizadas para cuantificar el gasto de energía anaeróbico de la glucólisis. Estas razones probablemente provienen de los análisis detallados que se han realizado a lo largo de los años que indican que durante la realización de ejercicios de tipo aeróbico de mayor duración se daría una remoción acelerada del lactato en vez de la producción del mismo. Ole Bang demostró esto hace unos 70 años (19-20). En estas condiciones - cuando la oxidación del lactato excede la producción del mismo - es realmente cierto que la medición del lactato sanguíneo no puede ser utilizada para estimar el gasto de energía de la glucólisis anaeróbica.
Sin embargo el análisis de Bang fue más allá. Bang demostró que las concentraciones de lactato siempre alcanzaron el máximo durante la recuperación del ejercicio de alta intensidad de corta duración. En el año 1960 Margaria et al. revelaron claramente la utilidad de la medición de la concentración de lactato sanguíneo durante la recuperación, en la estimación de gasto de energía anaeróbico en ejercicios de corta duración en cinta rodante dónde se observó una relación lineal entra la concentración de lactato sanguíneo y la tasa de trabajo (21). Lo mismo ocurre en series cortas de ejercicios de ciclismo y natación (22). Di Prampero y Ferretti (22) expresaron muy bien la utilidad del pico de lactato alcanzado durante la recuperación declarando: "Queda absolutamente claro, que la concentración del lactato sanguíneo no es el equivalente enérgico de la formación de lactato en los músculos activos y no proporciona información directa sobre la relación estequiométrica entre la formación de lactato y la síntesis de ATP. Sin embargo es, una medición útil que nos permite determinar la liberación de energía en el cuerpo cada vez que la concentración de lactato sanguíneo se incrementa hasta una determinada cantidad…" (22, pág. 109). El gasto de energía característico de los ejercicios de resistencia de larga duración (donde la oxidación de lactato puede ser igual o mayor que la producción del mismo) no parece ser similar al de los ejercicios de fuerza de corta duración (donde la producción de lactato excede la oxidación del mismo). Es interesante determinar cómo se diferencia el EPOC o si es “diferente” en las series de entrenamiento con sobrecarga de alta intensidad en comparación con el EPOC luego de ejercicio en estado estable de baja intensidad (23).
Independientemente de si esto verdad o no, existen profundas limitaciones para utilizar las mediciones de lactato sanguíneo con el fin de estimar el gasto de energía anaeróbico en la glucólisis. Si se desea convertir las concentraciones de lactato en una estimación razonable de gasto de energía anaeróbico, el ejercicio o la actividad deben ser breves, de alta intensidad y probablemente de naturaleza no intermitente.
La hipótesis de la deuda de oxígeno postula que la cantidad de lactato oxidado durante la etapa de recuperación del ejercicio puede determinar de manera precisa el gasto de energía anaeróbico de la glucólisis porque la conversión de los 21,1 kJ por litro de O2 consumido contiene un componente glucolítico (1,5 kJ) (donde se oxidan sustratos de 6 o 3 carbonos). Obviamente, el componente anaeróbico de la glucólisis no puede ser considerado dos veces: una vez durante el ejercicio (estimado a través del lactato sanguíneo) y otra vez como parte del consumo de oxígeno durante la recuperación. Nuestro análisis permite la separación del gasto de energía anaeróbico de la glucólisis (1,5 kJ) del gasto de energía mitocondrial (19,6 kJ por litro de O2 consumido).
Fundamentalmente la entropía y los intercambios de calor de la glucólisis anaeróbica rápida no son reversibles en los sistemas biológicos abiertos; los mismos no son posteriormente “incorporados” o “transportados” por la mitocondria durante la oxidación del lactato y por lo tanto no son considerados para el gasto de energía durante la recuperación o EPOC, el cual contiene un componente anaeróbico a 21,1 kJ por litro de O2 consumido (24).
¿Cómo es posible que el componente anaeróbico de la glucólisis del gasto energético del ejercicio representado por una medición del lactato sanguíneo sea excluido de la estimación del gasto de energía aeróbico (consumo de oxígeno) durante la etapa de recuperación del ejercicio?. El componente anaeróbico de la glucólisis puede ser desestimado mediante una conversión completamente aeróbica (12, 25), esto es 1 litro O2 =19,6 kJ, cuando el período de recuperación es alimentado a través de la oxidación de grasas y lactato, pero no a partir de la oxidación de la glucosa (26). El empleo de las reservas musculares limitadas de ATP y fosfato de creatina (CP) representa un tipo de deuda de oxígeno, porque estas reservas son utilizadas "anaeróbicamente" durante el ejercicio y re-sintetizadas aeróbicamente durante la recuperación.
Nosotros reconocemos que el uso de las reservas de ATP y CP durante el ejercicio se observa mediante la medición del consumo de oxígeno durante la recuperación, pero no se conoce cual es la cantidad exacta. Mas aún, debido a que por definición, la disminución exponencial en el consumo de oxígeno durante la recuperación, no implica un estado estable, nosotros nos abstenemos de usar la relación de producción de anhídrido carbónico y consumo de oxígeno (tasa de intercambio respiratorio, RER) para estimar el gasto de energía a partir de la utilización de combustibles dentro del intervalo de solamente grasa o solamente glucosa; es decir, 19,6 kJ a 21,1 kJ por litro de consumo de O2, respectivamente.
Hipotéticamente las siguientes afirmaciones permitirían la estimación razonable de los tres componentes del gasto de energía de por lo menos 1 sesión de ejercicio breve de alta intensidad con período de recuperación:
- Gasto de energía del ejercicio anaeróbico (glucolítico): lactato sanguíneo × 3 ml O2 × peso (kg) = ml de O2 equivalentes.
- Gasto de energía del ejercicio aeróbico: 1 litro de O2 consumido durante el ejercicio = 21,1 kJ.
- Gasto de energía aeróbico (no glucolítico) durante la recuperación: 1 litro de O2 consumido durante la recuperación = 19,6 kJ.
Conclusión
Los mecanismos de intercambio de energía a través del metabolismo anaeróbico y aeróbico son muy diferentes, pero ambos provocan cambios en el calor y la entropía que abarcan al gasto de energía durante el ejercicio y la recuperación. En 19,6 kJ por litro de oxígeno consumido, la degradación de las grasas es completamente aeróbica. La degradación de los carbohidratos tiene tanto un componente metabólico aeróbico como un componente anaeróbico de 21,1 kJ por litro de oxígeno consumido. Nosotros pensamos que la diferencia de calor de 1,5 kJ. L-1 de O2 observada entre la degradación de las grasas y los carbohidratos, en parte, proviene del componente metabólico anaeróbico de la degradación completa de la glucosa. De manera similar, las sesiones de actividad física (ejercicio) breves de alta intensidad pueden ser organizadas en un conjunto de intercambio energético anaeróbico y aeróbico (como kJ totales o METs por serie de actividad física). Las concentraciones de lactato sanguíneo pueden utilizarse como estimación razonable del gasto de energía anaeróbico, pero esto posee evidentes limitaciones. El gasto de energía durante la recuperación no contiene un componente anaeróbico del gasto energético glucolítico en 19,6 kJ por litro de oxígeno consumido.
Referencias
1. McArdle W. D., Katch F. I. and Katch V. L (2000). Exercise Physiology 5th Ed.: Energy, Nutrition and Human Performance. Philadelphia: Lippincott Williams & Wilkins, Pg. 182-183
2. Mendelsohn E (1964). Heat and Life: the Development of the Theory of Animal Heat. Cambridge: Harvard University Press
3. Stryer L (1988). Biochemistry 3rd. Ed. New York: W.H. Freeman & Co
4. Bechtel W. and Abrahamsen A (2007). In search of mitochondrial mechanisms: interfield excursions between cell biology and biochemistry. J History Biol; 40:1-33
5. Benedict F. G. and Milner R. D (1907). US Department of Agriculture Bulletin 175. Experiments on the metabolism of matter and energy in the human body, 1903-1904. Washington DC: US Government Printing Office
6. Krogh A. and Lindhard J (1913). The regulation of respiration and circulation during the initial stages of muscular hard work. J Physiol; 47:112-136
7. Hill A. V. and Lupton H (1923). Muscular exercise, lactic acid and the supply and utilization of oxygen. Q. J. Med; Jan: 135-171
8. Hale T (2008). History of developments in sport and exercise physiology: A.V. Hill, maximal oxygen uptake, and oxygen debt. J Sports Sci; 26: 365-400
9. Swyer P. R (1991). Assumptions used in measurements of energy metabolism. J Nutr; 121:1891- 1896
10. Marsh M. E. and Murlin J. R (1928). Muscular efficiency on high carbohydrate and high fat diets. J Nutr; 1:105-137
11. Minakami S. and de Verdier C. H (1976). Calorimetric study on human erythrocyte glycolysis: heat production in various metabolic conditions. Eur J Biochem; 65:451-460
12. Scott C. B (2008). Thermodynamics, Bioenergetics and Metabolism: A Primer for the Exercise Physiologist and Sports Nutritionist. Humana Press-Springer
13. Thornton W. M (1917). The relation of oxygen to the heat of combustion of organic compounds. Philos Mag Ser; 33:196-203
14. Patel S. A. and Erickson L. E (1981). Estimation of heats of combustion of biomass from elemental analysis using available electron concepts. Biotech Bioengin; 23:2051-2067
15. Kemp R. B (1991). Calorimetric studies of heat flux in animal cells. Thermochim Acta; 193:253-267
16. Gnaiger E., Kemp R. B (1990). Anaerobic metabolism in aerobic mammalian cells: information from the ratio of calorimetric heat flux and respirometric oxygen flux. Biochim Biophys Acta; 1016:328- 332
17. Kleiber M (1975). The Fire of Life: an Introduction to Animal Energetics. Robert E. Krieger Publ.:Malabar, FL., pp. 127. Energy Expenditure 43
18. Scott C. B (2005). Contribution of anaerobic energy expenditure to whole body thermogenesis. Nutr Metab (online); 2:14.
19. Bang O (1936). The lactate content of the blood during and after muscular exercise in man. Skand Arch Physiol; 74 (Suppl. 10): 49-82
20. Brooks G. A., Fahey T. D. and Baldwin K. M (2005). Exercise Physiology: Human Bioenergetics and its Applications, 4th ed. Boston: McGraw Hill, Pp. 220-221
21. Margaria R., Cerretelli P. and Mangili F (1964). Balance and kinetics of anaerobic energy release during strenuous exercise in man. J Appl Physiol; 19: 623-628
22. Di Prampero P. E., Ferretti G (1999). The energetics of anaerobic muscle metabolism: a reappraisal of older and recent concepts. Resp Physiol; 118: 103-115
23. Meirelles C. de-M. and Gomes P. S. C (2004). Acute effects of resistance exercise on energy expenditure: revisiting the impact of the training variables. Rev Bras Med Esporte; 10:131-138
24. Scott C. B. and Kemp R. B (2005). Direct and indirect calorimetry of lactate oxidation: implication for whole - body energy expenditure. J Sports Sci; 23:15-19
25. Scott C. B (2006). Contribution of blood lactate to the interpretation of total energy expenditure for weight lifting. J Strength and Cond Res; 20:21-28
26. Bahr R (1992). Excess postexercise oxygen consumption magnitude, mechanisms and practical implications. Acta Phys Scand, 144 (Suppl 605), 1-70
27. Nieman D. C (2007). Exercise Testing and Prescription a Health Related Approach. Boston: McGraw-Hill, Appendix D. pp. 756-769