Posibles Efectos Ergogénicos de la Vitamina D Sobre el Rendimiento y la Recuperación Deportiva
Dylan T. Dahlquist2, Brad P. Dieter3 y Michael S. Koehle1
1Simón Fraser University, Biomedical Physiology and Kinesiology (BPK), 8888 University Drive - Burnaby, Vancouver, BC V5A 1S6, Canadá.
22UBC Environmental Physiology Laboratory, School of Kinesiology, University of British Columbia, Vancouver, BC, Canadá.
3Providence Medical Research Center, Providence Sacred Heart Medical Center and Children’s Hospital, Research Discovery Lab, Spokane, WA 99204, USA.
Artículo publicado en el journal PubliCE del año 2016.
Publicado 4 de enero de 2016
Resumen
Palabras clave: Vitamina D, rendimiento, músculo esquelético, vitamina K, dosis, atleta, testosterona, hormonas, recuperación
INTRODUCCION
La vitamina D, una vitamina soluble en grasas, fue descubierta por primera vez en el aceite de hígado de bacalao (1) y posteriormente fue identificada como vitamina esencial, porque se desempeñaba como un esteroide precursor de una variedad de procesos metabólicos y biológicos. Una vez convertida a su forma biológicamente activa, la 1,25 dihidroxivitamina D (2), regula la expresión de cerca de 900 tipos de genes (3). Se ha demostrado que la expresión de estos genes tiene un impacto significativo en una gran variedad de variables relacionadas a la salud y al rendimiento, tales como inflamación inducida por el ejercicio, genes supresores de tumores, función neurológica, salud cardiovascular, metabolismo de glucosa, salud ósea y rendimiento del músculo esquelético (4, 10). Sorprendentemente el 88,1% de la población mundial tiene niveles de vitamina D inadecuados (11). Se ha observado que su deficiencia está ligada a diferentes resultados adversos en variables de salud y psicológicas, tales como pensamiento suicidas (12), depresión (13), disminución cognitiva y desórdenes neurológicos (14), y un mayor riesgo de padecer cáncer (15).Además, los individuos con déficit de vitamina D tienen un mayor riesgo de padecer desórdenes óseos como la epondiloartritis (16), raquitismo (1, 17), y fracturas debidas a la mayor resorción ósea por la superproducción de hormona paratiroidea (PTH) (18, 19). Por último, la deficiencia tiene efectos catabólicos en el tejido muscular (20), provoca debilidad muscular (21), y afecta la formación de puentes cruzados (22) lo que en conjunto podría perjudicar el rendimiento deportivo. Debido al aumento en la actividad enzimática producida por el ejercicio (23), los atletas pueden ser susceptibles, o incluso más susceptibles a presentar déficits de vitamina D que la población general. Un reciente meta-análisis que agrupó 23 estudios con 2313 atletas observó que 56% de atletas tenían niveles inadecuados de vitamina D (24). Debido a la elevada incidencia de la deficiencia de vitamina D (25) y sus efectos en la fisiología humana, esta revisión busca identificar el papel de la vitamina D en el rendimiento deportivo (para información sobre aspectos de la vitamina D asociados a la salud vea (11, 18, 26, 27)). Esta revisión abordará aspectos vinculados a cómo se metaboliza la vitamina que D en el cuerpo, su rol potencial en el rendimiento deportivo, fuentes de vitamina D, diferencias entre la vitamina D2 y vitamina D3, niveles óptimos de vitamina D para atletas, y las posibles estrategias para alcanzar estos niveles y evitar la toxicidad por las interacciones nutriente-nutriente.
Metabolismo de la vitamina D
La vitamina D viaja en el torrente sanguíneo unida a proteínas de unión a vitamina D (28) y sufre un proceso de tres etapas de reacciones enzimáticas importantes (Figura 1): 25-hidroxilación, 1α-hidroxilación y 24- hidroxilación (18, 29). El precursor esteroide, la vitamina D3, viaja primero al hígado dónde es hidrolizada a 25-hidroxivitamina D (25(OH)D) por la 25-hidroxilasa, mediada por las enzimas del complejo citocromo P450 CYP27A1 (en la mitocondria) y CYP2R1 (29). Esta 25(OH)D luego es hidrolizada por CYP27B1 (1 α-hidroxilación) (29). Este paso final ocurre principalmente en el riñón (18), pero en otros tejidos como el músculo esquelético también se ha observado la expresión de enzimas CYP24A, donde la 25(OH)D se transforma en la forma hormonal activa o 1,25-dihidroxivitamina D (29). Luego la 1,25 dihidroxivitamina D interacciona con los receptores de vitamina de D (VDR) que se localizan en casi todos los tejidos del cuerpo (30, 31), y luego se transcribe al interior de las células y se une a los elementos de respuesta de vitamina D (VDRE) localizados en el ADN (18). Si 1,25 dihidroxivitamina D no interacciona con los VDR, es degradada por CYP24A1 (24 hidroxilasa) a la forma inactiva, el ácido calcitroico (29).
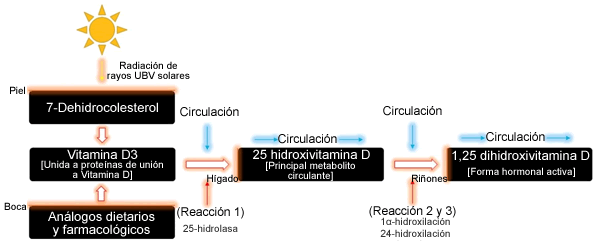
Figura 1. Transformación de la vitamina D3 proveniente de la dieta, de análogos farmacológicos y de la luz solar natural en el principal metabolito circulante de vitamina D (25-hidroxivitamina D) y posteriormente en la forma hormonal activa o 1,25 dihidroxivtiamina D.
Vitamina D y rendimiento
En el musculo esquelético humano existen receptores de vitamina D3 (30, 31), lo que indica que la 1,25 dihidroxivitamina D tiene un efecto directo en la actividad del músculo esquelético. Las investigaciones sobre los efectos de la vitamina D3 en el músculo (32) están limitados a poblaciones de fallecidos (20, 33), o a adultos desentrenados saludables (34). Hasta hace poco tiempo, algunas revisiones y meta-análisis habían demostrado que niveles séricos elevados de 25(OH)D en una población dada tiene un efecto positivo sobre la fuerza, la potencia y la masa muscular (33, 35) pero el único estudio que examinó los efectos en atletas (36), tuvo resultados mixtos. Además, von Hurst y Beck (36) concluyeron que la ingesta óptima y las concentraciones séricas optimas de 25(OH)D aún deben ser identificadas en la población de deportistas.
Consumo de oxígeno máximo
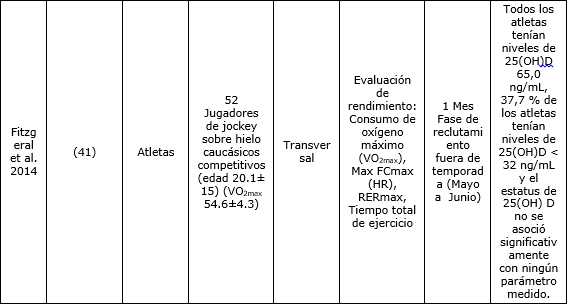
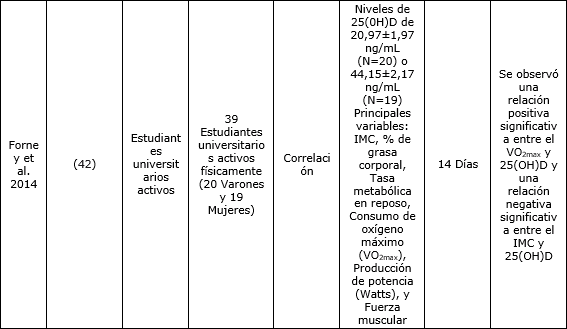
Los receptores de vitamina D (VDR) están presentes en el músculo cardíaco y en el tejido vascular (7), lo que indica que la 1,25 dihidroxivitamina D podría influir en el consumo de oxígeno máximo (VO2max) a través de la capacidad para transportar y utilizar el oxígeno presente en la sangre por los diferentes tejidos. Los múltiples estudios de correlación demostraron una correlación positiva entre VO2max y la concentración sérica de 25(OH)D en sujetos que no son deportistas (Tabla 1) (37, 39). Pero no se tuvieron en cuenta varias variables de confusión, como la ingesta simultánea de complejos multivitamínicos (38) o de suplementos (37, 39). Los estudios realizados con atletas son confusos. Koundourakis y colegas (40) observaron que había una correlación significativa entre los niveles de 25(OH)D y los parámetros de rendimiento en 67 varones caucásico jugadores de fútbol profesional (edad 25,6±6,2). Se observó una relación lineal entre las determinaciones de 25(OH)D pre y post temporada y la fuerza muscular determinada por salto desde sentadillas (SJ), salto contramovimiento (CMJ), capacidad de esprint (esprint de 10m y 20m) y VO2max (40). Una publicación más reciente de Fitzgerald et al. (41), concluyó que no había ninguna asociación entre los niveles de 25(OH)D y el VO2max del individuo en 52 jugadores de jockey sobre hielo caucásicos (41). Adicionalmente, la correlación observada frecuentemente entre las concentraciones séricas de 25(OH)D y VO2max se relacionó inversamente con las mejoras en la actividad física y en el estado de entrenamiento (39). Forney y colegas (42) investigaron recientemente la asociación entre los niveles séricos de 25(OH)D, VO2max y el estado de entrenamiento de 39 estudiantes universitarios físicamente activos (20 varones y 19 mujeres). Los autores demostraron que los participantes con niveles séricos de 25(OH)D más altos (>35 ng-mL-1) tenían un VO2max significativamente mayor (+20%) que el grupo con niveles de 25(OH)D mas bajos (<35 ng-mL-1) (42). Sin embargo, esta correlación sólo se limitó a los varones.
Tabla 1. Estudios de correlación e intervención sobre la vitamina D y el consumo de oxígeno máximo (VO2max).
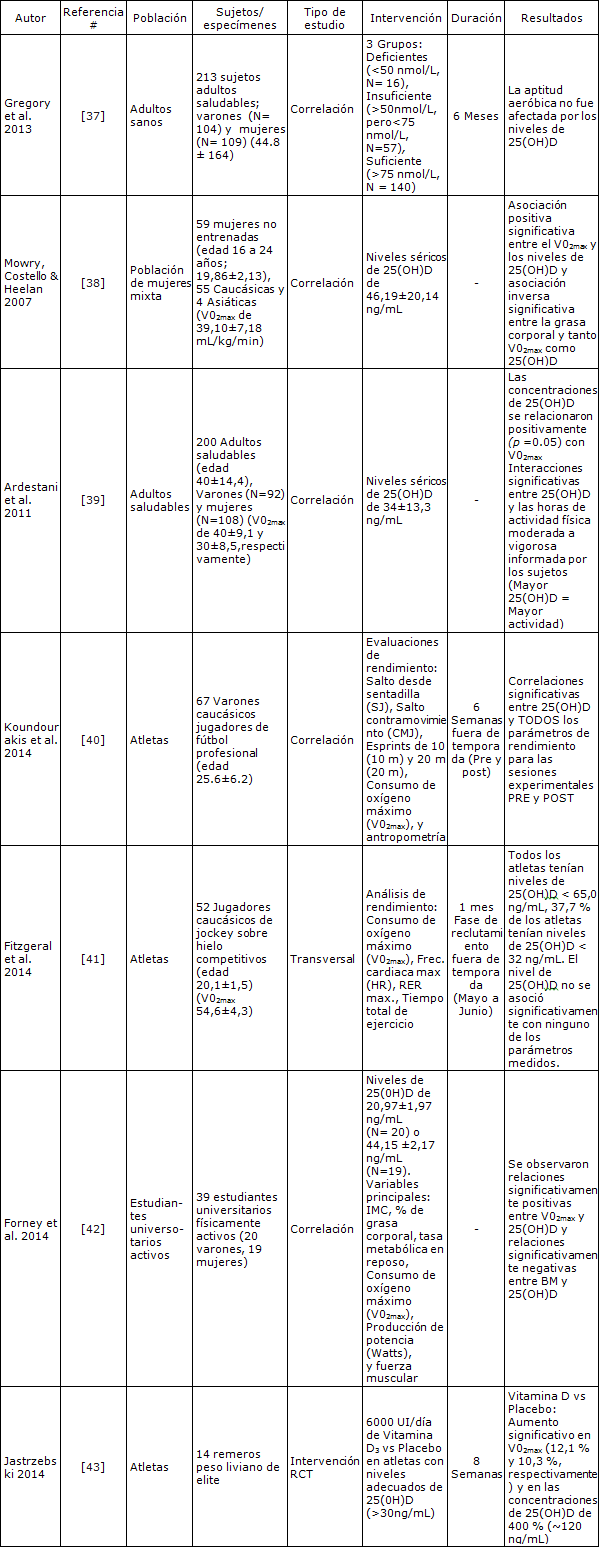
Las pruebas de intervención en la población de deportistas son escasas. Según nuestros conocimientos, existe solo un estudio que analizó los efectos de la suplementación con vitamina D sobre el VO2max. Jastrzebski (43) realizó un estudio a simple siego de suplementación con 6000 IU/día de vitamina D3 contra un placebo, durante un ciclo de entrenamiento semanal de 8 semanas en 14 remeros livianos de élite que tenían concentraciones suficientes de 25(OH)D (>30 ng/mL). Observaron un aumento significativo en el VO2max (12,1% y 10,3%, respectivamente) y de 400% (~120 ng/mL) en las concentraciones de 25(OH)D.
Los autores concluyeron que la suplementación con vitamina D3 durante el período de entrenamiento de 8 semanas mejoró el metabolismo aeróbico de los remeros de élite (43). Se necesitan investigaciones adicionales para evaluar si existe un efecto ergogénico en atletas que tienen una deficiencia sérica muy marcada de 25(OH)D, y si las dosis supra fisiológicas de vitamina D3, como las utilizadas por Jastrzebski, tienen un efecto ergogénico en atletas con niveles adecuados de vitamina D en otras disciplinas deportivas.
El mecanismo específico por el cual los mayores niveles de 25(OH)D afectan el VO2max no ha sido establecido (39), sin embargo este fenómeno podría deberse al hecho que las enzimas CYP que activan la vitamina D3 en 1,25-dihidroxivitamina D3 tienen proteínas con grupos hemo (44) y podrían afectar potencialmente la afinidad de unión del oxígeno a la hemoglobina.
Recuperación
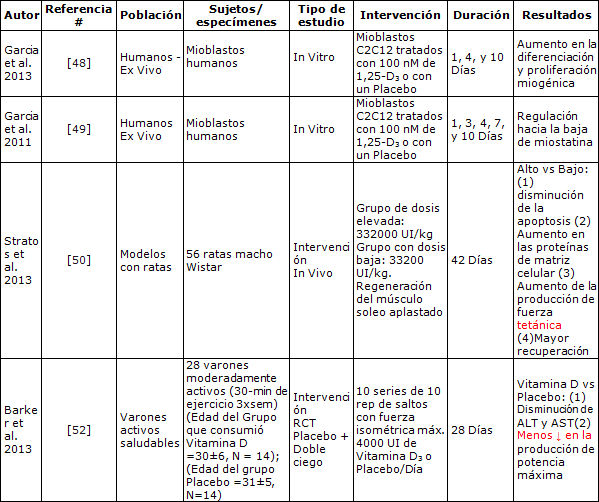
La capacidad para recuperarse rápidamente es fundamental para que los atletas puedan entrenar en elevadas intensidades mas frecuentemente. El tejido del músculo esquelético humano responde a los estímulos de entrenamiento y/o a daños en los tejidos a través de la remodelación (45, 47). Durante la recuperación, la 1,25 dihidroxivitamina D aumenta la diferenciación y proliferación miogénica (48) y produce una regulación hacia la baja de miostatina, un regulador inhibitorio de la síntesis muscular de mioblastos C2C12 en cultivo (49). Stratos y colegas (50) observaron este marcado incremento en la regeneración del musculo esquelético en el músculo soleo aplastado (in vivo) de 56 ratas machos Wistar (300 a 325g de peso corporal), después de una dosis supra fisiológica de ~100000 UI de vitamina D. Los autores (50) separaron las ratas en grupos en función de la dosis alta (332000 UI/kg) y baja (33200 UI/kg) y analizaron los tiempos de respuesta de recuperación del músculo soleo aplastado. En comparación con el grupo de dosis baja, el grupo que recibió la dosis alta presentó una atenuación significativa de la apoptosis cuatro días después de la lesión, lo que indica un aumento en las proteínas de la matriz celular (50); algo que es crucial para la reparación del tejido esquelético (51). Este aumento en el índice de renovación celular permitió un mejor tiempo de recuperación, un incremento en la producción de fuerza tetánica (sólo 10% menor que el miembro no lesionado), y un aumento en la fuerza de contracción en comparación con el grupo control (50). Dado que los modelos murinos presentan capacidades regeneradoras superiores a las de los humanos, es importante destacar las limitaciones de extender los resultados mencionados a las personas; sin embargo, el hallazgo que la suplementación con vitamina D puede mejorar la recuperación de la fuerza isométrica máxima poco después de los ejercicios de alta intensidad fue recientemente apoyado por un estudio con dosis bastante mas bajas en personas moderadamente activas (52).
En un estudio aleatorizado, doble-ciego, controlado con placebo, Barker et al. (52) demostraron en adultos saludables y moderadamente activos, que el consumo de 4000 UI/día de vitamina D durante 35 días produjo una atenuación de los marcadores biológicos de inflamación alanina (ALT) y aspartato (AST) inmediatamente después de 10 series de 10 repeticiones de saltos de fuerza isométrica máxima excéntrica-concéntrica. Además, aunque la producción de potencia máxima disminuyó en ambos grupos, el grupo que recibió la suplementación sólo presentó una disminución de 6%, mientras que la potencia del grupo placebo disminuyó 32% inmediatamente luego del ejercicio (52). Esta diferencia se mantuvo durante 48 h (52). Se necesitan investigaciones adicionales con dosis mayores que puedan determinar si la recuperación y el rendimiento pueden mejorar aun más (Tabla 2).
Tabla 2. Estudios in vitro e in vivo y de intervención sobre la vitamina D y la recuperación.
Producción de fuerza y potencia
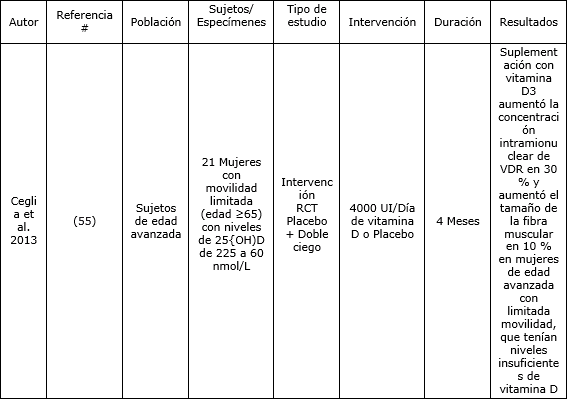
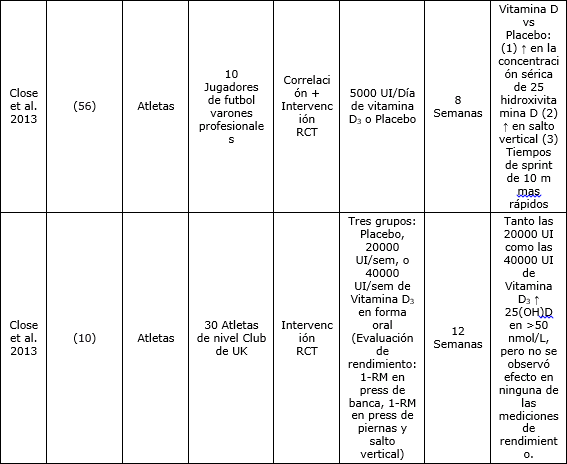
Se ha observado que la vitamina D3 aumenta la fuerza y la producción de potencia del músculo esquelético (19), quizás a través de la sensibilización de los sitios de unión al calcio del retículo sarcoplásmico, lo que produce un aumento en los ciclos de formación de puentes cruzados y contracción muscular (53). Existe evidencia adicional que la vitamina D3 también podría aumentar potencialmente el tamaño y la cantidad de fibras musculares de tipo II (20, 54, 55). Estos resultados han sido observados solo en mujeres de edad avanzada con movilidad limitada (≥65 años) (55), y todavía deben ser analizados en la población de deportistas. Por otro lado, se han estudiado aumentos en la fuerza y producción de potencia en atletas y se han obtenido resultados positivos en un estudio aleatorizado controlado con placebo realizado en 10 jugadores de fútbol profesional de sexo masculino (56). Después de una intervención larga de 8 semanas donde los sujetos consumieron o 5000 UI/día de vitamina D3 o un placebo, el grupo que consumió la vitamina D3 presentó un aumento significativo en los niveles séricos de 25(OH)D y una mejora significativa en sus tiempos de esprint de 10-m y en el salto vertical en comparación con el grupo que consumió el placebo (56). Las variables de confusión fueron correctamente controladas, ya que los autores solicitaron a los atletas que mantuvieran la ingesta nutricional habitual, y aquellos atletas que estaban consumiendo multivitamínicos, vitamina D, aceite de pescado y/o eran usuarios regulares de camas solares o que regresaban de vacaciones en zonas con clima con elevada exposición solar, no fueron considerados en el estudio. Sin embargo, otros estudios no observaron beneficios significativos de la suplementación con vitamina D en atletas con niveles ligeramente deficientes o adecuados de esta vitamina (10, 41, 42), lo que indicaría que los beneficios en el rendimiento estarían limitados a individuos que padecen una deficiencia significativa de vitamina D (Tabla 3).
Tabla 3. Estudios de correlación e intervención de la vitamina D sobre la producción de fuerza y potencia.
Vitamina D y testosterona
La testosterona es una hormona endógena importante para las adaptaciones musculares al entrenamiento. Los niveles de testosterona naturalmente bajos en hombres jóvenes se asocian con disminuciones en el anabolismo de las proteínas, en la fuerza, en la beta-oxidación y con un aumento en la acumulación de grasa (57). Por lo tanto los atletas deben optimizar la producción natural de andrógenos. Un reciente estudio transversal realizado con 2299 varones de edad avanzada (62±11 años) demostró que los niveles de 25(OH)D se correlacionaron con los niveles de testosterona y de andrógenos en los varones (58). En 18 % de los participantes se encontraron niveles bajos de testosterona o hipogonadismo y estos varones tenían niveles medios de 25(OH)D significativamente menores que el resto de la población. Además, sólo 11,4% de los participantes de la muestra tenían niveles suficientes de vitamina D.
Adicionalmente un estudio de 12 meses, aleatorizado en doble-ciego y controlado que se realizó con 54 varones no diabéticos demostró que el grupo que recibió 3332 UI/día de vitamina D tenía un aumento significativo en los niveles circulantes de 25-hidroxivitamina D, testosterona total, testosterona bioactiva y testosterona libre (59). Estos resultados apoyan la noción que el aumento en los niveles de 25(OH)D puede aumentar la producción de testosterona en sujetos varones no diabéticos lo que indicaría que la suplementación con vitamina D podría tener un potencial ergogénico a través de la mejora en la producción endógena de testosterona. Se necesitan mas investigaciones para investigar este papel potencial de la vitamina D y de los niveles de testosterona en las diferentes poblaciones de estudio (Tabla 4).
Tabla 4. Estudios in vivo y de intervención sobre la correlación entre Vitamina D y testosterona.
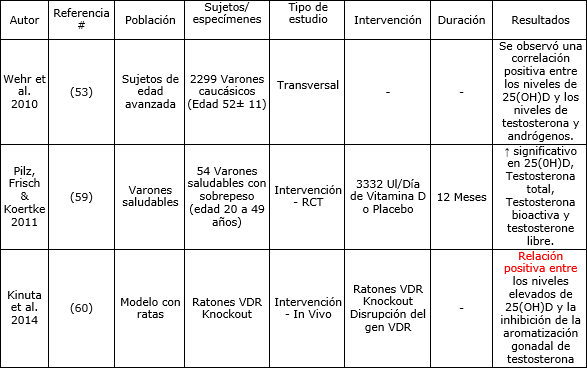
El mecanismo específico de acción de 25(OH)D sobre la testosterona en varones podría estar potencialmente relacionado con dos procesos: inhibición de la aromatización de la testosterona y mayor unión a andrógenos. La evidencia de estos dos mecanismos proviene de modelos con animales. Específicamente, se ha observado que niveles superiores de 25(OH)D inhiben la aromatización gonadal de testosterona en los ratones knockout VDR (60). Además, los receptores de vitamina D (VDR) y las enzimas del metabolismo de vitamina D han sido localizados en los testículos de humanos y de ratas, y se ha observado que mejoran la afinidad de los receptores de unión a andrógenos (57, 61, 62). Este efecto aumenta la tasa en la que los andrógenos pueden unirse a glándulas productoras de testosterona que producen concentraciones más altas de hormonas esteroides, lo que finalmente produce un aumento en la hipertrofia del músculo esquelético, en la fuerza y en la producción de potencia (63, 64).
FUENTES
Luz solar
Los seres humanos obtienen la vitamina D a partir de dos fuentes diferentes, la producción endógena después de la exposición al sol, o por la dieta (a partir de los alimentos o de la suplementación). A diferencia del metabolismo de la vitamina D dietética, la síntesis de vitamina D3 por la piel es un proceso biológico no enzimático (65). Una vez que la piel se expone a la radiación ultravioleta B del sol (UVB), el 7-dihidrocolesterol almacenado se convierte en vitamina D3 circulante, 25(OH)D (29) y otros isómeros (66). La cantidad de exposición a UVB determina la cantidad y el tipo de isómeros específicos de vitamina D3 que se formarán (66, 67). La dosis recomendada de exposición a la luz del sol durante el verano es de 5 a 20 min por día para 5,0 % de la piel expuesta a una radiación de UVB de 290-315 nm (68, 69) dos a tres veces por semana (70). Adicionalmente, se ha observado que 15 min de exposición adecuada a UVB (290-315 nm) durante los meses de verano en traje de baño puede producir 10000 a 20000 IU de vitamina D3 (71). Sin embargo, numerosos factores pueden afectar la tasa y síntesis de vitamina D3 (Tabla 5) (25, 66, 72-74).
Tabla 5. Factores que afectan la tasa y la síntesis de la producción endógena de vitamina D.

Dieta
La vitamina D proveniente de la dieta y de la suplementación se encuentra en dos formas, la vitamina D2 derivada de las plantas (ergo-calciferol), y una fuente con mayor biodisponibilidad proveniente de mamíferos y de peces o vitamina D3 (colecalciferol) (75). La vitamina D puede estar presente en varios productos alimenticios (Figura 2) (76), como los cereales y la leche fortificados, alimentos naturales como el salmón, o a través de los diferentes análogos de vitamina D producidos sintéticamente en un laboratorio (Tabla 6) (18, 76). Ambas fuentes se consideran pro-hormonas, y pueden incrementar lo niveles circulantes de 25(OH)D después de atravesar las reacciones enzimáticas descriptas anteriormente.
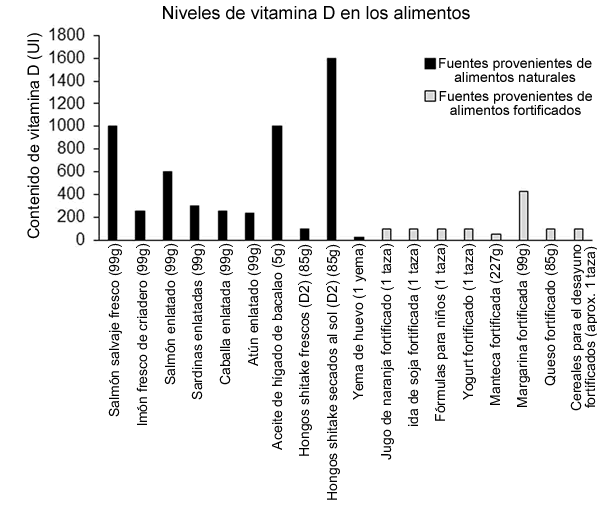
Figura 2. Fuentes dietéticas de vitamina D3 yD2 derivadas de fuentes naturales o de alimentos fortificados.
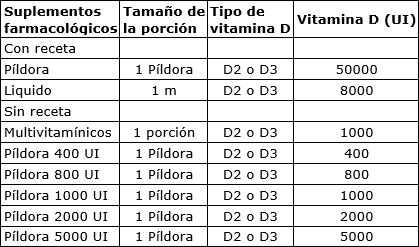
Tabla 6. Fuentes de vitamina D provenientes de análogos farmacológicos.
Dosis para un rendimiento óptimo
Tanto D2 como D3 pueden aumentar la concentración plasmática de 25(OH)D, pero la vitamina D3 podría ser más eficiente que la vitamina D2 (75, 77, 78). Comparada con la vitamina D3, la vitamina D2 es menos estable, y su biodisponibilidad es menor a medida que la edad se incrementa, y se ha demostrado en numerosos estudios clínicos que la cantidad de vitamina D2 absorbida es significativamente menor que la de vitamina D3. Además, la vitamina D2 tiene una menor afinidad por los VDR (54, 75, 77-79) y una mayor tasa de desactivación una vez que es hidroxilada en el riñón debido a las variaciones en la cadena lateral (77). Por último, un estudio epidemiológico realizado en Dunedin, Nueva Zelanda durante los meses invernales analizó los efectos de la suplementación con 1000 IU/día de vitamina D2 o vitamina D3 durante un período de 25 semanas en 95 participantes saludables, adultos (18-50 años) (78). Los participantes que recibieron el suplemento de vitamina D2 presentaron una disminución mas marcada en los niveles séricos de 25(OH)D (74 nmol/L a 50 nmol/L) que los que consumieron la vitamina D3 (80 nmol/L a 72 nmol/L) (78). Sin embargo, ambos resultados demostraron que una dosis de 1000 IU/día de vitamina D era inadecuado para aumentar las concentraciones séricas de 25(OH)D y en realidad provoca una disminución en ambas isoformas.
Siendo la vitamina D3 la más eficaz, la dosificación óptima varía, dependiendo del individuo y de la institución que proporciona las recomendaciones. El Instituto de Medicina (IOM) recomienda 400-800 IU/día para niños, adultos e individuos >70 años de edad para mantener el nivel sérico de vitamina D por encima de 50 nmol/L (11, 80, 81). Alternativamente, la Sociedad Endocrinológica (ES) recomienda una ingesta ligeramente mayor, con dosis de 400-1000 UI/día para los infantes, 600-1000 UI/día para los niños, y 1500-2000 UI/día para los adultos para mantener la concentración sérica adecuada de vitamina D de 75 nmol/L (82). Estas recomendaciones corresponden con una revisión realizada 2004 (83), que estableció que 70 nmol/L es la concentración sérica más baja deseable para evitar efectos perjudiciales para la salud. Otras recomendaciones han sugerido que los niveles óptimos deberían estar entre 90 y 120 nmol/L (86, 87), sobre la base de estimaciones hechas por los niveles observados en individuos que habitan en ambientes con mucha radiación solar (84) y/o han demostrado una función óptima en las extremidades inferiores (85). Las definiciones de hipovitaminosis o hipervitaminosis son más polémicas. El IOM define reservas inadecuadas de 25(OH)D como 30-50 nmol/L, y deficiencia para las concentraciones de 25(OH)D <30 nmol/L (88), y fija el límite superior de la ingesta dietética de vitamina D en 4000 UI/día (69). Por otro lado la ES, define la deficiencia de vitamina D como niveles de 25(OH)D <50 nmol/L, insuficiencia para niveles de 25(OH)D de 51 a 74 nmol/L (89), y fija el límite superior de ingesta dietética de vitamina D en 10000 UI/día (19). Por otra parte, las recientes revisiones han sugerido que esto va más allá de una preocupación teórica (72, 83, 84, 90). La dosis de vitamina D y los niveles óptimos son claramente polémicos (88, 91). Además, los niveles óptimos necesarios para el rendimiento deportivo no han sido todavía determinados. Hay evidencia creciente que sostiene que 600-800 UI/día no serían suficientes para alcanzar niveles óptimos de vitamina D, sobre todo en la población de deportistas (92), dado que se ha propuesto que las concentraciones séricas de 25(OH)D mayores a 100 nmol/L serían óptimas para la función del musculo esquelético de las extremidades inferiores (85), y que niveles bajos de vitamina D se asocian con una mayor remodelación ósea, y un mayor riesgo de fracturas por estrés (93). Se ha demostrado que el consumo de aproximadamente 2000 a 5000 UI/día de vitamina D de todas las fuentes disponibles, mejora la salud del hueso porque mantiene los niveles séricos de 25(OH)D entre 75 y 80 nmol/L (84, 85, 94, 95). Además, esta dosis sería inalcanzable a través de la exposición a UVB naturales durante los meses de octubre a abril cuando se reside en las latitudes de 42.2 a 52° N (96) lo que se comprueba por la elevada incidencia de déficit de vitamina D en los atletas de muchas disciplinas que se realizan bajo cubierta o al aire libre (24, 97-99). Por último, los estudios que observaron mejoras en el rendimiento deportivo utilizaron dosis superiores a 3000 UI/día, pero ninguno alcanzó un nivel superior a 100 nmol/L. Por lo tanto, aunque no se tiene plena certeza, los atletas podrían beneficiarse con niveles de 25(OH)D ≥100 nmol/L para aumentar la función del músculo esquelético y reducir el riesgo de fracturas por estrés.
Sin embargo, hasta la fecha ningún estudio ha analizado los efectos de la suplementación con vitamina D y la función del músculo esquelético en la población de deportistas con niveles de 25(OH)D ≥100 nmol/L (36). Adicionalmente, los estudios previos de intervención de rendimiento presentados en esta revisión utilizaron una suplementación muy por encima de las dosis recomendadas de 600-2000 UI/día (por ejemplo, 5000 UI/día de vitamina D3) y 1000 UI/día de vitamina D3 durante los meses invernales no son suficientes para prevenir una disminución en las reservas séricas de 25(OH)D (78).
Toxicidad e hipercalcemia
Aunque se ha informado que la toxicidad de la vitamina D se presentaría con dosis ≥10000 UI/día durante un período extendido (71, 84), y provocaría efectos adversos como hipercalcemia, no se conoce con certeza cual es el nivel de vitamina D que provoca toxicidad (71, 100), y debido a razones éticas, no se ha realizado ningún estudio prospectivo para analizar los efectos de la intoxicación con vitamina D en humanos. Recientemente, se produjo una sobredosis accidental de 2000000 UI de vitamina D3 en dos pacientes de edad avanzada y no se observaron efectos adversos mas allá de un nivel ligeramente elevado de calcio en la sangre (101). Es importante destacar que sólo se han informado efectos adversos en concentraciones séricas de 25(OH)D superiores a 200 nmol/L que corresponderían a dosis diarias de 40000 UI o más de vitamina D (84), y las concentraciones séricas de 25(OH)D <140 nmol/L no se han correlacionado con hipercalcemia. La 1,25-dihydroxivitamina D trabaja de manera sinérgica con el calcio y permite que el mismo sea absorbido en el tracto gastrointestinal y estimula los osteoblastos maduros para que expresen el ligando del receptor activador del factor nuclear Kappa B (RANKL) (102). A su vez, el RANKL estimula la mineralización y resorción ósea por medio de la osteoclastogenesis. Los mayores niveles de 25(OH)D pueden acelerar este proceso, lo que provocaría un aumento en la concentración de calcio en la sangre, una mayor tasa de absorción de calcio en los riñones, y podría provocar potencialmente la formación de piedras en los riñones y/o una potencial calcificación vascular (103).
Vitamina K
Cualquier discusión sobre la toxicidad de la vitamina D debe tener en cuenta la vitamina K. Como con el calcio, la vitamina K trabaja de manera sinérgica con la vitamina D para regular resorción, activación y distribución del hueso (104). La vitamina K carboxila la proteína osteocalcina recientemente formada que se produce en las células óseas maduras y está fuertemente regulada por la vitamina D (105). Una vez que la proteína es carboxilada, interacciona con los iones calcio en el tejido del hueso (106) y tiene un efecto significativo en la mineralización y formación de hueso, en la prevención de pérdida ósea y un efecto potencial en la prevención de fracturas en las mujeres (105, 107-111). Sin embargo, cuando los niveles de vitamina K son inadecuados, no se suprime la producción de osteocalcina (109). Esta situación facilita la aparición de una forma no carboxilada (inactiva) de proteína osteocalcina en el hueso, lo que provoca un aumento potencial en la liberación de calcio del hueso y la deposición de calcio en los tejidos blandos (lo que provoca calcificación arterial) (112, 113). Así, la toxicidad de la vitamina D3 sólo podría producirse en ausencia de una adecuada reserva de vitamina K. Las dosis recomendadas de vitamina K van de 50 mcg a 1000 mcg (108). Sin embargo, estas recomendaciones son polémicas porque las reservas de vitamina K se agotan rápidamente si no se produce un suministro constante (114) y al igual que la vitamina D, la vitamina K también tiene dos variantes: K1 y K2. Las fuentes de vitamina K pueden encontrarse en los análogos farmacológicos y naturalmente en la dieta. La vitamina K1, la forma más abundante que se encuentra en la dieta de un individuo (115), es abundante en las verduras crucíferas de hoja verde, en frutas, en varios aceites vegetales y en frijoles (114). La vitamina K2, es la forma de vitamina K con mayor biodisponibilidad (114) y se encuentra en una variedad de peces, vísceras, carne, productos lácteos, queso fermentado (por ejemplo, queso azul), y productos fermentados como el natto (soja fermentada, una delicadeza japonesa) (116).
Ambas formas juegan desempeñan papeles diferentes en el cuerpo (117), pero el IOM sólo la fijado la ingesta dietética recomendada para la isoforma K1 (90 mcg/día para las mujeres y 120 mcg/día para varones), sin límite superior, y aún debe establecer las recomendaciones dietéticas para la vitamina K2 (114). Específicamente, la vitamina K1 tiene un papel importante en la carboxilación de las diferentes proteínas que intervienen en la coagulación de la sangre y la vitamina K2 es esencial para la carboxilación y activación de osteocalcina y de la proteína Gla de la matriz (MGP) (una proteína esencial necesaria para prevenir la calcificación de los tejidos blandos) (118). Es importante destacar que una de las variantes de la vitamina K2, la MK-4, es muy efectiva para mitigar la formación de osteoclastos y los efectos negativos para la salud de las dosis excesivas de vitamina D (114, 115). Además, se ha demostrado que 10 mg/día (10,000 mcg) de vitamina K1 sintética (fitonadiona, comercializada bajo el nombre de Konakion® (119)) puede ser beneficiosa para corredoras de maratón porque aumenta la formación de hueso y evita la pérdida de hueso (120) y que megadosiss de 45 mg/día (45000 mcg) de MK4 junto con vitamina D3 podrían prevenir la osteoporosis en mujeres postmenopáusicas (102, 109). Así, aunque el efecto principal de la MK4 podría ser la carboxilación de osteocalcina, las vitaminas K1 y K2 interactúan entre sí para optimizar la salud del hueso y son esenciales para el cuerpo humano. Las futuras investigaciones deberían establecer cual es la dosis óptima de vitamina D3 junto con la vitamina K.
CONCLUSION
En resumen, ha surgido un tema interesante a partir de los estudios realizados con animales y es que las dosis suprafisiológicas de vitamina D3 tienen potenciales efectos ergogénicos en el sistema metabólico humano y pueden producir numerosas mejoras fisiológicas. Estas dosis podrían aumentar la capacidad aeróbica, el crecimiento muscular, la fuerza y la producción de potencia, y permitirían un menor tiempo de recuperación frente al ejercicio. Estas dosis también podrían mejorar la densidad ósea. Sin embargo, tanto la deficiencia (12,5 a 50 nmol/L) como los niveles altos de vitamina D (>125 nmol/L) pueden tener efectos colaterales negativos, entre los que se incluye la probabilidad de una mayor mortalidad (121). Por lo tanto es importante para la salud y el rendimiento que se mantengan los niveles séricos óptimos entre 75 y 100 nmol/L (11, 86) y asegurar el consumo de cantidades adecuadas de otros nutrientes esenciales entre los que se incluye la vitamina K. Los entrenadores, practicantes y el personal deportivo deben recomendar que sus pacientes y atletas realicen la medición sanguínea de 25(OH)D para determinar si necesitan suplementación. En función de lo observado en esta investigación sobre la recuperación, fuerza y producción de potencia, 4000-5000 UI/día de vitamina D3 junto con una mezcla de 50 mcg/día a 1000 mcg/día de vitamina K1 y K2 sería una dosis segura y tendría potencial para mejorar el rendimiento deportivo. Por último, ningún estudio realizado en una población de deportistas ha incrementado los niveles séricos de 25(OH)D por encima de 100 nmol/L, (el rango óptimo para la función del músculo esquelético) y han utilizado dosis de 1000 a 5000 UI/día. Así, los estudios futuros deben probar los efectos fisiológicos de dosis más altas (5000 UI a 10,000 UI/día o más) de vitamina D3 en combinación con dosis variables de vitamina K1 y vitamina K2 en la población de deportistas para determinar las dosis óptimas necesarias para aumentar al máximo el rendimiento.
Intereses de competencia
Los autores declaran que ellos no tienen intereses de competencia.
Contribuciones de los autores
DTD formuló la idea para la revisión de la literatura, adquirido los artículos de la investigación, interpretó la bibliografía presentada, y bosquejó el manuscrito inicial; BD y MSK colaboraron con la dirección del manuscrito, la interpretación de la bibliografía presentada, y editaron y escribieron completamente el manuscrito que fue presentado en la última versión enviada para su publicación. Todos los auores leyeron y aprobaron previamente el manuscrito final.
Referencias
1. McCollum E., Simmonds N., Becker J., Shipley P. (1922). An experimental demonstration of the existence of a vitamin which promotes calcium deposition. J. Biol. Chem.1922:293-8.
2. Jones G. (2012). Metabolism and biomarkers of vitamin D. Scand. J. Clin. Lab. Invest.;72(Suppl 243):7-13.
3. Wang T-T., Tavera-Mendoza L.E., Laperriere D., Libby E., MacLeod N.B., Nagai Y., et al. (2005). Large-scale in silico and microarray-based identification of direct 1,25-dihidroxivitamina D3 target genes. Mol. Endocrinol.19:2685-95.
4. Smith D.T., Broughton K.S., Larsonmeyer D.E. (2012). Vitamin D status and biomarkers of inflammation in runners. 3:35-42.
5. Alvarez-Díaz S., Valle N., García J.M., Peña C., Freije J.M.P., Quesada V., et al. (2009). Cystatin D is a candidate tumor suppressor gene induced by vitamin D in human colon cáncer cells. J. Clin. Invest.119:2343-58.
6. Dhesi J.K., Jackson S.H.D., Bearne L.M., Moniz C., Hurley M.V., Swift C.G., et al. (2004). Vitamin D supplementation improves neuromuscular function in older people who fall. Age Ageing.33:589-95.
7. Reddy Vanga S., Good M., Howard P.A., Vacek J.L. (2010). Role of vitamin D in cardiovascular health. Am. J. Cardiol.;106:798-805.
8. Sukumar D., Shapses S.A., Schneider S.H. (2015). Vitamin D supplementation during short-term caloric restriction in healthy overweight/obese older women: effect on glycemic indices and serum osteocalcin levels. Mol. Cell. Endocrinol.410:1–5.
9. Schoenmakers I., Francis R.M., McColl E., Chadwick T., Goldberg G.R., Harle C., et al. (2013). Vitamin D supplementation in older people (VDOP): Study protocol for a randomised controlled intervention trial with monthly oral dosing with 12,000 IU, 24,000 IU or 48,000 IU of vitamin D3. Trials.14:299.
10. Close G.L., Leckey J., Patterson M., Bradley W., Owens D.J., Fraser W.D., et al. (2013). The effects of vitamin D(3) supplementation on serum total 25(OH)D concentration and physical performance: a randomised dose–response study. Br J Sports Med.47:692–6.
11. Bendik I., Friedel A., Roos F.F., Weber P., Eggersdorfer M. (2014). Vitamin D: a critical and essential micronutrient for human health. Front. Physiol.5:248.
12. Grudet C., Malm J., Westrin A., Brundin L. (2014). Suicidal patients are deficient in vitamin D, associated with a pro-inflammatory status in the blood. Psychoneuroendocrinology.50C:210–9.
13. Polak M.A., Houghton L.A., Reeder A.I., Harper M..J, Conner T.S. (2014). Serum 25-hidroxivitamina D concentrations and depressive symptoms among young adult men and women. Nutrients.6:4720–30.
14. Chei C.L., Raman P., Yin Z-X., Shi X-M., Zeng Y., Matchar D.B. (2014). Vitamin D levels and cognition in elderly adults in China. J. Am. Geriatr. Soc.62(11):2125–9.
15. Holick M.F. (2006). Vitamin D: its role in cancer prevention and treatment. Prog. Biophys. Mol. Biol..92:49–59.
16. Guillot X., Prati C., Wendling. D. (2014). Vitamin D and spondyloarthritis. Expert. Rev. Clin. Immunol..10:1581–9.
17. Welch T.R., Bergstrom W.H., Tsang R.C. (2000). Vitamin D-deficient rickets: the reemergence of a once-conquered disease. J. Pediatr.137:143–5.
17. Welch T.R., Bergstrom W.H., Tsang R.C. (2000). Vitamin D-deficient rickets: the reemergence of a once-conquered disease. J. Pediatr.137:143–5.
18. Bikle D.D. (2014). Vitamin D metabolism, mechanism of action, and clinical applications. Chem. Biol.21:319–29.
19. Ogan D., Pritchett K. (2013). Vitamin D and the athlete: risks, recommendations, and benefits. Nutrients.5:1856–68.
20. Sato Y., Iwamoto J., Kanoko T., Satoh K. (2005). Low-dose vitamin D prevents muscular atrophy and reduces falls and hip fractures in women after stroke: a randomized controlled trial. Cerebrovasc. Dis.20:187–92.
21. Glerup H., Mikkelsen K., Poulsen L., Hass E., Overbeck S., Andersen H., et al. (2000). Hypovitaminosis D myopathy without biochemical signs of osteomalacic bone involvement. Calcif. Tissue Int.66:419–24.
22. Pfeifer M., Begerow B., Minne H. (2002). Vitamin D and muscle function. Osteoporos. Int.3:187–94.
23. Macdougall J.D., Hicks A.L., Macdonald J.R., Mckelvie R.S., Green H.J., Smith K.M. (1998). Muscle performance and enzymatic adaptations to sprint interval training. J. Appl. Physiol.84:2138–142.
24. Farrokhyar F., Tabasinejad R., Dao D., Peterson D., Ayeni O., Hadioonzadeh R., et al. (2014). Prevalence of vitamin D inadequacy in Atletas: A systematic-review and meta-analysis. Sport Med.5:365–78.
25. Calvo M., Whiting S. (2003). Prevalence of vitamin D insufficiency in Canada and the United States: importance to health status and efficacy of current food fortification and dietary supplement use. Nutr. Rev.61:107–13.
26. Hosseinnezhad A., Holick M.F. (2013). Vitamin D for health: a global perspective. Mayo Clin. Proc.88:720–55.
27. Schlögl M., Holick M.F. (2014). Vitamin D and neurocognitive function. Clin. Interv. Aging.9:559–68.
28. Holick M.F. (2011). Vitamin D: evolutionary, physiological and health perspectives. Curr. Drug Targets.12:4-18.
29. Prosser D.E., Jones G. (2004). Enzymes involved in the activation and inactivation of vitamin D. Trends Biochem. Sci.29:664-73.
30. Bischoff H., Borchers M., Gudat F., Duermueller U., Theiler R., Stähelin H., et al. (2001). In situ detection of 1,25-dihidroxivitamina D3 receptor in human skeletal muscle tissue. Histochem. J.33:19-24.
31. Simpson R., Thomas G., Arnold A. (1985). Identification of 1,25-dihidroxivitamina D3 receptors and activities in muscle. J. Biol. Chem.260:8882-891.
32. Hamilton B. (2011). Vitamin D and athletic performance: the potential role of muscle. Asian J. Sports Med.2:211–19.
33. Stockton K.A., Mengersen K., Paratz J.D., Kandiah D., Bennell K.L. (2010). Effect of vitamin D supplementation on muscle strength: a systematic review and meta-analysis. Osteoporos Int.22:859–71.
34. Tomlinson P.B., Joseph C., Angioi M. (2014). Effects of vitamin D supplementation on upper and lower body muscle strength levels in healthy individuals. A systematic review with meta-analysis. J. Sci. Med. Sport. 18(5):575-80.
35. Beaudart C., Buckinx F., Rabenda V., Gillain S., Cavalier E., Slomian J., et al. (2014). The effects of vitamin D on skeletal muscle strength, muscle mass and muscle power: A systematic review and meta-analysis of randomized controlled trials. J. Clin. Endocrinol. Metab.99:4336–345.
36. Von Hurst P.R., Beck K.L. (2014). Vitamin D and skeletal muscle function in Atletas. Curr. Opin. Clin. Nutr. Metab. Care.17:539–45.
37. Gregory S.M., Parker B.A., Capizzi J.A., Grimaldi A.S., Clarkson P.M., Moeckel-Cole S., et al. (2013). Changes in vitamin D are not associated with changes in cardiorespiratory fitness. Clin. Med. Res.2:68.
38. Mowry D.A., Costello M.M., Heelan K.A. (2009). Association among cardiorespiratory fitness, body fat, and bone marker measurements in healthy young females. J. Am. Osteopath. Assoc.109(10):534–9.
39. Ardestani A., Parker B., Mathur S., Clarkson P., Pescatello L.S., Hoffman H.J., et al. (2011). Relation of vitamin D level to maximal oxygen uptake in adults. Am. J. Cardiol.107:1246–9.
40. Koundourakis N.E., Androulakis N.E., Malliaraki N., Margioris A.N. (2011). Relation of vitamin D level to maximal oxygen uptake in adults. Am. J. Cardiol.107:1246–9.
41. Fitzgerald J., Peterson B., Warpeha J., Wilson P., Rhodes G., Ingraham S. (2014). Vitamin D status and VO2peak during a skate treadmill graded exercise test in competitive ice hockey players. J. Strength Cond. Res.28:3200–5.
42. Forney L., Earnest C.C., Henagan T., Johnson L., Castleberry T., Stewart L. (2014). Vitamin D Status, Body Composition, and Fitness Measures in College-Aged Estudiantes. J. Strength Cond. Res. 28:814–24.
43. Jastrzębski Z. (2014). Effect of vitamin D supplementation on the level of physical fitness and blood parameters of rowers during the 8-week high intensity training. Facicula Educ. Fiz şi Sport.2:57–67.
44. Sugimoto H., Shiro Y. (2012). Diversity and substrate specificity in the structures of steroidogenic cytochrome P450 enzymes. Biol. Pharm. Bull. 35:818–23.
45. D’Antona G., Lanfranconi F., Pellegrino M.A., Brocca L., Adami R., Rossi R., et al. (2006). Skeletal muscle hypertrophy and structure and function of skeletal muscle fibres in male body builders. J Physiol.570(Pt 3):611–27.
46. Schoenfeld B. (2010). The mechanisms of muscle hypertrophy and their application to resistance training. J. Strength Cond. Res.24:2857–72.
47. Schoenfeld B. (2012). Does exercise-induced muscle damage play a role in skeletal muscle hypertrophy? J Strength Cond Res. 26:1441–53.
48. Garcia L.A., Ferrini M.G., Norris K.C., Artaza J.N. (2013). 1,25(OH)2vitamin D3 enhances myogenic differentiation by modulating the expression of key angiogenic growth factors and angiogenic inhibitors in C2C12 skeletal muscle cells. J. Steroid. Biochem. Mol. Biol.133:1–11.
49. Garcia L.A., King K.K., Ferrini M.G., Norris K.C., Artaza J.N. (2011). 1,25(OH)2vitamin D3 stimulates myogenic differentiation by inhibiting cell proliferation and modulating the expression of promyogenic growth factors and myostatin in C2C12 skeletal muscle cells. Endocrinology.152:2976–86.
50. Stratos I., Li Z., Herlyn P., Rotter R., Behrendt A-K, Mittlmeier T., et al. (2013). Vitamin D increases cellular turnover and functionally restores the skeletal muscle after crush injury in rats. Am. J. Pathol.182:895–904.
51. Lund D., Cornelison D. (2013). Enter the matrix: shape, signal and superhighway. FEBS J.280:4089–99.
52. Barker T., Schneider E.D., Dixon B.M., Henriksen V.T., Weaver L.K. (2013). Supplemental vitamin D enhances the recovery in peak isometric force shortly after intense exercise. Nutr. Metab. (Lond). 10:69.
53. Ainbinder A., Boncompagni S., Protasi F., Dirksen R.T. (2015). Role of mitofusin-2 in mitochondrial localization and calcium uptake in skeletal muscle. Cell Calcium.57:14–24.
54. Todd J.J., Pourshahidi K.L., McSorley E.M., Madigan S.M., Magee P.J. (2015). Vitamin D: Recent advances and implications for Atletas. Sport Med.45:213–29.
55. Ceglia L., Niramitmahapanya S., da Silva M.M., Rivas D.A., Harris S.S., Bischoff-Ferrari H., et al. (2013). A randomized study on the effect of vitamin D3 supplementation on skeletal muscle morphology and vitamin D receptor concentration in older women. J. Clin. Endocrinol. Metab.98:E1927–35.
56. Close G.L., Russell J., Cobley J.N., Owens D.J., Wilson G., Fraser W.D., et al. (2013). Assessment of vitamin D concentration in non-supplemented professional Atletas and healthy adults during the winter months in the UK: implications for skeletal muscle function. J. Sports Sci.31:344–53.
57. Mauras N., Hayes V., Welch S., Rini A., Helgeson K., Dokler M., Veldhuis J.D., Urban R.J. (1998). Testosterone deficiency in young men: Marked alterations in whole body protein kinetics, strength, and adiposity. J. Clin. Endocrinol. Metab.83:1886–892.
58. Wehr E., Pilz S., Boehm B., März W., Obermayer-Pietsch B. (2010). Association of vitamin D status with serum androgen levels in men. Clin Endocrinol (Oxf). 73:243–8.
59. Pilz S., Frisch S., Koertke H., Kuhn J., Dreier J., Obermayer-Pietsch B., et al. (2011). Effect of vitamin D supplementation on testosterone levels in men. Horm Metab Res.43:223–5.
60. Kinuta K., Tanaka H., Moriwake T., Aya K., Kato S., Seino Y. (2000). Vitamin D is an important factor in estrogen biosynthesis of both female and male gonads. Endocrinology AD, 141:1317–324.
61. Blomberg Jensen M., Nielsen J.E., Jørgensen A., Rajpert-De Meyts E., Kristensen D.M., Jørgensen N., et al. (2010). Vitamin D receptor and vitamin D metabolizing enzymes are expressed in the human male reproductive tract. Hum Reprod.25:1303–11.
62. Blomberg Jensen M., Dissing S. (2012). Non-genomic effects of vitamin D in human spermatozoa. Steroids.77:903–9.
63. Herbst K.L., Bhasin S. (2004). Testosterone action on skeletal muscle. Curr. Opin. Clin. Nutr. Metab. Care.7:271–7.
64. Urban R.J. (2011). Growth hormone and testosterone: Anabolic effects on muscle. Horm. Res. Pædiatrics.76:81–3.
65. Holick M., MacLaughlin J., Clark M., Holick S., Potts J., Anderson R., et al. (1980). Photosynthesis of previtamin D3 in human skin and the physiologic consequences. Am. Assoc. Adv. Sci.210:203–05.
66. Webb A.R. (2006). Who, what, where and when-influences on cutaneous vitamin D synthesis. Prog. Biophys. Mol Biol.92:17–25.
67. Gilchrest B. (2008). Sun exposure and vitamin D sufficiency. Am. J. Clin. Nutr. 88:570–7.
68. Lim H.W., Gilchrest B.A., Cooper K.D., Bischoff-Ferrari H.A., Rigel D.S., Cyr W.H., et al. (2005). Sunlight, tanning booths, and vitamin D. J. Am. Acad. Dermatol. 52:868–76.
69. Wolpowitz D., Gilchrest B.A. (2006). The vitamin D questions: how much do you need and how should you get it? J. Am. Acad. Dermatol.54:301–17.
70. Holick M.F. (2001). Sunligth "D"ilemma: Risk of skin cancer or bone disease and muscle weakness. Lancet. :4–6.
71. Heaney R.P. (2008). Vitamin D in health and disease. Clin. J. Am. Soc. Nephrol. 3:1535–41.
72. Mithal A., Wahl D.A., Bonjour J-P, Burckhardt P., Dawson-Hughes B., Eisman J.A, et al. (2009). Global vitamin D status and determinants of hypovitaminosis D. Osteoporos. Int.20:1807–20.
73. Walker N, Love TD, Baker DF, Healey PB, Haszard J, Edwards AS, et al. (2014). Knowledge and attitudes to vitamin D and sun exposure in elite New Zealand Atletas: a cross-sectional study. J. Int. Soc. Sports Nutr.11:47.
74. Matsuoka L.Y., Wortsman J., Hollis B.W. (1990). Use of topical sunscreen for the evaluation of regional synthesis of vitamin D3. J. Am. Acad. Dermatol.22:772–5.
75. Tripkovic L., Lambert H., Hart K., Smith C.P., Bucca G., Penson S., et al. (2012). Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am. J. Clin. Nutr.95:1357–64.
76. Holick M. (2007). Vitamin D deficiency. N. Engl. J. Med.357:266–81.
77. Houghton L,A., Vieth R. (2006). The case against ergocalciferol (vitamin D2) as a vitamin supplement. Am. J. Clin. Nutr.;84:694–7.
78. Logan V.F., Gray A.R., Peddie M.C., Harper M.J., Houghton L.A. (2013). Long-term vitamin D3 supplementation is more effective than vitamin D2 in maintaining serum 25-hydroxyvitamin D status over the winter months. Br. J. Nutr.109:1082–8.
79. Harris SS, Dawson-Hughes B. (2002). Plasma vitamin D and 25OHD responses of young and old men to supplementation with vitamin D3. J. Am. Coll. Nutr. 21:357–62.
80. Post J.L., Ilich Ernst J.Z. (2013). Controversies in vitamin D recommendations and its possible roles in nonskeletal health issues. J. Nutr. Food Sci.03:1–5.
81. Ross A.C., Taylor C.L. (2011). Yaktine A. L. Calcium Vitamin D: Valle HB Del.
82. Endocrine S. (2011). Evalutation, treatment, and prevention of vitamin D deficiency: An endocrine society clinical practice guideline. .
83. Vieth R. (2004). Why the optimal requirement for Vitamin D3 is probably much higher than what is officially recommended for adults. J. Steroid Biochem. Mol. Biol.89–90:575–9.
84. Cannell J., Hollis B. (2008). Use of vitamin D in clinical practice. Altern. Med. Rev.13:6–20.
85. Heaney R.P. (2011). Assessing vitamin D status. Curr. Opin. Clin. Nutr .Metab Care.14:440–44.
86. Vieth R. (1999). Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am. J. Clin. Nutr.69:842–56.
87. Bischoff-Ferrari H.A., Giovannucci E., Willett W.C., Dietrich T., Dawson-Hughes B. (2006). Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am. J. Clin. Nutr.84:18–28.
88. Pramyothin P., Holick M.F. (2012). Vitamin D supplementation: guidelines and evidence for subclinical deficiency. Curr. Opin. Gastroenterol.28:139–50.
89. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., Gordon C.M., Hanley DA, Heaney R.P., et al. (2011). Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab.96:1911–30.
90. Hollis B.W. (2005). Circulating 25-hydroxyvitamin D levels indicative of vitamin D sufficiency: implications for establishing a new effective dietary intake recommendation for vitamin D. J. Nutr.135:317–22.
91. Engelman C.D. (2011). Vitamin D recommendations: the saga continues. J. Clin. Endocrinol. Metab. 96:3065–6.
92. Barger-Lux M.J., Heaney R.P., Dowell S., Chen T.C., Holick M.F. (1998). International original article vitamin D and its major metabolites : Serum levels after graded oral dosing in healthy men. Osteoporos. Int.25:222–30.
93. Lappe J., Cullen D., Haynatzki G., Recker R., Ahlf R., Thompson K. (2008). Calcium and vitamin d supplementation decreases incidence of stress fractures in female navy recruits. J. Bone Miner. Res. 23:741–9.
94. Dawson-Hughes B., Heaney R.P., Holick M.F., Lips P., Meunier P.J., Vieth R. (2005). Estimates of optimal vitamin D status. Osteoporos. Int.16:713–6.
95. Heaney R.P., Davies K.M., Chen T.C., Holick M.F., Janet Barger-Lux M. (2003). Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am. J. Clin. Nutr.77:204–10.
96. Webb A.R., Kline L., Holick M.F. (1988). Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J. Clin. Endocrinol. Metab.67:373–8.
97. Valtueña J., Dominguez D., Til L., González-Gross M., Drobnic F. (2014). High prevalence of vitamin D insufficiency among elite Spanish Atletas the importance of outdoor training adaptation. Nutr. Hosp.;30:124–31.
98. Villacis D., Yi A., Jahn R., Kephart C.J., Charlton T., Gamradt S.C., et al. (2014). Prevalence of Abnormal Vitamin D Levels Among Division I NCAA Atletas. Sports Health.;6:340–7.
99. Constantini N.W., Arieli R., Chodick G., Dubnov-Raz G. (2010). High prevalence of vitamin D insufficiency in Atletas and dancers. Clin. J. Sport. Med. 20:368–71.
100. Holick M.F. (2005). The vitamin D epidemic and its health consequences. J. Nutr.;135:2739S–48.
101. Van den Ouweland J., Fleuren H., Drabbe M., Vollaard H. (2014). Pharmacokinetics and safety issues of an accidental overdose of 2,000,000 IU of vitamin D3 in two nursing home patients: a case report. BMC Pharmacol. Toxicol.15:57.
102. Suda T., Ueno Y., Fujii K., Shinki T. (2003). Vitamin D and bone. J. Cell Biochem.;88:259–66S.
103. Zittermann A. (2014). Vitamin D and cardiovascular disease. Anticancer Res.34:4641–648.
104. Kidd P.M. (2010). Vitamins D and K as pleiotropic nutrients: clinical importance to the skeletal and cardiovascular systems and preliminary evidence for synergy. Altern. Med. Rev. 15:199–222.
105. Gundberg C.M., Lian J.B., Booth S.L. (2012). Vitamin K-dependent carboxylation of osteocalcin: friend or foe? Adv. Nutr. An.3:149–57.
106. Mizuguchi M., Fujisawa R., Nara M., Nitta K., Kawano K. (2001). Fourier-Transform infrared spectroscopic study of Ca2 + -binding to osteocalcin. Calcif. Tissue Int.69:337–42.
107. Fitzpatrick T.B., Basset G.J.C., Borel P., Carrari F., DellaPenna D., Fraser P.D., et al. (2012). Vitamin deficiencies in humans: can plant science help? Plant Cell. 24:395–414.
108. Binkley N.C., Krueger D.C., Kawahara T.N., Engelke J.A., Chappell R.J., Suttie J.W. (2002). A high phylloquinone intake is required to achieve maximal osteocalcin γ-carboxylation. Am. J. Clin. Nutr.76:1055–60.
109. Akiyama Y., Hara K., Tajima T., Murota S., Morita I. (1994). Effect of vitamin K2 (menatetrenone) on osteoclast-like cell formation in mouse bone marrow cultures. Eur. J. Pharmacol.263:181–5.
110. Akiyama Y., Hara K., Kobayashi M., Tomiuga T., Nakamura T. (1999). Inhibitory Effect of Vitamin K2 (Menatetrenone) on Bone Resorption in Ovariectomized Rats. A Histomorphometric and Dual Energy X-Ray Absorptiometic Study. The Japanese Journal of Pharmacology.80(1):67–74.
111. Feskanich D., Weber P., Willett W.C., Rockett H., Booth S.L., Colditz G.A. (1999). Vitamin K intake and hip fractures in women: a prospective study. Am. J. Clin. Nutr.69:74–9.
112. Masterjohn C. (2007). Vitamin D toxicity redefined: vitamin K and the molecular mechanism. Med. Hypotheses.68:1026–34.
113. El Asmar M.S., Naoum J.J., Arbid E.J. (2014). Vitamin k dependent proteins and the role of vitamin k2 in the modulation of vascular calcification: a review. Oman Med. J.;29:172–7.
114. Hamidi M.S., Cheung A.M. (2014). Vitamin K and musculoskeletal health in postmenopausal women. Mol. Nutr. Food Res.;58:1647–57.
115. Iwamoto J. (2014). Vitamin K2 therapy for postmenopausal osteoporosis. Nutrients.6:1971–80.
116. Murakami K., Yamanaka N., Ohnishi K., Fukayama M., Yoshino M. (2012). Inhibition of angiotensin I converting enzyme by subtilisin NAT (nattokinase) in natto, a Japanese traditional fermented food. Food Funct.3:674–8.
117. Dowd P., Hershline R., Ham S.W., Naganathan S. (1994). Mechanism of action of vitamin K. Nat. Prod. Rep.11:251–64.
118. Fusaro M., Crepaldi G., Maggi S., Galli F., D’Angelo A., Calò L., et al. (2011). Vitamin K, bone fractures, and vascular calcifications in chronic kidney disease: an important but poorly studied relationship. J. Endocrinol. Invest.;34:317–23.
119. Konakion®. (2010). Konakion®. p. 1–6.
120. Craciun A.M., Wolf J., Knapen M.H., Brouns F., Vermeer C. (1998). Improved bone metabolism in female elite Atletas after vitamin K supplementation. Int. J. Sports Med.19:479–84.
121. Visser M., Deeg D.J., Puts M.T., Seidell J.C., Lips P. (2006). Low serum concentrations of 25-hydroxyvitamin D in older persons and the risk of nursing home admission. Am. J. Clin. Nutr.84:671–672.