Regulación de la Grasa Endógena y Metabolismo de los Carbohidratos en Relación a la Intensidad y Duración del Ejercicio
Edward F Coyle1, J. A Romijn1, L. S Sidossis2, A. Gastaldelli2, J. F Horowitz2, E. Endert3 y R. R Wolfe3
1Metabolism Unit, Shriners Burns Institute and Dept. of Anesthesiology and of Surgery, University of Texas Medical Branch, Galveston.
2Human Performance Laboratory, Department of Kinesiology and Health Education, The University of Texas at Austin, TX 78712, Estados Unidos.
3Dept. of Endocrinology, Academisch Medisch Centrum, University of Amsterdam, Amsterdam, The Netherlands.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1996.
Publicado 29 de marzo de 2004
Resumen
Palabras clave: espectrometría de masa, isótopos estables, ácidos grasos libres, triglicéridos musculares, glucógeno
Numerosos estudios han apuntado al metabolismo de sustratos durante el ejercicio, pero no ha sido completamente elucidada la relación entre la intensidad del ejercicio y la movilización de sustratos de las distintas reservas endógenas (27). Jones y cols. (21) brindaron evidencias de que la tasa de aparición de ácidos grasos libres (AGL) es menor durante ejercicios de intensidad moderada [70 % del máximo consumo de O2 (VO2máx )] que durante ejercicios de baja intensidad (36 % del VO2máx; ver ref. 21). Esta respuesta paradójica con respecto a los requerimientos energéticos, podría estar relacionada a alteraciones en la lipólisis del tejido adiposo. Sin embargo, las tasas lipolíticas de todo el organismo sólo han sido medidas durante ejercicios de baja intensidad (16,37), y no se conoce el efecto de la intensidad del ejercicio sobre la lipólisis del tejido adiposo. También es posible que la lipólisis sea estimulada durante ejercicios de alta intensidad, pero los AGL no serían liberados a la circulación, ya sea por un aumento de la reesterificación o atrapamiento dentro de los adipocitos. Cualquiera de estas posibilidades podrían ser consecuencia de la vasoconstricción, y por lo tanto, del flujo deficiente de albúmina, la cual es necesaria para unirse a los AGL para el transporte (2,15,28). Sin embargo, hasta el momento no se conoce el compromiso de estos mecanismos en la regulación de la liberación de AGL, desde el tejido adiposo, durante diferentes intensidades de ejercicio.
La grasa oxidada por el músculo activo es derivada no sólo de los AGL plasmáticos sino también de los triglicéridos musculares. La utilización de los triglicéridos musculares podría ser responsable de una considerable porción de los requerimientos energéticos, especialmente en individuos entrenados (19, 20), pero no se ha cuantificado la tasa de utilización de triglicéridos musculares, a diferentes intensidades.
El objetivo del presente estudio fue determinar los efectos cuantitativos de la intensidad y duración del ejercicio sobre la movilización y utilización de AGL endógenos. Nosotros hipotetizamos que la lipólisis dentro de los adipocitos es estimulada al máximo, durante ejercicios de muy baja intensidad, ya que la lipólisis periférica es muy sensible a la estimulación simpática mínima (4), mientras que la lipólisis de triglicéridos dentro del músculo y, por lo tanto, la oxidación de triglicéridos musculares podría ser estimulada a mayores intensidades de ejercicio. Para ubicar los datos del metabolismo de los AGL en la perspectiva del metabolismo general de los sustratos energéticos, simultáneamente fue evaluado el metabolismo de los carbohidratos (CHO).
Como punto esencial para lograr el objetivo de este estudio, fue necesario cuantificar la oxidación de grasas y carbohidratos durante ejercicios de alta intensidad. Se observó previamente que la calorimetría indirecta era inexacta, debido a la excesiva producción de CO2. Por lo tanto, en un estudio reciente, nosotros describimos un nuevo método con trazadores isotópicos para cuantificar las tasas de oxidación de CHO y grasas, independientemente de las tasas de producción de CO2 (26). Utilizando este método, nosotros validamos la calorimetría indirecta durante intensidades de ejercicio a180-85 % del VO2máx. como medio para cuantificar las tasas de oxidación de sustratos en sujetos entrenados. Debido a que se puede asumir que la glucosa y AGL captados del plasma (medidos por la infusión continua de glucosa [6,6_2H2] y de palmitato [2H2]) son completamente oxidados durante el ejercicio (6,17), la contribución mínima de los triglicéridos y del glucógeno muscular a la producción energética está representada por la diferencia entre la oxidación de sustratos de todo el organismo y el consumo de AGL y glucosa plasmática. A partir de las tasas lipolíticas de todo el organismo (medidas por la infusión continua de glicerol [2H5]) y la tasa lipolítica de los triglicéridos musculares (derivada de la tasa de oxidación de triglicéridos), se obtiene la tasa de lipólisis dentro del tejido adiposo (lipólisis periférica). Por lo tanto, este nuevo enfoque permite por primera vez, la cuantificación de todos los aspectos esenciales de la cinética y oxidación de los lípidos y carbohidratos. Nosotros aplicamos estos métodos en cinco sujetos entrenados, durante tres intensidades de ejercicio (25, 65, y 85 % del VO2máx) .
METODOS
Sujetos
Cinco ciclistas entrenados en resistencia (edad 24 ± 2 años, peso 75.2± 3.6 kg, estatura 1.78 ± 0.03 m, VO2máx 67 ± 3 ml.kg-1.min-1) se prestaron como voluntarios para este estudio. Todos los sujetos estaban sanos, según la historia clínica médica y el examen físico. Los mismos fueron evaluados en estado post absortivo, luego de un ayuno de 10 a 12 horas. El VO2máx. fue determinado varias semanas antes de las series experimentales, mientras los sujetos pedaleaban en una bicicleta ergométrica (Monark 819). El VO2máx. se determinó durante un protocolo progresivo de ciclismo que duraba entre 7 y 10 min. El estudio fue aprobado por los Comités Institucionales de Revisión de la Universidad de Texas, en Galveston y Austin.
Protocolo de ejercicio
Los sujetos fueron evaluados en tres días consecutivos en estado de post-absorción. En cada día se realizó una intensidad diferente de ejercicio (25, 65, u 85 % del VO2máx.); el orden de las intensidades fue decidido al azar. En cada ocasión, se inyectaron isótopos estables, y se utilizó calorimetría indirecta para determinar el consumo de oxígeno (VO2) y la producción de dióxido de carbono (VCO2), durante un período basal de 2 horas, y durante 30 min. (85 VO2máx) o durante 120 min. de ejercicio (25 y 65 % VO2máx ), en una bicicleta ergométrica (Monark 819). Inmediatamente después del ejercicio, los sujetos se acostaban en una cama mientras la infusión de isótopos estables continuaba por una hora durante la recuperación. Inmediatamente después de la recuperación del ejercicio, se comenzó la reposición de carbohidratos, dándoles de beber a los sujetos una solución de granos de almidón a intervalos frecuentes. La cantidad de carbohidratos ingerida cada día (300-400 g) era aproximadamente el doble de la máxima cantidad de glucógeno oxidado durante el ejercicio.
Calorimetría indirecta
La calorimetría indirecta fue realizada en reposo, durante al menos 15 minutos en forma continua en los primeros 30 minutos de ejercicio (durante las 3 intensidades de esfuerzo), y durante intervalos de 5 a 10 minutos cada 15 minutos, durante el resto del ejercicio (en las intensidades de 25 y 65 % del VO2máx). Los valores obtenidos desde los 20 a los 30 minutos de ejercicio fueron utilizados para calcular y comparar las tasas de oxidación de sustratos, entre los 3 niveles de ejercicio, debido al aparente «steady-state» en ese momento. De ahí en más, los valores obtenidos en los períodos de 15 minutos subsiguientes, fueron usados para evaluar el efecto de la duración del ejercicio sobre la oxidación de sustratos. Los valores de reposo fueron obtenidos luego de que los sujetos hayan descansado en cama por lo menos una hora. Los volúmenes de aire inspirado fueron medidos con un ventilómetro (Parkinson-Cowan CD-4). Se extrajeron muestras de gases espirados de una cámara de mezclado y se analizaron los gases: el O2 (Applied Electrochemistry S3A) y el CO2 (Beckman LB-2). Los resultados analógicos de los analizadores de gases y del ventilómetro fueron ingresados en la computadora del laboratorio para el cálculo de VO2 y VCO2.
Infusión de isótopos
Se colocaron catéteres de teflón en forma percutánea en una vena antecubital, y un catéter de muestra fue inspirado en una vena en la parte dorsal de la mano, en el brazo contralateral. Para obtener muestras sanguíneas arterializadas, se utilizó la técnica de «mano caliente» (mediante uso de cremas hiperhemizantes). Luego de la colocación del catéter, los sujetos se acostaban en una cama durante 1 hora. Luego de la extracción de una muestra de sangre para determinar el nivel basal de los sustratos, se comenzaron a inyectar fracciones constantes de infusión de glucosa [6,6-2H2 (enriquecida al 99 %; Merck, Rahway, NJ; 0.22umol.kg -1.min.-1; fracción 17.6 umol/ kg), de glicerol [2H5] (0.1 umol.kg-1. min.-1; fracción 1.5umol/kg),y depalmitato [2H2] (0.04umol.kg-1.min.-1 ; no fracción), utilizando jeringas calibradas (Harvard Apparatus, Natick, MA). La tasa exacta de infusión en cada experimento fue determinada midiendo las concentraciones en las infusiones. Los trazadores isotópicos de glicerol y palmitato (ambos enriquecidos al 99 %) fueron adquiridos en TracerTechnologies (Newton, MA). El palmitato fue unido a albúmina (Cutter Biological, Berkeley, CA) siguiendo procedimientos descriptos previamente (36). Luego de 2 h de infusión, con los sujetos en reposo, comenzaba el ejercicio, y se duplicaba la tasa de administración de isótopos para palmitato y glucosa, y se triplicaba para glicerol, para minimizar los cambios en el enriquecimiento isotópico de sustratos. Durante el ejercicio al 85 % del VO2máx. se duplicó la tasa de infusión de glucosa [6,6_2H2], y luego de los primeros 10 minutos se triplicó, en comparación con la tasa de infusión en reposo. La infusión de isótopos continua con las tasas de reposo durante la primera hora de recuperación, para determinar la cinética de los sustratos.
Muestras de sangre
Se extrajo sangre a los 105, 110, 115, y 120 min. luego del comienzo de la infusión para medir las cinéticas de reposo. Durante el esfuerzo a intensidades al 25 y 65 % del VO2máx., se extrajo sangre luego de los 5, 15, 30, 45, 60, 75, 90, 105, y 120 minutos de ejercicio. Durante los 30 minutos de ejercicio a 185 del VO2máx, se obtuvieron muestras cada 5 minutos. En todos los experimentos, se extrajeron muestras sanguíneas luego de los 5, 15, 30, 45, y 60 min. de recuperación. Todas las muestras fueron colocadas en tubos de 10 ml que contenían heparina de litio y conservadas en hielo. El plasma fue separado por centrifugación luego de la extracción de las muestras, y congelado hasta su procesamiento posterior.
Análisis de las muestras
La concentración de glucosa plasmática fue medida usando un analizador de glucosa (Beckman Instruments) por el método de glucosa oxidasa. El enriquecimiento de glucosa [6,6-2H2] en el plasma fue determinado como se describió previamente (35). Brevemente, el plasma fue deproteinizado con soluciones de hidróxido de bario y sulfato de zinc. La glucosa se extrajo por cromatografia de intercambio anión-catión en lecho mixto (AG-1-X8 y AG 50WX8; Bio-Rad Laboratories, Richmond, CA), y reaccionó con anhídrido acético y piridina para formar el derivado penta-acetato. El enriquecimiento isotópico fue determinado por espectrometría de masa cromatografía gaseosa (GC-MS modelo 5985B; Hewlett-Packard, Fullerton, CA), utilizando ionización de impacto electrónico, que monitoriza en forma selectiva los iones al cociente masa-carga (m/e) 202, 201, y 200. Se realizaron correcciones por la contribución de moléculas unidas simples (m/e 201) al aparente enriquecimiento a m/e 202 (35).
Se extrajeron los AGL del plasma, aislados por cromatografía de estrato fino, y derivados a sus ésteres metilos. Las concentraciones de palmitato y AGL totales fueron determinadas por cromatografía gaseosa (Hewlett-Packard 5890), usando ácido heptadecanoico como standard interno. El enriquecimiento isotópico del palmitato fue medido por análisis GC-MS de los derivados del ester metilo en una Hewlett-Packard 5992 (36). Los iones de m/e 270 y 272 fueron selectivamente monitorizados. El enriquecimiento isotópico del glicerol fue determinado por GC-MS (Hewlett-Packard 5985B) siguiendo los procedimientos descriptos previamente (38). Los iones m/e 205 y 208 fueron monitorizados. Se midieron las concentraciones plasmáticas de catecolaminas según procedimientos descriptos con anterioridad (11).
Cálculos
CALORIMETRIA INDIRECTA. Las tasas de oxidación de carbohidratos y grasas fueron calculadas usando ecuaciones estaquiométricas (14). Se asumió una tasa de eliminación de nitrógeno de 135 ug.kg-1.min.-1 . Este valor promedio fue tomado por los valores medidos, en otro estudio realizado en nuestro laboratorio (3). Un error del 30 % en este valor asumido (que excede el rango total de valores en el estudio previo) no tendría un efecto significativo sobre los valores calculados de oxidación de grasas y carbohidratos, durante el ejercicio en el presente estudio. Se determinó la oxidación de ácidos grasos convirtiendo la tasa de oxidación de triglicéridos (g. kg-1.min.-1) a su equivalente molar, asumiendo que el peso molecular promedio de los triglicéridos es de 860 g/mol (14), y multiplicando la tasa molar de oxidación de triglicéridos por tres, porque cada mo1écula contiene tres moles de ácidos grasos. Las tasas de aparición (Ta) y, cuando era apropiado, las tasas de desaparición (Td = consumo por el tejido) de glucosa, glicerol y palmitato, en reposo, fueron calculadas utilizando la ecuación de Steele (33). Esta ecuación tuvo que ser modificada por el uso de un isótopo estable. La concentración (C) del trazador en el tiempo (t) puede ser calculada por la concentración medida (Cm) y el enriquecimiento (E; cociente trazador / trazado) en aquel momento C = Cm/(1 + E) Por lo tanto, la forma actual de la ecuación de Steele es:
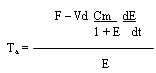
y
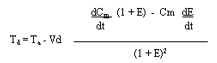
en donde: - F es la tasa de infusión; - Vd es el volúmen efectivo de distribución Los valores de Ta fueron calculados a los 20-30, min. para comparaciones entre las 3 intensidades de ejercicio a intervalos de 15 min., para después evaluar el efecto de la duración. Durante el ejercicio y los primeros 30 minutos de recuperación, las cinéticas fueron calculadas en la forma descripta arriba, después de un enriquecimiento de ajuste previo y una concentración de datos usando curvas de ajuste de puntos (39). Se asumió un Vd efectivo de 230 ml/kg para el glicerol y 40 ml/kg para el palmitato. El valor de palmitato fue elegido porque los cambios agudos en la concentración de palmitato están esencialmente restringidos al plasma (estando unidos a la albúmina). Es menos claro el valor apropiado para la glucosa, por lo cual los datos fueron computados para Vd = 40, 100, y 165 ml/kg. Han sido discutidas, en forma extensa, las limitaciones de la ecuación de Steele, pero en situaciones en las cuales los cambios en el enriquecimiento son pequeños, el valor elegido para Vd se vuelve inconsecuente y, por lo tanto, los valores calculados son confiables (35). La Ta de AGL fue calculada dividiendo la Ta de palmitato por la contribución fraccional de palmitato en la concentración total de AGL, determinada por la cromatografía gaseosa.
La Ta de glicerol fue utilizada como reflejo de la lipólisis, con la presunción que todo el glicerol liberado en el proceso de lipólisis, ya sea en el tejido adiposo o muscular, aparece en el plasma. Esto es porque la reutilización del glicerol requiere fosforilación a través de la enzima glicerol-kinasa, y esto ocurre principalmente en el hígado (9, 24). Además, el glicerol no puede ser producido en el organismo, de otra manera que no sea por la lipólisis (38). En consecuencia, la liberación total de AGL iguala en tres veces la Ta de glicerol.
Dada la tasa de lipólisis total y liberación total de AGL en el plasma (y su consumo), y la tasa de oxidación total de grasa, es posible distinguir en forma cuantitativa, entre la lipólisis en el tejido adiposo (lipólisis periférica) y la lipólisis intramuscular. Si se puede asumir que todos los AGL captados del plasma durante el ejercicio son oxidados (17), entonces la siguiente ecuación nos brinda la tasa mínima de oxidación intramuscular de ácidos grasos
oxidación intramuscular de ácidos grasos (umol.kg-1.min.-1)= oxidación total de ácidos grasos (umol AGL.kg-1.min.-1) - Td AGL
Por cada tres ácidos grasos liberados del «pool» intramuscular de triglicéridos, un glicerol será liberado en el plasma. Consecuentemente, la tasa mínima de liberación de glicerol por el «pool» intramuscular de triglicéridos (lipólisis intramuscular) se calculará de la siguiente manera:

La tasa total de liberación de glicerol es igual al glicerol liberado por los adipocitos periféricos, y el glicerol liberado por el «pool» intramuscular. En consecuencia, es posible calcular la tasa de lipólisis de adipocitos (periféricos) de la siguiente manera:
lipólisis periférica (umol.kg-1.min.-1) = Ta total de glicerol - lipólisis intramuscular (umol.kg-1.min.-1)
A partir de la tasa total de oxidación de carbohidratos, obtenida por calorimetría indirecta, y la tasa de consumo de glucosa del tejido, reflejada por la Td de glucosa, se puede calcular la contribución de las reservas de glucógeno muscular a la oxidación de carbohidratos, asumiendo que el 100 % del consumo de glucosa plasmática es oxidado durante el ejercicio (6). Si se oxida < 100 %, se subestimará el valor calculado de oxidación de glucógeno intramuscular. Por lo tanto, la siguiente ecuación brinda la tasa mínima de oxidación de glucógeno muscular:
oxidación de glucógeno muscular = oxidación total de carbohidratos - Td de glucosa
Por lo tanto, por este método, cualquier ruptura de glucógeno que lleve a la producción de lactato en lugar de su oxidación completa, no será incluida en el cálculo de la tasa de oxidación. Por ello, la ruptura glucogénica excede la tasa calculada de oxidación de glucógeno en un porcentaje igual al porcentaje de glucosa plasmática convertida a lactato, ya que los caminos metabólicos de glucógeno y glucosa convergen a glucosa 6-fosfato y, de allí en más, son los mismos.
Análisis estadísticos
Los resultados son presentados como las medias ± DS. Se analizó el efecto del tiempo sobre la respuesta dentro de cada nivel de ejercicio, a través de un análisis de variancia a dos vías de mediciones repetidas (tratamiento x tiempo). Cuando fue necesario, se compararon los tiempos a través del test de Fishers de la menor diferencia significativa. Los resultados de los 30 min. a las tres intensidades de ejercicio fueron comparados por análisis de variancia a dos vías para diseños de bloques aleatorios, en donde los sujetos son los bloques y los 3 niveles de ejercicio, los tratamientos. En algunos casos, el análisis de variancia fue seguido por un test de comparación múltiple para detectar diferencias entre los grupos. Se. consideró significancia estadística a un P< 0.05.
RESULTADOS
Estado basal
No hubo diferencias en las concentraciones plasmáticas de sustratos y hormonas, tasas de aparición, o tasas de oxidación de carbohidratos y AGL, en reposo, antes de las tres intensidades de ejercicio.
Ejercicio
Concentración plasmática. Después de 30 min. de ejercicio, hubo una clara relación entre intensidad del ejercicio y concentración de glucosa plasmática. Las concentraciones fueron de 77 ± 4, 98 ± 6, y 147 ± 1 mg/dl, después de 30 min. de ejercicio al 25, 65, y 85 % del VO2máx., respectivamente (P< 0.05 entre todos los valores). Durante los 90 min. siguientes de ejercicio (al 25 y 65 % del VO2máx.), la concentración de glucosa plasmática no cambió (al 25 % del VO2máx.) o disminuyó a los niveles anteriores al ejercicio (70 ± 3 mg/dl, a165 % del VO2máx ).
Las concentraciones de glicerol plasmático y AGL son mostradas en la Figura 1. Las de glicerol aumentaron durante todas las intensidades de ejercicio. Las concentraciones de glicerol después de 30 min. de ejercicio al 65 % y 85 % del VO2máx. fueron significativamente mayores que aquellas obtenidas durante ejercicios de baja intensidad (P< 0.05). La concentración de glicerol fue significativamente mayor después de 120 min. de ejercicio al 65 % del VO2máx., en comparación con un ejercicio al 25 % del VO2máx. (P< 0.01). Las concentraciones plasmáticas de AGL mostraron un incremento progresivo durante el ejercicio al 25 % del VO2máx. (reposo: 0.86 ± 0.12; 30 min.: 0.97 ± 0.18;120 min.: 1.17 mmol/l; P< 0.02). Durante el 65 % del VO2máx, hubo una disminución inicial (reposo: 0.86 ± 0.14; 5 min.: 0.67 ±0.13 mmol/ 1; P< 0.05), seguida por un incremento constante en la concentración plasmática de AGL (30 min.: 0.90 ± 0.14; 120 min.: 1.12 ± 0.12 mmol/l; no significativo vs. 25 % del VO2máx ) Sin embargo, durante ejercicios al 85 % del VO2máx., los niveles de AGL disminuyeron en forma persistente (reposo: 0.99 ± 0.05; 5 min.: 0.631 ± 0.06; 30 min.: 0.52 ± 0.08 mmol/1; P< 0.05). En la recuperación de ejercicios de alta intensidad, las concentraciones de AGL aumentaron en forma transitoria. Las concentraciones de lactato plasmático permanecieron al nivel de reposo durante ejercicios al 25 % del VO2máx. La concentración de lactato se incrementó de los valores de reposo de 1.04 ± 0.08 a 2.27 ± 0.29 mmol/l al 65 % del VO2 durante ejercicios al 85 % del VO2máx. la concentración de lactato fue de 7.9 ± 0.9 mmol/l a los 10 min., y 9.0 ± 0.5 mmol/l a los 30 min.
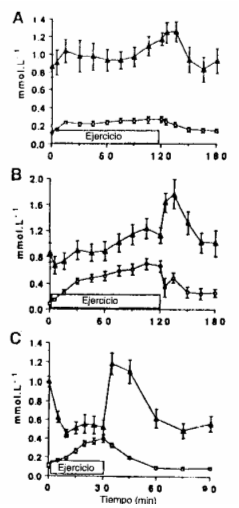
Figura 1. Concentraciones de glicerol () y ácidos grasos fibres (AGL;)
(medias ± DS) durante ejercicio al 25 % (A), 65 % (B), y 85 % (C) del máximo
consumo de oxígeno (VO2máx.), y subsiguiente recuperación
en 5 sujetos entrenados.
Cinéticas de los sustratos
Las tasas de infusión de isótopos estables fueron aumentadas al comienzo del ejercicio para minimizar el efecto de un enriquecimiento isotópico en condiciones no estables en el cálculo de las cinéticas de los sustratos (37). Porque no conocíamos de antemano el efecto preciso de la intensidad del ejercicio sobre la cinética de los sustratos (ésto es, el objetivo de este estudio), tuvimos solo un éxito parcial en mantener el «steady-state isotópico» (Figuras 2-4). Sin embargo, los enriquecimientos alrededor de los 30 min. de ejercicio, fueron relativamente estables para todos los trazadores (Figuras 2-4), y fue en este momento en el cual se realizaron las comparaciones entre las 3 intensidades de ejercicio. Consecuentemente, el use de distintas fracciones de «pool» de los sustratos, que es la principal variable que puede confundir en el cálculo de las cinéticas en «no steady-state» (35), no alteró en forma apreciable la Ta calculada para cualquier sustrato.
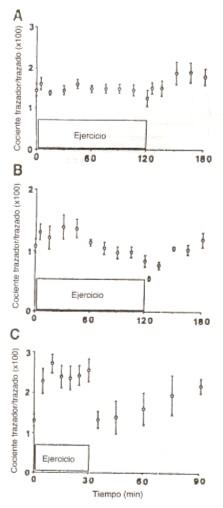
Figura 2. Cocientes
trazados/trazado (media ± DS) de palmitato, durante infusiones de palmitato (2H2),
medidos en reposo, y durante 3 niveles de ejercicio [25 % (A), 65 % (B) y 85 %
(C) del VO2máx.] y durante la 1° hora de recuperación.
Cada valor representa la media ± DS, en sujetos entrenados. Durante el
ejercicio, las tasas de infusión se incrementaron 2 veces por sobre la tasa de
infusión en reposo; durante el período de recuperación retornaron a la tasa de
reposo.
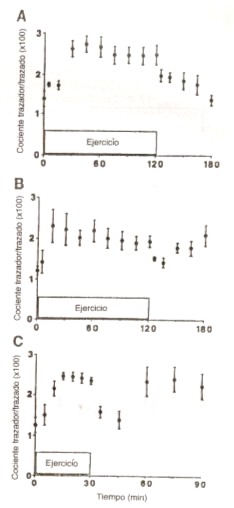
Figura 3. Cocientes
trazador/trazado de glicerol, durante infusión de glicerol [2H2],
medio en reposo, y durante 3 niveles de ejercicio [25 % (A), 65 % (B) y 85 % (C)
del VO2máx.], y durante la 1° hora de recuperación. Cada
valor representa la media ± DS, en 5 sujetos entrenados. Durante el ejercicio,
las tasas de infusión se incrementaron 3 veces por sobre la tasa de infusión en
reposo, durante el período de recuperación retornaron a la tasa de reposo.
Glucosa. La Ta y Td de glucosa aumentó significativamente (P < 0.02) durante las tres intensidades, acorde y en proporción a cada una de ellas (Figura 5). El uso en diferentes fracciones de “pool” (4, 100, 165 ml/kg) tuvo un efecto mínimo sobre los valores TA/Td de glucosa calculados, debiéndose al enriquecimiento isotópico casi en “steady-state” (estado estable). Los valores con una fracción de “pool” de 100 ml/kg fueron utilizados en los cálculos presentados en la Figura 5.
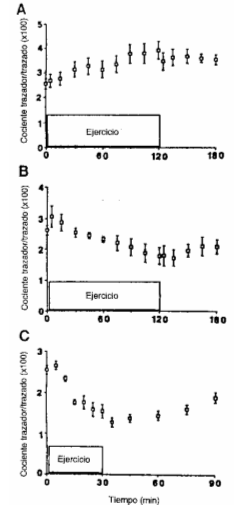
Figura 4. Cocientes
trazador/trazado de glucosa durante infusión de glucosa [6,6-2H2],
medido en reposo, y durante 3 niveles de ejercicio [25 % (A), 65 % (8), y 85 %
(C) del VO2máx.) y durante la 1° hora de recuperación.
Cada valor representa la media ± DS, en 5 sujetos entrenados. Las tasas de
infusión se incrementaron 2 veces por sobre la tasa de infusión en reposo, al
comienzo del ejercicio, y 3 veces durante el período de 10 a 30 minutos al 85 %
del VO2máx.. Durante la recuperación, la tasa de infusión retomó a
los niveles de reposo.
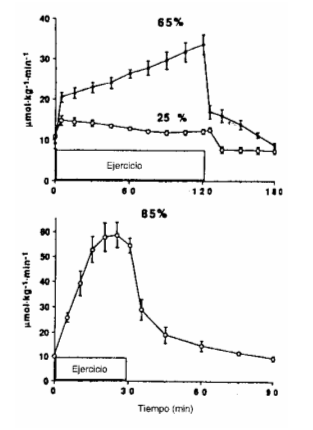
Figura 5. Tasas de
aparición de glucosa (media s± DS), durante ejercicios al 25, 65, y85 % del VO2máx.,
y subsiguiente recuperación, en 5 sujetos entrenados, calculadas por ecuaciones
en "no steady-state- con fracciones de "pool" de 100 ml/kg. Los valores
obtenidos durante las diferentes intensidades de ejercicio fueron
significativamente diferentes (P< 0.05).
AGL. La Ta de AGL aumentó al comienzo del ejercicio y luego permaneció estable durante los 120 min. de ejercicio al 25 % del VO2máx., mientras que se incrementó, en forma progresiva, a través del ejercicio al 65 % del VO2máx. (Figura 6). Por el contrario, la Ta de AGL durante el ejercicio al 85 % del VO2máx. no aumentó por sobre los valores de reposo, a pesar de la estimulación de la lipólisis, como se refleja por el incremento en la Ta del glicerol (Figura 6). Como resultado, hubo una correlación inversa entre la intensidad del ejercicio y la Ta de AGL, luego de 30 min. de ejercicio (Tabla 1). Durante la segunda hora de ejercicio al 25 y al 65 % del VO2máx; no hubo diferencia significativa en la Ta de AGL, a pesar de que el incremento promedio fue levemente mayor durante el ejercicio al 65 % (Fig. 6).
Dentro de los 5 min. de recuperación post ejercicio suave y moderado, la Ta de AGL disminuyó. Por el contrario, inmediatamente después de terminar el ejercicio de alta intensidad, hubo un incremento significativo pero transitorio en la Ta de AGL, en comparación con los valores obtenidos al final del ejercicio (P< 0.02; Fig. 6).
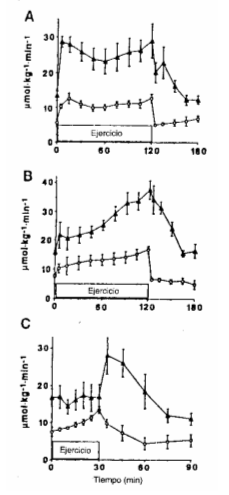
Figura 6. Tasas de
aparición de glicerol ( ) y ácidos grasos libres (AGL; ) (medias ± DS),
durante ejercicio a1 25 % (A), 65 (B), y 85 % (C) del máximo consumo de oxígeno
(VO2máx.), y subsiguiente recuperación, en 5 sujetos entrenados. La
tasa de aparición de los A GL (Ta) y del glicerol (Ta) aumentó durante el
ejercicio (P< 0.02), con excepción del ejercicio a alta intensidad, que no
reveló cambios en la Ta de AGL. Durante la recuperación del ejercicio a alta
intensidad, hubo un incremento transitorio del 60 % en la Ta de AGL (P< 0.01),
mientras que la Ta del glicerol disminuyó.
Glicerol. La Ta de glicerol aumentó significativamente por sobre los valores de reposo, durante los ejercicios a las tres intensidades (P< 0.05; Fig. 6). Luego de 30 min. de ejercicio, la Ta de glicerol fue significativamente mayor durante las intensidades al 65 y al 85 % del VOmáx., en comparación con el ejercicio de baja intensidad. Durante la recuperación, hubo una disminución inmediata en la Ta de glicerol. Esto también ocurrió durante la recuperación, luego del ejercicio de alta intensidad, indicando que el aumento transitorio de la Ta de AGL inmediatamente después del ejercicio, no era explicado por un incremento en la lipólisis (Figura 6). Hubo un aumento transitorio y significativo en el cociente Ta AGL/Ta glicerol, desde el final del ejercicio hasta la primer fase de la recuperación (al 25 % VO2máx.: de 2.3 ± 0.1 a las 2 hs. de ejercicio a 4.2 ± 0.5 en la recuperación; al 65 % VO2máx.: de 2.3 ± 0.2 a las 2 hs. de ejercicio a 5.1 ± 0.6 en la recuperación; al 85 % VO2máx.: de 1.3 t 0.2 a los 30 min. de ejercicio a 5.0 ± 1.4 en la recuperación). La respuesta lipolítica periférica, luego de 30 min. de ejercicio, no fue significativamente diferente en las tres intensidades (Tabla 1). Por el contrario, la lipólisis intramuscular alimentó en forma significativa al 65 y al 85 %, en comparación al 25 % del VO2máx. Esto concordó con una disminución significativa en el cociente Ta AGL/Ta glicerol de 2.4 ± 0.1(al 25 % VO2máx) y de 1.7 ± 0.1 (al 65 % VO2máx), hasta 1.3 ± 0.3 (a185 % VO2máx; P< 0.05), ya que se puede asumir que los AGL derivados de los triglicéridos musculares son oxidados sin haber pasado por el plasma.
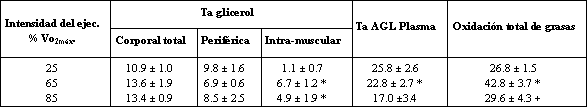
Tabla 1. Efecto de la
intensidad del ejercicio sobre el metabolismo de las grasas, medido luego de 30
minutos de ejercicio, en cinco atletas entrenados en resistencia.
Los valores representan las medias ± DS en umol.kg-1.min-1. Ta = tasa de
aparición.
(*) P < 0.05 vs. Ejercicio al 25 % del máximo consumo de oxígeno (VO2máx.)
(+) P < 0.05 vs. Ejercicio al 65 % del VO2máx.
Tasas de oxidación de sustratos
De los 20 a los 30 min. de ejercicio, los volúmenes inspiratorios, VO2, VCO2, y cocientes de intercambio respiratorio fueron constantes en los tres protocolos de ejercicio. Los cocientes respiratorios fueron significativamente diferentes entre sí: 0.73 ± 0.01 vs. 0.83 ± 0.02 vs. 0.91 ± 0.01 (al 25 %, al 65%, y al 85 % del VO2máx., respectivamente; P< 0.02).
Las tasas de oxidación de carbohidratos calculadas durante 20-30 min. de ejercicio a125, 65, y 85 % del VO2máx. aumentaron significativamente con la intensidad de ejercicio (Figura 7). Los valores de la oxidación total de carbohidratos al 65 y 85 % del VO2máx. fueron significativamente mayores que la tasa de consumo de glucosa por el tejido (la máxima cantidad de glucosa plasmática disponible para la oxidación). Esta diferencia refleja la contribución mínima del glucógeno muscular a la oxidación de carbohidratos, el que también aumentó significativamente con el incremento de la intensidad del ejercicio (Figura 7).
Las tasas de oxidación de las grasas estuvieron relacionadas en forma diferente al ejercicio que las tasas de oxidación de carbohidratos (Figura 7). La oxidación de grasas, luego de 30 min. de ejercicio, no fue diferente a1 25 y al 85 % del VO2máx., a pesar de un incremento mayor en tres veces mayor en el gasto energético. Al 65 % del VO2máx., la tasa de oxidación de grasas fue significativamente mayor que la observada durante ejercicios al 25 y al 85 % del VO2máx. (Figura 7). Durante los ejercicios a1 65 y a185 % del VO2máx., la oxidación de grasas de todo el organismo fue significativamente mayor que el consumo de AGL; la diferencia representa la mínima contribución de las reservas musculares de triglicéridos a la oxidación de grasas de todo el cuerpo (Figura 7).
La Figura 8 muestra las máximas contribuciones de la glucosa y los AGL plasmáticos, y las contribuciones mínimas de las reservas de triglicéridos y el glucógeno muscular al gasto energético, luego de 30 min. de ejercicio al 25, 65, y 85 % del VO2máx. El incremento en los equivalentes calóricos por el consumo de glucosa en los tejidos, ante el aumento de las intensidades, es en gran medida, contrabalanceado por la relativa disminución en el consumo de AGL plasmático. En consecuencia, la contribución de sustratos plasmáticos a la producción energética total permaneció esencialmente constante ante los distintos niveles de ejercicio, significando que, a mayores intensidades, las reservas musculares de los sustratos (particularmente glucógeno) se vuelven predominantes (Figura 8).
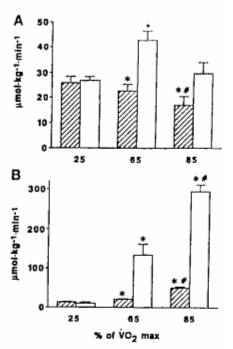
Figura 7. A: Consumo
de AGL (barras con líneas) y oxidación de ácidos grasos en todo el organismo
(barras blancas), medidos luego de 30 minutos de ejercicio a 3 intensidades
diferentes, en 5 atletas (medias ± DS). (*) P< 0.05 vs. 25 % VO2máx.;
(#) P< 0.05 vs. 65 % VO2máx.; (+) P< 0.05 vs. 25 y 85 % VO2máx.
B: Consumo de glucosa (barras con líneas) y oxidación de carbohidratos en todo
el organismo (barras blancas), medidos luego de 30 minutos de ejercicio a 3
intensidades diferentes, en 5 atletas (medias ± DS).(*) P< 0.05 vs. 25 % VO2máx.;
(#) P< 0.05 vs. 65 % VO2máx.
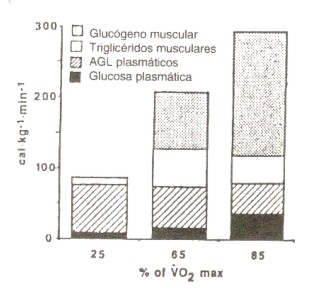
Figura 8.
Contribución máxima al gasto energético derivada de la glucosa y los AGL (FFA)
extraídas de la sangre, y contribución mínima de las reservas musculares de
triglicéridos y glucógeno musculares, luego de 30 min. de ejercicio, expresadas
en función de la intensidad del ejercicio. La cantidad total de calorías (cal)
disponibles del plasma no cambia en relación a la intensidad del ejercicio.
Se evaluó el efecto de la duración del ejercicio sobre las respuestas metabólicas durante los ejercicios al 25 y al 65 % del VO2máx. Al 25 % del VO2máx., no hubo una alteración significativa en la contribución relativa de los distintos sustratos a la producción de energía, durante el período de 2 h de ejercicio (Figura 9). Por el contrario, durante la actividad al 65. % del VO2máx., hubo un aumento progresivo en la dependencia de glucosa y AGL plasmáticos como sustratos energéticos. En consecuencia, disminuyó la contribución de las reservas musculares de sustratos a la producción de energía (Figura 9).
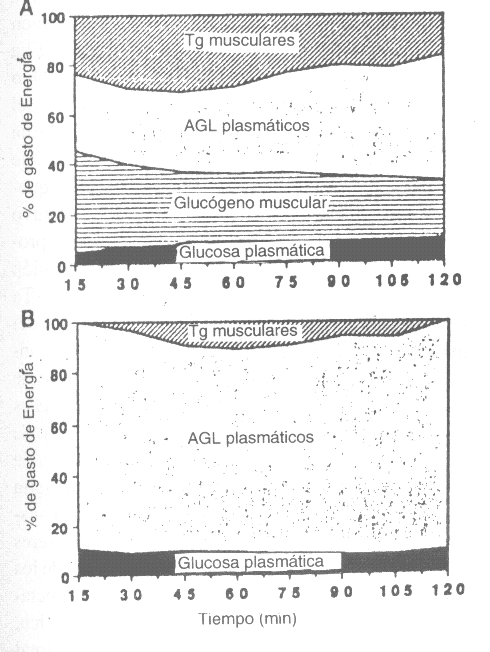
Figura 9.
Contribución relativa de los sustratos sanguíneos e intramusculares a la
producción de energía, durante 120 min. de ejercicio al 25 % del VO2máx.
(B), y al 65 % (A) del VO2máx. Tg: triglicéridos.
Concentraciones plasmáticas de catecolaminas
Luego de 30 min. de ejercicios a baja intensidad, hubo un leve pero significativo aumento en las concentraciones plasmáticas de epinefrina y norepinefrina (Tabla 2). Las concentraciones plasmáticas de catecolaminas se incrementaron en relación a la intensidad del ejercicio. Luego de 60 min. de recuperación, los valores no fueron significativamente diferentes de los valores pre-ejercicio.
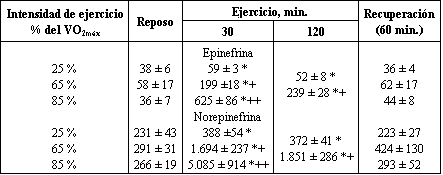
Tabla 2.
Concentraciones plasmáticas de catecolaminas en reposo, durante el ejercicio, y
luego de 60 min. de recuperación. Los valores representan las medias ± DS en mg/l.
(*) P < 0.05 vs. Reposo (+) P < 0.05 vs. Ejercicio al 25 % del VO2máx
(++) P < 0.01 vs. Ejercicio al 25 y 65 % del VO2máx.
DISCUSION
A pesar de que numerosos estudios han investigado la movilización y utilización de carbohidratos a diferentes intensidades de ejercicio, se dispone de pocos datos cuantitativos con respecto a la cinética de los lípidos. En este estudio, utilizamos un método de trazador isotópico para cuantificar los aspectos de la cinética de los lípidos no estudiada previamente en ejercicio, incluyendo la distinción entre la lipólisis que ocurre en los adipocitos (lipólisis periférica) y la lipólisis intramuscular. La lipólisis periférica fue elevada durante el ejercicio de baja intensidad y no se incrementó más con ejercicios más intensos. Sin embargo, se produjo poca lipólisis de triglicéridos musculares durante ejercicios de baja intensidad (25 % del VO2máx ), en comparación con la actividad a mayores intensidades. A pesar de las altas tasas lipolíticas, la Ta de AGL plasmáticos, y presumiblemente la de oxidación, fue mayor durante el ejercicio al 25 % del VO2máx.; TA de AGL disminuyó progresivamente a medida que la intensidad aumentaba al 65 y 85 % del VO2máx. La declinación progresiva en el intercambio («turnover») de AGL plasmáticos con el incremento de la intensidad, fue balanceada por progresivos aumentos en el «turnover» de glucosa sanguínea. Por lo tanto, la contribución de sustratos plasmáticos al gasto calórico permaneció esencialmente constante, a través de este amplio rango de intensidades. Los cambios en el metabolismo lípido ocurrieron concurrentemente con los cambios en el metabolismo de los carbohidratos, consistente con lo que habría sido predicho por trabajos previos, es decir que el consumo de glucosa por el tejido, y especialmente la utilización de glucógeno muscular se incrementaban exponencialmente en relación a la intensidad del ejercicio.
Evaluación de los métodos
El uso de trazadores de isótopos estables para la cuantificación del «turnover»
de glucosa y palmitato está bien fundamentado (35). Las tasas de oxidación de
grasas y carbohidratos en todo el organismo fueron calculadas por calorimetría
indirecta. Este método se basa en la presunción que el VO2 y VCO2
reflejan con exactitud el consumo de O2 y la producción de CO2
(14). Existe poca controversia con respecto al VO2, del cual no hay
grandes reservas en el organismo. Sin embargo, a intensidades de ejercicio que
causan hiperventilación, el VCO2 podría sobreestimar la producción de
CO2 (13). Potencialmente, ésto podría resultar en la sobreestimación
de la tasa de oxidación de carbohidratos y, en forma concomitante, en la
subestimación de la oxidación de grasas (13). Por lo tanto, antes de esta
investigación, nosotros realizamos un estudio preliminar que desarrollaba un
nuevo método de cociente de respiración 13C/12C para el
cálculo de la oxidación de carbohidratos y grasas durante ejercicios desde bajas
a altas intensidades, que es completamente independiente de la medición de VCO2
(26). Este nuevo método probó como válida la oxidación de grasas y carbohidratos
calculada por calorimetría indirecta durante el ejercicio, incluyendo
actividades a1 85 % del VO2máx. en sujetos entrenados, como se
realizó en el presente estudio.
Se asume que las tasas de oxidación de grasas y carbohidratos que exceden a los consumos medidos de glucosa sanguínea y AGL plasmáticos, son iguales a la oxidación de triglicéridos y glucógeno intramusculares, respectivamente. No hay una razón para pensar que existen otros destinos principales más que la oxidación, para la glucosa y AGL consumidos por los tejidos durante el ejercicio (6,17). La máxima tasa de oxidación de AGL por lipólisis periférica puede, por lo tanto, considerarse igual al consumo de AGL plasmático. La diferencia entre esa tasa y la oxidación total de grasas, puede atribuirse en gran medida, a la oxidación de grasa intramuscular, a pesar de que es posible que los triglicéridos plasmáticos contribuyan con una pequeña cantidad a la oxidación total de grasas.
La validación general de este método para cuantificar la tasa de oxidación intramuscular de triglicéridos está apoyada por el hecho de que un enfoque análogo con el metabolismo de la glucosa arribó a tasas de ruptura del glucógeno muscular, comparables a las derivadas de estudios que utilizaron datos obtenidos por biopsias (19). Una ventaja de los métodos utilizados en este trabajo es que no son necesarias las biopsias musculares, y que el valor calculado de la tasa de ruptura del glucógeno representa la respuesta promedio de la musculatura del cuerpo. La tasa de lipólisis de todo el cuerpo fue calculada midiendo la Ta de glicerol. El glicerol aparece en la sangre só1o como el producto de la lipólisis y puede ser reutilizado só1o en los tejidos que contienen glicerol-kinasa, predominantemente el hígado. En los animales, la actividad de la glicerol-kinasa en tejidos extrahepáticos está ausente o es muy baja (9, 24). Sin embargo, hasta el momento no existen datos que reflejen si hay suficiente glicerol-kinasa en el músculo para permitir una tasa fisiológicamente significativa de oxidación de glicerol. El estudio reciente de Elia y cols. (10) aumenta la posibilidad de que el glicerol liberado por la lipólisis intramuscular pudiera ser directamente oxidado, resultando por lo tanto, en una subestimación de la lipólisis total por nuestra técnica de trazado. Elia y cols. (10) observaron un significativo intercambio isotópico de glicerol a través del tejido muscular del antebrazo. Sin embargo, a partir de los datos de Elia y cols. (10), aun permanece confuso si este hecho fue só1o debido al lento equilibrio del glicerol enriquecido con el «pool» muscular de glicerol, o si estuvo relacionado con la concomitante utilización y producción de glicerol muscular. Los datos de oxidación de grasas en nuestro estudio, apoyan la idea que la Ta de glicerol es un reflejo preciso de la lipólisis total del cuerpo. Durante el ejercicio al 65 % del VO2máx., intensidad a la cual se observaron las mayores tasas de oxidación de grasas, la tasa Ta de glicerol (3 veces mayor), reflejando la máxima disponibilidad de AGL derivados de la lipólisis, y las tasas de oxidación de ácidos grasos, estuvieron de acuerdo. Si fuera cierta la presunción de la presencia de una actividad sustancial de la glicerol-kinasa en el músculo de los seres humanos, el glicerol derivado por la hidrólisis de los triglicéridos musculares habría sido oxidado directamente sin pasar a través del «pool» plasmático, provocando por lo tanto, que la lipólisis corporal total sea consistentemente menor que las tasas de oxidación de AGL. A partir de estas consideraciones, concluimos que la Ta de glicerol es un reflejo confiable de la tasa de lipólisis dentro del tejido adiposo y/o músculo en ejercicio. Los valores reportados previamente de la Ta de glicerol en seres humanos en ejercicio (16), usaron tritio como trazador, el que presentó un serio problema debido a la inadecuada separación de la glucosa en el procedimiento analítico, generando por lo tanto, una gran subestimación del valor real de la Ta de glicerol. El uso de GC-MS en el presente estudio permite una separación confiable y distintiva, así como una identificación y cuantificación del enriquecimiento del glicerol [2H5] (35).
Ejercicio de baja intensidad (25 % del VO2máx.). Los resultados por nuestra técnica indican que el glucógeno y los triglicéridos intramusculares no contribuyen significativamente a la producción de energía durante ejercicios al 25 % del VO2máx. (Figuras 8 y 9). La oxidación de carbohidratos pareció ser cubierta solamente por el consumo de glucosa sanguínea y, por lo tanto, el glucógeno muscular no fue utilizado (Figura 8). Esta conclusión es consistente con la medición (a través de biopsia) de los cambios en la concentración de glucógeno dentro de un músculo en ejercicio, a bajas intensidades (29). Además, la medición de la diferencia arteriovenosa a través de un miembro en ejercicio, durante una actividad a baja intensidad, indica que el consumo de glucosa se aproxima por lo general a la tasa de oxidación de carbohidratos, considerando el error introducido cuando se intenta medir pequeñas diferencias arteriovenosas, así como el flujo sanguíneo en el miembro (5). Por lo tanto, nuestra técnica para evaluar la contribución calórica de la glucosa sanguínea en oposición al glucógeno muscular, brinda resultados razonables.
Ejercicio de intensidad moderada (65 % del VO2máx.). En estos sujetos, el ejercicio al 65 % del VO2máx. Provocó tasas máximas de oxidación grasa de > 42 umol.kg-1.min.-1 Esta alta tasa de oxidación de grasas es comparable a tres veces la Ta de glicerol en todo el organismo (ej., 13.6 umol de glicerol. Kg-1 .min.-1 x 3 umol AGL/umol glicerol = 40.8 umol AGL.kg-1.min.-1), observada luego de 30 min. de ejercicio. Esta relación cercana entre la mayor disponibilidad posible de AGL (ej., 3 x Ta glicerol) y la oxidación total de grasas, podría indicar que la lipólisis total del cuerpo y, por ende, la disponibilidad de AGL limita la oxidación de AGL, luego de 30 min. de ejercicio al 65 % del VO2máx. Después de 120 min. de ejercicio al 65 % del VO2máx., aumentó la Ta de glicerol, indicando que la disponibilidad total de ácidos grasos por lipólisis (50 umol.kg-1.min.-1) fue mayor que la tasa de oxidación de grasas. Sin embargo, bajo la mayoría de las condiciones (además del ejercicio), los AG son disponibles para la oxidación a una tasa 2 a 3 veces mayor que la tasa de oxidación; por lo cual, aun cuando la disponibilidad de AGL exceda la oxidación en forma numérica, la disponibilidad podría aun estar restringida, quizás por limitaciones en el transporte a la mitocondria (34).
La lipólisis en los adipocitos periféricos y de reservas intramusculares contribuyeron de igual manera a la oxidación de las grasas durante el ejercicio al 65 % del VO2máx (Tabla 1, Figura 8). Los estudios anteriores sobre el metabolismo de las grasas durante el ejercicio, razonaban que los triglicéridos intramusculares debían contribuir a la oxidación de grasa durante un ejercicio moderado, basados en la observación que el consumo de AGL plasmáticos por el miembro en ejercicio era menor que la tasa medida de oxidación grasa (17). Este concepto general fue luego apoyado por la observación de que la concentración de triglicéridos musculares (medida con biopsias) disminuía durante ejercicios prolongados de intensidad moderada (55-75 % del VO2máx.). Sobre la base de presunciones con respecto a la cantidad de masa muscular reclutada, se estimó que los triglicéridos musculares eran responsables de un porcentaje considerable de grasa oxidada durante ejercicios moderados (12, 19). Sin embargo, ningún estudio intentó cuantificar en forma sistemática los triglicéridos musculares usados durante ejercicios a distintas intensidades, probablemente debido a la dificultad técnica para medir los triglicéridos musculares en pequeñas muestras de biopsias, así como el reconocimiento del hecho que varios músculos difieren marcadamente en el uso de triglicéridos (25, 32), dificultando la extrapolación de las tasas de oxidación de la muestra a todo el cuerpo. Sin embargo, nuestro método reportado en este estudio para la cuantificación del uso de triglicéridos intramusculares, está basado en mediciones de todo el cuerpo y no sufre estas limitaciones, a pesar de que se debe reconocer que nuestros cálculos representan la tasa mínima de uso de triglicéridos, ya que se asume que todos los AGL plasmáticos tornados del plasma son oxidados.
Ejercicio de alta intensidad (85 % del VO2máx). La concentración plasmática de AGL fue mucho menor durante el ejercicio al 85 % del VO2máx. que a menores intensidades, debido a una marcada reducción en la Ta AGL en el plasma (Tabla 1, Figura 6). La disminución en la Ta de AGL no se debió principalmente a una inhibición de lipólisis de todo el organismo o de la lipólisis periférica, ya que se mantuvo la Ta de glicerol. Jones y cols. (21) han reportado previamente que la liberación de AGL (específicamente palmitato) en el plasma disminuye en sujetos desentrenados durante un ejercicio de alta intensidad, pero no cuantificaron la lipólisis; por lo tanto, no fue clara la razón de la disminución en la liberación de AGL. En nuestro estudio, la concentración de AGL plasmáticos aumentó dramáticamente durante los minutos inmediatamente posteriores al ejercicio de alta intensidad, debido a un incremento en la Ta de AGL, a pesar de una reducción simultánea en la lipólisis, como se reflejó por la Ta de glicerol. Esta relación se explica probablemente, por un atrapamiento de AGL dentro del tejido adiposo durante el ejercicio, con una liberación después del mismo (18). Debido a que los AGL son hidrófobos, ellos só1o pueden ser transportados en la sangre unidos a la albúmina, que tiene una capacidad limitada de transportar AGL (31). Una reducción en el flujo sanguíneo del tejido adiposo podría resultar en una disminución en la liberación de AGL por el mencionado tejido. Por el contrario, el glicerol es soluble en agua; por lo tanto, su aparición en el plasma no depende del flujo sanguíneo. Hay algunos datos que muestran que el flujo sanguíneo al tejido adiposo, así como a la piel, disminuye a medida que aumenta la intensidad del ejercicio, especialmente cuando este se acerca a1 80-90 % del VO2máx. (1,30), y las catecolaminas plasmáticas aumentan en forma exponencial (22, Tabla2). Por lo tanto, el atrapamiento de AGL durante ejercicios de alta intensidad podría ser resultante de la inhibición alfa-andrenérgica del flujo sanguíneo del tejido adiposo o altos cocientes AGL/albúmina en el tejido adiposo (2). Esto podría ser un ejemplo de la jerarquía entre las diferentes funciones fisiológicas (metabolismo de las grasas vs. circulación) moduladas por un regulador común (catecolaminas). A pesar de que esta respuesta no es ventajosa en términos de disponibilidad de ácidos grasos, brinda un mayor transporte de oxigeno al músculo activo. Durante una actividad intensa, la disponibilidad de oxígeno es más probable que sea un factor limitante determinante de la función muscular que la disponibilidad de ácidos grasos, ya que la ruptura de glucógeno muscular puede brindar adecuados sustratos energéticos durante un corto período. La oxidación de grasas disminuye a medida que la intensidad del ejercicio aumenta del 65 al 85 % del VO2máx. junto con la declinación de la aparición de AGL en el plasma y la concentración plasmática de AGL. Gran porcentaje de esta disminución en la oxidación de grasas se debe, probablemente, a los efectos del ejercicio de alta intensidad sobre la estimulación de la glucogenólisis muscular y consumo de glucosa (Figura 8). Sin embargo, es posible que parte de la reducción en la oxidación grasa durante ejercicios intensos se deba a una disponibilidad sub-óptima de AGL plasmáticos. Hay algunos datos que indican que durante el ejercicio, que sea lo suficientemente intenso como para provocar una baja concentración de AGL plasmáticos, los suplementos exógenos de AGL durante el ejercicio producen un aumento en la oxidación grasa (8).
Patrón general de disponibilidad y oxidación de sustratos durante ejercicios de intensidad progresiva. Un importante hallazgo en este estudio es que la lipólisis en el tejido adiposo periférico parece estar estimulada al máximo durante el ejercicio de baja intensidad, pero no aumenta cuando la intensidad se incrementa y cuando las catecolaminas plasmáticas aumentan dramáticamente (Tablas 1 y 2). Esto sugiere que la lipólisis en el tejido adiposo periférico, al menos en sujetos entrenados en resistencia, es sensible a los pequeños incrementos en catecolaminas plasmáticas durante ejercicios de baja intensidad. Sin embargo, la lipólisis de triglicéridos intramusculares parece estar regulada en forma diferente, en cuando la misma no es estimulada durante actividades suaves. No obstante, con ejercicios al 65 % del VO2máx se estimula la lipólisis de los triglicéridos musculares, aunque no parece aumentar cuando la intensidad alcanza a 85 % del VO2máx. Esto podría reflejar que el mayor umbral para la estimulación de catecolaminas esta cerca de la máxima dosis efectiva de catecolaminas.
En este estudio, la disminución de la Ta de AGL con el incremento de la intensidad fue contra balanceada por los aumentos en la Ta de glucosa. Debido a que la glucosa y AGL captados por los músculos durante el ejercicio son oxidados casi completamente (6,17), esto indica un desplazamiento progresivo desde la oxidación de AGL plasmáticos a la oxidación de glucosa sanguínea con el aumento en la intensidad del ejercicio. A pesar de que es bien sabido que el consumo y oxidación de glucosa sanguínea aumentan con la intensidad (5), no ha sido generalmente reconocido que el consumo y presumiblemente oxidación de AGL plasmáticos disminuyan recíprocamente, por lo que la contribución combinada de estos sustratos plasmáticos al gasto energético total permanece constante, a través del amplio rango de intensidades (25-85 % del VO2máx.; ver Figura 8).
Efecto de la duración del ejercicio sobre la respuesta metabólica.
El objetivo original del estudio era evaluar los efectos tanto de la intensidad como duración del ejercicio sobre la respuesta metabólica. Sin embargo, esto no fue posible al 85 % del VO2máx., ya que este nivel de intensidad só1o pudo ser mantenido durante 30 min., y se necesitaban 20 min., de ejercicio para alcanzar un buen «steady-state isotópico» en todos los factores. Por lo tanto, só1o se pudo evaluar la respuesta sobre el tiempo a 125 % y 65 % del VO2máx., Al 25 % del VO2máx., pareció existir un «steady-state fisiológico», ya que no hubo cambios significativos desde los 30 min., a las 2 h en la disponibilidad y oxidación de sustratos. Por el contrario, al 65 % del VO2máx. hubo un aumento progresivo de la disponibilidad de glucosa y AGL plasmáticos con el desarrollo del tiempo. Debido a que las tasas de oxidación total de grasas y carbohidratos no cambiaron con el tiempo, se puede asumir que hubo una disminución progresiva en la dependencia de triglicéridos intramusculares y glucógeno muscular como sustratos energéticos. Hay datos que sugieren que la contribución del glucógeno muscular a la producción de energía disminuye con el tiempo durante ejercicios de intensidad moderada a alta (7). Sin embargo, no existe información previa en seres humanos, sobre la tasa de utilización de triglicéridos musculares durante el ejercicio. Nosotros presumimos que la estimulación progresiva de la lipólisis periférica, es la que provocó un aumento en la concentración y consumo de AGL plasmáticos por las células musculares, y la que minimizó el uso de triglicéridos musculares, en vez de lo contrario, y por varias razones. Lo más importante, es que no existe un mecanismo conocido por el cual la concentración de triglicéridos musculares o ácidos grasos pueda regular la lipólisis periférica. Además, la concentración de AGL plasmáticos aumentó con el tiempo, o sea que no hubo una señal de «feedback» (retroalimentación negativa) de sustrato al tejido adiposo que indicara que la disponibilidad de ácidos grasos intramusculares por la hidrólisis local de triglicéridos estuviera disminuyendo. Estos resultados apoyan la idea de que la ruptura de trigliéridos intramusculares se produce para compensar la respuesta tardía de liberación de AGL, al comienzo de un ejercicio moderado. En contraste a la situación durante actividades al 65 % del VO2máx. durante el esfuerzo al 25 % del VO2máx. la disponibilidad de ácidos grasos derivados del plasma, aparentemente fue adecuada para cubrir los requerimientos de sustratos para esa intensidad. Por lo tanto, se produjo un nivel mínimo de ruptura de triglicéridos musculares, a pesar de la sistémica estimulación de la lipólisis reflejada por la alta Ta de glicerol. Esto implica diferentes mecanismos de regulación de la lipólisis periférica y muscular, pero, hasta este punto, no tenemos una precisión de los factores específicos que regulan la lipólisis intramuscular.
En resumen, la lipólisis en los adipocitos periféricos parece ser elevada durante ejercicios de baja intensidad (25 % del VO2máx. y no aumenta con el incremento de la intensidad, a pesar de grandes aumentos en las catecolaminas circulantes. Por el contrario, se produce poca lipólisis intramuscular durante ejercicios de baja intensidad, en comparación con ejercicios de intensidades moderadas y altas. A pesar de las altas tasas lipolíticas en el tejido adiposo periférico, la tasa de liberación de AGL en el plasma disminuye progresivamente con el aumento en la intensidad de ejercicio, hasta un punto en el cual la concentración de AGL plasmáticos durante una actividad al 85 % del VO2máx. es marcadamente suprimida. Es posible que esta reducción en la disponibilidad de AGL plasmáticos pudiera contribuir en parte, a la disminución en la oxidación de grasas observada cuando la intensidad del ejercicio aumenta del 65 a 85 % del VO2máx. Finalmente, esta progresiva disminución en el «turnover» de AGL plasmáticos con el aumento en la intensidad del ejercicio, parecería estar compensada por el aumento progresivo en el «turnover» de glucosa sanguínea; por lo tanto, la contribución de sustratos plasmáticos al gasto calórico permanece notoriamente constante en este amplio rango de intensidades (25-85 % del VO2máx..)
Este trabajo ha sido apoyado por Becas de los Institutos Nacionales de Salud DK-378717 y GCRC-00073. J.A. Romijn fue apoyado con una beca de la Organización Holandesa para la Investigación Cientf fica. L.S. Sidossis fue un becario de la Fundación «Alejandro S. Onassis».
Referencias
1. Armstrong, R.B., M.D. Delph, E.F. Goljan, and M.H. Laughlin (1987). Distribution of blood flow in muscles of miniature swine during exercise. J. Appl. Physiol. 62: 1285-1298
2. Bulow,J.,J.Madsen,A.Astrup,andN.J.Christensen (1985). Vasoconstrictor effect of high FFA/albumin ratios in adipose tissue in vivo. Acta Physiol. Scand. 125: 661-667
3. Carraro, F., C.A. Stuart, W.H. Hartl, J. Rosenblatt, and R.R. Wolfe (1990). Effect of exercise and recovery on muscle protein synthesis in human subjects. Am J. Physiol. 259 (Endocrinol. Metab. 22): E470-476
4. Clutter, W.E., D.M. Bier, S.D. Shah, and P.E. Cryer (1980). Epinephrine plasma metabolic clearance rates and physiologic thresholds for metabolic and hemodynamic action in man. J. Clin. Invest. 66: 94101
5. Coggan,A.R (1991). Plasma glucose metabolism during exercise inhumans. Sports Medicine 11: 102-124
6. Coggan,A.R.,W.M.Kohn,R.J.Spina,D.M.Bier, and J.O.Holloszy (1990). Endurance training decerases plasma glucose turnover and oxidation during moderate exercise in men. J. Appl. Physiol. 68: 990-996
7. Coyle, E.F., A.R. Coggan, M.E. Hemmert, and J.L. Ivy (1986). Muscle glycogen utilization during prolonged strenous exercise when fed carbohydrate. J. Appl. Physiol. 61: 165-172
8. Costill, D.L., E.F. Coyle, G. Dalsky, W. Evans, W. Fink, and D. Hoopes (1977). Effect of elevated plasma FFA and insulin on muscle glycogen usage during exercise. J. Appl. Physiol. 43: 695-699
9. Dixon, M., nd E.L. Webb (1979). Enzymes. New York Academic, p. 842-843
10. Elia, M., K. Khan, G. Galder, and A. Kurpad (1993). Glycerol exchange accross the human forearm assessed by a combination of tracer and arteriovenous exchange techniques. Cli. Sci. Lond. 84: 99-104
11. Endert, D (1979). Determination of noradrenaline and adrenaline in plasma by radioenzymatic assay using high pressure liquid chromatography for the radio chernical products. Clin.Chem. Acta 96:233-239
12. Essen, B (1977). Intramuscular substrate utilization during prolonged exercise. Ann. NY Acad. Sci. 301: 30-44
13. Ferrarini, E (1988). The theoretical bases of indirect calorimeytry: a review. Metab. Clin. Exp. 37: 287-301
14. Frayn, K.N (1983). Calculation of substrate oxidation rates in vivo from gaseous exchange. J. Appl. Physiol. 55: 628-634
15. Hagenfeldt, L., and J. Wahren (1975). Turnover of free fatty acids during recovery from exercise. J. Appl. Physiol. 39: 247-250
16. Havel, R.J (1965). Some influences of the sympatetic nervous system and insulin on mobilization of fat from adipose tissue: studies on the turnover rates of free fatty acids and glycerol. Ann. NY Acad. Sci. 131:91-101
17. Havel, R.J., B. Pernow, and N.L. Jones (1967). Uptake and release of free fatty acidsand other metabolites in the legs of exercising men. J. Appl. Physiol. 23: 90-99
18. Hodgetts, V., S.W. Coppack, K.N. Frayn, and D.R. Hockaday (1991). Factors controlling fat mobilization from human subcutaneous adipose tissue during exercise. J. Appl. Physiol. 71: 445-451
19. Hurley, B.F., P.M. Nemeth, W.H. Marti 111, J.M. Hagberg, G.P. Dalsky, and John Holloszy (1986). Muscle trygliceride utilization during exercise. J. Appl. Physiol. 60: 562-567
20. Jansson, E. and L. Kaijser (1987). Substrate utilization and enzymes in skeletal muscle ofextremely endurance-trained men. J. Appl. Physiol. 62: 999-1005
21. Jones N.L., G.J.F. Heigenhauser, A. Kuskis, C.G. Matsos, J.R. Sutton, and C.J.Toews (1980). Fatmetabolism in heavy exercise. Cli.Sci. Lond. 59: 469-478
22. Mazzeo R.S (1991). Catecholaminesresponses toacute andchronic exercise. Med.Sci. Sports Exercise 23: 839-845
23. McGuire, E.A.H., J.H. Helderman, J.D. Tobin, R. Andres, and M. Berman (1976). Effects of arterial vs. venous sampling on analysis of glucose kinetics in man. J. Appl. Physiol. 41: 565-573
24. Newsholme, E.A., and K. Taylor (1969). Glycerol kinase activities in muscles from vertebratea and invertebrates. Biochem. J. 112: 465 474
25. Reitman, J., K.M. Baldwin, and J.O. Holloszy (1973). Intramuscular triglyceride utilization by red, white, and intermediate skeletal muscle and heart during exhausting exercise. Proc. Soc. Exp. Biol. Med. 142:628-631
26. Rominj, J.A., E.F. Coyle, J. Hibbert, and R.R. Wolfe (1992). Comparison of indirect calorimetry and a new breath 13C/12Cratio method during strenous exercise. Am. J. Physiol. 263 (Endocrin. Metab. 26): E64 E71
27. Rominj, J.A., and R.R. Wolfe (1992). Effects of prolonged exercise on endogenous substrate supply and utilization. Presp. Exerc. Sci. Sports Med. 5: 207-234
28. Rosell, S (1966). Release of free fatty acids from subcutaneous adipose tissue in dogs following sympathetic nerve stimulation. Acta Physiol. Scand.67: 343-351
29. Saltin, B., and J. Karlsson (1971). Muscle glycogen utilization during work of different intensities. In: Muscle Metabolism during exercise, edited by B. Pernow and B. Saltin. Mew York: Plenum, p. 289299
30. Smolander, J., J. Saalo, and O. Korhonen (1991). Effect of work load on cutaneous vascualr response to exercise. J. Appl. Physiol. 71: 1614 - 1619
31. Spector, A.A (1975). Fatty acid binnding to plasma albumin. J. Lipid Res. 16: 165-179
32. Spriet, L.L, G.J.F. Heigenhauser, and N.L. Jones (1986). Endogenous triglyceride utilization by rat skeletal muscle during tetanic stimulation. J. Appl. Physiol. 60: 410-415
33. Steele, R (1959). Influences of glucose loading and of injected insuline on hepatic glucose output. Ann. NY Acad. Sci. 82: 420-430
34. Winder W.W., J. Arogyasami, R.J. Barton, I.M. Elayan, and P.R. Vehrs (1989). Muscle malonyl-COA decreases during exercise. J. Appl. Physiol. 67: 2230-2233
35. Wolfe, R.R (1992). Radioactive and stable isotope tracers in biomedicine. Principles and Practice of Kinetic Analysis. New York: Wiley-Liss
36. Wolfe, R.R., J.E. Evans, C.J. Mullany, and J.F. Burke (1980). Measurement of plasma free fatty acid turnover and oxidation using 1 -13 C palmitic acid. Biomed.Mass. Spectrom. 7: 168-171
37. Wolfe, R. R., S. Klein, F. Carraro, and J. M. Weber (1990). Roleoftrygliceridefatty acid cycle in controlling fat metabolism in humans during and after exercise. Am. J. Physiol. 258 (Endocrinol. Metab. 21): E382 E389
38. Wolfe, R.R., and E.J. Peters (1987). Lipolytic response to glucose infusion in human subjects. Am. J. Physiol. 252 (Endocrinol. Metab. 15): 13189-13196
39. Wolfe, R.R., E.J. Peters, S. Klein, O.B. Holland, J. Rossenblat, and H. Gary (1987). Effect of short-term fasting on Lipolytic responsiveness in normal and obese human subjects. Am. J. Physiol. 252 (Endocrinol. Metab.15):E189-13196