Respuesta Aguda Cardio-Respiratoria y Cerebrovascular al Ejercicio de Fuerza
The Acute Cardiorespiratory and Cerebrovascular Response to Resistance Exercise
Blake G. Perry1 y Samuel J. E. Lucas2
School of Health Sciences, Massey University, Wellington, New Zealand
Artículo publicado en el journal Revista de Entrenamiento Deportivo, Volumen 1, Número 3 del año 2021.
Publicado 14 de julio de 2021
Resumen
Palabras clave: ejercicio, fuerza, respuesta aguda, cardio-respiratoria, cerebrovascular
Abstract
Keywords: exercise, strength, acute response, cardiorespiratory, cerebrovascular
INTRODUCCIÓN
El ejercicio de fuerza (EF) produce muchos resultados fisiológicos favorables que incluyen aumento de la fuerza muscular, metabolismo y alteraciones en la masa corporal magra [1]. Recientemente, el EF ha ganado popularidad y se considera una parte integral de la salud y el bienestar general, contrarrestando la disminución de la masa muscular relacionada con la edad [2] y se recomienda en combinación con el ejercicio aeróbico regular para mantener la función física durante el envejecimiento [3]. Además, el EF parece neuroprotector, con aumentos transitorios del factor neutrófico derivado del cerebro, un biomarcador clave relacionado con la neurogénesis y la supervivencia neuronal [4], reportado inmediatamente después de la interrupción del ejercicio [5, 6]. Más recientemente, el EF se recomienda como tratamiento para cohortes clínicas, incluida la diabetes mellitus tipo II [7, 8], el accidente cerebrovascular [9] y las enfermedades cardíacas [10, 11]. Aunque es poco común, la hipertensión aguda extrema experimentada durante el EF, tiene el potencial de producir una lesión cerebrovascular [12, 13] con la actividad física intensa y la maniobra de Valsalva (VM) identificada como desencadenante independiente de una rotura del aneurisma intracraneal [14]. Más común es el riesgo de síncope inmediatamente después de la interrupción del ejercicio [15], que tiene el potencial de causar lesiones relacionadas con el trauma. Sin embargo, los beneficios de la EF son vastos y se debe promover la participación regular para apoyar el bienestar físico.
El término EF abarca múltiples variaciones de generar fuerza muscular contra una carga externa y se puede subdividir en ejercicio estático y dinámico. Los términos estático y dinámico se refieren al tipo de contracción muscular realizada. Estático se refiere a una contracción isométrica, sostenida durante un período determinado (por ejemplo, 15 seg); mientras que dinámico generalmente se refiere a un ciclo de movimiento repetitivo que consta de distintas fases concéntricas y excéntricas (cambios en la longitud del músculo), con un cambio asociado en el ángulo de la articulación. Cada ciclo completo se denomina repetición, con una serie que comprende un número determinado de repeticiones. Además, algunas investigaciones han utilizado el ejercicio rítmico, que consiste en contracciones estáticas intercaladas con relajación de diferentes ciclos de trabajo. La distinción entre los tipos de EF dicta la respuesta hemodinámica, y las diferencias claves se discuten aquí.
Alcance de la revisión
La revisión se centrará principalmente en datos de participantes sanos y jóvenes (<40 años). En primer lugar, la revisión cubrirá brevemente la regulación cerebrovascular para contextualizar los mecanismos reguladores que estarán activos durante el EF. A partir de ahí, la revisión se divide en tres secciones principales. La primera sección discutirá la respuesta fisiológica a la VM de forma aislada y en relación con el EF. La segunda sección discutirá la respuesta hemodinámica durante el EF; incluidas las diferencias entre el tipo de ejercicio (estático vs dinámico) y los efectos de la intensidad del ejercicio. La sección final abarca la respuesta inmediatamente después del EF. También se considera la metodología relativa a la medición del flujo sanguíneo cerebral (FSC).
Regulación del flujo sanguíneo cerebral
El cerebro muestra una regulación diferencial en comparación con otros lechos vasculares. Es inmensamente sensible al dióxido de carbono (CO2), mucho más que el músculo esquelético [16], y el parénquima es extremadamente intolerante a la isquemia, con una capacidad limitada para el almacenamiento de sustratos metabólicos y una tasa metabólica extraordinariamente alta [17]. Como tal, el FSC está bajo control fino en reposo, y el ejercicio, modulado por una gran cantidad de variables que incluyen acoplamiento neurovascular (NVC) [18], presión de perfusión cerebral (CPP) [19], factores humorales (por ejemplo, presión parcial de CO2 y O2 arterial) [20, 21], gasto cardíaco [22] y sistema nervioso autónomo [23-25].
En reposo, la presión parcial de dióxido de carbono arterial (PaCO2) parece ser el regulador más potente y dominante del FSC [26]. Las reducciones de la PaCO2 (hipocapnia) estimulan la vasoconstricción de las arteriolas cerebrales, lo que aumenta la resistencia cerebrovascular y, en última instancia, reduce el FSC [27]. Por el contrario, los aumentos de la PaCO2 (hipercapnia) vasodilatan las arteriolas cerebrales, reducen la resistencia cerebrovascular y elevan el FSC [28, 29]. La jerarquía reguladora persiste durante el ejercicio, y durante el ejercicio aeróbico, el perfil del FSC se asemeja a una U invertida, incrementos iniciales a intensidades moderadas (50-80% de la carga de trabajo máximo) con reducciones inducidas por hipocapnia evidentes en el ejercicio máximo [30]; aunque se estudió principalmente en el ejercicio aeróbico basado en el ciclismo.
Si bien el conjunto de conocimiento actual describe el papel del CO2 en la perfusión cerebral de manera integral, la regulación del FSC durante los cambios en la CPP no ha sido tan sencilla. La autorregulación cerebral se refiere al proceso mediante el cual el FSC se mantiene relativamente constante a pesar de la variante presión de perfusión [31]. Cuando la CPP aumenta la vasoconstricción de los vasos cerebrales, lo que limita la hiperperfusión, por el contrario, cuando la CPP disminuye, los vasos cerebrales se dilatan para mantener el FSC [17, 32]. La eficacia de la autorregulación cerebral ha sido cuestionada recientemente [33, 34], con una meseta autorreguladora mucho más estrecha que la descrita previamente [35, 36]. Esto es pertinente dado que el sello distintivo del EF dinámico son los grandes cambios sinusoidales en la presión arterial media (PAM). Además, los moduladores del CBF descritos anteriormente están entrelazados y no están activos de forma aislada. Esto se ejemplifica por la interacción entre la autorregulación cerebral y la PaCO2, mediante la cual la hipocapnia mejora la autorregulación cerebral mientras que la hipercapnia la deteriora [19]. La discusión detallada de los moduladores del FSC está más allá del alcance de esta revisión, y el lector debe dirigirse a revisiones más completas de la regulación del FSC en reposo [17, 32, 37, 38] y en ejercicio [30]. Sin embargo, hay algunos aspectos únicos del EF que deben considerarse en el contexto de la regulación del FSC.
La maniobra de Valsalva
Tradicionalmente, la VM se realiza mediante una exhalación forzada contra una glotis cerrada y se utiliza en actividades cotidianas como levantar objetos [39], defecar y toser [40]. De forma aislada, la VM produce una respuesta cardiovascular compleja [41], utilizada clínicamente para probar la autorregulación cerebral dinámica [42, 43] y la función autónoma [44]. Hay 4 fases distintas de la VM (ver Figura 1). La primera (fase I) se caracteriza por un pico transitorio de la PAM a medida que el aumento de la presión intratorácica se traslada al árbol arterial [40]. Aproximadamente 3 seg después de la deformación, el llenado auricular (fase IIa) disminuye [39, 46], lo que reduce el volumen sistólico (VS) y, posteriormente, la PAM. Los aumentos de la frecuencia cardíaca mediados por el barorreflejo arterial (fase IIb) generan una recuperación parcial de la PAM hasta que se libera la tensión. Al cesar la tensión, la sangre inunda los vasos pulmonares distendidos y la reducción de la presión intratorácica descomprime las arterias torácicas, reduciendo la PAM (fase III), cuya magnitud depende de la intensidad de la tensión [47] y la posición del cuerpo [42]. El gasto cardíaco ahora elevado se expulsa contra una circulación sistémica restringida, un remanente del brazo vascular de la respuesta barorrefleja de las fases precedentes, aumenta transitoriamente la PAM (fase IV) [42, 43, 48]. Se puede encontrar una descripción más detallada de la fisiología de una VM aislada en otro sitio [41].
Respuesta cerebrovascular a la maniobra de Valsalva
Como se mencionó, el FSC está regulado por una gran cantidad de variables fisiológicas, muchas de las cuales sufren perturbaciones rápidas y bidireccionales sólo durante la VM. Un sello distintivo de la VM son los cambios rápidos en la PPC y, aunque los mecanismos autorreguladores cerebrales están activos, no pueden contrarrestar eficazmente dichos cambios [43, 49]. La CPP se calcula restando la presión intracraneal (PIC) de la PAM, y como la PIC se eleva durante una VM [40, 50], pueden producirse rápidamente reducciones significativas de la CPP, sobre todo durante las fases IIa-IIb cuando la PAM se reduce. La VM también eleva la presión venosa central (PVC) [42], lo que restringe el flujo venoso cerebral, eleva el volumen de sangre intracraneal y, posteriormente, la PIC [51]. El aumento de la PVC puede superar al de la presión del FSC y convertirse en el principal determinante de la PIC durante la VM, y las elevaciones de la PVC reducen el FSC [52, 53]. Sin una VM obvia, los cambios en la presión intratorácica pueden persistir durante el EF y alterar el drenaje venoso cerebral [54], en particular durante la carga axial de la columna, como se observa durante la sentadilla en posición vertical [55].
La PAM aumenta durante la fase I, sin cambios [47, 56] o un aumento modesto [42, 57] en la velocidad sanguínea de la arteria cerebral media (MCAv). Además, mayores tensiones, a pesar de producir mayor hipertensión, no producen un mayor aumento de la MCAv durante la fase 1 [47]. Una explicación propuesta es que las elevaciones de la PIC restringen mecánicamente la MCAv durante la fase I. Si bien el papel exacto del sistema nervioso autónomo en el control del FSC sigue siendo controvertido [58], la vasoconstricción simpática puede tener una función similar durante las CPPs elevadas [59-61] y limitar la hiperperfusión. Comparativamente, la respuesta de fase IV, asociada con una normalización de la PIC y aumentos simultáneos rápidos de la PAM, produce una respuesta máxima de la MCAv mayor que la fase I [56]. Además de las reducciones de la PIC en la fase IV, la hiperemia funcional contribuye a la hiperperfusión cerebral observada [57], impulsada por una reducción aguda de la oxigenación cerebral durante la fase II (figura 2), agravada por una PaCO2 elevada [42] y una autorregulada vasodilatación cerebral que persiste desde la fase III [43].
Cabe señalar que la mayoría de los datos relacionados con la VM y los datos que componen esta revisión son de hombres (véanse las Tablas 1 y 2). Esto es problemático dado que la respuesta de la fase IIb a la VM depende del sexo, con aumentos más pequeños en la MCAv media y diastólica observados en los hombres [84]. Las mujeres también tienen una mayor MCAv en reposo [85, 86] y una reactividad cerebrovascular diferencial al CO2 [87, 88]. Además, se ha demostrado que la autorregulación cerebral es mayor en los territorios vasculares de la arteria cerebral anterior [85] y la MCA [89] durante la hipotensión aguda en mujeres, que persiste independientemente de la fase del ciclo menstrual [90]. Como tal, se advierte la extrapolación de la respuesta discutida a las mujeres y se requiere más investigación para cuantificar la respuesta hemodinámica al EF en las mujeres.
El rol de la maniobra de Valsalva durante el ejercicio de fuerza
Durante el EF, la VM actúa para estabilizar el tronco, proporcionando una ventaja mecánica [39, 91]. Sin embargo, la VM exacerba las alteraciones de la presión arterial durante el EF y se desaconseja incluso en adultos sanos [92]. Para el levantador avanzado, la maniobra es inevitable a ≥80% de la contracción voluntaria máxima (MVC) o durante esfuerzos repetidos cuando se acerca a la fatiga [39]. A medida que la carga aumenta, la intensidad de la VM, y por lo tanto de la presión intratorácica, también aumenta [93] con tensiones más intensas que generan mayores picos de la PAM de fase I [57]. La carga relativa para tratar específicamente la potencia, la fuerza y la hipertrofia pueden superar el 80% de la MVC durante un ciclo de entrenamiento [94]. Como tal, es probable que las personas que realizan entrenamiento de la fuerza, independientemente del resultado deseado, realicen regularmente una VM. Durante el EF estático con una VM, el perfil hemodinámico es dominado por la VM [79], es decir, todas las fases de la VM son discernibles a pesar del trasfondo de la contracción muscular sostenida (fig. 1). Por el contrario, como se requieren ~15 seg de esfuerzo para discernir todas las fases de la VM [42, 95], las tensiones cortas experimentadas durante la EF dinámico están 'enmascaradas' por las mayores fluctuaciones de la PAM dependientes del ejercicio [55]. De hecho, la intensidad máxima de la deformación, indicada por la presión esofágica (sustituta de la presión intratorácica), se produce durante la transición de la fase excéntrica a la concéntrica durante el EF dinámico y se alinea con las presiones arteriales máximas [96] (véase también la figura 3).
Por tanto, la comprensión del perfil hemodinámico durante el EF depende de una interacción compleja entre el tipo de EF y el uso de la VM.
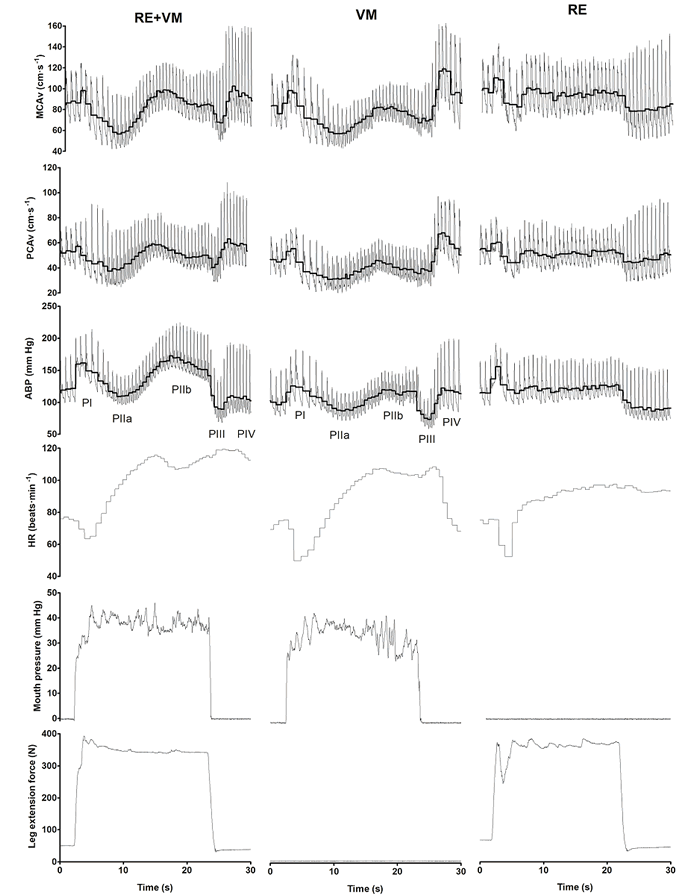
Figura 1. Trazado típico de una combinación de EF y VM (RE+VM), maniobra de Valsalva (VM) en aislación y EF isométrico aislado (RE). Las fases de la VM (fase I (PI) a la fase 4 (PIV)) son visibles tanto en EF+VM como en condiciones de VM. La línea negra gruesa en los trazos de la velocidad sanguínea de la arteria cerebral media (MCAv), la velocidad sanguínea de la arteria cerebral posterior (PCAv) y la presión arterial (PA) representan el valor medio para cada ciclo cardíaco. FC, frecuencia cardíaca. Reproducido con permiso de [45].
Respuesta fisiológica durante el ejercicio de fuerza
Respuesta cardiovascular al ejercicio de fuerza
Presión sanguínea
A pesar de que la vasculatura cerebral posee mecanismos autorreguladores bien desarrollados, la tasa de cambio en la CPP durante la EF dinámica representa un desafío sustancial para la regulación del flujo sanguíneo. La respuesta exacta de la presión arterial al EF depende del tipo de contracción y, dentro del espectro del EF, las respuestas de la presión arterial varían mucho. El EF estático produce aumentos modestos y dependientes de la intensidad de la presión arterial [97]. Desde el inicio de la contracción, la PAM aumenta constantemente [98] hasta una meseta final, cuyo comienzo varía según el tiempo y la intensidad de la contracción [79, 99, 100]. Sin embargo, el EF dinámico intenso produce fluctuaciones sinusoidales extremas en la presión arterial (Figura 3), con un pico individual de 480/350 mm Hg (sistólico/diastólico) reportado y un promedio grupal de 320/250 mm Hg durante el ejercicio dinámico bilateral de press de piernas [ 101]. De hecho, la extensión de la hipertensión intra-ejercicio viene dictada por la masa muscular reclutada, y los ejercicios que utilizan grandes grupos de músculos (por ejemplo, press de piernas) generan la mayor hipertensión [102-105]. Las respuestas de la presión arterial dependen de la intensidad [105] y están mediadas por aumentos de las presiones sistólica y diastólica [39, 106-108].
Dentro de un movimiento dinámico, los picos de presión arterial se observan en el ángulo de la articulación que se corresponde con el punto más débil de la curva de fuerza [39, 109], que para el ejercicio de press de piernas se corresponde con el pico de la flexión de la rodilla [39] y generalmente coincide con la transición entre contracciones excéntricas y concéntricas. La presión arterial disminuye a medida que avanza la fase concéntrica [109] y el ciclo se repite para cada repetición (fig. 3). La presión arterial concéntrica máxima también aumenta en repeticiones posteriores dentro de una serie [96, 101, 105], en series posteriores del mismo ejercicio [107], o si se reduce el período de descanso entre las series [110]. Sale y cols. [96] investigaron la respuesta de la presión arterial al press de piernas bilateral durante varios tipos de contracción (concéntrica, isométrica y excéntrica) utilizando un dinamómetro isocinético e informaron que, independientemente del tipo de contracción, el principal determinante de la presión arterial era el esfuerzo voluntario, determinado por la producción de fuerza en lugar de la medición del esfuerzo percibido. Sin embargo, los esfuerzos intensos de múltiples articulaciones provocarían una mayor presión arterial dentro del ejercicio. Por lo tanto, bajo el término EF, es posible generar perfiles de presión arterial dispares, dependiendo del tipo de contracción; es decir, el EF estático produce un desarrollo relativamente lento y un aumento modesto en la PAM que se estabiliza, mientras que los cambios cíclicos en la presión arterial caracterizan el EF dinámico.
Gasto cardíaco
En comparación con la clasificación de la presión arterial durante el EF, se dispone de una escasez de datos del gasto cardíaco, lo que es problemático para la descripción de la regulación del FSC dado que el gasto cardíaco modula el FSC independientemente de la presión arterial [22]. Durante el ejercicio de press de piernas de alta intensidad (95% 1MR), El VS se reduce y las elevaciones del gasto cardíaco son impulsadas principalmente por la FC [109], con resultados similares encontrados durante el ejercicio de agarre estático (handgrip) [99, 111, 112]. Sin embargo, este no es un hallazgo consistente para el ejercicio isométrico durante la extensión estática de la pierna con [79] y sin [113], la maniobra de VM. Cabría esperar que la VM inhibiera el retorno venoso de manera que la FC no compensara la reducción del VS [79]. Por el contrario, el ejercicio de sentadilla en posición vertical sin carga aumenta la precarga y el gasto cardíaco [114, 115], y debe tenerse en cuenta que las contracciones dinámicas facilitarían el retorno venoso debido al bombeo del músculo esquelético. A medida que PAM sufre cambios cíclicos a lo largo de una sola repetición, los determinantes primarios del VS, como la poscarga y la precarga, también cambiarán dinámicamente. De hecho, previamente se han informado cambios dependientes de la fase en el gasto cardíaco, con aumentos demostrados a lo largo del ejercicio de press de piernas, alcanzando su punto máximo al final de la fase concéntrica impulsada por una recuperación del VS [109]. Sin embargo, durante la contracción muscular, independientemente del tipo, el principal impulsor de un aumento del gasto cardíaco parece ser la frecuencia cardíaca.
Regulación del flujo sanguíneo cerebral durante el ejercicio de fuerza
Como se mencionó anteriormente, la regulación del FSC es compleja con procesos estrictos para asegurar una perfusión adecuada y, en última instancia, el mantenimiento de la función [116]. El ejercicio, de cualquier naturaleza, puede competir con los mecanismos reguladores del FSC, ya que múltiples determinantes del FSC pueden ejercer sus efectos simultáneamente. Recientemente, Smith y Ainslie [30] han sugerido que la literatura actual es incapaz de identificar claramente los roles individuales y las contribuciones de todas las variables reguladoras a las respuestas del FSC observadas y es indicativo de la relación intrincada-dependiente que muestran muchas variables (por ejemplo, la PaCO2 y la PAM). La mayoría de los estudios que investigan la respuesta cerebrovascular al ejercicio han utilizado el ejercicio aeróbico en estado estable, en particular, el ciclismo en posición vertical o semi-recostado [22, 117-126]. Incluso dentro de la clasificación general del ejercicio aeróbico dinámico, algunas modalidades, como el remo, muestran un perfil del FSC marcadamente diferente al del ciclismo, con una clara influencia de la presión arterial en el primero. De hecho, durante el remo se observan perfiles de la MCAv similares al EF dinámico, sinusoidal y a menudo acorde con la presión arterial [127, 128]. La complejidad inherente de la regulación del FSC se ve agravada por la maniobra VM y los efectos mecánicos asociados de las perturbaciones en la PIC durante la EF y el remo. De manera similar, correr produce oscilaciones rítmicas en la presión arterial y en la MCAv [129], producidas por la interferencia entre la frecuencia de zancada y la frecuencia cardíaca [130]. Si bien la jerarquía de reguladores cerebrovasculares todavía existe durante el EF (es decir, la PaCO2 es la más potente [65]), es evidente que la respuesta cerebrovascular no es uniforme entre los tipos de ejercicio. Por ejemplo, el gasto cardíaco contribuye a las elevaciones de la MCAv más durante el ciclismo que durante el ejercicio rítmico de agarre manual [73]. Por lo tanto, el conocimiento de la función cerebrovascular durante el ejercicio aeróbico no se puede extrapolar al ejercicio de fuerza.
Además, los diferentes perfiles de flujo sanguíneo entre las modalidades de ejercicio, incluidos los diversos tipos de EF descritos en esta revisión, pueden provocar diferentes procesos de adaptación durante la exposición habitual (es decir, el entrenamiento). Un mecanismo clave para las mejoras en la función vascular relacionadas con el ejercicio se atribuye a las fuerzas de fricción que resultan del movimiento mecánico de la sangre a través del endotelio vascular (es decir, el 'shear stress’, tensión tangencial [131]). Como se describe a continuación, el EF puede provocar una amplia gama de respuestas del flujo sanguíneo durante y después de un turno de ejercicio, cuyas consecuencias relacionadas con una función vascular mejorada o deteriorada son en gran parte desconocidas.
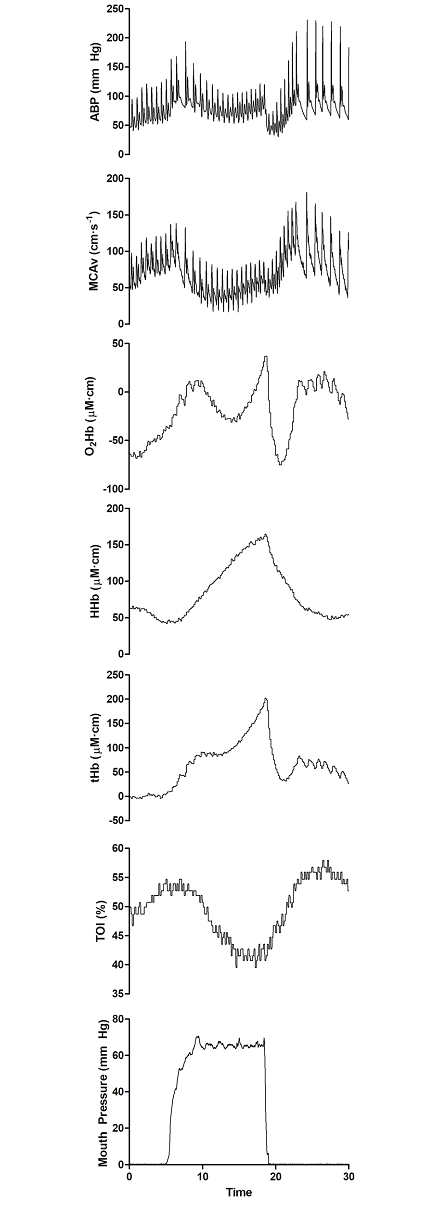
Figura 2. Variables hemodinámicas en un participante durante una maniobra de Valsalva al 90% de la presión bucal máxima durante 10 segundos. ABP, presión arterial sanguínea; MCAv, velocidad sanguínea promedio de la arteria cerebral media; TOI, Índice de oxigenación total; O2Hb, oxihemoglobina; HHb, desoxihemoglobina; tHb, hemoglobina total. Reproducido con permiso de [57].
EF dinámico
Durante el EF se ha informado de un aumento de cuatro veces en la presión arterial durante la fase concéntrica del levantamiento [101], excediendo en gran medida el límite autorregulador superior propuesto tradicionalmente [31]. Durante el ejercicio de ciclismo de alta intensidad, la autorregulación cerebral dinámica está activa y es capaz de modular eficazmente el FSC [126, 132, 133]; sin embargo, dada la naturaleza rápida de las fluctuaciones en la presión arterial durante el EF dinámico, la autorregulación cerebral es probablemente insuficiente, de modo que la MCAv varía en proporción con la PAM [12, 65] como se observa durante el press de piernas [12] y la sentadilla con carga adicional [55]. Tan impresionantes como parecen los picos de presión arterial, varios autores indican que el ΔPAM dicta la respuesta cerebrovascular [12, 63], ilustrando las características de filtro de paso alto [134] de la circulación cerebral y reflejando la latencia inherente (~5 seg) de mecanismos de autorregulación [135]. La variación de la MCAv con la PAM persiste durante la hipertensión intra-ejercicio, a pesar de la histéresis [136-138]. Evidentemente, se han utilizado repetidas maniobras de sentadilla con el peso corporal para perturbar la PAM y evaluar la autorregulación cerebral dinámica [138, 139].
El EF habitual reduce la distensibilidad arterial central [140] y previamente hemos especulado que la circulación cerebral no está excluida de tales adaptaciones. Como la distensibilidad cerebrovascular modula la autorregulación cerebral [141], es posible que los estímulos hipertensivos repetidos puedan modificar la función autorreguladora. Hemos demostrado que, a pesar de las diferencias sustanciales entre los tipos de ejercicio, los individuos entrenados aeróbicamente (excluyendo el remo) y los individuos entrenados en la fuerza muestran una capacidad autorreguladora dinámica similar durante las oscilaciones forzadas de la PAM (posiciones de sentadilla repetidas) [142]. Sin embargo, demostramos una tendencia a que la ganancia derivada de la función de transferencia sea mayor durante oscilaciones de frecuencia más lenta (0.05 Hz) en la PAM en una cohorte entrenada en fuerza. Además, los individuos entrenados en la fuerza muestran una mayor pulsatilidad de la MCA en reposo [143], probablemente debido a la reducción de la capacidad de amortiguación pulsátil de las arterias centrales. Estos datos indican modificaciones sutiles en función cerebrovascular; sin embargo, dada la plasticidad de la autorregulación cerebral [144], es posible que la función mejorada en individuos entrenados en fuerza pueda revelarse a altas presiones de perfusión y/o poseer un rango autorregulador efectivo mayor.
Los informes hasta la fecha sobre la respuesta media de la MCA durante el EF dinámico (todos los ejercicios) son equívocos, con algunos aumentos [63-65, 70, 76], sin cambios [12] o una disminución en los informes [62]. Los estudios que utilizan el EF de press de piernas han informado todas las posibilidades. También se debe considerar que un promedio simple en el transcurso del EF dinámico no refleja el perfil de la MCAv durante el ejercicio, como se destaca en la figura 3. Si se considera el ejercicio de press de piernas, los estudios que demostraron un aumento [64, 65] o ningún cambio [12] en la medición de la MCAv durante el ejercicio no utilizaron una maniobra VM, pero utilizaron un 80-100% de un máximo de 10 repeticiones. Sin embargo, como la VM se recluta al ≥80% de la MVC o durante esfuerzos repetidos al acercarse a la fatiga [39], es poco probable que la carga utilizada sea un reflejo fiel del 80-100% de 10 repeticiones máximas. Por el contrario, Dickerman y cols. [62] informaron que durante una sesión de ejercicio máximo de press de piernas de una repetición en individuos entrenados en fuerza de nivel de élite, la VM fue responsable de una reducción del 25% en la media de la MCAv. Sin embargo, estos autores no informaron la PaCO2 (o la presión parcial de CO2 al final de la espiración (PETCO2) como un método). Similar al reposo, la PaCO2 exhibe una fuerte influencia en el FSC durante el EF [66], lo cual es importante dado que los patrones típicos de respiración previos al ejercicio durante los levantamientos de alta intensidad se componen de hiperventilación [15], seguida de una VM intensa. De hecho, la hiperventilación previa al ejercicio que redujo la PETCO2 en ~8 mm Hg (valor absoluto = 26 mm Hg) redujo la MCA de ejercicio (press de piernas al 80% de 6MR) en ~39% sin una VM concurrente [65]. También vale la pena señalar que la hipocapnia mejora la autorregulación dinámica cerebral [19]. Por lo tanto, la hiperventilación puede desempeñar un papel complejo durante el EF, a saber: (1) actuar como una rutina previa al ejercicio, (2) reducir el FSC absoluto (hiperperfusión) durante el EF y (3) mejorar la autorregulación de manera que los cambios en la CPP se amortigüen de manera más adecuada.
Además de la hiperventilación, la VM también puede proteger la vasculatura cerebral durante el ejercicio mediante una reducción de la presión transmural [50]. La VM genera aumentos adicionales en la PAM, y aunque inicialmente esto parecería perjudicial, hemos informado que la media máxima de la MCAv fue similar entre el 90%, 60% y 30% de 6MR, a pesar del mayor aumento en la PAM observado para la serie al 90%, con la VM sólo reclutada a esta intensidad [55]. En el punto de transición entre la contracción excéntrica y la concéntrica, cuando el reclutamiento de la VM es permisible, se observan las mayores presiones esofágicas, que posteriormente disminuyen a medida que la fase concéntrica progresa de una manera notablemente similar a la PAM [96, 109]. Como la VM es inevitable a intensidades ≥80% de la MVC [39], es plausible que los participantes seleccionen por sí mismos la intensidad de la tensión de la VM [presión intratorácica] para que coincida con la intensidad del ejercicio y, por lo tanto, de la presión arterial; evidente como cuando los participantes se acercan a la fatiga, que se asocia con mayores esfuerzos voluntarios, tanto la PAM como la intensidad de la tensión aumentan [96, 109]. Si bien es especulativa, esta intensidad de autoselección de la VM inherente podría culminar en aumentos proporcionales de la PIC, limitando el FSC durante la CPP máxima y mitigando las perturbaciones drásticas en la presión transmural cerebrovascular. A medida que la presión torácica y la PAM disminuyen simultáneamente a lo largo de la fase concéntrica, la CPP se estabiliza ya que tanto la PIC como la PAM caen simultáneamente, manteniendo el FSC. Tomados en conjunto, la hipocapnia anticipatoria y el uso de la VM modifican la relación de la presión sanguínea del CBF durante el EF y ésta última puede proporcionar un mecanismo protector temporal.
Tabla 1. Estudios que investigan las respuestas del FSC al ejercicio de fuerza dinámica.
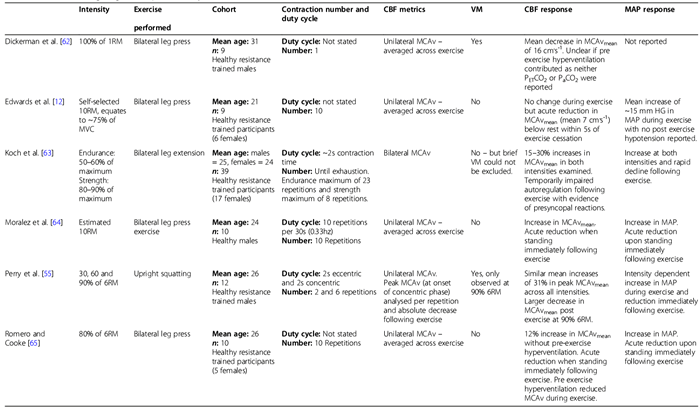
MCV, contracción voluntaria máxima; MCAv, velocidad sanguínea de la arteria cerebral media; PCAv, velocidad sanguínea de la arteria cerebral posterior; PETCO2, presión parcial de dióxido de carbono al final de la espiración; PaCO2, presión parcial de dióxido de carbono arterial; PAM, presión sanguínea arterial promedio; RM, repetición máxima; VA, arteria vertebral; CBF, flujo de sangre cerebral; VM, maniobra de Valsalva.
Tabla 2. Estudios que investigan las respuestas del FSC al ejercicio de fuerza estático y rítmico.
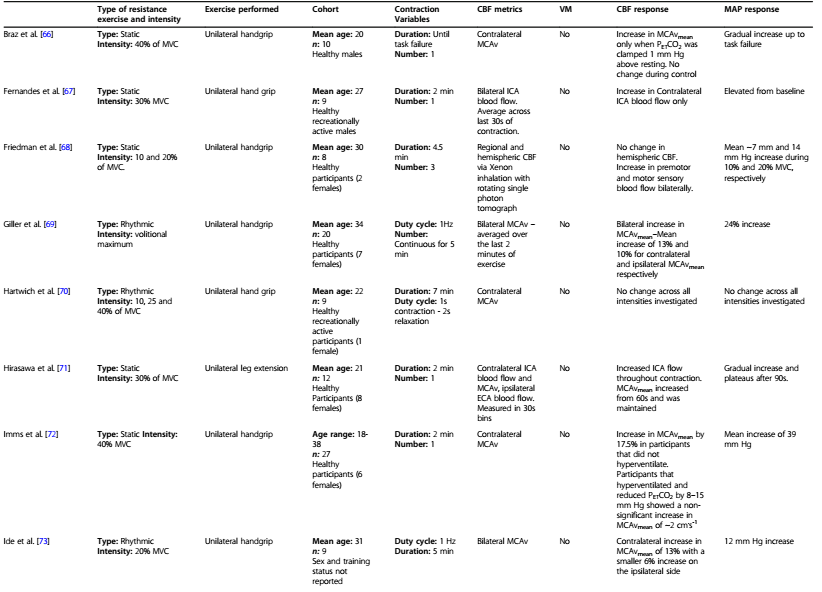

MCV, contracción voluntaria máxima; MCAv, velocidad sanguínea de la arteria cerebral media; PCAv, velocidad sanguínea de la arteria cerebral posterior; PETCO2, presión parcial de dióxido de carbono al final de la espiración; PaCO2, presión parcial de dióxido de carbono arterial; PAM, presión sanguínea arterial promedio; PCAv, velocidad sanguínea de la arteria cerebral posterior; RM, repetición máxima; VA, arteria vertebral; CBF, flujo de sangre cerebral; VM, maniobra de Valsalva; ICA, arteria carótida interna; ECA, arteria carótida interna.
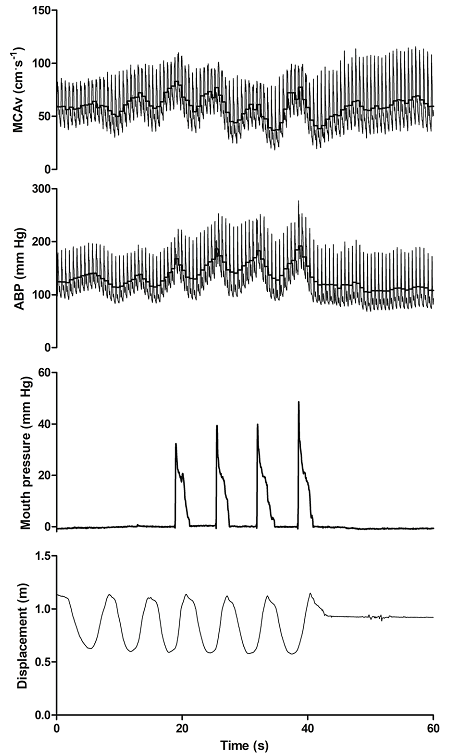
Figura 3. Respuesta hemodinámica a 6 sentadillas erguidas al 60% de una máxima repetición. MCAv, velocidad sanguínea de la arteria cerebral media; APB, presión arterial sanguinea (PA). La línea negra gruesa en los trazos de MCAv y PA representa la media de cada ciclo cardíaco. Tenga en cuenta que una reducción en el desplazamiento indica la fase excéntrica de la sentadilla. Sólo se realizó una VM en las últimas 4 repeticiones de la serie, notándose el aumento resultante en la PAM. La presión máxima de la VM se produce en la transición de la contracción excéntrica a la concéntrica y coincide con la presión arterial máxima. Datos de Perry y cols. [55].
Ejercicio de fuerza estático
Durante el EF estático (agarre manual y extensión de rodilla), se han informado aumentos en el flujo sanguíneo medio de la MCAv [22, 71, 72, 74, 76, 79], de la arteria carótida interna [67, 71] y de la arteria vertebral [81, 82]. Sin embargo, algunos autores no han informado cambios en la MCAv durante el agarre manual estático [66] o la extensión de la pierna [75]. De manera similar al EF dinámico, la media de la MCAv depende de la respuesta ventilatoria y, posteriormente, de la PaCO2, con pre- [145] y dentro del ejercicio [72] la hiperventilación disminuye y se recupera la media de la MCAv. Braz y cols. [66] informaron que durante el ejercicio de agarre manual estático, las elevaciones medias de MCAv eran evidentes sólo cuando la PETCO2 era llevada 1 mm Hg por encima del reposo. Por lo tanto, las discrepancias pueden resultar de una influencia primordial de la vasoconstricción hipocápnica y corroborar los hallazgos en el EF dinámico.
Se ha informado que la autorregulación cerebral dinámica no se ve afectada durante y después del ejercicio estático [78] y rítmico [76]. El EF estático se asocia con una respuesta presora prolongada con una meseta en la PAM [45, 71, 79]. Hirasawa y cols. [71] informaron una meseta en el flujo de la ICA de 60 seg a 120 seg en una contracción estática unilateral de la pierna al 30% de la MVC. El flujo sanguíneo de la arteria carótida externa, sin embargo, demostró un aumento continuo, concurrente con pequeños aumentos en la PAM en las etapas posteriores, indicativo de un mecanismo potencialmente protector al dirigir el flujo extracraneal durante la hipertensión [83]. Se desconoce si esto persiste durante el ejercicio dinámico con mayores aumentos en la PAM, y es difícil de evaluar con las metodologías de imágenes actuales (consultar en la parte de consideraciones de medición). Utilizando la extensión de pierna bilateral estática máxima (sin VM), Pott [79] informó de un fuerte aumento en la MCAv (~10 cm·seg-1), alcanzando un máximo en ~3 seg pero volviendo a la línea de base en ~5 seg. También se han demostrado aumentos moderados de la PCAv (~6 cm·seg-1) en el ejercicio de agarre estático al 30% de la MVC [146]. Otros estudios que no informaron un efecto del tiempo, pero informaron aumentos en la MCAv [78], PCAv [81], ICA [67] y flujo de la AV [81]. Curiosamente, hemos mostrado aumentos iniciales más grandes (tiempo alineado con la fase I de la VM) en la MCAv, pero no para la PCAv, durante el EF con ventilación normal en comparación con el ejercicio con VM [45]. Sin embargo, estos efectos disminuyeron con el tiempo de la contracción, de modo que no se observaron diferencias después de ~12 seg, lo que probablemente refleje la activación de la autorregulación cerebral después de >5 seg, y así la velocidad de la sangre se estabiliza [135].
También debe tenerse en cuenta que durante el ejercicio de una sola extremidad las alteraciones en el flujo sanguíneo al cerebro son heterogéneas. En primer lugar, al considerar la autorregulación cerebrovascular, algunos [147, 148], pero no todos [149], informan diferencias regionales en las respuestas del flujo sanguíneo a las alteraciones de la presión arterial. De manera similar, la reactividad cerebrovascular al CO2 [150, 151] puede diferir entre las circulaciones anterior y posterior, aunque este no es un hallazgo universal durante la hipercapnia [21]. En segundo lugar, se observan elevaciones más pronunciadas del flujo sanguíneo en los vasos contralaterales a la extremidad que realiza el ejercicio debido a la ubicación anatómica de las áreas motoras dentro del cerebro, evidentes durante el EF unilateral. Por ejemplo, Linkis y cols. [77] informaron que las contracciones de la mano derecha produjeron un aumento del 19% en la MCAv contralateral sin cambios en la MCAv ipsilateral 8del mismo lado). Se ha informado de aumentos en el flujo sanguíneo a las áreas sensoriales premotoras y motoras durante el agarre manual estático de baja intensidad [68] y la extensión de la pierna [152], sin cambios en el flujo hemisférico global medido con la técnica de eliminación de xenón. El aumento del flujo sanguíneo está mediado por NVC y se ha observado en la ICA [67] y AV [81] contralateral, y se apoya en aumentos en la MCAv [70, 73] durante el ejercicio estático unilateral. El flujo sanguíneo de la ICA ipsolateral parece estar restringido por la vasoconstricción simpática durante el ejercicio de agarre manual unilateral [67]. En apoyo de la regulación autonómica, durante el EF, las arterias intracraneales como la MCA sufren una vasoconstricción simpática durante el ejercicio rítmico de agarre manual [59]. Es importante destacar que la respuesta del flujo sanguíneo en el hemisferio contralateral depende de las contracciones volitivas (control central), ya que el ejercicio rítmico pasivo y el ejercicio estimulado eléctricamente no alteran la velocidad de la sangre en la arteria cerebral anterior [80]. Debido al aumento lento y progresivo de la PAM durante el EF estático sin la maniobra de VM, se puede observar el efecto del NVC, en contraste con el EF dinámico donde esta respuesta está enmascarada por cambios rápidos en la CPP. Independientemente de la naturaleza de la contracción, el aumento de la CPP puede exacerbar los aumentos de la perfusión cerebral mediados por el NVC. Si bien el papel exacto del sistema nervioso autónomo durante el EF aún no se ha dilucidado, el principal factor impulsor del FSC durante el EF dinámico parece ser la CPP; por el contrario, durante las contracciones estáticas de baja intensidad, es probable que el NVC sean el principal impulsor. Parece que los aumentos lentos y progresivos de la CPP durante el EF estático pueden contrarrestarse eficazmente mediante la autorregulación cerebral. Por lo tanto, la aplicación de los hallazgos en grupos de músculos pequeños que utilizan contracciones estáticas a todos los tipos de EF debe realizarse con precaución.
Respuesta fisiológica después del ejercicio de fuerza
Presión arterial inmediatamente después del ejercicio de fuerza.
Se han informado sistemáticamente reducciones de las presiones arteriales media, sistólica y diastólica inmediatamente (en segundos) después del EF [15, 64, 65, 153-155], con un aumento de la pulsatilidad de la presión [156]. Durante la contracción muscular se inhibe el flujo sanguíneo, con aumentos de las presiones intramusculares que obstruyen el flujo sanguíneo arterial y/o venoso [157]. Sin embargo, después del ejercicio, el flujo sanguíneo a la musculatura activa aumenta [158] mediado por la dilatación metabólica; una hiperemia funcional [159, 160] que se ve favorecida por una reducción de la presión transmural durante la relajación [161]. La hiperemia después del ejercicio de las extremidades inferiores se exacerba en la posición erguida [162] y depende de la intensidad de la contracción [163] y de la frecuencia [164]. En apoyo a esto, hemos observado previamente una hipotensión dependiente de la carga inmediatamente después de la sentadilla con la mayor intensidad relativa produciendo presiones sanguíneas absolutas más bajas [55]. Además, el tiempo de recuperación de la PAM y el tiempo por debajo del valor inicial fueron mayores, mediados por reducciones agudas del gasto cardíaco y de la resistencia periférica total, con resultados similares observados después del peso muerto estático en posición vertical [165]. Hasta la fecha, los estudios que investigan la respuesta hemodinámica al EF han utilizado típicamente un movimiento de press de piernas [12, 64, 65], ejercicio de tipo estático/isométrico [78, 103] o ambos [96, 102]. La posición en el press de piernas facilita el drenaje venoso, ya que los pies están al nivel del corazón o por encima de él, de modo que no se observa hipotensión cuando los participantes permanecen semisentados [12]. Por lo tanto, la posición erguida en combinación con mayores intensidades de ejercicio exacerba la hipotensión transitoria posterior al ejercicio independientemente del tipo de contracción. Pueden producirse similitudes de la hipotensión post-ejercicio después del EF con la intolerancia ortostática inicial, caracterizada esta última por la acumulación venosa [166] y reducciones de la presión venosa [167] y de la resistencia periférica total [168]; esto culmina en una rápida translocación de la sangre hacia las extremidades con una abrupta reducción de la PAM que supera el control barorreflejo del tono vascular [169]. Teniendo en cuenta estos mecanismos en el contexto de hipotensión post-EF, es probable que la hiperemia funcional de la musculatura por debajo del nivel del corazón y la rápida reducción de la presión intramuscular exacerben estas respuestas de una manera dependiente de la intensidad.
Respuesta cerebrovascular después del ejercicio de fuerza
Se ha informado hipoperfusión cerebral suficiente para inducir un síncope inmediatamente después del EF [15] y es probable que esté provocada por la hipotensión descrita anteriormente. Sin embargo, la hiperventilación previa al ejercicio reduce la MCAv antes del ejercicio y dentro del EF [65], lo que probablemente aumenta el riesgo de síncope post-ejercicio. A pesar de que la hipocapnia mejora la capacidad autorreguladora, la velocidad de inicio de la hipotensión supera las contramedidas cardiovasculares y cerebrovasculares reflejas, de modo que persisten las disminuciones en el FSC. En ausencia de perturbaciones de la PaCO2, la fase autorreguladora cerebral se reduce inmediatamente después del EF dinámico, lo que indica una capacidad reguladora deteriorada [63]. La magnitud de la reducción del FSC depende de la carga levantada cuando está en posición vertical y se alinea estrechamente con el patrón de la PAM después de la interrupción del ejercicio, con una disminución más grande y más prolongada en la MCAv observada después de levantar la carga relativa más alta [55]. Es importante destacar que, la carga relativa más alta coincidió con el reclutamiento de la maniobra de VM, cuyas implicaciones se discuten en la siguiente sección. Sin la presencia de hipotensión, la MCAv desciende por debajo de la línea de base después del EF de la extremidad inferior cuando se encuentra en una posición semirrecostada, enfatizando que el ΔPAM, no la PAM absoluta, impulsa la respuesta del FSC [12]. No obstante, la evidencia reciente indica que la autorregulación dinámica se modifica por la posición del cuerpo con una función reducida durante la bipedestación [86], lo que agrava el efecto de una mayor hipotensión después del ejercicio en bipedestación. Es de destacar que la disminución de la MCAv después del ejercicio se debe principalmente a las reducciones en la velocidad de la sangre diastólica [55], similar al pre-síncope [170]. Sin embargo, el aumento de la pulsatilidad es agudo, con una normalización aparente de 10 min después de la interrupción del ejercicio [156]. Al igual que con las respuestas durante el ejercicio, las respuestas cerebrovasculares posteriores al EF todavía parecen estar dominadas por la CPP que cambia rápidamente. Si bien no siempre se observa hipotensión después del EF debido a la posición del cuerpo, la hipotensión se asocia con mayores reducciones en la perfusión cerebral y el reclutamiento de la maniobra de VM.
El rol de la maniobra de Valsalva después del ejercicio de fuerza
El rol de la VM durante el EF es complejo (Figura 4), con efectos evidentes dependientes de la fase. Como se mencionó anteriormente, el efecto de esta VM puede limitar la perfusión cerebral durante el ejercicio y considerarse beneficioso; sin embargo, después del ejercicio, los efectos circulatorios perjudiciales de la VM son evidentes. Las maniobras de VM de corta duración (~10 seg) aisladas producen reducciones de fase II en la oxigenación cerebral (fig. 2) [57], suficientes para inducir un síncope en bipedestación [47]. Por lo tanto, no es sorprendente que se haya informado un síncope después de un EF de alta intensidad en posición vertical cuando se recluta la maniobra de VM [15]. En la posición erguida, la combinación de la liberación de la tensión, la hiperemia funcional inducida por el ejercicio en la musculatura dependiente por debajo del nivel del corazón (por ej., durante levantamientos de estilo olímpico, sentadillas o peso muerto) y la hiperventilación previa al ejercicio amenazan el mantenimiento del FSC después del EF [55, 65]. Si bien la hiperventilación antes y durante el ejercicio probablemente contribuya a la hipoperfusión cerebral posterior al ejercicio, la rápida reducción de la CPP probablemente sustente el síncope posterior al ejercicio, ya que la hiperventilación previa al esfuerzo no está presente en el síncope después de la VM incluso corta [47]. Como la hipotensión de fase III de la VM y las reducciones de la MCAv son menores en decúbito supino [42] o sentado (fig. 1), es probable que la posibilidad de un síncope post-ejercicio se mitigue en estas posiciones. Es probable que la vasoconstricción cerebral residual, mediada por la hipocapnia, autorregulación cerebral o ambas, persista después del ejercicio debido a la latencia inherente de la reactividad cerebrovascular al CO2 [171] y a la autorregulación [135]. Como tal, la CPP puede disminuir rápidamente mientras se contrae la vasculatura cerebral, aunque esto dependería de la duración y el momento de la liberación de la tensión. Los períodos de esfuerzo prolongados, como los observados en los levantamientos complejos de múltiples fases (levantamiento estilo olímpico) [15], probablemente exacerben el problema, ya que la perfusión cerebral se deprime durante períodos más largos y la oxigenación se ve comprometida. Por lo tanto, los efectos de la posición corporal y la VM actúan en conjunto para agravar el estrés hemodinámico inmediatamente posterior al EF. También existen otras posibilidades interactivas durante el EF dinámico y requieren más investigación, por ejemplo (1) una sola VM puede abarcar varias repeticiones y (2) el tiempo de una VM breve puede generar un escenario en el que la liberación de la respiración durante la fase tardía I (disminución de la PAM) coincide con el cese del ejercicio y la hiperemia funcional asociada, de modo que se produce una rápida disminución de la PAM a pesar de un breve período de esfuerzo.
Hasta ahora, nos hemos centrado en la presentación clínica más común después del ejercicio: el síncope. Si bien el síncope es el evento adverso obvio posterior al ejercicio, un problema potencial mayor es la hiperperfusión cerebral predominante. Con la VM sola, hemos informado previamente un aumento de casi tres veces en la fase IV de la MCAv desde la línea de base, donde se alcanzó el pico más alto en la MCAv (ver Figura 2 para la comparación de fase) [47]. Durante el EF estático, esta respuesta persiste (Figura 1), con velocidades sanguíneas máximas mayores >3 seg después del ejercicio asociadas con una pulsatilidad elevada en la PCA y la MCA [45]. De manera similar, segundos después del EF dinámico con una VM, son evidentes incrementos rápidos en la conductancia cerebrovascular y en la MCAv [55]. Se requiere más investigación para cuantificar las implicaciones agudas y a largo plazo de las VM repetidas durante el EF para informar una práctica segura, aunque primero deben superarse varios desafíos metodológicos.
Desafíos y consideraciones de la medición
La investigación del EF presenta muchos desafíos, principalmente limitaciones metodológicas que incluyen la medición de la presión arterial. La medición arterial no invasiva (por ej., fotopletismografía digital) y directa [101] de la presión arterial requiere que una mano esté libre y en reposo, lo que limita el alcance del ejercicio de EF de las extremidades inferiores o unilateral de las extremidades superiores. Por lo tanto, faltan las comparaciones de la presión arterial bilateral apropiadas entre el ejercicio de las extremidades superiores e inferiores, lo que inhibe la exploración de diferencias potenciales en las relaciones de CBF-presión arterial entre diferentes ejercicios y/o grupos de músculos. Otro inhibidor de la medición fisiológica es el movimiento físico del participante durante el EF, lo que limita la mayor parte de la investigación al EF estático. Dado que la mayoría del EF realizado [94] y recomendado [10, 92, 172, 173] es de tipo dinámico, surgen problemas con la extrapolación de los hallazgos a todas las variantes del EF. Sin embargo, el mayor desafío es medir el FSC, como se analiza a continuación.
La precisión del Doppler transcraneal ha sido cuestionada recientemente [69, 174] durante grandes cambios en la presión arterial [59] y en la PaCO2 [88, 175, 176], condiciones que caracterizan el EF. Las inferencias del flujo sanguíneo a partir de la velocidad deben hacerse con precaución [174] ya que el uso de la ecografía Doppler transcraneal como sustituto del flujo sanguíneo requiere un diámetro arterial estable. Utilizando imágenes de resonancia magnética, el ejercicio rítmico de agarre (60% MVC) produjo una disminución del 2% en el área de superficie de la MCA contralateral, lo que se sugiere que es un resultado directo de la vasoconstricción simpática [59]. Como los cambios en el diámetro de la MCA ocurren durante el ejercicio de intensidad moderada con una pequeña masa muscular unilateral (ejercicio de agarre manual), no se puede suponer la constancia del diámetro arterial intracraneal durante el EF (dinámico o estático) con una gran masa muscular. Además, durante la hipotensión transitoria, los registros de la velocidad sanguínea pueden subestimar el flujo, especialmente en la circulación posterior [149]. Se requieren más investigaciones para establecer si la vasoconstricción mediada por el sistema simpático persiste en el EF dinámico de alta intensidad o si las arterias cerebrales se dilatan pasivamente por la presión intramural extrema (PAM >300 mm Hg) [101]. Como tal, los datos que utilizan Doppler transcraneal deben interpretarse con precaución.
Dada la incertidumbre en torno a la constancia del diámetro arterial intracraneal, los investigadores suelen utilizar la ecografía dúplex para medir el flujo sanguíneo en las arterias de alimentación extracraneales 'vias ascendentes' para corroborar los datos del Doppler transcraneal [177]. Sin embargo, el movimiento de los participantes excluye en gran medida esta técnica y otras (por ej. resonancia) durante el EF dinámico. Además, se requiere una resolución temporal suficiente para capturar el flujo latido a latido para encapsular la naturaleza dinámica del perfil hemodinámico del EF. Los dispositivos de imagenología Doppler transcraneal podrían proporcionar una solución; sin embargo, la medición del diámetro de los vasos intracraneales sigue siendo un problema [178]. Además de complicar el perfil hemodinámico, la VM complica las mediciones del FSC y se evita en gran medida [12, 63-65, 67, 78, 81] (tablas 1 y 2). Durante la VM, la vena yugular interna se llena de sangre, ofuscando la arteria carótida común y sus bifurcaciones, lo que limita la medición del flujo sanguíneo a las arterias vertebrales. Si bien es posible obtener el flujo sanguíneo de la ICA durante una VM, se requieren maniobras de VM más largas (>30 seg), lo que aumenta la probabilidad de eventos adversos (por ejemplo, síncope) y se reduce la aplicabilidad. Sin embargo, las investigaciones en curso sobre el control cerebrovascular durante el EF con una VM concomitante son pertinentes, ya que las personas que entrenan a altas intensidades o casi a la fatiga probablemente utilizarán la VM. La anatomía del cerebro y el cráneo sigue siendo un problema para el investigador, particularmente cuando se cuantifica el FSC. Estas cuestiones no son nuevas [179]; sin embargo, impiden la medición precisa del flujo sanguíneo intracraneal con suficiente resolución temporal y precisión para revelar una comprensión más completa de la regulación del FSC durante el EF.
Conclusiones
Bajo el término general de ejercicio existen respuestas dispares de presión arterial y del FSC. Además, sólo dentro del EF, el tipo de contracción genera respuestas del FSC marcadamente diferentes. Dadas estas claras diferencias, es plausible esperar que las contribuciones relativas de los mecanismos reguladores a la respuesta del FSC observada difieran en la contribución entre los tipos de ejercicio, y los hallazgos de un tipo no se pueden aplicar de manera ubicua. Parece que la jerarquía de la regulación del FSC todavía existe durante el EF, con una PaCO2 dominante. Sin embargo, las perturbaciones sinusoidales en la PAM producidas por el EF dinámico y la inclusión de la VM desafían profundamente la regulación cerebrovascular, con la última dominante durante un trasfondo de EF estático. Se requiere más investigación, particularmente durante el ejercicio de fuerza dinámico, para (1) dilucidar la contribución de la VM a la regulación del FSC, (2) cuantificar el papel del sistema nervioso simpático, (3) establecer medios más precisos para medir el FSC durante grandes cambios en la PAM y (4) establecer las adaptaciones cerebrovasculares crónicas al EF. No se puede ignorar la eficacia del EF; sin embargo, se requiere una comprensión más completa de las respuestas hemodinámicas para informar una práctica segura.
Agradecimientos
Los autores agradecen a los investigadores su contribución al campo de estudio.
Contribuciones de los autores
BGP generó la idea del artículo y redactó la reseña. Ambos autores editaron el artículo y aprobaron la versión final del manuscrito.
Fondos
No se recibió financiación para la revisión.
Disponibilidad de datos y materiales
El intercambio de datos no se aplica a este artículo, ya que no se generaron ni analizaron conjuntos de datos durante el estudio actual.
Recibido: 24 de noviembre de 2020 Aceptado: 7 de marzo de 2021. Publicado: 27 de mayo 2021.
* Correspondencia: B.G.Perry@Massey.ac.nz