Resumen: Adaptaciones de las mitocondrias de los músculos esqueléticos a la obesidad
Publicado 25 de abril de 2018, 7:04
El papel principal de las mitocondrias, conocidas como la fuente de energía en la mayoría de las células eucariotas, es satisfacer las necesidades energéticas de las células.
Por lo tanto, la adaptación mitocondrial está asociada con el estado fisiológico del organismo, el cual puede ser influenciado por muchos factores, incluyendo la dieta y el ejercicio. En respuesta a los cambios en la disponibilidad y la demanda de energía, las mitocondrias sufren constantes cambios adaptativos (biogénesis) y morfologícos (fusión/ fisión) para ajustar la producción necesaria de trifosfato de adenosina (ATP) (Liesa y Shirihai, 2013).
Mientras que la homeostasis metabólica interrumpida, como las dietas altas en grasa o azúcar, puede causar disfunción mitocondrial y conducir al desarrollo de trastornos metabólicos, el ejercicio físico y las fuentes dietéticas muestran algunos efectos beneficiosos sobre la adaptación mitocondrial (Craig et al., 2015; Drake, Wilson y Yan, 2016).
Esta revisión aborda la correlación entre la disfunción mitocondrial y la obesidad, y se centra en el efecto del ejercicio físico sobre la adaptación mitocondrial en el músculo esquelético.
Adaptación mitocondrial al ejercicio
Además de las adaptaciones mitocondriales según el estado nutricional, los estudios realizados sugieren la interacción entre el ejercicio físico y la adaptación mitocondrial para modular la biogénesis y la dinámica mitocondrial (Cartoni et al., 2005; Drake et al., 2016). Hay dos tipos de entrenamiento: Ejercicios de resistencia (p. ej. trotar, montar en bicicleta y nadar) y ejercicios de fuerza. Se sabe que ambos tipos de entrenamiento provocan adaptaciones mitocondriales en el músculo esquelético (Tonkonogi & Sahlin, 2002). El ejercicio de resistencia promueve una mayor proporción de fibras musculares de cambio lento tipo I con alto contenido mitocondrial, lo que resulta en un consumo máximo de oxígeno (VO2 max) y un aumento de la capacidad respiratoria muscular (Sjodin y Svedenhag, 1985). Por otro lado, el ejercicio de fuerza aumenta la proporción de fibras musculares esqueléticas de cambio rápido tipo II (Costill et al., 1976), que promueve la síntesis de proteínas musculares y aumenta la capacidad respiratoria mitocondrial (Porter, Reidy, Bhattarai, Sidossis y Rasmussen, 2015).
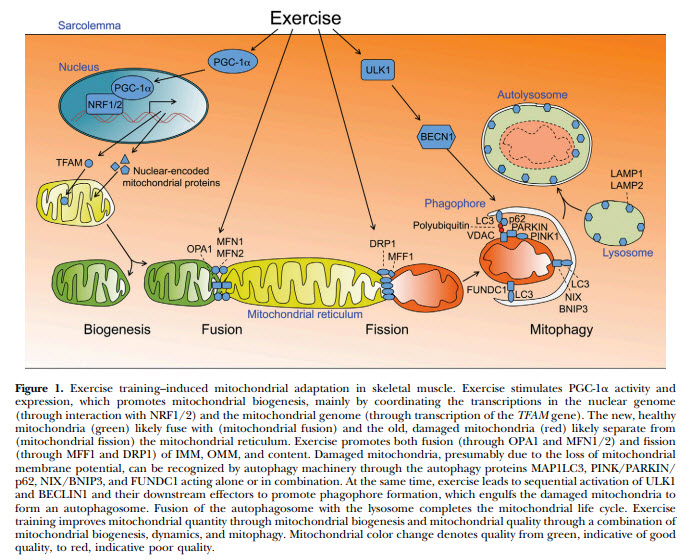
Desde 1967, los estudios han proporcionado evidencia de que tanto los ejercicios de resistencia como los de entrenamiento de fureza promueven la biogénesis mitocondrial a través de procesos altamente coordinados, como la activación de AMPK (Holloszy, 1967; Wilkinson et al., 2008) (Fig. 1). La activación de la AMPK activa posteriormente el PGC1α, que trabaja en cooperación con el factor respiratorio nuclear 1 (NRF1), NRF2 y el receptor alfa relacionado con el estrógeno (ERRα), para activar el factor de transcripción mitocondrial A (TFAM) (Wu et al., 1999). De hecho, se ha observado que el ejercicio aumenta la interacción de PGC1α/NRF1 y la transcripción de genes codificados por el genoma nuclear para las proteínas de la cadena de transporte de electrones mitocondriales en el núcleo (Safdar et al., 2011; Wu et al., 1999). Consecuentemente, las expresiones de NRF2 y ERRα también aumentan en el músculo esquelético humano después de un esfuerzo agudo de ejercicio (Ballmann et al., 2014; Cartoni et al., 2005). Por lo tanto, la adaptación mitocondrial se considera uno de los resultados beneficiosos clave del entrenamiento. En comparación con la biogénesis mitocondrial, los mecanismos exactos que controlan la dinámica mitocondrial de fusión/fisión en respuesta al ejercicio siguen siendo en gran medida un tema de estudio que va ampliándose con el tiempo y el conocimiento de la fisiología humana. Se plantea la hipótesis de que el aumento de la fusión mitocondrial podría ser ventajoso en el músculo esquelético a través de la promoción del acoplamiento energético debido a la alta demanda de energía del ejercicio. (Janssen, Heymsfield, Baumgartner y Ross, 2000; Skulachev, 2001; Youle y van der Bliek, 2012). De acuerdo con esto, durante el ejercicio de resistencia, los niveles de mRNA de MFN1 y MFN2 (marcadores de fusión mitocondrial) se incrementaron a las 12 y 24 h después del ejercicio en humanos y ratas, en parte mediados por la vía PGC1α/ERRα (Cartoni et al., 2005; Ding et al., 2010). Además, los niveles de proteína MFN1, MFN2 y OPA1 se elevaron 24 y 48 horas después del entrenamiento de resistencia y/o ejercicios de fuerza en el músculo esquelético de ratas y ratones (Greene et al., 2015; Ju et al., 2016; Kitaoka, Ogasawara, Tamura, Fujita, & Hatta, 2015). Sin embargo, los marcadores de fusión mitocondrial anteriores no parecieron tener cambios o disminuciones en la expresión inmediatamente y una hora después del ejercicio (Bori et al., 2012; Cartoni et al., 2005; Ding et al., 2010; Jamart, Naslain, Gilson, & Francaux, 2013; Kitaoka et al., 2015). Por lo tanto, la fusión mitocondrial en el músculo esquelético puede depender de los intervalos de tiempo del ejercicio.
Tanto el ejercicio de resistencia como el de fuerza se han relacionado con un aumento de los marcadores de fisión mitocondrial, incluyendo FIS1, DRP1 y fosforilación de DRP1 (Ser616), en el músculo esquelético (Ding et al.., 2010; Jamart et al., 2013; Ju et al., 2016; Kitaoka et al., 2015), aunque algunos estudios no mostraron cambios en estos marcadores (Bori et al., 2012; Greene et al., 2015). Se ha planteado que la fragmentación mitocondrial ayudaría a eliminar las mitocondrias dañadas y permitiría la incorporación de mitocondrias recién sintetizadas, lo que resultaría en una mejora de la calidad de las mitocondrias (Pagano, Py, Bernardi, Candau y Sánchez, 2014). Curiosamente, se han encontrado resultados contradictorios del efecto del ejercicio sobre la fusión/fisión mitocondrial en músculos esqueléticos envejecidos y obesos. Por ejemplo, el entrenamiento de ejercicio de resistencia disminuyó tanto la fusión mitocondrial (MFN1, 2) como la fisión (FIS1, DRP1) y las expresiones de los marcadores en hombres mayores (Bori et al., 2012), mientras que la expresión del gen DRP1 fue mayor en el músculo esquelético de las mujeres físicamente activas en comparación con las ancianas inactivas (Drummond et al., 2014). Además, el entrenamiento con ejercicios de fuerza disminuyó la fosforilación DRP1 (Ser616) e incrementó la expresión del gen OPA1 en personas mayores con obesidad resistentes a la insulina, lo que resultó en un aumento de la oxidación de las grasas y la sensibilidad a la insulina (Fealy, Mulya, Lai y Kirwan, 2014). Sin un análisis morfológico de la forma, tamaño y división mitocondrial en múltiples puntos temporales, la interpretación de estos cambios dinámicos mitocondriales sería limitada, aunque existe consenso general en que el ejercicio físico aumenta la biogénesis mitocondrial y altera la fusión/fisión mitocondrial, contribuyendo a la adaptación mitocondrial.
Observaciones finales
La desadaptación en la utilización de energía en las mitocondrias de los músculos esqueléticos podría ser uno de los factores que contribuyen a la obesidad y a los trastornos metabólicos. Se necesita investigación adicional sobre la implicación de la adaptación mitocondrial mediada por la actividad física y las dietas para comprender mejor el papel de la disfunción mitocondrial en la obesidad y los trastornos metabólicos, conduciendo así a estrategias preventivas y/o de tratamiento más efectivas en el futuro.
Referencia del artículo
Chen, P. B., Yang, J. S., & Park, Y. (2018). Adaptations of Skeletal Muscle Mitochondria to Obesity, Exercise, and Polyunsaturated Fatty Acids. Lipids.
Referencias que aparecen en el resumen del artículo:
- Kuzmicic, J., del Campo, A., López-Crisosto, C., Morales, P. E., Pennanen, C., Bravo-Sagua, R., ... & Parra, V. (2011). Dinámica mitocondrial: un potencial nuevo blanco terapéutico para la insuficiencia cardiaca. Revista Española de Cardiología, 64(10), 916-923.
- Liesa, M., & Shirihai, O. S. (2013). Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell metabolism, 17(4), 491-506.
- Craig, D. M., Ashcroft, S. P., Belew, M. Y., Stocks, B., Currell, K., Baar, K., & Philp, A. (2015). Utilizing small nutrient compounds as enhancers of exercise-induced mitochondrial biogenesis. Frontiers in physiology, 6, 296.
- Drake, J. C., Wilson, R. J., & Yan, Z. (2015). Molecular mechanisms for mitochondrial adaptation to exercise training in skeletal muscle. The FASEB Journal, 30(1), 13-22.
- Cartoni, R., Léger, B., Hock, M. B., Praz, M., Crettenand, A., Pich, S., ... & Gobelet, C. (2005). Mitofusins 1/2 and ERRα expression are increased in human skeletal muscle after physical exercise. The Journal of physiology, 567(1), 349-358.
- Drummond, M. J., Addison, O., Brunker, L., Hopkins, P. N., McClain, D. A., LaStayo, P. C., & Marcus, R. L. (2014). Downregulation of E3 ubiquitin ligases and mitophagy-related genes in skeletal muscle of physically inactive, frail older women: a cross-sectional comparison. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences, 69(8), 1040-1048.
- Tonkonogi, M., & Sahlin, K. (2002). Physical exercise and mitochondrial function in human skeletal muscle. Exercise and sport sciences reviews, 30(3), 129-137.
- Sjodin, B., & Svedenhag, J. (1985). Applied physiology of marathon running. Sports medicine, 2(2), 83-99.
- Porter, C., Reidy, P. T., Bhattarai, N., Sidossis, L. S., & Rasmussen, B. B. (2015). Resistance exercise training alters mitochondrial function in human skeletal muscle. Medicine and science in sports and exercise, 47(9), 1922.
- Wilkinson, S. B., Phillips, S. M., Atherton, P. J., Patel, R., Yarasheski, K. E., Tarnopolsky, M. A., & Rennie, M. J. (2008). Differential effects of resistance and endurance exercise in the fed state on signalling molecule phosphorylation and protein synthesis in human muscle. The journal of physiology, 586(15), 3701-3717.
- Holloszy, J. O. (1967). Biochemical adaptations in muscle effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle. Journal of Biological Chemistry, 242(9), 2278-2282.
- Wu, Z., Puigserver, P., Andersson, U., Zhang, C., Adelmant, G., Mootha, V., ... & Spiegelman, B. M. (1999). Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1. Cell, 98(1), 115-124.
- Safdar, A., Little, J. P., Stokl, A. J., Hettinga, B. P., Akhtar, M., & Tarnopolsky, M. A. (2011). Exercise increases mitochondrial PGC-1α content and promotes nuclear-mitochondrial cross-talk to coordinate mitochondrial biogenesis. Journal of Biological Chemistry, 286(12), 10605-10617.
- Ballmann, C., McGinnis, G., Peters, B., Slivka, D., Cuddy, J., Hailes, W., ... & Quindry, J. (2014). Exercise-induced oxidative stress and hypoxic exercise recovery. European journal of applied physiology, 114(4), 725-733.
- Janssen, I., Heymsfield, S. B., Baumgartner, R. N., & Ross, R. (2000). Estimation of skeletal muscle mass by bioelectrical impedance analysis. Journal of applied physiology, 89(2), 465-471.
- Ding, H., Jiang, N., Liu, H., Liu, X., Liu, D., Zhao, F., ... & Zhang, Y. (2010). Response of mitochondrial fusion and fission protein gene expression to exercise in rat skeletal muscle. Biochimica et Biophysica Acta (BBA)-General Subjects, 1800(3), 250-256.
- Greene, N. P., Lee, D. E., Brown, J. L., Rosa, M. E., Brown, L. A., Perry, R. A., ... & Washington, T. A. (2015). Mitochondrial quality control, promoted by PGC‐1α, is dysregulated by Western diet‐induced obesity and partially restored by moderate physical activity in mice. Physiological Reports, 3(7).
- Kitaoka, Y., Ogasawara, R., Tamura, Y., Fujita, S., & Hatta, H. (2015). Effect of electrical stimulation-induced resistance exercise on mitochondrial fission and fusion proteins in rat skeletal muscle. Applied Physiology, Nutrition, and Metabolism, 40(11), 1137-1142.
- Bori, Z., Zhao, Z., Koltai, E., Fatouros, I. G., Jamurtas, A. Z., Douroudos, I. I., ... & Boldogh, I. (2012). The effects of aging, physical training, and a single bout of exercise on mitochondrial protein expression in human skeletal muscle. Experimental gerontology, 47(6), 417-424.
- Pagano, A. F., Py, G., Bernardi, H., Candau, R. B., & Sanchez, A. M. (2014). Autophagy and protein turnover signaling in slow-twitch muscle during exercise. Medicine & Science in Sports & Exercise, 46(7), 1314-1325.
