Revisiones BJSM: A–Z de los Suplementos Nutricionales: Suplementos Dietarios, Alimentos para la Nutrición Deportiva y Ayudas Ergogénicas para la Salud y el Rendimiento: Parte 15
D. C. Nieman1, S.J. Stear2, L. M. Castell3 y L. M. Burke4
1Appalachian State University, Human Performance Laboratory, North Carolina Research Campus, Kannapolis, NC, USA
2Performance Influencers Limited, London, UK
3University of Oxford, Oxford, UK
4Australian Institute of Sport, Canberra, Australia
Artículo publicado en el journal PubliCE del año 2016.
Publicado 20 de diciembre de 2016
INTRODUCCION
Los suplementos dietéticos que se utilizan mas comúnmente son los micronutrientes. Las propiedades antioxidantes de varios micronutrientes dietarios son de particular interés para los atletas debido a que fortalecen los sistemas de defensa antioxidantes endógenos del cuerpo que neutralizan los radicales libres y disminuyen el daño oxidativo. Los antioxidantes dietéticos son la vitamina C, la vitamina E, carotenoides (principalmente β-caroteno), polifenoles (por ejemplo, flavonoides), selenio, glutatión y la coenzima Q 10 (consulte la parte 3 de esta serie para obtener una descripción excelente sobre los antioxidantes). Debido al creciente interés sobre la función de los flavonoides en el ejercicio, tanto en las investigaciones realizadas por los medios como en las investigaciones científicas, hemos dedicado esta edición a este tema. En virtud de la gran cantidad de flavonoides que existen se necesita una gran cantidad de citas. En esta breve reseña sintetizaremos los potenciales efectos bioactivos de los flavonoides y su eficacia para beneficiar el rendimiento y para contrarrestar el estrés oxidativo inducido por el ejercicio, la inflamación, el dolor muscular de aparición tardía (DOMS) y las alteraciones en el sistema inmune.
FLAVONOIDES
D. C. Nieman
Los fitoquímicos son sustancias químicas producidas por las plantas entre las que se incluyen los taninos, las lignina y los flavonoides. Los polifenoles más abundantes y mejor estudiados son los flavonoides porque se han identificado mas de 6000 y han sido clasificados al menos en seis subgrupos: flavonoles, flavonas, flavanonas, flavanoles (y sus oligómeros, proantocianidinas), antocianidinas e isoflavonoides (Tabla 1) (1). Los flavonoides se encuentran ampliamente distribuidos en las plantas donde funcionan como pigmentos, moléculas de señalización y sustancias de defensa contra infecciones y lesiones.
La ingesta dietética de flavonoides oscila entre 50 y 800 mg/día dependiendo del consumo de frutas y verduras y del consumo de té (2, 3). En EE.UU, la ingesta total promedio de flavonoides es 210 mg/día, (2) y en España 313 mg/día, (3) con fuentes importantes entre las que se incluyen el té, los cítricos y sus jugos, la cervezas y las cervezas claras, vinos, melón, bayas, manzanas, cebollas y bananas.
En numerosos estudios una alta ingesta de frutas y verduras se ha relacionado con un menor riesgo de enfermedades cardiovasculares y varios tipos de cáncer. La influencia en la reducción de enfermedades de las frutas y verduras puede deberse en parte a los altos niveles de flavonoides. Aunque las evidencias científicas provenientes de cultivos celulares y de modelos con animales apoyan la función de la ingesta de flavonoides en la prevención de enfermedades, los estudios realizados en personas arrojan resultados mixtos y no concluyentes cuando se analizan como un todo (4 5). Parte del problema es que los datos de flavonoides solo están disponibles en un número limitado de alimentos, lo que dificulta los esfuerzos para calcular la ingesta total de flavonoides en las personas (1-3). Muchos flavonoides poseen fuertes propiedades anti-inflamatorias, anti-virales, anti-oxidantes, anti-obesidad y anti-cancerígenas cuando se estudian in vitro utilizando grandes dosis de la forma purificada. La inflamación y el estrés oxidativo son mecanismos clave en la patogénesis de ciertos estados de enfermedad, lo que apoya la estrategia propuesta de incrementar la ingesta de flavonoides para la prevención de cáncer, diabetes mellitus y de enfermedades cardiovasculares. Sin embargo, los resultados de estudios aleatorizados, doble ciego en humanos con grandes dosis de flavonoides purificados como la quercetina han sido decepcionantes (6). Los flavonoides varían ampliamente en cuanto a su biodisponibilidad, y la mayoría se absorben mal, son expulsados activamente y sufren importantes reacciones de conjugación y transformación metabólica, que pueden afectar sus capacidades de actividad biológica (7). A pesar de la baja biodisponibilidad del favonoide original, algunos de los metabolitos in vivo pueden acumularse en los tejidos y tener actividad biológica, pero carecemos de datos concluyentes en humanos. Por ejemplo, los datos en animales indican que los metabolitos de quercetina se acumulan en el tejido vascular donde actúan como antioxidantes complementarios, y la albúmina plasmática facilita la translocación de los metabolitos de quercetina hacia el objetivo vascular (8).
Hay cada vez mas conciencia de que las influencias bioactivas de los flavonoides individuales se potencian cuando se mezclan con otros flavonoides (por ejemplo, el flavonol quercetina con el flavanol epigalocatequina 3-galato, EGCG) o cuando forman parte de un cóctel o extracto de polifenoles y otros nutrientes (9). Dos o más flavonoides ingeridos juntos pueden aumentar la biodisponibilidad y disminuir la eliminación por medio de inhibición competitiva por conjugación glucurónica o con sulfato tanto en el intestino como en el hígado, y mediante la inhibición de los transportadores de flujo de salida, tales como la glicoproteína P, las proteínas de resistencia al cáncer de mama y las proteína 2 de resistencia a múltiples fármacos (10).
Los efectos protectores de la salud de los vegetales no son producidos por un único componente, sino más bien por mezclas complejas de moléculas que interactúan (9). Los polifenoles y componentes naturales aportan una estrategia defensiva multifacética para las plantas y los seres humanos. Por lo tanto, el enfoque “Farmacéutico” de utilización de grandes dosis de una sola molécula bioactiva rara vez es exitoso en la aplicación de la nutrición para la salud humana y el rendimiento.
Tabla 1. Subgrupos de flavonoides y fuentes alimenticias de los mismos.
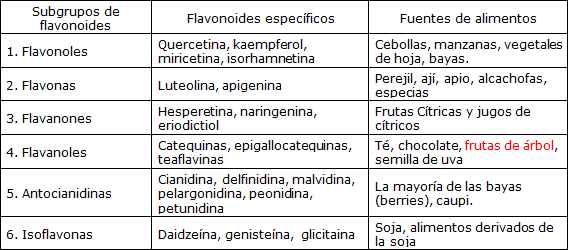
Fuente: Adaptado de Laboratorio de Datos de Nutrientes del USDA (1).
Tabla 2. Influencia del uso de flavonoides y de extractos y productos ricos en flavonoides sobre el rendimiento físico y como estrategia para combatir la inflamación inducida por el ejercicio, el dolor muscular de aparición tardía (DOMS), el estrés oxidativo, las alteraciones en la respuesta inmune y URTI
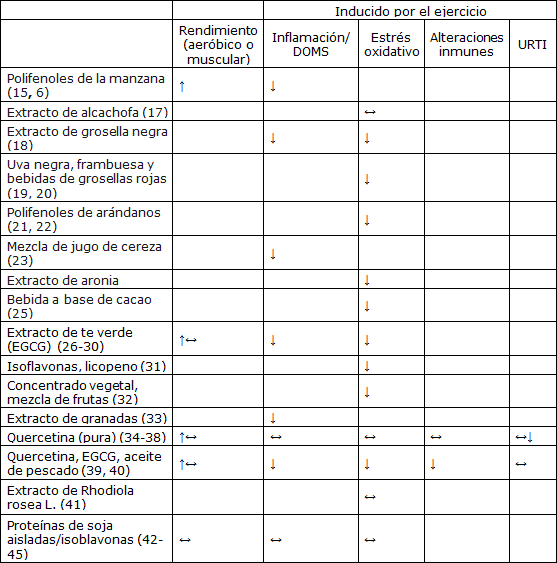
En blanco= Sin datos publicados; (↔)= Los datos indican que no hay influencia; (↔↓)= Resultados mixtos; (↑)= Los datos indican un aumento en las variables determinadas; (↓)= Disminución en las variables determinadas.
EGCG= epigalocatequina 3-galato; URTI= infección del tracto respiratorio superior.
Además, necesitamos realizar un enfoque desde la metabolómica o de la genómica nutricional para mejorar la capacidad de los investigadores para detectar las influencias complejas y sutiles de los suplementos de flavonoides o de los extractos ricos en flavonoides, de los alimentos y de las bebidas en el metabolismo y la fisiología del cuerpo entero (11).
Flavonoides y Ejercicio
Se han evaluado varios agentes nutricionales en cuanto a su capacidad para atenuar el estrés oxidativo, la inflamación y los cambios inmunológicos después del ejercicio de alta intensidad para reducir la magnitud del estrés fisiológico y el riesgo de infecciones del tracto respiratorio superior (URTI) (12). Algunos cuestionan el valor de uso de suplementos nutricionales para contrarrestar el estrés oxidativo y la inflamación inducidos por el ejercicio porque estos pueden interferir con los mecanismos de señalización que son fundamentales para las adaptaciones al entrenamiento (13). Otro punto de vista es que los suplementos nutricionales atenúan pero no bloquean totalmente el estrés oxidativo y la inflamación inducidos por el ejercicio, algo similar al uso beneficioso de bolsas de hielo para reducir la hinchazón después de las lesiones leves (14).
Los flavonoides puros, tales como la quercetina, EGCG y las isoflavonas, o los extractos vegetales ricos en flavonoides, están siendo probados por un número cada vez mayor de equipos de investigación como ayudas para el rendimiento y para contrarrestar la inflamación, el DOMS, el estrés oxidativo, las alteraciones en la respuesta inmune y en las URTI inducidas por el ejercicio (En la Tabla 1 presentamos un resumen) (15-45). La mayoría de los estudios se han centrado en la capacidad del té rico en flavonoides y de los extractos de frutas y vegetales para contrarrestar el estrés oxidativo y, tal como se resume en la Tabla 1, la mayoría observó una respuesta eficaz (18-22, 24-32, 39) La segunda variable mas comúnmente analizada está relacionada con la inflamación y el dolor muscular de aparición tardía (DOMS), y nuevamente, la mayoría de los estudios observaron efectos protectores cuando se consumieron mezclas de flavonoides o extractos de plantas antes de la realización de series de ejercicios exigentes (15-18, 23, 33, 39). Los resultados son mixtos para las variables de rendimiento, (15, 16, 26-30, 34-40, 43) y pocos estudios han incluido mediciones del sistema inmunológico y URTI (35, 38, 39).
Para cualquier extracto flavonoide particular o extracto de plantas estudiados dentro de un contexto deportivo, existen algunos documentos pero los diseños de investigación varían ampliamente en cuanto a la dosis y régimen de suplementación, el modo en que se produce el estrés físico y las variables de medición. El período de administración de suplementos de flavonoides en los estudios que figuran en la Tabla 2 varía de 15 min a 60 días antes de la realización de un ejercicio, y la mayoría de los estudios contemplan una administración entre 7 y 21 días. No obstante, en general, los datos apoyan la idea que los extractos vegetales ricos en flavonoides y las mezclas de nutrientes con un único flavonoide (por ejemplo, la quercetina con extracto de té verde y aceite de pescado, o las isoflavonas con licopeno) ayudan a contrarrestar el estrés oxidativo y la inflamación/DOMS inducidos por el ejercicio de
El flavonoide mas estudiado en relación al ejercicio es la quercetina (34-40). En uno de los primeros estudios realizado con ciclistas estresados con ejercicios, la suplementación con quercetina pura (1000 mg/día) durante un período de 5 semanas redujo las tasas de enfermedad pero no contrarrestó la inflamación post-ejercicio, el estrés oxidativo ni la alteración en el sistema inmune (35). En un estudio de seguimiento realizado siguiendo un diseño similar, la suplementación con quercetina combinada con extracto de té verde, isoquercetina y aceite de pescado provocó una reducción importante en la inflamación inducida por el ejercicio y en el estrés oxidativo, y un aumento crónico de la función inmune innata (39). El papel de la quercetina como ayuda para el rendimiento ha sido evaluado por varios equipos de investigación con resultados mixtos (34–39). Los estudios en animales han observado que la quercetina actuaría como un mimético del ejercicio para la biogénesis mitocondrial y favorecería el rendimiento de resistencia (34). Un estudio realizado con sujetos no entrenados observó un aumento modesto en la densidad mitocondrial del musculo esquelético y el rendimiento de resistencia, pero el aumento fue mucho menor al observado en ratones (36).
Aunque los datos son limitados y los regímenes de administración de suplementos varían mucho, la mayoría de los estudios han llegado a la conclusión de que las mezclas de nutrientes-flavonoides o tés ricos en flavonoides, los extractos de frutas y vegetales consumidos de forma aguda o crónica antes un ejercicio atenúan el estrés oxidativo, la inflamación y el DOMS. Los resultados son mixtos para las variables de rendimiento, y pocos estudios han incluido mediciones del sistema inmune.
COMENTARIOS FINALES
La evidencia actual parece afirmar que los atletas necesitan mayor capacidad antioxidante que los no atletas para poder reducir el daño oxidativo inducido por el ejercicio. Los extractos ricos en flavonoides cuando se consumen inmediatamente antes o crónicamente durante días o semanas antes de la realización de esfuerzo físico pesado, pueden contrarrestar parcialmente la inflamación y el estrés oxidativo post ejercicio. Se necesitan mas investigaciones para definir mejor los regímenes de dosificación óptimos. También es importante determinar si las mezclas de flavonoides que incluyen algunos de los flavonoides con mayor actividad biológica de los diferentes subgrupos, pueden magnificar estas influencias, y al mismo tiempo reforzar la inmunidad y actuar como miméticos del ejercicio para la biogénesis mitocondrial.
Si los atletas necesitan mejores antioxidantes dietéticos (entre los que se incluyen los flavonoides) que las personas sedentarias, debido a la mayor generación de radicales de oxígeno provocada por el entrenamiento de alta intensidad y las competencias sigue siendo controversial y especulativo. Mientras tanto, la forma mas eficaz para aumentar la ingesta de antioxidantes es consumir una dieta variada centrada en los alimentos que sean buenas fuentes de antioxidantes como las frutas, verduras y granos enteros. Esta estrategia también ayuda a minimizar el riesgo de exceder la ingesta. En casos en que exista la necesidad de complementar la ingesta dietética, parecería razonable elegir un producto que aporte combinación de antioxidantes, entre los cuales se incluyen los flavonoides, en niveles moderados, en lugar de grandes dosis de un solo nutriente.
Conflicto de intereses D.C.N es miembro del Consejo Asesor Científico de Quercegen Pharma, Sudbury, Massachusetts, EE.UU.
Procedencia y revisión por pares; Sin revisión externa por pares.
Referencias
1. USDA Nutrient Data Laboratory. (2007). USDA database for the flavonoid content of selected foods. Beltsville, Maryland, USA: US Department of Agriculture. http://www.ars.usda.gov/nutrientdata (accessed 24 September 2010).
2. Chun O.K., Floegel A., Chung S.J., et al. (2010). Estimation of antioxidant intakes from diet and supplements in U. S. adults. J. Nutr.140 : 317 – 24 .
3. Zamora-Ros R., Andres-Lacueva C., Lamuela-Raventós R.M., et al. (2010). Estimation of dietary sources and flavonoid intake in a Spanish adult population (EPIC–Spain). J. Am. Diet. Assoc. 110 : 390 – 8 .
4. Hooper L., Kroon P.A., Rimm E.B., et al. (2008). Flavonoids, flavonoid-rich foods, and cardiovascular risk: a meta-analysis of randomized controlled trials. Am. J. Clin. Nutr. 88 : 38 – 50 .
5. Wang L., Lee I.M., Zhang S.M., et al. (2009). Dietary intake of selected flavonols, flavones, and flavonoid-rich foods and risk of cancer in middle-aged and older women. Am. J. Clin. Nutr. 89 : 905 – 12 .
6. Shanely R.A., Knab A.M., Nieman D.C., et al. (2010). Quercetin supplementation does not alter antioxidant status in humans. Free Radic. Res. ; 44 : 224 – 31 .
7. Zhang L., Zuo Z., Lin G. (2000). Intestinal and hepatic glucuronidation of flavonoids. Mol. Pharmacol.;4 :833 – 45 .
8. Terao J., Kawai Y., Murota K. (2008). Vegetable flavonoids and cardiovascular disease. Asia Pac. J. Clin. Nutr.17 (Suppl 1): 291 – 3 .
9. Lila M.A. (2007). From beans to berries and beyond: teamwork between plant chemicals for protection of optimal human health. Ann NY Acad. Sci. 1114: 372 – 80 .
10. Kale A., Gawande S., Kotwal S., et al. (2010). Studies on the effects of oral administration of nutrient mixture, quercetin and red onions on the bioavailability of epigallocatechin gallate from green tea extract. Phytother. Res. 24 (Suppl 1): S48 – 55 .
11. Bakker G.C., van Erk M.J., Pellis L., et al. (2010). An antiinflammatory dietary mix modulates inflammation and oxidative and metabolic stress in overweight men: a nutrigenomics approach. Am. J. Clin. Nutr. 91 :1044 – 59 .
12. Nieman D. C. (2008). Immunonutrition support for athletes. Nutr. Rev. 66:310–20.
13. Ristow M., Zarse K., Oberbach A., et al. (2009). Antioxidants prevent healthpromoting effects of physical exercise in humans. Proc. Natl. Acad. Sci .USA; 106 : 8665 – 70 .
14. Yfanti C., Akerström T., Nielsen S., et al. (2010). Antioxidant supplementation does not alter endurance training adaptation. Med. Sci. Sports Exerc. ;42:1388– 95 .
15. Nakazato K., Ochi E., Waga T. (2010). Dietary apple polyphenols have preventive effects against lengthening contraction-induced muscle injuries. Mol. Nutr. Food Res.54:364–72 .
16. Nakazato K., Song H., Waga T. (2007). Dietary apple polyphenols enhance gastrocnemius function in Wistar rats. Med. Sci. Sports Exerc. 39:934 – 40 .
17. Skarpanska-Stejnborn A., Pilaczynska-Szczesniak L., Basta P., et al. (2008). The influence of supplementation with artichoke ( Cynara scolymus L. ) extract on selected redox parameters in rowers. Int. J. Sport Nutr. Exerc. Metab. 18 : 313 – 27 .
18. Lyall K.A., Hurst S.M., Cooney J., et al. (2009). Short-term blackcurrant extract consumption modulates exercise-induced oxidative stress and lipopolysaccharide-stimulated inflammatory responses. Am. J. Physiol. Regul. Integr. Comp. Physiol. 297 : R70 – 81 .
19. Morillas-Ruiz J.M., Villegas García J.A., López F.J., et al. (2006). Effects of polyphenolic antioxidants on exercise-induced oxidative stress. Clin. Nutr.25:444 – 53 .
20. Morillas-Ruiz J., Zafrilla P., Almar M., et al. (2005). The effects of an antioxidant supplemented beverage on exercise-induced oxidative stress: results from a placebo-controlled double-blind study in cyclists. Eur. J. Appl. Physiol. 95 : 543 – 9 .
21. Hurst R. D., Wells R.W., Hurst S.M., et al. (2010). Blueberry fruit polyphenolics suppress oxidative stress-induced skeletal muscle cell damage in vitro. Mol. Nutr. Food Res.54 : 353 – 63 .
22. McAnulty S. R., McAnulty L.S., Nieman D.C., et al. (2004). Consumption of blueberry polyphenols reduces exercise-induced oxidative stress compared to vitamin C. . Nutr. Res.24 : 209 – 21 .
23. Connolly D. A., McHugh M.P., Padilla-Zakour O.I., et al. (2006). Effiacy of a tart cherry juice blend in preventing the symptoms of muscle damage. Br. J. Sports Med. 40:679 – 83 .
24. Pilaczynska-Szczesniak L., Skarpanska-Steinborn A., Deskur E., et al. (2005). The influence of chokeberry juice supplementation on the reduction of oxidative stress resulting from an incremental rowing ergometer exercise. Int. J. Sport Nutr. Exerc. Metab. 15 : 48 – 58 .
25. Wiswedel I., Hirsch D., Kropf S., et al. (2004). Flavanol-rich cocoa drink lowers plasma F(2)-isoprostane concentrations in humans. Free Radic. Biol. Med. 37 : 411– 21 .
26. Dean S., Braakhuis A., Paton C. (2009). The effects of EGCG on fat oxidation and endurance performance in male cyclists. Int. J. Sport Nutr. Exerc. Metab.19 : 624 – 44 .
27. Eichenberger P., Mettler S., Arnold M., et al. (2010). No effects of three-week consumption of a green tea extract on time trial performance in endurance trained men. Int. J. Vitam. Nutr. Res. 80:54 – 64 .
28. Murase T., Haramizu S., Shimotoyodome A., et al. (2006). Green tea extract improves running endurance in mice by stimulating lipid utilization during exercise. Am. J. Physiol. Regul. Integr. Comp. Physiol. 290:R1550–6 .
29. Richards J.C., Lonac M.C., Johnson T.K., et al. (2010). Epigallocatechin-3-gallate increases maximal oxygen uptake in adult humans. Med. Sci. Sports Exerc. 42:739 – 44.
30. Panza V.S., Wazlawik E., Ricardo Schütz G., et al. (2008). Consumption of green tea favorably affects oxidative stress markers in weight-trained men. Nutrition. 24:433– 42 .
31. Di Giacomo C., Acquaviva R., Sorrenti V., et al. (2009). Oxidative and antioxidant status in plasma of runners: effect of oral supplementation with natural antioxidants. J. Med. Food.12:145–50 .
32. Bloomer R. J., Goldfarb A.H., McKenzie M.J. (2006). Oxidative stress response to aerobic exercise: comparison of antioxidant supplements. Med. Sci. Sports Exerc. 38:1098– 105.
33. Trombold J.R., Barnes J.N., Critchley L., et al. (2010). Ellagitannin consumption improves strength recovery 2–3 d after eccentric exercise. Med. Sci. Sports Exerc. 42:493 – 8 .
34. Nieman D. C. (2010). Quercetin’s bioactive effects in human athletes. Curr. Topic. Nutraceut. Res. 8:33– 44 35. Nieman D.C., Henson D.A., Gross S.J., et al. (2007). Quercetin reduces illness but not immune perturbations after intensive exercise. Med. Sci. Sports Exerc. 39:1561– 9.
36. Nieman D.C., Williams A.S., Shanely R.A, et al. (2010). Quercetin’s influence on exercise performance and muscle mitochondrial biogenesis. Med. Sci. Sports Exerc. 42:338 – 45 .
37. Cureton K.J., Tomporowski P.D., Singhal A., et al. (2009). Dietary quercetin supplementation is not ergogenic in untrained men. J. Appl. Physiol. 107 : 1095 – 104 .
38. Nieman D.C., Henson D.A., Davis J.M., et al. (2007). Quercetin ingestion does not alter cytokine changes in athletes competing in the Western States Endurance Run. J. Interferon Cytokine Res.27:1003–11 .
39. Nieman D.C., Henson D.A., Maxwell K.R., et al. (2009). Effects of quercetin and EGCG on mitochondrial biogenesis and immunity. Med. Sci. Sports Exerc. 41 : 1467 – 75 .
40. MacRae H.S., Mefferd K.M. (2006). Dietary antioxidant supplementation combined with quercetin improves cycling time trial performance. Int. J. Sport Nutr. Exerc. Metab. 16 : 405 – 19 .
41. Skarpanska-Stejnborn A., Pilaczynska-Szczesniak L., Basta P., et al. (2009). The influence of supplementation with Rhodiola rosea L. extract on selected redox parameters in professional rowers. Int. J. Sport Nutr. Exerc. Metab. 19:186–99 .
42. Beavers K. M., Serra M.C., Beavers D.P., et al. (2010). Soy and the exercise-induced inflammatory response in postmenopausal women. Appl. Physiol. Nutr. Metab. 35:261–9 .
43. Kok L., Kreijkamp-Kaspers S., Grobbee D.E., et al. (2005). Soy isoflavones, body composition, and physical performance. Maturitas. 52:102–10 .
44. Lenn J., Uhl T., Mattacola C., et al. (2002). The effects of fish oil and isoflavones on delayed onset muscle soreness. Med. Sci. Sports Exerc. 34:1605 – 13 .
45. Chen C..Y, Bakhiet R.M., Hart V., et al. (2005). Isoflavones improve plasma homocysteine status and antioxidant defense system in healthy young men at rest but do not ameliorate oxidative stress induced by 80% VO2peak exercise. Ann. Nutr. Metab. 49:33 – 41.