Rol del Ejercicio Submáximo en la Promoción de la Acumulación de Creatina y Glucógeno en el Músculo Esquelético
Tristan M Robinson1, Dean A Sewell1, Eric Hultman1 y Paul L Greenhaff1
Artículo publicado en el journal PubliCE, Volumen 0 del año 1999.
Publicado 5 de noviembre de 2003
Resumen
Palabras clave: fosfocreatina, insulina, carbohidrato, fatiga
INTRODUCCION
La creatina muscular total (TCr) se incrementa como resultado de la suplementación con creatina (23, 25). Este incremento ha sido asociado a una mejora del rendimiento en el ejercicio de máxima intensidad y corta duración (20) y a una aceleración en la velocidad de resíntesis de fosfocreatina durante la recuperación del ejercicio máximo (19). En estas investigaciones se observó que los sujetos que poseían una concentración de TCr inicial ([TCr]) cercana o menor a 120 mmol/kg de peso seco mostraban el mayor incremento en la acumulación de TCr muscular durante la suplementación. Además, fue específicamente en estos sujetos en quienes se observó una marcada mejora del rendimiento y una velocidad acelerada en la resíntesis de PCr después de la suplementación (7, 19).
Se ha demostrado que la insulina, en concentraciones suprafisiológicas, incrementa el consumo de Cr en las células del músculo esquelético de la rata ex vivo (24) y que previene la pérdida de Cr en el músculo esquelético de rata dañado por radiación in vivo (28). También se ha demostrado recientemente que las concentraciones suprafisiológicas de insulina estimulan el consumo de Cr en la célula del mioblasto de un ratón. En humanos, se demostró que la retención de Cr en el músculo, así como en todo el cuerpo está incrementada cuándo se ingieren grandes cantidades de carbohidratos simples (CHO; ~ 95% de azúcares simples) junto a la creatina (14, 17). Se sugirió que esta respuesta era atribuible a la liberación de insulina mediada por la glucosa, estimulando un incremento en el transportador muscular de Cr dependiente de Na+. Se demostró más recientemente, que también se requieren concentraciones altas o suprafisiológicas de insulina para aumentar la acumulación de creatina en humanos (41).
Se sugirió también que el ejercicio submáximo realizado inmediatamente antes de la ingesta de Cr incrementa el consumo muscular de Cr (23). Cinco sujetos realizaron 1 h de un ejercicio con una sola pierna en la mañana de cada día en la que fueron suplementados con creatina. Tres de los cinco sujetos ingirieron 30 gr de Cr cada día durante 4 días, otro ingirió la misma cantidad por 7 días, y el otro ingirió 20 g de Cr cada día durante 3.5 días. Al final del período de suplementación, los autores reportaron que la [TCr] fue significativamente mayor (~9%) en la pierna que se ejercitó que en la pierna que no se ejercitó. Se postuló que este efecto pudo haberse causado por un incremento en el flujo sanguíneo a la pierna inducido por el ejercicio, produciendo un aumento en la liberación de Cr, o por un cambio en la cinética del transportador muscular de creatina. Es importante destacar, sin embargo, que las diferencias observadas entre las piernas fueron relativamente pequeñas y altamente variables entre individuos. Además, la mayor acumulación de creatina muscular inducida por el ejercicio fue observada en dos sujetos vegetarianos. La evidencia preliminar indica que la magnitud de la retención de Cr muscular durante la suplementación con creatina es, al menos al inicio, marcadamente mayor en sujetos vegetarianos comparados con no vegetarianos (15). Podría parecer entonces que el bajo número de sujetos, la variación en el protocolo de suplementación, y la inclusión de vegetarianos en el estudio de Harris et al. (23) no proveyó una clara visión respecto al efecto del ejercicio sobre la acumulación de creatina muscular. Se ha reportado que la suplementación con Cr durante 10 días, combinada con entrenamiento, produce mejoras del rendimiento en carreras de alta intensidad en ratas (6). Aunque no se observaron diferencias en la concentración de creatina muscular ([Cr]) entre las ratas que estaban entrenadas y suplementadas con creatina y aquellas que estaban desentrenadas y suplementadas con creatina, se sugirió que las mejoras del rendimiento en el primer grupo fueron atribuibles a cambios en los depósitos de Cr+PCr muscular y a un aumento de la actividad de la citrato sintetasa muscular. Es necesario, por ello, examinar más detalladamente la influencia del ejercicio sobre la acumulación de Cr muscular.
En el estudio de Green et al. (14), se observó que el consumo de CHO con Cr resultó en un mayor incremento de la masa corporal respecto a los individuos que consumieron Cr sola. Otras investigaciones de este régimen de suplementación revelaron una correlación significativa entre la cantidad de glucógeno muscular y la acumulación de creatina después de la suplementación con Cr+CHO (r =0.75, n =8, P<0.05), lo cual no fue evidente cuándo la Cr o los CHO fueron consumidos individualmente. La disponibilidad de glucógeno muscular es un determinante principal del rendimiento en los ejercicios de resistencia (2). El método corriente para el incremento de las reservas de glucógeno muscular se realiza mediante “la carga de glucógeno”, la cual incluye clásicamente el vaciamiento de glucógeno muscular usualmente realizado mediante el ejercicio, seguido de una dieta con alto contenido de CHO durante varios días (e.g. 3, 39). Métodos cómo este pueden incrementar la concentración de glucógeno muscular entre el 150 y 200% por encima de los niveles normales en reposo. Esta respuesta ha sido atribuida a un incremento en la actividad de la glucógeno sintetasa en el periodo posterior al ejercicio y a un aumento de la sensibilidad a la insulina inducida por el ejercicio en los músculos vaciados de glucógeno (3). Sobre las bases de la relación observada, entre la acumulación de Cr y glucógeno durante la suplementación con Cr+CHO, nos interesaba investigar cómo la respuesta de supercompensación de glucógeno puede estar incrementada por la ingesta de creatina.
Por este motivo, el propósito principal del presente estudio, fue examinar varios de los factores propuestos que incrementan la acumulación de creatina en humanos. Usando un modelo de ejercicio de ciclismo con una pierna, nosotros intentamos determinar como el ejercicio incrementa la acumulación de creatina muscular, y si lo hizo, como esta respuesta estuvo restringida a los músculos ejercitados y cómo ésta estuvo influenciada por el incremento en el flujo sanguíneo inducido por el ejercicio. En un intento por estimular el transporte de Cr mediado por la insulina, el CHO fue administrado con Cr, lo que también nos proveyó la oportunidad de examinar la relación ulterior entre la acumulación de Cr y glucógeno muscular observada durante la suplementación con Cr+CHO.
METODOS
Catorce hombres saludables [edad 23±1 (DS) años, índice de masa corporal 22±0.5 kg/m2)] participaron voluntariamente en el presente estudio, el cual fue aprobado por el Comité de Ética de la Escuela de Medicina de la Universidad de Nottinham. Antes de comenzar la investigación, todos los sujetos dieron un informe consentimiento por escrito, y se realizaron mediciones fisiológicas y análisis sanguíneos. Todos los sujetos fueron moderadamente activos, y ninguno era altamente entrenado.
Protocolo y Tratamiento de Grupo
Los sujetos se reportaron al laboratorio en la mañana del estudio después de una noche de ayuno, estando privados del consumo de alcohol y de la práctica de ejercicio intenso durante las 48 hs previas al estudio.
Posteriormente, los sujetos en pares realizaron ciclismo estacionario con una sola pierna en un cicloergómetro, un sujeto de cada lado del ergómetro, de modo que cada uno soportaba su propio peso con la pierna contralateral (3). Se mantuvo una cadencia de pedaleo de 70 rpm, y los sujetos trabajaron en contra de una carga predeterminada que elevó sus frecuencias cardiacas entre 160 y 170 latidos/min. Se permitió el consumo libre de agua a lo largo del ejercicio. Los sujetos continuaron pedaleando hasta llegar cerca del agotamiento, cuándo se les permitió descansar por un máximo de 5 minutos. Esto fue seguido por períodos cortos de ciclismo y descanso hasta que la cadencia requerida no podía ser mantenida por más de dos minutos, o hasta que un sujeto decidiera no continuar. Si un sujeto se ejercitaba por más tiempo del que lo hizo su compañero, un investigador continuaba pedaleando en lugar del sujeto que abandonó la prueba. Durante el agotamiento, los sujetos descansaron en posición supina sobre una colchoneta en dónde se obtuvo una biopsia muscular (post-ejercicio) del vasto lateral de la pierna agotada (Ex) y no agotada (Nex) usando la técnica de biopsia por succión (1). También se obtuvieron posteriores muestras musculares de las piernas de cada sujeto 6 h después del agotamiento y 5 días más tarde. Después de la primera biopsia muscular se insertó una sonda en la vena cubital anterior del brazo de los sujetos, obteniéndose muestras de 8 ml de sangre a intervalos de 20 minutos durante un periodo de 100 minutos. La sonda se mantuvo abierta durante el periodo de muestreo usando un goteo de solución salina isotónica.
Después del ejercicio, los sujetos fueron asignados aleatoriamente dentro de dos grupos de tratamiento dietario. El grupo CHO se constituyó de siete sujetos (edad 24±2 años, índice de masa corporal 21.3±0.3 kg/m2). Durante las 6 h iniciales de recuperación del ejercicio, cada sujeto ingirió una bebida caliente sin azúcar, seguida inmediatamente por 500 ml de una solución con CHO disponible comercialmente (Lucozade, ~18.5% de glucosa y azúcares simples; SmithKline Beecham, Coleford, UK) durante tres ocasiones separadas, cómo se describe posteriormente.
El grupo Cr+CHO se constituyó de siete sujetos (edad 23 ±2 años, índice de masa corporal 22.5±08 kg/m2). Durante las 6h iniciales de la recuperación del ejercicio cada sujeto consumió 5 g de monohidrato de creatina en polvo (Experimental and Applied Sciences, Golden, CO) disueltos en una bebida caliente sin azúcar, seguido inmediatamente por 500 ml de Lucozade durante tres ocasiones separadas, como se describe posteriormente.
El primer suplemento fue ingerido inmediatamente después de la recolección de la muestra de sangre post-ejercicio (min 0), lo que ocurrió dentro de los 30 min después del final del ejercicio y de la muestra de biopsia muscular post-ejercicio. En el periodo de 6h de recuperación del ejercicio, antes de extraer más muestras musculares, los sujetos ingirieron dos dosis adicionales de su suplemento respectivo a intervalos de 2 h (i.e., 2 y 4 h después de la dosis inicial). Además de esto, todos los sujetos consumieron una pequeña comida, con un contenido de ~70 µg de CHO por comida, 1 h después de las dosis de suplementación 2 y 3 (i.e., 3 y 5 h después de la dosis inicial).
Los sujetos repitieron la ingesta de los suplementos cuatro veces por día durante otros 4 días. Además de los suplementos todos los sujetos consumieron una dieta de alto contenido de CHO (contribuyendo los CHO >80% de la ingesta nutricional diaria), que les ha sido suministrada por los investigadores. Durante este período los sujetos continuaron con todas sus actividades diarias normales, excluyendo al ejercicio intenso.
Muestras musculares tratamiento y análisis
Después de haber sacado las muestras musculares de las piernas cada muestra permaneció a temperatura ambiente durante 1 minuto para permitir que la concentración de PCr ([PCr]) retorne a un nivel normal antes de ser congelada en nitrógeno liquido, esto se debe a que la PCr decrece debido a los procesos de producción de energía asociados con el procedimiento de biopsia (40). Para los análisis las muestras fueron deshidratadas por congelación, la grasa fue extraída utilizando alcohol de petróleo, se removió la sangre y el tejido conectivo visible, y la muestra fue posteriormente pulverizada. Las muestras fueron subsiguientemente analizadas para [glucógeno], concentración de ATP ([ATP]), [PCr], y [Cr] libre. Se reportó la [Cr] total como la suma de [PCr] y [Cr]. El glucógeno y las concentraciones de metabolitos fueron corregidos para los constituyentes no musculares usando [ATP] muscular (23).
Tratamiento y Análisis de las Muestras de Sangre
Se ha observado previamente que el ejercicio exhaustivo, como aquel empleado durante la “carga de glucógeno”, puede resultar en una disminución de la respuesta de la insulina a la ingesta de glucosa (5, 13, 27). Para comprobar si esto ocurrió en la presente investigación, el protocolo de muestras de sangre fue repetido durante una visita separada para evaluar la respuesta de los sujetos a los suplementos ingeridos sin realizar el ejercicio. La concentración total de glucosa fue medida usando un analizador automático (Hemocue, Ägelhom, Sweden), y la [insulina] sérica fue medida usando un equipo de diagnóstico de radioinmunoensayo disponible comercialmente (Diagnostic Products, Los Angeles, CA).
Análisis Estadísticos
Se condujo un análisis de varianza a dos vías para mediciones repetidas entre los grupos y entre las piernas de los sujetos dentro de cada grupo. Dónde fue apropiado, las diferencias significativas fueron localizadas mediante un test post hoc apropiado. La significancia fue establecida en P<0.05, y los valores en el texto y en los datos adicionales están descriptos como medias ±DS.
RESULTADOS
Los sujetos reportaron obediencia con todos los aspectos del protocolo y no reportaron ningún efecto colateral de la suplementación. No hubo cambios significativos en la masa corporal en el grupo CHO después de 5 días de suplementación; sin embargo, la masa corporal del grupo Cr+CHO se incremento significativamente (antes de la suplementación 72.8±4.6 kg, luego de la suplementación 73.8±4.6 kg; P<0.05).
Metabolitos Musculares y Cambios en los Substratos
No se observó cambio en la [ATP] muscular en la piernas de ningún grupo a lo largo del estudio (Tabla 1).
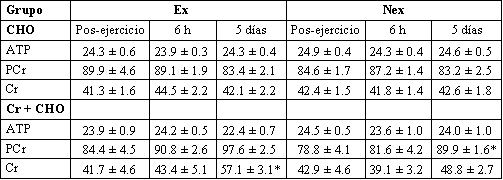
Tabla 1. Concentraciones de los metabolitos en las piernas agotada y no
agotada en los tratamientos CHO y Cr+CHO inmediatamente después del ejercicio
con una pierna y 6 h y 5 días después de la suplementación. Los valores están
presentados como medias±DS, n =7 sujetos por grupo. CHO: carbohidratos; Cr:
creatina; Ex pierna agotada: Nex: pierna no agotada; PCr: fosfocreatina. Los
paréntesis denotan concentración. * Significativamente diferente de la
concentración posterior al ejercicio, P<0.05.
No se observaron cambios significativos en la [TCr] muscular en las piernas Ex y Nex en ninguno de los dos grupos 6 h después del ejercicio con una pierna (Figura 1) o en las piernas del grupo CHO después de 5 días (Figura 1A). Hubo un incremento significativo en la [TCr] muscular en la pierna Ex (23% de incremento; P<0.001) y la pierna Nex (14% de incremento, P<0.05) del grupo Cr+CHO después de 5 días de suplementación, la pierna Ex tubo una acumulación un 68% mayor (P<0.01; Figura 1B).
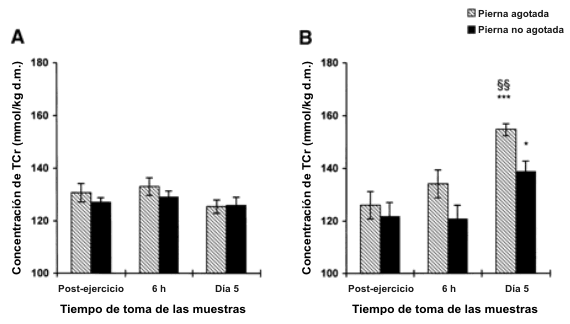
Figura 1. Concentraciones de la creatina muscular total. A: resultados de la
pierna Ex y Nex para el grupo carbohidratos (CHO) luego del ejercicio con una
sola pierna (Posex) y 6 h y 5 días después de la suplementación con CHO. d.m.,
Músculo seco. B: resultados de las piernas Ex y Nex del grupo Cr+CHO luego del
ejercicio con una sola pierna y 6h y 5 días después del consumo de CR+CHO. Los
valores están presentados como medias±DS. Significativamente diferente de la
concentración posterior al ejercicio: * P<0.05, *** P<0.001. Diferencia
significativa entre las piernas Ex y Nex después de 5 días de suplementación, §§
P<0.01.
De acuerdo con los cambios en la [TCr], no se observaron cambios en la [PCr] o [Cr] en las piernas del grupo CHO en ningún momento. Un incremento significativo en la [PCr] se observó en las piernas Nex del grupo Cr+CHO después de 5 días de suplementación (Tabla 1), y también hubo un incremento significativo en la [Cr] en las piernas Ex de este grupo (todas P<0.05). No se observaron cambios significativos en la [PCr] en la pierna Ex después de 5 días.
El protocolo de ejercicio depletó casi completamente el glucógeno en las piernas Ex de los grupos CHO y Cr+CHO (hasta un 8 y 5% de la concentración medida en la pierna Nex después del ejercicio, respectivamente; P<0.001; Figura 2). La [glucógeno] muscular en la pierna Nex después del período de ejercicio fue usada como una medición de la [glucógeno] inicial en la pierna Ex, como fue demostrado previamente este protocolo de ciclismo con una sola pierna no afecta la [glucógeno] muscular en la pierna que soporta el peso durante el ejercicio (8).
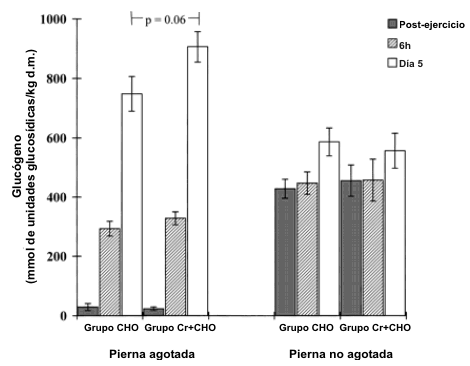
Figura 2. Concentraciones de glucógeno muscular en las piernas Ex y Nex
luego del ejercicio de una sola pierna y 6 h y 5 después de la suplementación
con CHO o Cr+CHO.
Seis horas después de la ingesta del primer suplemento, el glucógeno fue restituido en la pierna Ex hasta el 69 y 73% de la [glucógeno] de la pierna Nex en los grupos CHO y Cr+CHO, respectivamente, pero no hubo diferencias entre grupos (Figura 2). Después de 5 días de suplementación, la [glucógeno] se ha incrementado dramáticamente de la concentración post-ejercicio medida en la pierna Ex de los grupos CHO y Cr+CHO (ambos P<0.001; Figura 2). Además, la magnitud de este incremento fue un 23% mayor en el grupo Cr+CHO (P=0.06), de manera tal que estuvo muy cerca de ser alcanzada una diferencia significativa en la [glucógeno] entre grupos estuvo (P=0.06).
La [glucógeno] en la piernas Nex para ambos grupos permaneció sin cambios 6 h después de la ingesta, pero estuvo incrementada después de 5 días de suplementación (grupo CHO, P<0.01; grupo Cr+CHO, P<0.05). Sin embargo, no hubo diferencias en la concentración de glucógeno entre grupos (Figura 2).
Glucosa sanguínea y cambios en la insulina
No hubo diferencias entre grupos en la concentración de glucosa o en las respuestas de la [insulina] sérica (Figura 3) en ningún momento durante los 100 minutos iniciales de la ingesta post-suplementación. La comparación de estas respuestas con las mediciones correspondientes realizadas en la condición de no ejercicio mostraron que la [insulina] sérica en el estado posterior al ejercicio en ambos grupos fue significativamente menor durante los primeros 40 minutos después de la ingesta del suplemento (Figura 3).

Tabla 2. Concentraciones de glucosa sanguínea total de los grupos CHO y
Cr+CHO durante los 100 minutos posteriores a la ingesta de 500 ml de una
solución con CHO, bajo la condición de no ejercicio y después del ejercicio
exhaustivo de ciclismo con una sola pierna. Los valores están presentados como
medias ±DS; n =7 sujetos por grupo. No se observaron diferencias en las
respuestas entre grupos durante ningún período de recolección. Diferencias
significativamente diferentes de las concentraciones post-ejercicio dentro de
los grupos: AP<0.05, B P<0.01. Significativamente
diferente de la concentración inicial (0 min) dentro del grupo: C
P<0.05, D P <0.01, E P<0.001.
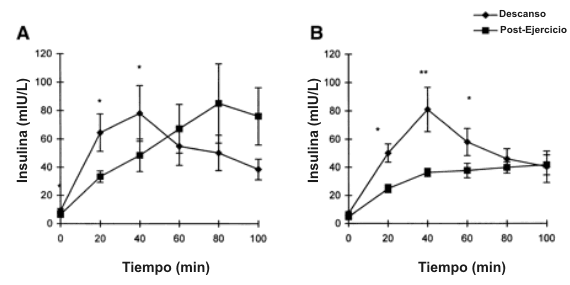
Figura 3. Concentraciones de insulina sérica. A: resultados del grupo CHO
estando los sujetos en reposo y después del ejercicio exhaustivo en respuesta a
la ingesta de una solución de 500 ml de CHO (~90 g CHO). Significativamente
diferente de la concentración posterior al ejercicio, * P<0.05. B: resultados de
los sujetos del grupo Cr+CHO en reposo y después del ejercicio exhaustivo en
respuesta a la ingesta de 5 g de monohidrato de Cr y 500 ml de una solución de
CHO. Significativamente diferente de la concentración posterior al ejercicio: *
P<0.05 y ** P<0.01.
DISCUSION
El hallazgo principal del presente estudio fue la diferencia encontrada en la [TCr] entre las piernas Ex y Nex en el grupo Cr+CHO, después de 5 días de suplementación. Esto demuestra que una serie de ejercicio exhaustivo antes de la suplementación puede aumentar marcadamente la acumulación de Cr muscular y que esta respuesta está restringida al músculo ejercitado, éste es un hallazgo que puede ser importancia práctica. La presente observación avala la indicación de Harris et al. (23) acerca de que el ejercicio puede aumentar la acumulación de Cr muscular. En su investigación, los autores propusieron que el ejercicio incrementa el consumo de Cr muscular mediante el aumento del flujo sanguíneo al músculo ejercitado durante el período posterior al ejercicio o a través del aumento de la cinética del transportador muscular de Cr. Los autores sugirieron que el incremento del flujo sanguíneo al músculo ejercitado pudo maximizar la exposición de ese músculo a la [Cr] para realizar su transporte por encima de la constante de Michaelis. Sin embargo, aunque el fluido sanguíneo al músculo no fue medido en la presente investigación, nosotros creemos que fue improbable que un aumento en el flujo sanguíneo después del ejercicio haya sido responsable del mayor contenido de Cr en la pierna Ex en el presente estudio. Esta controversia está avalada, primero por la baja diferencia en la [TCr] entre las piernas después de 6 h de suplementación, cuándo las diferencias en el flujo sanguíneo a las piernas se supone que está en su máximo nivel. Segundo, la evidencia demuestra que la constante de Michaelis para el transporte de Cr muscular es substancialmente menor (20-110 µmol/l; 30, 36, 37) que el valor de 500 µmo/l propuesto por Fitch y Shields (12), y citado por Harris et al. (23), lo cual hace que sea poco probable que la disponibilidad de Cr pueda limitar el transporte usando regímenes convencionales de suplementación con Cr.
El transporte de Cr al interior de la célula es dependiente de la presencia de Na+ extracelular (10). Un transportador específico de Cr, el que se encuentra altamente expresado en el músculo esquelético, ha sido identificado y clonado (21, 33, 36). En el presente estudio después de 5 días de suplementación de Cr+CHO, hubo un 11% de diferencia en la [TCr] entre las piernas Ex y Nex. Dado que ambas piernas estuvieron expuestas a la misma concentración de [Cr] plasmática durante 5 días de suplementación, es posible que el ejercicio haya aumentado la acumulación de Cr mediante el incremento de la máxima velocidad del transporte de Cr a la pierna ejercitada. En efecto, se ha demostrado que el ejercicio incrementa el transporte de otros aminoácidos (4), lo cual ha sido sugerido ser sólo parcialmente dependiente del aumento del flujo sanguíneo al músculo (42). Un aumento del transporte de Cr muscular inducido por el ejercicio pudo haber ocurrido a través de varios de mecanismos aún desconocidos. Por ejemplo. Odoom et al. (37) han sugerido que un incremento en la máxima velocidad de transporte de Cr puede ocurrir como resultado de un efecto alostérico sobre el transporte en sí mismo, mediante el restablecimiento o síntesis de nuevos transportadores, o mediante la producción de cambios en las fuerzas de conducción del transporte de Cr. Avalando la sugerencia anterior, se ha propuesto que la mayor parte del transporte de Cr es logrado por un sistema co-transportador de Na+-Cr (30, 37), el que hace uso de las bombas de Na+–K+ del sarcolema. Se ha sugerido que la actividad total de la bomba de Na+-K+ del sarcolema puede estar incrementada tanto por, un aumento en la actividad intrínseca de la bomba o por una ganancia neta en el número de bombas (9). Se ha demostrado que el entrenamiento produce aumentos en el número de bombas de Na+-K+, las que atenúan la pérdida de K+ del músculo durante el ejercicio subsiguiente (34, 35). Green y colegas (18) han demostrado en humanos que el entrenamiento de suficiente intensidad y duración (2 h/día, 65% del máximo consumo de oxígeno, durante 6 días) puede incrementar la concentración de bombas de Na+-K+ dentro de la primer semana de entrenamiento. Adicionalmente, se demostró en ratas que una sola serie de ejercicio de carrera puede incrementar la concentración muscular de algunas subunidades de bombas de Na+-K+ en el sarcolema y también elevar los niveles de ARNm para subunidades de bombas de Na+-K+ adicionales (43). Es por ello posible que en el presente estudio un sola serie de ejercicio exhaustivo haya producido un incremento de la función de la bomba Na+-K+ en la pierna Ex que facilitó el transporte de Cr. En sustento de esta conclusión, esta el hallazgo de que la activación farmacológica y la inhibición de la actividad de la bomba Na+-K+ en las células del mioblasto del ratón fueron paralelas a un aumento y a una disminución de la regulación de la acumulación celular de Cr (37).
La actividad de la bomba de Na+-K+ ATPasa en el músculo esquelético también está influenciada por la insulina (26, 32). Se ha demostrado que la abundancia de algunas subunidades de bombas en la membrana del músculo se incrementan con la exposición aguda a la insulina, más preferentemente mediante el reclutamiento a partir de los compartimientos intracelulares. Es verosímil que este cambio contribuya al incremento en la acumulación de Cr, que es observado cuándo el CHO se ingiere con la Cr (14). Permanece por ser analizada cualquier interacción existente entre el aumento de la actividad total de la bomba inducida por el ejercicio y la insulina.
La acumulación de la TCr en el músculo Ex en el presente estudio (28.6±4.8 mmol/kg de músculo seco) no fue superior cuándo se comparó con la magnitud de la acumulación previamente observada en sujetos que no realizaron ejercicio y que consumieron Cr sola (25 mmol/kg de músculo seco; 14). Además, la magnitud de la acumulación de la TCr en el músculo Nex del grupo Cr+CHO (17.0±4.7 mmol/kg de músculo seco), aunque estuvo significativamente elevada de su concentración inicial, fue notablemente menor a la conseguida previamente en individuos que no realizaron ejercicio y recibieron el mismo suplemento (14). Dada la respuesta disminuida de la insulina a la ingesta de CHO orales después del ejercicio exhaustivo observada en el presente estudio, este hallazgo también sostiene indirectamente un rol de la insulina en la promoción del transporte de Cr. Específicamente, puede esperarse que la disminución del efecto de los CHO en la liberación de insulina a causa del ejercicio observado en el presente estudio (Figura 3), afecte negativamente la estimulación del transporte de Cr muscular mediado por la insulina, particularmente debido a que recientes trabajos han demostrado que altas concentraciones fisiológicas de insulina son requeridas para estimular la acumulación de Cr en humanos (41). Este fenómeno es de importancia práctica en términos de optimizar la acumulación de TCr durante la suplementación; i.e.; los individuos que desean maximizar el transporte de creatina al músculo mediante el consumo de CHO deberían abstenerse de realizar ejercicio exhaustivo o prolongado durante el período de suplementación.
Este estudio encontró que combinando la ingesta de Cr y CHO con un ejercicio previo que vacía las reservas de glucógeno se aumentó la resíntesis de glucógeno durante la recuperación y, de forma similar a la acumulación de Cr, esta respuesta estuvo restringida al músculo ejercitado. Esta es la primera documentación de esta respuesta en humanos. Además, este incremento de la [glucógeno] fue de una magnitud que uno puede considerar suficiente para producir una mejora significativa del rendimiento en el ejercicio de resistencia. Green et al. (16) demostraron un mayor pico de la [insulina] después de la ingesta de Cr+CHO, comparada con la ingesta de solo CHO y también demostraron una relación significativa entre la acumulación de Cr muscular y la acumulación de glucógeno (r =0.75, n =8, P<0.05) después de 5 días de suplementación en individuos que no realizaron ejercicios. En el presente estudio, no hubo diferencias significativas en la respuesta de la insulina estimulada por la glucosa entre grupos después del ejercicio. Sin embargo, se supone que la cantidad de vaciamiento de glucógeno producido por el presente estudio haya estimulado a la resíntesis de glucógeno independientemente de la insulina durante la mayor parte del período inicial de recuperación (38). Por ello, el efecto de la disminución de la [insulina] circulante observada después del ejercicio pudo haber sido, al menos en términos de síntesis de glucógeno, insignificante durante la fase temprana de resíntesis. Sin embargo, en el presente estudio, la clara falta de un efecto de la Cr+CHO sobre la acumulación de glucógeno en la pierna Nex después de 6 h y 5 días de recuperación va en contra de que un incremento en la disponibilidad de insulina sea responsable del aumento de la resíntesis de glucógeno. Presumiblemente uno podría haber esperado ver un incremento de la [glucógeno] en ambas piernas después de la ingesta de Cr+CHO, aunque en menor cantidad la pierna Nex, si este mecanismo hubiera estado en funcionamiento.
Recientemente se reportó que la síntesis de glucógeno muscular está modulada por los cambios en el volumen de la célula (31). El crecimiento de los miotubos principales de las ratas inducido osmoticamente incrementó la síntesis de glucógeno independientemente de los cambios en el consumo de glucosa. Se ha demostrado que la suplementación con Cr en humanos incrementa la masa corporal (e.g., 20), en particular la masa magra (11, 29), y también se ha demostrado que incrementa el contenido de agua corporal durante el período de suplementación (11). Si la acumulación de Cr muscular puede causar un crecimiento muscular, es posible que la mayor acumulación de Cr en la pierna Ex del grupo Cr+CHO produjo un mayor volumen de la célula muscular que en la pierna correspondiente del grupo CHO, contribuyendo por ello a la mayor concentración de glucógeno en el grupo Cr+CHO después de 5 días de suplementación. Tal respuesta también podría explicar, al menos en parte, la carencia de un efecto de la Cr+CHO en la síntesis de glucógeno de la pierna Nex, dónde la acumulación de Cr estuvo marcadamente disminuida a la observada previamente después de la ingesta de Cr+CHO (14).
En conclusión, el ejercicio exhaustivo incrementó la subsiguiente acumulación de Cr en el músculo ejercitado a través de mecanismos aún no determinados. Este efecto estuvo restringido al propio músculo ejercitado y aparentemente no se debe a un aumento del flujo sanguíneo al músculo. El ejercicio exhaustivo disminuyó la liberación de insulina estimulada por la glucosa, sin embargo, por ello atenuó cualquier incremento en la acumulación de Cr debida a la ingesta de CHO. Finalmente, la suplementación de Cr+CHO después de un ejercicio que vació el glucógeno aumentó la resíntesis de glucógeno en el músculo ejercitado, este incremento puede ser considerado como suficiente para mejorar el rendimiento en los ejercicios de resistencia.
Agradecimientos
Este trabajo fue subencionado en gran parte por la Experimental and Applied Sciences, Golden, CO.
Notas Al Pie
Dirección para el pedido de reimpresiones y otras correspondencias: T. Robinson, School of Biomedical Sciences (Floor E), Univ. of Nottingham Medical School, Queens Medical Centre, Nottingham, NG7 2UH, UK.
Referencias
1. Biolo, G., S. P. Maggi, B. D. Williams, K. D. Tipton, and R. R. Wolfe (1995). Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am. J. Physiol. 268 (Endocrinol. Metab. 31): E514-E520
2. Bloom, S., R. Johnson, D. Park, M. Rennie, and W. Sulaiman (1976). Differences in metabolic and hormonal response to exercise between racing cyclists and untrained individuals. J. Appl. Physiol. 258: 1-18
3. Brannon, T. A., G. R. Adams, C. L. Conniff, and K. M. Baldwin (1997). Effects of creatine loading and training on running performance and biochemical properties of rat skeletal muscle. Med. Sci. Sports Exerc. 29: 489-495
4. Casey, A., S. Howell, D. Constantin-Teodosiu, E. Hultman, and P. L. Greenhaff (1996). Effect of creatine supplementation on muscle metabolism and exercise performance. Am. J. Physiol. 271 (Endocrinol. Metab. 34): E31-E37
5. Casey, A., A. H. Short, E. Hultman, and P. L. Greenhaff (1995). Glycogen resynthesis in human muscle fibre types following exercise-induced glycogen depletion. J. Physiol. (Lond.) 483: 265-271
6. Clausen, T (1996). The Na+, K+ pump in skeletal muscle: quantification, regulation and functional significance. Acta Physiol. Scand. 156: 227-235
7. Daly, M. M. and S. Seifter (1980). Uptake of creatine by cultured cells. Arch. Biochem. Biophys. 203: 317-324
8. entowski, A, B. H. Opaszowski, D. Blachnio, and B. Polanowski (1997). Effect of creatine supplementation on the performance in supramaximal, intermittent exercise. Biology Sport 14: 291-298
9. itch, C. D., and R. P. Shields (1966). Creatine metabolism in skeletal muscle. J. Biol. Chem. 241: 3611-3614
10. Galbo, H (1985). The hormonal response to exercise. Proc. Nutr. Soc. 44: 257-266
11. Green, A. L., E. Hultman, I. A. MacDonald, D. A. Sewell, and P. L. Greenhaff (1996). Carbohydrate ingestion augments skeletal muscle creatine accumulation during creatine supplementation in humans. Am. J. Physiol. 271 (Endocrinol. Metab. 34): E821-E826
12. Green, A. L., I. A. Macdonald, and P. L. Greenhaff (1997). The effects of creatine and carbohydrate ingestion on whole-body creatine retention in vegetarians (Abstract). Proc. Nutr. Soc. 56: 81A
13. Green, A. L., D. A. Sewell, L. Simpson, E. Hultman, I. A. Macdonald, and P. L. Greenhaff (1996). Creatine ingestion augments muscle creatine uptake and glycogen synthesis during carbohydrate feeding in man (Abstract). J. Physiol. (Lond.) 491: P63-P64
14. Green, A. L., E. J. Simpson, J. J. Littlewood, I. A. Macdonald, and P. L. Greenhaff (1996). Carbohydrate ingestion augments creatine retention during creatine feeding in humans. Acta Physiol. Scand. 158: 195-202
15. Green, H. J., E. R. Chin, M. Ball-Burnett, and D. Ranney (1993). Increases in human skeletal muscle Na+-K+-ATPase concentration with short-term training. Am. J. Physiol. 264 (Cell Physiol. 33): C1538-C1541
16. Guimbal, C., and M. W. Kilimann (1983). A Na+-dependent creatine transporter in rabbit brain, muscle, heart, and kidney. J. Biol. Chem. 268: 8418-8421
17. Harris, R. C., E. Hultman, and L. Nordesjo (1974). Glycogen, glycolytic intermediates and high-energy phosphates determined in biopsy samples of musculus quadriceps femoris of man at rest. Methods and variance of values. J. Clin. Lab. Invest. 33: 109-120
18. Haughland, R. B., and D. T. Chang (1975). Insulin effects on creatine transport in skeletal muscle. Proc. Soc. Exp. Biol. Med. 148: 1-4
19. Hundal, H. S., A. Marette, Y. Mitsumoto, T. Ramlal, R. Blostein, and A. Klip (1992). Insulin induces translocation of the 2 and 1 subunits of the Na+-K+-ATPase from intracellular compartments to the plasma membrane in mammalian skeletal muscle. J. Biol. Chem. 267: 5040-5043
20. Ivy, J. L., B. A. Frishberg, S. W. Farrell, W. J. Miller, and W. M. Sherman (1985). Effects of elevated and exercise-reduced muscle glycogen levels on insulin sensitivity. J. Appl. Physiol. 59: 154-159
21. Koszalka, T. R., and C. L. Andrew (1972). Effect of insulin on the uptake of creatine-1-14C by skeletal muscle in normal and X-irradiated rats. Proc. Soc. Exp. Biol. Med. 139: 1265-1271
22. Kreider, R. B., M. Ferreira, M. Wilson, P. Grindstaff, S. Plisk, J. Reinardy, E. Cantler, and A. L. Almada (1998). Effects of creatine supplementation on body composition, strength, and sprint performance. Med. Sci. Sports Exerc. 30: 73-82
23. Loike, J. D., M. Somes, and S. C. Silverstein (1986). Creatine uptake, metabolism and efflux in human monocytes and macrophages. Am. J. Physiol. 251 (Cell Physiol. 20): C128-C135
24. Low, S. Y., M. J. Rennie, and D. M. Taylor (1996). Modulation of glycogen synthesis in rat skeletal muscle by changes in cell volume. J. Physiol. (Lond.) 495: 299-303
25. Marette, A., J. Krischer, L. Lavoie, C. Ackerley, J.-L. Carpenter, and A. Klip (1993). Insulin increases the Na+-K+-ATPase 2-subunit in the surface of rat skeletal muscle: morphological evidence. Am. J. Physiol. 265 (Cell Physiol. 34): C1716-C1722
26. Mayser, W., P. Schloss, and H. Betz (1992). Primary structure and functional expression of a choline transporter expressed in the rat nervous system. FEBS Lett. 305: 31-36
27. McKenna, M. J., A. R. Harmer, S. F. Fraser, and J. L. Li (1996). Effects of training on potassium, calcium and hydrogen ion regulation in skeletal muscle and blood during exercise. Acta Physiol. Scand. 156: 335-346
28. McKenna, M. J., G. J. F. Heigenhauser, R. S. McKelvie, J. D. MacDougall, and N. L. Jones (1997). Sprint training enhances ionic regulation during intense exercise in men. J. Physiol. (Lond.) 501: 687-702
29. Nash, S. R., B. Giros, S. F. Kingsmore, J. M. Rochelle, S. T. Suter, P. Gregor, M. F. Seldin, and M. G. Caron (1994). Cloning, pharmacological characterisation, and genomic localisation of the human creatine transporter. Receptors Channels 2: 165-174
30. Odoom, J. E., G. J. Kemp, and G. K. Radda (1996). The regulation of total creatine content in a myoblast cell line. Mol. Cell. Biochem. 158: 179-188
31. Price, T. B., D. L. Rothman, R. Taylor, M. J. Avison, G. I. Shulman, and R. G. Shulman (1994). Human muscle glycogen resynthesis after exercise: insulin-dependent and -independent phases. J. Appl. Physiol. 76: 104-111
32. Sherman, W. M., and D. L. Costill (1984). The marathon: dietary manipulation to optimize performance. J. Sports Med. 12: 44-51
33. Steenge, G. R., J. Lambourne, A. Casey, I. A. Macdonald, and P. L. Greenhaff (1998). The stimulatory effect of insulin on creatine accumulation in human skeletal muscle. Am. J. Physiol. 275 (Endocrinol. Metab. 38): E974-E979
34. Tipton, K. D, and R. R. Wolfe (1998). Exercise-induced changes in protein metabolism. Acta Physiol. Scand. 162: 377-387
35. Tsakiridis, T., P. P. C. Wong, Z. Liu, C. D. Rodgers, M. Vranic, and A. Klip (1996). Exercise increases the plasma membrane content of the Na+-K+ pump and its mRNA in rat skeletal muscles. J. Appl. Physiol. 80: 699-705