Transiciones de Tipo de Fibra Muscular con el Entrenamiento Físico: Perspectivas Cambiantes
Muscle Fiber Type Transitions with Exercise Training: Shifting Perspectives
Daniel L. Plotkin1, Michael D. Roberts2, Cody T. Haun3 y Brad J. Schoenfeld1
1Health Sciences Department, CUNY Lehman College, Bronx, NY 10468, USA
2School of Kinesiology, Auburn University, Auburn, AL 36849, USA
3Fitomics, LLC., Pelham, AL 35124, USA
Artículo publicado en el journal Revista de Entrenamiento Deportivo, Volumen 1, Número 4 del año 2021.
Publicado 12 de octubre de 2021
Resumen
Palabras clave: fibras de contracción rápida, fibras de contracción lenta, entrenamiento de fuerza, entrenamiento de resistencia
Abstract
Keywords: fast-twitch fibers, slow-twitch fibers, strength training, endurance training
INTRODUCCIÓN
El músculo esquelético contiene una composición heterogénea de diferentes tipos de fibras que existen en un continium de lento a rápido, lo que hace que su función sea específica de la tarea. La identificación de la composición de la isoforma de la cadena pesada de miosina (MHC) es un enfoque viable para clasificar los tipos de fibras a lo largo de este espectro. Sin embargo, incluso entre fibras del mismo tipo, existen diferencias características estructurales y funcionales; por lo tanto, el tipo de MHC es un método algo crudo pero útil para clasificar los tipos de fibra en función de la relación entre el tipo de MHC y la función de la fibra. En los seres humanos, las fibras de tipo I, o de contracción lenta, poseen velocidades de contracción más lentas y son relativamente resistentes a la fatiga. Las fibras de tipo IIa, o fibras glucolíticas oxidativas rápidas (fast oxidative glycolytic, FOG), presentan velocidades de contracción más altas que las fibras de tipo I, pero son menos resistentes a la fatiga. Las fibras de tipo IIx, o fibras glucolíticas rápidas, poseen las velocidades de contracción más rápidas, pero son muy fatigables [1]. Estas características diferencian la utilidad respectiva de cada tipo de fibra en una variedad de contextos de la vida real [2] y, por lo tanto, son un área de gran interés tanto en poblaciones sanas como enfermas.
La capacidad de los tipos de fibra para pasar de lento a rápido y viceversa ha sido un tema de discusión e investigación siempre. Está bien establecido que la composición del tipo de fibra muscular de un individuo puede predecir relativamente el rendimiento deportivo, con una mayor proporción de fibras de tipo I que predicen el éxito en eventos más lentos y de mayor duración [3] y una mayor proporción de fibras de tipo II que predicen éxito en eventos de mayor velocidad y menor duración [4, 5]. Por lo tanto, el alcance y el contexto de la plasticidad del tipo de fibra tienen importantes implicaciones en el deporte y el entrenamiento. El propósito de este artículo es revisar las técnicas que se han utilizado comúnmente para cuantificar la distribución del tipo de fibra y resaltar sus respectivas fortalezas y debilidades. Además, exploramos la literatura de manera no sistémica para determinar si, cuándo y cómo ocurre el cambio de tipo de fibra con diferentes tipos de entrenamiento físico. Finalmente, discutimos las limitaciones de la investigación actual, las implicaciones para la aplicación práctica y las futuras direcciones de estudio.
Técnicas de identificación del tipo de fibra
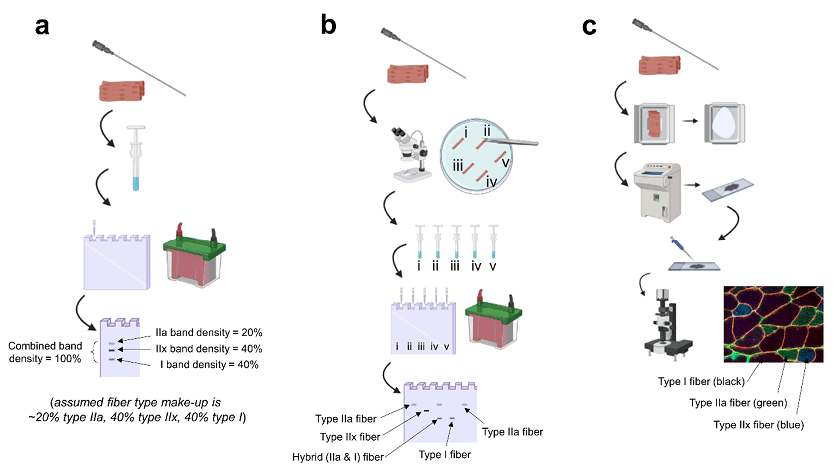
Existen diferentes técnicas para analizar las fibras del músculo esquelético, y cada técnica tiene fortalezas y limitaciones dependiendo del tema de investigación. Como tal, los resultados deben interpretarse a la luz de la técnica y cómo se aplica. Los métodos actuales existentes se dividen en tres categorías amplias: (i) análisis de homogeneizado muscular, (ii) análisis histológico de secciones del tejido y (iii) análisis electroforético de la expresión de isoformas de cadena pesada de miosina a partir de fibras individuales.
El análisis de homogeneizados musculares crudos puede ser útil para extrapolar las características del tejido, dado que el homogeneizado contiene una mezcla de varias fibras musculares [6]. En resumen, el tejido congelado se homogeneiza utilizando tampones especializados. A continuación, se preparan los lisados para electroforesis en gel de poliacrilamida-dodecilsulfato de sodio (SDS-PAGE). Después del SDS-PAGE, se realiza la tinción en gel (por ejemplo, tinción de plata o tinción de Coomassie) para identificar el contenido de las isoformas de la MHC del tejido por peso molecular. Se anima a los lectores a consultar a Roberts y cols. para más detalles sobre este método [7]. En esencia, si el tejido analizado presenta un perfil que contiene ~50% de proteína de MHC tipo I, ~40% de proteína de MHC tipo IIa y ~10% de MHC tipo IIx, el investigador puede extrapolar que el músculo contiene estos porcentajes correspondientes de tipo I , IIa y IIx de fibras musculares. Sin embargo, como se analiza a continuación, una proporción significativa de fibras musculares puede co-expresar proteínas de MHC, ejemplificado por la existencia de fibras I/IIa, fibras IIa/IIx y fibras I/IIa/IIx [8]. Como resultado, esta técnica carece de especificidad para estimar la presencia de fibras híbridas. Esta es una limitación importante si la intención de un proyecto de investigación dado es examinar cómo el entrenamiento físico afecta potencialmente el cambio del tipo de fibra.
El análisis de secciones de tejido muscular es otra técnica comúnmente utilizada para la tipificación de las fibras. En resumen, el análisis se puede realizar de diversas formas. Históricamente, los investigadores realizaban tinciones bioquímicas para determinar el contenido de enzimas oxidativas. Tales tinciones han incluido, por ejemplo, tinción de NADH o tinción de SDH, donde las miofibras más oscuras indican un fenotipo más oxidativo [9]. Si bien son informativos, estos estudios no permiten la identificación segura de las fibras de tipo I frente a las de tipo II, sino que proporcionan información sobre las propiedades oxidativas de una muestra de músculo. Como ejemplo contextual, los investigadores han demostrado que la carrera voluntaria a corto plazo en roedores conduce a una tinción de NADH más oscura del músculo sóleo y plantar en comparación con los controles sin ejercicio [10]. Esto ejemplifica cómo la diferenciación del tipo de fibra basada únicamente en la tinción metabólica bioquímica no fue posible. Las investigaciones históricas también han utilizado métodos bioquímicos que tiñen las miofibras basándose en la labilidad del pH de diferentes enzimas de la miosina ATPasa. Este método permite distintos patrones de tinción de fibras de tipo I, IIa y IIx. Un inconveniente de estos métodos es que requieren una precisión meticulosa, dado el número relativamente alto de cambios de solución durante el procesamiento de tejidos. Además, la calidad de la tinción (y la extrapolación de datos de las tinciones resultantes) está muy influenciada por cambios sutiles en el contenido de pH de las diferentes soluciones de preincubación e incubación [11].
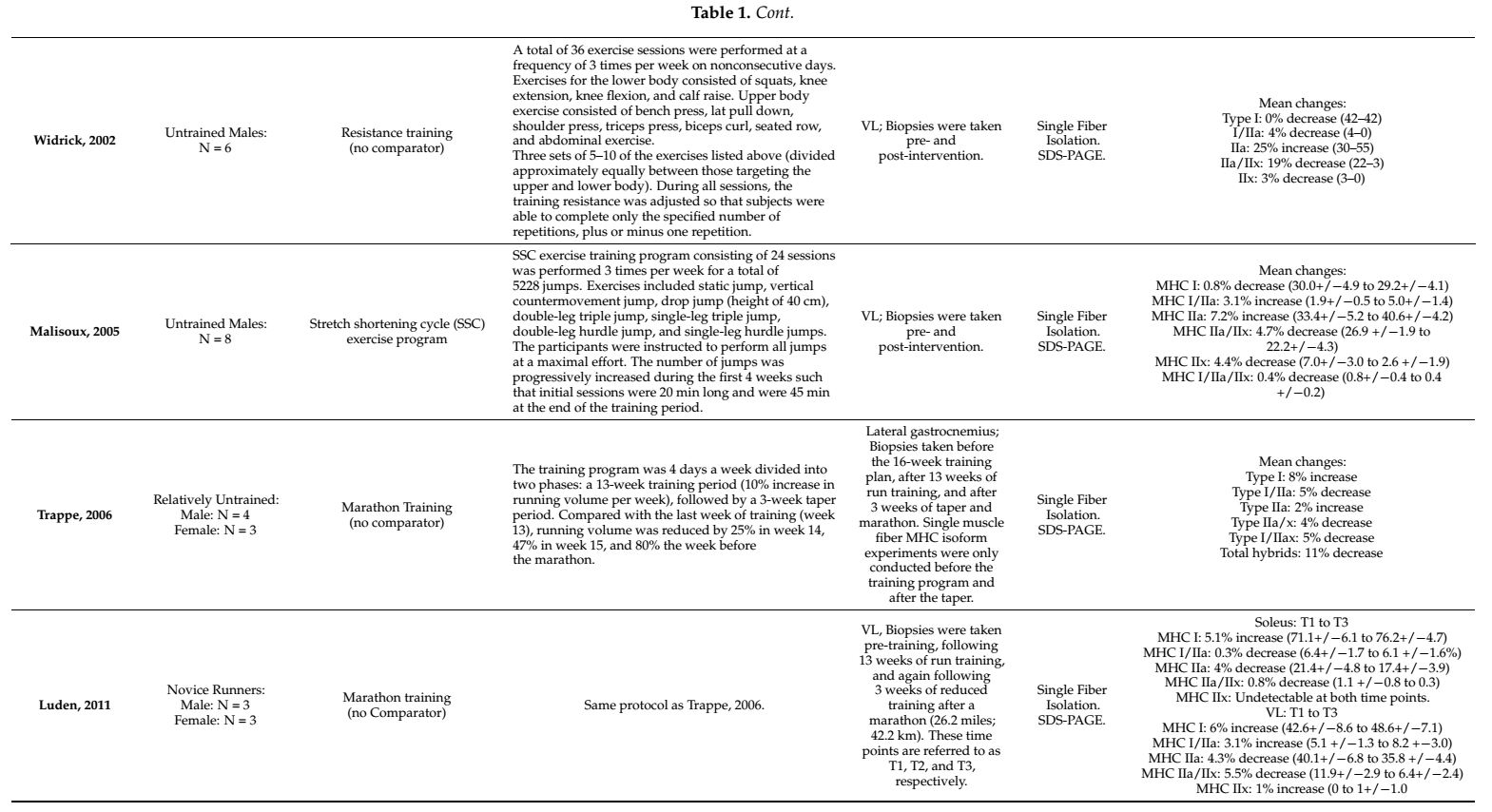
Un método más reciente, ampliamente adoptado y altamente reproducible de tipificación de las fibras incluye el uso de anticuerpos para sondear diferentes isoformas de la MHC. En resumen, esta técnica implica incubaciones relativamente simples, que incluyen: (i) medio para bloquear la sección para la unión no específica, (ii) una solución que contiene anticuerpos primarios para teñir los tipos de fibra de interés (por ej., anticuerpos de tipo I y IIa, donde las fibras no teñidas serían fibras IIx), y (iii) una solución que contiene anticuerpos secundarios que se conjugan con diferentes fluoróforos (por ejemplo, anti-FITC de tipo I y anti-TRITC de tipo II). A partir de entonces, se puede utilizar un microscopio fluorescente para fusionar la imagen RGB adecuada para la tipificación de fibras musculares. Un inconveniente de esta técnica es que carece de la sensibilidad para identificar con seguridad a las fibras híbridas [12]. Además, algunos estudios han teñido típicamente fibras de tipo I sin teñir las fibras de tipo IIa y IIx. Esta forma de tinción genera un análisis binario de fibras de tipo I versus II cuando, en realidad, los tipos de fibras abarcan un espectro de fibras puras e híbridas, como se discutió anteriormente.
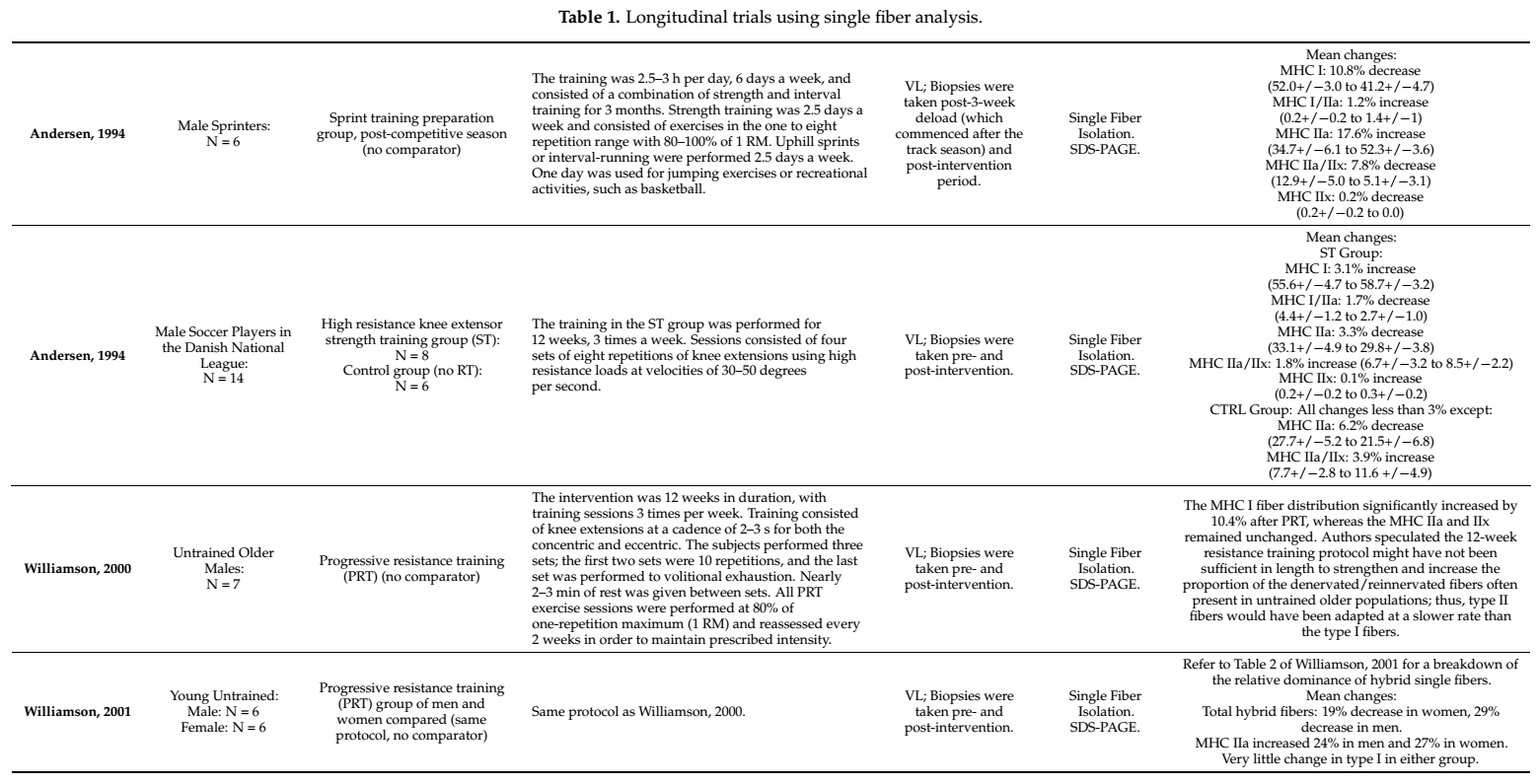
La tipificación de una sola fibra es, sin lugar a dudas, el mejor método para delimitar la composición del tipo de fibra a partir de una muestra de biopsia. La tipificación de una sola fibra también es el único método que permite el análisis mecánico y molecular de una manera específica del tipo de fibra. Brevemente, este método implica separar miofibras individuales en una placa de Petri de solución de digestión bajo un microscopio óptico. Después de aislar cada fibra, se pueden homogeneizar individualmente. A partir de entonces, los homogeneizados individuales se pueden analizar mediante la tinción SDS-PAGE y la tinción con plata, como se discutió anteriormente. Sin embargo, debido a la pequeña cantidad de proteína dentro de la muestra, a veces se necesita la combinación de fibras. Además, separar y analizar cada fibra individual es tedioso, lo que hace que esta técnica requiera mucho tiempo y trabajo. Una advertencia adicional está relacionada con el potencial de las biopsias que muestren diferentes fibras musculares después de una intervención en comparación con antes. Se asume que, al estandarizar la ubicación anatómica de una biopsia desde antes hasta después de la intervención, se puede hacer una comparación razonable en la misma región de fibras musculares. Pero, si bien la estandarización de la ubicación anatómica del muestreo de tejido puede ayudar, la profundidad del músculo del que se extrae la muestra, las pequeñas desviaciones del sitio de la biopsia original y otros factores relacionados con la extracción y el procesamiento del tejido pueden influir en el análisis posterior y en las inferencias. En otras palabras, es posible que se puedan comparar diferentes fibras musculares individuales antes y después del estudio, y esto podría influir en las inferencias hechas sobre la transición del tipo de fibra en respuesta a una intervención. Dicho esto, esta limitación también existe para todas las técnicas mencionadas anteriormente.
También es importante señalar que el número de fibras necesarias para determinar la extensión de los cambios de tipo de fibra no se ha dilucidado y puede diferir según el individuo, el músculo y la región muscular. No obstante, el aislamiento de una sola fibra y el análisis del final permiten la identificación segura de fibras puras e híbridas, y varios estudios que se analizan a continuación han aprovechado esta técnica para hacer descubrimientos únicos en relación en cómo el entrenamiento puede afectar el tipo de fibra muscular. La Figura 1 proporciona un resumen de las técnicas para analizar los tipos de fibras musculares.
Figura 1. Resumen de las técnicas. Leyenda: (a) estimación del tipo de fibra basada en homogeneizados biopsiados: se obtiene una biopsia, el tejido se homogeneiza en tampones especializados y se prepara para la electroforesis, y el gel se tiñe después de la electroforesis para visualizar el porcentaje de cada banda de isoformas de miosina. (b) análisis de fibra simple: se obtiene una biopsia, el tejido se desgarra bajo un estereoscopio en un tampón de digestión fisiológica, cada fibra se coloca en un tubo y se homogeneiza, y se realiza la electroforesis con tinción en gel posterior; esto permite la detección segura de fibras híbridas (por ejemplo, “fibra iii”). (c) inmunohistoquímica: se obtiene una biopsia, el tejido se congela lentamente en un criomolde (o en corcho) utilizando un medio de congelación, el tejido congelado se secciona en portaobjetos de microscopio utilizando un criostato, se pipetean soluciones primarias de anticuerpos contra varias isoformas de miosina del portaobjetos, las soluciones de anticuerpos secundarios contra los anticuerpos primarios se pipetean sobre el portaobjetos, y el portaobjetos se monta y se visualiza en un microscopio fluorescente. Tenga en cuenta que esta imagen se generó utilizando BioRender.com, y la imagen fluorescente es del laboratorio de MDR.
Entrenamiento de fuerza/sprint y de la potencia
La literatura actual indica que el entrenamiento de la fuerza realizado a velocidades más lentas debido al uso de cargas relativamente altas (>70% del máximo de una repetición) produce un cambio de los tipos híbridos IIx y IIx/IIa a un fenotipo más puro de IIa y menos cambio en fibras de tipo I puras, al menos en los períodos de tiempo longitudinales que se han observado [13,14]. Sin embargo, el "entrenamiento de potencia" llevado a cabo a velocidades más rápidas generalmente muestra una pérdida algo menor en las fibras IIx y IIx/IIa y una disminución o cambio concomitante en las fibras de tipo I a un fenotipo más rápido. Por ejemplo, Liu y cols. compararon los cambios en las características del tipo de fibra después del entrenamiento combinado (es decir, el rendimiento de ejercicio balístico y pliométrico junto con el entrenamiento de la fuerza) versus el entrenamiento de la fuerza máxima en estudiantes de educación física entrenados de forma recreativa [15].
Los autores utilizaron electroforesis en gel de homogeneizado muscular para identificar las isoformas de la MHC del tríceps braquial de los participantes. En resumen, los autores informaron que el grupo que completó 6 semanas de entrenamiento de la fuerza solamente experimentó un cambio a un fenotipo más IIa (49.4% a 66.7%, p <0.01) de IIx (33.4% a 19.5%, p <0.01), sin cambios en la proporción de fibras de tipo I. Sin embargo, el grupo de entrenamiento combinado no mostró una pérdida significativa de las fibras IIx, sino que experimentó un aumento en las fibras de tipo IIa (47.7 a 62.7%, p <0.05) y una pérdida de fibras de tipo I (18.2% a 9.2%, p < 0.05). Del mismo modo, Malisoux y cols. encontraron que el "entrenamiento del ciclo de estiramiento y acortamiento" aumentó el fenotipo IIa (33.4% a 40.6%), según lo evaluado por la tipificación de fibra única SDS-PAGE [16]. A diferencia de Liu y cols., Malisoux y cols. observaron una mayor reducción en el fenotipo tipo IIx (7.0% a 2,.6%), lo que puede explicarse por el uso de la técnica de análisis de biopsia de fibra única en comparación con el análisis de homogeneizado utilizado por Liu y cols., un mayor volumen total de ejercicio completado, diferente historial de ejercicio u otros factores. En general, las pocas pruebas longitudinales de entrenamiento de la fuerza y el entrenamiento de la potencia disponibles con tipificación de fibra única han mostrado una resistencia relativa a un cambio de fibras de tipo I puras en comparación con los cambios de fenotipos puros de contracción rápida.
Andersen y cols. utilizaron el análisis de fibra única SDS-PAGE y encontraron que 8 semanas de entrenamiento de velocidad en velocistas masculinos aumentaron la proporción de fibras de tipo IIa en su vasto lateral (del 35% al 52%; p <0.05), con una reducción correspondiente en el porcentaje de fibras de tipo I (del 52% al 41%; p <0.05) [17]. Este estudio sugiere que el entrenamiento de la velocidad puede producir un cambio bidireccional hacia un fenotipo IIa, con un cambio mayor desde el tipo I que el que se observa en el entrenamiento de la fuerza tradicional. Las fibras MHC IIa/IIx también experimentaron un cambio pronunciado (del 13% al 5%; p <0.05). Es importante señalar que los velocistas acababan de completar un período de descanso completo de 3 semanas cuando se tomó la primera biopsia, y el entrenamiento siguió a partir de entonces. Por lo tanto, aunque es especulativo, es posible que la cantidad de cambio híbrido IIa/IIx hubiera sido menos pronunciada si no fuera por el período de desentrenamiento.
La totalidad de la investigación sugiere que el entrenamiento de la velocidad, la potencia y la pliometría puede provocar una transición hacia más de un tipo de fibra de IIa. Sin embargo, es posible que las personas que comienzan este estilo de entrenamiento con más fibras IIx no experimenten tanta transición. Actualmente, no es posible saber qué cambios ocurrieron durante períodos de tiempo más largos y cuánta composición inicial de fibra se debe a la influencia genética con evidencia transversal; sin embargo, pueden dar ideas para la formación de hipótesis. Un ejemplo extremo que apunta hacia la retención del tipo IIx se observó en un velocista de élite cuya biopsia, según lo evaluado por análisis de fibra única, contenía 24% de MHC IIx pura. Dada la evidencia longitudinal, es razonable sospechar que el cambio de tipo de fibra puede ocurrir en menor grado cuanto mejor entrenado esté un individuo usando un cierto estilo de entrenamiento. Sin embargo, algunos datos desafían esta afirmación. Al respecto, D’Antona y cols. utilizaron técnicas de aislamiento de una sola fibra para comparar la distribución del tipo de fibra del vasto lateral en cinco culturistas competitivos bien entrenados en relación con controles no entrenados [18]. Los culturistas poseían ~35% de fibras de tipo I, mientras que los controles poseían ~48% de fibras de tipo I (p <0.05). Ambos grupos poseían una proporción estadísticamente similar de fibras de tipo IIa (~45%); sin embargo, los culturistas poseían una proporción sorprendentemente alta de fibras de tipo IIx (~15%), mientras que los controles poseían sólo ~5% (p <0.05). Los autores notaron que este hallazgo no fue anticipado, dado que varios estudios de entrenamiento de la fuerza de corta duración generalmente informan una transición de tipo de fibra IIx → IIa. Sigue siendo posible que los programas de entrenamiento de la fuerza intensos puedan causar un cambio eventual de un fenotipo lento a rápido a lo largo del tiempo, lo que explica la discrepancia entre la evidencia longitudinal y observacional. Sin embargo, es igualmente o quizás más probable que aquellos con predisposiciones genéticas retengan/obtengan una mayor proporción del fenotipo de MHC más ventajosa.
Entrenamiento de la resistencia
El entrenamiento de la resistencia generalmente induce un cambio de tipo de fibra hacia un fenotipo más oxidativo. Esto es lógico desde el punto de vista de la especificidad del entrenamiento, considerando el mayor consumo de oxígeno durante el ejercicio de resistencia. La tasa de cambio de tipo de fibra parece ser menos pronunciada a medida que los atletas de resistencia progresan más en la preparación específica del evento y si comienzan una intervención de entrenamiento de resistencia con una mayor abundancia de fibras de tipo I [19]. Luden y cols. investigaron los efectos de 13 semanas de entrenamiento de maratón, seguido de una reducción gradual de 3 semanas en los cambios de tipo de fibra en corredores novatos [20]. Los investigadores hicieron una biopsia de los músculos vasto lateral y sóleo y emplearon técnicas de aislamiento de una sola fibra emparejadas con SDS-PAGE para la tipificación de las fibras. La composición de fibras del vasto lateral el tipo I aumentó (42.6% a 48.6%), I/IIa aumentó (5.1% a 8.2%), IIa disminuyó (40.1% a 35.8%), IIa/IIx disminuyó (11.9% a 6.4%) y IIx aumentó (0% a 1%). El sóleo, un músculo compuesto predominantemente de fibras de tipo I [21,22], experimentó un cambio similar pero menos pronunciado, lo que podría indicar que ciertos músculos tienen una mayor propensión al cambio de tipo de fibra que otros. Es importante destacar que las biopsias se obtuvieron después de una puesta a punto, por lo que se puede especular que los resultados habrían sido aún más a favor de una abundancia de las de contracciones más lentas si se hubieran medido directamente después del entrenamiento. Sin embargo, un cambio hacia las fibras de tipo I fue evidente con el entrenamiento de la resistencia de mayor volumen. Otras investigaciones han encontrado patrones similares, lo que indica un cambio hacia las fibras de tipo I o un fenotipo más oxidativo después del entrenamiento de la resistencia [23,24,25].
Múltiples investigaciones transversales han utilizado una de las técnicas antes mencionadas para demostrar que los atletas de resistencia bien entrenados poseen una proporción significativamente mayor de fibras de tipo I en comparación con sus homólogos sedentarios o entrenados en fuerza [26,27,28]. Sin embargo, existe una escasez de evidencia longitudinal a largo plazo sobre los cambios de fibra en los atletas de resistencia, lo que excluye afirmaciones sólidas sobre la retención de tipo I o los cambios en el atletismo de élite. Sin embargo, un estudio de gemelos ha destacado el potencial de cambios dramáticos en el tipo de fibra durante largos períodos de tiempo. Bathgate y cols. (2018) llevaron a cabo un estudio de caso en gemelos donde uno de los gemelos fue sedentario durante la mayor parte de su vida adulta, mientras que el otro participó de forma recreativa en ejercicios de resistencia durante décadas. El análisis del tipo de fibra única mostró que el gemelo entrenado tenía una composición del vasto lateral que era principalmente de contracción lenta (95% MHC I), lo que equivale a un 55% más de fibras de tipo MHC I que el gemelo desentrenado. Además, el gemelo no entrenado poseía muchas más fibras híbridas y tipo IIa que el gemelo entrenado. Este estudio sugiere que el músculo humano puede cambiar drásticamente hacia un tipo de fibra cuando el entrenamiento ocurre durante un período de tiempo prolongado. Aunque se necesitan más investigaciones para sacar conclusiones sólidas, es posible que ciertos individuos tengan una mayor plasticidad/propensión a los cambios de tipo de fibra en una dirección u otra y, quizás, en general. Si bien son difíciles de ejecutar, los estudios que examinan múltiples grupos de gemelos o cohortes apropiadas podrían brindar información sobre las respuestas individuales y el alcance de los cambios en el tipo de fibra durante un período de tiempo más largo.
Desuso y sobreimpulso de la fibra de tipo IIx
Está bien caracterizado que las fibras cambian hacia una expresión de MHC más rápida durante el desuso [29]. Sin embargo, parece haber un sobreimpulso del tipo IIx después de un período de entrenamiento y de desentrenamiento, que se corresponde con características superiores de velocidad de la fibra [30]. Además, la evidencia en eventos de resistencia de mayor duración indica que las características funcionales del vasto lateral son favorables después de una disminución en los corredores de maratón, sin cambios observados en las características funcionales de las fibras de tipo I y un aumento de la potencia de una sola fibra y la potencia máxima en las fibras de tipo IIa post 3 semanas de puesta a punto [25]. Es importante señalar que incluso si las características funcionales de las fibras de tipo I permanecen sin cambios, una puesta a punto puede beneficiar a un atleta de resistencia a través de las características de las fibras y los cambios relacionados con las fibras de tipo II. Tal efecto puede aumentar la capacidad de generar una mayor fuerza y generación de energía al correr en cuestas más empinadas o “patalear” al final de una carrera. De hecho, está bien caracterizado que la puesta a punto es beneficiosa para una variedad de atletas de resistencia, y esto puede ser un factor explicativo [31,32].
Mecanismos potenciales
La experimentación previa en los mecanismos de los cambios de tipo de fibra demostró el papel crucial que tenía la inervación en el perfil de una fibra muscular [33]. En particular, la investigación en gatos encontró que la inervación cruzada del músculo sóleo con un nervio que inervaba un músculo que contiene principalmente fibras de contracción rápida (músculo flexor largo de los dedos, FDL) conducía a tiempos de contracción contráctil más rápidos. Además, el músculo FDL experimentó tiempos de contracción más lentos después de la inervación cruzada. Sin embargo, experimentos posteriores han arrojado resultados contradictorios con respecto a cómo la inervación cruzada afecta el tipo de fibra muscular. Por ejemplo, se ha demostrado que la inervación cruzada de los músculos esternohioideo y tiroaritenoideo en ratas durante 12 semanas provoca un desplazamiento insignificante del tipo de fibra [34]. Por lo tanto, aunque la entrada de las neuronas motoras alfa probablemente afecte el tipo de fibra, también hay otros factores que pueden contribuir al cambio del tipo de fibra.
Las vías de señalización intramiocelular inducidas por diferentes formas de ejercicio probablemente juegan un papel importante en el cambio de tipo de fibra. Por ejemplo, la activación muscular aumenta las vías de señalización activadas por el calcio, y estas vías contienen moléculas de señalización, como la calcineurina, proteína quinasas dependientes de calcio/calmodulina y factor de transcripción del factor nuclear de células T activas (NFAT) [35]. Curiosamente, se ha demostrado que el bloqueo de la vía NFAT previene un cambio hacia fibras de contracción lenta [36,37]. Por lo tanto, la inducción de NFAT a través del calcio, en particular, puede ser en gran parte responsable del cambio de tipo de fibra durante los períodos de entrenamiento físico.
La proteína quinasa activada por AMP (AMPK) puede ser otro mediador de señalización involucrado con el tipo de fibra [38]. La AMPK es un mediador de señalización que existe en diferentes isoformas y se asocia típicamente con la regulación positiva durante el ejercicio de resistencia, aunque hay evidencia de que el entrenamiento de la fuerza también puede aumentar su activación [39,40]. Curiosamente, se ha demostrado que la inhibición de la actividad de la AMPK atenúa la transición del tipo de fibra rápida a lenta en roedores [41]. Como se mencionó anteriormente, una adaptación característica que parece ocurrir rápidamente durante los primeros meses de entrenamiento de resistencia y de la fuerza implica la transición de las fibras IIx → IIa. Por lo tanto, estos eventos de señalización pueden ser críticos para el cambio de tipo de fibra en respuesta al entrenamiento físico, dado que las contracciones musculares repetitivas durante los ejercicios de resistencia y de fuerza provocan aumentos en el calcio intracelular junto con la activación de la AMPK.
Por último, también es importante señalar que la predisposición genética, en parte, puede explicar algunas de las diferencias interindividuales observadas en la composición del tipo de fibra [42,43]. En este sentido, el genotipo ACTN3 R577X se ha asociado con la composición del tipo de fibra muscular, donde los individuos que tienen el genotipo RR poseen más fibras de tipo IIx en comparación con aquellos con el genotipo XX [44]. Otros investigadores han demostrado que aquellos con el alelo D del gen de la enzima convertidora de angiotensina (ACE) tenían una proporción de fibras de tipo I un 4.7% mayor que los que tenían el genotipo ACE II [45]. Curiosamente, un estudio reciente en atletas de resistencia (n = 103) y velocistas (n = 89) también identificó cinco polimorfismos de un sólo nucleótido (PDE3A, PDE6C y tres variantes no anotadas) que se asociaron con el predominio de fibras musculares tipo I [46]. Una combinación de factores genéticos, de entrenamiento, nutrición, estilo de vida y quizás otros factores parecen interactuar e influir en la distribución del tipo de fibra individual [47,48]. Algunas de estas modalidades pueden inducir cambios a través de mecanismos superpuestos, mientras que otros mecanismos pueden ser independientes. La Tabla 1 proporciona un resumen de los métodos de las pruebas longitudinales de ejercicio que utilizan análisis de fibra única y sus respectivos resultados.
Tabla 1. Ensayos longitudinales que utilizan análisis de fibra única.
Más direcciones y limitaciones
Como se mencionó anteriormente, una limitación importante con los estudios que intentan indagar el cambio de tipo de fibra con el entrenamiento físico es la falta de datos longitudinales en atletas de élite. Por ejemplo, los velocistas de élite y los levantadores de pesas tienen una proporción relativamente alta de fibras IIx [4,5]; sin embargo, la preponderancia de la evidencia intervencionista indica un cambio pronunciado hacia las fibras de tipo IIa. Por lo tanto, sigue siendo cuestionable si los hallazgos a corto plazo (es decir, estudios de entrenamiento de 6 a 16 semanas) pueden extrapolarse a poblaciones de élite que se someten a años o décadas de entrenamiento. También parece evidente que es probable que diferentes músculos tengan una propensión diferente a los cambios del tipo de fibra, y hay una escasez relativa de datos en muchos grupos musculares [12]. La evidencia también sugiere que diferentes regiones musculares (profunda versus superficial y origen versus inserción) pueden tener diferentes patrones del tipo de fibra y, por lo tanto, probablemente muestren diferentes patrones de cambio en respuesta al entrenamiento [49]. Además de las diferencias de tipo de fibra que pueden estar presentes entre regiones en respuesta al entrenamiento, también es probable que sea necesario obtener múltiples biopsias debido a la variabilidad del tipo de fibra de muestra a muestra. Horwath y cols. obtuvieron cinco biopsias a lo largo del VL de la pierna de cada participante (10 biopsias en total) y no encontraron un patrón de diferencia en la distribución de fibras de tipo II entre los sitios de biopsia a lo largo del músculo o entre las piernas (promedio lado izquierdo 58±8%, lado derecho 55±8%). Sin embargo, se encontró una notable variabilidad no sistemática intraindividual de 18±4%. Los investigadores notaron que intentaron estandarizar la profundidad del muestreo. Dada tal variabilidad no sistemática, dos o más biopsias por sitio probablemente proporcionarían hallazgos más sólidos al evaluar la distribución de las fibras [50]. Sin embargo, desde una perspectiva práctica, reconocemos que la técnica de la biopsia es invasiva y tales estudios serían un desafío logístico.
Comprender los cambios del tipo de fibra para diferentes músculos y diferentes regiones utilizando técnicas de biopsia de múltiples sitios es prometedor para mejorar nuestra capacidad de adaptar el entrenamiento para diferentes partes/regiones del cuerpo y para tareas específicas. Esta área de investigación brinda una gran oportunidad de descubrimiento en los próximos años.
Aplicaciones prácticas
Basándonos en nuestra comprensión del cuerpo de la literatura actual sobre los tipos de fibras musculares, podemos sacar las siguientes conclusiones desde un punto de vista aplicado:
- La capacidad innata afectará el desempeño de un individuo en diferentes deportes/tareas, y la composición del tipo de fibra probablemente juega un papel importante desde una perspectiva fisiológica.
- La evidencia sugiere que las fibras musculares tienen la capacidad de experimentar una transición del tipo de fibra, de fibras híbridas a fibras puras y entre tipos de fibras. La capacidad de discernir híbridas es necesaria para tener un alto grado de confianza en los hallazgos relacionados con la distribución del tipo de fibra.
- Dada la escasez de pruebas sobre el curso temporal de la adaptación a largo plazo (>16 semanas), se pueden extraer pocas inferencias de la planificación/periodización a largo plazo de la literatura actual sobre la transición del tipo de fibra. Sin embargo, probablemente sería prudente mantener algunas de las características de fuerza-velocidad de la tarea o deporte específico.
- Las prácticas de puesta a punto son útiles para permitir una transición hacia un tipo de fibra más rápido. Alguna evidencia emergente sugiere un fenómeno de "sobreimpulso" en el que las fibras de tipo IIx alcanzan niveles posteriores a la puesta a punto por encima de lo que se esperaría sólo con el reposo. Esto puede permitir que un atleta sea más explosivo para un evento determinado. Por lo tanto, la puesta a punto puede presentar una estrategia viable para que los atletas de potencia y resistencia mejoren el rendimiento.
- Más investigación ayudará a dilucidar las diferencias en la plasticidad del tipo de fibra en otros músculos, la especificidad regional, la adaptabilidad a largo plazo y otras consideraciones prácticas, como las estrategias nutricionales y de entrenamiento.
Financiamiento
Esta investigación no recibió financiación externa.
Conflictos de interés
Los autores declaran no tener ningún conflicto de intereses.
Referencias
1. Smerdu V., Karsch-Mizrachi I., Campione M., Leinwand L., Schiaffino S. (1994). Type IIx Myosin Heavy Chain Transcripts Are Expressed in Type IIb Fibers of Human Skeletal Muscle. Am. J. Physiol. 1994;267:C1723–C1728. doi: 10.1152/ajpcell.1994.267.6.C1723.
2. Tihanyi J., Apor P., Fekete G. (1982). Force-Velocity-Power Characteristics and Fiber Composition in Human Knee Extensor Muscles. Eur. J. Appl. Physiol. Occup. Physiol. 1982;48:331–343. doi: 10.1007/BF00430223.
3. Tesch P.A., Karlsson J. (1985). Muscle Fiber Types and Size in Trained and Untrained Muscles of Elite Athletes. J. Appl. Physiol. (1985). 1985;59:1716–1720. doi: 10.1152/jappl.1985.59.6.1716.
4. Serrano N., Colenso-Semple L.M., Lazauskus K.K., Siu J.W., Bagley J.R., Lockie R.G., Costa P.B., Galpin A.J. (2019). Extraordinary Fast-Twitch Fiber Abundance in Elite Weightlifters. PLoS ONE. 2019;14:e0207975. doi: 10.1371/journal.pone.0207975.
5. Trappe S., Luden N., Minchev K., Raue U., Jemiolo B., Trappe T.A. (2015). Skeletal Muscle Signature of a Champion Sprint Runner. J. Appl. Physiol. (1985). 2015;118:1460–1466. doi: 10.1152/japplphysiol.00037.2015.
6. Larson L., Lioy J., Johnson J., Medler S. (2019). Transitional Hybrid Skeletal Muscle Fibers in Rat Soleus Development. J. Histochem. Cytochem. 2019;67:891–900. doi: 10.1369/0022155419876421.
7. Roberts M.D., Dalbo V.J., Sunderland K.L., Kerksick C.M. (2012). Electrophoretic Separation of Myosin Heavy Chain Isoforms Using a Modified Mini Gel System. J. Strength Cond. Res. 2012;26:3461–3468. doi: 10.1519/JSC.0b013e318270fcab.
8. Medler S. (2019). Mixing It up: The Biological Significance of Hybrid Skeletal Muscle Fibers. J. Exp. Biol. 2019;222:jeb200832. doi: 10.1242/jeb.200832.
9. Quiat D., Voelker K.A., Pei J., Grishin N.V., Grange R.W., Bassel-Duby R., Olson E.N. (2011). Concerted Regulation of Myofiber-Specific Gene Expression and Muscle Performance by the Transcriptional Repressor Sox6. Proc. Natl. Acad. Sci. USA. 2011;108:10196–10201. doi: 10.1073/pnas.1107413108.
10. Roberts M.D., Brown J.D., Company J.M., Oberle L.P., Heese A.J., Toedebusch R.G., Wells K.D., Cruthirds C.L., Knouse J.A., Ferreira J.A., et al. (2013). Phenotypic and Molecular Differences between Rats Selectively Bred to Voluntarily Run High vs. Low Nightly Distances. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013;304:R1024–R1035. doi: 10.1152/ajpregu.00581.2012.
11. Müntener M. Variable PH (1979). Dependence of the Myosin-ATPase in Different Muscles of the Rat. Histochemistry. 1979;62:299–304. doi: 10.1007/BF00508358. ]
12. Tobias I.S., Galpin A.J. (2020). Moving Human Muscle Physiology Research Forward: An Evaluation of Fiber Type-Specific Protein Research Methodologies. Am. J. Physiol.-Cell Physiol. 2020;319:C858–C876. doi: 10.1152/ajpcell.00107.2020.
13. Adams G.R., Hather B.M., Baldwin K.M., Dudley G.A. (1993). Skeletal Muscle Myosin Heavy Chain Composition and Resistance Training. J. Appl. Physiol. (1985). 1993;74:911–915. doi: 10.1152/jappl.1993.74.2.911.
14. Carroll T.J., Abernethy P.J., Logan P.A., Barber M., McEniery M.T. (1998). Resistance Training Frequency: Strength and Myosin Heavy Chain Responses to Two and Three Bouts per Week. Eur. J. Appl. Physiol. Occup. Physiol. 1998;78:270–275. doi: 10.1007/s004210050419.
15. Liu Y., Schlumberger A., Wirth K., Schmidtbleicher D., Steinacker J.M. (2003). Different Effects on Human Skeletal Myosin Heavy Chain Isoform Expression: Strength vs. Combination Training. J. Appl. Physiol. (1985). 2003;94:2282–2288. doi: 10.1152/japplphysiol.00830.2002.
16. Malisoux L., Francaux M., Nielens H., Theisen D. (2006). Stretch-Shortening Cycle Exercises: An Effective Training Paradigm to Enhance Power Output of Human Single Muscle Fibers. J. Appl. Physiol. 2006;100:771–779. doi: 10.1152/japplphysiol.01027.2005.
17. Andersen J.L., Klitgaard H., Saltin B. (1994). Myosin Heavy Chain Isoforms in Single Fibres from m. Vastus Lateralis of Sprinters: Influence of Training. Acta Physiol. Scand. 1994;151:135–142. doi: 10.1111/j.1748-1716.1994.tb09730.x.
18. D’Antona G., Lanfranconi F., Pellegrino M.A., Brocca L., Adami R., Rossi R., Moro G., Miotti D., Canepari M., Bottinelli R. (2006). Skeletal Muscle Hypertrophy and Structure and Function of Skeletal Muscle Fibres in Male Body Builders. J. Physiol. 2006; 570:611–627. doi: 10.1113/jphysiol.2005.101642
19. Gehlert S., Weber S., Weidmann B., Gutsche K., Platen P., Graf C., Kappes-Horn K., Bloch W. (2012). Cycling Exercise-Induced Myofiber Transitions in Skeletal Muscle Depend on Basal Fiber Type Distribution. Eur. J. Appl. Physiol. 2012;112:2393–2402. doi: 10.1007/s00421-011-2209-4.
20. Luden N., Hayes E., Minchev K., Louis E., Raue U., Conley T., Trappe S. (2012). Skeletal Muscle Plasticity with Marathon Training in Novice Runners. Scand. J. Med. Sci. Sports. 2012;22:662–670. doi: 10.1111/j.1600-0838.2011.01305.x.
21. Vandervoort A.A., McComas A.J. (1983). A Comparison of the Contractile Properties of the Human Gastrocnemius and Soleus Muscles. Eur. J. Appl. Physiol. Occup. Physiol. 1983;51:435–440. doi: 10.1007/BF00429079.
22. Gallagher P., Trappe S., Harber M., Creer A., Mazzetti S., Trappe T., Alkner B., Tesch P. (2005). Effects of 84-Days of Bedrest and Resistance Training on Single Muscle Fibre Myosin Heavy Chain Distribution in Human Vastus Lateralis and Soleus Muscles. Acta Physiol. Scand. 2005;185:61–69. doi: 10.1111/j.1365-201X.2005.01457.x.
23. Howald H., Hoppeler H., Claassen H., Mathieu O., Straub R. (1985). Influences of Endurance Training on the Ultrastructural Composition of the Different Muscle Fiber Types in Humans. Pflug. Arch. 1985;403:369–376. doi: 10.1007/BF00589248.
24. Jansson E., Sjödin B., Tesch P. (1978). Changes in Muscle Fibre Type Distribution in Man after Physical Training: A Sign of Fibre Type Transformation? Acta Physiol. Scand. 1978;104:235–237. doi: 10.1111/j.1748-1716.1978.tb06272.x.
25. Trappe S., Harber M., Creer A., Gallagher P., Slivka D., Minchev K., Whitsett D. (2006). Single Muscle Fiber Adaptations with Marathon Training. J. Appl. Physiol. (1985). 2006;101:721–727. doi: 10.1152/japplphysiol.01595.2005.
26. Costill D.L., Daniels J., Evans W., Fink W., Krahenbuhl G., Saltin B. (1976). Skeletal Muscle Enzymes and Fiber Composition in Male and Female Track Athletes. J. Appl. Physiol. 1976;40:149–154. doi: 10.1152/jappl.1976.40.2.149.
27. Costill D.L., Fink W.J., Pollock M.L. (1976). Muscle Fiber Composition and Enzyme Activities of Elite Distance Runners. Med. Sci. Sports. 1976;8:96–100. doi: 10.1249/00005768-197600820-00015.
28. Fink W.J., Costill D.L., Pollock M.L. (1977). Submaximal and Maximal Working Capacity of Elite Distance Runners. Part II. Muscle Fiber Composition and Enzyme Activities. Ann. N. Y. Acad. Sci. 1977;301:323–327. doi: 10.1111/j.1749-6632.1977.tb38210.x.
29. Vikne H., Strøm V., Pripp A.H., Gjøvaag T. (2020). Human Skeletal Muscle Fiber Type Percentage and Area after Reduced Muscle Use: A Systematic Review and Meta-Analysis. Scand. J. Med. Sci. Sports. 2020;30:1298–1317. doi: 10.1111/sms.13675.
30. Andersen L.L., Andersen J.L., Magnusson S.P., Suetta C., Madsen J.L., Christensen L.R., Aagaard P. (2005). Changes in the Human Muscle Force-Velocity Relationship in Response to Resistance Training and Subsequent Detraining. J. Appl. Physiol. 2005;99:87–94. doi: 10.1152/japplphysiol.00091.2005.
31. Houmard J.A., Scott B.K., Justice C.L., Chenier T.C. (1994). The Effects of Taper on Performance in Distance Runners. Med. Sci. Sports Exerc. 1994;26:624–631. doi: 10.1249/00005768-199405000-00016.
32. Murach K.A., Bagley J.R. (2015). Less Is More: The Physiological Basis for Tapering in Endurance, Strength, and Power Athletes. Sports. 2015;3:209–218. doi: 10.3390/sports3030209.
33. Buller A.J., Eccles J.C., Eccles R.M. (1960). Interactions between Motoneurones and Muscles in Respect of the Characteristic Speeds of Their Responses. J. Physiol. 1960;150:417–439. doi: 10.1113/jphysiol.1960.sp006395.
34. Rhee H.S., Hoh J.F.Y. (2010). Immunohistochemical Analysis of the Effects of Cross-Innervation of Murine Thyroarytenoid and Sternohyoid Muscles. J. Histochem. Cytochem. 2010;58:1057–1065. doi: 10.1369/jhc.2010.956706.
35. Chin E.R., Olson E.N., Richardson J.A., Yang Q., Humphries C., Shelton J.M., Wu H., Zhu W., Bassel-Duby R., Williams R.S. (1998). A Calcineurin-Dependent Transcriptional Pathway Controls Skeletal Muscle Fiber Type. Genes Dev. 1998;12:2499–2509. doi: 10.1101/gad.12.16.2499.
36. McCullagh K.J.A., Calabria E., Pallafacchina G., Ciciliot S., Serrano A.L., Argentini C., Kalhovde J.M., Lømo T., Schiaffino S. (2004). NFAT Is a Nerve Activity Sensor in Skeletal Muscle and Controls Activity-Dependent Myosin Switching. Proc. Natl. Acad. Sci. USA. 2004;101:10590–10595. doi: 10.1073/pnas.0308035101.
37. Serrano A.L., Murgia M., Pallafacchina G., Calabria E., Coniglio P., Lømo T., Schiaffino S. (2001). Calcineurin Controls Nerve Activity-Dependent Specification of Slow Skeletal Muscle Fibers but Not Muscle Growth. Proc. Natl. Acad. Sci. USA. 2001;98:13108–13113. doi: 10.1073/pnas.231148598.
38. Röckl K.S.C., Hirshman M.F., Brandauer J., Fujii N., Witters L.A., Goodyear L.J. (2007). Skeletal Muscle Adaptation to Exercise Training: AMP-Activated Protein Kinase Mediates Muscle Fiber Type Shift. Diabetes. 2007;56:2062–2069. doi: 10.2337/db07-0255.
39. Chen Z.-P., Stephens T.J., Murthy S., Canny B.J., Hargreaves M., Witters L.A., Kemp B.E., McConell G.K. (2003). Effect of Exercise Intensity on Skeletal Muscle AMPK Signaling in Humans. Diabetes. 2003;52:2205–2212. doi: 10.2337/diabetes.52.9.2205.
40. Dreyer H.C., Fujita S., Cadenas J.G., Chinkes D.L., Volpi E., Rasmussen B.B. (2006). Resistance Exercise Increases AMPK Activity and Reduces 4E-BP1 Phosphorylation and Protein Synthesis in Human Skeletal Muscle. J. Physiol. 2006;576:613–624. doi: 10.1113/jphysiol.2006.113175.
41. Chen X., Guo Y., Jia G., Liu G., Zhao H., Huang Z. (2018). Arginine Promotes Skeletal Muscle Fiber Type Transformation from Fast-Twitch to Slow-Twitch via Sirt1/AMPK Pathway. J. Nutr. Biochem. 2018;61:155–162. doi: 10.1016/j.jnutbio.2018.08.007.
42. Flück M., Kramer M., Fitze D.P., Kasper S., Franchi M.V., Valdivieso P. (2019). Cellular Aspects of Muscle Specialization Demonstrate Genotype–Phenotype Interaction Effects in Athletes. Front. Physiol. 2019;10:526. doi: 10.3389/fphys.2019.00526.
43. Simoneau J.A., Bouchard C. (1995). Genetic Determinism of Fiber Type Proportion in Human Skeletal Muscle. FASEB J. 1995;9:1091–1095. doi: 10.1096/fasebj.9.11.7649409.
44. Vincent B., De Bock K., Ramaekers M., Van den Eede E., Van Leemputte M., Hespel P., Thomis M.A. (2007). ACTN3 (R577X). Genotype Is Associated with Fiber Type Distribution. Physiol. Genom. 2007;32:58–63. doi: 10.1152/physiolgenomics.00173.2007.
45. Kumagai H., Tobina T., Ichinoseki-Sekine N., Kakigi R., Tsuzuki T., Zempo H., Shiose K., Yoshimura E., Kumahara H., Ayabe M., et al. (2018). Role of Selected Polymorphisms in Determining Muscle Fiber Composition in Japanese Men and Women. J. Appl. Physiol. (1985). 2018;124:1377–1384. doi: 10.1152/japplphysiol.00953.2017.
46. Borisov O., Semenova E., Miyamoto-Mikami E., Murakami H., Zempo H., Kostryukova E., Kulemin N., Larin A., Miyachi M., Ospanova E., et al. (2018). FEBS Open Bio. Wiley; Hoboken, NJ, USA: 2018. A Genome-Wide Association Study of Muscle Fibers Composition Revealed 5 SNPs Associated with Slow-Twitch Fibers.
47. Bagley J., Murach K., Trappe S. (2012). Microgravity-Induced Fiber Type Shift in Human Skeletal Muscle. Gravit. Space Biol. 2012;26:34–40.
48. Hua N., Takahashi H., Yee G.M., Kitajima Y., Katagiri S., Kojima M., Anzai K., Eguchi Y., Hamilton J.A. (2017). Influence of Muscle Fiber Type Composition on Early Fat Accumulation under High-Fat Diet Challenge. PLoS ONE. 2017;12:e0182430. doi: 10.1371/journal.pone.0182430.
49. Korfage J.A.M., Van Eijden T.M.G.J. (1999). Regional Differences in Fibre Type Composition in the Human Temporalis Muscle. J. Anat. 1999;194:355–362. doi: 10.1046/j.1469-7580.1999.19430355.x.
50. Horwath O., Envall H., Röja J., Emanuelsson E.B., Sanz G., Ekblom B., Apró W., Moberg M. (2021). Variablity in Vastus Lateralis Fiber Type Distribution, Fiber Size and Myonuclear Content along and between the Legs. J. Appl. Physiol. 2021 doi: 10.1152/japplphysiol.00053.2021.