Transporte de Oxígeno durante el ejercicio Submáximo en Estado Estable, en Hipoxia Crónica
Eugene E Wolfel1, Gail E Butterfield2, George A Brooks2, Bertron M Groves1, Robert S Mazzeo3, Lorna G Moore4, John R Sutton5, Paul R Bender5, Thomas E Dahms6 y Robert E McCullough6
1Cardiovascular Pulmonary Research Laboratory and Division of Cardiology, University of Colorado Health Sciences Center, Denver 80262.
2Department of Kinesiology, University of Colorado, Boulder, Colorado 80309.
3Exercise Physiology Laboratory, University of California, Berkeley 94720.
4Veterans Administration Medical Center, Palo Alto, California 94304.
5Cumberland College of Health Sciences, Lidcoinbe, New South Wales 2141, Australia.
6Department of Anesthesiology, St. Lotus University Medical School, St. Louis, Missouri 63104.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1997.
Publicado 7 de mayo de 2004
Resumen
Palabras clave: altitud elevada, aclimatación, hipoxia, contenido de oxígeno, volumen minuto cardíaco, flujo sanguín
LA ACLIMATACION a altitudes moderadas de 3.000 a 4.000 m involucra adaptaciones en el transporte de O2, particularmente durante el ejercicio, que son poco comprendidas. Por ejemplo, los incrementos en la concentración de hemoglobina y la saturación de O2, arterial son compensados por reducciones en el volumen minuto cardíaco y volumen sistólico (VS) (2, 5, 7, 13, 15, 18, 24, 29, 30). El resultado neto es que el transporte de O2 durante el ejercicio submáximo no se incrementa con la aclimatación. Similares hallazgos fueron obtenidos con estudios en flujo sanguíneo coronario en el ejercicio a 3.100 m (7), como también en estudios del flujo sanguíneo del miembro en ejercicio a 4.300 m (3). Uno de los conceptos difundidos en todos esos estudios de aclimatación es que la reducción en el flujo sanguíneo actúa para mantener un nivel constante de transporte de O2.
Se creía que las reducciones en el volumen minuto cardíaco y en el flujo sanguíneo a las piernas (FSP) eran el resultado de una reducción en el volumen plasmático, observada en la altitud (1,2). Esa explicación no es consistente con los hallazgos de diversos estudios que fallaron en demostrar un incremento en el volumen minuto cardíaco, a pesar de la manipulación del volumen plasmático (2, 13). Adicionalmente, los residentes en altitud moderada, en el largo plazo, demostraron tener un incremento en el volumen minuto cardíaco luego de 10 días a nivel del mar (NM), a pesar de los cambios insignificantes en el volumen sanguíneo total (12). Por lo tanto, los mecanismos adicionales, o ajenos al volumen sanguíneo, pueden ser importantes en la modulación del flujo sanguíneo con la aclimatación (3, 29).
Las mediciones de la presión arterial sistémica media y la resistencia vascular sistémica durante el ejercicio demostraron elevaciones significativas con la residencia en altitud elevada (3, 7, 24, 29, 30). La causa de esas elevaciones no ha sido determinada, pero la actividad elevada del sistema nervioso simpático, lo que es sugerido por los niveles incrementados de norepinefrina (NE) en plasma (21), puede tener un rol importante. La vasoconstricción arterial, mediada simpáticamente, podría resultar en reducciones tanto del flujo sanguíneo local como del sistémico, previniendo así un incremento en el transporte de O2 con la aclimatación, a pesar de la mejoría en el contenido de O2 arterial.
El propósito de este estudio fue investigar el efecto de la aclimatación a 4.300 m sobre el transporte de oxígeno, a todo el cuerpo, y a las piernas, durante el ejercicio en estado estable más prolongado. Adicionalmente, se determinaron la importancia relativa del volumen sanguíneo y la resistencia vascular arterial en las adaptaciones del flujo sanguíneo a la hipoxia crónica.
Las mediciones de volumen minuto cardíaco, FSP, la oxigenación sanguínea arterial y venosa, y la presión sanguínea arterial, fueron hechas en reposo y durante un esfuerzo de ejercicio en estado estable de 45 min., al mismo nivel absoluto de consumo de O2 (VO2) corporal total a NM, inmediatamente sobre la llegada a una altitud de 4.300 m, y luego de una residencia de 21 días en esa altitud. Fue estimado el volumen sanguíneo bajo condiciones de reposo a NM, y luego de una exposición aguda y crónica a la altitud. Finalmente, se obtuvieron los niveles de NE en plasma para evaluar la relación potencial entre la actividad nerviosa simpática elevada y las respuestas circulatorias durante el ejercicio con aclimatación.
METODOS
Las mediciones fueron hechas en reposo y durante el ejercicio en estado estable, en tanto los sujetos respiraban aire ambiente a NM [presión barométrica 751 Torr, PO2 inspirado (PI02)148 Torr], dentro de las cuatro horas de llegada a los 4.300 m (PB 463 Torr, PI 02 87 Torr), y luego de 21 días de residencia en la altitud (PB 461 Torr, PI 02 87 Torr). Los estudios a altitud elevada comenzaron 4 semanas luego de aquellos ejecutados a NM. Los sujetos fueron transportados por aire del NM a Denver Colorado y durmieron a una altura de 1.954 m (Manitou Springs) la noche anterior al ascenso a 4.300 m. La llegada de los sujetos a la altitud fue periodizada de manera que los sujetos fueran estudiados inmediatamente a su llegada, y luego de un periodo equivalente de residencia en la altitud. Los niveles a NM fueron realizados en el Centro Clínico de Investigación Geriátrica y Educación del Centro Médico de Administración de Veteranos de Palo Alto, en tanto los estudios de altitud fueron realizados en el Laboratorio de Investigación Maher Memorial de la Armada de los Estados Unidos en la cima del pico Pikes, Colorado (4.300 m PB 463 Torr). El diseño fue hecho para realizar mediciones durante hipoxia a altitud elevada, antes y después de la aclimatación, y para ser comparados con estudios durante normoxia a NM.
Sujetos
Siete individuos masculinos dieron su consentimiento informado para la participación en el estudio de investigación aprobado por los Comites de Sujetos Humanos de Centro de Ciencias de la Salud de la Universidad de Colorado, Universidad de Stanford, Universidad de California, Berkeley y Armada de los Estados Unidos. Los sujetos promediaron 23 ±2 (SE) años de edad, 72.0 ± 1.6 kg de peso corporal y 11,7 de grasa corporal (determinado por pesaje hidrostático); todos fueron residentes cercanos al NM sin exposición reciente a la altitud. Solo uno de los sujetos estuvo involucrado en entrenamiento regular de resistencia, pero 61 no entrenó vigorosamente por ≥ 1 mes previo al comienzo de la fase de NM.
Dieta
Se controló la ingesta de alimentos a NM y en la altitud, con una fórmula alimenticia y de dieta provista en cantidades suficientes para cubrir los requerimientos de energía medidos. Se exigió el compromiso con el régimen de dieta y la ingesta de fluidos en la altitud, promediando 4.854 ± 447 ml/ día. El peso corporal fue 72.0 ± 1.6 kg a NM, 73,4 ± 1.8 kg a la llegada a los 4.300 m, y 71 ± 1.8 kg luego de 21 días a altitud elevada.
Máximo consumo de oxígeno (VO2 máx)
El VO2 máx fue determinado por el uso de un protocolo de ejercicio progresivo sobre una bicicleta ergométrica para determinar la intensidad de ejercicio a ser usada durante el estudio de ejercicio submáximo en estado estable. La carga de trabajo fue incrementada en 25 W cada 2 min., hasta la imposibilidad del sujeto para continuar, a pesar del fuerte aliento verbal. El VO2máx fue el valor obtenido cuando un aumento de intensidad de 25 W en el ejercicio no resultó en ningún incremento adicional en el VO2 (por ej., un descenso, o sin cambios, o un incremento < 150 ml/min.). Esto resultó en un «plateau» (meseta) en el VO2 en la mayoría de los sujetos. Las mediciones fueron hechas luego de un test de familiarización inicial en dos días separados a NM, y en los días 5, 7 y 18 a 4.300 m respirando aire ambiente.
Los sujetos ejercitaron en una bicicleta ergométrica Warren Collins a pedal con freno electrónico, calibrada precisamente para la carga de trabajo. El intercambio respiratorio de gases fue medido «on-line» utilizando técnicas standard de circuito abierto (analizadores AMETEK S-3A O2, Beckman LB-2 CO2, transductor de presión Validyne MP 45 y Neumotacógrafo Fleisch N° 3). Esas mediciones fueron utilizadas para calcular VO2 producción de CO2 (VCO2) y ventilación por minuto (VE). El mismo equipamiento fue utilizado para todos los estudios de ejercicio a NM y a altitud elevada.
Ejercicio en estado estable
Se eligió una carga de trabajo submáxima para producir un VO2 que
fuese el 50% del VO2máx a NM. Ese mismo VO2 absoluto fue
utilizado para todos los estudios en estado estable a NM, en ascenso agudo a
4.300 m, y luego de 21 días de residencia en la altitud. Debido a que el VO2máx
no cambió entre unos pocos días de la llegada y 18 días de residencia en la
altitud, esa carga de trabajo representó el mismo % VO2máx para ambos
estudios en la altitud, pero fue una carga de trabajo relativamente mayor,
comparado con NM.
Las mediciones en reposo fueron hechas estando los sujetos sentados quietos en
una silla por 1 hora, luego de que toda la instrumentación fue completada. Los
sujetos entonces fueron sentados en una bicicleta ergométrica, y ejercitaron por
45 min. Varias mediciones, como fue descripto anteriormente, fueron hechas luego
de 5,15, 30 y 45 min., de ejercicio. Todos los sujetos estuvieron capacitados
para completar 45 min., de ejercicio a NM, y luego de 21 días en la altitud. Dos
sujetos estuvieron capacitados para ejercitar solo por 30 min., a la llegada a
la altura.
Cateterizaci6n femoral arterial y venosa
Luego del uso de anestesia local Xylocaína, la arteria femoral y su vena en la misma pierna fueron canalizadas por el uso de técnicas percutáneas standard, tal fue descripto anteriormente (3). Un catéter de 23 cm., 5-Fr (North American Medical Instrument, modelo 91100900) fue ubicado en la aorta abdominal distal. Un catéter 6-Fr de termodilución venosa (American Edwards Laboratories, modelo 93-135-6F) fue pasado a través de la vaina de la vena femoral para posicionar su punta en la vena iliaca - 13 cm., de la piel. Ambos catéteres fueron asegurados por una sutura en la piel y una venda elástica envuelta en el muslo superior y la cintura, sobre el punto de inserción. Las porciones externas de ambos catéteres fueron dirigidas lateralmente a lo largo del muslo para permitir el acceso al muestreo durante el ejercicio. No hubo complicaciones significativas en el procedimiento. Se utilizaron piernas alternadas para cada período de evaluación.
Mediciones sanguíneas
Las muestras de sangre arterial y venosa de la pierna fueron extraídas simultáneamente, en condiciones anaeróbicas, durante 5 seg cuando el VO2 alcanzó el estado estable, en reposo, y a 5, 15, 30 y 45 min., durante el ejercicio. Las muestras de sangre fueron inmediatamente preservadas en hielo y fueron analizadas dentro de los 30 min., para obtener PO 21 PCO2 y pH (ABL 300, Radiometer Copenhagen). El contenido de oxígeno, la saturación de oxígeno y la concentración de hemoglobina (Hb) fueron medidas independientemente en cada muestra de sangre (Hemoxímetro OSM 3, Radiometer Copenhagen), y el Hematocrito (Hct) arterial fue determinado por el método de microhematocrito. Las temperaturas medidas en el termistor de la punta del catéter fueron utilizadas para corregir la tensión del gas sanguíneo a temperatura «in vivo».
La sangre arterial también fue obtenida en reposo, y luego de 15, 30 y 45 min., de ejercicio por la determinación de niveles de Norepinefrina (NE) en plasma. Esas muestras fueron analizadas con una técnica de cromatografía líquida (10).
Mediciones hemodinámicas
La frecuencia cardíaca fue determinada por monitoreo electrocardiográfico simple en una impresora Soltec (modelo 8K22, Sun Valley, CA). La presi6n de la arteria aórtica abdominal distal fue monitoreada en reposo, y a lo largo del ejercicio con un transductor lleno de fluido (Statham, modelo 23 DB) calibrado a presión cero a 5 cm., debajo del ángulo esternal (9), con impresiones fásicas en la impresora Soltec.
Luego de la extracción de muestras en reposo y durante el ejercicio, se determinó el volumen minuto cardíaco por la técnica de dilución de tintura verde lndocyanina, con la inyección de un bolo de tintura dentro de la vena iliaca y muestreo continuo de sangre arterial femoral a través de una célula espectrofotométrica (densitómetro y cuvette Waters D-402A, Rochester, MN) para generar una curva indicadora de dilución en la impresora. Las mediciones fueron hechas en reposo; y a 5, 15, 30 y 45 min., de ejercicio. La validez de cada medición fue determinada tanto por la morfología de la curva como por la consistencia del esfuerzo, a lo largo de la misma carga de ejercicio. Si la morfología de la curva era considerada atípica, la determinación del volumen minuto cardíaco era repetida volviendo a cero el espectrofotómetro para detectar cualquier tintura residual de la primera inyección. Fue utilizado un volumen de 0.75 ml de tintura para los estudios a NM y en la llegada a la altitud, en tanto la cantidad fue reducida en 0.5 ml para el estudio luego de la aclimatación (porque las curvas fueron mayores debido a la declinación en el volumen minuto cardíaco). El volumen minuto cardíaco fue determinado a partir de esas curvas por la f6rmula standard:
Volumen Minuto Cardfaco = 1 x 60 s/min/A x factor cal, donde: 1 es indicador de concentración, A es el área de la curva, y el factor cal esta determinado de la curva standard de tintura verde en la sangre del sujeto individual (19). Fue utilizado el método Hamilton para evaluar la porción descendente de la curva antes de la recirculación (11).
Luego de tomar las muestras de sangre, se estimó el flujo sanguíneo de la vena iliaca desde la inyección de un bolo de 10 ml de solución salina esterilizada, enfriada a cerca de 0° C, a través de un Set 11(Modelo 93-520 de American Edwards Laboratories) por la técnica de termodilución utilizando una computadora de volumen minuto cardíaco (American Edwards Laboratories modelo 9520). Las mediciones fueron hechas por triplicado, en reposo y durante cada periodo de muestreo, durante el ejercicio. La validez de las mediciones fue determinada obteniendo en la impresora Soltec curvas morfológicas de termodilución apropiadas con cada determinación. La validez y precauciones utilizadas con esta técnica fueron descriptas previamente (3, 28).
Variables hemodinámicas derivadas
El VS fue calculado dividiendo el volumen minuto cardíaco por la frecuencia cardíaca. La resistencia vascular sistémica file determinada dividiendo la tensión arterial media (TAM) por el volumen minuto cardíaco, en tanto la resistencia vascular de la pierna fue obtenida dividiendo TAM por FSP. Los valores de resistencia son expresados como unidades de resistencia periférica (Torr/l. min). La conductividad vascular de la pierna fue determinada dividiendo FSP por TAM. El transporte o distribución de O2 corporal total fue el producto del volumen minuto cardíaco x contenido de O, arterial, en tanto el transporte de O2 de la pierna fue el producto del flujo sanguíneo de la pierna x contenido de O2 arterial.
Mediciones de volumen sanguíneo
El volumen sanguíneo fue determinado por el uso de una técnica modificada de reinspiración de monóxido de carbono (CO). Este método se impuso teniendo que reinspirar el sujeto una mezcla de 6 a 8 litros de gas que contenga > 40 % de O2 en N2, con un absorbente de CO2 ubicado en la línea de inspiración. Las muestras de sangre venosa fueron obtenidas 5 min antes y 10 min después de la introducción de un volumen conocido de CO en el circuito de reinspiración. El Hematocrito fue medido inmediatamente después, y las muestras fueron almacenadas a 4° C para la medición subsecuente de Hemoglobina y Carboxihemoglobina total (HbCO). Todas las mediciones fueron hechas por un investigador (TED). La HbCO fue medida por el uso de una técnica cromatográfica descripta previamente (4). EI volumen sanguíneo total fue calculado por la fórmula:
VS = (VCO stpd / CO / HbS) / [Hb]c
donde: VS es el volumen sanguíneo total; VCO stpd es el volumen de monóxido de carbono (stpd) introducido dentro del circuito de reinspiración; 0 CO / Hb, es el cambio en HbCO expresado en mililitros stpd por gramo de hemoglobina; y [Hb], es la concentración total de hemoglobina por mililitro de sangre entera. El volumen de eritrocitos (GR) fue obtenido multiplicando el volumen conocido por el Hematocrito post-CO. El volumen plasmático fue obtenido sustrayendo el volumen GR del volumen sanguíneo total. Los volumenes sanguíneos obtenidos por esta técnica en nuestro laboratorio estuvieron dentro del 3-6 % de los valores obtenidos por el método de GR marcados con Tecnecio 99 (99Tc). Mediciones repetidas con el uso de la técnica de reinspiración de CO en cinco sujetos revelaron que las mediciones fueron reproducibles dentro de 4.8 ± 0.9 % para el volumen sanguíneo total, 5.6 ± 0.9 % para el volumen de GR, y 2.4 ± 7 % para el volumen plasmático. Todas las mediciones de volumen sanguíneo fueron obtenidas un día antes de la ejecución del estudio de ejercicio en estado estable para minimizar todo efecto del muestreo de sangre durante esos estudios sobre la determinación del volumen sanguíneo. Las mediciones de volumen sanguíneo fueron obtenidas a NM y en el día 18 de residencia a 4.300 m. El volumen sanguíneo no fue directamente medido a la llegada a la altitud debido a la urgencia por realizar el estudio de ejercicio hemodinámico, y la preocupación por la influencia del CO sobre la performance del ejercicio. A la llegada, el volumen sanguíneo fue estimado por el cambio en el Hematocrito comparado con NM, asumiendo que todos los cambios en el volumen sanguíneo estuvieron relacionados con los efectos del volumen plasmático.
Estadística
Los valores están expresados como medias ± ES (Error Standard) en el texto, en tablas y figuras. Se utilizo un análisis de variancia (ANOVA) a dos vías, tanto con el test de Student-Newman-Keuls (SNK) como con el de comparación múltiple Scheffe, para determinar diferencias entre períodos de evaluación, así como también diferencias entre varios momentos durante el ejercicio. P <0.05 fue considerado un valor estadísticamente significativo.
RESULTADOS
El VO2, máx fue 3.549 ± 89 ml/min a NM, 2.694 ± 86 ml/min (76 ±2 % del, VO2máx a NM) en el día 5 (PP5), 2.679 ± 93 ml/min (75 ± l % del VO, I X a NM) en el día 7, y 2.719 ± 79 ml/min (77 ± 1 % del VO2máx a NM) en el día 18 a 4.300 m. Por lo tanto, no hubo diferencias en el VO2máx a 4.300 m. Por diseño, el VO2 fue mantenido a nivel constante durante el ejercicio submáximo a NM, y a4.300 m de altura, siendo 1.804 ± 27 ml/min (51 ± 1 % del VO2máx) a una intensidad de trabajo de 101 ± 3 W, 1.817 ± 61 ml/min (67 ± 2 % del VO21 , X PP-5) a una intensidad de trabajo de 97 ± 2 W, y 1.820 ± 15 ml/min (68 ± 1 % del VO2máx X PP5) a una intensidad de trabajo de 97 ± 3 W, para NM, altitud aguda y altitud crónica, respectivamente. Además, el VO2 permaneció sin cambios durante los últimos 40 min de ejercicio submáximo, lo que confirma un estado estable del gasto de energía corporal total (Tabla 1). La temperatura sanguínea se elev6 1.0° C entre los 5 y 45 min de ejercicio, sin diferencias significativas entre NM y 4.300 m.
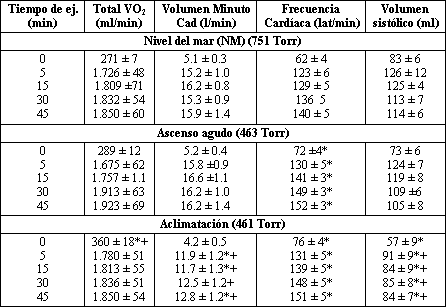
Tabla 1. Respuestas
circulatorias centrales a nivel del mar, al ascenso agudo, y a 21 días de
aclimatación 4.300 metros.
Tiempo de ej. (min) Total VO2 (ml/min) Volumen Minuto Cad (l/min)
Frecuencia Cardíaca (lat/min) Volumen sistólico (ml)
Nivel del mar (NM) (751 Torr)
Los valores son medias ± ES. VO2= Consumo de O2; 0=
Estado de reposo. El volumen sistólico es calculado como volumen minuto
cardíaco/frecuencia cardiaca. (*) P <0.05 por ANOVA para el mismo periodo de
tiempo, comparado con el nivel del mar; (+) P <0.05 por ANOVA para el mismo
periodo de tiempo comparado con el test de ascenso agudo.
A la llegada a 4.300 m hubo un incremento significativo en la frecuencia cardiaca durante el ejercicio. Esto no fue acompañado de un incremento en el volumen minuto cardíaco, debido a una tendencia a menor VS comparado con NM.
Con la aclimatación hubo un 25 % de reducción en el volumen minuto cardíaco en el ejercicio, explicado íntegramente por una caída similar en VS (Tabla 1).
El FSP no cambió entre NM y la hipoxia aguda, pero decreció 18 % como resultado de la aclimatación (Tabla 2). El porcentaje de volumen minuto cardíaco hacia ambas piernas durante el ejercicio fue similar para NM, en hipoxia (tanto aguda como crónica), sin evidencia de redistribución como resultado de la aclimatación (Fig. 1 A). El VO2 de la pierna fue mas bajo durante el ejercicio submáximo a altitud elevada, comparado con NM, sin un cambio adicional como resultado de la aclimatación. El porcentaje de VO = corporal total para las piernas fue más bajo en la altitud, sin diferencias luego de la aclimatación (Fig. 1 B). La TAM tendió a declinar en cierta forma con la hipoxia aguda, pero se incrementó significativamente con la aclimatación.
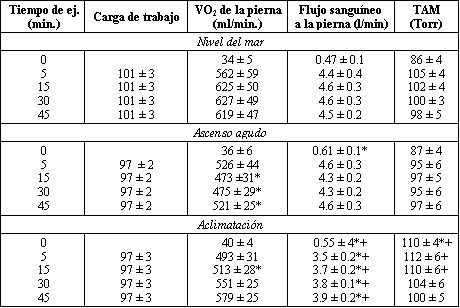
Tabla 2. Respuestas
fisiológicas de la pierna en ejercicio a nivel del mar, en ascenso agudo, y con
21 días de aclimatación a 4.300 metros.
Los valores son medias ± ES. TAM = Tensión Arterial Media; 0= Estado de reposo. () P <0.05 por ANOVA comparado con nivel del mar, (+) P <0.05 por ANOVA comparado con ascenso agudo.
La PCO2 arterial en reposo decreció de 40± 1 Torr a NM hasta 30 ± 1 Torr en hipoxia aguda (P <0.05) y 23 ± 1 Torr en hipoxia crónica (P <0.05 comparado con hipoxia aguda). No hubo una caída acentuada en PO2 arterial y saturación de O2 durante el ejercicio con hipoxia aguda y restauración parcial hacia los valores de NM con la aclimatación (Tabla 3). La saturación de O2 arterial y la concentración de Hb (ambas) se incrementaron con la aclimatación, resultante en elevaciones acentuadas en el contenido de O2 arterial. Debido al contenido de O2 arterial reducido a la llegada, y los flujos sanguíneos sin cambios, la distribución de O2 tanto a las piernas como a todo el cuerpo se redujeron (Figura 2, A y B). Luego de la aclimatación, el volumen minuto cardíaco y el FSP disminuyeron, tanto como el contenido de O2 arterial se incrementó, resultante en distribuciones de O2 que permanecieron sin cambios, comparadas con el arribo a la altura, y más bajas que en NM. La distribución de O2 a las piernas y a todo el cuerpo se comportaron de manera similar.
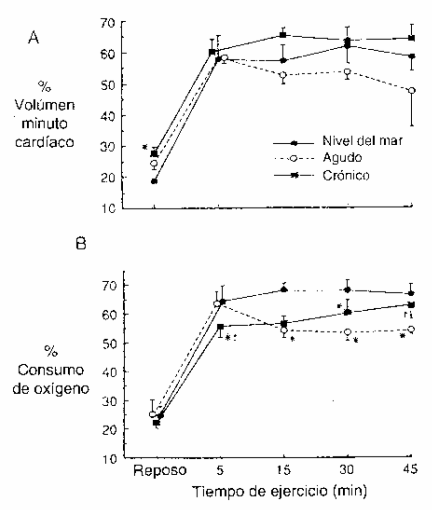
Figura 1. A:
Porcentaje de volumen minuto cardíaco para ambas piernas en reposo y durante
ejercicio a nivel del mar (NM), en hipoxia aguda. (Agudo), e hipoxia crónica
(Crónico). B: Pocentaje del consumo de O2 total para ambas piernas en
reposo, durante ejercicio a NM, y durante hipoxia aguda y crónica. Los valores
son medias ± ES. (*) P <0.05 comparado con NM; (+) P <0.05 comparado con Agudo
El Hct arterial resultó, de alguna manera, incrementado con la hipoxia aguda, pero hubo una elevación prominente luego de la aclimatación. La hipoxia aguda resultó en un detrimento del volumen plasmático y del volumen sanguíneo total. En contraste, la aclimatación estuvo asociada a un incremento en el volumen GR que acompañó a una caída en el volumen plasmático, no generando en un cambio general en el volumen total (Tabla 4).
La hipoxia aguda no resultó en cambios en la resistencia vascular sistémica en reposo y durante el ejercicio, en tanto hubo un detrimento significativo en la resistencia vascular de la pierna y un incremento en la conducción vascular de la pierna, sugiriendo alguna vasodilatación local (Fig. 3). En contraste, la aclimatación resulto en marcados incrementos en las resistencias vasculares sistémica y de la pierna, especialmente durante el ejercicio. Estos cambios estuvieron acompañados por un detrimento en la conducción vascular de la pierna.
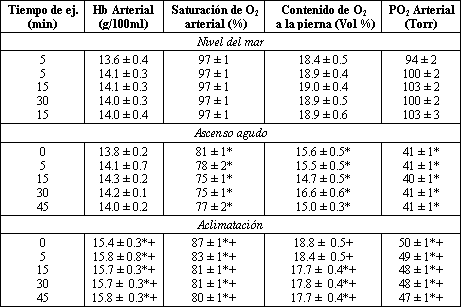
Tabla 3. Respuestas del O2 sanguíneo arterial a nivel del
mar, ascenso agudo y 21 días de aclimatación a 4.300 m.
Los valores son medias ± SE. Hb = Hemoglobina; 0 = reposo. (*) P <0.05 por
AN[OVA, comparado por tiempo similar a nivel del mar; (+) P < 0.05 por ANOVA,
comparado con ascenso agudo.
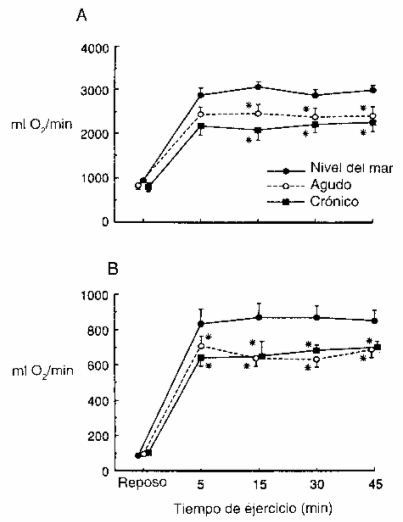
Figura 2. A: Media de distribución de O2 corporal total en
reposo durante el ejercicio a NM, y en hipoxia aguda y crónica. Distribución de
O2 corporal total = volumen minuto cardiaco x contenido arterial de O2,
B: media de distribución de oxigeno a las piernas en reposo y durante ejercicio
a NM, y en hipoxia aguda y crónica. Distribución de O2a las piernas =
flujo sanguíneo a las piernas x contenido de O2 arterial. Los valores
son medias ± ES. (*) P <0.05 comparado con NM.
La NE arterial de reposo fue 0.56 ± 0.07 ng/ml a NM; esta decreció a 0.35 ± 0.04 ng/ml con la hipoxia aguda (P <0.05), pero luego de la aclimatación se elevó a0.80±0.05 ng/ml, lo que fue significativamente mayor que los otros dos valores (P <0.05). Durante el ejercicio, el nivel medio de NE promediado durante 45 min fue 2.08 ± 0.25 y 2.23 ± 0.12 ng/ml a NM y a la llegada a la altitud, respectivamente (P = NS), pero se elevó (P <0.05) a 2.85 ± 0.23 ng/ml con la aclimatación. Esto representó un incremento del 28 % en NE con el ejercicio en el periodo de aclimatación.
En total, durante el ejercicio, la aclimatación resultó en detrimentos significativos del volumen minuto cardíaco, VS y FSP; sin cambios en el volumen total; y marcados incrementos en TAM, resistencias vasculares de la pierna y sistémica, y niveles de NE en plasma (Fig. 4)
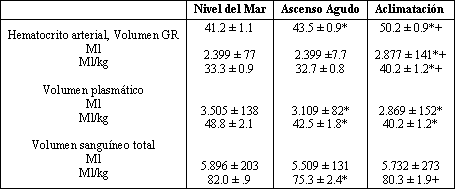
Tabla 4. Respuestas
del volumen sanguíneo a nivel del mar, ascenso agudo y con 18 días de
aclimatación a 4.300 metros.
Los valores son medias ± ES. El volumen sanguíneo en hipoxia aguda fue
estimado a partir de cambios en el Hematocrito asumiendo que stodos los efectos
fueron secundarios a detrimentos en el volumen plasmático (*) P <0.05 por ANOVA
comparado con el nivel del mar; (+) P <0.05 por ANOVA comparado con ascenso
agudo.
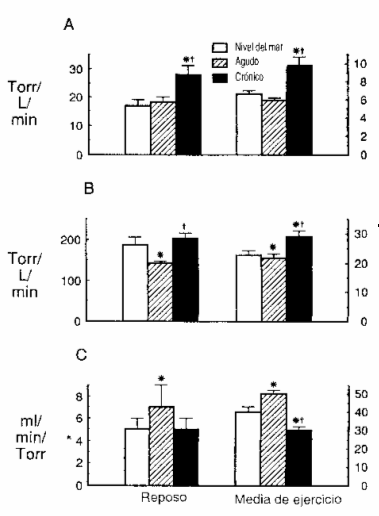
Figura 3. A:
Resistencia vascular sistémica media en reposo y durante el ejercicio a NM, y en
hipoxia aguda y crónica. Los valores de ejercicio fueron promediados durante un
periodo de 45 min. B: Resistencia vascular media de la pierna en reposo y
durante el ejercicio a NM, y en hipoxia aguda y crónica. C: Conductancia
vascular media de la pierna en reposo y durante el ejercicio a NM, y en hipoxia
aguda y crónica. Los valores son medias ± ES. () P <0.05 comparados con NM, (+)
P <0.05 comparado con Ascenso Agudo.
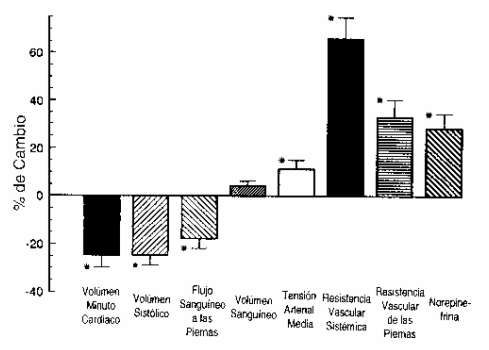
Figura 4. Efectos
cardiovasculares de la aclimatación durante el ejercicio submáximo. Los
porcentajes fueron obtenidos de valores en hipoxia aguda vs., crónica. Los
valores son medias ± ES. () P <0.05.
DISCUSION
Los resultados de esta investigación dan soporte a la evidencia previa de que tanto el volumen minuto cardíaco (2, 7, 13, 15, 18, 29) como FSP (3) durante el ejercicio submáximo son reducidos con la aclimatación a altitud elevada. El único aspecto de este estudio es que tanto volumen minuto cardíaco como FSP fueron medidos concurrentemente en varios momentos a lo largo del mismo nivel absoluto de ejercicio submáximo prolongado. En esta forma, podría ser determinada la distribución del volumen minuto cardíaco a los tejidos ejercitados y no ejercitados. Adicionalmente, esas mediciones hemodinámicas fueron hechas en conjunción con la determinación de los niveles de NE arterial tanto como del volumen sanguíneo en reposo. Esta fue la primera investigación que incluyó la determinación de todos los mayores factores potencialmente involucrados en el transporte de O2 en altitud elevada. Los hallazgos no sugieren redistribución del volumen minuto cardíaco entre el miembro en ejercicio y otras regiones del cuerpo durante el ejercicio ejecutado durante exposición aguda o crónica a la hipoxia; por lo tanto, las respuestas del flujo sanguíneo periférico y central ocurrieron en paralelo a la carga de trabajo utilizada. Tanto el transporte de O2 corporal total como de la pierna, permanecieron constantes a través del tiempo en la altitud, aunque más bajos que en NM. Los detrimentos en el flujo sanguíneo se contraponen a los incrementos observados en el contenido de O2 arterial, no resultando, por lo tanto, en un incremento en el transporte de O2 como resultado de la aclimatación.
A lo largo de esta investigación, el VO2 permaneció constante durante el ejercicio submáximo. Por lo tanto el transporte de O2 corporal total fue más bajo en hipoxia aguda y crónica que a NM a pesar del constante VO2 corporal total. Las cargas de trabajo utilizadas en la altitud tendieron a ser de alguna manera más bajas que a NM (Tabla 2) para mantener el VO2 corporal total constante. Este menor VO2 de la pierna puede reflejar VO2 elevado tanto en lechos de músculo no ejercitado o, probablemente también, por los músculos respiratorios, dado que el trabajo respiratorio es mayor que a NM (8). Este detrimento en el VO2 de la pierna probablemente contribuyó al menor transporte de O2 de la misma, visto durante hipoxia aguda y crónica; sin embargo, como se revela por las respuestas circulatorias centrales, el proceso de aclimatación por si solo tuvo un efecto más profundo.
En este estudio no hubo incrementos significativos en volumen minuto cardíaco o FSP durante el ejercicio con hipoxia aguda comparado con NM. Estos hallazgos difieren de otros estudios de hipoxia aguda donde son administradas (en forma aguda o brusca) bajas concentraciones de oxigeno inspirado, lo que resulta en un incremento del flujo sanguíneo durante el ejercicio (23). Los sujetos en este estudio pasaron una noche a una altitud intermedia de 1.954 m, lo que pudo generar algunas adaptaciones ventilatorias prematuras. La PCO, arterial de reposo de 30 ± 1 Torr en hipoxia aguda sustenta esta explicación. A pesar de esta potencial adaptación prematura, se reflejan marcadas diferencias entre los periodos de evaluación en hipoxia aguda y crónica, indicando marcados efectos de la aclimatación sobre el transporte de O2.
Uno de los potenciales mecanismos para los detrimentos en el flujo sanguíneo observados con la aclimatación, podría ser un detrimento en el volumen sanguíneo total, resultante, por lo tanto, en menos llenado cardíaco y un menor VS. Es muy dudoso que ocurra disfunción cardíaca, ya que nunca ha sido observado, incluso a altitud extrema (20, 27). Estudios previos han sugerido que los detrimentos en el volumen minuto cardíaco observados con la aclimatación estuvieron relacionados a reducciones en el volumen plasmático resultantes de presiones atriales derechas mas bajas y volumenes intraventriculares mas pequeños (1, 2). A pesar de estos hallazgos, hubo mejorías mínimas observadas en el VS de ejercicio con expansión de volumen (2), y flebotomía más reemplazo de volumenes (13) en sujetos, luego de aclimatación a altitudes moderadas.
Adicionalmente, los residentes crónicos de altitud moderada logran mejorías en el volumen minuto cardiaco y VS luego del descenso a NM, sin cambios significativos en el volumen sanguíneo total (12). Los hallazgos en el presente estudio también cuestionan la importancia del volumen sanguíneo como el mayor determinante de la reducción en el flujo sanguíneo observada con la aclimatación. La caída del volumen plasmático que se observa con la aclimatación fue contrarrestada por un incremento en la masa de GR. Por lo tanto el volumen sanguíneo total de reposo no cambió significativamente con el tiempo a 4.300 m, a pesar del 25 % de detrimento en el VS de ejercicio. Si bien el volumen sanguíneo no fue medido directamente en el ascenso agudo a la altitud, el use del Hct como un indicador de cambios en el volumen plasmático fue suficiente para determinar la adaptación ocurrida entre la hipoxia aguda y crónica. Otros estudios han reportado un detrimento (16) o ningún cambio (26) en el volumen sanguíneo total con la aclimatación a altitudes moderadas, aunque no se hicieron mediciones hemodinámicas. Los hallazgos difieren debido al tiempo variable en la altitud, los métodos utilizados para determinar el volumen sanguíneo y la falta de detalles en lo concerniente a la ingesta nutricional y de fluidos de los sujetos. La presente investigación difirió de todos estos otros estudios debido a la atención puesta en el estado metabólico y nutricional de los sujetos (observaciones no publicadas de G.E. Butterfield, J. Gates, G.A. Brooks, J.R. Sutton y J.T. Reeves). El peso corporal total se redujo solo un 3 % durante los 21 días a 4.300 m.
Hubo un marcado incremento en la tensión arterial sistémica media, tanto como incrementos en la resistencia vascular sistémica y de la pierna, que acompañó a los detrimentos en volumen minuto cardíaco y FSP observados con la aclimatación (Fig. 4). Estudios previos también mostraron un incremento en la TAM con aclimatación a altitud moderada (3, 7, 24, 29, 30). Los incrementos en la resistencia vascular sistémica y de la pierna ocurrieron en contraposición a una elevación en la TAM y un detrimento en el flujo sanguíneo. El análisis de la conductancia vascular de la pierna reve1ó una marcada diferencia entre hipoxia aguda y crónica (Fig. 3C). Si bien la conductancia vascular de la pierna se incrementó significativamente en el ascenso agudo a la altitud, hubo un marcado detrimento debajo de los niveles de NM e hipoxia aguda, como resultado de la aclimatación.
Esos cambios en resistencia vascular y conductancia están directamente relacionados con el proceso de aclimatación, en el cual el contenido de O2 arterial se incrementa en tanto el flujo sanguíneo decrece. Si bien el Hct arterial se incrementa solo modestamente desde 43.5 ±0.9 a 50.2±0.9 %, puede haber ocurrido algún incremento en la viscosidad de la sangre. Este incremento en la viscosidad de la sangre debe ser considerado como un posible mecanismo para el incremento en la resistencia vascular observado con la aclimatación. Un estudio previo en animales, utilizando transfusiones de intercambio isovolémico, bajo condiciones de normoxia, mostró incrementos paralelos en la viscosidad de la sangre entera, y tanto la resistencia vascular sistémica como el Hct se incrementaron de 40 a 55 % (6). Esos cambios fueron registrados solo en reposo, no durante ejercicio, y no estuvieron acompañados de un incremento en la TAM.
Estudios realizados en perros a 1.500 m, con el use de transfusiones de sangre entera para producir incrementos similares en Hb y Hct, no resultaron en un incremento en la resistencia vascular sistémica (l7). Solo cuando el hematocrito se incrementó a 65 %, cayó el volumen minuto cardíaco y la resistencia vascular sistémica se incrementó, en tanto la distribución de O2 sistémica permaneció sin cambios. Finalmente, estudios usando transfusiones iosovolémicas de GR conteniendo 100 % Hb-met sugieren que el contenido de O2 arterial puede ser más importante que la viscosidad de la sangre en la regulación del flujo sanguíneo y la resistencia vascular, especialmente durante el ejercicio (comunicación personal de J. Lindelfeld, J.V. Weil, V.L. Travis y L.D. Horowitz). A pesar de esta información, debe considerarse que existe una contribución de la viscosidad de la sangre entera aumentada en la elevación de la resistencia vascular observada con la aclimatación. Si bien la viscosidad de la sangre entera no fue medida en este estudio, no es probable que el modesto incremento esperado en la viscosidad de la sangre pudiera explicar completamente el 65 % de incremento en la resistencia vascular sistémica y el 33 % de incremento en la resistencia vascular de la pierna, observados durante el ejercicio luego de la aclimatación.
La vasoconstricción activa resultante del incremento en la resistencia
vascular puede ser el mecanismo responsable de la regulación del flujo sanguíneo
en relación al contenido de O2 arterial con la hipoxia crónica, para
mantener el transporte de O2 El mecanismo preciso para esta
vasoconstricción activa no puede ser determinado por los datos disponibles en
esta investigación. Una causa potencial para que la vasoconstricción conduzca a
incrementos en la resistencia vascular con la aclimatación podría ser la
actividad nerviosa simpática elevada. Los niveles de NE en plasma fueron
elevados en hipoxia crónica, pero no en hipoxia aguda en este estudio. Este
patr6n de elevación de NE con la exposición a la hipoxia en altitud elevada
difirió de aquel de la epinefrina, y apareció ligado a los incrementos
observados en la resistencia vascular (observaciones no publicadas de R.S.
Mazzeo, P.R. Bender, G.A. Brooks, G.E. Butterfield, B.M. Groves, J.R. Sutton,
E.E. Wolfel y J.T. Reeves). Si bien los niveles de NE en plasma son solo un
indicador de actividad nerviosa simpática, durante el ejercicio están
directamente relacionados a la actividad nerviosa simpática muscular (25).
Aunque ha sido mostrado que los niveles de NE en plasma subestiman la presencia
de la actividad nerviosa simpática muscular incrementada durante el reposo en
hipoxia aguda (23), esto ocurrió en forma primaria a niveles más severos de
hipoxemia que en el presente estudio. Además, hubo una pobre correlación entre
actividad nerviosa simpática muscular individual y las respuestas fisiológicas.
Con la hipoxia crónica, especialmente durante el ejercicio, las elevaciones de
NE en plasma podrían reflejar una liberación acrecentada, derrame o una
reducción en la depuración (<
Por lo tanto, nuestros hallazgos sugieren que la regulación del transporte de O2 del cuerpo total y de la pierna en ejercicio durante la hipoxia crónica, ocurre en paralelo, está relacionada con la reducción del flujo sanguíneo central y periférico, y puede estar mediada par una vasoconstricción conducida simpáticamente, resultante en una resistencia vascular elevada y conductancia reducida. Los cambios en el volumen sanguíneo con la aclimatación no parecen tener una influencia mayor en esta regulación. Se necesitan trabajos adicionales para definir más precisamente el rol de la estimulación simpática en la adaptación del transporte de O2 en, hipoxia crónica.
Referencias
1. Borkan G (1940). Relationship between cigarette smoking. chest size and body size in health-screened adult males. Ann Hum Biol 1981;8: 153-60
2. Albanes D. Jones Y. Micozzi MA. Mattson ME (1987). Associations between smoking and body weight in the US population: analysis of NHANES 11. Am J Public Health; 77:439-44
3. Gordon T. Kanncl W'B. Dawber TR. McGee D (1975). Changes associated with quitting cigarette smoking: The Framingham Study. Am Heart J:90:322-8
4. Stamford B.A. Matter S. Fell RD. Papenek P (1986). Effects of smoking cessation on weight gain, metabolic rate, caloric consumption. and blood lipids. Am 1-Clin Nutr: 43:486-94
5. Fehily AM. Phillips KM, Yarnell WG (1984). Diet. smoking- social class. and body mass index in the Caerphilly heart disease study. Am J Clin Nutr:40:827-33
6. Shimokata H. Muller DC, Andres R (1989). Studies in the distribution of body fat: Ill. effects of cigarette smoking. JAMA: 261:116973
7. Barrett-Connor E. Khaw KT (1989). Cigarette smoking and increased central adiposity. Ann Intern Med:111:783-7
8. Comstock GW'. Stone RA' (1972). Changes in body weight and subcutaneous fatness related to smoking habits. Arch Environ Health:24:271-6
9. Nemen B. Moavero NE. Brasscur L. Stanescu DC (1983). moking. lung function. and body weight. Clin Res:286:249-51
10. Jacobs DR. Gottcnborg S (1981). Smoking and weight: the Minnesota lipid research clinic. Am J Public Health 71:391-6
11. Haffner SM. Stern MP. Hazuda HP. Pugh J. Patterson JK. Malina R (1986). Upper body and centralized adiposity in Mexican-Americans and nonhispanic whites: relationship to body mass index and other behavioral and demographic variables. Int J Obes:10:493- 502
12. Shimokata H. Tobin JD. M taller DC. Elahi D. Coon PJ. Andres R (1989). Studies in the distribution of body fat: 1. effects of age. sex, and obesity. J Gerontol:44:M66-73
13. Enzi G. Gasparo M. Biondetti PR. Fiore D. Semisa M. Zurlo F (1986). Subcutaneous and visceral fat distribution according to sex. age. and overweight. evaluated by computed tomography. Am 1 Clin Nutr: 44:73916
14. Seidell IC. Oosterlee A. Thijssen MAO. et al (1987). Assessment of introabdominal and subcutaneous abdominal fat: relation between anthropometry and computed tomography. Am J Clin Nutr: 45: 7-13
15. Vague I (1956). The degree of masculine differentiation orobesities: a factor determining predisposition to diabetes. atherosclerosis, gout. and uric calculous disease. Am J Clin Nutr: 4:20-34
16. Feldman R. Sender Al. Siegelaub AB (1969). Difference in diabetic and nondiabetic fat distribution patterns by skinfold measurements. Diabetes: 18:478-86
17. Hartz AI, Rupley DC. Kalkoff RD. Rimm AA (1983). Relationship ofobesity to diabetes: influence of obesity level and body fat distribution. Prev Med:12:351-7
18. Ohlson L-0, Larsson B, S%ardsudd K. et al (1985). The influence of body fat distribution on the incidence of diabetes mellitus: 13. 5 years of follow-up or the participants in the study of men born in 1913. Diabetes. 34:1055-8
19. Sparrow D. Borkan GA, Gcrzof SG, Wisniewski C, Silbett JE (1986). Relationship of fat distribution to glucose tolerance: results of computed tomography in male participants of the normative aging study. Diabetes: 35:411-5
20. Kalkoff RK, Hartz AH. Rupley D, Kisscbah AH. Kelber S (1983). Relationship or body fat distribution to blood pressure, carbohydrate tolernc, and plasma lipids in healthy obese women. J Lab Clin N1ea: 102:621-7
21. Freedman DS, Srinivasan SR, Burke GL, et al (1987). Relationship of body fat distribution to hyperinsulinemia in children and adolescents: the Bogalusa heart study. Am I Clin Nutr; 46;403-10
22. Gillum RF (1987). The association orbody fat distribution with hyperten sion- h. pertensive heart disease, coronary heart disease, diabetes and cardiovascular risk factors in men and women aged 18-79 years. J Chronic Dis: 40:421-9
23. Seidell JC, Bakx IC, De Boer E, Deurenberg P, Hautvast JGAJ (1985). Fat distribution of overweight persons in relation to morbidity and subjective health. Int J Obes: 9:363-74
24. Larsson B. Svardsudd K, Welin L, Wilhelmsen L. Bjorntorp P, Tibblin G (1984). Abdominal adipose tissue distribution, obesity, and risk of cardiovascular disease and death: 13 year follow up of participants in the study of men born in 1913. Br Med J: 288:1401-4
25. Bell B. Rose CL, Damon H (1972). The normative aging study: an interdisciplinary and longitudinal study orhealth and aging. Aging Hum:3:5-17
26. STOKKE, K. T., K. ROO'FWELT, R. WERGELAND, AND J. R. VALE (1986). Changes in plasma and red cell volumes during exposure to high altitude. Stand. J. Clin. Lab. Incest. 46, SupoL 184: 113-117
27. SUAREZ, J., J. K. ALEXANDER, AND C. S. HOUSTON (1987). Enhanced left ventricular systolic performance at high altitude during Operation Everest II. Am. J. Cordial. 60: 137-142
28. SULLIVAN, M. J., P. K. BINKLEY, D. V. UNVERFERTH, AND C. V. LEIER (1987). Hemodynamic and metabolic responses of the exercising lower limb of humans. J. Lab. Clin. Med. 110: 145-152
29. VOGEL, J. A., J. E. HANSEN, AND C. W. HARRIS (1967). Cardiovascular responses in man during exhaustive work at sea level and high altitude. J. Appl. Physiol. 23: 531-539
30. VOGEL, J. A., L. H. HARTLEY, J. C. CRUZ, AND R. P. HOGAN (1974). Cardiac output during exercise in sea-level residents at sea level and high altitude. J. Appl. Physiol 36: 169-172