Umbrales de Ventilación y Frecuencia Cardiaca durante el Ejercicio Incremental y la Oclusión Venosa de las Piernas
Department of Kinesiology, Midwestern State University, Wichita Falls, TX, Estados Unidos.
Artículo publicado en el journal PubliCE del año 2012.
Publicado 2 de julio de 2008
Resumen
Palabras clave: metabolitos, aferente, periférico, cardiorrespiratorio
INTRODUCCION
Durante el ejercicio, a medida que se incrementa la tasa de trabajo, una serie de variables fisiológicas medidas se incrementan proporcionalmente. Los sistemas corporales interactúan para adaptarse a las demandas impuestas. Entre estas interacciones están incluidos los sistemas de bioenergética del metabolismo, musculoesquelético, cardiorrespiratorio y endocrino. A medida que la tasa de trabajo se incrementa, ocurre un punto de tasa de cambio desproporcionada dentro de las variables específicas (1). Pueden ser usadas diferentes variables para definir umbrales específicos. La tasa de trabajo a la cual las concentraciones de lactato sanguíneo muestran una tasa de cambio desproporcionada es llamada umbral del lactato (LT) (2). El umbral del lactato sanguíneo parece ser un desequilibrio entre la producción de lactato intracelular y los mecanismos de clearence, tal como el flujo a la sangre del lactato intracelular en exceso (3, 4). Subsiguientemente, el amortiguamiento del lactato sanguíneo produce ácido carbónico y un exceso de dióxido de carbono, lo cual resulta en una respuesta hiperventilatoria para establecer el equilibrio ácido-base, que es definida como umbral ventilatorio (VT) (5, 6). Recientemente, Smith et al. (1999) han demostrado que existe un estímulo intramuscular para la ventilación, el cual parece estar relacionado al VT (7). En el momento que en se produce el flujo del lactato hacia la sangre, identificado como LT, ocurre la acidosis metabólica intracelular con el incremento de la tasa de trabajo. Este LT ha sido usado como marcador del inicio de la fatiga muscular, un concepto que recientemente ha sido puesto en duda (2). La asociación estrecha entre el LT y el VT fue identificada por Wasserman et al. (1973) usando un muestreo sanguíneo en serie para el LT y una detección matemática de los cambios agudos en las variables ventilatorias, respiración a respiración, para la identificación del VT (8). Esto fue confirmado a través de un meta-análisis acerca del LT y el VT, en el cual su aparición no difirió (9). Los estudios y revisiones han especulado con la dinámica desproporcionada de las reacciones fisiológicas asociadas con estos umbrales. Williamson et al. (1993) investigaron el estímulo ventilatorio durante diferentes presiones positivas de los miembros inferiores (LBPP) y encontraron patrones de umbral alterado con el LBPP. Debido a que el lactato sanguíneo, el pH y el potasio (K+) no mostraron cambios con LBPP, ellos concluyeron en que las concentraciones intramusculares y/o presión de los tejidos influenciaron los cambios en el LT. Ellos debatieron acerca de si estos umbrales fueron el resultado de señales neurales aferentes que estimulan un comando central de prealimentación o fueron estimulados por medio de niveles periféricos de concentración de metabolitos (10).
Está bien establecido que dentro de los músculos que trabajan tanto los mecanorreceptores como los metaborreceptores funcionan para proporcionar retroalimentación neural a través de la circulación para satisfacer las demandas metabólicas del músculo (11, 12, 13). Tibes et al. (1977) compararon a atletas y no atletas durante un trabajo isquémico y no isquémico. Sus hallazgos indicaron que los cambios respiratorios estuvieron relacionados principalmente a la liberación del metabolito potasio (K+) desde el músculo. Sin embargo, esta asociación ocurrió durante el inicio del ejercicio y el inicio del incremento en la respuesta de la frecuencia cardiaca. El incremento en la acidosis metabólica dentro del músculo en ejercicio ha sido asociado directamente con la activación simpática (15, 16). A partir de los estudios anteriormente mencionados sería esperado que la acumulación de metabolitos intracelulares (i.e., H+, K+, CO2) produzca un incremento desproporcionado (umbral) en la frecuencia cardiaca. Cuando se los compara con los umbrales fisiológicos conocidos (i.e., lactato, ventilatorio), los hallazgos indican asociaciones significativas con el umbral de la frecuencia cardiaca (HRT) (17). Recientemente, fue determinada una técnica matemática para identificar de manera exacta un umbral de la frecuencia cardiaca (HRT) (18). Esta investigación también determinó correlaciones significativas a las mediciones de criterio de los umbrales de lactato y ventilatorio. Los investigadores han identificado que la acumulación de metabolitos (i.e., CO2, H+) dentro del músculo conduce a la activación directa de metaborreceptores de la respuesta ventilatoria (7, 10). Sus hallazgos no mostraron una influencia sobre el miocardio. Sin embargo, su falta de alteración miocárdica puede ser debido a la ausencia de un estudio matemático preciso de la respuesta de la frecuencia cardiaca durante la aparición del VT (7, 19).
Smith et al. utilizaron un procedimiento de oclusión del flujo sanguíneo venoso con cuff y por lo tanto atrapando metabolitos (7) a través de este procedimiento. Esto fue conseguido colocando cuffs de presión bilateralmente en los muslos de los sujetos que realizaban ejercicio e inflando los mismos hasta 90 mmHg. Mientras que se reduce el flujo sanguíneo venoso y se proporciona el efecto de atrapamiento anteriormente mencionado, a esta presión no se reduce el flujo sanguíneo arterial o el transporte de oxígeno. Usando una técnica de inflado con cuff, nosotros nos propusimos atrapar los metabolitos intramusculares durante un ejercicio en bicicleta ergométrica de tasa de trabajo progresiva hasta alcanzar un esfuerzo máximo. En base a la asociación entre acidosis intramuscular, VT, LT y activación simpática, es hipotetizado que la acidosis intramuscular va a influenciar el umbral de la frecuencia cardiaca. De este modo, el objetivo de la presente investigación fue demostrar, a través de la oclusión venosa, una modificación fisiológica del HRT, VT y tiempo hasta el agotamiento.
METODOS
Sujetos
Veinticuatro (n=24) sujetos de sexo masculino y femenino realizaron dos tests de ejercicio de carga de trabajo incremental en bicicleta ergométrica hasta la fatiga volitiva. Cada sujeto proporcionó un consentimiento informado por el Comité de Revisión Institucional del Centro de Ciencias de la Salud en la University of North Texas en Fort Worth. A los sujetos se les pidió que se abstuvieran de consumir bebidas con cafeína, alcohol y de realizar actividad física intensa por lo menos 12 horas antes de cualquier test programado.
Procedimiento
Cada sujeto realizó dos tests de ejercicio incremental hasta la fatiga volitiva en una bicicleta ergométrica (Monark 818e) para determinar la capacidad aeróbica pico (VO2 pico). Los sujetos fueron asignados aleatoriamente a uno de los siguientes grupos: 1) test sin intervención (CON); 2) test con inflado del cuff del muslo (CUFF). El segundo test (CON o CUFF) fue determinado por asignación aleatoria del primer procedimiento de evaluación. El protocolo CUFF implicó oclusión bilateral parcial del muslo mediante cuff, implementada al inicio del ejercicio y discontinuada hasta alcanzar el límite de tolerancia al ejercicio. Los manguitos o cuffs tenían un ancho de 4,5 pulgadas (11,43 cm) (Aspen Labs, Englewood, CO), fueron colocados tan elevados como fuera posible en los muslos e inflados hasta 90 mmHg bajo control solenoide. En esta presión ocurre el “atrapamiento” de metabolitos (7, 19). El test en bicicleta ergométrica comenzó con una entrada en calor a 50 vatios, seguida por la tasa de trabajo inicial del test a 100 vatios. La tasa de trabajo fue incrementada en 25 vatios cada 30 segundos hasta que el sujeto no pudiera continuar manteniendo la tasa de trabajo en una cadencia de por lo menos 60 rpm, a pesar del fuerte aliento verbal. Después del test inicial, los sujetos se recuperaron sentados y fueron rehidratados por un período no menor a 60 minutos, o hasta que las mediciones de frecuencia cardiaca y presión sanguínea hubieran regresado a la línea de base o condición inicial, antes de realizar el segundo test.
Mediciones
Fueron obtenidas las siguientes mediciones: frecuencia cardíaca (HR, lat.min-1); electrocardiograma estándar (ECG) latido a latido; consumo de oxígeno pico (VO2 pico) (L.min-1, mL.kg-1.min-1). Las mediciones ventilatorias fueron obtenidas mientras los sujetos respiraban a través de una boquilla adherida a un transductor de volumen de baja resistencia con turbina (Sensor Medics, VMM series), lo que permitió realizar análisis, respiración a respiración, de las concentraciones fraccionales de oxigeno (O2) y dióxido de carbono (CO2) por medio de espectrometría de masas (Perkin-Elmer MGA 1100B). El espectrómetro de masas fue calibrado antes de cada test usando gases estándar de alta precisión de concentración conocida. Las señales fueron analizadas usando una conversión analógica a digital en una computadora con un programa personalizado para la determinación on-line y, respiración a respiración, de la salida de datos de VO2, VCO2 y ventilación minuto (VE).
Análisis Estadísticos
Los estadísticos descriptivos incluyeron valores medios (±desviación estándar) de la información demográfica (i.e., talla, peso) y mediciones de ejercicio (i.e., VO2 pico, HR máx.). Fueron realizadas comparaciones bivariadas entre los grupos (CON vs. CUFF) a través de análisis de varianza para mediciones repetidas (RMANOVA). Fue utilizado el Coeficiente de Correlación Momento Producto de Pearson para determinar las asociaciones entre los umbrales. La determinación del umbral ventilatorio (VT) fue realizada utilizando el método V-slope (20). Este método de diseño experimental indica un punto de quiebre ventilatorio inicial (V1) cuando el VCO2 se incrementa desproporcionalmente a medida que el VO2 se incrementa proporcionalmente. El umbral de frecuencia cardiaca (HRT) fue determinado utilizando un modelo matemático, donde se intersecan las curvas de regresión logarítmica y lineal de la respuesta de la frecuencia cardiaca (18). El análisis de potencia del diseño experimental indicó que un tamaño de muestra de 16-21 produciría una alta potencia (.8 a .9) para un valor delta de .8. La significancia estadística fue establecida a priori a un nivel p=0,05.
RESULTADOS
Los datos demográficos de los sujetos son reportados en la Tabla 1, y el efecto de la oclusión venosa es reportado en la Tabla 2. Tal como puede apreciarse, los valores para el VO2 pico relativo, frecuencia cardíaca máxima, máxima tasa de trabajo y tiempo hasta el agotamiento fueron disminuidos significativamente por la condición de evaluación CUFF en comparación con la condición de evaluación CON (p<0,05). Además, utilizando la medición de criterio del VO2 para determinar la respuesta metabólica a la tasa de trabajo, los umbrales anteriormente mencionados (VT, HRT) se produjeron a un VO2 significativamente (p<0,05) menor (i.e., reducción de la tasa de trabajo) durante la condición de evaluación CUFF.

Tabla 1. Valores medios (±DS) de los datos demográficos de los
sujetos
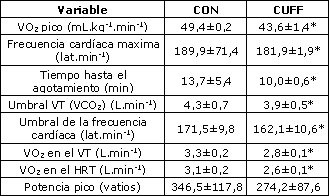
Tabla 2. Comparación de las variables medidas durante el procedimiento
de oclusión venosa (media±DS). Abreviaturas: CON, control; CUFF:
oclusión venosa usando cuffs para los muslos, *, diferencias significativas
a un nivel p<0,05.
El VO2 en el cual ocurrió el umbral ventilatorio en la condición CON no fue significativamente diferente que el VO2 en el cual ocurrió el umbral de la frecuencia cardiaca en la misma condición de evaluación (CON). Además, el VO2 en el cual ocurrió el umbral ventilatorio en la condición CUFF no fue significativamente diferente del VO2 en el cual ocurrió el umbral de la frecuencia cardiaca en la condición CUFF. Fueron establecidas asociaciones bivariadas significativas (p<0,05) entre los umbrales (i.e., VT, HRT) durante la condición CON (r=0,69) y CUFF (r=0,49).
DISCUSION
Los hallazgos de la presente investigación indican que la oclusión sanguínea venosa de las piernas afecta las respuestas ventilatoria y cardiovascular. Esto es indicado principalmente a través de la alteración de la aparición del umbral en la ventilación y frecuencia cardiaca, así como también por el tiempo hasta el agotamiento (TE). Esta alteración fue observada ya que el VT, HRT y TE se dieron a menores tasas de trabajo durante la condición de evaluación CUFF. Con el CO2 y los H+ establecidos como factores que afectan la ventilación (6, 21, 22), las asociaciones entre frecuencia cardiaca y ventilación indican más evidencia acerca de la influencia de los metabolitos sobre el miocardio. Las diferencias significativas en el VO2 pico, tiempo en el umbral, umbral de la frecuencia cardiaca, umbral respiratorio y tiempo hasta el agotamiento, verifican los efectos que tiene la oclusión sanguínea venosa sobre las mediciones fisiológicas. Hay varias explicaciones para la asociación existente entre dióxido de carbono y frecuencia cardiaca, así como para la influencia de los iones hidrógeno sobre la actividad simpática en el corazón.
El incremento del CO2 conduce a vasodilatación arterial en el tejido muscular esquelético periférico que trabaja (23). Ajustándose para la reducción de la presión sanguínea en los tejidos periféricos, son observados incrementos cronotrópicos e inotrópicos en el miocardio para permitir el mantenimiento de la presión sanguínea (11, 15, 16). Otra influencia miocárdica se relaciona a la activación de los mecanorreceptores en el músculo esquelético activo y dentro de la pared del pecho con el incremento de la ventilación (13). Estos mecanorreceptores facilitan la respuesta simpática del corazón. De este modo con un incremento de la ventilación producido por la acumulación de CO2 y H+, la descarga simpática asociada incrementa la frecuencia cardiaca. Además, la estimulación del dióxido de carbono de los cuerpos carotídeos (i.e., quimiorreceptores) indica al centro respiratorio en la médula que altere la estimulación parasimpática eferente y/o la salida simpática hacia el corazón (6, 11, 16). Finalmente, a través del procedimiento de inflado del cuff del muslo y los metabolitos atrapados resultantes, los receptores intramusculares identificados como metaborreceptores pueden influenciar al miocardio a través de señales directas hacia el sistema simpático, lo cual incrementa la frecuencia cardiaca (10, 15, 16). Previamente, Smith et al. (1999) demostraron que se producía un estímulo intramuscular para la ventilación a través del uso de una baja presión de los miembros inferiores a 45 torr y cuffs de oclusión venosa a 90 mmHg, utilizando un ejercicio en bicicleta de carga de trabajo progresiva (7). Esto resultó en una modificación del VT hacia un menor VO2. En la presente investigación, hemos demostrado que el VO2 al cual se da el VT coincide con el VO2 del HRT, tanto en el procedimiento de control como en con cuff. Sin embargo, el HRT y el VT se modificaron, yendo hacia un menor VO2 (ver Figura 1), indicando que la acumulación de metabolitos influencia directamente la ventilación y la frecuencia cardiaca.
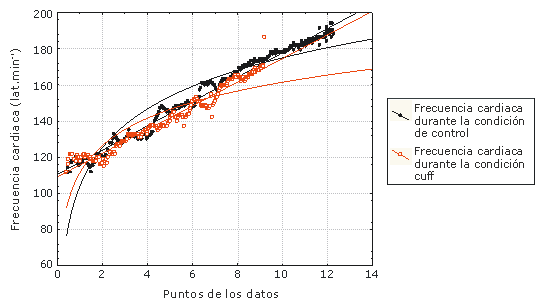
Figura 1. Respuesta de la frecuencia cardiaca entre los test
de Control y Cuff en un sujeto. Nota: Las flechas indican el umbral de la frecuencia
cardiaca y el tiempo hasta el agotamiento entre los grupos.
Conclusiones
En conclusión, a través de la oclusión sanguínea venosa de la pierna y el incremento resultante en la acumulación de CO2 y H+ en el músculo periférico, fueron encontradas alteraciones en la frecuencia cardiaca y la ventilación. Estas alteraciones indican una posible influencia de los metabolitos en el tejido muscular periférico que trabaja sobre la descarga simpática al miocardio durante el ejercicio de ciclismo.
Agradecimiento
Queremos brindar agradecimientos especiales para el Dr. Peter Raven por su ayuda, ideas y apoyo para este proyecto. El proyecto fue apoyado en parte por el subsidio NIH #HL45547.
Dirección para Envío de Correspondencia
Frank B. Wyatt, Ed.D., Department of Kinesiology, 3410 Taft Blvd., Ligon Hall 214, Midwestern State University, Wichita Falls, TX 76308-2099, 940.397.4829. Correo electrónico: frank.wyatt@mwsu.edu.
Referencias
1. Wyatt, F, Autrey, L, Fitzgerald, Y, Colson, S and Heimdal, J (2004). Phase transition defines steady state beyond threshold. JEPonline 7 (2), 70-76
2. Brooks, G (1985). Anaerobic threshold: review of the concept and directions for future research. Med Sci Sports Exerc. 17 (1): 22-31
3. Hall, GV, Jensen-Urstad, M, Rosdahl, H, Holmberg, H-C, Saltin, B, & Calbet, JA (2003). Leg and arm lactate and substrate kinetics during exercise. Am J Physiol Endocrinol Metab 284: E193-E205
4. Stanley, WC, Gertz, EW, Wisneski, JA, Neese, RA, Morris, DL, & Brooks, GA (1986). Lactate extraction during net lactate release in legs of humans during exercise. J Appl Physiol 60 (4): 1116-1120
5. Caiozzo, VJ, Davis, JA, Ellis, JF, Azus, JL, Vandagriff, R, Prietto, CA & McMaster, WC (1982). A comparison of gas exchange indices used to detect the anaerobic threshold. J Appl Physiol; Respirat Environ Exercise Physiol 53(5):1184-1189
6. Koyal, SN, Whipp, BJ, Huntsman, D, Bray, GA & Wasserman, K (1976). Ventilatory responses to the metabolic acidosis of treadmill and cycle ergometer. J Appl Physiol 40(6):864-867
7. Wasserman, K, Whipp, BJ, Koyal, SN and Beaver, WL (1973). Anaerobic threshold and respiratory gas exchange during exercise. J. Appl. Physiol 35: 236-243
8. Wyatt, F. B (1999). Comparison of lactate and ventilatory threshold to maximal oxygen consumption: a meta-analysis. J Strength and Conditioning Res 13 (1): 67-71
9. Williamson J. W., Raven, P. B., Foresman, B. H. & Whipp, B. J (1993). Evidence for an intramuscular ventilatory stimulus during exercise in man. Respiration Physiology 1-15
10. Rowell, L. B., Hermansen, L & Blackmon, J. R (1976). Human cardiovascular and respiratory responses to graded muscle ischemia. J Appl Physiol 41: 693-701
11. Sheriff, D. D., Wyss, C. R., Rowell, L. B. & Scher, A. M (1987). Does inadequate oxygen delivery trigger pressor response to muscle hypoperfusion during exercise?. Am J Physiol Heart Circ Physiol 253: H1199-H1207
12. Stebbins, C. L., Brown, B., Levin, D. & Longhurst, J. C (1988). Reflex effect of skeletal muscle mechanoreceptor stimulation on the cardiovascular system. J Appl Physiol 65: 1539-1547
13. Tibes, U., Hemmer, B. & Boning, D (1977). Heart rate and ventilation in relation to venous [K+], osmolality, pH, PCO2, PO2, [orthophosphate], and [lactate] at transition from rest to exercise in athletes and non-athletes. Eur J Appl Physiol Occup Physiol 36 (2): 127-140
14. McCloskey, D. I. & Mitchell, J. H (1972). Reflex cardiovascular and respiratory responses originating in exercising muscle. J Physiol (Lond) 224: 173-186
15. Mitchell, J. H (1985). Cardiovascular control during exercise: central and reflex neural mechanisms. Am J Cardiol 55: 34D-41D
16. Bunc, V., Hofmann, P., Leitner, H. and Gaisl, G (1995). Verification of the heart rate threshold. Eur. J. Appl. Physiol. 70: 263-269
17. Wyatt, F., Godoy, S., Autrey, L., McCarthy, J. & Heimdal, J (2005). Utilizing a logarithmic regression to identify the heart rate threshold in cyclists. J Strength and Cond Research 19 (4): 838-841
18. Gallagher, K. M., Fadel, P. J., Smith, S. A., Norton, K. H., Querry, R. G., Olivencia-Yurvati, A. & Raven, P. B (2001). Increases in intramuscular pressure raise arterial blood pressure during dynamic exercise. J Appl Physiol 91: 2351-2358
19. Beaver, W. L., Wasserman, K. & Whipp, B. J (1986). A new method for tetecting anaerobic threshold by gas exchange. J. Appl. Physiol. 60:2020-2027
20. Sutton, J. R. & Jones, N. L (1979). Control of pulmonary ventilation during exercise and mediators in the blood: CO2 and hydrogen ion. Med. Sci. Sports Exerc. 11(2):198-203
21. Whipp, B. J (1994). Peripheral chemoreceptor control of exercise hyperpnea in humans. Med. Sci. Sports Exerc. 26(3): 337-347
22. Ganong, W. F (1983). Review of Medical Physiology, 11th edition. Los Altos, California ,Lange Medical Publications