Una Dieta Baja en Carbohidratos durante un Breve Período de Tiempo disocia los Umbrales de Lactato y Amoniaco en Hombres
Józef Langfort1, Dariusz Czarnowski1, MaLgorzta Zendzian-Piotrowska1 y Ryszard Zarzeczny3
1Department of Physiology, Medical University of Bialystok, Bialystok, Polonia.
3Department of Physiology, Academy of Physical Education, Katowice, Polonia.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2004.
Publicado 27 de diciembre de 2007
Resumen
Palabras clave: amoniaco, lactato, catecolaminas, sangre, dieta, ejercicio
INTRODUCCION
Se ha demostrado repetidamente el incremento de la concentración de amoniaco y lactato sanguíneo durante ejercicios de alta intensidad con cargas constantes (7, 8, 17, 37, 47). Diferentes estudios han mostrado que durante el ejercicio de incremento progresivo la concentración de los 2 compuestos en la sangre aumenta exponencialmente y los umbrales son alcanzados a intensidades de trabajo submáximas similares (2, 3, 10, 45). Sin embargo hay algunos reportes que sugieren que la acumulación sanguínea de amoniaco puede preceder (37) u ocurrir después de alcanzado el umbral del lactato (41).
Hay evidencia que demuestra que la elevación en la concentración de epinefrina y norepinefrina en el plasma también aumenta exponencialmente durante ejercicios incrementales, con un umbral que se produce a cargas de trabajo submáximas similares a las del umbral del lactato (9, 28, 33). Recientemente se ha descubierto que la infusión de epinefrina desciende los niveles plasmáticos de amoniaco en humanos en reposo (44). El bloqueo no selectivo de receptores β-adrenérgicos aumenta la producción de amoníaco durante el ejercicio en perros (30) y en humanos (6). El tratamiento con salbutamol (un β-2 adrenoreceptor agonístico) reduce la elevación de la concentración de amoniaco en la sangre durante el ejercicio en humanos (31). Estas observaciones sugieren que las catecolaminas pueden estar involucradas en la regulación de la concentración sanguínea de amoniaco durante el ejercicio.
Investigaciones previas han mostrado que 3-días de una dieta baja en carbohidratos (L-CHO) induce una elevación en la concentración de ácidos grasos libres en la sangre (FFA) y de β-hydroxibutirato (β-HB), un descenso del pH sanguíneo durante un ejercicio máximo y un incremento en la captación de oxígeno durante ejercicios submáximos y máximos. Esto último ocurrió pesar del hecho de que la máxima carga de trabajo permaneció estable en los sujetos no entrenados. Adicionalmente a continuación de la dieta L-CHO, las concentraciones plasmáticas pre- y post-ejercicio de epinefrina, norepinefrina, cortisol, hormona de crecimiento (hGH) se incrementaron, sin embargo la concentración de testosterona y de insulina se redujo. Esta dieta no tubo influencia en la producción máxima de potencia durante el ejercicio supramáximo, y desplazó el umbral de lactato hacia cargas de ejercicio más altas en ejercicios incrementales (25-27). Algunos de estos cambios (ej. elevación de la máxima captación de oxígeno y utilización de grasa, actividad del sistema nervioso simpático) también fueron encontrados después de un período largo (más de 20 días) de dieta L-CHO (19). Esto sugiere que pueden ocurrir ciertos procesos de adaptación a una dieta L-CHO en un estadio temprano de privación de carbohidratos.
Las modificaciones dietarias han mostrado influenciar la producción de lactato y amoníaco y la respuesta hormonal durante el ejercicio. La ingesta de carbohidratos (250 ml con una solución al 8% de carbohidratos-electrolitos cada 15 minutos) reduce la acumulación de amoníaco en el músculo y en el plasma durante el ejercicio prolongado en humanos (42). Por otro lado, una dieta L-CHO incrementa la concentración plasmática de amoníaco durante el ejercicio de resistencia (12) y el ejercicio incremental (40). Sin embargo no hay información específica que indique la relación entre el aumento de carbohidratos ingeridos y el grado de reducción de amoníaco.
Por otro lado el ejercicio de resistencia después de una dieta L-CHO resulta en una disminución de los niveles de lactato en sangre, lo cual está acompañado con un aumento en la concentración de amoníaco en el plasma y el sudor en comparación con respectivos valores después de una dieta mixta de control (12). Sin embargo, el efecto de la dieta en el umbral de amoníaco durante el ejercicio no ha podido ser determinado hasta ahora. El presente trabajo fue diseñado para estudiar el efecto de una dieta L-CHO en un breve período de tiempo sobre los cambios tendientes a la concentración plasmática de amoníaco, lactato, epinefrina y norepinefrina durante el ejercicio incremental hasta el agotamiento voluntario.
METODOS
Enfoque Experimental del Problema
La manipulación dietaria es comúnmente recomendada para el mejoramiento de la capacidad en el ejercicio. Esto ha sido demostrado aplicando dietas L-CHO durante varios días previos a una competición lo que puede mejorar significativamente el desempeño en ejercicios de resistencia (18, 24). Estas estrategias dietarias se han vuelto muy populares. Así, nosotros esperabamos comprobar si el cambio de una dieta mixta normal a una dieta L-CHO tiene una influencia potencial en la evaluación de la capacidad de trabajo por medio de la medición de los umbrales de amoníaco y lactato sanguíneo. Los sujetos realizaron 2 test de ejercicios idénticos en un cicloergómetro tal como habían hecho 7-8 días antes, durante la determinación del VO2 máx. El primer test de ejercicio fue desarrollado 3 días después de haber tenido una dieta mixta normal (dieta M), (control). Esta consistió en 50% de carbohidratos, 30% de grasas, y 20% de proteínas. Después del primer test, los sujetos consumieron una dieta de L-CHO por 3 días. La dieta consistió en un 5% de carbohidratos, 50% de grasas, y 45% de proteínas. Las dietas tuvieron el mismo contenido energético (2200 kcal•75 kg−1•d−1). Entonces, después de un ayuno nocturno, ellos repitieron el mismo test de ejercicio. Esta clase de protocolo fue elegido por el hecho de que es la manera más popular de cambiar un régimen dietario durante el proceso de entrenamiento. La frecuencia cardiaca fue continuamente monitoreada por medio de un electrocardiógrafo. Treinta minutos antes del ejercicio, fue insertado un catéter en la vena cubital anterior. El test de ejercicio comenzó pedaleando sin carga a 60 rpm, y a partir de allí la intensidad fue incrementada por 40 W cada 3 minutos hasta el agotamiento voluntario. Inmediatamente antes del test y al final del ejercicio y en cada intensidad del ejercicio, fueron tomadas las muestras sanguíneas por vena, para la determinación del amoniaco, acido láctico, epinefrina y norepinefrina.
Sujetos
Ocho, hombres saludables no entrenados fueron voluntarios en este estudio. Fueron informados acerca del objetivo y del protocolo del mismo y cada uno de ellos dio su consentimiento por escrito. El protocolo fue aprobado por el comité Ético de Experimentos con Humanos de la Academia de Medicina de Bialystok. Los sujetos no participaron de ninguna actividad deportiva en la semana anterior al estudio o durante el mismo. No eran fumadores y no bebieron café o té tres días antes, ni durante el estudio. Las características físicas de los sujetos fueron (media±DS), edad 21,5±0,5 años, altura 173,8±9,6 cm, y masa corporal 74,8±6,9 kg. El contenido de grasa corporal (calculado por la medición de 4 pliegues cutáneos, supraíliaco, bíceps y tríceps braquial y subescapular) no excedió el 18,5% de la masa corporal. El VO2 máx. fue determinado durante un test de ciclismo incremental a 60 rpm, una semana antes de la aplicación de las dietas. El criterio de estabilización fue usado para estimar el pico de consumo de oxígeno (VO2 máx.), el VO2 máx. fue de 3,85±0,21 L•min−1.
Mediciones
La concentración de ácido láctico fue medida enzimaticamente usando un kit comercial (Boehringer, Mannheim, FRG). Los coeficientes de variación de la medición de lactato intra- e inter-janálisis fueron 3,2% y 8,9%, respectivamente. La concentración de amoniaco en el plasma fue analizada por medio del Monotest Ammoniak (Boehringer Mannheim, Alemania). Los coeficientes de variación de la medición de amoníaco intra- e inter-análisis fueron 5,2% y 9,5%, respectivamente. Las concentraciones de epinefrina y norepinefrina plasmática fueron medidas por el método radioenzimatico (13) usando el Catechola test producido por el Instituto de Investigación Producción y Aplicación de Radioisotopos (Praga, República Checa). De acuerdo al fabricante, fueron encontradas determinaciones con la misma muestra con coeficientes de variación de 6 paralelos (intra-medición): 3,1% de epinefrina y 4,2% de norepinefrina. Se encontraron determinaciones con la misma muestra con coeficientes de variación de 10 noparalelos (inter-medición): 6,6% de epinefrina y 7,4% de norepinefrina. La reactividad-cruzada entre las catecolaminas individuales fue testeada por el agregado de las catecolaminas individuales estándar en el plasma, y este fue hallado por debajo del 2%. Los umbrales en sangre de amoniaco, lactado, epinefrina y norepinefrina fueron definidos como el punto en el que un dado compuesto comienza a incrementarse en una manera no lineal. Estos umbrales fueron expresados como las cargas de ejercicio correspondientes al punto individual de quiebre de cada compuesto y calculados usando 2 segmentos de regresión lineal (registro de la concentración de amoniaco, ácido láctico o catecolaminas vs. registro de la carga del ejercicio en vatios) de acuerdo a Beaver y col. (4).
Análisis Estadísticos
Las diferencias estadísticas entre los resultados obtenidos después de las 2 dietas fue evaluada usando el análisis de varianza de dos colas (ANOVA) seguido por Newman-Keuls post hoc test. El valor de significancia fue de p≤0,05. Todos los resultados son presentados con media ± DS.
RESULTADOS
La máxima carga de trabajo registrada por cada sujeto después de cada dieta fue igual (282±12 W). La concentración sanguínea de amoniaco (Figura 1), ácido láctico (Figura 2), epinefrina (Figura 3), y norepinefrina (Figura 4) subió exponencialmente en relación a la carga de trabajo después de las dos dietas. Después de la dieta L-CHO, las concentraciones plasmáticas de amoniaco, epinefrina y norepinefrina en reposo y durante el ejercicio a cada carga de trabajo fueron significativamente mayores que después de la dieta M (p<0,05). Por el contrario, la concentración de ácido láctico fue más alta después de la dieta M que con la dieta L-CHO, después de cada carga (p<0,05). Después de la dieta M, los umbrales de amoníaco (127,93±12,89 W), ácido láctico (119,15±6,09 W), epinefrina (128,65±18,24 W), y norepinefrina (120,75±10,23 W) ocurrieron a la misma carga de trabajo. Luego de la dieta L-CHO, el umbral de ácido láctico se desplazó hacia cargas más altas en comparación con la dieta M (137,50±12,77, p<0,05). Los umbrales de amoniaco (98,11±19,57 W) y norepinefrina (99,71±14,60 W) se desplazaron hacia intensidades más bajas en comparación con los datos respectivos después de la dieta M (p<0.05). El umbral de epinefrina (124,96±15,02 W) fue similar después de ambas dietas (p>0,05). Los coeficientes de variación de todos los umbrales medidos son presentados en la Tabla 1.
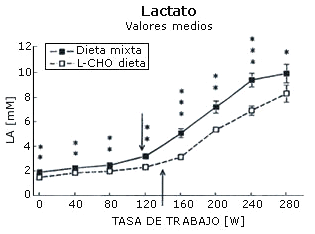
Figura 1. Efecto de la dieta baja en carbohidratos sobre el umbral de
lactato. * p<0,05; ** p<0,01; *** p<0,001. Las flechas indican los umbrales.
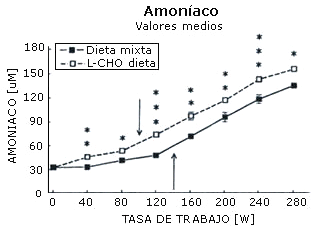
Figura 2. Efecto de la dieta baja en carbohidratos sobre el umbral de
amoníaco. * p < 0,05; ** p < 0,01; *** p < 0,001. Las flechas indican los
umbrales.
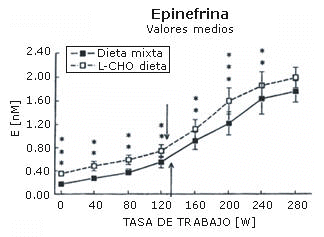
Figura 3. Efecto de la dieta baja en carbohidratos sobre el umbral de
epinefrina. * p<0,05; ** p<0,01; *** p<0,001. Las flechas indican los umbrales.
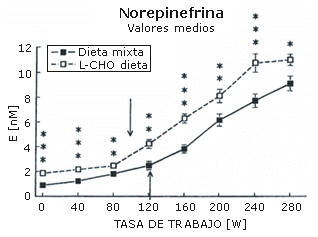
Figura 4. Efecto de la dieta baja en carbohidratos sobre el umbral de
norepinefrina. * p<0,05; ** p<0,01; *** p<0,001. Las flechas indican los
umbrales.
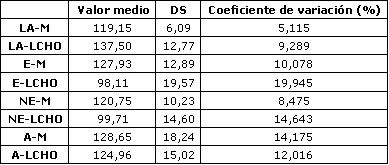
Tabla 1. Valor medio, desvío estándar y coeficiente de variación (CV), de
los umbrales de lactato, amoniaco, epinefrina, y norepinefrina (n=8). LA=Lactato
(mM); E=epinefrina (nM); NE=norepinefrina (nM); A=amoníoaco (μM); M=dieta mixta;
LCHO=dieta baja en carbohidratos.
DISCUSION
Anteriormente ha sido mostrado que la misma dieta L-CHO aplicada en el presente estudio causa una elevación pre-ejercicio de la concentración sanguínea de FFA sobre 1 mM y la concentración de β-HB sobre 2 mM (34). Esta concentración de β-HB induce un estado de cetosis moderada (16). Los valores fueron próximos a los reportados después de 2-3 días de ayuno (53) y son marcadamente más bajos que en la diabetes no controlada, cuando la concentración de FFA puede alcanzar hasta 4 mM y los cuerpos cetónicos hasta 15-20 mM (35). Esto podría indicar que la respuesta del metabolismo de los lípidos de los sujetos después de 3 días de L-CHO fue similar a los cambios observados por el consumo prolongado L-CHO (19).
El presente estudio demostró que los umbrales plasmáticos de amoniaco, lactato, y norepinefrina se ven afectados por la composición de la dieta consumida 3 días antes del test de ejercicio. Para nuestro conocimiento la disociación de los umbrales de amoníaco y lactato después de L-CHO no ha sido previamente demostrada. Nuestros resultados también mostraron que la dieta L-CHO resulto en una elevación menos pronunciada en la concentración sanguínea del ácido láctico con un incremento concomitante en la concentración plasmática de amoniaco y catecolaminas.
Podría haber 2 razones para la reducción en la producción de lactato durante el ejercicio incremental después de una dieta L-CHO. Algunos estudios recientes demostraron la reducción de la concentración de glucógeno muscular después de un breve período de dieta L-CHO (11). Sin embargo, también ha sido observado en hombres en reposo, que una reducción dietaria de la ingesta de carbohidratos en un breve periodo de tiempo no tiene un impacto significativo en el contenido de glucógeno muscular (23, 32). Aunque, la restricción dietaria de carbohidratos después del ejercicio retarda marcadamente la resíntesis de glucógeno en los músculos esqueléticos (5, 15). En el presente estudio la dieta L-CHO fue aplicada después de un test de ejercicio en el grupo de control. Por consiguiente, esta es una buena razón para creer que este procedimiento resulto en una reducción en la reservas de glucógeno muscular. Subsecuentemente, fue producido menos ácido láctico durante el ejercicio. Ha sido previamente demostrado que la dieta L-CHO eleva la concentración plasmática de ácidos grasos libres durante el ejercicio incremental en hombres (23). Se sabe que el incremento de la disponibilidad de los ácidos grasos libres tiene un efecto de ahorro sobre la utilización de carbohidratos durante el ejercicio (20, 39). Este factor podría también contribuir en una reducción de la concentración del lactato sanguíneo durante un ejercicio luego de una dieta L-CHO.
El presente estudio demostró que una dieta L-CHO desplaza el umbral de lactato hacia cargas más altas. Este hallazgo concuerda con los datos mostrados en el incremento del umbral de ácido láctico bajo condiciones de reducción de las reservas de glucógeno inducidas por una dieta L-CHO o el ejercicio extenuante (29, 52). Incluso ha sido sugerido que el cambio en el umbral de lactato podría servir como un indicador de la deficiencia de carbohidratos.
Fue observado que la infusión de epinefrina aumenta la concentración de ácido láctico durante el ejercicio submáximo (14, 21) y durante la estimulación eléctrica prolongada en el músculo cuadriceps en humanos (43). Sin embargo, los presentes resultados demostraron que la concentración sanguínea de ácido láctico en cada carga de trabajo aplicada después de una dieta L-CHO es menor que en el grupo de control, a pesar de la alta concentración de epinefrina en el grupo L-CHO, hallada en el primero en vez de en el segundo grupo. Estos descubrimientos sugieren que la aceleración del catabolismo del glucógeno en el músculo esquelético, el cual es esencial para el incremento de la concentración sanguínea de ácido láctico durante el ejercicio, depende en un marcado grado del contenido de glucógeno muscular y no de la concentración de epinefrina en el plasma.
Los resultados del presente experimento muestran que la concentración sanguínea de amoniaco a cada carga de trabajo aplicada es mayor después de la dieta L-CHO que después de la dieta M. Esto sigue la línea de nuestras observaciones previas demostrando que el ejercicio de resistencia desarrollado después de una dieta L-CHO aumenta la concentración sanguínea de amoniaco (12). Esto también podría haber sido mencionado en el último estudio, durante el test de ejercicio de control, la concentración sanguínea de amoniaco se incremento progresivamente; sin embargo, el grado de este incremento no fue tan alto como después de la dieta L-CHO. El origen del amoniaco durante el ejercicio prolongado continua siendo un misterio. Está completamente aceptado que durante las contracciones musculares de alta-intensidad, cuando la resíntesis de ATP no satisface la demanda energética, el amoniaco es principalmente formado como resultado de la acción de la adenosina 5 monofosfato-deaminasa (AMP-D), con cambios estequiométricos en sustratos (ej. descenso del pool total de nucleótidos de adenina) y productos (incremento de la concentración de inosina 5 monofosfato (IMP) y amoniaco) de la reacción (46). En base a estas afirmaciones, la producción de amoniaco durante el ejercicio de moderada intensidad podría no ocurrir o ser insignificante, gracias a un excelente balance energético. El hecho de que el amoniaco se acumule durante tal tipo de ejercicio puede ser causado por la reducción en la disponibilidad de carbohidratos. Cuando las reservas musculares de carbohidratos están reducidas, como ocurre durante el ejercicio prolongado, a través de la reacción de desaminación, los aminoácidos pueden ser transformados en ácidos tricarboxilicos (TCA), el cual media en la producción concomitante de amoniaco (48). Por otro lado, la formación de amoniaco durante el ejercicio submáximo, especialmente continuado hasta la fatiga, puede resultar en un incremento en nucleótidos cíclicos de purina, lo cual ocurre a una alta tasa de aminación de IMP y/o progresivo reclutamiento de fibras oxidativas-lentas que poseen una alta actividad de AMP-D (46). Desafortunadamente, la fuente exacta de la producción de amoniaco durante el ejercicio prolongado es aun desconocida.
En el presente estudio, la concentración sanguínea de lactato, amoniaco, y catecolaminas se incremento exponencialmente durante el ejercicio incremental. Esto nos permitió calcular los umbrales de estas variables en una manera similar al umbral de lactato (20). Durante el desarrollo del ejercicio después de la dieta M, los umbrales de amoniaco y catecolaminas fueron similares al umbral de lactato. Esto está en concordancia con los cambios en los datos en el transcurso del tiempo en la concentración plasmática de estas variables durante el ejercicio incremental (1, 3, 9, 10, 28). Nuestros resultados mostraron que una reducción en la ingesta de carbohidratos desplaza los umbrales sanguíneos de amoniaco y norepinefrina hacia intensidades de trabajo más bajas. Puede haber 2 razones para esto. Una, mencionada arriba, el incremento de la oxidación de aminoácidos de cadena ramificada (BCAA), ya que ha sido demostrado que existe una elevación en la forma activa de ceto-acido deshidrogenasa, la enzima limitante de la tasa de oxidación de BCAA, en los músculos con el glucógeno agotado (49). Es válido mencionar que según Wagenmakers (48), la oxidación de leucina en los músculos que presentan agotamiento del glucógeno puede iniciar una remoción neta del α-cetoglutarato, el cual es un intermediario del ciclo de los ácidos tricarboxílicos, por medio de la acción de la enzima BCAA aminotransferasa. Este gasto de carbono puede ser compensado por una regeneración de α-cetoglutarato en la reacción en la cual interviene la alanina aminotransferasa (mientras el glucógeno muscular este disponible y la concentración de piruvato muscular se mantenga alta, 48) y/o en la reacción en la cual interviene la glutamato deshidrogenasa. Ha sido demostrado que durante la acidosis, una fracción significativa (30%) del nitrógeno del amoníaco en los tubos renales deriva del grupo amino α del glutamanto, aparentemente por la acción de la glutamato deshidrogenasa (36). Teniendo en cuenta que: (a) aplicar una dieta L-CHO después de un ejercicio extenuante probablemente reduce las reservas de glucógeno en los músculos, (b) una dieta L-CHO consiste en el doble de proteínas que una dieta M, y (c) después de una dieta L-CHO la concentración plasmática de amoníaco durante el ejercicio fue mayor que después de una dieta M, parece probable que el desplazamiento en el umbral del amoníaco puede ser causado por un incremento en la oxidación de BCAA y una elevada actividad de la glutamato deshidrogenasa.
Otra posibilidad que puede afectar el umbral de amoniaco es la activación de los nucleótidos cíclicos de purina. Ha sido demostrado que la disminución de la disponibilidad de carbohidratos en el músculo acelera la degradación de los nucleótidos de purina, resultando en un incremento en la producción de amoniaco durante el ejercicio de alta intensidad (10, 44). Adicionalmente, uno de los factores no señalados que incrementan la actividad AMP-deaminasa es la acidosis celular (46). Tal como fue observado en nuestros estudios previos (25), (a) el alto costo energético del ejercicio (mayor VO2 máx.) a cada carga de trabajo después de una dieta L-CHO, y (b) el bajo pH sanguíneo, es razonable atribuir la alta producción de amoníaco a la actividad de los nucleótidos cíclicos de purina en las fibras musculares activas, especialmente debido a que la aminación del AMP puede también proveer fumarato, un intermediario del ciclo de los ácidos tricarboxílicos (46).
En los años recientes ha sido sugerida la contribución de las catecolaminas en el mecanismo del umbral anaeróbico, ya que fue descubierto que el punto de inflexión en las concentraciones de epinefrina y norepinefrina sanguíneas durante el ejercicio incremental ocurre simultáneamente con el umbral de lactato, sugiriendo una relación causal entre estas hormonas y el umbral anaeróbico (33, 40). Sin embargo, en estudios realizados en atletas, no ha sido confirmada una relación entre la norepinefrina y el umbral anaeróbico (11, 15). Se encontró que la reducción de la ingesta de carbohidratos por los sujetos que tomaron parte en este estudio desplazó el umbral de norepinefrina hacia intensidades de ejercicio más bajas en comparación con la dieta M. Se sabe que una disminución del pH en los músculos en contracción debido a la aceleración de la producción de lactato puede estimular el sistema simpático por medio de señales neurales aferentes desde receptores metabólicos de los músculos, causando de esta manera una rápida liberación de catecolaminas (22, 34). El mecanismo arriba mencionado parece poco probable, ya que en nuestro estudio la acumulación de lactato sanguíneo se redujo con una dieta L-CHO. Sin embargo, la estimulación de receptores metabólicos musculares no puede ser excluida porque el descenso del pH ocurrió después de la dieta L-CHO (25).
Las mediciones sanguíneas de lactato, amoníaco, y norepinefrina después de cada estadio de ejercicio incremental mostró que el transcurso de tiempo de la adrenalina plasmática no esta afectado por el régimen dietario, mientras que la dieta L-CHO causó una divergencia entre los umbrales de lactato y de norepinefrina. Podolin y col. (38) demostraron que el agotamiento de glucógeno causado por el ejercicio prolongado seguido de una noche de ayuno bajó las concentraciones plasmáticas de amoníaco, norepinefrina, y lactato sanguíneo a la máxima carga de trabajo. Por otra parte, los puntos de inflexión de estas variables fueron retardados de una manera coordinada. La comparación de nuestros datos con los de Podolin y col. (38) indica que la restricción en la ingesta de carbohidratos por algunos días influencia la respuesta adreno-simpática al ejercicio en manera diferente que el agotamiento muscular inducido por el ejercicio.
En resumen, nosotros demostramos que 3 días de una dieta L-CHO resulta en una disociación entre el umbral de lactato y el de amoníaco durante el ejercicio incremental en hombres: el primero se desplaza hacia cargas de trabajo más altas, mientras el segundo hacia cargas de trabajo más bajas. El umbral de norepinefrina (pero no de epinefrina), después de una dieta L-CHO, también se desplaza hacia cargas más bajas en comparación con la dieta control M. Esto indica que el incremento de la actividad del sistema nervioso simpático después de una dieta L-CHO puede contribuir a cambiar el umbral del amoníaco.
Aplicaciones Prácticas
Los umbrales de lactato y amoníaco son herramientas útiles para predecir el rendimiento y el diseño de programas de entrenamiento de resistencia (50). Recientemente se ha postulado que la periodización de la dieta de un programa de entrenamiento puede optimizar el aporte de carbohidratos y oxidación de grasas como una fuente de energía para los músculos activos, y por consiguiente mejorar la resistencia y el rendimiento en el ejercicio prolongado (18). Se asume que esta estrategia promueve la disponibilidad de grasas como combustible del ejercicio para reducir la dependencia sobre las reservas endógenas de carbohidratos (18). Nuestros resultados indican que los umbrales de lactato y amoníaco no son herramientas útiles para predecir el rendimiento de resistencia y diseñar programas de entrenamiento cuando la composición de la dieta se cambia durante el proceso de entrenamiento.
Agradecimientos
Este trabajo fue apoyado por la Universidad de Medicina de Bialystok, beca 3-18979.
Dirección para Envío de Correspondencia
Dr. Jan Górski, E-mail: gorski@amb.edu.pl
Referencias
1. Ament, W., J.R. Huizenga, G.A. Mook, C.H. Gips, and G.J. Verkerke (1996). Lactate and ammonia concentration in blood and sweat during incremental cycle ergometer exercise. Int. J. Sports Med. 18:3539
2. Ament, W., J.R. Huizenga, T.W. van der Mark, R.G. Grevink, and G.J. Verkerke (1999). Respiratory ammonia output and blood ammonia concentration during incremental exercise. Int. J. Sports Med. 20:7177
3. Babij, P., S.M. Matthews, and M.J. Rennie (1983). Changes in blood ammonia, lactate and amino acids in relation to workload during bicycle ergometer exercise in man. Eur. J. Appl. Physiol. 50:405411
4. Beaver, W.L., K. Wasserman, and B.J. Whipp (1985). Improved detection of lactate threshold during exercise using a log-log transformation. J. Appl. Physiol. 59:193640.
5. Bergstrom, J., L. Hermansen, E. Hultman, and B. Saltin (1967). Diet, muscle glycogen and physical performance. Acta Physiol. Scand. 71:140150
6. Broberg, S., A. Katz, and K. Sahlin (1988). Propranolol enhances adenine nucleotide degradation in human muscle during exercise. J. Appl. Physiol. 65:24782483
7. Broberg, S., and K. Sahlin (1989). Adenine nucleotide degradation in human skeletal muscle during prolonged exercise. J. Appl. Physiol. 67:116122
8. Broberg, S., and K. Sahlin (1988). Hyperammonemia during prolonged exercise: An effect of glycogen depletion?. J. Appl. Physiol. 65:24757
9. Brooks, G.A., and S.G. Gregg (1988). Catecholamine stimulation during cure anemia increases exercise lactate production and decreases clearance. Med. Sci. Sports Exerc. 20: (Suppl.):S46
10. Buono, M.J., T.R. Clancy, and J.R. Cook (1984). Blood lactate and ammonium ion accumulation during graded exercise in humans. J. Appl. Physiol. 57:135139
11. Da Prada, M., and G. Zurcher (1979). Radioenzymatic assay of plasma and urinary catecholamines in man and various animal species.Physiological and pharmacological adaptations.In: Radioimmunoassay of Drugs and Hormones in Cardiovascular Medicine. A. Albertini, M. DaPrada, and A. Pescar, eds. Amsterdam: Elsevier/North Holland, 112119
12. Gaesser, G.A., S.A. Ward, V.C. Baum, and B.J. Whipp (1994). Effects of infused epinephrine on slow phase of O2 uptake kinetics during heavy exercise in humans. J. Appl. Physiol. 77:24132419
13. Galbo, H., J.J. Holst, and N.J. Christiansen (1979). The effect of different diets and of insulin on the hormonal response to prolonged exercise. Acta Physiol. Scand. 107:1932
14. Gilbert, D.L., P.L. Pyzik, and J.M. Freeman (2000). The ketogenic diet: Seizure control correlates better with serum beta-hydroxybutyrate than with urine ketones. J. Child Neurol. 15:787790
15. Graham, T.E., P.K. Pedersen, and B. Saltin (1987). Muscle blood ammonia and lactate responses to prolonged exercise with hyperoxia. J. Appl. Physiol. 63:14571462
16. Hawley, J.A., F. Brouns, and A. Jeukendrup (1998). Strategies to enhance fat utilization during exercise. Sports Med. 25:241257
17. Helge, J.W (2000). Adaptation to a fat-rich diet. Effects on endurance performance in humans. Sports Med. 30:347357
18. Holloszy, J.O (1990). Utilization of fatty acids during exercise. In: Biochemistry of Exercise VII. A.W. Taylor, P.D. Gollnick, H.J.Green, C.David Ianuzzo, E.G. Noble, G. Metivier, J.R. Sutton, eds. Champaign, IL: Human Kinetics 112119
19. Jansson, E., P. Hjemdahl, and L. Kaijser (1986). Epinephrine-induced changes in muscle carbohydrate metabolism during exercise in male subjects. J. Appl. Physiol. 60:14661470
20. Kjear, M., N.H. Secher, F.W. Bach, S. Sheikh, and H. Gakbo (1989). Hormonal and metabolic responses to exercise in humans: Effect of sensory nervous blockade. Am. J. Physiol. 257:E96E101
21. Knapik, J.J., C. Meredith, B.H. Jones, L. Suek, V.R. Young, and W.J Evans (1988). Influence of fasting on carbohydrate and fat metabolism during rest and exercise in men. J. Appl. Physiol. 64:19231929
22. Lambert, E.V., J.H. Goedecke, C. Zyle, K. Murphy, J.A. Hawley, S.C. Dennis, and T.D. Noakes (2001). High-fat diet versus habitual diet prior to carbohydrate loading: Effects of exercise metabolism and cycling. Int. J. Sports Nutr. Exerc. Metab. 11:209225
23. Langfort, J., W. Pilis, R. Zarzeczny, K. Nazar, and H. Kaciuba-U ci ko (1996). Effect of low-carbohydrateketogenic diet on metabolic and hormonal responses to graded exercise in man. J. Physiol. Pharmacol. 47:361371
24. Langfort, J., R. Zarzeczny, K. Nazar, and H. Kaciuba-U ci ko (2001). The effect of low-carbohydrate diet on the pattern of hormonal changes during incremental, graded exercise in young men. Int. J. Sport Nutr. Exerc. Metab. 11:248257
25. Langfort, J., R. Zarzeczny, W. Pilis, K. Nazar, and H. Kaciuba-U ci ko (1997). The effect of a low-carbohydrate diet on performance, hormonal and metabolic responses to a 30-s bout of supramaximal exercise. Eur. J. Appl. Physiol. 76:128133
26. Lehmann, M., J. Keul, G. Huber, and M. Da Prada (1981). Plasma catecholamines in trained and untrained volunteers during graduated exercise. Int. J. Sports Med. 3:143147
27. Maassen, N., and M.W. Busse (1989). The relationship between lactic acid and work load: A measure for endurance capacity or an indicator of carbohydrate deficiency? . Eur. J. Appl. Physiol. Occup. Physiol. 58:728737
28. Matthys, D., P. Calders, and J.L. Pannier (1995). Effects of acute non-selective beta-adrenergic blockade on plasma ammonia levels in exercising dogs. Int. J. Sports. Med. 16:373377
29. Matthys, D., P. Calders, and J.L. Pannier (1998). Inhaled salbutamol decreases blood ammonia levels during exercise in normal subjects. Eur. J. Appl. Physiol. Occup. Physiol. 79:110113
30. Maughan, R., and C. Williams (1992). Muscle citrate content and the regulation of metabolism in fed and fasted human skeletal muscle. Clin. Physiol. 2:2127
31. Mazzeo, R.S., and P. Marshal (1989). Influence of plasma catecholamines on the lactate threshold during graded exercise. J. Appl. Physiol. 67:13191322
32. McCloskey, D.L., and J.H. Mitchel (1972). Reflex cardiovascular and respiratory responses originating in exercise muscle. J. Physiol. 224:173231
33. Meier, J.M., J.D. McGarry, G.R. Faloona, R.H. Unger, and D.W. Forest (1972). Studies of development of diabetic ketosis in the rat. J. Lipid Res. 13:228233
34. Nissim, I., M. Yudkoff, and S. Segal (1985). Metabolism of glutamine and glutamate by rat renal tubules. Study with 15N and gas chromatographymass spectrometry. J. Biol. Chem. 260:1395513967
35. Ogino, K., T. Kinugawa, S. Osaki, M. Kato, A. Endoh, Y. Furuse, K. Uchida, M. Shimoyama, O. Igawa, I. Hisatome, and C. Shigemasa (2000). Ammonia response to constant exercise: Differences to the lactate response. Clin. Exp. Pharmacol. Physiol. 27:612617
36. Podolin, D.A., P.A. Munger, and R.S. Mazzeo (1991). Plasma catecholamine and lactate response during graded exercise with varied glycogen conditions. J. Appl. Physiol. 71:14271433
37. Putman, C.T., L.L. Spriet, E. Hultman, D.J. Dyck, and G.J.F. Heigenhauser (1995). Skeletal muscle pyruvate dehydrogenase activity during acetate infusion in humans. Am. J. Physiol. 268:E1007E1017
38. . Roeykens, J., L. Magnus, R. Rogers, R. Meeusen, and K. De Meirleir (1998). Blood ammoniaHeart rate relationship during graded exercise is not influenced by glycogen depletion. Int. J. Sports. Med. 19:2631
39. Schlicht, W., W. Naretz, D. Witt, and H. Rieckert (1990). Ammonia and lactate: Differential information on monitoring training load in sprint events. Int. J. Sports Med. 11:327341
40. Snow, R.J., M.F. Carey, C.G. Stathis, M.A. Febbraio, and M. Hargreaves (2000). Effect of carbohydrate ingestion on ammonia metabolism during exercise in humans. J. Appl. Physiol. 88:15761580
41. Spriet, L.L., K. Soderlund, M. Bergstrom, and E. Hultman (1989). Skeletal muscle glycogenolysis, glycolysis and pH during electrical stimulation in men. J. Appl. Physiol. 62:616621
42. Svedenhag, J., and J. Nowak (1998). Opposite effects of adrenaline on plasma ammonia and blood lactate levels in humans. Acta Physiol. Scand. 164:115116
43. Taylor, A.D., R. Bronks, and A.L. Bryant (1997). The relationship between electromyography and work intensity revisited: A brief review references to lactic acidosis and hyperammonemia. Electromyogr. Clin. Neurophysiol. 37:387398
44. Terjung, R.L., and P.C. Tullson (1992). Ammonia metabolism during exercise. In: . Energy Metabolism in Exercise and Sport. D.R. Lamb and C.V. Gisolfi, eds. Indianapolis, IN: Brown & Benchmark,235268
45. Urhausen, A., and W. Kinderman (1992). Blood ammonia and lactate concentrations during endurance exercise of differing intensities. Eur. J. Appl. Physiol. 65:209214
46. Wagenmakers, A.J.M (1998). Muscle amino acids metabolism at rest and during exercise: Role in human physiology and metabolism. Exerc. Sport Sci. Rev. 26:287314
47. Wagenmakers, A.J.M., E. Beckers, F. Brouns, H. Kuipers, P.B. Soeters, G.J. van der Vusse, and W.H.M. Saris (1991). Carbohydrate supplementation, glycogen depletion, and amino acid metabolism during exercise. Am. J. Physiol. 260:E883E890
48. Weltman, A (1995). Lactic acid metabolism and the blood lactate response to exercise. In: . Current Issues in Exercise Science No. 4. Champaign, IL: Human Kinetics, 1528
49. Weltman, A., C.M. Wood, C.J. Womack, S.E. Davis, J.L. Blumen, J. Alvare, K. Sauer, and G.A. Graesser (1994). Catecholamine and blood lactate responses to incremental rowing and running exercise. J. Appl. Physiol. 78:11441149
50. Yoshida, T (1986). Effect of dietary modification on anaerobic threshold. Sport Med. 3:49
51. Zinker, B.A., K. Britz, and G.A. Brooks (1990). Effects of a 26-hour fast on human endurance and substrate utilization. J. Appl. Physiol. 69:18491855