Una revisión enfocada en las mioquinas como contribuyente potencial a la hipertrofia muscular a partir del ejercicio de fuerza
Publicado 7 de mayo de 2020, 13:51
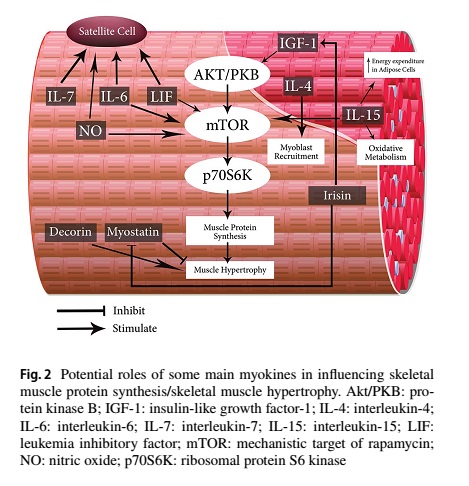
Los protocolos del ejercicio de fuerza diseñados normalmente para provocar la hipertrofia del músculo esquelético se focalizan en generar tensión mecánica, estrés metabólico, y daño muscular (Schoenfeld 2010). Aunque estos tres estímulos parecen iniciar la señalización a través de un laberinto complejo de vías de la hipertrofia en el músculo, al entrar en la recuperación, se identifican muchos mecanismos subyacentes que finalmente producen las adaptaciones hipertróficas (Bamman y cols. 2018). Como tal, mucha más investigación se requiere antes de una mejor comprensión de los mecanismos de la hipertrofia muscular que puede apreciarse totalmente, particularmente desde la prevención o tratamiento de la atrofia del músculo esquelético que envejece y el desuso; es un gran desafío para los individuos y la sociedad. Mientras que la estímulación de las vías miogénicas, las influencias endócrinas y otras y locales, y las células precursoras miogénicas (llamadas células satélite), todas aportan contribuciones únicas y superpuestas a la hipertrofia muscular (Schoenfeld 2010), la reciente investigación también ha identificado un rol potencial para las mioquinas derivadas de los músculos en este proceso (Pedersen 2011; So y cols. 2014; Bamman y cols. 2018; Lee y Jun 2019). Las mioquinas son proteínas producidas por el músculo esquelético durante la contracción que pueden actuar localmente o a alguna distancia, en el músculo y también en células no musculares y tejidos (Pedersen 2011; Pedersen y Febbraio 2012; Iizuka y cols. 2014; Lee y Jun 2019).
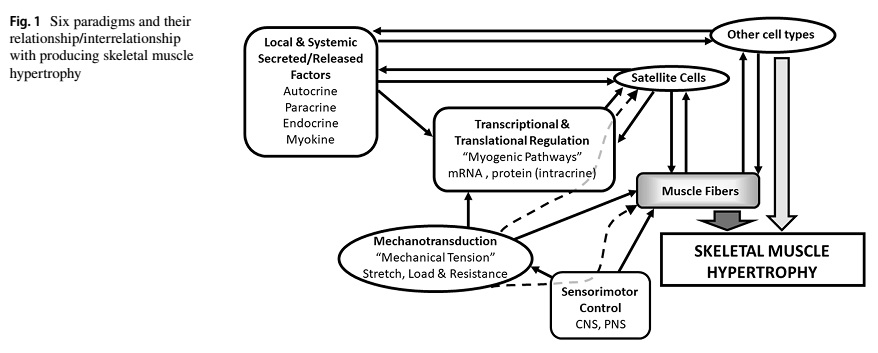
Hay seis paradigmas mecánicos que predominan nuestro conocimiento actual de las vías de señalización que median los estímulos hipertróficos. Estos paradigmas incluyen: (1) las células satélite; (2) el mRNA transcripcional y el control de traducción de proteínas; (3) la mecanotransducción; (4) los factores autócrinos, parácrinos, y endócrinos; (5) el control sensitivomotor; y (6) las células no-miogénicas en el músculo (ver Fig. 1). Las células satélite se cree que están involucradas en la hipertrofia muscular cuando ellas se mueven de un estado inmóvil a uno activado y luego a un estado proliferativo del cual pueden diferenciarse y comprometerse completamente a formar nuevos miotubos multinucleados (Fukada 2018) y/o contribuir a la hipertrofia de la fibra agregando nuevos mionúcleos a través de la fusión con fibras existentes (Englund y cols. 2019). Se piensa que este proceso es mediado por el daño muscular producido por el ejercicio de fuerza (acciones musculares especialmente del tipo excéntricas) (Guilhem y cols. 2010; Damas y cols. 2018), aunque se sabe que la carga muscular desempeña un papel en la hipertrofia de la fibra, particularmente después de la atrofia muscular, y está bien establecido que la hipertrofia muscular puede ocurrir independientemente de la actividad de las células satélite (Bruusgaard y cols. 2010; Leiter y cols. 2011, 2012,; Eftestøl y cols. 2016; Psilander y cols. 2019).
El control transcripcional y de traducción de la hipertrofia muscular sigue un proceso secuencial con el que se generan las transcripciones del mRNA y luego se traducen dentro de las células para producir nuevas proteínas del músculo. La principal quinasa que participa en la generación de nuevas proteínas musculares es el objetivo mecanicista de la rapamicina (mTOR) (Yoon 2017). Revisiones recientes de este tema han identificado que puede haber vías sensibles a la rapamicina e insensibles a la rapamicina y que ambas conducen a una mayor síntesis de proteínas musculares. (Ogasawara y cols. 2019; Goodman 2019). La mecanotransducción convierte las señales de carga de la ejecución de ejercicios de fuerza en procesos bioquímicos/biológicos mediante los cuales la adición de proteína muscular recién sintetizada tanto dentro de las fibras musculares como en el tejido muscular, dará como resultado la hipertrofia del músculo esquelético (Toigo y Boutellier 2006). También, el tipo de estímulo de estiramiento (estática o dinámica) puede influenciar las respuestas al entrenamiento de la fuerza para el crecimiento muscular y de la fuerza (Ferreira Júnior y cols. 2019).
Por ello, recientemente, Stephen M. Cornish de la University of Manitoba (Canadá) llevó a cabo una gran revisión al respecto, donde indica que el ejercicio de fuerza induce el crecimiento muscular y es un tratamiento importante para las pérdidas relacionadas con la edad en la masa muscular y en la fuerza. Se supone que a las mioquinas como una señal que lleva la información fisiológica al músculo esquelético, posiblemente a otras vías reguladoras de 'índole más finas'. Mientras las mioquinas son liberadas desde el músculo esquelético luego de la contracción, su rol en el aumento de la masa muscular y la fuerza en respuesta al ejercicio de fuerza o entrenamiento, no está del todo establecido. La reciente investigación identificó la liberación local y sistémica de mioquinas después de un turno agudo de ejercicio de fuerza. Sin embargo, no se sabe si las mioquinas con supuesta función anabólica están involucradas mecánicamente en la producción de hipertrofia muscular después del ejercicio de fuerza. Aún más, el óxido nítrico (NO), un mediador importante de la activación de células madre musculares, regula la expresión de ciertos genes de mioquinas en el músculo esquelético.
En el contexto sistémico del complejo de señalización hipertrófica, esta revisión: (1) resume la literatura sobre varias mioquinas representativas bien reconocidas con el potencial anabólico; (2) explora el rol mecánico potencial de las mioquinas en la hipertrofia del músculo esquelético; y (3) identifica la investigación futura requerida para avanzar en la comprensión del anabolismo miocínico específicamente en el músculo esquelético.
Esta revisión establece un vínculo entre las mioquinas y la producción de NO, y recalca la importancia de considerar la liberación sistémica de mioquinas anabólicas potenciales durante el ejercicio de fuerza como complementario a otras señales que promueven la hipertrofia.
Es decir, puesto que la resistencia anabólica observada en los mayores de edad resulta en unapérdida de la masa del músculo esquelético, es importante alcanzar un mejor conocimiento del rango de mecanismos, incluyendo a las mioquinas, que regulan o median la hipertrofia muscular y las ganancias en la fuerza. Tal conocimiento nos ayudará a identificar la mejor manera de combatir los crecientes costos de atención médica que resultan de la disminución de la función musculoesquelética asociada con el proceso de envejecimiento. Encontrar métodos específicos y medibles para mantener o mejorar la masa del músculo esquelético a medida que una persona envejece, mediante la aplicación de técnicas de entrenamiento como el ejercicio de fuerza con flujo sanguíneo restringido, nos ayudará a dilucidar los mecanismos que podrían ser valiosos para mejorar la hipertrofia del músculo esquelético en la población adulta mayor. Ese mioquinas tienen un rol en la hipertrofia muscular que está claro, aunque el grado de su influencia requiere una exploración más extensa antes de que tengamos una base sólida de conocimiento sobre estas proteínas de señalización pequeñas. La investigación más enfocada en el potencial hipertrófico de las mioquinas a partir de colaboraciones de científicos aplicados y médicos extenderá nuestras especulaciones actuales y explicará el rol de las mioquinas en la producción de las adaptaciones en el músculo esquelético.
Desde la perspectiva de la biología fundamental del músculo esquelético, nuestro conocimiento sobre la regulación de las células precursoras del músculo a partir de modelos de desarrollo, salud, envejecimiento, y enfermedad serán proporcionados por los investigadores con un amplio rango y rico de disciplinas y métodos. La investigación futura sobre las mioquinas necesita aprovechar las interconexiones entre la biología básica del músculo esquelético, a menudo explorada en modelos animales y estudios de cultivo de tejidos humanos, y la fisiología aplicada del músculo esquelético para avanzar en nuestra comprensión de los mecanismos subyacentes a la adaptación del músculo esquelético al ejercicio y entrenamiento de la fuerza. Una mayor integración de estas disciplinas, en particular las exploraciones que utilizan el beneficio de la aplicación directa en humanos (mejor proporcionada a través de la colaboración multidisciplinaria y mejorada por los estudios de biopsia), aumentará nuestra capacidad de aplicar la ciencia mediante el desarrollo de estrategias de tratamiento basadas en la evidencia; tales estrategias serán el mejor enfoque para mejorar la salud del músculo esquelético y la calidad de vida de nuestra población que envejece y de aquellos en rehabilitación.
Determinar el papel de las mioquinas, particularmente aquellas con potencial anabólico, y su interacción con el NO y sus metabolitos en la regulación o mediación de la hipertrofia del músculo esquelético será un tema importante para futuras investigaciones. Además, determinar el papel de las mioquinas anabólicas en la producción de los efectos del entrenamiento de la fuerza con flujo sanguíneo restringido podría brindar la posibilidad de inducir un crecimiento muscular durante o antes del inicio de la atrofia relacionada con la edad en hombres y mujeres sanos, y en aquellos que sufren lesiones o enfermedades que requieren rehabilitación de corto o largo plazo. Comprender las relaciones complejas e interactivas entre las numerosas vías de la hipertrofia en el músculo esquelético y actuar sobre ella a partir de las influencias sistémicas, es esencial para desarrollar intervenciones basadas en la evidencia que sean intervenciones efectivas y realistas para mejorar la salud muscular en general en nuestra población de edad avanzada en todo el mundo.