Adaptaciones musculares al entrenamiento aeróbico
Departamento de Fisiología del Centro de Ciencias de la Salud Syracuse de la Universidad del Estado de New York, Syracuse, New York.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1998.
Publicado 8 de diciembre de 2003
Resumen
Palabras clave: adaptaciones cardiovasculares, densidad mitocondrial, capacidad aeróbica, capilarización, consumo de
PUNTOS CLAVES
- El músculo se adapta al entrenamiento de ejercicio aeróbico para convertirse en un proveedor de energía más efectivo. Una mejoría en la capacidad de extracción de oxígeno del torrente sanguíneo y un control celular del metabolismo de energía alterado, probablemente contribuyan a un incremento de la performance muscular evidente en el entrenamiento. Por supuesto, la performance también se incrementa por mejorías en el volumen minuto cardíaco y otras adaptaciones no relacionadas a cambios bioquímicos en los músculos.
- Las adaptaciones del entrenamiento son inducidas específicamente en los músculos activamente utilizados en el ejercicio; estas adaptaciones están sostenidas por la actividad continua y se pierden luego de la inactividad. Sesiones de entrenamiento con ejercicios de intensidad tanto como de duración son factores importantes que influyen en las adaptaciones musculares.
- Si bien es de esperar el desarrollo de óptimas adaptaciones musculares para acrecentar la performance en deportes competitivos, adaptaciones significativas desarrolladas por actividad física de rutina en poblaciones no-atléticas también pueden ser importantes para promover una vida más saludable.
INTRODUCCIÓN
La aptitud para mantener una prueba de ejercicio, como lo son correr o pedalear, requiere que la utilización de energía dentro del músculo activo (por ej., tasa de ruptura de adenosín trifosfato (ATP)) esté completamente equiparada a los procesos de provisión de energía (por ej., resíntesis de ATP). Si la demanda de energía no es satisfecha, sobreviene la fatiga muscular. Durante cualquier actividad física que pueda mantenerse por más de unos pocos minutos, esta provisión de energía es provista primariamente por el metabolismo aeróbico, por ej. el consumo de oxígeno que conduce a la oxidación de carbohidratos y ácidos grasos. La mitocondria dentro de las fibras musculares responde a señales químicas producidas durante las contracciones utilizando la energía derivada a través del consumo de oxígeno para resintetizar ATP desde adenosín difosfato (ADP) más fósforo libre (productos de la ruptura de ATP). Este proceso requiere un suficiente transporte de oxígeno hacia las fibras musculares activas y un adecuado abastecimiento de combustible dentro de la célula para soportar el consumo de oxígeno. Estos combustibles incluyen carbohidratos (glucógeno y glucosa) y ácidos grasos suministrados desde dentro de la célula o desde la circulación. El oxígeno debe ser derivado de un flujo sanguíneo adecuado y debe difundirse desde los glóbulos rojos en los capilares hacia la mitocondria en las fibras musculares. Por lo tanto, podría ocurrir una interrupción en la provisión de energía si el abastecimiento de combustible dentro de las fibras musculares se agota, y/o si la circulación no provee un adecuado abastecimiento de combustibles u oxígeno. La participación en ejercicios del tipo de resistencia en el entrenamiento causa adaptaciones musculares que influyen sobre estos procesos, controlando la provisión de energía. Dichas adaptaciones al entrenamiento sirven para rediseñar el músculo e inducen a un incremento de la capacidad de intercambio de oxígeno entre capilares y tejidos, y a un mejor control del metabolismo dentro de las fibras musculares. Ambos factores proveen una mejor base para la mejoría de la performance física.
DISEÑO MUSCULAR
Tipo de Fibra Muscular
El músculo esquelético adulto comprende proporciones aproximadamente equivalentes de fibras musculares lentas (Tipo I) y rápidas (Tipo II) (Saltin y Gollnick, 1983). Las fibras lentas exhiben una capacidad de flujo sanguíneo relativamente alta, una alta densidad capilar y un alto contenido mitocondrial. Este tipo de fibra es impresionantemente resistente a la fatiga, en tanto el flujo sanguíneo sea suficiente. Las fibras rápidas pueden ser convenientemente divididas en dos subtipos primarios - tipo IIa, con capacidad de flujo sanguíneo relativamente alta, alta densidad capilar y alto contenido mitocondrial; y tipo IIb, capacidad de flujo sanguíneo relativamente baja, baja densidad capilar y bajo contenido mitocondrial. Las fibras de tipo IIa tienen una mayor capacidad para el metabolismo oxidativo y son relativamente resistentes a la fatiga, en tanto las fibras de tipo IIb se fatigan rápidamente cuando son reclutadas para contraerse. La aptitud para ejercitar a intensidades crecientes desde suave-a-moderado-a-severo se logra, en gran parte, por el reclutamiento de más fibras musculares, generalmente en un orden serial desde tipo I, tipo IIa y tipo IIb. Reconociendo las diferencias de características de las fibras musculares, es fácil observar porque la performance del ejercicio puede prolongarse a intensidades submáximas relativamente suaves, pero de duración relativamente corta a una intensidad extremadamente alta. Aunque hay adaptaciones significativas en las fibras musculares esqueléticas inducidas por el entrenamiento, el mismo no parece causar marcados cambios en las distribuciones entre tipos de fibras lentas (Tipo I) y rápidas (Tipo II). Por lo tanto, la muy alta proporción de fibras de tipo I (por ej., 70-90%) observada en los músculos de los atletas de resistencia de élite (Fink y cols., 1977) probablemente es más una dote genética que una adaptación al entrenamiento.
Mitocondrias
Una adaptación bioquímica fundamental inducida por el ejercicio es un incremento en el contenido mitocondrial a lo largo de las fibras musculares entrenadas (Holloszy, 1967). Este mayor contenido mitocondrial incrementa la capacidad de provisión de energía aeróbica desde los ácidos grasos y la oxidación de carbohidratos, y puede encontrarse tanto en fibras lentas como rápidas cuando ellas están listas para la adaptación al programa de ejercicio. Si bien se pensó previamente que esta capacidad enzimática incrementada no es utilizada debido a que el contenido mitocondrial fue considerado en exceso de las necesidades máximas, aún en el músculo desentrenado normal (Gollnick y Saltin, 1982), ahora hay evidencia para indicar que un incremento en el contenido mitocondrial es necesario para concretar el potencial incrementado para la provisión aeróbica de ATP inducida en el músculo por el entrenamiento (Robinson y cols. 1994). Adicionalmente, es probable que el incremento en el contenido mitocondrial mejora el control del metabolismo de energía, influye en las fibras musculares para oxidar más ácidos grasos y menos glucógeno, y mejora la performance muscular (ver más adelante).
Capilaridad Muscular
El entrenamiento incrementa el número de capilares que rodean las fibras musculares individuales. En efecto, cuando una fibra es reclutada, ésta se torna más efectiva al ser "bañada" por el flujo de sangre distribuido hacia el músculo. Si bien el incremento de la capilaridad es mayormente observado en las regiones de fibras de baja oxidación (tipo IIb) donde la densidad capilar es normalmente la mínima, este desarrollo de nuevos capilares puede ocurrir en todos los tipos de fibras (Saltin y Gollnick, 1983; Yang y cols. 1994).
Un incremento en el número de capilares rodeando cada fibra podría mejorar el intercambio de oxígeno entre los capilares y la fibra presentando una mayor área de superficie para la difusión del oxígeno, acortando la distancia promedio requerida por el oxígeno para difundirse dentro del músculo, y/o incrementando el tiempo para que ocurra la difusión (por ej., los glóbulos rojos pierden más tiempo en el capilar). Estos efectos del incremento de la capilaridad pueden contribuir a un aumento de la extracción de oxígeno que ocurre en los músculos entrenados de animales de laboratorio (Bebout y cols., 1993; Yang y cols., 1994) y en seres humanos (Saltin y cols., 1976) y da cuenta, en parte, del incremento en el máximo consumo de oxígeno del cuerpo total que es observado en los individuos entrenados para resistencia.
Capacidad de Flujo Sanguíneo
La capacidad de flujo sanguíneo del músculo esquelético normal es excepcionalmente elevada; es tan alta, de hecho, que el volumen minuto cardíaco no puede incrementarse suficientemente para "bañar" a todos los vasos sanguíneos en nuestra masa muscular, aún si ellos estuvieran dilatados al máximo (Anderson y Saltin, 1985). Por lo tanto, aún durante el ejercicio intenso que requiere de un máximo consumo de oxígeno, esta limitación en el volumen minuto cardíaco significa que solo una fracción de la masa muscular de un individuo puede estar activa, y así ésta funciona solo a una fracción de su capacidad de flujo sanguíneo. No obstante, hay evidencia de que el pico de capacidad de flujo del músculo se incrementa con el entrenamiento de resistencia (Mackie y Terjung, 1983; Sexton y Laughlin, 1994), pero el valor de esa adaptación que además incrementa la reserva de flujo "en desuso" en los músculos, no es clara. Es probable que los atributos importantes de las adaptaciones vasculares al entrenamiento incluyan la utilización óptima del flujo distribuido hacia el músculo y el intercambio de nutrientes entre capilares y fibras. Esto tiene importancia en el control vasomotor de los vasos arteriales de provisión/resistencia (Delp y cols., 1993; Segal, 1994) y en las propiedades de intercambio de distribución de los vasos que rodean las fibras musculares.
METABOLISMO
El incremento en el contenido mitocondrial de los músculos entrenados debería tener una serie de efectos metabólicos que sirven para mejorar la performance, al menos durante el ejercicio prolongado. Primero, el incremento de las mitocondrias debería posibilitar una mayor tasa de oxidación de ácidos grasos luego del entrenamiento, aún cuando la concentración de ácidos grasos circulantes disponibles para el músculo no sea elevada (Mol y cols., 1971). Segundo, un incremento en el contenido mitocondrial en la fibra muscular altera las señales bioquímicas que controlan el metabolismo de energía durante el ejercicio submáximo (Dudley y cols., 1987). En efecto, cuando se compara con el estado de desentrenamiento, las señales dentro de las fibras musculares entrenadas que aceleran el metabolismo durante el ejercicio están atenuadas, reduciendo así la tasa de ruptura de carbohidratos y contribuyendo probablemente al ahorro de glucógeno muscular observado en sujetos entrenados (Karlsson y cols., 1972). Por lo tanto, las adaptaciones bioquímicas en el músculo ayudan a proveer la base para los cambios metabólicos favorables a la performance de resistencia en sujetos entrenados (Holloszy y Booth, 1976; Holloszy y Coyle, 1984).
ESTIMULO DE ENTRENAMIENTO
Duración e Intensidad del Ejercicio
En el presente, los mecanismos mencionados responsables de inducir las adaptaciones del entrenamiento en el músculo son desconocidos. Sin embargo, es claro que los músculos deben ser reclutados durante la prueba de ejercicio con el objeto de adaptarse al programa de entrenamiento (Holloszy, 1967). Los músculos (o fibras dentro del músculo) no involucrados en la prueba de ejercicio no se adaptan. Por lo tanto, el estímulo crítico para la adaptación es algo muy específico para las fibras activas, y probablemente no sea algún factor generalizado circulante en la sangre que influye en todos los músculos. Además, para un programa de ejercicio dado, el entrenamiento debe ser ejecutado con una duración suficiente de días o semanas para permitir las adaptaciones bioquímicas específicas del músculo para alcanzar el estado estable (Figura 1). Por ejemplo, el contenido mitocondrial del músculo parece alcanzar un estado estable luego de aproximadamente 4-5 semanas de entrenamiento (Terjung, 1979).
La magnitud del incremento en el contenido mitocondrial inducido por el ejercicio también está influenciado por la duración del esfuerzo de ejercicio diario. Como se ilustra con las líneas individuales en la Figura 2, los esfuerzos de ejercicio más prolongados, generalmente producen mayores incrementos en el contenido mitocondrial. Sin embargo, la influencia de la duración del esfuerzo de ejercicio no es lineal (Dudley y cols., 1982); en tanto las sesiones de entrenamiento se tornan prolongadas de forma incrementada, el tiempo adicional de entrenamiento parece ser relativamente menos importante como señal que induce a un incremento en el contenido mitocondrial. Además, la intensidad del ejercicio interactúa con la duración del esfuerzo del ejercicio para hacer que los minutos iniciales de ejercicio sean aún más efectivos en establecer un estímulo para la adaptación. Nótese en la Figura 2 que el pico de adaptación en contenido mitocondrial parece ocurrir en duraciones más cortas de ejercicios, en tanto la intensidad de cada esfuerzo de entrenamiento se incrementa. El beneficio de sesiones de entrenamiento muy prolongadas en el aumento de la performance puede estar relacionado a adaptaciones en la función cardiovascular, en el balance de fluidos, en la disponibilidad de sustratos, u otros factores no relacionados directamente a las adaptaciones específicas del músculo.
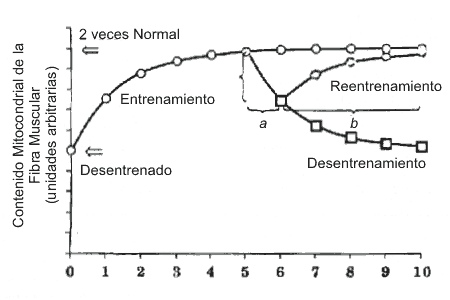
Figura 1. Curso del tiempo de las adaptaciones de entrenamiento /
desentrenamiento en el contenido mitocondrial del músculo esquelético. Nótese
que aproximadamente un 50% del incremento en contenido mitocondrial fue perdido
luego de una unidad de tiempo, por ej., 1 semana de desentrenamiento (a), y que
toda la adaptación fue perdida luego de cinco unidades de desentrenamiento.
Además, tomó cuatro unidades de trabajo, por ej., 4 semanas de reentrenamiento
(b) para recuperarla adaptación perdida en la primer semana de desentrenamiento.
Adaptado de Booth (1977).
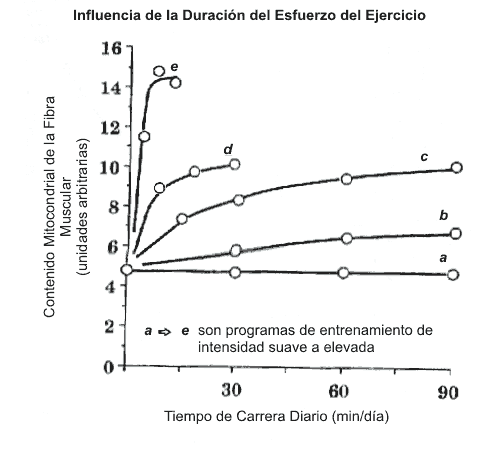
Figura 2. Influencia de la duración del esfuerzo de ejercicio sobre la
adaptación muscular. Desde una perspectiva práctica, uno podría asumir que el
programa de ejercicio "a" fue realizado a una intensidad del 40 % del VO2
max, y "b " al 50 % del VO2 max, "c" al 70 del VO2 max, "d
" al 85 % del VO2 max, y "e " al 100 % del VO2 max.
Adaptado de Dudley y cols. (1982).
Al menos una parte del efecto benéfico de la intensidad de ejercicio en el incremento sobre las adaptaciones inducidas por el entrenamiento en los músculos puede atribuirse al efecto de la intensidad sobre el reclutamiento de las fibras musculares (Dudley y cols., 1982). Esto se ilustra en la Figura 3. Una vez obtenido el pico de performance (por ej., desarrollo de fuerza y/o producción de potencia) de un grupo de fibras musculares involucrado (ilustrado en la Figura 3 como las fibras altamente oxidativas), se consigue una mayor producción de potencia por el reclutamiento de fibras musculares adicionales. Esto es ilustrado por la marcada oxidación que se torna aparente en las fibras de baja oxidación, en la medida que las mismas son reclutadas para satisfacer las demandas de la prueba de ejercicio más intensa.
Entrenamiento a Corto Plazo
No toda la mejoría en la performance del ejercicio que acompaña al entrenamiento puede ser explicada por las adaptaciones bioquímicas a largo plazo. Por ejemplo, aún en los días iniciales de un programa de ejercicio, hay evidencia de una mejoría en la performance del músculo y en el metabolismo (Cadefau y cols. 1994; Green y cols. 1992), tal vez debido a que el entrenamiento breve causa un movimiento inicial en el control neuromuscular y/o cardiovascular que mejora la utilización de las fibras, el metabolismo y la distribución del flujo sanguíneo. Esto es un ejemplo de la complejidad de los cambios y la variedad de duraciones de entrenamiento requeridas para lograr adaptaciones particulares que llevan a un estado de entrenamiento óptimo. Toda la mejoría en la performance del ejercicio luego del entrenamiento no puede ser atribuida solamente a las adaptaciones musculares desarrolladas en este artículo. Otros cambios (por ej., neuromusculares, cardiovasculares y endócrinos) pueden ser instrumentos que contribuyen al incremento de la performance del ejercicio luego del entrenamiento por varias semanas o meses.
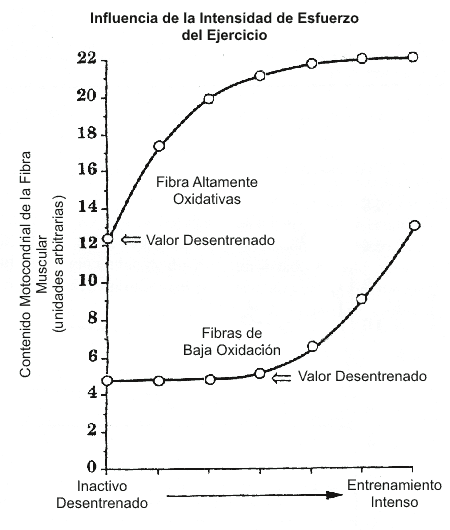
Figura 3. Influencia de la intensidad del esfuerzo del ejercicio sobre las
adaptaciones inducidas por el entrenamiento, en el contenido mitocondrial del
músculo. En la medida que los esfuerzos de ejercicio se tornan más intensos, más
fibras de baja oxidación (Tipo IIb) son reclutadas y se adaptan al
entrenamiento. Adaptado de Dudley y cols. (1982).
Desentrenamiento
Al tiempo que las adaptaciones significativas son inducidas por la actividad física, éstas se pierden gradualmente en personas que se tornan inactivas. El alcance y curso del tiempo de regresión no son conocidos para muchas variables, y probablemente estén relacionados al proceso exacto bajo consideración. Por ej., como se ilustra en la Figura 1, aproximadamente un 50% del contenido mitocondrial del músculo inducido por el entrenamiento puede ser perdido en una semana de desentrenamiento (Henriksson y Reitman, 1977; Terjung, 1979). Un retorno al entrenamiento hace recobrar las adaptaciones musculares; sin embargo, el tiempo requerido para reestablecer la condición entrenada de estado estable puede tomar más tiempo que el intervalo de desentrenamiento (Booth, 1977). Por ejemplo, en la Figura 1 se compara el tiempo relativamente largo (identificado como "b") necesario para recuperarse del tiempo breve de desentrenamiento que causó la declinación en el contenido mitocondrial.
Referencias
1. Andersen, P., and B. Saltin (1985). Maximal perfusion of skeletal muscle in man. J. Physiol., London 366: 233-249
2. Bebout, D.E., M.C. Hogan, S.C. Hempleman, and P.D.Wagner (1993). Effects of training and immobilization on VO2 and DO2 in dog gastrocnemius muscle in situ. J. Appl. Physiol. 74: 1697-1703
3. Booth, F.W (1977). Effects of endurance exercise on cytochrome c turnover in skeletal muscle. Annals N. Y Acad. Sci. 301: 431-439
4. Cadefau, J., H.J. Green, R. Cusso, M. Ball-Burriett, and G. Jamieson (1994). Coupling of muscle phosphorylation potential to glycolysis during work after shortterm training. J Appl. Physiol. 76: 2586-2593
5. Delp, M.D., R.M. McAllister, and M.H. Laughlin (1993). Exercise training alters endothelium-dependent vasoreactivity of rat abdominal aorta. J. Appl. Physiol. 75: 1354-1363
6. Dudley, G.A., W.M. Abraham, and R.L. Terjung (1982). nfluence of exercise intensity and duration on biochemical adaptations in skeletal muscle. J. Appl. Physiol. 53: 844-850
7. Dudley, G.A., P.C. Tullson, and R.L. Terjung (1987). Influence of mitochondrial content on the sensitivity of respiratory control. J. Biol. Chem. 262: 9109-9114
8. Fink. W.J., D.L. Costill, and M.L. Pollock (1977). Submaximal and maximal working capacity of elite distance runners. Part 11. Muscle fiber composition and enzyme activities. Annals N.Y Acad. Sci. 301:323-327
9. Gollnick, P.D., and B. Saltin (1982). Significance of skeletal muscle oxidative enzyme enhancement with endurance training. Clin. Physiol. 2: 1 -12
10. Green, H.J., R. Helyar, M. Ball-burnett, N. Kowalchuk, S. Symon, and B. Farrance (1992). Metabolic adaptations to training precede changes in muscle mitochondrial capacity. J. Appl. Physiol. 72: 484-49 1
11. Henriksson, J., and J.S. Reitman (1977). Time course of changes in human skeletal muscle succinate dehydrogenase and cytochrome oxidase activities and maximal oxygen uptake with physical activity and inactivity. Acta Physiol. Scand. 99: 91-97
12. Holloszy, J.O (1967). Biochemical adaptations in muscle. Effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle. J Biol. Chem. 242: 2278-2282
13. Holloszy, J.O., and F.W. Booth (1976). Biochemical adaptations to endurance exercise in muscle. Ann. Rev. Physiol. 38: 273-291
14. Holloszy, J.O., and E.F. Coyle (1984). Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J. Appl. Physiol. 56: 831-838
15. Karlsson, J., L.O. Nordesjo, L. Jorfeldt, and B. Saltin (1972). Muscle lactate, ATP, and CP levels during exercise after physical training in man. J. Appl. Physiol. 33: 199-203
16. Mackie, B.G., and R.L. Terjung (1983). Influence of training on blood flow to different skeletal muscle fiber types. J. Appl. Physiol. 55:1072-1078
17. Robinson, D.M., R.W. Ogilvie, P.C. Tullson, and R.L.Terjung (1994). Increased peak oxygen consumption of trained muscle requires increased electron flux capacity. J Appl. Physiol. 77: 1941-1952
18. Saltin, B., and P.D. Gollnick (1983). Skeletal muscle adaptability: significance for metabolism and performance. In: L.D. Peachey (ed.) Handbook of Physilogy, Sec. 10, Skeletal Muscle. Baltimore, MD: Williams and Wilkins, pp. 555-631
19. SaltinB., K. Nazar, D.L. Costill, E. Stein, E. Jansson, B. Essen, and P.D. Gollnick (1976). The nature of the training response: peripheral and central adaptations of one-legged exercise. Acta Physiol. Scand. 96: 289-305
20. Segal, S.S (1994). Cell-to-cell communication coordinates blood flow control. Hypertension 23: 1113-1120
21. Sexton,W.L., and M.H. Laughlin (1994). Influence of endurance exercise training on distribution of vascular adaptations in rat skeletal muscle. Am. J. Physiol. 266: H483-90
22. Terjung, R.L (1979). The turnover of cytochrome c in different skeletal-muscle fibre types of the rat. Biochem. Biochem. J. 178: 569-574
23. Yang, H.T.R.W Ogilvie, and R.L. Terjung (1994). Peripheral adaptations in trained aged rats with femoral artery stenosis. Circ. Res. 74: 235-243