Altura y Radicales Libres
Artículo publicado en el journal PubliCE, Volumen 0 del año 2004.
Publicado 30 de noviembre de 2004
Resumen
Palabras clave: altura, especies reactivas de oxígeno y nitrógeno, estrés oxidativo, daño oxidativo, antioxidantes, enfermedad aguda de montaña
INTRODUCCION
La producción de especies reactivas de oxígeno y nitrógeno (RONS) es una consecuencia necesaria del metabolismo aerobio. Las RONS son moduladores fisiológicos naturales del ambiente redox celular y por lo tanto participan como factores de señalización y control en un amplio rango de procesos fisiológicos y pato-fisiológicos conocidos y desconocidos. A pesar de que existe un sistema antioxidante, el nivel de producción de RONS puede exceder la capacidad de esta red de defensa, derivando en lo que se conoce como estrés oxidativo (Askew, 2002). Se ha asumido que el incremento en el metabolismo aeróbico o hiperoxia favorece el incremento en el nivel de RONS y provoca el daño oxidativo de lípidos, proteínas y ADN. En efecto, el ejercicio físico, especialmente una única serie de ejercicio por encima de cierta intensidad o duración puede resultar en estrés oxidativo y provocar el daño de diferentes órganos (Radak et al., 2001). Sin embargo, parece que el incremento en el nivel de producción de RONS no solo se debe a la respiración mitocondrial, ya que el ejercicio anaeróbico también puede provocar daño oxidativo (Radak et al., 1998). Además, la protección del endotelio mediante la administración de superóxido dismutasa exógena (SOD) evito el daño oxidativo de los lípidos y redujo la actividad de la xantina oxidasa, indicando que la producción de RONS inducida por el ejercicio ocurre a través de diversas fuentes y mecanismos.
Similarmente al ejercicio físico anaeróbico, la exposición a la altura con frecuencia provoca el daño oxidativo de macromoléculas. La baja presión de oxígeno parece favorable para reducir la producción de RONS, pero parece que la exposición a la altura está asociada con el incremento en el daño oxidativo, lo cual podría ser consecuencia de un incremento en la actividad de las RONS y con la reducción de la actividad de los sistemas antioxidantes. Además, de acuerdo con nuestro conocimiento actual, no se puede descartar que las RONS estén involucradas en el daño oxidativo y que además sean uno de los factores causantes de la enfermedad aguda de montaña (AMS), del edema pulmonar provocado por la exposición a la altura (HAPE) y del edema cerebral provocado por la exposición a la altura (HACE) (Bailey et al., 2001, Baumgartner et al., 2002, Chao et al., 1999). La presente revisión tratará la literatura disponible acerca de la exposición a la altura, el ejercicio y el estrés oxidativo.
Altura y Daño Oxidativo
En uno de nuestros cuatro estudios, hemos utilizado un protocolo de exposición intermitente (12 hs por día) a una altitud de 4000 m para estudiar los cambios en la actividad y contenido de las enzimas antioxidantes dependientes de las fibras musculares y en el nivel de peroxidación de lípidos (Radak et al., 1994). Nuestros datos revelaron que la exposición intermitente a la altura resultó en un incremento significativo en la peroxidación de los lípidos tanto en las fibras lentas como en las fibras rápidas de las ratas estudiadas. Interesantemente, cuando utilizamos un protocolo de exposición continua de 4 semanas a la misma altura, no observamos un incremento en la peroxidación de los lípidos pero si un incremento en la oxidación de proteínas medida como un incremento en derivados carbonilos (Radak et al., 1997). Kumar et al (1989) han hallado que una exposición de corta duración (5 días) a una altura de 7576 m provocó el incremento en el nivel de peroxidación de lípidos plasmáticos de ratas. Estos resultados fueron confirmados por el mismo protocolo experimental pero con la adición de un grupo suplementado con vitamina E (Ilavazhagan et al., 2001). Además, Nakanishi y colaboradores (1995) reportaron que la exposición a 5500 m de altura resultó en un incrementado nivel sérico de malondialdehído en pulmones, hígado, corazón y riñones.
Los estudios llevados a cabo con humanos han revelado resultados similares. Moller et al (2001) expuso a doce sujetos saludables a una altitud de 4559 m, lo que provocó un incremento significativo en la ruptura de cadenas de ADN medidas en la orina. El daño fue más prominente en los sitios de endonucleasa-III. Cuando los humanos fueron expuestos simultáneamente a la altura (2700 m) y al frío, el nivel de lípidos peroxidados y de cadenas dañadas de ADN en la orina se incrementó significativamente (Schmidt et al., 2002). En el estudio denominado Operación Everest III, el nivel de peroxidación de lípidos se incrementó hasta un 23% a los 6000 m y hasta un 79% a la altura de 8848 m, indicando que el nivel de estrés oxidativo se incrementa con el incremento en la altura (Joanny et al., 2001). De esta manera se puede observar que los estudios llevados a cabo con humanos y animales son relativamente consistentes en el reporte de que la hipoxia asociada con la altura provoca el daño oxidativo de los lípidos, proteínas y cadenas de ADN. Este daño puede deberse al incremento en la producción de RONS y/o a la reducción de la capacidad antioxidante.
Efecto de la Altura sobre los Sistemas Antioxidantes
Las células desarrollan sistemas antioxidantes enzimáticos y no enzimáticos para regular los efectos de las RONS. Los sistemas enzimáticos contienen SOD mitocondriales (Mn-SOD), citosólicos (Cu,Zn-SOD) y extracelulares para convertir los superóxidos altamente reactivos en peróxidos de hidrógenos menos potentes. La glutatión peroxidasa (GPX) y la catalasa descomponen los peróxidos de hidrógeno en agua. Otras enzimas, tal como la tioredoxina y glutaredoxina no serán discutidas en la presente revisión ya que no hay datos disponibles en relación con la exposición a la altura. Los sistemas no enzimáticos son muy complejos y además existen muchos antioxidantes no enzimáticos en las células. Los estudios relacionados con la exposición a la altura han medido el contenido de glutatión, vitamina E y vitamina C entre los antioxidantes no enzimáticos y por lo tanto estos agentes están incluidos en la discusión de la presente revisión.
Solo existen algunos estudios que han examinado la capacidad de las enzimas antioxidantes durante la exposición a la altura. Nosotros hemos reportado que 6 meses de exposición intermitente a la altura (4000 m) resultó en una reducción de la actividad y del contenido proteínico de SOD mitocondrial en los músculos esqueléticos de ratas (Radak et al., 1994). Esto fue confirmado por Nakanishi et al (1995) quienes hallaron que la exposición a una altura simulada de 5500 m provocó el incremento del nivel sérico de Mn-SOD inmunoreactivo y en una reducción del nivel de Mn-SOD inmunoreactivo en pulmones e hígado de los animales examinados. La actividad de la glutatión peroxidasa (GPX) también se redujo en el hígado sugiriendo que éste órgano puede ser particularmente sensible al estrés oxidativo inducido por la exposición a la altura (Nakanishi et al., 1995). En otro de nuestros estudios no pudimos detectar ningún efecto de 4 semanas de exposición a una altura de 4000 m sobre la actividad de las enzimas antioxidantes (Radak et al. 1997). Imai et al (1995), compararon la actividad sérica de la GPX en sujetos nacidos en la altura (4000 m) y de sujetos nacidos a nivel del mar. Estos investigadores hallaron que las personas nacidas y criadas en la altura tenían un menor nivel de actividad de la GPX. La actividad y efectividad de la GPX es altamente dependiente del estado del sistema tiol. La Glutamil-cisteinil-glicina, es una de las principales fuentes tiol/antioxidante de la célula, la cual se sintetiza continuamente en el ciclo glutamil. La exposición a la altura provoca la disminución del nivel de glutatión reducido (GSH) e incrementa la concentración de glutatión oxidado (Ilvazhagan et al., 2001, Joanny et al., 2001).
Por lo tanto, al parecer la capacidad de los sistemas antioxidantes enzimáticos y no enzimáticos se reduce con la exposición a la altura. Existen algunas formas de evitar el daño oxidativo asociado con la exposición a la altura mediante la suplementación con antioxidantes. Schmidt et al (2002) han utilizado una mezcla de antioxidantes que contenía vitamina E, beta-carotenos, ácido ascórbico, selenio, ácido alfa-lipóico, N-acetil 1-cisteína, catechina, luteína y licopeno para reducir el estrés oxidativo causado por la exposición a la altura. Esta mezcla de antioxidantes fue efectiva observándose una reducción del daño oxidativo.
La suplementación oral con vitamina E (40 mg por día) en ratas, 5 días antes y durante el período de exposición hipóxica a 7576 m redujo significativamente la peroxidación de los lípidos inducida por la exposición a la altura (Ilvazhagan et al., 2001). Por otra parte, la suplementación con una mezcla de antioxidantes que contenía 20000 UI de beta-carotenos, 400 UI de vitamina E, 500 mg de vitamina C, 100 microgramos de selenio y 30 mg de Zinc (en forma diaria) no redujo el daño oxidativo de macromoléculas (Pfeiffer et al., 1999).
La utilización de un protocolo de muy corta duración a una altura de 8000 m en ratas resultó en un incrementado nivel de melatonina en sangre (Kaur et al., 2002). La melatonina además de poseer un amplio espectro de efectos fisiológicos puede actuar como antioxidante. Luego de las primeras 4 semanas de exposición a la altura, el número de mitocondrias y de gotas de lípidos en los pinealocitos pareció reducirse en comparación con lo observado en las ratas de control sugiriendo que otra fuente, además de los pinealocitos, también produce melatonina.
Al parecer la exposición a la altura reduce la actividad y el contenido de ciertas enzimas antioxidantes. Además, la efectividad del sistema tiol también se ve reducida por la exposición a la altura. Existen algunos indicios de que la suplementación con antioxidantes reduce o previene el daño oxidativo de macromoléculas inducido por la exposición a la altura.
Sistemas Productores de RONS con la Exposición a la Altura
Está bien demostrado que la suplementación masiva con oxígeno resulta en una incrementada formación de ROS mitocondriales. Sin embargo, también parece que la hipoxia puede derivar en estrés reductor, lo cual a su vez resulta en un incremento en la producción de ROS a través del sistema de transporte de electrones mitocondrial (Mohanraj et al., 1998). Se cree que las ROS se generan en el complejo I y en el complejo III de la cadena de transporte de electrones. Durante la hipoxia, hay menos O2 disponible para ser reducido a H2O en la citocromo oxidasa, causando la acumulación de equivalentes reductores dentro de la secuencia de la respiración mitocondrial. Esto se conoce como estrés reductor, lo cual deriva en la formación de ROS mediante la auto-oxidación de uno o más complejos mitocondriales tal como la cupla redox ubiquinona-ubiquinol. Khan y O’Brien (1995) han observado incrementos en el cociente celular de NADH/NAD+ con el estrés reductor asociado a la hipoxia.
El sistema xantina deshidrogenasa/oxidasa es un potente generador de ROS durante condiciones de hipoxia/reperfusión. La exposición intermitente a la altura tiene características similares a la isquemia/reperfusión (Radak et al., 1994). Por otra parte, el patrón cambiante de ROS y óxido nítrico (NO) es diferente durante la isquemia/reperfusión y la exposición a la altura. Durante la isquemia/reperfusión la respuesta inicial está acompañada por un incremento reversible en la producción de ROS y esta respuesta es bloqueada por antioxidantes y por intervenciones que incrementan los niveles tisulares de NO. En contraste a la isquemia/reperfusión, los niveles de ROS se incrementan durante la hipoxia y retornan a los niveles pre-hipóxicos luego de que se establezca la normoxia. La aclimatación implica la regulación ascendente de la NO sintetasa (iNOS) lo cual sugiere que la hipoxia deriva en una alteración del equilibrio ROS/NO el cual eventualmente se verá restaurado durante el proceso de aclimatación (Gonzalez and Wood, 2001). Este fenómeno podría tener relevancia para las alteraciones microcirculatorias asociadas con la exposición hipóxica, incluyendo la enfermedad aguda de montaña y el edema pulmonar y cerebral asociado con la exposición a la altura. Los hallazgos de Serrano et al (2002) indican que la producción de NO durante la exposición a la altura está asociada a diferentes tipos de NOS, lo cual puede derivar en una incrementada formación de nitrotirosina en el cerebelo de ratas luego de la reoxigenación al nivel del mar. Se sabe bien que la radiación UV se incrementa significativamente durante la exposición a la altura, resultando en una incrementada formación de RONS.
De acuerdo con nuestro conocimiento actual, parece que el incremento en la producción de RONS asociado a la exposición a la altura tiene diferentes fuentes entre las que se incluyen la cadena respiratoria mitocondrial, la xantina oxidasa y la iNOS.
Exposición a la Altura y Ejercicio
El entrenamiento en la altura es utilizado frecuentemente por los atletas para incrementar el número de glóbulos rojos, lo cual se cree que incrementa el rendimiento de resistencia. Sin embargo, el estrés oxidativo asociado, consecuencia del entrenamiento en la altura, no se comprende con claridad. Está bien aceptado que el ejercicio físico incrementa el consumo de oxígeno y el flujo de oxígeno hacia la mitocondria, y que el ejercicio de cierta intensidad y/o duración puede derivar en estrés oxidativo. También se ha demostrado que no solo el ejercicio aeróbico sino también el ejercicio anaeróbico puede provocar daño oxidativo (revisado por Radak et al., 2001). Se ha sugerido que durante el ejercicio anaeróbico la XO es una de las mayores fuentes de producción de ROS (Radak et al., 1995). Los datos disponibles sugieren que tanto la exposición a la altura como el ejercicio por si solo pueden derivar en estrés oxidativo y cambiar el estado redox de las células. Por lo tanto, no es sorprendente que los efectos combinados del ejercicio y la altura resulten en un incrementado daño oxidativo. Nosotros hemos demostrado que el entrenamiento a una altura de 4000 m resultó en una incrementada carbonilación de ciertas proteínas musculares, particularmente de la actina, la cual es la principal proteína contráctil (Radak et al., 1997). Por esta razón hemos sugerido que el ejercicio potencia los efectos de la exposición a la altura sobre la producción de ROS y debilita la potencia de los sistemas antioxidantes. Esta hipótesis fue confirmada en estudios llevados a cabo con humanos (Wozniak et al., 2001). Moller et al (2001) concluyeron que la hipoxia desmejora la capacidad de los sistemas antioxidantes y reduce la capacidad del cuerpo para soportar el estrés oxidativo provocado por el ejercicio hasta el agotamiento. Los datos de Joanny et al (2001) respaldan esta sugerencia y destacan la importancia de la suplementación con antioxidantes para aquellos individuos que realizan ejercicios en la altura.
El incremento de actividad física durante la exposición a la altura incrementa la vulnerabilidad del cuerpo para soportar el estrés oxidativo y puede derivar en daño oxidativo. Por lo tanto, la suplementación con antioxidantes parece ser una herramienta importante y natural para reducir el estrés oxidativo inducido por la exposición a la altura y el ejercicio.
Enfermedad Aguda de Montaña (AMS) y RONS
Nuestra comprensión actual de la AMS todavía está lejos de ser completa. Los síntomas más comunes de la AMS son dolores de cabeza, nauseas, anorexia, insomnio, fatiga/laxitud, vómitos y mareos. Muchos de los eventos fisiológicos asociados con la Patofisiología de la AMS han sido bien documentados, incluyendo hiperventilación, desmejora en el intercambio de gases (edema intersticial pulmonar), retención y redistribución de fluidos e incremento en la activación simpática (revisado por Hackett, 1999). En contraste la presión intercraneal y el edema cerebral se han documentado con AMS moderada a severa, reflejando el continuum entre la AMS y el HACE (edema cerebral provocado por la exposición a la altura). Durante el desarrollo del HACE la elevada presión de los capilares cerebrales provoca la alteración de las barreras sanguíneas cerebrales (BBB) provocando edema. Aparentemente los radicales libres (e.g., radicales oxígeno e hidroxilo), la bradiquinina, la histamina, el ácido araquidónico y el NO podrían estar involucrados en la alteración de las BBB (Schilling and Wahl, 1999).
De hecho, existen algunos datos que indican que las RONS están involucradas e incluso que son factores causantes de la AMS (Bailey and Davies, 2001). El HAPE (edema pulmonar provocado por la exposición a la altura), una condición clínica potencialmente mortal, representa una seria complicación de la AMS. El HAPE es un incremento en la permeabilidad capilar, lo cual ocurre como resultado de una reacción inflamatoria y/o de lesiones pulmonares mediadas por radicales libres (Figura 1). A partir de los hallazgos de su estudio, Kleger et al (1996) sugirieron que la reacción inflamatoria, la cual fue asociada con el HAPE, fue más una consecuencia que una causa del edema pulmonar provocado por la exposición a la altura (Kleger et al., 1996). No obstante, la inhalación de NO fue utilizada con éxito para suavizar o reducir los síntomas de HAPE (Anand et al., 1998) y esta observación sugiere que el NO puede ser un factor causante. Los efectos beneficiosos de la inhalación de NO también fueron demostrados en modelos con ratas, en los cuales la tasa de mortalidad de las ratas de control fueron del 39.5% y de solo el 6.2% en el grupo tratado con NO (Omura et al., 2000). Por lo tanto se ha hipotetizado que la susceptibilidad a padecer HAPE puede estar relacionada con una reducida producción de NO, un modulador endógeno de la resistencia vascular pulmonar y que, durante la exposición hipóxica, podría detectarse una reducción en el NO exhalado. Por lo tanto, se requiere de una vasoconstricción pulmonar exagerada provocada por la hipoxia para el desarrollo de HAPE.
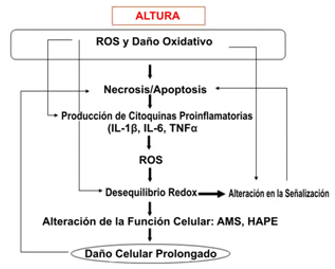
Figura 1. Posibles mecanismos de la inflamación inducida por la exposición a la altura.
A pesar de nuestro limitado conocimiento acerca de la AME, la información disponible sugiere que las RONS son factores activos en el proceso de la enfermedad, sin embargo no es claro si estas son agentes causantes o asociados.
CONCLUSIONES
La exposición a la altura reduce la eficiencia de los sistemas antioxidantes y la incrementada producción de RONS puede derivar en el daño oxidativo de macromoléculas. El ejercicio físico puede exacerbar los efectos de la exposición a la altura y puede incrementar el estrés oxidativo. La suplementación con antioxidantes ha mostrado tener efectos beneficiosos y puede atenuar y/o evitar el daño oxidativo asociado con el ejercicio y la exposición a la altura. No se puede excluir que las RONS estén involucradas en el desarrollo de la AMS, y especialmente el NO parece desempeñar un importante rol.
Puntos Clave
Referencias
1. Anand, I.S., Prasad, B.A., Chugh, S.S., Rao, K.,R., Cornfield, D.N,, Milla, C.E,, Singh, N., Singh, S. and Selvamurthy, W (1988). Effects of inhaled nitric oxide and oxygen in high-altitude pulmonary edema. Circulation 98, 2441-2445
2. Askew, E.W (2002). Work at high altitude and oxidative stress: antioxidant nutrients. Toxicology 180, 107-119
3. Bailey, D.M., Davies, B., Young, I.S,, Hullin, D.A. and Seddon, P.S (2001). A potential role for free radical-mediated skeletal muscle soreness in the pathophysiology of acute mountain sickness. Aviatione Space Environ Medicine 72, 513-521
4. Bailey, D.M and Davies, B (2001). Acute mountain sickness; prophylactic benefits of antioxidant vitamin supplementation at high altitude. High Altitude Medicine and Biology 2, 21-29
5. Baumgartner, R.W., Eichenberger, U. and Bartsch, P (2002). Postural ataxia at high altitude is not related to mild to moderate acute mountain sickness. European Journal of Applied Physiology 86, 322-326
6. Chao, W.H, Askew, E.W., Roberts, D.E., Wood, S.M and Perkins, J.B (1999). Oxidative stress in humans during work at moderate altitude. Journal of Nutrition 129, 2009-2012
7. Gonzalez, N.C. and Wood, J.G (2001). Leukocyte-endothelial interactions in environmental hypoxia. Advanced Experimental Medicine and Biology 502, 39-60
8. Hackett, P.H (1999). High altitude cerebral edema and acute mountain sickness. A pathophysiology update. Advanced Experimental Medicine and Biology 474, 23-45
9. Ilavazhagan, G., Bansal, A., Prasad, D., Thomas, P., Sharma, S.,K., Kain, A.K., Kumar, D. and Selvamurthy, W (2001). Effect of vitamin E supplementation on hypoxia-induced oxidative damage in male albino rats. Aviatione Space Environ Medicine 72, 899-903
10. Imai, H., Kashiwazaki, H., Suzuki, T., Kabuto, M., Himeno, S., Watanabe, C., Moji, K., Kim, S.W., Rivera, J.O. and Takemoto, T (1995). Selenium levels and glutathione peroxidase activities in blood in an andean high-altitude population. Journal of Nutrition Science and Vitaminology (Tokyo) 41, 349-361
11. Joanny, P., Steinberg, J., Robach, P., Richalet, J.P., Gortan, C., Gardette, B. and Jammes, Y. Operation Everest III (Comex'97) (2001). the effect of simulated sever hypobaric hypoxia on lipid peroxidation and antioxidant defence systems in human blood at rest and after maximal exercise. Resuscitation 49, 307-314
12. Kaur, C., Srinivasan, K.N., Singh, J., Peng, C.M. and Ling, E.A (2002). Plasma melatonin, pinealocyte morphology, and surface receptors/antigen expression on macrophages/microglia in the pineal gland following a high-altitude exposure. Journal Neuroscience Research 67, 533-543
13. Khan, S. and O'Brien, P.,J (1995). Modulating hypoxia-induced hepatocyte injury by affecting intracellular redox state. Biochimica Biophysica Acta 1269, 153-161
14. Kleger, G.R., Bartsch, P., Vock, P., Heilig, B., Roberts, L.J. and Ballmer, P.E (1923). Evidence against an increase in capillary permeability in subjects exposed to high altitude. Journal of Applied Physiology 81, 1917
15. Kumar, D., Bansal, A., Thomas, P., Sairam, M., Sharma, S.K., Mongia, S.S., Singh, R. and Selvamurthy, W (1999). Biochemical and immunological changes on oral glutamate feeding in male albino rats. International Journal of Biometeorology 42, 201-204
16. Mohanraj, P., Merola, A.J., Wright, V.P. and Clanton, T.L (1998). Antioxidants protect rat diaphragmatic muscle function under hypoxic conditions. Journal of Applied Physiology 84, 1960-1966
17. Moller, P., Loft, S., Lundby, C. and Olsen, N.V (2001). Acute hypoxia and hypoxic exercise induce DNA strand breaks and oxidative DNA damage in humans. FASEB Journal 15, 1181-1186
18. Nakanishi, K., Tajima, F., Nakamura, A., Yagura, S., Ookawara, T., Yamashita, H., Suziki, K., Taniguchi, N. and Ohno. H (1995). Antioxidant system in hypobaric-hypoxia. Journal of Physiology 489, 869-876
19. Omura, A., Roy, R. and Jennings, T (2000). Inhaled nitric oxide improves survival in the rat model of high-altitude pulmonary edema. Wilderness Environmental Medicine 11, 251-256
20. Pfeiffer, J.M,, Askew, E.W., Roberts, D.E., Wood, S.M., Benson, J.E., Johnson, S.C. and Freedman, M,S (1999). Effect of antioxidant supplementation on urine and blood markers of oxidative stress during extended moderate-altitude training. Wilderness Environmental Medicine 10, 66-74
21. Radak, Z., Lee, K., Choi, W., Sunoo, S., Kizaki, T., Oh-Ishi, S., Suzuki, K., Taniguchi, N., Ohno, H. and Asano, K (1994). Oxidative stress induced by intermittent exposure at a simulated altitude of 4000 m decreases mitochondrial superoxide dismutase content in soleus muscle of rats. European Journal of Applied Physiology 69, 392-395
22. Radak, Z., Asano, K., Inoue, M., Kizaki, T., Oh-Ishi, S., Suzuki, K., Taniguchi, N. and Ohno, H (1995). Superoxide dismutase derivative reduces oxidative damage in skeletal muscle of rats during exhaustive exercise. Journal of Applied Physiology 79, 129-135
23. Radak, Z., Asano, K., Inoue, M., Kizaki, T., Oh-Ishi, S., Suzuki, K., Taniguchi, N. and Ohno, H (1996). Superoxide dismutase derivative prevents oxidative damage in liver and kidney of rats induced by exhausting exercise. European Journal of Applied Physiology 72, 189-194
24. Radak, Z., Asano, K., Lee, K.C., Ohno, H., Nakamura, A., Nakamoto, H. and Goto, S (1997). High altitude training increases reactive carbonyl derivatives but not lipid peroxidation in skeletal muscle of rats. Free Radical Biology and Medicine 22, 1109-1114
25. Radak, Z., Nakamura, A., Nakamoto, H., Asano, K., Ohno, H. and Goto, S (1998). A period of anaerobic exercise increases the accumulation of reactive carbonyl derivatives in the lungs of rats. Pflügers Archiv European Journal of Physiology 435, 439-441
26. Radak, Z., Taylor, A.W., Ohno, H. and Goto, S (2001). Adaptation to exercise-induced oxidative stress: from muscle to brain. Exercise Immunology Reviews 7, 90-107
27. Schilling, L. and Wahl, M (1999). Mediators of cerebral edema. Advanced Experimental Medicine and Biology 474, 123-141
28. Schmidt, M.C., Askew, E.W., Roberts, D.E., Prior, R.L., Ensign, W.Y., Jr. and Hesslink, R.E, Jr (2002). Oxidative stress in humans training in a cold, moderate altitude environment and their response to a phytochemical antioxidant supplement. Wilderness Environmental Medicine 13, 94-105
29. Schneider, J.C., Blazy, I., Dechaux, M., Rabier, D., Mason, N.P. and Richalet, J.P (2001). Response of nitric oxide pathway to L-arginine infusion at the altitude of 4,350 m. European Respiratory Journal 18, 286-292
30. Serrano, J., Encinas, J.M., Salas, E., Fernandez, A.P,, Castro-Blanco, S., Fernandez-Vizarra, P, Bentura, M.L. and Rodrigo, J (2003). Hypobaric hypoxia modifies constitutive nitric oxide synthase activity and protein nitration in the rat cerebellum. Brain Research 976, 109-119
31. Wozniak, A., Drewa, G., Chesy, G., Rakowski, A., Rozwodowska, M. and Olszewska, D (2001). Effect of altitude training on the peroxidation and antioxidant enzymes in sportsmen. Medicine Science ii Sports and Exercise 33, 1109-1113