AMPK: Regulador Metabólico
Publicado 19 de abril de 2014, 0:08
La
proteína cinasa activada por AMP (AMPK) fue descubierta como una enzima que inhibía
preparaciones de Acetil CoA Carboxilasa (ACC) y 3-hidroxi-3-metilglutaril-CoA
Reductasa (HMG-CoA Reductasa, HMGR) y que era inducida por AMP [1], lo cual la
relaciona directamente con la homeostasis energética de la célula. AMPK es una enzima
heterotrimérica compuesta de una subunidad catalítica α (63 kDa) y dos
subunidades no catalíticas β (40 kDa) y γ (38 kDa); sin embargo, han sido
identificadas dos subunidades α (α1 y α2), aunque la expresión y actividad
varía dependiendo del tejido donde se exprese, esto ha permitido diferentes
combinaciones de enzimas heterotriméricas de AMPK. Además, las concentraciones
relativas de α1 y α2 varían, siendo α1 más abundante en el músculo esquelético
que α2, aunque ésta última presenta una mayor actividad [2]. AMPK induce una
cascada de eventos en las células en respuesta a los constantes cambios de
energía. El papel de AMPK en la regulación de la carga de energía de la célula
coloca a esta enzima en un punto central de control para mantener la homeostasis
de energía (Figura 1).
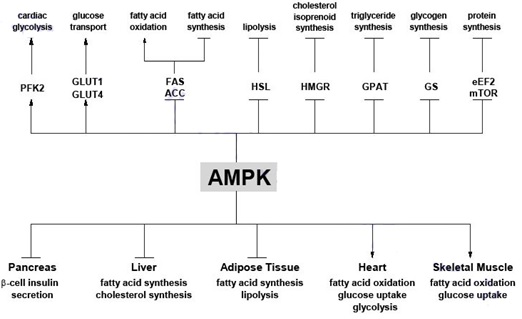
Figura 1. Funciones generales de AMPK. Demostración del papel central de AMPK en la regulación del metabolismo en respuesta a eventos como estrés inducido por nutrientes o ejercicio. Varios de los blancos conocidos de AMPK se han incluido, así como también varias vías metabólicas cuyo flujo se afecta por la activación de AMPK. Las flechas indican efectos positivos de AMPK, mientras que las líneas –T indican efectos inhibitorios.
Así, una vez activa AMPK, la fosforilación mediada por ésta cinasa cambia a la célula de consumir ATP en forma activa (biosíntesis de ácidos grasos y colesterol) a la producción activa de ATP (oxidación de ácidos grasos y glucosa). Estos eventos son iniciados rápidamente y se los refiere como procesos de regulación a corto plazo. La activación de AMPK también tiene efectos a largo plazo a nivel de expresión de genes y síntesis de proteínas [3]. Cabe resaltar que esta cinasa fue el centro de investigación del metabolismo muscular durante la década pasada [2][4]. Una reciente investigación, Febrero de 2014 [5], demostró que AMPK tiene un rol inesperado en el músculo esquelético en lo que respecta a la regulación de la fosforilación oxidativa mitocondrial que contribuye a suplir las altas demandas energéticas durante el ejercicio. Por lo tanto, se esperan encontrar en el futuro muchas más funciones alternas que sinérgicamente con otras moléculas y/o procesos permitan descifrar varios de los parámetros metabólicos desconocidos de ésta importante cinasa.
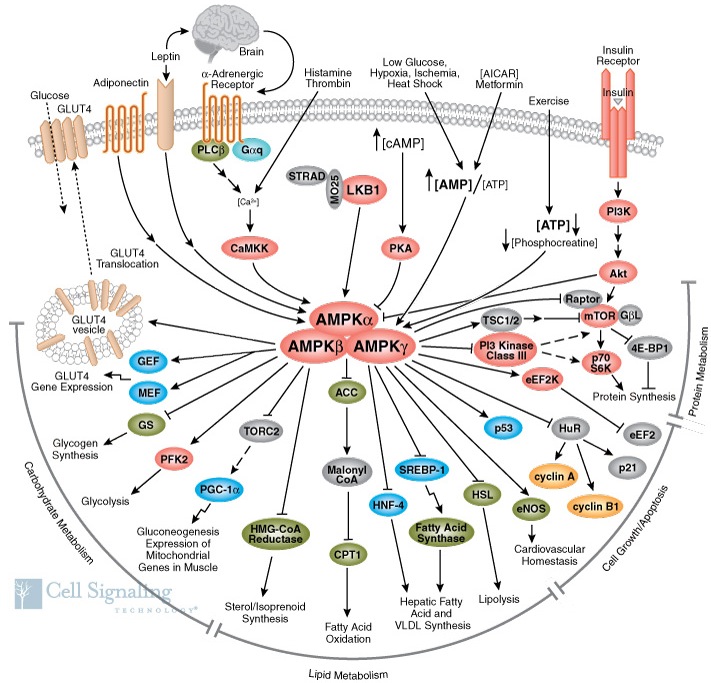
Figura 2. Principales blancos de AMPK. La cascada de señalización de AMPK involucra la regulación de múltiples targets enzimáticos que regulan procesos como el metabolismo proteico, el crecimiento celular, la apoptosis, el metabolismo lipídico, el metabolismo de carbohidratos, entre otros.
Referencias
[1] themedicalbiochemistrypage.org/spanish/ampk-sp.html
[2] Holmes B & Dohm GL. (2004). Regulation of GLUT-4 Gene Expression during Exercise. Med Sci Sports Exerc 36 (7); 1202–1206
[3] Bruce E. Kemp, Ken I. Mitchelhill, David Stapleton, Belinda J. Michell, Zhi-Ping Chen and Lee A. Witters. (1999). Dealing with energy demand: the AMP-activated protein kinase. TIBS 24
[4] Sebastian B. Jørgensen, Erik A. Richter and Jørgen F. P.Wojtaszewski. (2006). Role of AMPK in skeletal muscle metabolic regulation and adaptation in relation to exercise. J Physiol 574.1 pp 17–31
[5] Louise Lantier, Joachim Fentz, Rémi Mounier, Jocelyne Leclerc, Jonas T. Treebak, Christian Pehmøller, Nieves Sanz, Iori Sakakibara, Emmanuelle Saint-Amand, Stéphanie Rimbaud, Pascal Maire, André Marette∥, Renée Ventura-Clapier, Arnaud Ferry, Jørgen F. P. Wojtaszewski, Marc Foretz and Benoit Viollet. (2014). AMPK controls exercise endurance, mitochondrial oxidative capacity, and skeletal muscle integrity. FASEB J fj.14-250449