Aplicaciones Multi-Dimensionales del Análisis de Impedancia Bioeléctrica
Roberta L Pohlman3, Reggie OHara2, Munna Khan1, David B Goldstein3 y Sujoy K Guha4
1Indian Institute of Technology Guwahati, Department of Electronics & Communication Engineering, North Guwahati, Guwahati-781039, India.
2Health and Wellness Clinic, 74 Aerospace Medicine, Wright Patterson, Air Force Base, OH, 45422-5350.
3Wright State University, Department of Biological Sciences and Mathematics, Dayton, OH 45435-0001.
4Indian Institute of Technology Kharagpur, Kharagpur- 721302, India.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2005.
Publicado 1 de junio de 2005
Resumen
Palabras clave: aviación, pilotos de líneas aéreas, composición corporal, fluidos corporales, bia
INTRODUCCION
Numerosos investigadores han demostrado que el análisis de impedancia bioeléctrica (BIA) constituye una técnica útil, confiable, versátil, segura, simple y prometedoramente no invasiva para la detección de eventos fisiológicos (1, 2, 3). Antes de revisar las aplicaciones y la validez del BIA, parece adecuado discutir el origen de la técnica de BIA.
Desarrollo de la Técnica de BIA
Los estudios del fenómeno bioeléctrico en tejidos humanos y animales comenzaron a finales del siglo 19 (4, 5). Las mediciones de impedancia bioeléctrica (BI) estaban basadas en la ley de Ohm: la corriente en un circuito es directamente proporcional al voltaje e inversamente proporcional a la resistencia en un circuito DC o a la impedancia en un circuito de corriente alterna (AC). Para aplicar AC en el cuerpo o segmento corporal se utilizan dos electrodos. La señal de voltaje que proviene desde la superficie del cuerpo es medida en términos de impedancia utilizando los mismos dos electrodos o un electrodo adicional. Es posible expresar la información de la resistencia o la impedancia del cuerpo o segmento corporal en términos de eventos fisiológicos. Entre 1930 y 1950 se llevaron a cabo una considerable cantidad de trabajos para establecer los usos básicos de la impedancia para medir varios aspectos de la fisiología humana (6-9). Estos estudios exploraron las relaciones de la impedancia bioeléctrica y sus parámetros con las variables fisiológicas tales como la función tiroidea, el ritmo metabólico basal, los niveles hormonales y el flujo sanguíneo (10). La capacidad del BIA para reflejar con precisión los cambios en el volumen sanguíneo ha estado sujeta a críticas (11). Anderson (12) determino que la confusión en cuanto a la relación entre el BIA y el volumen sanguíneo se debía a la limitación del sistema de dos electrodos empleado en muchos instrumentos de BIA. La introducción de cuatro electrodos (dos como corriente y dos como voltaje) eliminó los efectos de la impedancia de la piel y redujo la sensibilidad de los cambios cercanos a los electrodos. Los avances tecnológicos en los instrumentos de BIA permiten ahora que el BIA mida la impedancia con un alto grado de precisión (13).
Importancia de la Técnica de BIA
Las técnicas clásicas basadas en el desplazamiento de aire o de fluidos son complejas, lo cual limita su utilización fuerza del laboratorio. Por otra parte, la técnica del BIA es significativamente más conveniente para la utilización en análisis clínicos más rutinarios. El BIA que utiliza pletismografía de oclusión venosa ha mostrado tener gran aceptación como una forma rutinaria para el monitoreo de la trombosis de las venas profundas principales (14, 15). Ejlersen (16) utilizó el BIA para evaluar el mínimo flujo sanguíneo de un bypass veno-venoso para compensar la compresión de la vena cava durante un transplante de hígado. Un bypass veno-venoso alivia la congestión en el corazón y mejora el gasto cardíaco. El monitoreo del tórax con BIA permite la determinación continua del volumen latido, de los índices de contractilidad tales como la velocidad y aceleración del flujo sanguíneo, la resistencia sistémica vascular y su índice, el gasto cardiaco (CO) y el índice cardíaco (CI), y el contenido de fluidos en el tórax. Además, Belott (17) y Gilbert (18) han mostrado que el BIA provee otros índices hemodinámicos tales como el tiempo sistólico interno, el índice de trabajo del corazón izquierdo, y el índice diastólico en la Clínica Pacemaker y su realización lleva solo minutos.
En los últimos 20 años, el BIA ha sido ampliamente utilizado en los análisis clínicos para la valoración de la composición corporal. Numerosos investigadores han demostrado la utilidad del BIA para la valoración de la composición corporal, los cambios en la composición corporal y la distribución de fluidos en un amplio rango de condiciones fisiológicas y clínicas (19-21).
Las estimaciones de la impedancia eléctrica de un segmento de la pierna (LEI) son extremadamente útiles para los aviadores cuando se determinan diagnósticos médicos y terapias en la medicina aeroespacial. Khan (22) investigó una aplicación particular del BIA en un estudio sobre la acumulación sanguínea en un segmento de la pierna simulado en un piloto de aviones sometido al estrés de las fuerzas G. En otro estudio, el BIA también fue utilizado para simular y medir la acumulación de sangre en el brazo de un piloto de aviones sometido al estrés de las fuerzas G. Los resultados de los estudios pueden derivar en diseños prácticos y en el desarrollo de contramedidas para reducir o eliminar el dolor en los brazos en los pilotos de aviones.
Instrumentos del BIA
Existen numerosas compañías que fabrican instrumentos del BIA a escala comercial. Un panel de expertos en BIA enfatizó la necesidad de estandarizar los equipamientos y recomendaron que todos los instrumentos del BIA deberían reportar la resistencia, la reactancia y las ecuaciones de predicción, así como también los valores calculados de composición corporal (23). Estos expertos también señalaron que deberían estar disponibles los datos crudos, tales como la fuente de corriente, la frecuencia, el rango y la precisión. Los avances tecnológicos y los cambios en los modelos teóricos han resultado en numerosas variaciones de los instrumentos tradicionales del BIA. Además, se han diseñado analizadores de BIA sencillos para el uso doméstico y para el monitoreo de la salud y la aptitud física (24).
Clasificación de los Instrumentos de BIA
Los instrumentos de BIA han sido clasificados en diferentes modelos:
Tradicional o Modelo de BIA en Serie
Los instrumentos tradicionales o modelo BIA en serie asumen que hay solo una vía de conducción y que el cuerpo consiste en una serie de resistencias. Una corriente eléctrica, inyectada a una única frecuencia, se utiliza para medir la impedancia corporal total (i.e., desde la muñeca hasta el tobillo) con el propósito de estimar el agua corporal total y la masa libre de grasa. Su impedancia (Z) es igual a (R2 + Xc2)1/2. La bioimpedancia corporal total (Z, R y Xc) son utilizadas en las ecuaciones de predicción de BIA para estimar el agua corporal total (TBW) y la masa libre de grasa (FFM). Las ecuaciones son específicas para una población o generales. Numerosos investigadores han desarrollado ecuaciones de predicción que son específicas para la edad, la etnia, la adiposidad y el nivel de actividad física (25-30).
Modelo de BIA en Paralelo
En este modelo de impedancia, las resistencias y capacitores están orientados en el cuerpo humano, tanto en serie como en paralelo (31). Se ha sugerido que esta disposición es más consistente con la fisiología humana. Su impedancia es simplemente la recíproca del modelo en serie (Z-2 = R-2 + Xc-2). Se piensa que el modelo en paralelo es más útil para estimar el contenido de agua intracelular o la masa de la célula. Este modelo es también preferido cuando se valoran pacientes con desnutrición o que tienen un desequilibrio de fluidos (32, 33). Los valores de Rp y Xcp del modelo en paralelo pueden ser transformados a partir del modelo en serie:
Rp=Rs + [(Xc5)2/ (Rs)]
Xcp=Xcs + [(Rs)2/ (Xcs)]
Donde los subíndices p y s indican paralelo y en serie respectivamente.
Modelo de BIA para Segmentos
El antebrazo explica solamente un poco más del 1% del peso corporal, pero contribuye al 25% de la impedancia total del cuerpo (34). De manera similar la región del tronco representa la mayor parte de la masa libre de grasa, pero contribuye relativamente poco a la resistencia total del cuerpo. El índice teórico de resistencia miembros superiores–tronco–miembros inferiores es 13.8:1:11.8. Por lo tanto, el BIA corporal total es relativamente insensible a los cambios en la región del tronco. Se ha determinado que el modelo BIA de segmentos es más útil para pacientes con alteraciones en la distribución de fluidos. Organ (35) describió la teoría del BIA para segmentos y la ubicación de los electrodos. Cornish (36) posteriormente simplificó y estandarizó el procedimiento para la utilización del modelo BIA de segmentos. Las investigaciones realizadas hasta ahora sugieren que el BIA por segmentos es el método preferido para la evaluación de los cambios regionales de fluidos y para el monitoreo del agua extracelular en pacientes con distribución anormal de fluidos, tales como aquellos que deben realizarse hemodiálisis (37-39).
Modelo BIA de Multi-Frecuencia
Un instrumento BIA operado a una única frecuencia de 50KHz refleja principalmente los compartimientos de agua extracelulares, debido a que una corriente muy pequeña pasa a través de la célula. Debido a que una corriente de baja frecuencia (~1KHz) no penetra las células y que la penetración completa se produce solamente a muy altas frecuencias (~1 MHz); se han desarrollado dispositivos de BIA de multi-frecuencia o dispositivos de espectroscopia de impedancia bioeléctrica. Estos dispositivos son capaces de registrar un amplio rango de frecuencias.
El modelo Cole es un modelo en paralelo que utiliza valores de resistencia a frecuencias iguales a cero y a infinito. El modelo fue diseñado para analizar datos multi-frecuencia para la valoración del agua corporal total (TBW), aguaintracelular (ICW) y agua extracelular (ECW) en pacientes con distribuciones anormales de fluidos (40, 41). También se ha reportado que este es el mejor modelo para estimar los cambios en el ECW, ICEW y TBW (42).
Modelo para el Tren Inferior
El desarrollo de un analizador para el tren inferior que pudiera ser de uso domestico comenzó en 1992. La corporación Tanita, Estados Unidos, comercializa aproximadamente unos 20 modelos diferentes de analizadores para el tren inferior que varían en la capacidad de peso, en los programas, en la memoria y en la producción de datos. Su almohadilla para los pies posee dos electrodos; una para el pie y otra para el talón. El sujeto se para descalzo sobre la almohadilla, de forma similar a sobre una balanza de baño, y entonces el dispositivo mide la impedancia del tren inferior con electrodos de contacto a presión. La corriente es aplicada por el electrodo anterior (punta del pie) y la impedancia es medida por el electrodo posterior (talón). Las investigaciones han mostrado buena concordancia con la impedancia medida por los electrodos de contacto por presión y por los electrodos en gel comerciales (43).
Tyrrel (44) derivó una ecuación para la estimación de la masa libre de grasa en niños utilizando mediciones de impedancia pie a pie obtenidas con el analizador Tanita. Utter (45) ha mostrado que la precisión del modelo de BIA para el tren inferior es similar a la de la hidrodensitometría para valorar los cambios en el % de masa grasa a través del tiempo.
El Modelo BIA para el Tren Superior
El desarrollo de un analizador para el tren superior que pueda ser utilizado domésticamente comenzó a finales de 1990. Omron Health Care, Estados Unidos, desarrollo un analizador de BIA con un agarre para ambas manos de bajo costo (modelo HBF-306BL). Las agarraderas del dispositivo contienen electrodos en placa, los cuales se sostienen con ambas manos con los brazos estirados paralelos al piso en posición erecta. Recientemente, este método ha sido modificado para estimar la composición corporal de adultos y niños activos y no activos. Las variables de predicción en la ecuación proporcionada por el fabricante son la impedancia del tren superior, la edad, el sexo, la talla, el peso y el nivel de actividad física. El dispositivo ha sido evaluado en diversas muestras étnicas de poblaciones europeas y asiáticas.
La composición del cuerpo humano está basada principalmente en el análisis químico de los órganos y cuantificada como grasa, minerales (hueso y tejido blando), proteínas y agua. Dicha cuantificación es llamada modelo de cuatro compartimentos (4-C). El error estándar de estimación (EEE) del modelo de BIA para el tren superior es de 4.5% en la grasa corporal (% BF), en comparación con el modelo de 4-C. El EEE en el % BF se relaciona también con la edad, el nivel de grasa corporal y el índice, envergadura de los brazos/talla de los sujetos (46). Una ecuación patentada ha sido validada transversalmente en una muestra grande, diversa y heterogénea en tres laboratorios que utilizaron hidrodensitometría para obtener medidas de referencia de mediciones de % BF y masa libre de grasa con un modelo de dos compartimientos (47). La diferencia promedio entre los valores de % BF de referencia y estimados fueron ligeramente menores con el analizador Omron (2.2% BF), en comparación con los analizadores para todo el cuerpo (3.3% BF) y los analizadores para el tren inferior (3.2% BF) (48).
Modelo de BIA Diseñado para el Laboratorio
Se están comenzando a utilizar sistemas de electrodos bipolares y tetrapolares de forma práctica en los instrumentos de BIA. De estos, el sistema tetrapolar tiene una ventaja definida, ya que provee una distribución uniforme de la densidad de corriente en los segmentos corporales y mide la impedancia con menor artefacto de interfase del electrodo y menores errores de impedancia. Para valorar la acumulación de sangre simulada en un piloto de aviones bajo estrés producido por fuerzas G, se diseño y desarrollo un nuevo instrumento de BIA. En el sistema tetrapolar, se utilizan un par de electrodos de superficie (I1, I2) como electrodos de corriente para inducir una corriente constante de baja intensidad y de alta frecuencia en un segmento de la pierna. Un par separado de electrodos (E1, E2) miden los cambios que acompañan a los eventos fisiológicos. El voltaje medido entre E1-E2 es directamente proporcional a la impedancia eléctrica del segmento de la pierna (LEI) del sujeto humano. Se ha defendido la utilización de electrodos de superficie circulares y planos, así como también de electrodos de banda. Estos tipos de electrodos no afectan significativamente la producción de EIP. Por lo tanto, por conveniencia se utilizaron cuatro electrodos de banda. Los electrodos de corriente (I1, I2) fueron colocados alrededor del extremo de la pierna y por debajo de la articulación de la rodilla para dirigir una corriente constante de 3mA a 20KHz al segmento de la pierna. Los electrodos potenciales E1–E2 fueron colocados hacia el lado interno manteniendo una distancia de 2cm uno del otro. Se mantuvo un espacio constante entre cada electrodo de corriente y de voltaje para obtener resultados reproducibles. Los cuatro electrodos fueron conectados a un Puente Doble Kelvin para cuantificar el valor de la impedancia. El puente fue equilibrado por medio de la variación alternativa de los componentes de resistencia y capacitancia. Luego de esto, fue observado el LEI de la pierna en una pantalla de reproducción digital del instrumento de BIA.
Selección de la Corriente y la Frecuencia para el BIA
Los niveles de corriente aplicados que oscilaron entre 20μA y 10mA rms en un rango de frecuencia de 20-100KHz han sido utilizados anteriormente en la literatura de la técnica de BIA (49). Para evitar los efectos de la presión de contacto en la interfase electrodo/piel se debería utilizar una fuente adecuada de corriente constante y un circuito de alta impedancia de entrada en conjunto con la configuración tetrapolar de electrodos. Anderson (12) ha mostrado la utilidad del BIA con una corriente operante de 1mA a 22KHz. La colocación de los cuatro electrodos fue optimizada por medio de neumografía de impedancia utilizando la corriente de excitación incrementada de 2mA a 78.8KHz (50) Incluso en la EIP se ha utilizado una corriente de excitación de 4mA a 100KHz para evaluar el flujo de un bypass veno-venoso (16). Otros investigadores han utilizado diferentes niveles de corriente de excitación a diferentes frecuencias manteniendo 5mA como la máxima intensidad de corriente que no produce daños.
Usos Recomendados del BIA
Los diferentes métodos de análisis de impedancia bioeléctrica (BIA) están siendo recomendados para una variedad de aplicaciones clínicas. La Tabla 1 resume los diferentes métodos de BIA y sus usos recomendados. La técnica de BIA ha demostrado ser valiosa, debido a que no es invasiva y tiene aplicaciones multi-dimencionales en diversos campos de la investigación y los análisis clínicos. Así, el BIA ha sido utilizado en la medicina aeroespacial para incrementar la tolerancia a las fuerza G en pilotos de aviones, para estimar la composición corporal, para determinar el agua corporal total, para valorar la compartimentalización de los fluidos corporales, para proporcionar monitoreo cardíaco, medir el flujo sanguíneo, y monitorear la trombosis de las venas profundas.
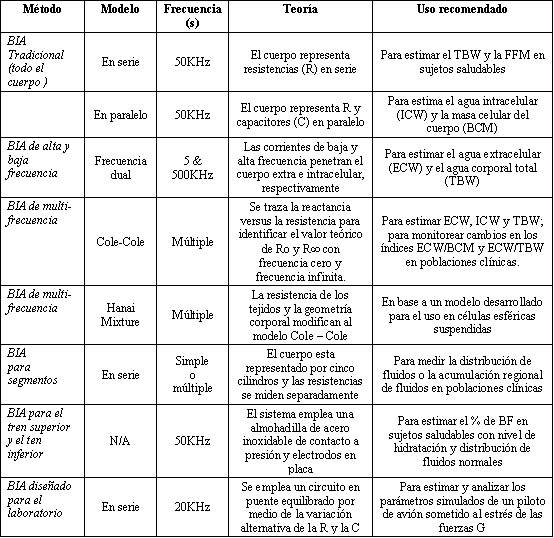
Tabla 1. Métodos del BIA y sus usos recomendados.
Usos del BIA en la Medicina Aeroespacial
Khan (2) ha descrito la utilización del BIA para estimar los parámetros de impedancia eléctrica en un segmento de la pierna simulado de un piloto de aviones sometido al estrés de las fuerzas. Los segmentos de las piernas de pilotos de aviones fueron simulados colocando un esfingomanómetro alrededor de los muslos de los voluntarios humanos. Cuando el esfingomanómetro era inflado a presiones mayores de la presión venosa, pero menores que la presión arterial, se registró la acumulación de sangre en la pierna por debajo del esfingomanómetro. La acumulación de sangre inducida en pilotos de aviones fue estudiada utilizando un modelo por computadora y un modelo humano. En el modelo por computadora, el segmento de la pierna del piloto fue modelado como un cilindro que contenía una capa de grasa, huesos (la tibia y el peroné), músculos y volúmenes sanguíneos presentes en las arterias, arteriolas, capilares, vénulas y venas. Los elementos finitos de análisis (FEA) fueron aplicados a modelos en 3D del segmento de la pierna para computar el campo eléctrico, los patrones de densidad de corriente y sus vectores de graficación. Un voltaje específico fue aplicado entre los puntos terminales del modelo utilizando condiciones límites adecuadas.
Khan (2) además halló una contribución relativa de admitancia para los constituyentes de la pierna tales como grasa, músculo, huesos y volumen sanguíneo de 2.96, 75.58, 0.33 y 11.3% respectivamente. Los análisis de los resultados también fueron llevados a cabo para los siguientes casos.
Caso I: las resistividades de los constituyentes de la pierna; grasa, músculo, hueso (tibia y peroné) y volumen de sangre fueron tomados como 1400, 200, 10000 y 150Ω-cm, respectivamente. Se estimó que el LEI sería de 46.7Ω, valor que se corresponde con el valor experimental de 46.0Ω y con un valor estimado de 1.58% mayor. Se halló un índice de densidad de corriente entre los puntos terminales del segmento de la pierna de 86.49.
Caso II: las resistividades de los constituyentes particulares de la pierna, tales como el músculo se redujeron desde 175 a 200Ω-cm manteniendo el volumen sanguíneo y las resistividades de las otras regiones como en el Caso I. El propósito del Caso II fue evaluar el efecto del cambio en la conductividad del músculo sobre la distribución de la densidad de corriente. La impedancia eléctrica de la grasa, hueso, músculo y volumen sanguíneo se calcularon y compararon con la impedancia eléctrica de los constituyentes de la pierna como en el Caso I. Estos parámetros fueron también computados para observar el cambio en la resistividad de la sangre desde 150 a 125Ω-cm. Los valores de la impedancia eléctrica de los constituyentes de la pierna estimados para el cambio en la resistividad de la sangre se muestran en la Figura 1.
Caso III: la acumulación de sangre en el modelo FE fue simulada para un incremento del 7% en el volumen, monitoreando la longitud del vaso sanguíneo y la misma longitud del segmento de la pierna. Se estimó que el LEI total sería de 44.2Ω. La impedancia eléctrica de la grasa, hueso, músculo y volumen sanguíneo fueron calculados y comparados con la impedancia estimada de los constituyentes de la pierna como en el caso I.
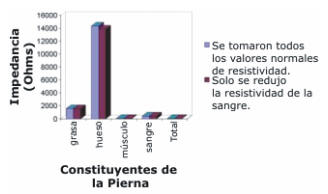
Figura 1. Impedancia eléctrica de los diferentes constituyentes de la
pierna con una resistividad normal y una resistividad reducida de la sangre
desde 150 a 125ohm-cm.
Hatsell (51) derivó un análogo al teorema de Cohn para un conductor utilizando el teorema Quasi-Power y presentó comentarios sobre la reoencefalografía. La Ecuación 1 muestra un análogo del teorema de Cohn aplicado al cambio de la resistividad que es más conveniente para la investigación. Los constituyentes de la resistividad de la pierna tales como la sangre y los músculos, fueron reducidos desde 150 a 125Ω-cm y de 200 hasta 175Ω-cm, respectivamente. Los parámetros estimados de la impedancia satisfacen el teorema de Cohn.
[∂RI/∂ℓI]≤∆V[Jm]2/(iI)2
Donde, []=módulo; ∂RI=pequeño cambio en la resistividad; ∂ℓI=pequeño cambio en la resistividad de los constituyentes de la pierna; Jm=máxima densidad de corriente dentro de la región; iI=ingreso de corriente a la región y ∆V=cambio en el volumen.
Khan (22) modificó un modelo de BIA diseñado para laboratorio para evaluar un segmento simulado del brazo de un piloto de avión. El instrumento de BIA modificado fue utilizado para realizar el análisis de la impedancia eléctrica de la acumulación simulada de sangre en el brazo que experimenta un piloto sometido a las fuerzas G. La acumulación de sangre fue simulada en el modelo de computadora utilizando el análisis de elementos finitos (FEA). Un programa comercial para realizar el FEA llamado NISA/EMAG fue utilizado para estimar la acumulación simulada de sangre. Luego, en el laboratorio se simuló la acumulación de sangre en un segmento del brazo mediante la colocación de un esfingomanómetro alrededor de la parte superior del brazo en voluntarios humanos. Cuando el esfingomanómetro fue inflado a presiones mayores que la presión venosa, pero menores que la presión arterial, se observó la acumulación de sangre en el brazo en el segmento que se encontraba por debajo del esfingomanómetro. Esta acumulación simulada de sangre se midió utilizando pletismografía de impedancia eléctrica y pletismografía con relleno de aceite. Los sujetos también experimentaron dolor en el brazo el cual puede ser analizado en el laboratorio en estudios futuros.
Utilizando el método de elementos finitos se estimo que la impedancia eléctrica total en el segmento del brazo sería de 83.1Ω. Este valor coincide con el valor experimental de 81.5Ω de las mismas dimensiones, siendo el valor estimado 1.94% mayor. El valor estimado de impedancia eléctrica sobre la acumulación simulada de sangre en el modelo de computadora disminuyó a 79.93Ω. El cambio de impedancia fue utilizado para valorar la acumulación de sangre y se hallo que era de 14.90ml. Se trazaron diferentes curvas para las cinco series de datos experimentales de la acumulación simulada de sangre en un segmento del brazo, obtenidos por medio de pletismografía de impedancia eléctrica (EIP) y pletismografía con relleno de aceite (OFP). Se observó una correlación lineal entre los valores de sangre acumulada medidos por EIP y OFP. Se halló un factor de correlación de 0.99 entre las técnicas de medición de acumulación de sangre por EIP y OFP.
Utilización de la BIA para Monitorear la Función Cardiaca
Un método ideal para valorar la información del sistema vascular debería ser no invasivo, simple, no traumático, barato, confiable y también aplicable a la vigilancia a largo plazo fuera del laboratorio de monitoreo cardíaco. La utilización del BIA para monitorear la función cardíaca es llamada técnica convencional de cardiografía por impedancia (ICG). La ICG proporciona un trazo único de impedancia, a partir del cual se pueden estimar los parámetros.
relacionados a la función de bombeo del corazón, tal como el gasto cardíaco (CO). La mayoría de las propiedades del ICG dan resultados superiores en comparación con otros métodos. Kubicek (52) introdujo el primer método parcial para la determinación de la función cardíaca en la evaluación clínica. Patterson (53) produjo una ecuación original para calcular el CO en base a física elemental. A lo largo de los años se han presentado distintas variaciones en la configuración de los electrodos con el objetivo de mejorar el método (54-56). Los modelos de computación diseñados para calcular el flujo de corriente en el tórax, se han utilizado más recientemente para examinar las configuraciones de medición del ICG, produciendo datos que respaldan la concepción anticipada de la complejidad de la señal de origen (57-59).
Newman (60) condujo una revisión acerca de la valoración no invasiva del volumen latido y del gasto cardíaco por medio de la cardiografía de impedancia (ICG). También describió la precisión del ICG en términos de valores absolutos del volumen latido (SV) y del CO. Kubicek (61) desarrollo una ecuación para el volumen latido que se ha vuelto ampliamente utilizada y aceptada. La ecuación de Kubicek esta dada por la siguiente expresión:
SV=ρ.[L2]/[Zo2].dZ/dt.t (2)
Donde SV=volumen latido (ml), Ω=resistividad eléctrica de la sangre (Ω-cm), L=distancia entre los electrodos internos, Zo=impedancia torácica promedio (Ω), dZ/dt=tasa máxima del cambio del componente, Z la bioimpedancia (Ω/s), t=tiempo de eyección ventricular.
Varios autores han ofrecido refinamientos a la ecuación original de Kubicek y al modelo modificado de Kubicek. Otra ecuación utilizada para determinar el SV es la ecuación modificada de Sramek generalmente conocida como la ecuación de Sramek-Bernstein. Su expresión es la siguiente:
SV=δ((0.17 H)3/4.2). dZ/dt. t /Zo (3)
Donde δ=factor de corrección de Bernstein o factor de corrección del peso= β (Wobservado / Wideal), W=peso del sujeto, β=índice de volumen sanguíneo relativo, los detalles pueden encontrarse en el artículo original de Bernstein [Bernstein (54)].
Una vez que se ha determinado el SV, el CO se puede calcular fácilmente de acuerdo a la siguiente expresión:
CO=SV*FC (4)
Donde FC=frecuencia cardiaca.
El CO puede ser determinado para cada latido cardíaco. Esta capacidad para determinar el SV y el CO latido a latido es una de las ventajas y recursos más importantes del ICG.
Gilbert (18) manejó el fallo cardíaco congestivo y el efecto de la prescripción de inhibidores ACE, β-bloqueantes y diuréticos sobre las funciones cardíacas tales como el gasto cardiaco (CO), la resistencia sistémica vascular (SVR) y el volumen latido (SV). La técnica de bioimpedancia eléctrica torácica (TEB) no es más que el BIA aplicado al tórax. Un incremento en el contenido torácico de fluidos detectado por TEB puede garantizar un incremento abrupto en la dosis de diuréticos para tratar la retención de fluidos asociada con la iniciación del tratamiento con β-bloqueantes (62). En la Tabla 2 se presentan solamente las descripciones de solo tres sujetos de ocho debido a un límite de palabras en los artículos de revisión.
Una cuestión importante que rodea al ICG tiene que ver con cuan buena esta técnica en comparación con la técnica convencional de termodilución. Existen numerosos estudios que han intentado resolver este asunto (63). El método convencional que determina el volumen latido (SV) y el gasto cardiaco (CO) depende de maniobras invasivas y tiene un riesgo significativo de morbidez experimental. La termodilución se ha vuelto ampliamente aceptada como un método preciso para determinar el CO, particularmente en establecimientos clínicos de cuidado coronario. Una de las desventajas de este y otros métodos invasivos es que es capaz de proveer solo estimaciones intermitentes del CO. Por otro lado, el ICG provee una valoración no invasiva del CO latido a latido. La Figura 2 muestra los resultados de varios estudios que comparan el ICG con la técnica invasiva de termodilución en la valoración del volumen latido, el gasto cardiaco y el índice cardíaco (37, 64-72).
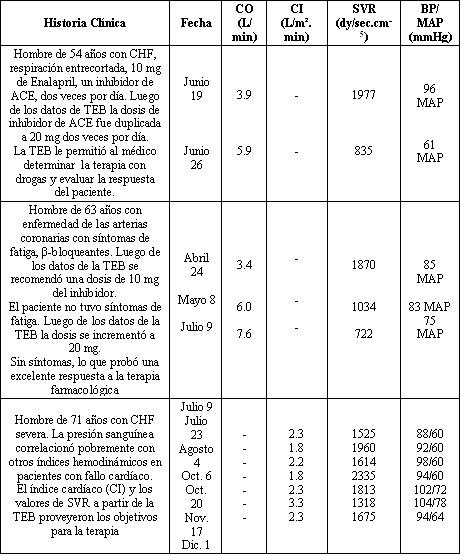
Tabla 2. Respuesta de la terapia farmacológica utilizando los datos de la
TEB en pacientes durante el año 1998.
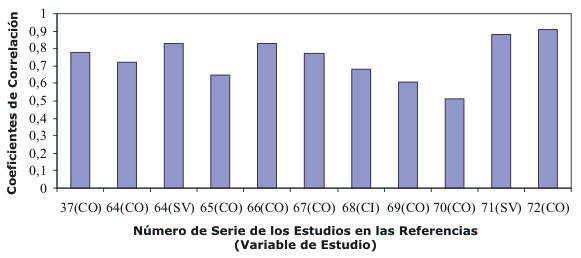
Figura 2. Comparación del ICG con la técnica invasiva de termodilución en
la valoración del SV, CO y del índice cardíaco (CI).
El amplio rango (0.41 a 0.91) de coeficientes de correlación refleja la amplia diversidad de metodologías empleadas con diferentes grupos de sujetos y la diversidad de técnicas de BIA utilizadas. Se ha hallado que el ICG es una forma confiable de monitorear el CO. De manera similar, otros autores han concluido que el ICG es un método satisfactorio con una probabilidad de error similar a otras técnicas establecidas. Sin embargo, unos pocos autores han concluido que la técnica de BIA es inadecuada debido a la baja confiabilidad.
Determinación de la Composición Corporal
La primera vez que se utilizó el BIA para realizar análisis de composición corporal fue entre 1960 y 1970. Thomassett (73) desarrollo un método para estimar el agua corporal total (TBW) y el agua extracelular utilizando la técnica de electrodos de doble aguja. Esta técnica no se volvió popular debido al disconfort que padecía el paciente. Hoffer (74) y Jenin (75) desarrollaron un método para el estudio de la composición corporal que utilizaba cuatro electrodos de superficie. Estos investigadores reportaron una fuerte correlación entre las mediciones de la impedancia total del cuerpo y el TBW, sugiriendo que este método de BIA podía ser una valiosa herramienta para analizar la composición corporal en establecimientos clínicos. Nyboer (76) extendió la técnica de electrodos tetrapolares para estimar la masa libre de grasa (FFM) y el porcentaje de grasa corporal. La utilización actual del BIA para estimar la composición corporal se basa en el mayor contenido de electrolitos y la mayor conductividad de la FFM en comparación con el tejido adiposo o el hueso (72, 77) y en la relación geométrica entre la impedancia y el volumen del conductor (78). Varios investigadores han desarrollado ecuaciones de predicción a partir del BIA para el TBW, FFM y el % BF. Houtkooper (79) resumió 55 ecuaciones de predicción a partir del BIA (18 para TBW, 29 para la FFM, 8 para el % BF o masa grasa). Estos autores reportaron que el error estándar de estimación (EEE) para las ecuaciones de predicción estaba en un rango de 0.9 a 1.8kg para el TBW; de 2.0 a 3.0kg para la FFM y 3.0 a 4.0% para el % de BF, en adultos.
Generalmente se asume que una corriente eléctrica a 50 KHz es conducida por los electrolitos contenidos en el agua corporal. La corriente de excitación (200-800μA) es aplicada a los electrodos de corrientes en la mano y pie, y la caída de voltaje debido a la impedancia es detectada por los electrodos de voltaje en la muñeca y tobillo. Las ecuaciones de predicción a partir del BIA comúnmente utilizadas para poblaciones específicas y generales están disponibles para estimar la composición corporal y pueden ser utilizadas para obtener R y Xc directamente del analizador de BIA. Baumgartner (80) y Spinale (81) también utilizaron métodos para determinar la composición corporal en los niveles clínicos y de investigación.
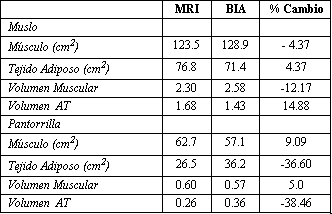
Tabla 3. Porcentaje de cambio para el área, el volumen muscular y AT
medido por MRI y BIA en secciones del muslo y la pantorrilla.
La composición de las secciones de la pierna fue estimada con antropometría y por análisis de impedancia bioeléctrica utilizando resonancia magnética (MRI) como referencia (82). Las mediciones de impedancia obtenidas por medio de una modelo de BIA multi-frecuencia (Make: SFB2, SEAC, Brisbane, Australia) para estimar la masa muscular y la masa del tejido adiposo (AT) en secciones del muslo y la pantorrilla explicaron las resistividades específicas de todos los tejidos constituyentes a una frecuencia de 50KHz. El modelo BIA multi-frecuencia lee hasta un lugar decimal en el rango de 10 a 2000Ω, la exactitud esta dentro del 1%, como lo afirma el fabricante, y ha sido verificado experimentalmente (83). La media±DE para la impedancia en una sección de 20cm del muslo fue 22.8±5.3Ω, y la obtenida para una sección de 10cm de la pantorrilla fue de 25.2±7.0Ω. La Tabla 3 muestra que con el método fundamental de BIA hubo una pequeña sobreestimación media para la masa muscular del muslo y una subestimación del AT, para el área de sección transversal y el volumen, en comparación con las medidas de referencia de MRI. Mientras que los valores medios para la masa muscular de la pantorrilla se subestimaron ligeramente y los valores de AT se sobreestimaron.
CONCLUSION
Los resultados de los estudios sobre el BIA muestran que la simplicidad y la no invasividad de la técnica son dos de sus ventajas más significativas. Las deficiencias del BIA han sido evaluadas utilizando modelos por computadora y ecuaciones de predicción de BIA de manera apropiada. En la medicina aeroespacial, se ha investigado la técnica de BIA con modelos por computadora utilizando el programa de elementos finitos. El estudio conducido sobre segmentos simulados de las piernas de pilotos de aviones sometidos a fuerza G ha reportado lo siguiente:
- La contribución relativa de los diferentes constituyentes de las piernas a la impedancia eléctrica total del segmento de la pierna (LEI).
- El efecto del cambio en la resistividad de un constituyente en particular de la pierna al LEI total manteniendo los otros parámetros constantes.
- El efecto de la acumulación de sangre sobre la resistividad de los constituyentes de la pierna.
El modelo de BIA por computadora también calculó la admitancia de constituyentes de la pierna tales como grasa, hueso, músculos y volumen de sangre. El valor estimado de impedancia eléctrica del segmento de la pierna (LEI) se verificó también experimentalmente por medio de la técnica de BIA con el sistema de electrodos tetrapolar.
El BIA ofrece una variedad de aplicaciones para la medición no invasiva de la composición corporal incluyendo el % de BF, la FFM, el TBW, y la compartimentalización de fluidos corporales. La técnica de BIA ha sido validada por varios investigadores y esta siendo ampliamente utilizada para la valoración del TBW y la FFM en niños y adultos saludables. Para una mayor efectividad de la técnica, el operador debería familiarizarse con los principios y aplicaciones del BIA. Además, se deben medir consistentemente y con precisión, la talla y el peso del sujeto, la posición corporal con procedimientos estandarizados, la historia previa, la ingesta dietaria y la temperatura de la piel. En conjunto, errores mínimos en estas mediciones pueden resultar en errores significativos en los resultados de la BIA.
El desarrollo de nuevos modelos comerciales de BIA ha extendido en gran proporción sus aplicaciones clínicas. Por lo tanto, los métodos de BIA tienen gran relevancia en cada dirección de los marcos de investigación y clínicos con aplicaciones multi-dimencionales.
Agradecimientos
Los autores agradecen a todo el Consejo para Educación Técnica de la India, al Ministerio de Recursos Humanos y Desarrollo, al Gobierno de la India, el cual otorgó el Premio a la Carrera para Maestros Jóvenes a Munna Khan, Ph.D, a través de Jamia Millia Islamia (Universidad Central), Nueva Deli. El Premio de Carrera permitió al Dr. Khan visitar la Wright State University en Dyton, OH, Estados unidos como Profesor Asistente visitante en el Departamento de Ciencias Biológicas, Facultad de Ciencia y Matemática. Además, los autores desean agradecer a todo el personal técnico y operativo del Departamento de Ciencias Biológicas por su ayuda y cooperación durante la preparación de este manuscrito.
Dirección para el Envió de Correspondencia
Munna Khan, Ph.D., Indian Institute of Technology Guwahati, Department of Electronics and Communication Engineering, North-Guwahati, Guwahati-781039, Assam, India. Teléfono: +91-361-2582514; Fax: +91-361-2690762, 2583210; correo electrónico: munna@iitg.ernet.in o khanmunna@yahoo.com
Referencias
1. Geddes LA, Baker LE (1968). Principles of applied biomedical instrumentation. New York: John Wiley Sons, Inc;150-155
2. Khan M, Guha SK (2002). Prediction of electrical impedance parameters for the simulated leg segment of an aircraft pilot under G-stress. Aviat Space Environ Med;73(6):558-564
3. Kyle UG, Pichard C, Rochat T, Slosman DO, Fitting J-W, Thiebaud D (1998). New bioelectrical impedance formula for patients with respiratory insufficiency: comparison to dual-energy X-ray absorptiometry. Eur Respir J;12:960-966
4. Nunez C, Gallagher D, Visser M, Pi-Sunyer FX, Wang Z, Heymsfield SB (1997). Bioimpedance analysis: Evaluation of leg to leg system on pressure contact foot pad electrodes. Med & Sci Sports & Exer; 29:524-531
5. Nyboer J (1970). Electrical impedance plethysmography. Spring Field: Charles C Thomas;258-272
6. Barnett A (1937). The basic factors in proposed electrical methods for measuring thyroid function. I. The effect of body size and shape. West J Surg Obstet Gyn; 45:322-326
7. Barnett A, Bagno S (1936). The physiological mechanisms involved in the clinical measure of phase angle. Am J Physiol; 114:366-382
8. Burger HC, Van Dongen R (1960). Specific electric resistance of body tissues. Physics Med Biol; 5:431-447
9. Lofgren B (1951). The electrical impedance of a complex tissue and its relation to change in volume and fluid distribution. A study of rat kidneys. Acta Physiol Scand; 23(81):5-50
10. Rising R, Swinburn B, Larson K, Ravussin E (1991). Body composition in Pima Indians: Validation of bioelectrical resistance. Am J Clin Nutr; 53:594-598
11. Hill RV, Jansen JC, Fling JL (1967). Electrical impedance plethysmography: A critical analysis. J Appl Physiol; 22:161-168
12. Anderson FA, Penney BC, Patwardhan NA, Wheeler HB (1980). Impedance plethysmography: the origin of electrical impedance changes measured in the human calf. Med Biol Eng Comput; 18:234-240
13. Ackmann JJ, Seitz MA (1984). Methods of complex impedance measurements in biologic tissue. Crit Rev Biomed Eng; 11:281-311
14. Flanigan DP, Goodreau JJ, Burnham SJ, Bergan JJ, Yao JST (1978). Vascular laboratory diagnosis of clinically suspected acute deep vein thrombosis. Lancet; 2:231
15. Wheeler HB, Anderson Jr. FA, Matesanz JM, Larsen JE (1997). Impedance phlebography: a diagnostic procedure for venous thrombosis by occlusive impedance plethysmography. In: Non-invasive diagnostic techniques in vascular disease. Bernstein EF (Ed.), St. Louis, Missouri, CV Mosby
16. Ejlersen E, Sode P, Skak C, Rasmussen A, Espersen K, Kirkegaard P, Secher NH (1997). Lower body impedance for the evaluation of venovenous bypass flow. Liver Transpla Surg; 3(2):153-159
17. Belott P (1999). Bioimpedance in the pacemaker clinic. AACN Clin Issues; 10(3):414-418
18. Gilbert J, Lazio L (1999). Managing congestive heart failure with thoracic electrical bioimpedance. AACN Clin Issues; 10(3):400-405
19. Bracco D, Thiebaud D, Chiolero RL, Landry M, Burckhardt P, Schutz Y (1996). egmental body composition assessed by bioelectrical impedance analysis and DEXA in humans. J Appl Physiol; 81(6):2580-1287
20. Kushner R.F (1992). Bioelectrical impedance analysis: a review of principles and applications. J Am Coll. Nutr; 11;199-209
21. Lukaski HC (1990). Applications of bioelectrical impedance analysis: A critical review. Yasumura et al. Ed. Advance in in vivo body composition studies Plenum Press, New York
22. Khan M and Guha SK (2003). Electrical Impedance Analysis for Simulated Arm Blood Pooling of an Aircraft Pilot under G-Stress (Abstract). Aviat Space Environ Med; 74(4):406
23. Ellis KJ, Bell SJ, Chertow GM, Chumlea WC, Knox TA, Kotler DP, Lukaski HC, Schoeller DA (1999). Bioelectrical impedance methods in clinical research: A follow-up to the NIH technology assessment conference. Nutrition; 15:874-880
24. Heyward VH, Wagner DR (2004). Applied body composition assessment. Illinois: Human Kinetics Publications; 87-98
25. Deurenberg P, Van der Kooy K, Evers P, Hulshof T (1990). Assessment of body composition by bioelectrical impedance in a population age greater than 60 y. Am J Clin Nutr; 51:3-6
26. Gray DS, Bray GA, Gemayel N, Kaplan K (1989). Effect of obesity on bioelectrical impedance. Am J Clin Nutr; 50:255-260
27. Houtkooper LB, Lohman TG, Going SB, Hall MC (1989). Validity of bioelectric impedance for body composition assessment in children. J App Physiol; 66:814-821
28. Loman TG (1999). Advances in body composition assessment. Current Issues in Exercise Science Series, Monograph No.3. Champaign, IL: Human Kinetics
29. Segal KR, Van Loan M, Fitzgerald PI, Hodgdon JA, Van Itallie TB (1988). Lean body mass estimation by bioelectrical impedance analysis: A four site cross validation study. Am J Clin Nutr; 47:7-14
30. Stolarczyk LM, Heyward VH, Hicks VL, Baumgartner RN (1994). Predictive accuracy of bioelectrical impedance in estimating body composition of Native American women. Am J Clin Nutr; 59:964-970
31. Lukaski HC (1996). Biological indexes considered in the derivation of the bioelectrical impedance analysis. Am J Clin Nutr; 64:397S-404S
32. Kotler DP, Burastero S, Wang J, Pierson RN (2002). Prediction of body cell mass and total body water with bioelectrical impedance analysis: Effects of race, sex and disease. Am J Clin Nutr; 64:489S-497S
33. Talluri T, Lietdke RJ, Evangelisti A, Talluri J, Maggia G (1999). Fat free mass qualitative assessment with bioelectrical impedance analysis. Ann N Y Acad Scien; 873:94-98
34. Fuller NJ and Elia M (1989). Potential use of bioelectrical impedance of whole body and of body segments for the assessment of body composition: A comparison with densitometry and anthropometry. Euro J of Clin Nutr; 43:779-791
35. Organ LW, Bradham GB, Gore DT, Lozier SL (1994). Segmental bioelectrical impedance analysis: Theory and application of new technique. J App Physiol; 77:98-112
36. Cornish BH, Jacobs A, Thomas BJ, Ward LC (1999). Optimizing electrode sites foe segmental bioimpedance measurements. Physiol Measure; 20:241-250
37. Song JH, Lee SW, Kim GA and Kim MJ (1999). Measurement of fluid shift in CAPD patients using segmental bioelectrical impedance analysis. Perito Dialy Int; 19:386-390
38. Zhu F, Schneditz D, Kaufman AM, Levin NW (2000). Estimation of fluid changes during peritoneal dialysis by segmental bioimpedance analysis. Kid Int; 57:299-306
39. Zhu F, Schneditz D, Wang E, Martin K, Morris AT, Levin NW (1998). Validation of changes in extracellular volume measured during hemodialysis using a segmental bioimpedance technique. ASAIO Journal; 44:M541-M545
40. Cornish BH, Ward LC (1998). Data analysis in multiple frequency bioelectrical impedance analysis. Physiol Measure; 19:275-283
41. Schoeller DA (2000). Bioelectrical impedance analysis: What does it measure?. Ann N Y Acad Sci; 904:159-162
42. Gudivaka R, Schoeller DA, Kushner RF, Bolt MJG (1999). Single and multi-frequency models for bioelectrical impedance analysis of body water compartments. J App Physiol; 87:1087-1096
43. Tan YX, Nunez C, Sun Y, Zhang K, Wang Z, Heymsfield SB (1997). New electrode system for rapid whole-body and segmental bioimpedance assessment. Med & Sci in Sports & Exer; 29:1269-1273
44. Tyrrell VJ, Richards, Hofman P, Gillies GF, Robinson E, Cutfield WS (2001). Foot to foot bioelectrical impedance analysis: A valuable tool for the measurement of body composition in children. Int J of obesity and related metabolic disorders; 25:273-278
45. Utter AC, Nieman DC, Ward AN, Butterworth DE (1999). Use of the leg to leg bioelectrical impedance method is assessing body composition change in obese women. Am J Clin Nutr; 69:603-607
46. Deurenberg P, Deurenberg-Yap M (2002). Validation of skinfold thickness and hand held impedance measurements for estimation of body fat percentage among Singaporean Chinese, Malay and Indian subjects. Asia Pacific J of Clini Nutr; 11:1-7
47. Loy SF, Likes EA, Andrews PM, Vincent WJ, Holland GJ, Kawai H, Cen S, Swenberger, Van Lohman M, Tanaka K, Heyward V, Stolarczyk L, Lohman TG, Going SB (1998). Easy grip on body composition measurements. ACSMs Heal & Fit J; 2(5):16-19
48. Demura S, Yamaji S, Goshi F, Kobayashi H, Sato S, Nagasawa Y (2002). The validity and reliability of relative body fat estimates and the construction of new prediction equations for young Japanese adult males. J of Sports Sci; 20:153-164
49. Webster JG, Eds (1988). Encyclopedia of medical devices and instrumentation. New York: A Wiley-Interscience; 3:1622-1624
50. Khambete N, Metherall P, Brown B, et al (1999). Can we optimize electrode placement for impedance pneumography?. Ann NY Acad Sci; 20(873):534-542
51. Hatsell CP (1991). A quasi-power theorem for bulk conductors: Comments on rheoencephalography. IEEE Trans Biomed Eng; 38(7):665-669
52. Kubicek WG, Karnegis JN, Patterson RP, Witsoe DA and Mattson RH (1966). Development and evaluation of an impedance cardiac output system. Aerospace Medicine; 37:1208-1212
53. Patterson RP, Kubicek WG, Kinnen E, Witsoe DA and Noren G (1964). Development of an electrical impedance plethysmography system to monitor cardiac output. In: Proceedings of the 1st Annual Rocky Mountain Bioeng Symp:56-71
54. Bernstein DP (1986). A new stroke volume equation for thoracic electrical bioimpedance: theory and rationale. Critical Care Medicine; 14:904-909
55. Penney BC, Patwardhan NA and Wheeler HB (1985). Simplified electrode array for impedance cardiography. Med Biol Eng Comput; 23:1-7
56. Woltjer HH, van der Meer BJ, Bogaard HJ and de Vries PM (1995). Comparison between spot and band electrodes and between two equations for calculations of stroke volume by means of impedance cardiography. Med Biol Eng Comput; 33:330-334
57. Kim DW, Baker LE, Pearce JA and Kim WK (1988). Origins of the impedance change in impedance cardiography by a three-dimensional finite element model. IEEE Transactions on Biomedical Engineering; 35:993-1000
58. Wang L and Patterson R (1995). Multiple sources of the impedance cardiogram based on 3-D finite difference human thorax models. IEEE Transactions on Biomedical Engineering; 42:141-148
59. Wtorek J and Polinski A (1995). Examination of impedance cardiography properties--FEM model studies. Biomed Sci Instru; 31:77-82
60. Newman DG, Callister R (1999). he non-invasive assessment of stroke volume and cardiac output by impedance cardiography: a review. Avia Space Environ Med; 70:780-789
61. Kubicek WG (1989). On the source of peak first time derivative (dZ/dt) during impedance cardiography. Annals of Biomedical Engineering; 17:459-462
62. Sackner-Bernstein J (1998). Use of carvedilol in chronic heart failure: Challenges in therapeutic management. Prog Cardiovasc Dis; 48:53-58
63. Mohapatra S.N (1981). Non-invasive cardiovascular monitoring by electrical impedance technique. London: Pitman Medical
64. Jewkes C, Sear JW, Verhoeff F, et al (1991). Non-invasive measurement of cardiac output by thoracic electrical bioimpedance: a study of reproducibility and comparison with thermodilution. Br J Anaesth; 67:788-794
65. Pepke-Zaba J, Higenbottam TW, Dinh Xuan AT, et al (1990). Validation of impedance cardiography measurements of cardiac output during limited exercise in heart transplant recipients. Trans plant Int; 3:108-112
66. Salandin V, Zussa C, Risica G, et al (1988). Comparison of cardiac output estimation by thoracic electrical bioimpedance, thermodilution, and Fick methods. Crit Care Med; 16:1157-1158
67. Spaln DR, Schmid ER, Tornic M, et al (1990). Noninvasive versus invasive assessment of cardiac output after cardiac surgery: clinical validation. J Cardiothorac Anesth; 4(1):46-59
68. Talarico G, Saino A, Lotto A (1992). Noninvasive evaluation of cardiac index and ejection fraction in ischaemic cardiopathy: Comparison of thoracic bioimpedance, thermodilution and cineventriculography. Minerva Cardioangiol; 40:203-209
69. Wong DH, Tremper KK, Stemmer EA, et al (1990). Noninvasive cardiac output: simultaneous comparison of two different methods with thermodilution. Anaesthesiol; 72:784-792
70. Woo MA, Hamilton M, Stevenson LW, Vredevoe DL (1991). Comparison of thermodilution and transthoracic electrical bioimpedance cardiac outputs. Heart Lung; 20:357-62
71. Ekman LG, Milsom I, Arvidsson S, et al (1990). Clinical evaluation of an ensemble averaging impedance cardiograph for monitoring stroke volume during spontaneous breathing. Acta Anaesthesiol Scand; 34:190-196
72. Clancy TV, Norman K, Reynolds R, et al (1991). Cardiac output measurement in critical care patients: thoracic electrical bioimpedance versus Thermodilution. J Trauma; 31:1116-1121
73. Thomassett A (1962). Bioelectrical properties of tissue impedance measurements. Lyon Medical; 207:107-118
74. Hoffer EC, Meador CK, and Simpson DC (1969). Correlation of whole body impedance with total body water volume. J of App Physiol; 27:531-534
75. Jenin P, Lenoir J, Roullet C, Thomasset AL, Bucrot H (1975). Determination of body fluid compartments by electrical impedance measurements. Aviat Space Environ Med; 46:152-155
76. Nybore J (1981). Percent body fat by four terminal bio-electrical impedance and body density in college freshmen. Proceedings of the Vth International Conference on Electrical Bio-impedance, Tokyo
77. Kushner RF, Schoeller DA (1986). Estimation of total body water by bioelectrical impedance analysis. Am J Clin Nutr; 44:417-424
78. Nybore J (1970). Electromagnetic properties of tissues and fluids. Ann NY Acad Sci; 170:410-20
79. Houtkooper LB, Lohman TG, Going SB, Howell WH (1996). Why bioelectric impedance analysis should be used for estimating adiposity. Am J Clin Nutr; 64:436S-448S
80. Baumgartner R.N., Chumlea Wm. C., Roche A.F (1990). Bioelectric Impedance for Body composition. In: Exercise and sport sciences reviews, Am Coll Sports Med Series edited by Pandolf K.B. USA: Williams & Wilkins; 18:193-224
81. Spinale FG, Reines HD, Crawford FA (1988). Comparison of bioimpedance and thermodilution methods for determining cardiac output: experimental and clinical studies. Ann Thorac Surgery; 45:421-425
82. Fuller NJ, Hardingham CR, Grave M, et al (1999). Prediction of leg sections with anthropometry and bioelectrical impedance analysis, using magnetic resonance imaging as reference. Clin Sci; 96:647-657
83. Ward LC, Byrne N, Rutter K. et al (1997). Reliability of multiple frequency bioelectrical impedance analysis: an inter machine comparison. Am J Hum Biol; 9:63-72