Basófilos e Hipoxemia Inducida por el Ejercicio en Atletas de Resistencia Altamente Entrenados
Patrick Mucci1, Fabienne Durand2, Bernard Lebel3, Jean Bousquet3 y Christian Préfaut2
1Laboratoire de Physiologie des Interactions, Unité Progre á la Recherche et á l’Enseignement Supérieur EA701.
2Laboratoire de Physiologie des Interactions, Unité Progre á la Recherche et á l’Enseignement Supérieur EA701.
3Unité Institut National de la Santé et de la Recherche Médicale 454, Hópital Arnaud de Villeneuve, 34295 Montpellier, Francia.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2001.
Publicado 23 de agosto de 2006
Resumen
Palabras clave: hombres saludables, ejercicio progresivo hasta el agotamiento, concentración de cationes
INTRODUCCION
Es bien sabido que el ejercicio puede inducir la hipoxémia en atletas de resistencia altamente entrenados (5, 7, 2, 28, 29), a quienes se los conoce como “atletas extremos” (2, 29). El mecanismo implicado en el desarrollo de la hipoxémia inducida por el ejercicio (EIH) ha sido debatido durante mucho tiempo, y se han propuesto dos explicaciones principales: 1) una falta de hiperpnea compensatoria (7, 1, 2) y/o 2) una alteración en el intercambio de gases que puede resultar de mecanismos funcionales durante el ejercicio (1, 35). Este último mecanismo puede involucrar alteraciones en la ventilación-perfusión (19, 33) y en la difusión inducidas por incompleto equilibrio de O2 entre el gas alveolar y la sangre capilar pulmonar como resultado del rápido transito pulmonar de los glóbulos rojos (7) y/o de la formación de edemas vasculares peri bronquiales e intersticiales en el pulmón, durante la realización de ejercicios agotadores (9, 15, 16, 19, 29, 33, 35).
Un estudio previo (2) ha mostrado que la caída en la presión parcial arterial de O2 (PaO2) durante la realización de ejercicios agotadores estuvo asociada a un incremento concomitante en la liberación de histamina (%H) en atletas extremos, mientras que no se observaron cambios en la PaO2 o en los niveles de histamina en un grupo de sujetos de control desentrenados. Se reconoce ampliamente que la histamina es un mediador de la respuesta inflamatoria que provoca el incremento en la permeabilidad microvascular a las macromoléculas (38) y por lo tanto incrementan el movimiento transcapilar de fluidos. Por ello, se ha sugerido que el incremento en la liberación de histamina podría estar relacionado con las alteraciones en el movimiento pulmonar de fluidos y de esta manera con las alteraciones en el intercambio gaseoso tal como la EIH (2, 3). El hallazgo de que la EIH puede ser parcialmente inhibida por la previa inhalación de nodocromil sodio, una droga que se piensa actúa inhibiendo la liberación de histamina (30), provee evidencia de que el incremento en la liberación de histamina durante el ejercicio puede estar involucrado en el desarrollo de la EIH. Mas recientemente, se ha reportado que este incremento en el %H pude suprimirse en asociación con un cambio aparente en la distribución de la ventilación – perfusión (9). Una cuestión interesante tiene que ver con el origen de este incremento en la liberación de histamina. Se sabe bien que la histamina es un mediador de la respuesta inflamatoria y que contribuye potencialmente a la hipoxémia suave (30, 38). El incremento en la liberación de histamina asociado con la EIH puede entonces ser consecuencia de un proceso inflamatorio en el pulmón y/o en los músculos periféricos (38) durante el ejercicio progresivo. Este incremento pude también ser consecuencia de un incremento en el número de basófilos y/o de la elevación del contenido de histamina en estas células (1, 17, 24) en atletas extremos. La histamina está contenida esencialmente en los mastocitos y en los basófilos, y la mayor parte de la histamina presente en la sangre total se deriva de los leucocitos basófilos polimorfonucleares (basófilos) (38). Se ha reportado que 1) existe una relación positiva entre la liberación de histamina y el contenido de histamina en los basófilos tanto en sujetos normales como en asmáticos no medicados (1), y que 2) tanto en sujetos normales como en sujetos asmáticos, hay una estrecha asociación entre la concentración de histamina en la sangre total periférica luego del ejercicio y la cuenta de basófilos circulantes (17, 24).
El ejercicio y el entrenamiento producen una serie de cambios fisiológicos complejos que pueden alterar la concentración de leucocitos circulantes (8, 12, 14, 20). En base a los hallazgos publicados hasta la fecha, nosotros planteamos la hipótesis de que los atletas de resistencia altamente entrenados podrían inducir un incremento en el número de basófilos y/o en el contenido de histamina de los basófilos, lo cual podría explicar el incremento en la liberación de histamina observada durante el ejercicio. Sin embargo, existen datos conflictivos acerca del efecto del ejercicio sobre la cuenta de basófilos, de los cuales algunos autores han reportado incrementos (14, 17) y otros han reportado que no se observaron cambios significativos (12, 20, 24) entre los valore pre y post ejercicio. Para evaluar nuestra hipótesis, hemos medido la cuenta de basófilos y el contenido de histamina en los basófilos en reposo y durante la realización de ejercicio progresivo hasta el agotamiento en atletas altamente entrenados quienes han mostrado EIH, así como también en atletas altamente entrenados que no presentan EIH y en sujetos desentrenados de control. Además, hemos examinado la osmolaridad plasmática y las concentraciones de Na+ y K+, parámetros no inflamatorios que se sabe se incrementan con el ejercicio (11) y que influencian la liberación de histamina (4, 10).
METODOS
Sujetos
Treinta hombres jóvenes saludables participaron en este estudio. Las características antropométricas y los regímenes de entrenamiento se presentan en la Tabla 1. Ninguno de los sujetos reportó enfermedades respiratorias o cardíacas, hipertensión o conocimiento de estar sufriendo alguna enfermedad crónica. Ninguno de los sujetos consumía medicamentos en forma regular. Ninguno tenía historia de asma, asma inducida por el ejercicio, enfermedades atípicas o mostró signos de enfermedades alérgicas, lo cual fue valorado con el test Phadiatop, un test sexológico con una sensibilidad del 90% y una especificidad del 98% (37). Ninguno de los sujetos era fumador y todos presentaron valores espirométricos normales. Antes de ser admitidos en el estudio, se evaluó la salud cardiovascular de todos los sujetos. Cualquier sujeto que exhibiera un trazado anormal en un electrocardiograma de 12 derivaciones (ECG) o una presión sanguínea en posición supina mayor a 160/100 Torr fue excluido del estudio. Luego de esto se llevó a cabo un test preliminar de ejercicio máximo en cicloergómetro. Los sujetos fueron excluidos del estudio si presentaban una depresión del segmento ST en el ECG o arritmias significativas. El estudio fue aprobado por el Comité de Ética Institucional, y todos los sujetos dieron su consentimiento por escrito para participar en el estudio, luego de que se describieran el diseño y los riesgos del mismo.
Atletas
En la presente investigación se estudió a veinte atletas hombres entrenados en resistencia (HT). Los criterios para la selección de los sujetos fueron los siguientes: edad, 19-30 años, consumo máximo de O2 (VO2 máx.) > 6 ml/kg/min. Estos sujetos fueron asignados a uno de dos grupos. El primer grupo estuvo compuesto de nueve atletas extremos (HThyp), i.e., atletas altamente entrenados que desarrollaron EIH. Esto fue definido como una caída en la PaO2 de al menos 8 Torr a partir de los valores de reposo, corregido por la temperatura, que durara al menos las últimas tres etapas de un test de ejercicio progresivo (2, 9, 29, 30). Tres de los sujetos del grupo HThyp eran triatletas, y los otros seis eran ciclistas. Estos sujetos participaban regularmente en competiciones de nivel regional o nacional, y todos habían estado entrenando regularmente durante un promedio de 4.6±0.5 años. Estos sujetos entrenaban durante 16.3±1.1 h/semana. El segundo grupo de sujetos entrenados estuvo compuesto por nueve atletas de control (HTnor), i.e., atletas altamente entrenado que no exhibían EIH. La reducción máxima en la PaO2 en este grupo fue de 3 Torr. Tres de los sujetos del grupo HTnor eran triatletas, y los otros seis eran ciclistas. Estos habían estado participando en competencias de nivel regional o nacional durante un promedio de 3.6±0.8 años. Todos entrenaban regularmente un promedio de 13.7±1.1 h/semana. Los dos restantes atletas exhibieron reducciones en la PaO2 de 5 y 6 Torr, respectivamente, i.e., por encima de la definición de hipoxemia de reposo (31) y bajo el umbral de 8 Torr. Estos sujetos no fueron incluidos en ninguno de los grupos de atletas para mantener las diferencias grupales. Sin embargo, estos sujetos fueron utilizados en los análisis de correlación para determinar las relaciones entre las variables dependientes.
Sujetos de Control
Diez hombres desentrenados (UT), de entre 20-30 años de edad (26.0±1.2 años), formaron parte del grupo de control. Ninguno había participado en deportes de resistencia, aunque tenían estilos de vida activos con un promedio de actividad física de 2.3±0.4 h/semana.
Test de Ejercicio
Se llevó a cabo un test de ejercicio progresivo hasta el agotamiento en un cicloergómetro (Monark 860, Varberg, Sweden) calibrado. La potencia inicial fue de 30 W para el grupo UT y de 60 W para el grupo HT, la cual se mantuvo durante 3 min, con sucesivos incrementos de 30 W por minuto excepto al final del test, cuando el incremento se redujo para estar lo más próximo posible al VO2 máx. La ventilación minuto (VE), el consumo de oxígeno (VO2) y la producción de CO2 (VCO2) se midieron de forma continua utilizando un sistema metabólico automatizado con mediciones respiración por respiración (CPX, Medical Graphics, St. Paul, MN). Los datos fueron promediados durante los últimos 20 s de cada carga. Para asegurar que los sujetos habían alcanzado el VO2 máx. durante la prueba de ejercicio, estos debían cumplir con al menos tres de los siguientes criterios: 1) una estabilización en el VO2 con el ultimo incremento en la carga (criterio de “nivelación”); 2) alcanzar la frecuencia cardíaca máxima estimada a partir de la edad [210 – (0.65 x edad) ± 10%]; 3) un índice de intercambio respiratorio de 1.1; y 4) la incapacidad de mantener la frecuencia de pedaleo requerida (60 rpm) a pesar del máximo esfuerzo y la estimulación verbal.
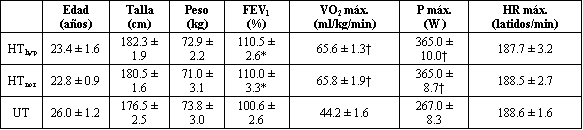
Tabla 1. Características físicas y fisiológicas de los sujetos. Los
valores son medias ± EE. FEV1, volumen espiratorio forzado en 1 min expresado
como un porcentaje del valor estimado; VO2 máx, consumo máximo de
oxígeno; P máx., carga máxima alcanzada durante el ejercicio progresivo hasta el
agotamiento, HR máx., frecuencia cardíaca máxima alcanzada durante el ejercicio
progresivo hasta el agotamiento; HThyp, grupo altamente entrenado e hipoxémico;
HTnor, grupo altamente entrenado normohipoxémico; UT, grupo
desentrenado. Grupos de sujetos entrenados significativamente diferente con
respecto al grupo de sujetos desentrenados: * p<0.05, † p<0.01.
Durante todo el test se llevó a cabo el monitoreo cardíaco de forma continua utilizando un ECG de tres derivaciones (DII, V2, V5) (Quinton Q 3000, Seattle, WA) y se registraron los valores obtenidos en el último minuto de cada etapa del test, para determinar la frecuencia cardíaca. Fue posible monitorear y registrar las otras nueve derivaciones en cualquier momento.
Análisis Sanguíneos
Las muestras de sangre se extrajeron de la arteria braquial del brazo no dominante utilizando para esto un catéter de 1 mm de diámetro (Seldicath; Plastimed, Paris, Francia).
Gases Sanguíneos
Los gases sanguíneos arteriales fueron inmediatamente analizados para determinar la PaO2, la presión parcial arterial de CO2 (PaCO2) y el pH a 37ºC utilizando los electrodos apropiados (IL Meter 1306, Milan, Italia). Debido a la elevación en la temperatura central durante el test de ejercicio, existió el riesgo de sobreestimar la reducción en la PaO2. Por ello, los gases sanguíneos tuvieron que ser corregidos por la temperatura central estimada mediante una sonda timpánica (YSI Probe 43TA, Yellow Springs Instruments, Yellow Springs, OH) en cada etapa de la evaluación. Con esto observamos un cambio promedio de 0.7±0.1 ºC durante el test progresivo de ejercicio alcanzándose el valor máximo al quinto minuto de la recuperación. Debido a que corregimos los gases sanguíneos por el apropiado incremento en la temperatura, utilizamos el siguiente razonamiento para definir la EIH: dada la variabilidad en la medición de la PaO2 en reposo, la hipoxemia en la condición de reposo debería ser definida como una reducción significativa de 5 Torr respecto de los valores normales individuales (31). Debido a que la sonda timpánica es una forma precisa de estimar el incremento en la temperatura de la sangre central, i.e., ~0.1 o 0.2ºC, y que por lo tanto puede ser utilizada para corregir los valores en los gases sanguíneos (32) y también debido a que necesitamos detectar la hipoxemia suave, nosotros adicionamos 3 Torr a la caída de 5 Torr en la PaO2 de reposo para obtener un valor final de 8 Torr y asegurar una rigurosa definición de la EIH. Por lo tanto, fue necesaria una caída de al menos 8 Torr en la PaO2 que durara al menos las últimas tres etapas del test de ejercicio progresivo (9) para establecer la presencia de hipoxemia durante el ejercicio.
Análisis de Osmolaridad
La osmolaridad de la sangre fue inmediatamente medida con la técnica calorimétrica utilizando un micro-osmómetro avanzado (3Mo1, Advanced Instruments, Needham Heights, MA). Las concentraciones de Na+ y K+ fueron determinadas mediante el uso de un analizador automático apropiado (Vitros 700 XRC, Johnson and Johnson Clinical Diagnostic).
Ensayo de la Histamina Plasmática
Las muestras de sangre para la determinación de la histamina plasmática fueron obtenidas en tubos Vacutainer (Becton Dickinson, Rutherford, NJ), los cuales contenían EDTA y fueron colocados inmediatamente en hielo. El plasma fue obtenido mediante la centrifugación a 900 g durante 10 min a 4ºC en una centrífuga refrigerada modelo PR-J (Beckman Instruments, Irvine, CA). Las alícuotas fueron separadas 0.5-1 cm por encima de las células para evitar recoger cualquier leucocito, especialmente los basófilos, y fueron congeladas a -80ºC hasta la realización de los análisis. La cuantificación de la histamina fue llevada a cabo utilizando instrumental para la realización de inmunoensayos enzimáticos (Immunotech, Marseille, Francia)
Histamina Total en Sangre
Las muestras de sangre para la determinación de la histamina en sangre total fueron obtenidas en tubos Vacutainer heparinizados y fueron colocadas en hielo inmediatamente después de ser extraídas. Cincuenta microlitros de sangre total fueron adicionados a 950 μl de agua destilada, y las alícuotas fueron congeladas a -80ºC hasta que se realizara la medición de la histamina. Para la cuantificación de la histamina en sangre total, la sangre diluida fue congelada y descongelada dos veces para provocar la lisis celular. Luego de descongelar por última vez la sangre y de remover las membranas centrifugando la muestra a 900 g durante 10 min a 4ºC, se realizó la cuantificación de la histamina en el suero como se describió previamente.
Liberación de Histamina
Como se describiera previamente (2, 9, 23, 30), la liberación de histamina se expresó como un porcentaje de la histamina total (%H). La liberación específica de histamina fue determinada como %H=100 x PH/TH, donde PH es la histamina plasmática para una determinada etapa del test en cada sujeto, y TH es la correspondiente concentración total de histamina.
Cuenta de Basófilos
La cuenta de basófilos fue llevada a cabo en muestras de sangre anticoaguladas (EDTA) tomadas en el mismo momento que las muestras para el ensayo de histamina. La sangre fue teñida con Azul de Alcian, el cual es un método altamente específico, preciso y reproducible para determinar la cuenta de basófilos en base a la tinción de los gránulos de basófilos, como lo describieran Gilbert y Ornstein (13). La cuenta de basófilos fue llevada a cabo en una cámara de conteo Fuchs-Rosenthal.
Contenido de Histamina
Debido a que la mayor parte de la histamina deriva de los basófilos (38), el contenido de histamina de los basófilos fue determinado como HC = (TH – PF)/BC, donde BC es la cuenta de basófilos correspondiente al nivel de histamina plasmática y a la concentración total de histamina para una determinada etapa del test (1).
Protocolo
Los sujetos realizaron tres tests de ejercicio separados por algunas semanas, los cuales fueron llevados a cabo entre las 9 y las 11 AM para evitar variaciones diurnas. En el primer día, se llevaron a cabo entrevistas y exámenes clínicos, y se registraron los valores de la talla, la masa corporal, la presión sanguínea, el ECG de reposo y la espirometría pulmonar de reposo. Luego de esto se realizó el primer test de ejercicio para permitir que el sujeto se adapte al ergómetro y al ambiente del laboratorio, para detectar cualquier anormalidad cardíaca relacionada con el ejercicio y para determinar el VO2 máx. Durante el segundo test de ejercicio, se extrajeron las muestras de sangre de la arteria braquial, para las posteriores mediciones de los gases sanguíneos, basófilos e histamina. Las muestras de sangre arterial fueron extraídas durante los últimos 20 s del tercer y quinto minuto del período de reposo, durante los últimos 20 s de la última carga correspondiente al VO2 máx., y durante los últimos 20 s del quinto minuto de la recuperación. Durante el tercer test de ejercicio, se realizaron las mediciones de las temperaturas timpánicas, las cuales se llevaron a cabo en los mismos momentos en que se extrajeron las muestras de sangre, i.e., nosotros utilizamos el valor medio de la temperatura obtenida durante los últimos 20 s del tercer y quinto minuto del reposo, durante los últimos 20 s de la última carga correspondiente al VO2 máx., y durante los últimos 20 s del quinto minuto de la recuperación. Durante los dos últimos tests de ejercicio cada sujeto alcanzó similares valores fisiológicos. Durante cada uno de los tests de ejercicio, se monitorearon las variables ventilatorias de los sujetos, y se monitoreo la respuesta cardíaca durante los 5 min previos al test, desde el comienzo al final del test y en durante los 10 min de la recuperación, utilizando para esto un ECG de tres derivaciones. Las variables ventilatorias (VO2, VCO2, y VE) fueron promediadas en un número integral de respiraciones durante los últimos 20 s de cada minuto del reposo, del ejercicio y de la recuperación. Esto permitió el calculo de la Ai-aDO2 utilizando la ecuación estándar PAiO2 = PiO2 – PACO2 [FIO2 + (1-FIO2/R)], donde Ai-aDO2 es la diferencia arterioalveolar idela de PO2, PAIO2 es la PO2 alveolar ideal, PIO2 es la PO2 del aire inspirado, FIO2 es la fracción de O2 inspirada, R es el índice de intercambio respiratorio, PACO2 es la PCO2 alveolar y PACO2 = PaCO2 (3).
Análisis Estadísticos
Los valores se presentan como medias±EE. Los datos respecto de las características de los sujetos fueron comparados para evaluar la homogeneidad entre los sujetos de los grupos UT, HTnor y HThyp utilizando el análisis de varianza ANOVA, luego de verificar la distribución normal. Las medias de diferencia (D) entre cada etapa del test para un determinado parámetro de histamina fueron calculadas y comparadas entre los tres grupos con este test. Para comparar los valores medios a través de las etapas de los tests entre los tres grupos de sujetos se utilizó el análisis de varianza ANOVA de dos vías para medidas repetidas, y se utilizó el análisis de varianza ANOVA de una vía para medidas repetidas para evaluar los cambios intra grupales. Se utilizaron análisis de regresión linear para definir la relación entre dos variables, y la significancia estadística fue evaluada utilizando los coeficientes de correlación. La significancia estadística para todos los test fue establecida a p<0.05, a dos colas.

Tabla 2. PaO2 y D(Ai-a)O2 durante los tests de
ejercicio progresivo hasta el agotamiento. Los valores son medias ± EE. PaO2,
presión parcial arterial de O2; D(AI-a)O2, diferencia
arterioalveolar ideal en la presión parcial de O2; Máx, carga máxima
en el ejercicio progresivo; Rec, 5to minuto de la recuperación. Diferencia
significativa de los grupos de entrenados respecto del grupo desentrenado: *
p<0.01, † p<0.001. Grupo HThyp significativamente diferente del grupo THnor, ‡p<
0.05, § p< 0.01.
RESULTADOS
Datos Máximos y Físicos
No se hallaron diferencias significativas entre los tres grupos respecto de la edad, talla, masa corporal o frecuencia cardíaca máxima. Los grupos de sujetos altamente entrenados mostraron valores significativamente mayores de volumen espiratorio forzado en un minuto (p<0.05), VO2 máx. (p<0.001) y carga máxima (p<0.001) en comparación con los sujetos desentrenados (Tabla 1)
Gases Sanguíneos
Los datos de la PaO2 y de la Ai-aDO2 se muestran en la Tabla 2. En reposo, no se observaron diferencias significativas en los valores medios de PaO2 y Ai-aDO2 entre los grupos. Sin embargo, durante el test de ejercicio, con la máxima carga, el grupo HThyp mostró menores valores de PaO2 y mayores valores de Ai-aDO2 que el grupo UT (p<0.001) y que el grupo HTnor (p<0.01). Durante la recuperación, los datos de la PaO2 fueron significativamente diferentes entre los grupos HThyp y HTnor (p<0.05).
Histamina
No se hallaron diferencias significativas entre los tres grupos en la concentración plasmática de histamina y en la concentración de histamina en sangre total durante ninguna de las etapas de los tests. Todos mostraron un incremento significativo en la concentración plasmática de histamina entre el reposo y la carga máxima (p<0.01 y p<0.05, respectivamente) pero no se observaron diferencias entre el reposo y la recuperación. La concentración de histamina en la sangre total fue significativamente mayor con la carga máxima y en la recuperación en los grupos HThyp (p<0.05), HTnor (p<0.01) y UT (p<0.001) que en reposo (Tabla 3). Los valores basales de %H no difirieron significativamente entre los tres grupos. Sin embargo, con el ejercicio máximo, hubo un incremento significativo en el grupo HThyp (p<0.01) pero no en los grupos no hipoxémicos (Figura 1A). Durante la recuperación, los valores de %H no difirieron de los valores de reposo en ningún grupo. Se hallaron correlaciones significativas en el grupo HThyp entre 1) el incremento en el %H y la caída en la PaO2 entre el reposo y el ejercicio máximo (n = 9, r = 0.74, p<0.05) (Figura 2), lo cual no fue observado en los grupos HTnor (n=9, r=0.09, p=0.82) o UT (n=10, r = 0.16, p = 0.65); y 2) entre el cambio en el %H y el incremento en la Ai-aDO2 entre el reposo y el ejercicio máximo (n=9, r=0.68, p<0.05), lo cual tampoco fue observado en los grupos HTnor (n = 9, r 0 0.16, p = 0.73) o UT (n = 10, r = 0.25, p = 0.49).
Basófilos
Las cuentas de basófilos no fueron significativamente diferentes entre los grupos en ninguna etapa de los tests. Los grupos HT y UT exhibieron una reducción significativa durante el ejercicio (p<0.01), pero durante la recuperación solo los grupos UT y HTnor retornaron a los valores de reposo, lo que no ocurrió en el grupo HThyp (p<0.05) (Figura 1B).
Contenido de Histamina
El contenido de histamina en los basófilos no fue significativamente diferente entre los tres grupos en ninguna de las etapas de los tests. Se observó un incremento significativo en el contenido de histamina en los grupos HThyp, HTnor y UT entre el reposo y el ejercicio máximo (p<0.05, p<0.01 y p<0.001, respectivamente) y entre el reposo y la recuperación post ejercicio (p<0.05, p<0.05 y p<0.001, respectivamente) (Figura 1C). Sin embargo, el incremento en el contenido de histamina de los basófilos entre el reposo y el ejercicio máximo fue significativamente menor en el grupo HThyp que en los grupos HTnor y UT (p<0.05) (Figura 3).
Osmolaridad
Se observaron incrementos en la osmolaridad de la sangre (p<0.001), K+ (p<0.001) y Na+ (p<0.001) entre el reposo y el ejercicio máximo en los tres grupos. Los valores de todos estos parámetros retornaron a los niveles de reposo al quinto minuto de la recuperación post ejercicio, excepto la concentración de Na+ en el grupo UT (Tabla 4). Los valores de reposo no fueron diferente entre los tres grupos; sin embargo, los valores máximos fueron menores en el grupo HThyp que en el grupo UT respecto de la osmolaridad (p<0.01), K+ (p<0.05) y Na+ (p<0.005). No se hallaron diferencias significativas entre los grupos HThyp y HTnor. Tampoco se hallaron correlaciones significativas entre los cambios en estos parámetros y los cambios en el %H.
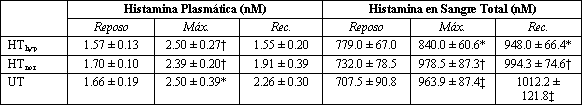
Tabla 3. Cambios en la histamina plasmática y en la histamina en sangre
total durante el test de ejercicio progresivo hasta el agotamiento. Los valores
son medias ± EE. Significativamente diferente de los valores de reposo: *
p<0.05; † p<0.01; ‡ p<0.001.
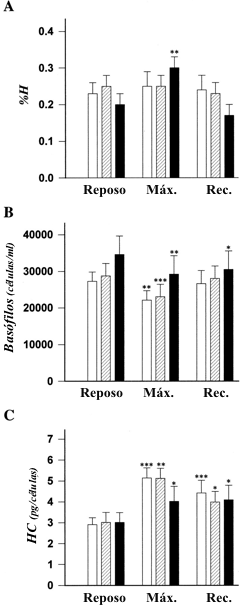
Figura 1. Liberación de histamina (%H, A), cuenta de basófilos (basófilos;
B) y contenido de histamina (HC; C), en sujetos de control desentrenados (UT;
barras blancas), en sujetos no hipoxémicos altamente entrenados (HTnor;
barras a rayas), y sujetos altamente entrenados con hipoxemia inducida por el
ejercicio (HThyp, barras negras) en reposo (Reposo), durante el ejercicio máximo
(Máx.), y al 5to minuto de la recuperación (Rec.). Significativamente diferente
de los valores de reposo dentro de los grupos: *p<0.05, **p<0.01, ***p<0.001.
DISCUSION
Los resultados de la presente investigación mostraron que el incremento en la liberación de histamina durante el ejercicio no está asociado con el incremento en la cuenta de basófilos, en el contenido de histamina de los basófilos o en la osmolaridad de la sangre en atletas extremos. Sin embargo, hallamos un menor incremento en el contenido de histamina en estos atletas durante el ejercicio en comparación con los atletas de control y con los sujetos desentrenados y una reducción en la cuenta de basófilos en cada grupo durante el ejercicio máximo pro solo en los atletas extremos al 5to minuto de recuperación post ejercicio.
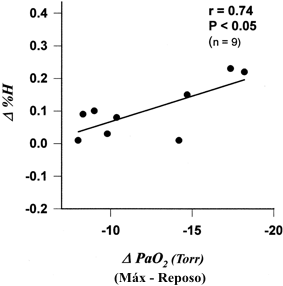
Figura 2. Correlación entre el incremento en la liberación de histamina (D%H
= %H durante el ejercicio máximo - %H en reposo) y la caída en la PaO2
(DPaO2 = PaO2 durante el ejercicio máximo-PaO2
en reposo) durante el ejercicio en el grupo HThyp (n=9 sujetos).
Metodología
Debido a que Anselme et al (2) y Préfaut et al (30) hallaron una fuerte correlación entre el %H y la caída en la PaO2 en atletas extremos, nosotros utilizamos el %H como un índice de liberación de histamina, más que la histamina plasmática o la histamina en la sangre total. Sin embargo, el índice %H tiene en cuenta las variaciones tanto en la histamina plasmática como en la histamina total (2, 20, 27).
En el presente estudio hallamos un incremento en el %H durante el ejercicio progresivo hasta el agotamiento en los atletas extremos pero no en los sujetos desentrenados, al igual que Anselme et al. (2). Sin embargo, en nuestros atletas extremos el incremento medio en el %H estuvo por debajo del 0.1-0.2% hallado por estos autores, e.g., uno de nuestros sujetos mostró una reducción en el %H y dos mostraron un incremento de ~ 0.02%. Asimismo, no hallamos diferencias significativas en el %H durante el ejercicio máximo entre el grupo HThyp y los grupos no hipoxémicos. A pesar de esto, hallamos la misma correlación significativa entre los cambios en el %H y la caída en la PaO2 durante el ejercicio (2, 30) en el grupo HThyp.
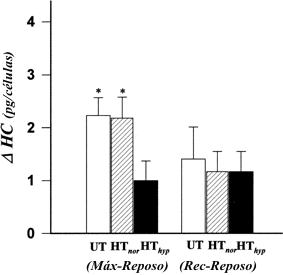
Figura 3. Comparación de los cambios en el contenido de histamina de los
basófilos (DHC) entre los grupos UT, HTnor y HThyp, entre el
ejercicio máximo y el reposo (Max-Reposo) y entre los niveles de recuperación y
de reposo (Rec.-Reposo). Significativamente mayor que el grupo HThyp, *p<0.05
Hipoxemia Inducida por el Ejercicio y Liberación de Histamina
El desarrollo de la EIH en nuestros atletas altamente entrenados es consistente con los reportes publicados previamente en la literatura. Siete atletas mantuvieron la PaO2 dentro de los 8-15 Torr de los valores de reposo, y otros dos mostraron reducciones de 15 a 20 Torr en la PaO2. Asimismo, esta caída en la PaO2 estuvo acompañada por una mayor Ai-aDO2 máxima en el grupo HThyp en comparación con los grupos HTnor y UT. Este último resultado para los atletas extremos ha sido previamente sugerido, con una correlación significativa entre los cambios en la PaO2 y la elevación en la Ai-aDO2 (16, 35). En el presente estudio, hemos estudiado por primera vez el %H durante el ejercicio en atletas no hipoxémicos altamente entrenados y mostramos que el grupo HTnor no presentó un cambio significativo en el %H durante el ejercicio progresivo, siendo similar el caso para los sujetos desentrenados. Este resultado fortalece la hipótesis de una relación entre la EIH y el %H. La falta de incremento en el %H en el grupo HTnor estuvo asociada con una Ai-aDO2 máxima que fue menor a la observada en el grupo HThyp. Esto es consistente con la hipótesis de una contribución de la liberación de histamina a la desmejora del intercambio de gases en la EIH. No obstante, nuestros resultados no pueden determinar si el incremento en el %H es un efecto o una causa de la EIH. El hallazgo de Préfaut et al. (30) (una parcial inhibición de la EIH con la inhalación de un antihistamínico) proveyó evidencia de que este incremento en la liberación de histamina durante el ejercicio puede estar involucrado en el desarrollo de la EIH, pero es probable que la histamina por si sola no pueda inducir alteraciones en el intercambio de gases, por lo que debe ocurrir otro fenómeno (30).
Histamina y Ejercicio Progresivo hasta el Agotamiento
Nosotros observamos que el ejercicio progresivo hasta el agotamiento induce el mismo incremento relativo en la histamina total y la histamina plasmática en sujetos no hipoxémicos, que el observado previamente en sujetos normales luego de la realización de ejercicios (8, 17, 24). Por lo tanto, estos sujetos no mostraron cambios en la media del %H. En contraste, el %H se incrementó en los atletas extremos debido a un acentuado aumento en la histamina plasmática (2, 23), i.e., durante el ejercicio, los niveles plasmáticos y totales de histamina se incrementaron en casi la misma proporción en los sujetos no hipoxémicos, mientras que el incremento en la histamina plasmática estuvo relativamente más acentuado (media ~ 50%) respecto del incremento en la histamina total en los atletas hipoxémicos. En atletas altamente entrenados, la liberación de histamina puede estar relacionada con un proceso inflamatorio periférico (38) durante el ejercicio (14). Sin embargo, el grupo HTnor no exhibió un incremento en el %H, aunque alcanzaron el mismo nivel absoluto de ejercicio que el grupo HThyp. Asimismo, la desmejora en el intercambio gaseoso en estos atletas extremos correlacionó significativamente con el %H. Esto sugiere que una explicación alternativa al incremento en la liberación histamina durante el ejercicio puede ser que parte de la histamina liberada proviene de la activación de los basófilos y los mastocitos que se encuentran en el pulmón luego de la inflamación del mismo (38). Esta hipótesis está respaldada por dos hechos: 1) nosotros recolectamos las muestras de sangre de la arteria y no de la vena (17) y 2) investigaciones recientes con lavados broncoalveolares han sugerido que el ejercicio intenso puede desmejorar la integridad de la barrera pulmonar sangre – gas en los atletas de elite e inducir la liberación de mediadores inflamatorios (18).
Recuento de Basófilos
En el presente estudio no se observaron diferencias significativas en la cuenta de basófilos entre los grupos de sujetos altamente entrenados en resistencia y los sujetos del grupo control. Nieman et al. (27) originalmente reportó este resultado para atletas en general y en reposo, y nosotros hemos extendido estos resultados con datos similares pero bajo condiciones de ejercicio y en un grupo de atletas altamente entrenados que exhibían EIH. Por lo tanto podemos concluir que el entrenamiento de alta intensidad no induce una alta cuenta de basófilos y que por lo tanto el número de basófilos no puede explicar el incremento en el %H asociado con la EIH. Por lo tanto, otros factores deberían intervenir. Nosotros describimos, por primera vez para nuestro conocimiento, una reducción en la cuenta de basófilos durante la realización de ejercicios progresivos hasta el agotamiento en sujetos sanos. Este es el primer estudio que ha investigado específicamente los cambios en la cuenta de basófilos durante la realización de ejercicios progresivos, con la única excepción de un estudio de hace 40 años pero en donde se utilizó ejercicio de una duración mucho mayor (8). Nuestros datos sugieren que el test de ejercicio progresivo hasta el agotamiento estuvo acompañado por una “basopenia” en todos los grupos. Esta basopenia inducida por el ejercicio pudo haberse debido al método de conteo, el cual se basó en la tinción específica de los gránulos de basófilos y la detección de las células teñidas. También pudo haberse debido a la degranulaicón parcial de los basófilos durante el ejercicio y a la consecuente subestimación de la cuenta que ocurre en presencia de basófilos ligeramente teñidos que son difíciles de distinguir de los leucocitos no basófilos con tinción nuclear. Estas células intermedias son normalmente omitidas en la cuenta de basófilos debido a esta incerteza (13). Esta hipótesis está respaldada por el hecho de que esta basopenia desapareció durante el período de recuperación en los hombres no hipoxémicos.
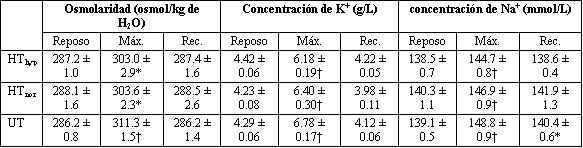
Tabla 4. Cambios en la osmolaridad de la sangre y en las concentraciones
sanguíneas de K+ y Na+ durante los test de ejercicio
progresivo hasta el agotamiento. Los valores son medias ± EE. Significativamente
diferente de los valores de reposo: *p<0.01, † p<0.0001.
En efecto, al igual que en la mayoría de las investigaciones (12, 20, 22, 24) no hemos observado cambios en el número de basófilos entre las cunetas de basófilos pre y poste ejercicio. Por lo tanto, preferimos el término pseudobasopenia. La caída en la cuenta de basófilos probablemente refleja la desgranulación de los basófilos, lo cual sugiere un proceso inflamatorio inducido por el ejercicio progresivo. La cuenta de basófilos en atletas extremos, sin embargo, no retornó a los niveles de reposo luego de transcurridos cinco minutos de la recuperación. Esto puede estar relacionado con el hecho de que esta población de sujetos presenta un incremento en el %H durante el ejercicio, por lo que hipotetizamos que esta baja cuenta de basófilos luego del ejercicio pudo haberse debido a la completa desgranulación de los basófilos. Nuevamente, este resultado sugiere una respuesta inflamatoria inducida por el ejercicio progresivo que se ve incrementada en los atletas extremos.
Esta alta desgranulación de los basófilos también pudo haber sido causada por una incrementada estimulación debida a varios factores entre los que se encuentra la hiperosmolaridad (10). En acuerdo con la literatura (11), hemos hallado un incremento en la osmolaridad y en la concentración de cationes durante el ejercicio. No obstante, los atletas extremos no presentaron un mayor valor maximal medio de osmolaridad en comparación con los sujetos desentrenados o con los sujetos entrenados no hipoxémicos. Esta observación no es consistente con la hipótesis de la activación hiperosmolar de la liberación de histamina en estos atletas. Asimismo, los sujetos controles desentrenados mostraron un mayor valor medio máximo de concentración sanguínea de Na+ que los atletas extremos, lo cual respalda la hipótesis de un efecto inhibitorio del Na+ exógeno sobre la liberación de histamina (4). Sin embargo, nosotros no hallamos diferencias significativas entre los grupos hipoxémico y no hipoxémico ni tampoco una correlación significativa entre el cambio en el %H y la concentración de Na+. Nuestros datos por lo tanto no respaldan la hipótesis de una influencia de factores no inflamatorios tales como la hiperosmolaridad o la concentración sanguínea de cationes sobre el incremento en la liberación de histamina en atletas extremos. Otros factores podrían inducir una elevación en la liberación de histamina, tal como las citoquinas. Por ejemplo, se sabe que la interleukina-1 (IL-1) es un mediador inflamatorio y un factor liberador de histamina (21) y además que se incrementa con el ejercicio (6, 34). Recientemente, nuestro laboratorio ha mostrado que la liberación de histamina estaba aumentada en atletas altamente entrenados en comparación con los sujetos desentrenados (25). Obviamente, se requieren estudios adicionales para esclarecer los mecanismos involucrados y para confirmar o eliminar la hipótesis de la respuesta inflamatoria y la de las citoquinas.
Contenido de Histamina
Los resultados de este estudio no mostraron diferencias en el contenido de histamina entre los sujetos no hipoxémicos y los atletas extremos. Por lo tanto nosotros no podemos explicar el incremento en el %H en los atletas extremos por medio de la elevación en el contenido de histamina inducida por el entrenamiento de alta intensidad. Para nuestro conocimiento, desde la investigación de Duner y Pernow en 1958 (8), no se ha llevado a cabo otra investigación acerca del contenido celular de histamina durante el ejercicio. Nosotros hallamos, al igual que estos investigadores, un incremento en la histamina celular en los sujetos desentrenados de control; y también hallamos este incremente en los atletas altamente entrenados. Este incremento en ambos grupos pudo deberse a un incremento en la síntesis de histamina durante el ejercicio. La literatura es consistente con esta hipótesis: 1) el ejercicio deriva en una elevada actividad plasmática de la IL-1 (6, 34); y 2) la IL-1 puede inducir un incremento en la síntesis de histamina en los basófilos (36). El incremento en el contenido de histamina en los basófilos observado en los atletas extremos durante el ejercicio fue menor que el observado en los sujetos desentrenados y en los sujetos altamente entrenados no hipoxémicos. Una explicación del bajo contenido de histamina en los basófilos asociado con la reducción en la cuenta de basófilos y el incremento en el %H en atletas altamente entrenados durante el ejercicio es el incremento en la desgranulación de las células basófilas. Como mostramos anteriormente, el aumentado %H en los basófilos en atletas extremos no puede deberse a un efecto provocado por el entrenamiento de alta intensidad sobre los basófilos o a una estimulación hiperosmolar no inflamatoria. Sin embargo, esto puede ser explicado a través de un proceso inflamatorio sistémico (14) y/o pulmonar (18) inducido por la alta carga de trabajo alcanzada por los atletas extremos.
En conclusión, no podemos explicar el incremento en la liberación de histamina asociada a la EIH mediante la elevación en el número de basófilos o en el contenido de histamina en atletas extremos. Esto sugiere que otro tipo de células pueden estar interviniendo: los mastocitos. Sin embargo, la observación de una baja cuenta de basófilos durante la recuperación y el relativamente bajo incremento en el contenido de basófilos durante el ejercicio máximo asociado con el incremento en el %H sugiere la desgranulación de los basófilos durante el ejercicio en atletas extremos. En estos atletas, la desgranulación no estuvo asociada con la estimulación hiperosmolar durante el ejercicio, pero pudo estar relacionada con algún proceso inflamatorio. Nosotros hipotetizamos que el incremento en la liberación de histamina en los atletas extremos se debe, al menos parcialmente, a una elevada desgranulación de los basófilos circulantes en respuesta a la estimulación provocada por factores inflamatorios durante el ejercicio, tales como las citoquinas. Esta especulación, obviamente requiere de investigación adicional.
Agradecimientos
Queremos agradecer a M. Rongier, P. Kippelen, and C. Caillaud por su experiencia técnica y a N. Blondel (Laboratoire d’Analyses Multidisciplinaires des Pratiques Sportives, Université d’Artois, France) y a C. Fabre y S. Berthoin (Laboratoire d’Etudes de la Motricité Humaine, Université Lille II, France) por su asistencia técnica. Este trabajo fue apoyado por una subvención otorgada por el Conseil Re´gional du Languedoc-Roussillon.
Dirección para el pedido de reimpresiones y otra correspondencia
P. Mucci, UFR STAPS de Lievin-Universite d’Artois, Laboratoire d’Analyse Multidisciplinaire des Pratiques Sportives, 62800 Lievin, Francia (correo electrónico: pmucci@wanadoo.fr).
Referencias
1. Akagi K and Townley RG (1989). Spontaneous histamine release and histamine content in normal subjects and subjects with asthma. J Allergy Clin Immunol 83: 742749
2. Anthonisen NR and Fleetham JA (1987). Ventilation: total, alveolar, and dead space. In: Handbook of Physiology. The Respiratory System. Gas Exchange. Bethesda, MD: Am. Physiol. Soc., sect. 3, vol. IV, chapt. 7, p. 113129
3. Beauvais F, Shimara T, Inoue I, Hieblot C, Burtin C, and Benveniste J (1992). Regulation of human basophil activation. II. Histamine release is potentiated by K+ efflux and inhibited by Na+ influx. J Immunol 148: 149154
4. Caillaud C, Anselme F, and Prefaut C (1996). Effects of two successive maximal exercise tests on pulmonary gas exchange in athletes. Eur J Appl Physiol 74: 141147
5. Cannon JG, Evans WJ, Hughes VA, Meredith CN, and Dinarello CA (1986). Physiological mechanisms contributing to increased interleukin-1 secretion. J Appl Physiol 61: 18691874
6. Dempsey JA, Hanson PG, and Henderson KS (1984). Exercise induced arterial hypoxemia in healthy human subjects at sea level. J Physiol (Lond) 355: 161175
7. Duner H and Pernow B (1958). Histamine and leukocytes in blood during muscular work in man. Scand J Clin Lab Invest 10: 394396
8. Findlay SR, Dvorak AM, Sobotka AK, and Lichtenstein LM (1981). Hyperosmolar triggering of histamine release from human basophils. J Clin Invest 67: 16041613
9. Freund BJ, Claybaugh JR, Dice MS, and Hashiro GM (1987). Hormonal and vascular fluid responses to maximal exercise in trained and untrained males. J Appl Physiol 63: 669675
10. Fry RW, Morton AR, Crawford GPM, and Keast D (1992). Cell numbers and in vitro responses of leucocyte and lymphocyte subpopulations following maximal exercise and interval training sessions of different intensities. Eur J Appl Physiol 64: 218227
11. Gilbert HS and Ornstein L (1975). Basophil counting with a new staining method using alcian blue. Blood 46: 279286
12. Gleeson M, Almey J, Brooks S, Cave R, Lewis A, and Griffiths H (1995). Haematological and acute-phase responses associated with delayed-onset muscle soreness in humans. Eur J Appl Physiol 71: 137142
13. Hammond MD, Gale GE, Kapitan KS, Ries A, and Wagner PD (1986). Pulmonary gas exchange in humans during exercise at sea level. J Appl Physiol 60: 15901598
14. Harms CA, McClaran SR, Nickele GA, Pegelow DF, Nelson WB, and Dempsey JA (1998). Exercise-induced arterial hypoxaemia in healthy young women. J Physiol (Lond) 507: 619628
15. Hopkins SR, Schoene RB, Henderson WR, Spragg RG, Martin TR, and West JB (1997). Intense exercise impairs the integrity of the pulmonary blood-gas barrier in elite athletes. Am J Respir Crit Care Med 155: 10901094
16. Hopkins SR, Gavin TP, Siafakas NM, Haseler LJ, Olfert JM, Wagner H, and Wagner PD (1998). Effect of prolonged heavy exercise on pulmonary gas exchange in athletes. J Appl Physiol 85: 15231531
17. Janssen GME, van Wersch JWJ, Kaiser V, and Does JMM (1989). White cell system changes associated with a training period of 1820 months: a transverse and a longitudinal approach. Int J Sports Med 10: S176S180
18. Kaplan A, Baeza M, Reddigari S, and Kuna P (1991). Histaminereleasing factors. Int Arch Allergy Appl Immunol 94: 148153
19. Keen P, McCarthy DA, Passfield L, Shaker HAA, and Wade AJ (1995). Leucocyte and erythrocyte counts during a multi-stage cycling race (the Milk Race). Br J Sports Med 29: 6165
20. Lichtenstein LM and Osler A (1964). Studies of the mechanisms of hypersensitivity phenomena. J Exp Med 120: 507529
21. Morgan DJR, Moodley I, Phillips MJ, and Davies RJ (1983). Plasma histamine in asthmatic and control subjects following exercise: influence of circulating basophils and different assay techniques. Thorax 38: 771777
22. Mucci P, Anselme F, Caillaud C, Couret I, Rossi M, and Prefaut C (1999). Basophil releasability during exercise in young highly trained and older athletes. Med Sci Sports Exerc 31: 507513
23. Mucci P, Prioux J, Hayot M, Ramonatxo M, and Prefaut C (1998). Ventilation response to CO2 and exercise-induced hypoxemia in master athletes. Eur J Appl Physiol 77: 343351
24. Nieman DC, Brendle D, Henson DA, Suttles J, Cook VD, Warren BJ, Butterworth DE, Fagoaga OR, and Nehlsen- Cannarella SL (1995). Immune function in athletes versus nonathletes. Int J Sports Med 16: 329333
25. Powers S, Dodd S, Lawler J, Landry G, Kirtley M, McKnight T, and Grinton S (1988). Incidence of exercise hypoxemia in elite endurance athletes at sea level. Eur J Appl Physiol 58: 298302
26. Prefaut C, Anselme F, Caillaud C, and Masse-Biron J (1994). Exercise-induced hypoxemia in older athletes. J Appl Physiol 76: 120126
27. Prefaut C, Anselme-Poujol F, and Caillaud C (1997). Inhibition of histamine release by nedocromil sodium reduces exercise-induced hypoxemia in master athletes. Med Sci Sports Exerc 29: 1016
28. Prefaut C, Bourgouin Karaouni D, Ramonatxo M, Michel FB, and Macabies J (1988). A one-year double-blind follow-up of blood gas tensions and haemodynamics in almitrine bismesylate therapy. Eur Respir J 1: 4150
29. Sato KT, Kane N, Soos G, Gisolfi C, Kondo N, Sato K (1996). Reexamination of tympanic membrane temperature as a core temperature. J Appl Physiol 80: 12331239
30. Schaffartzik W, Poole DC, Derion T, Tsukimoto K, Hogan MC, Arcos JP, Debout DE, and Wagner PD (1992). VA/Q distribution during heavy exercise and recovery in humans: implications for pulmonary edema. J Appl Physiol 72: 16571667
31. Shephard RJ, Rhind S, and Shek PN (1994). Exercise and the immune system: natural killer cells, interleukins and related responses. Sports Med 18: 340369
32. St Croix CM, Harms CA, McClaran SR, Nickele GA, Pegelow PF, Nelsen WB, and Dempsey JA (1998). Effect of prior exercise on exercise-induced arterial hypoxemia in young women. J Appl Physiol 85: 15561563
33. Subramanian N and Bray MA (1987). Interleukin 1 releases histamine in human basophils and mast cells in vitro. J Immunol 138: 271275
34. Vervloet D, Haddi E, Tafforeau M, Lanteaume A, Kulling G, and Charpin D (1991). Reliability of respiratory symptoms to diagnose atopy. Clin Exp Allergy 21: 733737
35. West GB (1990). Histamine, mast cells and basophils. Chem Immunol 49: 121142