Cambios en la Sensibilidad a la Insulina y Marcadores del Perfil Lipídico Luego de Series Inicial y Secundaria de Múltiples Ejercicios Excéntricos
Trevor C. Chen1, Min-Jyue Huang2, Leonardo C. R. Lima3, ai-Ying Chou1,4, Hung-Hao Wang1, Jui-Hung Tu5, Shi-Che Lin5 y Kazunori Nosaka2
1Department of Physical Education and Sport Sciences, National Taiwan Normal University, Taipei City, Taiwan
2Centre for Human Performance, School of Medical and Health Sciences, Edith Cowan University, Cowan, WA, Australia
3School of Physical Education and Sport of Ribeirão Preto, University of São Paulo, Ribeirão Preto, Brazil
4Department of Athletic Performance, National Taiwan Normal University, Taipei City, Taiwan
5Department of Physical Education, National Pingtung University, Pingtung City, Taiwan
Artículo publicado en el journal PubliCE del año 2022.
Publicado 26 de agosto de 2022
Resumen
INTRODUCCIÓN
El entrenamiento con ejercicios de fuerza induce no sólo adaptaciones musculares, como aumentos en la fuerza y la masa muscular, sino también efectos positivos sobre la sensibilidad a la insulina y el perfil de lípidos en sangre (Tsekouras y cols., 2009; Bacchi y cols., 2012). En general, las adaptaciones crónicas a un entrenamiento físico pueden predecirse mediante respuestas agudas a una sesión de ejercicio (Thompson y cols., 2001). Sin embargo, los cambios en la sensibilidad a la insulina y los marcadores del perfil de lípidos en sangre después de un ejercicio de fuerza agudo no reflejan necesariamente los cambios posteriores al entrenamiento con ejercicios de fuerza. Por ejemplo, Gordon y cols. (2012) informaron que la concentración de glucosa sérica en reposo (∼176%) y el área de insulina bajo la curva (∼82%) aumentaron durante 4 días después del ejercicio de fuerza que constaba de tres series de 10 repeticiones de press de banco, press de piernas, press de hombros, elevación de pantorrillas y tirones en polea alta realizado por adultos mayores sanos sin entrenamiento, lo que indicó una disminución en la sensibilidad a la insulina. En cuanto a los marcadores del metabolismo de los lípidos, Tsekouras y cols. (2009) informaron que la concentración de triglicéridos (TG) en plasma se redujo (-21%) inmediatamente después de los ejercicios de fuerza que consisten en press de piernas, tirón de piernas, flexión de rodilla, extensión de rodilla, press de hombros, dominadas, press de pecho, remo de pie, flexión de cadera, extensión de cadera, abducción de hombro y aducción de hombro realizados por hombres jóvenes sanos, activos y recreativos. Esto sugiere algunos efectos positivos sobre el metabolismo de los lípidos incluso después de una serie de ejercicios de fuerza agudos.
Lee y cols. (2020) informaron que una serie aguda de 50 contracciones excéntricas isocinéticas máximas (20°/seg) de los extensores del tronco aumentó significativamente la concentración de glucosa sérica en reposo en más del 10% y disminuyó los TG en más del 11% a los 2 o 3 días posteriores al ejercicio, pero no se observó tal efecto después de contracciones concéntricas que no indujeron daño muscular. Por lo tanto, es necesario comprender los efectos del daño muscular sobre la sensibilidad a la insulina y el perfil de lípidos en sangre. De hecho, Asp y cols. (1995) sugirieron que la resistencia a la insulina y el deterioro de la resíntesis de glucógeno muscular después del ejercicio excéntrico se asociaron con daño muscular que resultó en una disminución en la concentración de la proteína transportadora de glucosa 4 (GLUT-4) en el músculo. Las contracciones excéntricas podrían alterar mecánicamente la membrana plasmática del músculo y la red de túbulos T (Cooper y McNeil, 2015), lo que podría afectar a los transportadores de sustrato transmembrana como el GLUT-4. Sidky y cols. (2022) informaron recientemente que la distrofina (+136%), el β-sarcoglicano (+56%) y la junctofilina (+58%) en el tibial anterior y el extensor largo de los dedos de los ratones aumentaban después de seis turnos de 50 contracciones excéntricas máximas realizadas in vivo cada 7 días entre los turnoss. Es posible que la integridad de la membrana se fortalezca incluso después de la sesión de ejercicio excéntrico inicial, reduciendo los efectos negativos del daño muscular inducido por el ejercicio excéntrico sobre los transportadores de glucosa y la eliminación de la glucosa intracelular. Es bien sabido que la magnitud del daño muscular se atenúa sustancialmente cuando se repite el mismo ejercicio excéntrico durante varias semanas, lo que se conoce como el efecto de serie repetida (Hirose y cols., 2004; Smith y cols., 2007; Hubal y cols., 2008; Hyldahl y cols., 2017). Por lo tanto, es importante comparar la primera y la segunda serie de ejercicios excéntricos en cuanto a los cambios agudos en la sensibilidad a la insulina y los marcadores del perfil lipídico, con el fin de comprender mejor los efectos agudos del ejercicio excéntrico sobre el metabolismo de la glucosa y los lípidos.
MATERIALES Y MÉTODOS
Participantes y diseño del estudio
Los detalles del estudio, excepto las medidas de sangre específicas del presente estudio, se pueden encontrar en un estudio anterior (Chen y cols., 2019b). Brevemente, se reclutaron 15 hombres jóvenes sedentarios (media ±SD de edad: 21.5±1.6 años, altura: 173.2±5.2 cm, masa corporal: 72.6±15.6 kg), quienes dieron su consentimiento informado para participar en el estudio que había sido aprobado por un Comité de Ética del Instituto de Investigación. El estudio se realizó de conformidad con la declaración de política sobre el uso de sujetos humanos de la Declaración de Helsinki.
Los participantes realizaron dos series de 9 ejercicios excéntricos (EC1 y EC2) consistentes en curl de brazos (músculos objetivo: flexores de codo), extensión de brazos (extensores de codo), press de pecho (pectoral), extensión de piernas (extensores de rodilla), curl de piernas (flexores de rodilla), elevación de pantorrillas de pie (flexores plantares), tirón de polea alta (dorsal), contracción abdominal (abdominales) y extensión de la espalda (erector de la columna) en nueve máquinas de entrenamiento de fuerza diferentes (Cybex International, Inc., Owatonna, MN., Estados Unidos), con 2 semanas entre turnos (Chen y cols., 2019b). Para cada ejercicio, la carga se fijó en el 80% de la fuerza de MVC y se realizaron 5 series de 10 contracciones excéntricas con un descanso de 15 seg entre contracciones y un descanso de 2 min entre series. Para minimizar la fatiga neuromuscular por contracciones concéntricas, la fase concéntrica fue asistida por uno o dos investigadores. Cada contracción excéntrica duró 5 seg guiada por el investigador que contaba "0, 1, 2, 3, 4, 5" para el movimiento. Los participantes resistieron la carga desde una longitud muscular corta (es decir, el ángulo inicial) hasta una longitud muscular larga (es decir, el ángulo final), y después de cada contracción al final del rango de movimiento, el investigador reinició la máquina a la posición inicial mientras los participantes se relajaban.
Análisis de sangre
Los análisis de sangre consistieron en actividad de CK en plasma, glucosa en suero, insulina, HOMA, TG, TC, LDLC, concentraciones de HDLC, así como la relación TC/HDLC. Las muestras de sangre se recogieron después de 10 horas de ayuno entre las 7:00 y las 9:00 a. m., excepto en el punto de tiempo de 2 horas después del ejercicio. La muestra de sangre se extrajo mediante una técnica estándar de venopunción de la región de la fosa cubital del brazo a dos tubos de 5 ml; uno con ácido etilendiaminotetraacético (Becton Dickinson and Company, Plymouth, Reino Unido) y otro tubo de separación de suero. La sangre se coaguló a temperatura ambiente para la muestra de suero, y los tubos se centrifugaron a 3.000 rpm durante 10 minutos para obtener plasma y suero, respectivamente, y las muestras se separaron en varios tubos y se almacenaron a -80 °C hasta su análisis.
La actividad de la CK en plasma se analizó espectrofotométricamente mediante un analizador de química clínica automatizado (Modelo 7080; Hitachi, Co. Ltd., Tokio, Japón) utilizando un kit de prueba disponible comercialmente (por ej., Chou y cols., 2018; Chen y cols.., 2019a, Chen y cols.., 2019b; Kang y cols.., 2022). La concentración de glucosa sérica se analizó con un analizador químico Beckman Unicel DxC 600/800 (Beckman Coulter Inc., Fullerton, CA, Estados Unidos de América) utilizando un kit disponible comercialmente (GLUCm) (p. ej., Smith y cols., 2020; Tsai y cols., 2021). La concentración de insulina sérica se analizó mediante un kit de ensayo inmunorradiométrico (kit INS-IRMA; Biosource, Nivelles, Bélgica) utilizando un sistema de contador gamma (MIC Group, Inc., Ramsey, MN, Estados Unidos de América) (por ej., Chen y cols., 2017a; Lee y cols., 2018). El HOMA se calculó como insulina en ayunas (μU/ml) glucosa en ayunas (mmol/l)/22,5 (Paschalis y cols., 2011; Chen y cols., 2017a). Los rangos de referencia normales para la glucosa y la insulina fueron de 3.9 a 5.6 mmol/l y de 28.6 a 114.3 pmol/l, respectivamente, según la información del fabricante.
Los parámetros del perfil de lípidos en sangre consistieron en concentraciones séricas de TG, TC, HDLC, LDLC y la relación TC/LDHC (por ej., Paschalis y cols., 2011; Kuo y cols., 2020; Cheng y cols., 2022). Estas medidas se realizaron con un analizador químico Beckman Unicel DxC 600/800 utilizando kits comerciales (Beckman Coulter, Inc., Brea, CA, Estados Unidos), y se calculó la relación TC/HDLC (considerado un índice aterogénico) (Paschalis y cols., 2011). Los rangos de referencia de TG, TC, HDLC y LDLC fueron <1.6 mmol/L, <5.2 mmol/L, ≥1.6 mmol/L y <2.6 mmol/L, respectivamente, según la información del fabricante.
La confiabilidad test-retest de cada medida se determinó mediante el coeficiente de variación (CV) que se puede encontrar en estudios anteriores (Chen y cols., 2017a; Chen y cols., 2017b; Chen y cols., 2021). El CV de las concentraciones de la actividad de la CK en plasma, glucosa sérica, insulina, HOMA, TG, TC, HDLC y LDLC, así como la relación TC/HDLC fue 8.0%, 5.3%, 0.4%, 7.1%, 3.7%, 1.8%, 7.0%, 1.8% y 3.7%, respectivamente.
Análisis estadístico
Los valores de referencia de las medidas de sangre antes de EC1 y EC2 se compararon mediante t-tests apareados. Los cambios en la actividad de la CK plasmática y las concentraciones séricas de glucosa, insulina, HOMA, TG, TC, HDLC y LDLC, así como la relación TC/LDHC a lo largo del tiempo, se compararon entre EC1 y EC2 mediante un análisis de varianza de medidas repetidas de dos vías (ANOVA). Cuando se encontró un efecto de interacción significativo, se realizó una prueba post-hoc de Tukey. Los valores de eta-cuadrado (η2) se calcularon como medidas del tamaño del efecto y se consideraron ∼0.02 como efecto pequeño, ∼0.13 como efecto medio y >0.26 como efecto grande (Bakeman, 2005). Además, se utilizó un ANOVA unidireccional de medidas repetidas para examinar los cambios en las medidas de la sangre antes, 2 hs y 1–5 días después de cada serie de ejercicio. Se usaron los coeficientes de correlación producto-momento de Pearson para evaluar las relaciones entre la actividad máxima de la CK en plasma y los cambios máximos en las concentraciones séricas de glucosa, insulina, HOMA, TG, TC, HDLC y LDLC, así como la relación TC/LDHC después de EC1 (n = 15) y de EC2 (n = 15) por separado, y de EC1 y de EC2 agrupándolos (N = 30). Se fijó un nivel de significación en p ≤0.05 para todos los análisis. Los datos se presentaron como media ± desviación estándar (SD).
RESULTADOS
Mediciones de referencia
No se observaron diferencias significativas (p >0.05) en los valores basales de las concentraciones séricas de TG, TC, HDLC y LDHC, así como la relación TC/HDLC entre las series (Figuras 1D-H). Sin embargo, las concentraciones séricas de glucosa (4.81±0.38 mmol/L) e insulina (21.8±6.3 pmol/L), así como el HOMA (2.10±0.49) antes de EC2 fueron significativamente (p <0.05) más pequeñas que antes de EC1 (glucosa: 5.00±0.33 mmol/L, insulina: 25.2±6.3 pmol/L, HOMA: 2.64±0.46) (Figuras 1A–C).
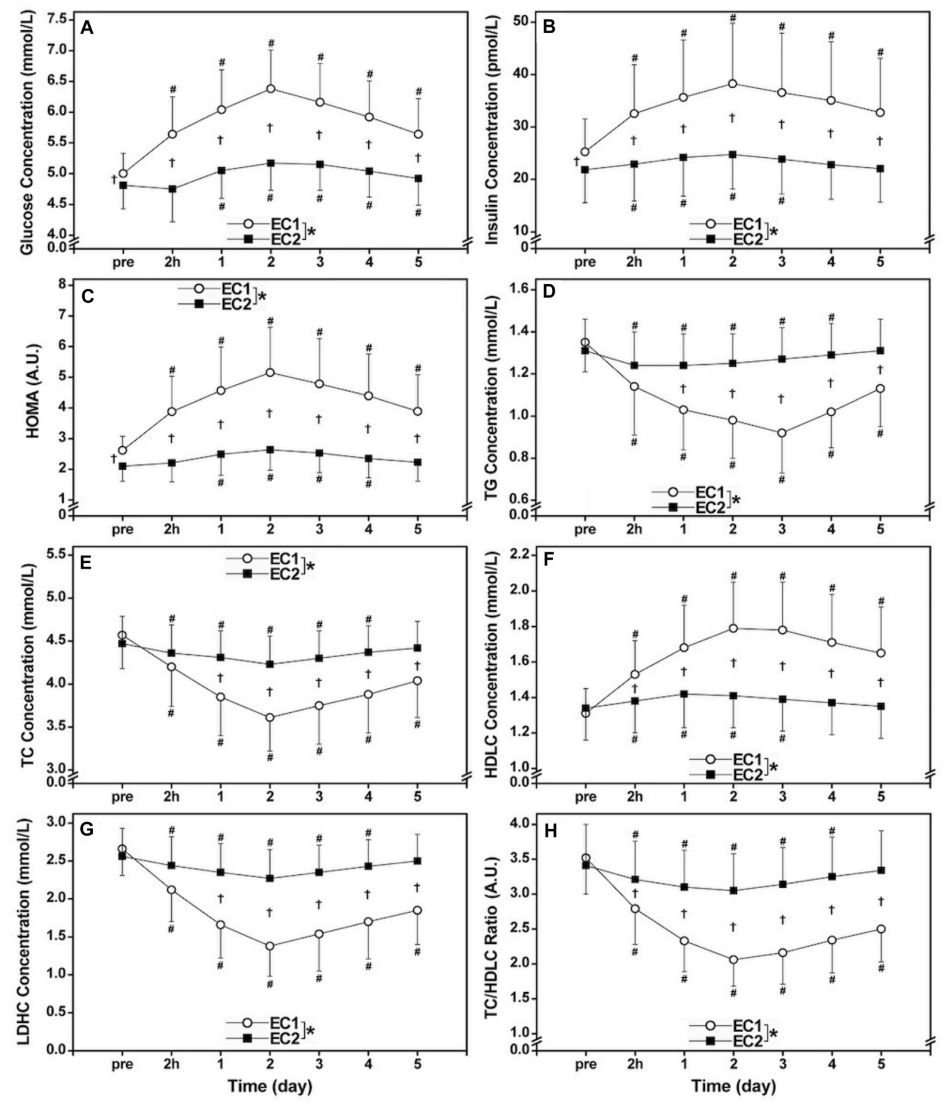
Figura 1. Cambios (media ±SD) en glucosa sérica (A), insulina (B) y evaluación del modelo de homeostasis (HOMA, (C), triglicéridos [TG, (D)], total [TC, (E)] y concentraciones de colesterol de lipoproteínas de alta [HDLC, (F)] y de baja densidad [LDLC, (G)], así como la relación TC/HDLC (H) antes (pre) y 2 hs (2 hs), 1, 2, 3 , 4 y 5 días (1–5) después de la primera serie (EC1) y la segunda serie (EC2) de ejercicios excéntricos para todo el cuerpo.* diferencia significativa (p <0.05) entre EC1 y EC2 basada en el efecto de interacción mostrado por el ANOVA.† diferencia significativa (p <0.05) entre turnos para cada punto de tiempo basado en la prueba post hoc. #diferencia significativa (p <0.05) desde la línea de base.
Cambios en la sensibilidad a la insulina y los marcadores del perfil lipídico después del ejercicio
La Figura 1 comparó entre EC1 y EC2 para los cambios en las concentraciones séricas de glucosa, insulina, HOMA, TG, TC, HDLC y LDLC, así como la relación TC/LDHC. Glucosa sérica (EC1: η2 = 0.787, EC2: η2 = 0.686), insulina (EC1: η2 = 0.693, EC2: η2 = 0.535), HOMA (EC1: η2 = 0.768, EC2: η2 = 0.712), TG (EC1: η2 = 0.767, EC2: η2 = 0.715), TC (EC1: η2 = 0.831, EC2: η2 = 0.479), HDLC (EC1: η2 = 0.689, EC2: η2 = 0.595) y LDHC (EC1: η2 = 0.818, EC2: η2 = 0.513) y la relación TC/HDLC (EC1: η2 = 0.788, EC2: η2 = 0.597) cambiaron significativamente (p <0.001) después de ambos turnos (Figura 1). Sin embargo, los cambios en glucosa (efecto de interacción η2 = 0.663), insulina (η2 = 0.639), HOMA (η2 = 0.754), TG (η2 = 0.762), TC (η2 = 0.669), HDLC (η2 = 0.663), LDHC (η2 = 0.780) y la relación TC/HDLC (η2 = 0.708) fueron significativamente (p <0.001) menores después de EC2 que EC1.
Correlaciones entre los cambios en la CK máxima y otras medidas
La Figura 2 muestra las relaciones entre la actividad máxima de la CK en plasma y los cambios máximos en las concentraciones séricas de glucosa, insulina, HOMA, TC, TG, HDLC y LDLC, así como la relación TC/HDLC. Al centrarse sólo en EC1 (n = 15), se encontró una correlación significativa (p <0.01) entre la actividad máxima de la CK plasmática y la glucosa máxima (r = 0.793), insulina (r = 0.965), HOMA (r = 0.944), Concentraciones de TC (r = −0.755), TG (r = −0.723), HDLC (r = 0.830) y LDLC (r = −0.778), así como la relación TC/HDLC (r = −0.882). En cuanto a EC2 sólo (n = 15), también se observó una correlación significativa (p <0.05) entre la actividad máxima de la CK plasmática y la glucosa máxima (r = 0.530), insulina (r = 0.540), HOMA (r = 0.569), TG (r = −0.538), concentraciones de HDLC (r = 0.555), pero no se encontró una corrección significativa entre la actividad máxima de la CK plasmática y el pico de TC (r = −0.451, p = 0.092) y concentraciones de LDLC (r = −0.472, p = 0.076), así como la relación TC/HDLC (r = −0.501, p = 0.057). Cuando se agruparon los datos de EC1 y EC2 (N = 30), aún eran evidentes correlaciones significativas (p <0.001) entre la actividad máxima de la CK plasmática y la glucosa máxima (r = 0.880), insulina (r = 0.938), HOMA (r = 0.943), concentraciones de TG (r = −0.895), TC (r = −0.856), HDLC (r = 0.888) y LDHC (r = −0.881), así como la relación TC/HDLC (r = −0.919) después de EC1 y EC2.
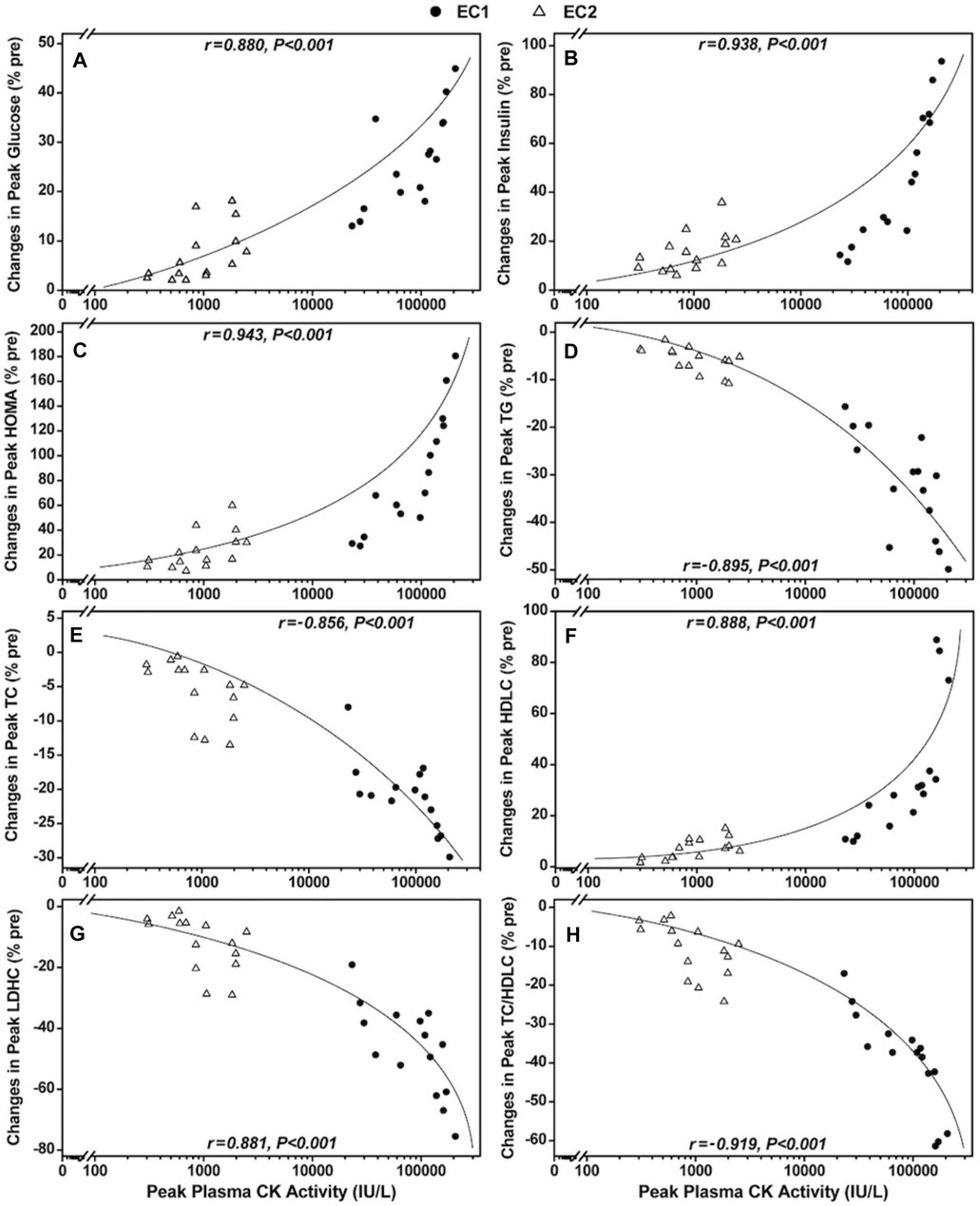
Figura 2. Correlaciones entre la actividad máxima de la creatina quinasa (CK) plasmática y los cambios máximos en la glucosa sérica (A), insulina (B), evaluación del modelo de homeostasis [HOMA, (C)], triglicéridos [TG, (D)], colesterol total [TC, (E)] y colesterol de baja densidad [LDLC, (F)] y colesterol de alta densidad [HDLC, (G)], así como la relación TC/HDLC (H) y luego del primero (●) y el segundo (∆) turno de ejercicios excéntricos de cuerpo completo (N = 30).
Discusión
Los principales hallazgos del presente estudio fueron los siguientes. 1) Los cambios en toda la sensibilidad a la insulina (concentraciones de glucosa e insulina, HOMA) y marcadores de lípidos (concentraciones de TG, TC, HDLC y LDHC, relación TC/HDLC) fueron significativamente mayores después del EC1 que EC2, aunque los cambios después de EC2 siguieron siendo significativos (Figura 1). 2) La actividad máxima de la CK en plasma se correlacionó significativamente con los cambios máximos en la sensibilidad a la insulina y los marcadores de lípidos (Figura 2). Estos resultados respaldaron la hipótesis de que los cambios en la sensibilidad a la insulina y los marcadores de lípidos serían mayores después de EC1 que EC2.
Sensibilidad a la insulina
La magnitud de los aumentos máximos en glucosa (26%), insulina (46%) y HOMA (86%) después de EC1 fue significativamente mayor que después de EC2 (7%, 15% y 24%, respectivamente), como se muestra en las Figuras 1A -C. Green y cols. (2010) informaron aumentos significativos en la insulina (38%) y el área de glucosa bajo la curva (21%) 2 días después de la primera tanda de carrera en descenso de 30 min, pero no después de la segunda tanda que se realizó 2 semanas después. Especularon que los aumentos en la insulina y la glucosa después de la primera sesión de ejercicio se debieron a una falla en la disposición adecuada de la glucosa en la sangre debido al daño muscular. Cabe señalar que la magnitud de los aumentos en la glucosa, la insulina y el HOMA después de EC1 en el presente estudio fue mayor que después de una serie aguda de ejercicio excéntrico bilateral de flexores de rodilla (glucosa: 6%, insulina: 18%, HOMA: 22%) (Paschalis y cols., 2011) o ejercicio excéntrico extensor del tronco (glucosa: 12%, insulina: 18%, HOMA: 22%) (Lee y cols., 2020). Los mayores aumentos de glucosa, insulina y HOMA en el presente pueden estar asociados con el mayor daño muscular indicado por los aumentos mucho mayores en la actividad de la CK plasmática (pico: 101.668 UI/L), en comparación con los de los estudios previos (<3.000 UI/L) (Paschalis y cols., 2011; Lee y cols., 2020). Es probable que más músculos y membranas plasmáticas musculares se hayan visto afectados por los ejercicios de todo el cuerpo, lo que redujo en mayor medida la disponibilidad de glucosa a los músculos esqueléticos. Es importante tener en cuenta que los aumentos en las concentraciones de glucosa e insulina en plasma y en HOMA aumentaron después de EC2. Si se considera que estos cambios representan una disminución de la sensibilidad a la insulina, la sensibilidad a la insulina disminuyó de forma aguda después de EC2, aunque su extensión fue mucho menor que después de EC1.
Como se muestra en la Figura 2, también se encontraron correlaciones significativas entre la actividad máxima de la CK en plasma y los marcadores de sensibilidad a la insulina (glucosa, insulina, HOMA). Esto sugiere que cuanto mayor sea la magnitud del daño de la membrana muscular (Brancaccio y cols., 2007), mayor será la magnitud del aumento de la resistencia a la insulina. Es posible que el daño de la membrana muscular afecte a los transportadores de sustrato transmembrana (Cooper y McNeil, 2015). Asp y cols. (1995) informaron que aumentos significativos en el nivel de glucosa en sangre en 1 día (+14%) después del ejercicio de ciclismo excéntrico de una pierna, junto con disminuciones significativas en la concentración muscular de la proteína transportadora de glucosa GLUT-4 (-44%--46%) y concentraciones de glucógeno muscular (−11%–17%) a los 1–2 días e inmediatamente a 2 días después del ejercicio, respectivamente. Ellos afirmaron que la resistencia a la insulina y la resíntesis de glucógeno muscular deteriorada después del ejercicio excéntrico se asociaron con una disminución en la concentración de la proteína GLUT-4 en el músculo. Es posible que la mayor disminución en la sensibilidad a la insulina (o los aumentos en la resistencia a la insulina) después de EC1 que EC2 se deba al transporte deficiente de glucosa a las células musculares asociado con disminuciones en las concentraciones de GLUT-4 en los músculos después del ejercicio excéntrico. Aoi y cols. (2013) afirmaron que la disminución de la utilización de glucosa fue causada por la disminución de la captación de glucosa estimulada por la insulina en los músculos dañados con la inhibición de la translocación de la membrana de la GLUT-4 y de las citocinas inflamatorias, las especies reactivas de oxígeno, incluido el 4-hidroxi-2-nonenal y el peroxinitrato que inducen la degradación o inactivación de las proteínas de señalización a través de la modificación post-traduccional, lo que da como resultado una alteración en la transducción de la señal de la insulina. Sidky y cols. (2022) mostraron aumentos en la distrofina, la β-sarcoglicano y la junctofilina en los músculos de las patas traseras de ratones después de series repetidas de 50 contracciones excéntricas máximas y concluyeron que el aumento de la distrofina, la β-sarcoglicano y la junctofilina reducía la tensión de la membrana inducida por la contracción excéntrica. Si este también es el caso para humanos, parece posible que el mantenimiento de la integridad de la membrana después del EC2 redujera las interrupciones del receptor de insulina y mantuviera las funciones de los transportadores de glucosa y la eliminación de glucosa intracelular.
Perfil lipídico
Los cambios en TC (−20%), TG (−32%), HDLC (35%), LDHC (−47%), relación TC/HDLC (−39%) después de EC1 fueron significativamente mayores que después de EC2 (−6%, −6%, 7%, −12% y −11%, respectivamente) como se muestra en las Figuras 1D–H. Estos resultados coincidieron con los hallazgos de Nikolaidis y cols. (2008) quienes demostraron que la magnitud de los cambios en TC (pico: −14%), TG (−18%), LDHC (−25%) y relación TC/HDLC (−20%) después de un EC1 de los flexores unilaterales de rodilla fueron significativamente mayores que después de EC2 (-10%, -8%, -18% y -15%, respectivamente), sin diferencias en el HDLC entre turnos (7-8%). Los autores especularon que la disminución en la concentración sérica de TG después de EC1 se asoció con el aumento de la actividad de la lipoproteína lipasa (LPL) que actuó sobre las partículas de lipoproteína que pasaban a través de los capilares, liberando ácidos grasos libres que podrían ser captados por el músculo esquelético y esterificados en fosfolípidos y TG intramusculares u oxidados en las mitocondrias (Nikolaidis y cols., 2008). El aumento de la actividad de la LPL está relacionado con el aumento de la demanda de ácidos grasos del músculo activo como sustrato productor de energía y con la reposición de los depósitos de fosfolípidos y de TG del músculo con ácidos grasos para la regeneración de las fibras musculares dañadas (Jansson y Kaijser, 1987; Oscai y cols., 1990). Además, la disminución de los niveles séricos de TG después de EC1 puede deberse a los niveles más altos de gasto energético en reposo que dura varios días después del ejercicio excéntrico (Dolezal y cols., 2000; Hackney y cols., 2008), donde existe una mayor necesidad de energía de trifosfato de adenosina principalmente para la regeneración de las fibras musculares dañadas y/o para la formación de nuevas fibras musculares a partir de células satélite.
Nikolaidis y cols. (2007) informaron que el glutatión (GSH: -40% vs -19%) y la relación GSH/glutatión oxidado (GSSG: -63% vs -43%) disminuyeron más después de la primera que de la segunda serie de ejercicio excéntrico de los flexores de la rodilla, mientras que el GSSG (+54% vs +33%), sustancias reactivas al ácido tiobarbitúrico (+73% vs +25%), proteínas carbonilo (+82% vs +32%), catalasa (+70% vs +22 %), ácido úrico, (+15% vs +4%), bilirrubina (+21% vs +8%) y la capacidad antioxidante total (+48% vs +17%) aumentaron menos después del primero que el segundo turno de ejercicio. Demostraron que el estrés oxidativo fue mayor después de EC1 que EC2. Nikolaidis y cols. (2008) especularon que los cambios más favorables en el perfil de lípidos después del primer ejercicio excéntrico que del segundo, estaban relacionados con el mayor estrés oxidativo después de la primera sesión de ejercicio. Por lo tanto, el daño muscular parece inducir temporalmente efectos favorables sobre el perfil de lípidos en sangre.
Como se muestra en las Figuras 2D-H, se encontraron correlaciones significativas entre la actividad máxima de la CK y todos los marcadores del perfil lipídico. Cuanto mayor sea la actividad máxima de la CK, mayores serán los cambios en los perfiles de lípidos en una mejor dirección. Dado que el colesterol constituye aproximadamente el 13% de las membranas musculares (Guyton, 1981), puede ser que las disminuciones en las concentraciones séricas de TC y de LDLC después del ejercicio excéntrico estuvieran asociadas con la salida de colesterol del plasma en la síntesis muscular que promueve la síntesis de nuevas membranas celulares (Nikolaidis y cols., 2008; Paschalis y cols., 2010). Por lo tanto, las concentraciones séricas reducidas de TC y de LDLC observadas después del EC2 (Figuras 1E, F) pueden deberse, al menos en parte, al menor daño muscular porque se necesitarían menos moléculas de colesterol para el proceso de reparación que tiene lugar en la célula muscular dañada. Parece que el daño muscular es favorable para los cambios en el perfil de lípidos en sangre de forma aguda, pero se debe tener en cuenta que el perfil de lípidos en sangre cambia en una dirección favorable incluso después del ejercicio excéntrico sin daño muscular como se muestra en la segunda serie de ejercicio excéntrico (sin aumento significativo en la actividad plasmática de la CK). Por lo tanto, no significa que el daño muscular sea bueno para mejorar el perfil de lípidos en sangre.
Aplicación práctica
Es interesante que los efectos del daño muscular sobre los marcadores de lípidos fueron en dirección de respuestas favorables, en contraste con los marcadores de glucosa que mostraron respuestas desfavorables. Cabe señalar que los cambios favorables o desfavorables después del ejercicio excéntrico encontrados en el presente estudio fueron respuestas agudas, y las variables tanto de sensibilidad a la insulina como de marcadores del perfil lipídico regresaron a los niveles previos al ejercicio en 2 semanas antes de realizar el EC2 (Figura 1). Por lo tanto, incluso si el daño muscular produce respuestas favorables del perfil de lípidos en sangre, no significa necesariamente que sea mejor dañar los músculos para mejorar el perfil de lípidos en sangre. Aunque los cambios fueran menores, el EC1 cambió los marcadores de lípidos en una dirección favorable y, lo que es más importante, los cambios en los marcadores de la sensibilidad a la insulina fueron mucho menores después del EC2 (Figura 1).
Varios estudios han demostrado que el entrenamiento con ejercicios excéntricos sin daño muscular mejora la sensibilidad a la insulina y el perfil de lípidos en sangre (Chen y cols., 2017a; Chen y cols., 2017b; Drexel y cols., 2021). Por ejemplo, Chen y cols. (2017b) informaron que el entrenamiento de la fuerza excéntrica progresivo de los extensores de la rodilla durante 12 semanas disminuyó los niveles de reposo de insulina, glucosa, HOMA y OGTT, y disminuyó TG y TC. La mejora de la sensibilidad a la insulina después del entrenamiento excéntrico crónico puede estar relacionada con el aumento de la oxidación de las grasas (Paschalis y cols., 2011). Dado que el ejercicio de fuerza excéntrica produce menos estrés cardiovascular (Meyer y cols., 2003) y menos fatiga (Horstmann y cols., 2001) que el ejercicio de fuerza concéntrica, el ejercicio de fuerza excéntrica puede ser una modalidad de ejercicio más adecuada para personas con problemas de resistencia, como pacientes con enfermedades crónicas. Es interesante investigar un efecto a largo plazo de los ejercicios excéntricos para todo el cuerpo sobre la sensibilidad a la insulina y el perfil de lípidos.
Limitaciones del estudio
Hubo varias limitaciones en el presente estudio. En primer lugar, el presente estudio utilizó un número relativamente menor de hombres jóvenes sanos sedentarios, por lo que los hallazgos del presente estudio no podrían generalizarse a otras poblaciones. En segundo lugar, en el presente estudio no se controló la composición corporal, la ingesta diaria de alimentos ni los niveles de actividad física. Es posible que estos factores también afectaran las medidas del resultado. En tercer lugar, el presente estudio sólo analizó la sensibilidad a la insulina en sangre y los marcadores del perfil lipídico en relación con la actividad de la CK en plasma como marcador de daño muscular. Es interesante investigar las relaciones entre otros marcadores de daño muscular como la función muscular y el dolor muscular y la sensibilidad a la insulina en sangre y los marcadores del perfil lipídico. Sin embargo, parece que la actividad de la CK en plasma representa bien el daño de la membrana plasmática del músculo. La técnica de biopsia muscular para examinar los cambios histológicos en las fibras musculares y la medición de marcadores de energía como la adiponectina son necesarias para comprender los mecanismos que sustentan los efectos del daño muscular en el metabolismo de la glucosa y los lípidos. En cuarto lugar, no hubo un grupo de control o de comparación (por ej., ejercicio concéntrico) en el presente estudio. Por lo tanto, no se sabe si los cambios en la sensibilidad a la insulina en sangre y los marcadores del perfil de lípidos fueron peculiares del ejercicio excéntrico, y cómo los ejercicios concéntricos de todo el cuerpo afectan en los marcadores. Por último, no se sabe si los ejercicios excéntricos para todo el cuerpo son más efectivos que otros ejercicios excéntricos, cuando se realizan regularmente durante un período de tiempo más prolongado (es decir, entrenamiento), para mejorar la sensibilidad a la insulina y el perfil lipídico.
Conclusión
El presente estudio mostró que cuanto mayor es la magnitud del daño muscular inducido por el ejercicio excéntrico, más efectos negativos sobre los marcadores de la sensibilidad a la insulina pero efectos más favorables sobre los marcadores del perfil de lípidos en sangre. Se justifican más estudios para investigar cómo les afectó el daño muscular, los mecanismos que sustentan el efecto de las sesiones repetidas sobre la sensibilidad a la insulina y los marcadores de lípidos, y los efectos del entrenamiento con ejercicios excéntricos para todo el cuerpo sobre la obesidad, el síndrome metabólico, la diabetes mellitus tipo 2 y otros trastornos metabólicos.
Declaración de Ética
Los estudios con participantes humanos fueron revisados y aprobados por el Comité de Ética de Investigación de la Universidad Normal Nacional de Taiwán. Los pacientes/participantes dieron su consentimiento informado por escrito para participar en este estudio.
Financiamiento
Este trabajo fue apoyado financieramente por el Ministerio de Ciencia y Tecnología (MOST 108-2410-H-003-116-MY3) y el Proyecto Sprout de Educación Superior del Ministerio de Educación (MOE) en Taiwán. La financiación fue recibida por TC. Sin embargo, los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la interpretación de los datos y la redacción del manuscrito, la decisión de publicar o la preparación del manuscrito.
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de interés.
Agradecimientos
Nos gustaría agradecer a los participantes del estudio por su tiempo y esfuerzo.
Referencias
1. Aoi W., Naito Y., Yoshikawa T. (2013). Role of Oxidative Stress in Impaired Insulin Signaling Associated with Exercise-Induced Muscle Damage. Free Radic. Biol. Med. 65, 1265–1272.
2. Asp S., Daugaard J. R., Richter E. A. (1995). Eccentric Exercise Decreases Glucose Transporter GLUT4 Protein in Human Skeletal Muscle. J. Physiol. 482 ( Pt 3) (Pt 3), 705–712.
3. Bacchi E., Negri C., Zanolin M. E., Milanese C., Faccioli N., Trombetta M., et al. (2012). Metabolic Effects of Aerobic Training and Resistance Training in Type 2 Diabetic Subjects. Diabetes Care 35 (4), 676–682.
4. Bakeman R. (2005). Recommended Effect Size Statistics for Repeated Measures Designs. Behav. Res. Methods 37 (3), 379–384.
5. Brancaccio P., Maffulli N., Limongelli F. M. (2007). Creatine Kinase Monitoring in Sport Medicine. Br. Med. Bull. 81-82, 209–230.
6. Chen H.-Y., Chen Y.-C., Tung K., Chao H.-H., Wang H.-S. (2019a). Effects of Caffeine and Sex on Muscle Performance and Delayed-Onset Muscle Soreness after Exercise-Induced Muscle Damage: a Double-Blind Randomized Trial. J. Appl. Physiology 127 (3), 798–805.
7. Chen T. C.-C., Tseng W.-C., Huang G.-L., Chen H.-L., Tseng K.-W., Nosaka K. (2017b). Superior Effects of Eccentric to Concentric Knee Extensor Resistance Training on Physical Fitness, Insulin Sensitivity and Lipid Profiles of Elderly Men. Front. Physiol. 8, 209.
8. Chen T. C., Hsieh C.-C., Tseng K.-W., Ho C.-C., Nosaka K. (2017a). Effects of Descending Stair Walking on Health and Fitness of Elderly Obese Women. Med. Sci. Sports Exerc. 49 (8), 1614–1622.
9. Chen T. C., Huang T.-H., Tseng W.-C., Tseng K.-W., Hsieh C.-C., Chen M.-Y., et al. (2021). Changes in Plasma C1q, Apelin and Adropin Concentrations in Older Adults after Descending and Ascending Stair Walking Intervention. Sci. Rep. 11 (1), 17644.
10. Chen T. C., Yang T. J., Huang M. J., Wang H. S., Tseng K. W., Chen H. L., et al. (2019b). Damage and the Repeated Bout Effect of Arm, Leg, and Trunk Muscles Induced by Eccentric Resistance Exercises. Scand. J. Med. Sci. Sports 29 (5), 725–735.
11. Cheng H.-C., Tsai S.-H., Liu H.-W. (2022). Activation of Inflammatory Pathways in PBMCs Linking Type 2 Diabetes in Older Adults without Obesity. Exp. Gerontol. 163, 111779.
12. Chou Y. C., Chen H. L., Chen T. C., Lin M. J. (2018). Eccentric Exercise-Induced Different Magnitude of Variability in Blood Creatine Kinase and Indirect Markers of Muscle Damage. Phys. Educ. J. 51 (1), 13–24.
13. Clarkson P. M., Kearns A. K., Rouzier P., Rubin R., Thompson P. D. (2006). Serum Creatine Kinase Levels and Renal Function Measures in Exertional Muscle Damage. Med. Sci. Sports Exerc. 38 (4), 623–627.
14. Cooper S. T., McNeil P. L. (2015). Membrane Repair: Mechanisms and Pathophysiology. Physiol. Rev. 95 (4), 1205–1240.
15. Dolezal B. A., Potteiger J. A., Jacobsen D. J., Benedict S. H. (2000). Muscle Damage and Resting Metabolic Rate after Acute Resistance Exercise with an Eccentric Overload. Med. Sci. Sports Exerc. 32 (7), 1202–1207.
16. Drexel H., Mader A., Saely C. H., Tautermann G., Dopheide J. F., Vonbank A. (2021). Downhill Hiking Improves Low-Grade Inflammation, Triglycerides, Body Weight and Glucose Tolerance. Sci. Rep. 11, 14503.
17. Gordon B. A., Fraser S. F., Bird S. R., Benson A. C. (2012). Insulin Sensitivity in Response to a Single Resistance Exercise Session in Apparently Healthy Individuals. J. Endocrinol. Investig.. 35 (7), 665–669.
18. Green M. S., Doyle J. A., Ingalls C. P., Benardot D., Rupp J. C., Corona B. T. (2010). Adaptation of Insulin-Resistance Indicators to a Repeated Bout of Eccentric Exercise in Human Skeletal Muscle. Int. J. Sport Nutr. Exerc. Metab. 20, 181–190.
19. Gunst J. J., Langlois M. R., Delanghe J. R., de Buyzere M. L., Leroux-Roels G. G. (1998). Serum Creatine Kinase Activity Is Not a Reliable Marker for Muscle Damage in Conditions Associated with Low Extracellular Glutathione Concentration. Clin. Chem. 44 (5), 939–943.
20. Guyton A. (1981). Text Book of Medical Physiology. 6th ed.. Philadelphia (PA: WB Saunders.
21. Hackney K. J., Engels H.-J., Gretebeck R. J. (2008). Resting Energy Expenditure and Delayed-Onset Muscle Soreness after Full-Body Resistance Training with an Eccentric Concentration. J. Strength Cond. Res. 22 (5), 1602–1609.
22. Hirose L., Nosaka K., Newton M., Laveder A., Kano M., Peake J., et al. (2004). Changes in Inflammatory Mediators Following Eccentric Exercise of the Elbow Flexors. Exerc. Immunol. Rev. 10, 75–90.
23. Horstmann T., Mayer F., Maschmann J., Niess A., Roecker K., Dickhuth H.-H. (2001). Metabolic Reaction after Concentric and Eccentric Endurance-Exercise of the Knee and Ankle. Med. Sci. Sports Exerc. 33 (5), 791–795.
24. Hubal M. J., Chen T. C., Thompson P. D., Clarkson P. M. (2008). Inflammatory Gene Changes Associated with the Repeated-Bout Effect. Am. J. Physiology-Regulatory, Integr. Comp. Physiology 294 (5), R1628–R1637.
25. Hyldahl R. D., Chen T. C., Nosaka K. (2017). Mechanisms and Mediators of the Skeletal Muscle Repeated Bout Effect. Exerc. Sport Sci. Rev. 45 (1), 24–33.
26. Jansson E., Kaijser L. (1987). Substrate Utilization and Enzymes in Skeletal Muscle of Extremely Endurance-Trained Men. J. Appl. Physiology 62 (3), 999–1005.
27. Kang H.-Y., Fu S.-K., Chan C.-W., Chang C.-C., Wang C.-F., Tseng W.-C. (2022). Long-term Upper Arm Immobilization Can Increase the Magnitude of Eccentric Exercise–Induced Muscle Damage. Phys. Educ. J. (2), 0003.
28. Kuo Y.-C., Chang H.-L., Cheng C.-F., Mündel T., Liao Y.-H. (2020). Six-week Inspiratory Resistance Training Ameliorates Endurance Performance but Does Not Affect Obesity-Related Metabolic Biomarkers in Obese Adults: a Randomized Controlled Trial. Respir. Physiology Neurobiol. 273, 103285.
29. Lee C.-L., Kuo Y.-H., Cheng C.-F. (2018). Acute High-Intensity Interval Cycling Improves Postprandial Lipid Metabolism. Med. Sci. Sports Exerc. 50 (8), 1687–1696.
30. Lee H.-S., Akimoto T., Kim A.-R. (2020). Effects of Trunk Extensor Eccentric Exercise on Lipid Profile and Glycaemic Response. BMJ Open Sport Exerc. Med. 6 (1), e000861.
31. Meyer K., Steiner R., Lastayo P., Lippuner K., Allemann Y., Eberli F., et al. (2003). Eccentric Exercise in Coronary Patients: Central Hemodynamic and Metabolic Responses. Med. Sci. Sports Exerc. 35 (7), 1076–1082.
32. Nikolaidis M. G., Paschalis V., Giakas G., Fatouros I. G., Koutedakis Y., Kouretas D., et al. (2007). Decreased Blood Oxidative Stress after Repeated Muscle-Damaging Exercise. Med. Sci. Sports Exerc. 39 (7), 1080–1089.
33. Nikolaidis M. G., Paschalis V., Giakas G., Fatouros I. G., Sakellariou G. K., Theodorou A. A., et al. (2008). Favorable and Prolonged Changes in Blood Lipid Profile after Muscle-Damaging Exercise. Med. Sci. Sports Exerc. 40 (8), 1483–1489.
34. Oscai L. B., Essig D. A., Palmer W. K. (1990). Lipase Regulation of Muscle Triglyceride Hydrolysis. J. Appl. Physiology 69 (5), 1571–1577.
35. Paschalis V., Nikolaidis M. G., Giakas G., Theodorou A. A., Sakellariou G. K., Fatouros I. G., et al. (2010). Beneficial Changes in Energy Expenditure and Lipid Profile after Eccentric Exercise in Overweight and Lean Women. Scand. J. Med. Sci. Sports 20 (1), e103–e111.
36. Paschalis V., Nikolaidis M. G., Theodorou A. A., Panayiotou G., Fatouros I. G., Koutedakis Y., et al. (2011). A Weekly Bout of Eccentric Exercise Is Sufficient to Induce Health-Promoting Effects. Med. Sci. Sports Exerc. 43 (1), 64–73.
37. Paulsen G., Mikkelsen U. R., Raastad T., Peake J. M. (2012). Leucocytes, Cytokines and Satellite Cells: what Role Do They Play in Muscle Damage and Regeneration Following Eccentric Exercise? Exerc. Immunol. Rev. 18, 42–97.
38. Sidky S. R., Ingalls C. P., Lowe D. A., Baumann C. W. (2022). Membrane Proteins Increase with the Repeated Bout Effect. Med. Sci. Sports Exerc. 54 (1), 57–66.
39. Smith H. A., Hengist A., Thomas J., Walhin J.-P., Heath P., Perkin O., et al. (2020). Glucose Control upon Waking Is Unaffected by Hourly Sleep Fragmentation during the Night, but Is Impaired by Morning Caffeinated Coffee. Br. J. Nutr. 124 (10), 1114–1120.
40. Smith L. L., McKune A. J., Semple S. J., Sibanda E., Steel H., Anderson R. (2007). Changes in Serum Cytokines after Repeated Bouts of Downhill Running. Appl. Physiol. Nutr. Metab. 32 (2), 233–240.
41. Thompson P. D., Crouse S. F., Goodpaster B., Kelley D., Moyna N., Pescatello L. (2001). The Acute versus the Chronic Response to Exercise. Med. Sci. Sports Exerc. 33 (6 Suppl. l), S438–S445.
42. Tsai S.-H., Cheng H.-C., Liu H.-W. (2021). Effects of Volume-Matched Resistance Training with Different Loads on Glycemic Control, Inflammation, and Body Composition in Prediabetic Older Adults. Appl. Physiol. Nutr. Metab. 46 (11), 1400–1406.
43. Tsekouras Y. E., Magkos F., Prentzas K. I., Basioukas K. N., Matsama S. G., Yanni A. E., et al. (2009). A Single Bout of Whole-Body Resistance Exercise Augments Basal VLDL-Triacylglycerol Removal from Plasma in Healthy Untrained Men. Clin. Sci. (Lond). 116 (2), 147–156.