Características del Perfil Pulsátil de la Hormona del Crecimiento luego de la Realización de Ejercicios Agudos de Sobrecarga de Alta Intensidad
William J Kraemer1,2,3,6, Bradley C Nindl1,2,3, Wesley C Hymer1,4 y Daniel R Deaver1,5
Artículo publicado en el journal PubliCE, Volumen 0 del año 2001.
Publicado 17 de mayo de 2006
Resumen
Palabras clave: ensayo inmunofuncional, somatotrofina, entrenamiento de la fuerza
INTRODUCCION
Es ampliamente sabido que el ejercicio agudo estimula la secreción de la hormona del crecimiento (GH) (13, 24, 33), pero la persistencia de esta estimulación y el efecto sobre la secreción de GH durante períodos de seguimiento más prolongados no están todavía bien caracterizadas. Una resolución óptima de la liberación pulsatil de la GH humana (hGH) debería incluir tanto muestreos frecuentes como técnicas sensibles de análisis para, de esta manera, definir la dinámica de secreción del eje de la GH (14). Asimismo, sería prudente realizar el muestreo durante las horas de sueño en el momento de la liberación dinámica de la hGH. Los pocos estudios que han examinado la liberación nocturna de hGH luego de la realización de ejercicios han reportado resultados contradictorios, los cuales podrían atribuirse a factores tales como el protocolo de ejercicio, el esquema de extracción de muestras y los inmunoensayos utilizados (1, 16, 22, 23, 29, 43).
La significancia fisiológica de estudiar el perfil pulsatil de la hGH reposa en el hecho de que se piensa que el patrón discontinuo de liberación es fundamental para una óptima función agonista a nivel celular. Se ha mostrado que el suministro pulsatil de GH por vía intravenosa es más efectivo que el suministro continuo para la regulación ascendente de los productos terminales de los tejidos (7, 8, 19, 27). La liberación pulsatil de la hGH es también clínicamente importante, debido a que se ha mostrado que está amplificada durante los períodos de crecimiento lineal (7, 9) y luego del entrenamiento aeróbico a largo plazo (42) y a que se deprime durante condiciones patológicas (18) y con el envejecimiento (11, 18) y bajo la regulación sexualmente dismórfica en hombres y mujeres (20). Actualmente no se sabe si los beneficios del entrenamiento de la fuerza, tales como el incremento en la fuerza y en la masa muscular, están acompañados de un incremento en la liberación pulsatil de la hGH.
Pocos estudios han explorado el impacto del ejercicio sobre la liberación pulsatil de la GH en humanos. Weltman et al. (42) reportaron una amplificación de la liberación pulsatil de GH en mujeres que realizaron 1 año de entrenamiento aeróbico por encima del umbral de lactato. Kenaley et al. (22) han publicado el único estudio en donde se utilizó un esquema de muestreo frecuente (cada 10 min durante 24 horas) y un programa de detección del pulso de liberación para examinar el impacto de ejercicio agudo aeróbico realizado durante el día sobre la liberación pulsatil nocturna de hGH. En este estudio, no se observó que el ejercicio aeróbico tuviera algún efecto. Aunque el ejercicio de sobrecarga es el modo preferido para el óptimo desarrollo y mantenimiento de sistema músculo esquelético y aunque se ha documentado que las variables de un programa agudo influencian las concentraciones de hGH inmediatamente después del ejercicio (24), ninguna investigación hasta la fecha ha examinado la influencia del ejercicio agudo de sobrecarga sobre la pulsatilidad nocturna de la hGH.
En la actualidad existen una variedad de inmunoensayos comercialmente disponibles para detectar las concentraciones circulantes de hGH. Debido a que estos inmunoensayos emplean diferentes anticuerpos monoclonales y policlonales dirigidos a epítopos específicos de la molécula de GH y debido a que las diferentes formas de la GH pueden o no tener estos epítopos intactos espacialmente accesibles para estos anticuerpos, los resultados obtenidos en cuanto a las concentraciones de GH a partir de una misma muestra pueden variar significativamente (10, 15, 25). Un trabajo reciente en donde se evaluó el impacto del ejercicio sobre las concentraciones in vivo de hGH bioanalizable vs. inmunoanalizable también ha mostrado disparidad en las dos concentraciones de hGH (28). De esta manera, la selección de un método apropiado de análisis para la detección de la hGH se vuelve una decisión importante para el científico/clínico cuyo interés en la medición de las concentraciones de hGH esté relacionado con la evaluación diagnóstica de la función pituitaria.
Strasburger et al. (38) recientemente desarrollaron un nuevo análisis de inmunoabsorción ligado a enzimas (ELISA) que se basa en la interacción molecular necesaria entre la hormona y su receptor para la dimerización del receptor y la subsiguiente transducción de la señal. Este análisis utiliza un anticuerpo monoclonal de la hGH y una proteína recombinante biotinilada de unión a la hGH (BP) que se une, respectivamente, a los sitios receptores 2 y 1 de la hGH, lo cual es el primer paso de la cascada de eventos intracelulares para la señalización de la hGH (12). Strasburger et al. reportaron que este análisis tuvo una correlación mayor que el análisis tradicional policlonal en comparación con el bioanálisis in vitro NB2, dándole crédito a la idea de que este tipo de análisis puede ser más relevante biológicamente que otros tipos de inmunoensayos. Este tipo de análisis todavía debe ser evaluado luego de la realización de tests de estimulación de la hGH, tales como el ejercicio.
Nosotros examinamos la hipótesis de la que las concentraciones nocturnas de hGH podrían verse incrementadas luego de la realización de un protocolo agudo de entrenamiento de la fuerza de alta intensidad. Para estudiar una respuesta más intensa de la hGH luego del entrenamiento de la fuerza de las que se han examinado previamente, se utilizó un diseño de muestreo serial nocturno con muestras repetidas dentro de cada grupo. Cada sujeto participó tanto en la condición de control como en la condición de ejercicio. La liberación pulsatil de hGH fue entonces evaluada y comparada. Además, para obtener un conocimiento adicional acerca del impacto del método de análisis, se midieron las concentraciones de hGH utilizando tres inmunoensayos: un análisis inmunoradiométrico convencional, un radioinmunoensayo convencional, y un nuevo análisis "inmunofuncional" que detecta moléculas en base a la interacción molecular entre la molécula y su receptor, lo cual es esencial para la dimerización del receptor y la subsiguiente transducción de la señal.
METODOS
Sujetos
Diez hombres jóvenes saludables con buena aptitud física, participaron en esta investigación, la cual fue aprobada por el Comité de Revisión Institucional para la Utilización de Sujetos Humanos de la Universidad Estatal de Pennsylvania y por el Comité de Revisión Científica del Centro de Investigación Clínica General. Todos los sujetos fueron informados acerca de los riesgos de la investigación y subsiguientemente leyeron y firmaron un formulario de consentimiento informado. Antes de ser incluidos en el estudio todos los sujetos se efectuaron una revisión médica llevada a cabo por un médico. De la revisión médica, se determinó que los sujetos eran no fumadores y estaban libres de problemas endócrinos, ortopédicos o de cualquier otro problema médico (e.g., desordenes alimenticios, de sueño o psiquiátricos) que pudieran haber alterado los datos de esta investigación. Los sujetos que habían utilizado suplementos (e.g., creatina o androstenediona, etc) en los 3 meses previos al estudio fueron excluidos del mismo. Para eliminar cualquier otra variable de confusión que afectara la secreción de hGH, tal como la edad, la aptitud física y la adiposidad (18), se requirió que los sujetos cumplieran con un estricto conjunto de criterios de aptitud física para la inclusión. Estos criterios de inclusión fueron: edad, <25 años, porcentaje de grasa corporal, <20%, consumo máximo de oxígeno, >45 ml.kg.-1min-1, y fuerza en una repetición máxima (1RM) en sentadilla, >1.5 x masa corporal. De esta manera, al cumplir con estos criterios, se reclutó para esta investigación una población de sujetos homogénea la cual pudo ser caracterizada como por encima del promedio con respecto a la aptitud aeróbica y a la fuerza. Durante este examen físico se recolectaron muestras de sangre venosa que fueron subsiguientemente analizadas para determinar concentraciones de testosterona, triiodotironina y factor de crecimiento tipo insulinico I (IGF-I), con lo cual se pudo asegurar que las concentraciones hormonales de estos sujetos estuvieran dentro de los valores normales para adultos jóvenes. La densidad corporal se determinó mediante el pesaje hidroestático, utilizando los métodos descriptos por Akers y Buskirk (2). La densidad corporal fue posteriormente utilizada para estimar el porcentaje de grasa corporal. El volumen máximo de consumo de oxígeno fue determinado mediante un protocolo realizado en cinta ergométrica. La Tabla 1 muestra las características físicas y descriptivas de los sujetos.
Valoración de la Fuerza
Se llevaron a cabo tests de 1RM en los siguientes ejercicios: sentadillas, press de banca, press de piernas, y tirones en polea utilizando equipamientos Universal (Universal Equipment, Omaha, NE) y barras York (York Barbell, York, PA). La entrada en calor consistió de la realización de 5-10 repeticiones al 40-60 % del máximo percibido, con un período de recuperación y estiramiento de 3 a 5 minutos, luego de lo cual se realizaron 3-5 repeticiones al 60-80 % del máximo.
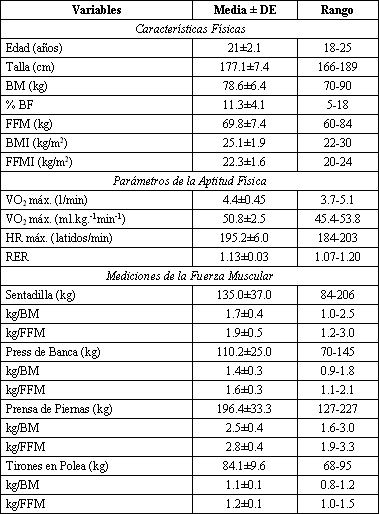
Tabla 1. Datos físicos descriptivos de los sujetos al comienzo del
estudio. % BF, porcentaje de grasa; BM, masa corporal; BMI, índice de masa
corporal; FFM, masa libre de grasa; FFMI, índice de masa libre de grasa, VO2
máx., consumo máximo de oxígeno, HR máx., frecuencia cardiaca máxima; RER,
índice de intercambios respiratorio.
Luego de esto se realizaron de tres a cinco levantamientos para determinar la fuerza en 1RM con 5 minutos de recuperación entre los levantamientos. Se consideró un levantamiento exitoso cuando este era completado en todo el rango de movimiento sin observarse desviaciones en la técnica y en la forma apropiada.
Protocolo de Ejercicio Agudo de Sobrecarga de Alta Intensidad
El protocolo de ejercicio agudo de sobrecarga de alta intensidad (AHREP) comenzó a las 15:00 horas y fue diseñado de manera tal que el volumen de entrenamiento fuera alto, incluyendo un total de 50 series que provocaban el reclutamiento y la activación de una gran cantidad de tejido muscular. La Tabla 2 muestra un detalle del AHREP. Lo anterior se cumplió utilizando ejercicios multiarticulares que requerían la utilización de los grupos musculares principales tanto del tren superior como del tren inferior. Los sujetos terminaban la serie de un ejercicio al alcanzar el número de repeticiones requeridas o cuando se producía el fallo muscular. Si eventualmente no se alcanzaba el número deseado de repeticiones en una serie dada, la carga era reducida antes de que el sujeto volviera a realizar el mismo ejercicio con la misma carga. Luego de cada ejercicio se realizaba una pausa de 90 s, y el orden de los ejercicios era tal que se alternaban los grupos musculares utilizados, tal como se muestra en la Tabla 2. Todos los sujetos completaron la sesión de ejercicios. El tiempo medio±DE para completar el AHREP fue de 125.3±3.4 min.
Pruebas Nocturnas
Los sujetos realizaron dos pruebas nocturnas cuyo orden fue aleatorio y equilibrado que se llevaron a cabo en el parque universitario del Centro de Investigación Clínica General (GCRC), ubicado en el Centro de Investigaciones Fisiológicas Noll de la Universidad Estatal de Pennsylvania. Para facilitar la familiarización con las instalaciones y para evitar el efecto de la interrupción del sueño de la primera noche, todos los sujetos durmieron en el GCRC la noche previa a cada extracción serial nocturna de muestras sanguíneas. Las condiciones fueron repetidas exactamente para incluir la llave del catéter de extracción cerca de la vena antecubital para la noche. Una de estas pruebas nocturnas sirvió de prueba control, en la cual los sujetos se reportaron al GCRC a las 14:30, momento en el cual se extrajeron las muestras sanguíneas de reposo mediante la técnica de punción venosa, y descansaban hasta ~ 17:00, hora a la cual una enfermera registrada insertaba un catéter en la vena antecubital de los sujetos para las extracciones seriales de sangre, que se llevaron a cabo a un ritmo de una extracción cada 10 minutos hasta las 06:00 de la mañana siguiente. La recolección de las muestras sanguíneas se llevó a cabo siguiendo los mismos procedimientos en la condición de ejercicio. Durante la condición de ejercicio los sujetos realizaron el AHREP desde las 15:00 hasta las 17:00 en el gimnasio de la universidad. Las muestras de sangre fueron recolectadas lo más pronto posible luego de que los sujetos hubiesen completado la última serie. El tiempo medio ± DE para la recolección de la primera muestra de sangre luego del ejercicio fue de 4.3±0.7 minutos. Durante cada prueba nocturna, se les permitió a los sujetos moverse libremente por las instalaciones, mirar televisión, recibir llamadas telefónicas, estudiar, etc. Las luces de las habitaciones fueron apagadas a las 22:00, y la TV fue apagada a las 23:00. Al lado de la cama, una enfermera registrada y los técnicos de la investigación realizaron las recolecciones seriales de muestras sanguíneas durante toda la noche, tratando de no causar ninguna interrupción en el sueño de los sujetos. Las muestras de sangre fueron recolectadas en contenedores de vidrio, permitiendo que coagulen a temperatura ambiente, y luego de lo cual fueron centrifugadas durante 30 minutos a 800 g y a 4 ºC. Luego de la centrifugación, se tomó una alícuota de 900 ml del suero, la cual fue separada en tres tubos Eppendorf, que fueron rápidamente congelados en nitrógeno líquido, y guardados a 280 ºC para los posteriores análisis.
Control Dietario
Todos los sujetos completaron dos diarios en los cuales registraron las ingestas dietarias de 3 días (i.e., uno para cada período de 3 días previos a cada prueba nocturna). Se les pidió a los sujetos que, para la segunda prueba nocturna replicaran, con la mayor precisión posible, la ingesta dietaria de los 3 días previos a la primera prueba nocturna. Los análisis dietarios (Nutritionist IV, First DataBank, San Bruno, CA) de estos registros verificaron que el contenido calórico y la composición de los alimentos fueran similares en los dos períodos previos a cada prueba nocturna. Para cada uno de los días en que se realizaron las pruebas nocturnas, los sujetos fueron provistos con todos los alimentos necesarios para la estadía. Estas comidas fueron preparadas por nutricionistas registrados en las instalaciones del GCRC y estuvieron constituidas para que cumplieran con los siguientes criterios: no debían contener cafeína, aspartamo o bocadillos; la distribución de los macronutrientes fue, 55% de carbohidratos, 15% de proteínas y 30% de grasa, y con un contenido total de sodio de 3 g. Las calorías ingeridas se calcularon en base a la formula estándar de Harris Benedict más un factor apropiado de actividad de acuerdo con la edad y actividad física de los sujetos. Los horarios de las comidas fueron, desayuno a las 06:30, almuerzo a las 11:30, y cena a las 19:00. Los horarios del almuerzo y de la cena fueron programados teniendo en cuenta la sesión de ejercicio de las 15:00-17:00 de forma tal que se asegurara que los sujetos ejercitaran en estado postabsortivo y asimismo para permitir que el régimen de muestreo luego del ejercicio agudo no estuviera influenciado por el consumo calórico. Se les permitió a los sujetos beber agua ad libitum.
Inmunoensayos de la Hormona de Crecimiento
Las concentraciones de hGH sérica circulante fueron comparados utilizando tres inmunoensayos por separado: 1) análisis inmunoradiométrico del Instituto de Diagnostico Nichols (Nichols IRMA) (San Juan Capistrano, CA); 2) radioinmunoensayo policlonal competitivo del Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK RIA); y 3) análisis inmunofuncional ELISA del Diagnostic Systems Laboratory (DSL IFA) (Webster, TX).
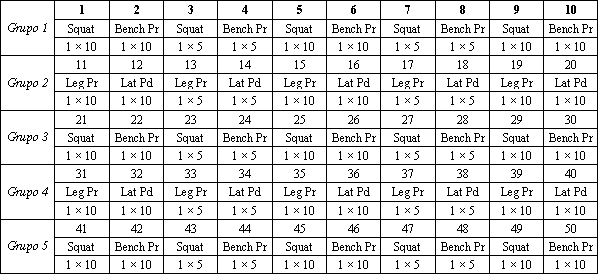
Tabla 2. Orden, ejercicios, repeticiones y cargas relativas del protocolo
agudo de ejercicios de sobrecarga de alta intensidad. Se utilizaron ejercicios
multiarticulares que requieren la utilización de los principales grupos
musculares, tanto del tren superior como del tren inferior [e.g., sentadilla (Squat,
15 series), prensa de piernas (Leg Pr; 10 series), press de banca (Bench Pr; 15
series), tirones en polea (Lat Pd; 10 series)]. Las cargas relativas para cada
ejercicio alternaron entre 10 y 15 repeticiones máximas (RM). Las cargas de 10
y 5 RM fueron calculadas como el 70% y el 85% de 1 RM, respectivamente. Las 50
series totales fueron divididas en 5 grupos de 10 ejercicios cada uno. Las
series 1-10, 21-30 y 41-50 fueron idénticas con respecto a los ejercicios
realizados (e.g., sentadilla y press de banca) y a la intensidad relativa (las
series del mismo ejercicio alternaron entre 10 y 5 RM). Del mismo modo, las
series 11-20 y 31-40 fueron idénticas con respecto a los ejercicios realizados
(e.g., prensa de piernas y tirones en polea) y a la intensidad relativa (ver
más arriba). Los números secuenciales son el orden en el cual los ejercicios
fueron realizados. Comience con el Grupo 1, serie 1, y muévase a la derecha. En
la serie 10 del grupo 1, la secuencia comienza con el grupo 2, serie 1 y así
sucesivamente. Nota: los grupos 1, 3 y 5 están compuestos idénticamente con
respecto a los ejercicios, al orden de ejercicio, y a las cargas relativas. Los
grupos 2 y 4 también están compuestos idénticamente con respecto a los
ejercicios, al orden de ejercicio, y a las cargas relativas. Se utilizó una
pausa de 90 segundos luego de cada ejercicio y una pausa de 120 segundos luego
de cada grupo de 10 series.
Los análisis NIDDK RIA y Nichols IRMA fueron seleccionados debido a que representan prototipos de "RIA comeptitivo policlonal" y de "IRMA monoclonal doble", respectivamente. Estos dos tipos de análisis son fáciles de conseguir, y son comúnmente utilizados en los laboratorios que realizan estudios sobre la hGH, y son considerados análisis representativos con los cuales pueden compararse datos obtenidos mediante DSL IFA. El análisis DSL IFA fue elegido debido a su particular base molecular y también para extender el trabajo realizado por Strasburger et al. (35-38), ya que por primera vez se compararían los resultados obtenidos mediante este tipo de análisis luego de la realización de ejercicios agudos de sobrecarga con lo resultados obtenidos mediante los análisis anteriormente mencionados. El análisis está diseñado para detectar solo aquellas moléculas de hGH que poseyeran intactos los sitios 1 y 2, lo cual es un prerequisito para inducir la dimerización del receptor de la molécula. Todos los análisis fueron validados con respecto al paralelismo, recuperación y linealidad. Se utilizaron curvas de regresión de mejor ajuste Log- logit, log-log y lineal estándar para los análisis NIDDK RIA, Nichols IRMA y DSL IFA, respectivamente. Todos los puntos estándar de las curvas fueron corridos en cuadriplicado. Para eliminar la varianza interanálisis, todas las muestras analizadas para un sujeto en particular fueron analizadas dentro del mismo lote en un contador gamma con algoritmos para el trazado de la curva de mejor ajuste (EG & G Wallac Gamma Counter, Turku, Finland) para el análisis RIA y con un lector de microplaca (Bio-Tek Instruments, Winooski, VT) para el análisis ELISA. Las sensibilidad de los análisis Nichols IRMA, NIDDK RIA, y DSL IFA fueron 0.04, 0.10, y 0.20 µg/l, respectivamente. Todos los valores obtenidos con Nichols RIA cayeron por encima de la sensibilidad del análisis. Los valores obtenidos con NIDDK RIA y con DSL IFA que cayeron por debajo de los umbrales fueron igualados a la sensibilidad para el respectivo inmunoensayo. Las varianzas interanálisis para las concentraciones bajas, medias y altas de hGH fueron las siguientes: 7.2, 5.2, y 5.4%, respectivamente, para los análisis Nichols IRMA; <10% para NIDDK RIA; y, 7.1, 7.6, y 8.4%, respectivamente, para el DSL IFA. La concentración sérica de IGF-I fue medida en tres momentos diferentes durante el muestreo, utilizando el análisis IRMA de dos sitios (Diagnostic Systems Laboratories, Webster, TX). La sensibilidad y la varianza intraanálisis para la determinación de IGF-I fue 2.06 µg/l y 3.9 %, respectivamente.
Análisis de la Actividad Pulsatil
Los análisis de la pulsatilidad de la hGH fueron realizados utilizando el programa Merriam and Wachter PC-Pulsar para PC IBM (30), programa que fue gentilmente provisto por J. F. Gitzen y V. D. Ramirez, del Programa para la Investigación Neural y Comportamental de la Universidad de Illinois. Los parámetros G correspondientes a un índice de error de detección del 1% utilizados fueron: G (1): 4.40, G (2): 2.60, G (3): 1.92, G (4): 1.46, G (5): 1.13. Para los análisis estadísticos se utilizaron las siguientes características del perfil pulsatil: concentración media de hGH, concentración máxima de hGH, número de picos, amplitud media de estos picos, duración media del pico e intervalo medio entre los picos.
Análisis Estadísticos
Todos los resultados se reportan como medias±DE. Para determinar los efectos del ejercicio vs. condición control (i.e., mediciones repetidas) y del tipo de análisis de detección (i.e., Nichols IRMA vs. NIDDK RIA vs. DSL IFA) se utilizó el análisis de varianza ANOVA para mediciones repetidas. Los datos brutos obtenidos entre las 18:00 y las 06:00 fueron ingresados en el programa de detección pulsatil pico para distinguir las características pulsátiles descritas previamente. Luego de esto se evaluaron los efectos de la condición y del inmunoensayo sobre los perfiles de pulsatilidad para determinar la significancia estadística (p=0.05) sobre las características del perfil pulsatil (i.e., concentración media de hGH, concentración máxima de hGH, número de picos, amplitud media de estos picos, duración media del pico e intervalo medio entre los picos). Posteriormente a esto los datos de las 12 h fueron divididos en cuatro conjuntos. A partir de esto se analizaron las concentraciones medias de hGH con respecto a los efectos principales del período de tiempo [1800-1900 (I); 1900-2300 (II); 2300-0300 (III); 0300-0600 (IV)], del método de análisis, y condición. Los análisis de regresión valoraron la relación entre las concentraciones de hGH obtenidas con las técnicas Nichols IRMA:NIDDK RIA, Nichols IRMA:DSL IFA, y DSL IFA:NIDDK RIA. Todos los análisis fueron llevados a cabo utilizando un programa estadístico comercialmente disponible (CSS: Statistica, StatSoft, Tulsa, OK).
RESULTADOS
Integridad del AHREP
El volumen de ejercicio para la combinación en "superserie" de los ejercicio de sentadilla y press de banca se redujo (p=0.05) a lo largo del AHREP [series 1-10: 15751±1176 repeticiones (rep.) x lb; series 21-30: 13292±988 (rep.) x lb (~84 % de las series 1-10); y series 41-50: 11898±911 (rep.) x lb (~76 % de las series 1-10)]. Asimismo, el volumen de ejercicio para la combinación en superserie de los ejercicios de press de piernas y tirones en polea se redujo durante las series 31 - 40 [16629±707 (rep.) x lb (~91 % de las series 11-20) 18336±772 (rep.) x lb]. La intensidad del AHREP fue confirmada a partir del incremento observado en las concentraciones medias de lactato entre los valores pre y post AHREP (2.0±0.4 vs. 17.2±1.2 mmol).
Respuesta de la Hormona del Crecimiento Inmediatamente Postejercicio
La Figura 1 muestra las concentraciones séricas de hGH para la primeraa hora posterior al ejercicio, valoradas con los análisis Nichols IRMA (1A), NIDDK RIA (1B), y DSL IFA (1C). Después del ejercicio, y durante la primera hora, las concentraciones de GH se redujeron gradualmente, mientras que en la condición de control las concentraciones de hGH se incrementaron en el mismo período de tiempo. Las concentraciones de hGH se incrementaron significativamente en los primeros 30 min posteriores al ejercicio. El incremento en las concentraciones de hGH durante el período de control se atribuyen al pulso que se produce naturalmente en horas del día, específicamente en el horario de ~17:30. En los 10 sujetos se observó este pulso característico producido durante las horas del día entre las 17:00 y las 18:30.
Características del Perfil Pulsatil de los Datos Obtenidos en Serie durante las 12 h
La Figura 2 ilustra los perfiles pulsátiles de las 12 horas, determinados utilizando los análisis Nichols IRMA (2A), NIDDK RIA (2B), o DSL IFA (2C). Los resultados principales fueron una menor concentración máxima de hGH y una menor amplitud del pico medio luego de la realización del AHREP. La Tabla 3 muestra los efectos principales sobre las características del perfil pulsatil. Se observaron efectos significativos de los análisis sobre la concentración media de hGH (Nichols IRMA>NIDDK RIA=DSL IFA), la concentración máxima de hGH (Nichols IRMA>DSL IFA>NIDDK RIA), sobre la amplitud del pulso medio (Nichols IRMA>NIDDK RIA=DSL IFA) y sobre la duración del pulso medio (Nichols IRMA>DSL IFA; NIDDK igual en ambos). No se observaron diferencias entre los análisis para el número de picos o para el intervalo entre los picos. Efectos significativos de la condición se observaron solo para la concentración máxima de hGH [ejercicio (10.7 µg/l), control (15.4 µg/l)]. La amplitud media del pulso se acercó a la significancia [ejercicio (4.84 µg/l) vs. control (6.65 µg/l); p=0.08]. La concentración media de hGH (p=0.25), la duración media del pico (p=0.75), el número de picos (p=0.80) y el intervalo entre los picos (p=0.34) no fueron difirieron estadísticamente entre las condiciones. La Figura 3 muestra las formas de interacción para las características del perfil de pulsatilidad. La Figura 3, A-D, muestra que no hubo diferencias entre las condiciones de ejercicio y control para la concentración media de hGH (3A), el número de picos (3B), la duración media del pulso (3C) o para el intervalo entre los picos (3D).
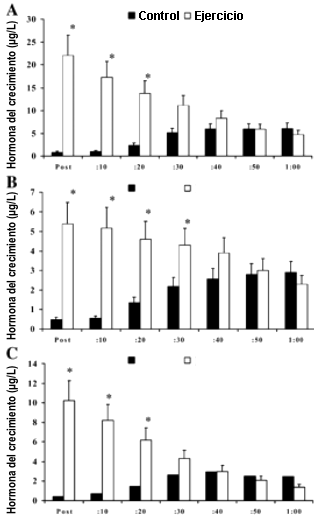
Figura 1. A: Respuesta de la hormona de crecimiento humana (hGH) valorada
con el análisis inmunoradiométrico de Nichols (IRMA) para la primera hora
posterior a la realización del ejercicio entre las condiciones de control y
ejercicio. B: Respuesta de la hGH valorada con el análisis Instituto Nacional
de Diabetes y Enfermedades Digestivas y Renales (NIDDK RIA) para la primera hora
posterior a la realización del ejercicio entre las condiciones de control y
ejercicio. C: Respuesta de la hGH valorada con el análisis inmunofuncional del
Diagnostics Systems Laboratory (DSL IFA) para la primera hora posterior a la
realización del ejercicio entre las condiciones de control y ejercicio. *
Diferencia significativa (p=0.05) entre las condiciones de control y ejercicio.
Los efectos de interacción fueron evidentes para la concentración máxima de hGH y para la amplitud del pulso medio (Figura 3E y F). Estas figuras muestran que los análisis Nichols IRMA y DSL IFA detectaron un menor máximo de hGH y una menor amplitud del pulso medio para la condición de ejercicio vs. la condición de control.
Concentraciones Medias de hGH divididas por Períodos de Tiempo
La Figura 4 ilustra el perfil pulsatil compuesto (i.e., valores medios a cada intervalo de 10 min para los tres inmunoensayos). El perfil de las 12 horas fue dividido en cuatro segmentos: 18:00-19:00 (I), 19:00-23:00 (II), 23:00-03:00 (III), y 03:00-06:00 (IV). Esto fue realizado para determinar si existía un patrón temporal diferencial tal como lo sugiriera la observación visual de los datos. Los segmentos fueron elegidos en base a la hora de alimentación, a la hora de apagado de las luces y al tiempo observado para la divergencia entre las condiciones de ejercicio y control. Subsiguientemente, se compararon las concentraciones medias de hGH en las condiciones de ejercicio vs. control, en cada período de tiempo y con los tres inmunoensayos. Este análisis se muestra en la Figura 5. Con los tres inmunoensayos, y en el período de tiempo I, la concentración de hGH en la condición de control fue mayor en la condición de control que en la condición de ejercicio. No se observaron diferencias entre las condiciones para el período de tiempo II. Las concentraciones de hGH en la condición de control fueron mayores que las concentraciones de hGH en la condición de ejercicio durante el período de tiempo III, cuando estas fueron valoradas por medio de los análisis Nichols IRMA y DSL IFA, pero no con el análisis NIDDK RIA. Las concentraciones de hGH en la condición de ejercicio fueron mayores que las concentraciones de hGH en la condición de control durante el período de tiempo IV, cuando estas fueron valoradas con los análisis Nichols IRMA y NIDDK RIA, pero no con el análisis DSL IFA.
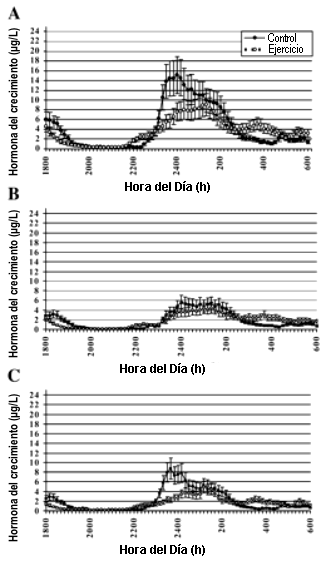
Figura 2. Comparaciones de los perfiles pulsátiles compuestos de la hGH
entre las condiciones de control y de ejercicio analizadas mediante los
inmunoensayos Nichols IRMA (A), NIDDK RIA (B), y DSL IFA (C).
Respuestas de la IGF-I Sérica
No se observaron diferencias en las concentraciones de IGF-I entre las condiciones de control y AHREP a las horas 1, 5 o 9.
Comparación entre los Inmunoensayos (a Través de Análisis de Regresión)
Los análisis de regresión lineal revelaron correlaciones significativas entre los tres análisis (las correlaciones estuvieron en un rango de 0.85 a 0.95, ver Figura 6). El análisis Nichols IRMA y el análisis DSL IFA tuvieron la mayor correlación, mientras que la recta de regresión entre el análisis NIDDK RIA y el análisis DSL IFA tuvo una pendiente de 1.13. A partir de la inspección visual de los datos graficados fue evidente que los puntos correspondientes a los datos divergen de la recta de regresión a medida que se incrementan las concentraciones de hGH.
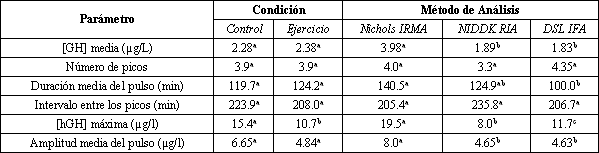
Tabla 3. Valores medios de los efectos principales hallados mediante el
análisis de varianza ANOVA para los inmunoensayos y para las diferentes
condiciones sobre la pulsatilidad en las 12 horas de muestreo. IRMA, análisis
inmunoradiométrico, NIDDK, Instituto Nacional de Diabetes y Enfermedades
Digestivas y Renales, RIA, radioinmunoensayo, DSL, Diagnostic Systems Laboratory;
IFA, análisis inmunofunicional; [GH], concentración de la hormona de
crecimiento; [hGH], concentración de la hormona de crecimiento humana. Letras
diferentes indican diferencia estadística dentro del mismo efecto principal,
mientras que letras similares indican similitud estadística dentro del efecto
principal (p=0.05). Los valores medios de la interacción indicada por el
análisis de varianza ANOVA se muestran en la Figura 3.
DISCUSION
Este estudio proporciona un conocimiento adicional acerca de la dinámica de secreción de la hGH por medio de la utilización de un riguroso esquema de muestreo para caracterizar, por primera vez, el
impacto del ejercicio agudo de sobrecarga de alta intensidad sobre la pulsatilidad de la hGH, y utiliza un análisis inmunofuncional recientemente establecido (i.e., DSL IFA), el cual detecta moléculas de hGH en base a la interacción molecular entre la molécula y su receptor (12, 38)
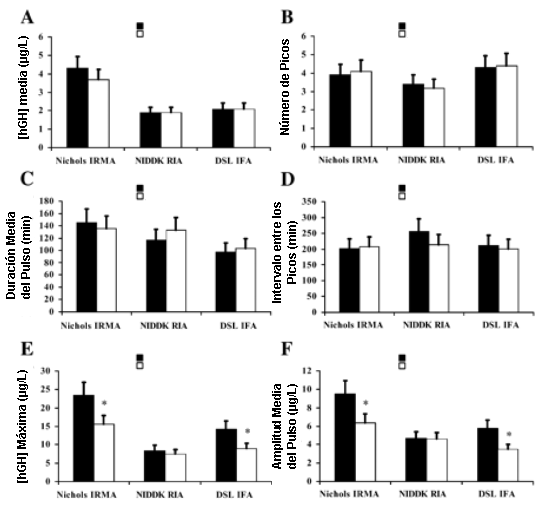
Figura 3. Comparaciones de las condiciones de ejercicio y de control
entre los inmunoensayos para las características del perfil pulsatil, mostrando
los valores medios de interacción indicados por el análisis de varianza ANOVA.
Concentración media de hGH ([hGH]; A), número de picos (B), amplitud media del
pulso (C), intervalo entre los picos (D), [hGH] máxima (E) y amplitud media del
pulso (F). * Diferencia estadística (p=0.05) entre las condiciones de control y
de ejercicio.
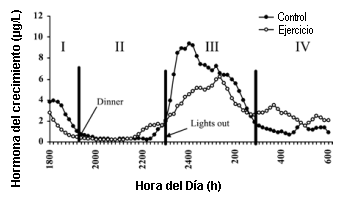
Figura 4. Perfiles compuestos (medias de los tres inmunoensayos) de la
pulsatilidad de la hGH entre las condiciones de control y de ejercicio,
ilustrando la división de los datos seriales. El perfil fue particionado de
esta manera en 4 segmentos (nombrados del I-IV) para determinar si existió un
patrón temporal diferencial de liberación como lo sugiriera la observación
visual de los datos. Los segmentos fueron seleccionados en base al horario de
las comidas, a la hora en que se apagaron las luces, y en base a la hora en que
se observó la divergencia entre las condiciones de ejercicio y control. Los
valores medios de la [hGH] para cada segmento se muestran en la Figura 5.
Nuestros datos demuestran que el ejercicio agudo de sobrecarga de alta intensidad realizado en las últimas horas de la tarde provoca la reducción de la concentración máxima nocturna de hGH, y de las amplitudes del pulso de hGH, aunque la concentración media global de hGH no se vieron significativamente reducidas. El ejercicio agudo de sobrecarga de alta intensidad influenció de manera diferencial el patrón temporal de liberación nocturna, debido a que la hGH estuvo reducida durante la primera mitad del período de sueño mientras que estuvo incrementada durante la segunda mitad en comparación con la condición de control. Otro hallazgo de particular interés es que el análisis DSL IFA produjo valores de concentración de hGH que fueron menores a la mitad de la concentración media de hGH producida por el análisis Nichols IRMA, ampliamente utilizado.
No se observaron diferencias en el número de picos de hGH entre las condiciones de ejercicio y control. Este hallazgo es consistente con lo observado en los estudios de Pritzlaff et al. (31) y Kanaley et al. (22), quienes reportaron que la realización de sesiones de ejercicio aeróbico no alteraban el número episodios de liberación de hGH durante períodos de 6 h y 24 h, respectivamente. Weltaman et al. (42) también reportaron que el número de picos era un fenómeno estable incluso en presencia de una amplificación significativa de la liberación de hGH luego de un año de entrenamiento aeróbico en mujeres posmenopáusicas. Considerando el hecho de que la concentración global media de hGH a través de las 12 h del período de muestreo tampoco fue afectada por el ejercicio, los datos sugieren que la cantidad global de hGH liberada puede ser estrechamente regulada, aun cuando los datos de la Figura 4 muestran claramente que la intensidad del régimen de ejercicio afectó los otros parámetros del perfil pulsátil.
La concentración media máxima de hGH y la amplitud media del pulso de hGH fueron menores durante la condición de ejercicio que durante la condición de control. Existen varias interpretaciones posibles para este hallazgo, una de las cuales podría ser el incrementado tono de somatostatina luego del ejercicio, ya se requiere de la hormona liberadora de GH para la iniciación del pulso de GH, en tanto que la somatostatina modula la amplitud del pulso de GH (17, 39). Aunque se sabe que la somatostatina inhibe la liberación de GH, esta no afecta negativamente la biosíntesis de GH. Este es un concepto importante debido a que puede explicar el "rebote" en la secreción de GH luego de la liberación/remoción de la somatostatina (14). Los picos nocturnos fueron menores durante la condición de ejercicio que durante la condición de control, entre las 23:00 y las 03:00 horas, pero fueron mayores durante las 03:00 y las 06:00 horas. Por lo tanto, aun cuando la concentración media de hGH fue similar entre las condiciones de ejercicio y control, el patrón temporal de liberación de hGH fue claramente influenciado por la realización de ejercicios durante el día. Desde una perspectiva mecánica, sugerimos que la sesión de ejercicio agudo de sobrecarga de alta intensidad resultó en una elevación del tono de la somatostatina entre las 23:00 y las 03:00 horas. Durante este período de tiempo, la liberación de hGH estuvo en cierta medida inhibida. Concurrentemente, la biosíntesis de hGH no estuvo inhibida. A las ~ 03:00 horas se produjo la disminución del tono de la somatostatina, y las moléculas de hGH sintetizadas y almacenadas durante el período en que la liberación de hGH estuvo inhibida, estuvieron disponibles y fueron fácilmente liberadas. Nuestros datos también demuestran que es improbable que se haya producido una retroalimentación inhibitoria de la IGF-I sobre la liberación de hGH en la pituitaria, ya que las concentraciones séricas de IGF-I no fueron diferentes entre las condiciones de control y ejercicio. Un conjunto de otras señales metabólicas y hormonales, tales como cambios en las concentraciones de GHRH, de los hexapéptidos o en la liberación de grelina, pudieron haber mediado en al respuesta observada de la hGH.
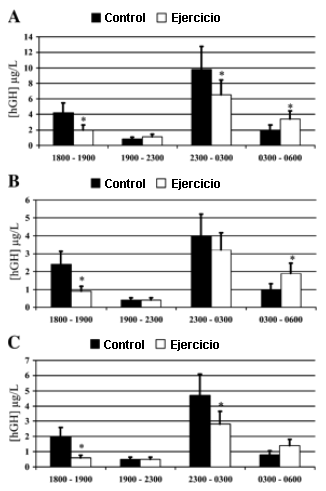
Figura 5. [hGH] medias para los períodos de tiempo I a IV, valoradas con
los análisis Nichols IRMA (A), NIDDK RIA (B) y DSL IFA (C). * Diferencia
significativa entre las condiciones de control y de ejercicio (p=0.05)
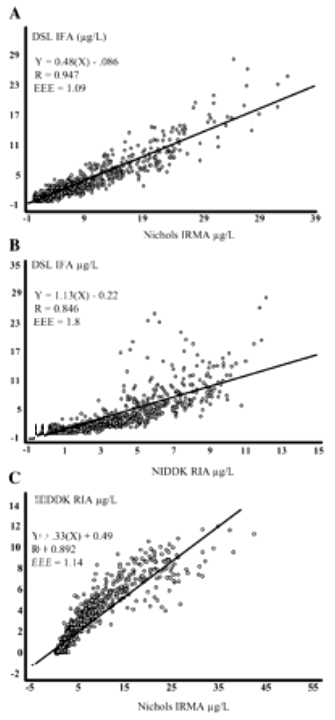
Figura 6. Gráficas de los valores experimentales para la [hGH] entre los
análisis Nichols IRMA vs. DSL IFA (A), NIDDK RIA vs. DSL IFA (B) y Nichols IRMA
vs. NIDDK RIA (C). Todas las correlaciones fueron significativas (p<0.01).
Los datos representan todos los puntos seriales para todos los sujetos (n=1580).
El patrón temporal de liberación de hGH en el presente estudio es sorprendentemente similar al reportado por Kern et al. (23), luego de la realización de ejercicios aeróbicos de baja y moderada intensidad. Las concentraciones de hGH en el estudio de Kern fueron mayores para la condición de control que para ambas condiciones de ejercicio, para el primer período de sueño, mientras que las concentraciones de hGH en la condición de control fueron menores que durante ambas condiciones de ejercicio durante el segundo período de sueño. En contraste a los hallazgos del estudio de Kern, otros dos estudio, uno que utilizó un protocolo de ejercicios aeróbicos (22) y otro que utilizó un protocolo de ejercicios de sobrecarga (29), no hallaron ningún impacto provocado por el ejercicio realizado durante las horas del día sobre la liberación nocturna de hGH. Es importante señalar que tanto nuestro protocolo como el protocolo utilizado por Kern fueron de mayor duración y por lo tanto resultaron en un mayor volumen de ejercicio en comparación con el volumen resultante de los protocolos de ejercicio utilizados en los estudios de Kanaley et al. (22) y McMurray et al. (29). Conjuntamente, los datos actualmente disponibles acerca del impacto del ejercicio llevado a cabo en horas del día sobre la liberación nocturna de hGH respaldan las siguientes conclusiones: 1) el ejercicio realizado durante el día con la duración y la intensidad suficiente, puede influenciar la liberación temporal nocturna de hGH, y 2) esta influencia es similar, tanto con la realización de ejercicio aeróbico como con la realización de ejercicios de sobrecarga.
Una interpretación algo ingenua de la disminución observada en la amplitud del pulso de hGH durante la primera mitad del sueño, aunque algo sorprendente, podría ser que el ejercicio de sobrecarga tiene un efecto negativo sobre la influencia somatotrófica de la hGH. Las concentraciones séricas periféricas proporcionan poca información acerca de la absorción de hGH en los diferentes biocompartimentos o acerca de las respuestas de los tejidos blanco. Es improbable que los inmunoensayos utilizados en este estudio no tuvieran la capacidad de detectar todas las formas moleculares de la hGH. Se ha demostrado que las formas con mayor peso molecular tienen mayores índices de bioactividad/inmunoreactividad como lo muestran las mediciones realizadas in vivo con el bioanálisis tibial en ratas (28). Por lo tanto, es posible que se liberen formas de la hGH que tengan una actividad biológica superior, pero que no sean detectadas por los inmunoensayos convencionales. Sin tener en cuenta los factores subyacentes responsables de la alteración de las concentraciones nocturnas de hGH luego de la realización de ejercicios de sobrecarga, esta influencia probablemente refleja las respuestas compensatorias a los déficits energéticos y a los daños localizados en los tejidos, causados por los períodos de actividad física. Nosotros solo podemos especular acerca del efecto, que en última instancia, provoca el ejercicio sobre el cambio temporal en la facilitación de la actividad metabólica y somatogénica de la hormona. Se necesitan trabajos adicionales para determinar si las concentraciones séricas de hGH inducidas por un alto volumen de ejercicio en las horas precedentes a la finalización del día se mantienen en las horas tardías de la mañana siguiente. Aunque se ha demostrado que el entrenamiento aeróbico crónico amplifica la liberación pulsatil de hGH (42), no hay datos disponibles que indiquen si aquellas personas que realizan entrenamientos regulares de la fuerza también exhiben una amplificación incrementada de la liberación de hGH.
Otro hallazgo interesante del presente estudio fue la disparidad entre los inmunoensayos para detectar concentraciones de hGH. Dicha variabilidad ha sido atribuida a varios factores, incluyendo la especificidad de los anticuerpos, la pureza del preparado de referencia, y la heterogeneidad molecular de la hormona que esta siendo medida (5, 6, 10, 15, 25, 32). El preparado de referencia utilizado en los tres inmunoensayos en nuestro estudio fue de origen pituitario y, en teoría, es el que mejor representa la mezcla de las formas de hGH circulantes, en comparación con una única forma altamente purificada. Aun cuando los resultados de los tres inmunoensayos estuvieron altamente correlacionados, el análisis Nichols IRMA produjo los mayores valores de concentración de hGH y de amplitud pulsatil. Debido a que el análisis DSL IFA solo mide las formas de hGH "biológicamente activas", no es posible saber con precisión que otras moléculas adicionales puede estar midiendo el análisis Nichols IRMA. El análisis Nichols IRMA ha demostrado ser capaz de detectar formas de hGH de alto peso molecular (21, 26). Parece razonable sugerir que, en promedio, el 50% de la GH liberada en la circulación de nuestros sujetos durante la noche estaba ligada a proteínas y fue detectado por el análisis Nichols IRMA, pero no el antisuero en los análisis DSL IFA y NIDDK RIA. Es posible que las diferentes isoformas de la hGH sean liberadas al mismo tiempo y que sean detectadas por un tipo de análisis, pero no por otro. Esto pudo haber contribuido a la relación curvilínea entre los análisis para los datos de concentraciones mayores.
Es importante considerar el impacto de la BP en la IFA. La IFA utiliza hGHBP recombinante para ligarse al sitio 1. Por lo tanto, se podría inferir que una molécula de hGH que ha formado un complejo con la GH BP no sería detectada con este sistema de análisis, debido a que el sitio 1 no se encontraría accesible. Además, un complejo hGH-BP podría estar configurado de manera tal que el sitio 2 no estuviera expuesto al anticuerpo monoclonal (MAb7B11). Esto podría ser una distinción importante del análisis DSL IFA, dado que Strasburger reportó que los niveles endógenos de GH BP, en concentraciones fisiológicas, no interfieren con los resultados de hGH derivados del análisis DSL IFA (38). Se ha reportado que la alta afinidad de la GH BP inhibe la unión de la GH a los receptores y la bioactividad in vitro a través de la competición por el ligando (4). Si esto es cierto la GH en complejo con el BP es muy grande como para traspasar el endotelio capilar y unirse a los receptores celulares, entonces la falta de detección de la hGH acomplejada con el análisis IFA provee de respaldo adicional a la "selectividad funcional" del análisis IFA. El análisis no detecta las moléculas de GH que hayan formado complejos con BP, ni tampoco las moléculas de GH en complejo con receptores BP dimerizados.
Otra posible explicación para las diferencias observadas entre los análisis IRMA e IFA podría ser que el análisis IRMA pude detectar fragmentos o formas fraccionadas que no pueden ser detectadas por el análisis IFA. Recientemente se ha reportado que el fragmento de GH 44-191 es detectable en niveles substanciales en el suero humano (34). Debido a que esta forma carece de la terminación NH2, es probable que no pueda ser detectada por el análisis IFA, pero dependiendo de los epítopos blanco, podría ser detectada mediante el análisis IRMA.
La heterogeneidad en las formas circulantes de la hGH es conocida y ha sido estudiada durante muchos años. No se sabe como esta heterogeneidad molecular se ajusta a los patrones de secreción de la GH durante períodos extendidos de tiempo. Sin embargo, nuestros hallazgos muestran de forma concluyente que al menos algunas de las moléculas liberadas durante los períodos de secreción son capaces de dimerizar los receptores de la hGH. En este sentido, estas moléculas son "biológicamente activas". En base a las altas correlaciones entre los inmunoensayos y a la similar detección del número de picos e intervalos entre los picos, parece ser que los inmunoensayos muestran representaciones cualitativas similares de la respuesta de la GH. Las diferencias cuantitativas entre los inmunoensayos tienen que ser todavía explicadas por completo, pero probablemente se deban a la existencia de diferentes isoformas moleculares. Serán de gran utilidad estudios futuros diseñados para separar las diferentes formas de la hGH durante diferentes etapas del pulso de GH luego de la realización de ejercicios.
Agradecimientos
Este estudio no podría haberse llevado a cabo sin la experiencia y profesionalismo del conjunto de enfermeras del Laboratorio Noll del Centro de Investigación Clinica Genral de la Universidad Estatal de Pennsylvania (i.e., Nancy Lambert, Paula Kirwin, Laurie Aquilino, y Jan Dwelf). Agradecemos a Alan D. Ragol, PhD, MD, por su asistencia en el diseño de esta investigación. Agradecemos a Jana Peters por su incalculable asistencia en el desarrollo del análisis de la hormona del crecimiento del Instituto Nacional de Diabetes y de Enfermedades Digestivas y Renales. A Judy True y a Sara Diaz por proveer un excelente apoyo nutricional. A Adam Hittinger, Skip Hildrebrand, Dave Benson, Kei Dohi, Jeff Heckman, Mike Gentry, y Marcus Glover quienes realizaron un gran esfuerzo para ayudar a realizar las extracciones sanguíneas realizadas en las noches, en la reducción de los datos y en el apoyo logístico. Agradecemos a Chip Harris por proveer las instalaciones para la realización de los ejercicios y a Michele Ilgen por ordenar todos los equipos y suministros a tiempo. Jeanne Nindl y Shari Hallas proporcionaron una ayuda incalculabre en el análisis de los datos y en la preparación del manuscrito. También estamos en deuda con sujetos, que estuvieron altamente motivados, y quienes con entusiasmo completaron cada cosa que les pedimos.
Este estudio fue respaldado, en parte, por una subvención del NIH MO1-RR-10732, y por subvenciones recibidas del Colegio Americano de Medicina del Deporte (ACSM) (American Collage of Sport Medicine) y de la Asociación Nacional de Fuerza y Acondicionamiento (NSCA) (National Strength and Contitioning Association) (a B.C. Nindl).
Dirección para el Envío de Correspondencia
B. C. Nindl, Military Performance Division, United States Army Research Institute of Environmental Medicine, Natick, MA 01760 (correo electrónico): bradley.nindl@na.amedd.army.mil).
Referencias
1. Adamson, L, Hunter WM, Ogunremi OO, Oswald I, and Percy-Robb IW (1974). Growth hormone increase during sleep after daytime exercise. J Endocrinol 62: 473-478
2. Akers, R, and Buskirk ER (1969). An underwater weighing system utilizing "force cube" transducers. J Appl Physiol 26: 649-652
3. Arimura, A, Smith WD, and Schally AV (1976). Blockade of the stress-induced decrease in blood GH by anti-somatostatin serum in rats. Endocrinology 98: 540-543
4. Baumann, G (1991). Growth hormone heterogeneity: genes, isohormones, variants, and binding proteins. Endocr Rev 12: 424-443
5. Baumann, G (1990). Growth hormone binding proteins and various forms of growth hormone: implications for measurements. Acta Paediatr Scand Suppl 370: 72-80
6. Baumann, G, Amburn KD, and Buchanan TA (1987). The effect of circulating growth hormone-binding protein on metabolic clearance, distribution, and degradation of human growth hormone. J Clin Endocrinol Metab 64: 657-660
7. Borer, KT (1989). Exercise-induced facilitation of pulsatile growth hormone (GH) secretion and somatic growth. In: Hormones and Sport, edited by Laron Z, and Rogol A.. New York: Serono Symposia Publications/Raven, p. 21-40
8. Borer, KT (1995). The effects of exercise on growth. Sports Med 20: 375-397
9. Borer, KT, Nicoski D, and Owens V (1986). Alteration of the pulsatile growth hormone secretion by growth-inducing exercise: involvement of endogenous opiates and somatostatin. Endocrinology 118: 844-850
10. Celniker, AC, Chen AB, Wert RM, and Sherman BM (1989). Variability in the quantitation of circulating growth hormone using commercial immunoassays. J Clin Endocrinol Metab 68: 469-476
11. Corpas, E, Harman SM, and Blackman MR (1993). Human growth hormone and human aging. Endocr Rev 14: 20-39
12. Cunningham, BC, Ultsch M, de Vos AM, Mulkerrin MG, Clauser KR, and Wells JA (1991). Dimerization of the extracellular domain of the human growth hormone receptor by a single hormone molecule. Science 254: 821-825
13. Felsing, NE, Brasel JA, and Cooper DM (1992). Effect of low and high intensity exercise on circulating growth hormone in men. J Clin Endocrinol Metab 75: 157-162
14. Giustina, A, and Veldhuis JD (1998). Pathophysiology of the neuroregulation of growth hormone secretion in experimental animals and the human. Endocr Rev 19: 717-797
15. Granada, ML, Sanmarti A, Lucas A, Salinas I, Carrascosa SA, Foz M, and Audi L (1990). Assay-dependent results of immunoassayable spontaneous 24-hour growth hormone secretion in short children. Acta Paediatr Scand Suppl 370: 63-70
16. Hackney, AC, Ness RJ, A, and Schrieber (1989). Effects of endurance exercise on nocturnal hormone concentrations in males. Chronobiol Int 6: 341-346
17. Hartman, ML, Veldhuis JD, and Thorner MO (1993). Normal control of growth hormone secretion. Horm Res 40: 37-47
18. Iranmesh, A, Lizarralde G, and Veldhuis JD (1991). Age and relative adiposity are specific negative determinants of the frequency and amplitude of growth hormone (GH) secretory bursts and the half-life of endogenous GH in healthy men. J Clin Endocrinol Metab 73: 1081-1088
19. Isgaard, J, Carlsson L, Isaksson OGP, and Jansson JO (1988). Pulsatile intravenous growth hormone (GH) infusion to hypophysectomized rat increases insulin-like growth factor I messenger ribonucleic acid in skeletal tissues more effectively than continuous GH infusion. Endocrinology 123: 2605-2610
20. Jaffe, CA, Ocampo-Lim B, Krueger K, Sugahara I, Demott-Friberg R, Bermann M, and Barkan AL (1998). Regulatory mechanisms of growth hormone secretion are sexually dimorphic. J Clin Invest 102: 153-164
21. Jan, T, Shaw MA, and Baumann G (1991). Effects of growth hormone-binding proteins on serum growth hormone measurements. J Clin Endocrinol Metab 72: 387-391
22. Kanaley, JA, Weltman JY, Veldhuis JD, Rogol AD, Hartman ML, and Weltman A (1997). Human growth hormone response to repeated bouts of aerobic exercise. J Appl Physiol 83: 1756-1761
23. Kern, W, Perras B, Wodick R, Fehm HL, and Born J (1995). Hormonal secretion during nighttime sleep indicating stress of daytime exercise. J Appl Physiol 79: 1461-1468
24. Kraemer, WJ, Marchitelli LJ, Gordon SE, Harman E, Dziados JE, Mello R, Frykman P, McCurry D, and Fleck SJ (1990). Hormonal and growth factor responses to heavy resistance exercise protocols. J Appl Physiol 69: 1442-1450
25. Levin, PA, Chalew SA, Martin L, and Kowarski AA (1987). Comparison of assays for growth hormone using monoclonal or polyclonal antibodies for diagnosis of growth disorders. J Lab Clin Med 109: 85-88
26. Luthman, M, Jonsdottir I, Skoog B, Wivall I, Roos P, and Werner S (1990). Monoclonal antibodies reveal circulating growth hormone of high molecular weight not detectable by conventional assays. Acta Endocrinol 123: 317-325
27. Maiter, D, Underwood LE, Maes M, Davenport ML, and Ketelslegers JM (1988). Different effects on intermittent and continuous growth hormone (GH) administration in serum somatomedin-C/insulin-like growth factor I and liver GH receptors in hypophysectomized rats. Endocrinology 123: 1053-1059
28. McCall, GE, Goulet EC, Grindland RE, Hodgson JA, Bigbee AJ, and Edgerton VR (1997). Bed rest suppresses bioassayable growth hormone release in response to muscle activity. J Appl Physiol 83: 2086-2090
29. McMurray, RG, Eubank TK, and Hackney AC (1995). Nocturnal hormonal responses to resistance exercise. Eur J Appl Physiol 72: 121-126
30. Merriam, GR, and Wachter KW (1982). Algorithms for the study of episodic hormone secretion. Am J Physiol Endocrinol Metab 243: E310-E318
31. Pritzlaff, CJ, Wideman L, Weltman JY, Abbott RD, Gutgesell ME, Hartman ML, Veldhuis JD, and Weltman A (1999). Impact of acute exercise intensity on pulsatile growth hormone release in men. J Appl Physiol 87: 498-504
32. Reiter, EO, Morris AH, MacGillivary MH, and Weber D (1988). Variable estimates of serum growth hormone concentrations by different radioassay systems. J Clin Endocrinol Metab 66: 68-71
33. Roemmich, JN, and Rogol AD (1997). Exercise and growth hormone: does one affect the other?. J. Pediatrics 131: S75-S80
34. Rowlinson, SW, Waters MJ, Lewis UJ, and Barnard R (1996). Human growth hormone fragments 1-43 and 44-191. in vitro somatogenic activity and receptor binding characteristics in human and nonprimate systems. Endocrinology 137: 90-95
35. Strasburger, CJ (1990). Antigenic epitope mapping of the human growth hormone molecule: a strategy to standardize growth hormone immunoassays. Acta Paediatr Scand Suppl 370: 82-86
36. Strasburger, CJ, and Dattani MT (1997). New growth hormone assays: potential benefits. Acta Paediatr Suppl 423: 5-11
37. Strasburger, CJ, Kostyo J, Vogel T, Barnard GJ, and Kohen F (1989). The antigenic epitopes of human growth hormone as mapped by monoclonal antibodies. Endocrinology 124: 1548-1557
38. Strasburger, CJ, Wu Z, Pfaulm C, and Dressendorfer RA (1996). Immunofunctional assay of human growth hormone (hGH) in serum: a possible consensus of quantitative hGH measurement. J Clin Endocrinol Metab 81: 2613-2620
39. Tannenbaum, GS, Painson JC, Lapointe M, Gurd W, and McCarthy GF (1990). Interplay of somatostatin and growth hormone releasing hormone in genesis of episodic growth hormone secretion. Metabolism 39: 35-39
40. Terry, LC, and Crowley WR (1980). The effects of exercise stress on somatostatin concentrations in discrete brain nuclei. Brain Res 197: 543-546
41. Terry, LC, Willoughby JO, Brazeau P, Martin JB, and Patel Y (1976). Antiserum to somatostatin prevents stress-induced inhibition of growth hormone secretion in the rat. Science 192: 565-567
42. Weltman, H, Weltman JY, Schurrer G, Evans WS, Veldhuis JD, and Rogol AD (1992). Endurance training amplifies the pulsatile release of growth hormone: effects of training intensity. J Appl Physiol 72: 2188-2196
43. Zir, LM, Smith RA, and Parker DC (1971). Human growth hormone release in sleep: effect of daytime exercise. J Clin Endocrinol Metab 32: 662-665