Cascada de Señalización de la Insulina
Publicado 12 de junio de 2014, 3:12
La insulina es una de las hormonas más conocidas y con amplia variedad
de efectos metabólicos que tiene una relación directa con el ejercicio. Es por eso que conocer su cascada de señalización (signaling pathway) nos permite explicar muchos de sus efectos fisiológicos a nivel molecular. En primer lugar, la
insulina se sintetiza como una preprohormona en las células-β de los islotes de
Langerhans en el páncreas. La secuencia líder de la preprohormona es eliminada
en la cisterna del retículo endoplasmático y la hormona es empaquetada en
vesículas secretorias en el Golgi, es plegada en su estructura nativa y fijada
en su conformación por la formación de 2 uniones disulfuro. Por acción de
endopeptidasas y carboxipeptidasas, la molécula de pro-insulina se disocia como
péptido C, dejando el péptido amino terminal B unido por un puente disulfuro al
péptido carboxiterminal A. La secreción de insulina por las células-β es
regulada principalmente por los niveles de glucosa. Así, un incremento en el
ingreso de glucosa a las células-β del páncreas conduce a un concomitante
aumento en el metabolismo que conlleva a una elevación de la relación ATP/ADP.
Esto a su vez lleva a la inhibición del canal de potasio sensible a ATP (canal
K+-ATP) en donde el resultado neto es la despolarización de la
célula llevando a un influjo de Ca2+ y a la secreción de insulina [1].
Una vez secretada al torrente sanguíneo, la insulina ejerce efectos metabólicos
en las células mediante su unión al receptor de insulina, el cual es un
heterotetrámero (α2β2) unido por varios enlaces
disulfuro, la subunidad extracelular α se une a la insulina y la unidad
transmembranal β traduce la señal por medio de un dominio tirosina cinasa
localizado en la porción citoplasmática de este polipéptido [2] (Figura 1).
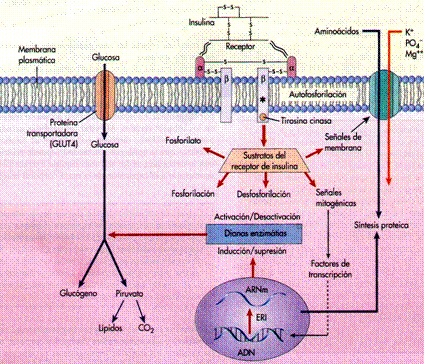
Figura 1. Efectos generales de la unión de insulina a su receptor celular. La función más importante de la insulina es contrarrestar la acción de varias hormonas que causan hiperglicemia, por tanto mantiene bajos los niveles de glucosa sanguínea. Además de su papel en la regulación del metabolismo de la glucosa, la insulina estimula la lipogénesis, disminuye la lipólisis, incrementa el transporte de aminoácidos a la célula, modula la trascripción alterando el contenido celular de numerosos ARNm, estimula el crecimiento, la síntesis de ADN y la replicación celular, efectos que son comunes a los de los Factores de Crecimiento similares a la Insulina tipo I (IGF-I) y tipo II (IGF-II) [1]. IGF-I y IGF-II tienen un alto grado de secuencia similar con la insulina, además el receptor de IGF-I es altamente homólogo al receptor de insulina y las vías de señalización intracelulares que son activadas por estas hormonas son muy parecidas [17,190]. Figura tomada de: Brandan N, Luponio A, Aguirre F, Aquino JA & Fortuny L. Regulación de la Glucemia. Cátedra de Bioquímica, Facultad de Medicina, Universidad Nacional del Nordeste, 2002
Todas las respuestas post-receptor que se inician por la unión de la insulina a su receptor son mediadas como consecuencia de la activación de varias vías de transducción (Figura 10). Estas incluyen la activación de la fosfatidilinositol-3-cinasa (PI3K), la cual involucra una unión con sustratos del receptor de la insulina (de los cuales hay cuatro: IRS1, IRS2, IRS3 y IRS4) activados por el dominio tirosina cinasa del receptor [1]. PI3K fosforila fosfolípidos de membrana siendo uno de los principales productos el fosfatidilinositol-3,4,5-trifosfato (PIP3). PIP3 se une a los dominios PH de la cinasa dependiente de PIP3 (PDK) permitiendo su activación. Por su lado, PDK fosforila y activa la proteína cinasa B (también conocida como Akt). Akt/PKB es una proteína cinasa específica de Ser/Thr que regula múltiples procesos biológicos incluyendo el metabolismo de glucosa, apoptosis, expresión de genes y la proliferación celular [3]. La estimulación de la cascada de señalización de Akt/PKB a través de IGF/IRS/PI3K activa corriente abajo una serie de objetivos anabólicos incluyendo mTOR, además de inhibir vías catabólicas que incluyen la glucógeno sintasa cinasa 3β (GSK3β, glycogen synthase kinase 3β) y los factores de transcripción FOXO (forkhead transcription factors) y sus genes atróficos atrogin-1 y MuRF1 [4].
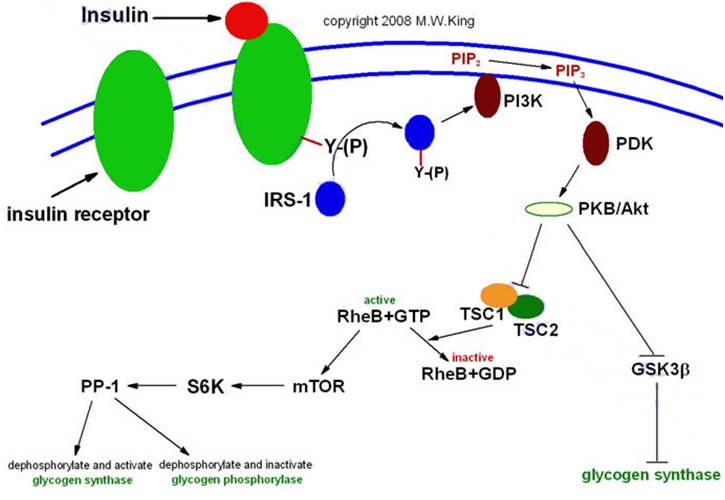
Figura 2. Cascada de señalización de la insulina. La estimulación de la actividad tirosina cinasa tras la unión de la insulina a su receptor genera, además de la autofosforilación del receptor, la fosforilación de residuos de tirosina (Y) en los IRS-1/4. Además, el incremento de fosfotirosina estimula la actividad de muchas otras moléculas intracelulares como GTPasas vía GRB2/mSOS. En la imagen se muestra la cascada que involucra la activación alostérica de PI3K, en el dominio p85, por los IRS-1/4. PI3K genera una mayor cantidad de PIP3, el cual actúa como mensajero secundario permitiendo la activación de PDK y posteriormente una variedad de objetivos corriente abajo que incluyen Akt/PKB, SGK y PKC [2]. Figura tomada de: http://themedicalbiochemistrypage.org/spanish/insulin-sp.html
REFERENCES
[1] http://themedicalbiochemistrypage.org/spanish/insulin-sp.html
[2] Murray R, Granner D, Mayes P & Rodwell V. (2003). Harper’s Illustrated Biochemistry 26th Edition. Ed. Lange Medical Books/McGraw-Hill
[3] Haussinger D, Roth ER, Lang F & Gerok W. (1993). Cellular Hydration State: An Important Determinant of Protein Catabolism In Health And Disease. Lancet; 341:1330-1332
[4] Schiaffino & Mammucari. (2011). Regulation of Skeletal Muscle Growth by the IGF1-Akt/PKB Pathway: Insights from Genetic Models. Skeletal Muscle 1:4