Cinética del Lactato en el Músculo Activo y en todo el Cuerpo después del Entrenamiento de Resistencia
Bryan C Bergman1, Eugene E Wolfel2, Gail E Butterfield3, Gary D Lopaschuk4, Gretchen A Casazza1, Michael A Horning1 y George A Brooks1
1Exercise Physiology Laboratory, Department of Integrative Biology, University of California, Berkeley 94720.
2University of Colorado Health Sciences Center, Division of Cardiology, Denver, Colorado 80262.
3Geriatric Research, Education, and Clinical Center, Palo Alto Veterans Affairs Health Care System, Palo Alto, California 95304.
4Departments of Pediatrics and Pharmacology, Cardiovascular Research Group, University of Alberta, Edmonton, Alberta, Canada T6G 2S2.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1999.
Publicado 30 de junio de 2003
Resumen
Palabras clave: transporte de lactato, agotamiento, glucógeno, glucosa, isótopos estables, lactacidemia
INTRODUCCIÓN
La concentración arterial de lactato disminuye a intensidades de ejercicio absolutas (14, 20, 33) y relativas (2, 22, 30) después del entrenamiento de resistencia. Los mecanismos responsables de la respuesta atenuada de lactato sanguíneo al ejercicio continuo no están completamente establecidos. Por medio del uso de trazadores isotópicos, fue por primera vez observado en ratas (14) un clearence de lactato incrementado en todo el cuerpo durante el ejercicio. Subsecuentemente, se demostró que el entrenamiento disminuía la tasa de aparición de lactato (RA) en humanos que se ejercitan a intensidades relativas altas (30). De manera contraria, otros encontraron que la producción de lactato no cambiaba, en estudios realizados con ratas (14). Subsecuentemente, se demostró que el entrenamiento disminuía la tasa de aparición de lactato (RA) en humanos que se ejercitan a intensidades relativas dadas (30). De manera contraria, otros encontraron que la producción de lactato no cambiaba en ratas (14) y hombres (33) que se ejercitan a cargas de trabajo absolutas dadas después del entrenamiento de resistencia. Así, aunque es posible concluir que el clearence de lactato incrementado contribuye en la disminución de la concentración de lactato arterial durante el ejercicio después del entrenamiento, la importancia de la alteración de la aparición de lactato es poco clara.
El balance de lactato de un miembro también ha sido usado para evaluar los efectos del entrenamiento de resistencia sobre el metabolismo de lactato. Después del entrenamiento, han sido reportadas disminuciones en las liberaciones netas de lactato (L) de los miembros para los primeros 10-15 min (19, 22) o a través de todo los 50 min de ejercicio (39) a una carga de trabajo absoluta dada. A la misma intensidad relativa de ejercicio, la L fue similar en sujetos entrenados y desentrenados (45). Sin embargo, la captación y oxidación de lactato de los miembros durante la L (10-12, 42), confundió a la misma con una medición de producción de lactato intramuscular. De este modo, la interpretación del balance de lactato de un miembro es poco sólida sino se cuenta con las mediciones con isótopos, para cuantificar la captación de lactato y la L total (LTOT).
El propósito de la presente investigación fue cuantificar el metabolismo del lactato en todo el cuerpo y en un miembro activo por medio del uso de técnicas con trazadores y de balance de un miembro, a intensidades de ejercicio absolutas y relativas dadas, antes y después del entrenamiento. Específicamente, nosotros evaluamos la hipótesis acerca de que el entrenamiento disminuye la producción de lactato a cargas de trabajo absolutas e incrementa el clearence de lactato a intensidades de ejercicio relativas y absolutas dadas. Adicionalmente, evaluamos si la mantención de concentraciones arteriales de lactato durante el ejercicio se produce debido a una L del músculo activo sostenida.
MATERIALES Y MÉTODOS
Sujetos
9 sujetos varones sedentarios y sanos de 19-33 años de edad fueron reclutados de la Universidad de California, Berkeley, por medio de avisos. Los sujetos dieron un consentimiento, se les consideró desentrenados si no habían estado implicados en más de 2 horas de actividad física por semana por al menos 1 año y si tenían un consumo pico de oxígeno (VO2 pico) <45 ml. kg-¹.min-¹ Los sujetos fueron incluidos en el estudio si tenían un porcentaje de grasa corporal <25 %, eran no fumadores, eran estables en el peso y en la dieta, tenían un volumen espiratorio forzado (FEV) de un 70 % o más de la capacidad vital, y si estaban libres de lesiones y/o enfermedades, como fue determinado por una examinación física. El estudio fue aprobado por el Comité para la protección de Sujetos Humanos en la Universidad de Stanford y en la Universidad de California, Berkeley (CPHS 97-6-34).
Diseño Experimental
Después de las entrevistas, los sujetos realizaron dos evaluaciones graduadas para determinar el VO2 pico durante la ergometría en cicloergómetro. El umbral láctico fue determinado durante la segunda evaluación. Los sujetos fueron luego evaluados en un orden al azar al 45 y 65 % del VO2 pico, con una semana entre las pruebas con isótopos (ver Protocolo con trazadores). Dos días después de la primera prueba, los sujetos comenzaron a entrenar sobre los cicloergómetros. Las pruebas con isótopos post-entrenamiento fueron también realizadas en un orden al azar al 65 % del VO2 pico pre-entrenamiento [misma carga de trabajo absoluta (ABT)], y al 65 % del VO2 pico post-entrenamiento [misma intensidad relativa (RLT)].
Evaluaciones Preliminares
Todas las evaluaciones de ejercicio fueron realizadas sobre un cicloergómetro frenado electrónicamente (Monark Ergometric 829 E). Para la determinación de VO2 pico, los ejercicios comenzaron a un apotencia de 50 W cada 3 min hasta el agotamiento. Los gases respiratorios fueron analizados por medio de un sistema indirecto de circuito abierto y registrados por medio de un sistema basado en una computadora personal en línea y en tiempo real (2). La composición corporal fue determinada por medio de mediciones de pliegues cutáneos (21) y pesaje subacuático. Fueron registrados datos de dietas de 3 días para obtener hábitos dietarios en una condición normal y para monitorear la composición de macronutrientes y la ingesta de energía durante el curso del estudio. Los análisis dietarios fueron realizados por medio del software Nutritionist III (N-Aquared Computing, San Mateo, CA).
Protocolo Dietario
Los sujetos descansaron antes de cada prueba con trazadores y comenzaron un protocolo dietario estandarizado que fue replicado en cada ocasión (2, 3).
Cateterizaciones
Después de anestesiar con lidocaina, la arteria y vena femoral de la misma pierna fueron canalizadas por medio del uso de técnicas percutáneas como fue previamente descrito (2, 3). Fueron usadas piernas alternas para las dos pruebas durante las evaluaciones pre y post-entrenamiento. Un sujeto experimentó una pérdida de sangre desde la colocación del catéter durante los minutos iniciales del ejercicio al 65 % del VO2 pico pre-entrenamiento y no realizó los ejercicios posteriores. Dos sujetos diferentes no recibieron un catéter venoso para una de sus pruebas. Como resultado, un tamaño de muestra de 9 sujetos fue usado para los cálculos y las comparaciones.
Protocolo con Trazadores
Un catéter venoso fue colocado en una vena antecubital en la mañana de cada prueba para la infusión de soluciones con isótopos estables durante 90 min de reposo y 1 h de ejercicio. Las muestras de sangre y respiración fueron recolectadas después de la cateterización de la arteria y vena femoral. Los sujetos recibieron luego una infusión fundamental continua de glucosa[6,6-2H] y lactato[3-13C] mientras descansaban en posición semisupina por 90 min. La cinética de la glucosa está reportada en forma separada (2). El bolo fue igual a 23 veces la tasa de infusión de lactato en reposo. El indicador de lactato fue administrado por medio de una bomba inteligente 522 (Kendall McGraw, Irvine, CA) a 2.5 mg/min en reposo y 7.5 mg/min durante el ejercicio al 45 % del VO2 pico pre-entrenamiento y al 65 % del viejo VO2 pico en el post-entrenamiento (ABT), y 10 mg/min al 65 % del VO2 pico pre-entrenamiento y 65 % del VO2 pico post-entrenamiento (RLT). Los incrementos en la infusión de trazadores o indicadores fueron diseñados para provocar enriquecimientos arteriales similares entre las intensidades de ejercicio durante los últimos 30 min de ejercicio. Los isótopos fueron obtenidos a partir los laboratorios Cambrige Isotope (Woburn, MA), diluidos en 9 % de una solución salina estéril, y evaluados en esterilidad y pirogenidad antes de su uso (University of California, School of Pharmacy, San Francisco, CA).
Biopsias y Análisis Musculares
Inmediatamente después de que fue indicada la infusión con isótopos, un músculo vasto lateral fue preparado para hacer una biopsia percutánea con aguja. Para cada prueba experimental, las biopsias fueron tomadas de dos localizaciones separadas por 1.5 cm: El sitio distal para la muestra pre-ejercicio y el sitio proximal para las muestras tomadas inmediatamente post-ejercicio. Los músculos vasto lateral derecho e izquierdo fueron alternados entre pruebas. Las biopsias tomadas en reposo, y dentro de los 10 seg de cesado el ejercicio, fueron inmediatamente sumergidas en nitrógeno líquido y subsecuentemente almacenadas en nitrógeno líquido y guardadas en hielo seco. Las muestras fueron analizadas para determinar la concentración de lactato como fue previamente descrito (7).
Muestras Sanguíneas
La temperatura sanguínea fue obtenida a partir de un termómetro al final de la termodilución venosa con catéter, inmediatamente antes de la obtención de las muestras sanguíneas. Las muestras sanguíneas arteriales y venosas fueron obtenidas simultáneamente y anaeróbicamente a través de 5 seg después de 75 y 90 min de reposo, y a los 5, 15, 30, 45 y 60 min de ejercicio. Las variables PO2, PCO2 y ph fueron medidas dentro de 30 min la obtención de las muestras sanguíneas (ABL 300, Radometer, Copenhagen, Denmark). La sangre para la determinación de la concentración de glucosa y el enriquecimiento de lactato fue inmediatamente transferida a tubos que contenían 8 % de ácido perclórico, sacudidas y colocadas en hielo. La sangre para la determinación de la concentración de lactato arterial y venoso fue inmediatamente colocada en hielo. Después de la obtención de la muestra final de sangre al final del ejercicio, las muestras fueron centrifugadas a 3000 g durante 10 min, y el sobrenadando fue transferido a tubos de almacenamiento, los cuales fueron congelados a -20 ºC hasta los análisis. Las mediciones de hematócrito fueron realizadas para la sangre arterial y venosa por medio del uso del método microhematócrito. La concentración de hemoglobina sanguínea fue determinada en cada muestra sanguínea por medio del uso del método cianometaglobina.
Hemodinámica
El flujo sanguíneo de la vena ilíaca fue determinado por medio de la técnica de termodilución con el uso de una computadora de gasto cardíaco (model 9520, American Edwards Laboratorios) como fue previamente descrito (3). Las mediciones fueron hechas en triplicado y cuadriplicado durante el reposo y el ejercicio inmediatamente después de la obtención de las muestras sanguíneas.
Análisis de Metabolitos y Enriquecimiento con Isótopos
Las concentraciones de glucosa fueron medidas en duplicado por medio del uso de un kit hexoquinasa (Sigma Chemical, St. Louis, MO). Las concentraciones del lactato plasmático fueron medidas en duplicado usando el método de Gutman y Wahlfeld (18), el cual usa lactato dehidrogenasa (LDH) corregida con los valores totales de sangre usando el método de Pendergraus et al. (32). Las muestras de sangre arterial y venosa y las espiraciones para las mediciones de enriquecimiento con 13CO2 fueron determinadas por medio de espectroscopia por cromatografía de gases (GCMS; GC model 5890 series II and MS model 5989 A, Hewlett-Packard) del derivado de N-propilamida heptafluorbutirato. En la preparación para el análisis GCMS, las muestras fueron neutralizadas con K OH 2N, transferidas a columnas de intercambio de cationes (AG 50 W-X8; 50 a 100 mesh H+) y aniones (AG1-X8; 100 a 200 mesh) y el lactato fue colocado en ácido fórmico 2N. Las muestras fueron luego liofilizadas, transferidas a frascos de microrreacción, resuspensidas en 200 µl de 2,2 dimetoxipropano seguidos de 20 µl de H Cl 10 % en metanol, tapadas y dejadas a la temperatura del laboratorio por 60 min. Después de agregarles 50 µl de N-propilamina, las muestras fueron calentadas por 30 min a 100ºC. Las muestras fueron subsecuentemente secadas bajo una corriente de gas N2, trasferidas a frascos GCMS por medio de 200 µl de etilacetato, y secadas nuevamente bajo gas N2. Finalmente, fueron adicionados a las muestras 20 µl de anhídrido heptafluorbutírico y se permitió que reaccione por 5 min a la temperatura del ambiente antes de secar la misma bajo N2 gaseoso. El lactato derivado fue luego resuspendido en etilacetato y subsecuentemente analizado por medio de GCMS.
Para los análisis GCMS, la temperatura del inyector fue establecida a 200 ºC, la tempertura inicial del horno fue establecida a 80 ºC, la línea de transferencia a 250 ºC, la temperatura cuadrapolar a 126 ºC. El transportador fue helio, la inyección fue usada a un índice 35/1 ml/min. El metano fue usado para la ionización química, y la monitorización de iones selectivos fue usada para monitorear los índices masa de los iones/carga de 327.25 y 328.25 para el lactato [12C] y [13C], respectivamente.
Protocolo de Entrenamiento
El entrenamiento fue realizado en cicloergómetro 5 días/semana, con cargas de trabajo ajustadas para provocar una frecuencia cardiaca correspondiente al 75 % del VO2 pico. Se les pidió a los sujetos que se ejercitaran 1 día/semana por su cuenta, además del entrenamiento en ciclo ergómetro, por lo que el entrenamiento total fue 6 días/semana. Todos los sujetos se ejercitaban al 75 % de su VO2 pico por 1 h al final de la segunda semana de entrenamiento. Después de 4 semanas de entrenamiento, los sujetos realizaron otra evaluación máxima para cuantificar los incrementos en el VO2 pico, y las cargas de entrenamiento fueron ajustadas para mantener la intensidad de entrenamiento relativa al 75 % del VO2 pico. Dos semanas antes de las evaluaciones post-entrenamiento, los sujetos comenzaron a realizar entrenamientos intervalados durante los últimos 10 min de cada hora de trabajo. El entrenamiento intervalado fue adicionado para desarrollar patrones de reclutamiento que conduzcan a alcanzar una potencia aeróbica máxima durante las evaluaciones post-entrenamiento.
Los sujetos continuaron entrenando por toda la semana en las evaluaciones post-entrenamiento, con un día de descanso antes de una prueba experimental y 2 días de descanso después de una prueba experimental para recobrarse de los procedimientos de evaluación. Los sujetos fueron pesados diariamente y se les pidió que incrementaran la ingesta energética para mantener el peso durante el programa de entrenamiento sin cambiar la composición normal de macronutrientes. Fueron registrados los datos de 3 días de la dieta después de 4 semanas de entrenamiento y al final del entrenamiento para asegurar el mantenimiento de la línea de base en la composición de la dieta.
Cálculos
Intercambio Neto de Metabolitos
Las diferencias en el intercambio neto de metabolitos fueron calculadas como el producto del flujo sanguíneo de la pierna y las diferencias arteriovenosas, donde los valores arteriales (a) y venosas (v) de hematócrito fueron usados para corregir los cambios en el volumen plasmático.
Liberación neta de lactato (L) (mMol/min) = 2 (1 Q de la pierna) (([lactato]V (HctA/ HctV)) - [lactato]A)
Liberación total de lactato (LTOT) (mMol/min) = L + captación de lactato medida con trazadores
La extracción fraccional de lactato de la pierna medida con trazadores (FEX) fue medida usando dos métodos.
FEX reposo (%) = {(lactatoA[13C] IE) ([lactato]A)} - {(lactatoV[13C] IE) ([lactato]V x HctA/ HctV)} / {(lactatoA[13C] IE) ([lactato]A)}
FEX ejercicio (%) = {[(13CO2) (CvCO2)] - [(13CO2 A) (CaCO2)]} / {(lactatoA[13C] IE) ([lactato]A)}
La tasa de oxidación de lactato de la pierna (ROX) fue también medida usando dos métodos.
ROX reposo (mMol/min) = extracción fraccional de la pierna medida con trazadores ([lactato]A) (2 x Q de la pierna)
ROX ejercicio (mMol/min) = {[(13CO2) (CvCO2)] - [(13CO2 A) (CaCO2)]} (2 x Q de la pierna) / lactatoA IE)
Contenido Sanguíneo de CO2
Las PCO2 y PO2 sanguíneas, el ph y Hb fueron medidos en las muestras sanguíneas arteriales y venosas y fueron usados en los cálculos de Douglas et al. (15) y Kelman (27) para la determinación del contenido sanguíneo de CO2 (CCO2 sanguíneo) (2, 3).
Cinética del Lactato
La RA del lactato y la tasa de desaparición (RD), la tasa de clearence metabólico (MCR), y la oxidación fueron calculadas usando ecuaciones definidas por Steele y modificadas para el uso con isótopos estables (47).
RA (mg. kg-¹. min-¹) = F – V [(C + C2) / 2] [(IE2 – IE) / (t2 – t1)] / [(IE2 – IE) / 2]
RD (mg. kg-¹. min-¹) = RA - V [(C + C2) / (t2 – t1)]
MCR (ml. kg-¹. min-¹) = RD / [(C + C2) / 2]
ROX (mg. kg-¹. min-¹) = RD [(VCO2) (IE CO2 (100)] / [(F) (k) / 89.08]
Donde F representa la tasa de infusión de isótopos, IE, e IE2 son el enriquecimiento isotópico con lactato en los puntos de tiempo de las muestras 1 (t1) y 2 (t2), respectivamente; C1 y C2 son las concentraciones de lactato en t1 y t2, respectivamente; V es la distribución del volumen de lactato estimado (180 ml/kg); 89.09 es el peso molecular del lactato; y k es un factor de corrección para la retención de trazadores en las cantidades de CO2 (0.65 durante el reposo y 0.90 durante el ejercicio). Los enriquecimientos isotópicos de lactato fueron corregidos para los enriquecimientos a partir de las muestras de sangre tomadas antes de la infusión con isótopos. Los cálculos de la cinética de lactato en estado estable fueron realizados durante los últimos 15 min de reposo (75 y 90 min) y 30 min de ejercicio (30, 45, 60) cuando la concentración arterial de lactato y los enriquecimientos eran estables, minimizando así las suposiciones relacionadas a la concentración y al volumen arterial.
Análisis Estadísticos
La significancia de las diferencias entre el promedio de glucosa arterial y las concentraciones de lactato de los últimos 30 min de ejercicio fueron analizadas usando ANOVA de un factor con mediciones repetidas. Las diferencias entre los estados de entrenamiento para las variables de grasa corporal, VO2 pico, y potencia al nivel del umbral del lactato fueron determinadas usando una prueba t de Student. Las diferencias entre los grupos para las diferencias de concentración de lactato venoso-arterial de los miembros ([lactato]V -A), L y LTOT, RA, RD, MCR y oxidación de lactato y enriquecimiento arterial fueron determinadas usando un test ANOVA factorial para mediciones repetidas. Las diferencias entre grupos para la FEX de lactato[13C] de las piernas, captación de lactato de las piernas, y concentración muscular de lactato, fueron determinadas usando un test ANOVA para mediciones repetidas. Las comparaciones Post Hoc fueron hechas usando el test de Fisher para la menor diferencia significativa.
RESULTADOS
Características de los Sujetos
Los datos antropométricos de los sujetos en las condiciones pre y post-entrenamiento han sido reportados previamente (2), pero son repetidos en la tabla 1. El peso corporal de los sujetos fue estable a través de todo el estudio. El VO2 pico se incremento significativamente en un 14.6 % como resultado del entrenamiento. Consecuentemente, las pruebas post-entrenamiento al 66 ±1.1 % del VO2 pico pre-entrenamiento (la misma carga de trabajo absoluta como en el pre-entrenamiento, 150 W) fueron realizadas al 54.0 ±1.7 % del VO2 pico post-entrenamiento, fueron requeridos 174 W para provocar el 65 % del VO2 pico post-entrenamiento. La potencia correspondiente al umbral láctico se incremento un 22% (P <0.05) después del entrenamiento. Las potencias específicas y velocidades o tasas de consumo de oxígeno alcanzadas por los sujetos antes y después del entrenamiento han sido reportadas previamente (3).
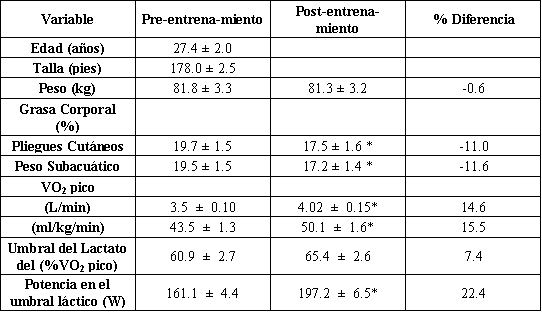
Tabla 1. Características de los sujetos antes y después de 9 semanas
entrenamiento de resistencia.
Los valores son presentados como medias ± DS; n =9 sujetos; VO2 pico: pico de
consumo de O2. *Significativamente diferente a partir de los valores pre-entrenamiento
a una P <0.05.
Concentraciones de Lactato Muscular
Las concentraciones de lactato del músculo vasto lateral en reposo fueron similares antes y después del entrenamiento (Tabla 2). Adicionalmente, las concentraciones de lactato muscular post-ejercicio y las diferencias entre las concentraciones de lactato muscular pre y post-ejercicio (i.e., ∆ de la concentraciones de lactato) no fueron alteradas por la intensidad de ejercicio o el estado de entrenamiento.
Concentraciones Arteriales de Lactato y Glucosa
Las concentraciones arteriales de lactato en reposo no fueron alteradas por el entrenamiento de resistencia. Las concentraciones arteriales de lactato se incrementaron significativamente arriba del reposo bajo todas las condiciones de ejercicio, y la concentración de lactato estuvo directamente relacionada a la intensidad de ejercicio antes y después del entrenamiento (Figura 1 A). En comparación con el estado desentrenado, el entrenamiento de resistencia disminuyó las concentraciones arteriales de lactato en un 40 % en ABT y 20 % en RLT (P <0.05). La concentración arterial de glucosa fue estable a través del tiempo y no fue significativamente diferente entre intensidad de ejercicio antes y después del entrenamiento (2).

Tabla 2. Concentración de lactato en el músculo vasto lateral durante el
reposo e inmediatamente después del ejercicio, antes y después del
entrenamiento.
Los valores son presentados como medias ± DS; n =9 sujetos. ABT, carga de
trabajo absoluta; RLT, intensidad de ejercicio relativa, ∆, cambio. Los
corchetes indican concentración.
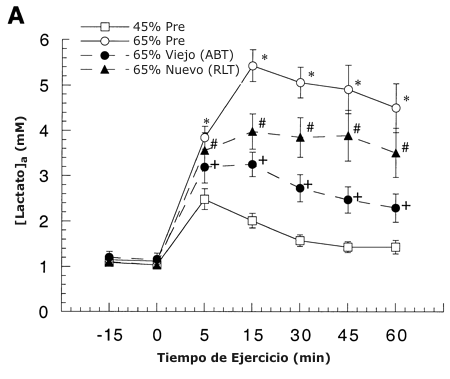
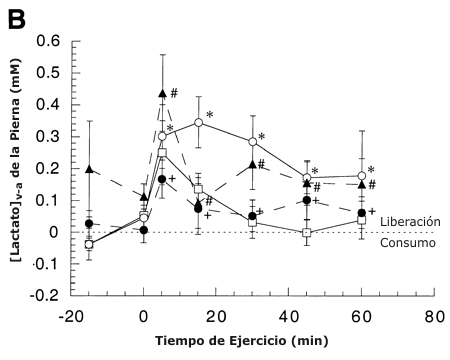
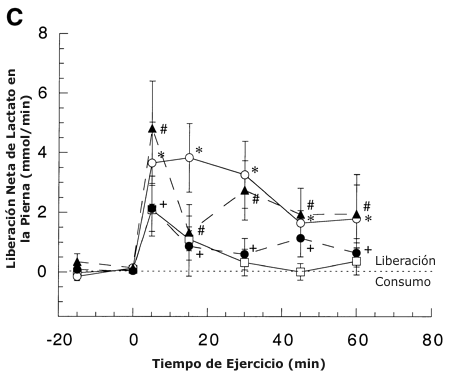
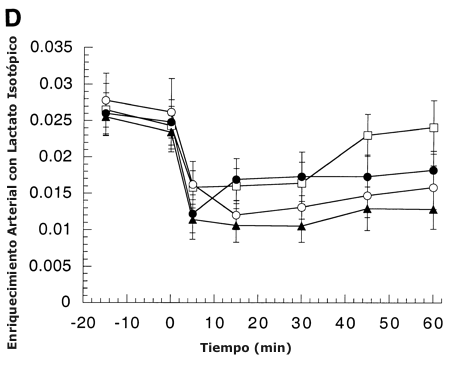
Figura 1. A: Concentración arterial de lactato durante el reposo y el
ejercicio antes (Pre) y después del entrenamiento de resistencia. Los valores
están presentados como medias ± DS para 8-9 sujetos. ABT: carga de trabajo
absoluta; RLT: intensidad relativa. B: Diferencia de concentración de lactato
(v-a) venoso-arterial de la pierna durante el reposo y el ejercicio antes y
después del entrenamiento. Los valores están presentados como medias ± DS para
7-8 sujetos. C: Liberación neta de lactato durante el reposo y el ejercicio
antes y después del entrenamiento de resistencia. Los valores están presentados
como medias ± DS para 7-8 sujetos. D: Enriquecimientos arteriales con lactato
isotópico durante el reposo y el ejercicio antes y después del entrenamiento de
resistencia. Los valores están presentados como medias ± DS para 8-9 sujetos.
* = significativamente diferente con respecto a la condición pre-entrenamiento
(45 %) a P <0.05.
+ = significativamente diferente con respecto a la condición pre-entrenamiento (65 %) a P <0.05.
# = significativamente diferente con respecto
a la condición post-entrenamiento (viejo 65 %) a P <0.05.
Metabolismo del Lactato de las Piernas
La [lactato]V –A en reposo no cambio antes o después del entrenamiento (Figura 1 B). La iniciación del ejercicio antes o después del entrenamiento resultó en una [lactato]V –A elevada, la cual disminuyó a través del tiempo. Antes y después del entrenamiento, la [lactato]V -A estuvo directamente relacionada a la intensidad de ejercicio. En comparación con la condición pre-entrenamiento, la [lactato]V-A disminuyó un 60 % (P <0.05) en ABT, pero no cambió en RLT.
Los miembros en reposo, liberaron lactato bajo todas las condiciones y la L de los miembros no cambió en la condición de reposo, debido al entrenamiento (Figura 1C). Bajo todas las condiciones de ejercicio durante el comienzo del ejercicio, los incrementos en el flujo sanguíneo de las piernas (3) y en la [lactato]V -A causaron un incremento en la L, sin embargo, con una liberación un 210 % mayor al 65 % en comparación con el 45 % del VO2 pico pre-entrenamiento (P<0.05), y una liberación un 55% mayor en RLT en comparación con ABT (P <0.05). En comparación con el estado pre-entrenamiento, la L disminuyó un 60 % (P <0.05) en ABT, pero no fue significativamente diferente en RLT.
El enriquecimiento isotópico de lactato arterial es mostrado en la Figura 1 D. En base a experiencias anteriores, la velocidad de infusión de trazadores fue ajustada entre pruebas. Consecuentemente, aunque el enriquecimiento cayo durante el ejercicio, no hubo diferencias en le enriquecimiento entre pruebas.
La FEX de lactato de las piernas aproximo el 15 % (Figura 2), no cambió en reposo antes y después del entrenamiento, y no cambió significativamente a partir del reposo durante el ejercicio a ninguna intensidad. Antes del entrenamiento al 65 % en comparación con el 45 % del VO2 pico, la extracción fraccional disminuyo un 50 % (P <0.05). Después del entrenamiento en comparación con el 65 % del VO2 pico pre-entrenamiento, la misma se incremento un 65 y 90 % en ABT y RLT, respectivamente. La extracción fraccional no fue estadísticamente diferente entre ABT y RLT.
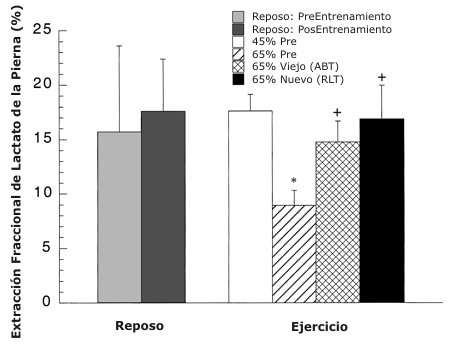
Figura 2. Extracción fraccional de lactato de la pierna medida por medio de
trazadores durante el reposo y el ejercicio antes y después del entrenamiento.
Los valores son presentados como medias ±DS para 7-9 sujetos. * = significativamente diferente con respecto a la condición pre-entrenamiento
(45 %) a P <0.05. + =significativamente diferente con respecto a la condición
pre-entrenamiento (65 %) a P <0.05.
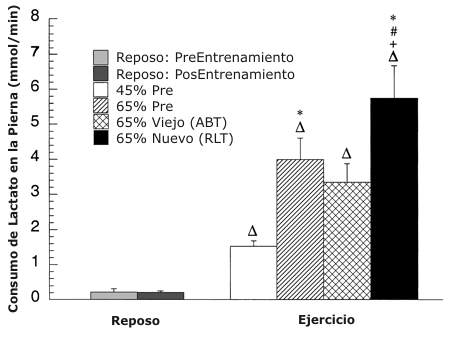
Figura 3. Captación de lactato medida por medio de trazadores durante el
reposo y el ejercicio antes y después del entrenamiento. Los valores son
presentados como medias ±DS para 7-9 sujetos. ∆ = significativamente diferente
de la condición de reposo, P <0.05. * = significativamente diferente con
respecto a la condición pre-entrenamiento (45 %) a P <0.05. +
=significativamente diferente con respecto a la condición pre-entrenamiento (65
%) a P <0.05. # =significativamente diferente con respecto a la condición
post-entrenamiento (viejo 65 %) a P <0.05.
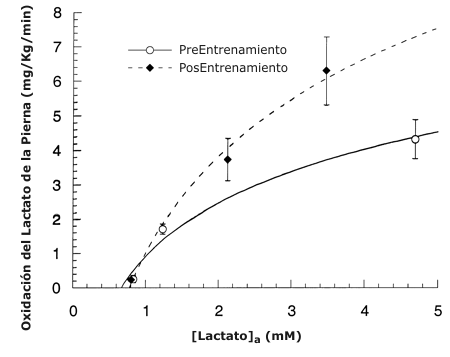
Figura 4. Relación entre la tasa de oxidación de lactato de la pierna medida
con trazadores y la concentración arterial de lactato [lactato]A antes y después
del entrenamiento.
Los valores son presentados como medias ±DS para 7-9 sujetos.
La velocidad de captación de lactato de la pierna medida con trazadores (Figura 3) y la oxidación (no mostrada) no cambiaron en reposo antes y después del entrenamiento y se incrementaron desde el reposo al ejercicio a todas las intensidades. La captación y oxidación de lactato de la pierna aumentaron con la intensidad de ejercicio antes del entrenamiento, incrementándose un 160 % del 45 al 65 % del VO2 pico, y después del entrenamiento, incrementándose un 70 % desde ABT a RLT (P <0.05). En comparación con el 65 % pre-entrenamiento, la captación y oxidación de lactato de la pierna no cambió en ABT y fue un 44 % mayor (P <0.05) en RLT.
La relación entre la oxidación de lactato de las piernas y la concentración arterial de lactato es mostrada en la Figura 4. Antes del entrenamiento, la oxidación de lactato de las piernas exhibió saturación, donde la oxidación de lactato de las piernas entro en plateau con el incremento de la concentración arterial de lactato. Después del entrenamiento, la saturación no fue aparente en las concentraciones alcanzadas. La Tabla 3 muestra la contribución de la oxidación de lactato de la pierna con respecto a la oxidación de carbohidratos de la misma, determinada a partir del cociente respiratorio de la pierna (3). Antes y después del entrenamiento, la oxidación de lactato en reposo explicó el 50 % de la oxidación de carbohidratos de la pierna, la cual disminuyó al 15 % durante el ejercicio a todas las intensidades. No hubo diferencias durante el ejercicio, antes y después del entrenamiento, en la contribución de la oxidación de lactato de la pierna a la oxidación de carbohidratos de la pierna.
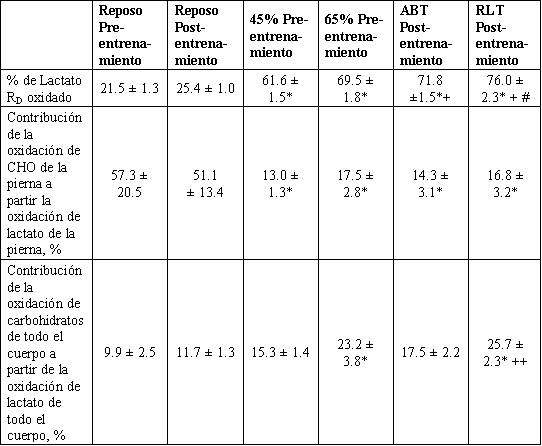
Tabla 3. Comparación de los parámetros del metabolismo de las piernas y de
todo el cuerpo en los hombres en reposo y ejercicio, antes y después del
entrenamiento. Los valores son presentados como medias ±DS para 7-9 sujetos, n
=9 sujetos. * Significativamente diferente de la condición de reposo, P <0.05. +
Significativamente diferente de la condición de reposo y 45 % en pre-entrenamiento,
P <0.05. #Significativamente diferente con respecto al 65 % pre-entrenamiento, P
<0.05. ++ Significativamente diferente con respecto al post-entrenamiento (ABT),
P <0.05.
Cinética del Lactato en Todo el Cuerpo
La RA y RD de lactato fueron similares en reposo antes y después del entrenamiento y se incrementaron durante el ejercicio a todas las intensidades (Figura 5 A y B, respectivamente). En comparación con la condición de reposo, las RA y RD de lactato se incrementaron en un 150 % en el 45 % del VO2 pico pre-entrenamiento y un 500 % al 65 % del VO2 pico pre-entrenamiento (P <0.05). Durante el ejercicio después del entrenamiento en comparación con la condición de reposo, las RD y rd de lactato se incrementaron un 400 % en ABT y un 800 % en RLT (P <0.05). Durante el ejercicio después del entrenamiento, las RA y RD de lactato se incrementaron un 140 % (P <0.05) al 65 % en comparación con el 45 % del VO2 pico. Después del entrenamiento en comparación con la condición al 65 % del VO2 pico pre-entrenamiento, las RA y RD de lactato disminuyeron un 40 % (P <0.05) en ABT, pero no cambiaron en RLT. Después del entrenamiento, las RA y RD de lactato se incrementaron un 85 % (P <0.05) en RLT en comparación con ABT.
La MCR de lactato en reposo fue similar antes y después del entrenamiento (Figura 5 C). La misma se incrementó significativamente desde el reposo al ejercicio en un 150 % al 45 % del VO2 pico pre-entrenamiento, un 100 % en ABT y un 130 % en RLT. Antes del entrenamiento, la MCR disminuyó un 40 % al 65 % en comparación con el 45 % del VO2 pico (P <0.05). Durante el ejercicio en ABT después del entrenamiento, la MCR tendió a incrementarse, pero el aumento en MCR no fue significativo (P =0.06). Durante el ejercicio en RLT después del entrenamiento, la MCR de lactato se incrementó un 70 % en comparación con el 65% del VO2 pico pre-entrenamiento (P <0.05).
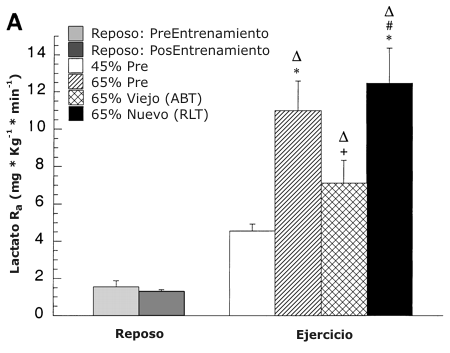
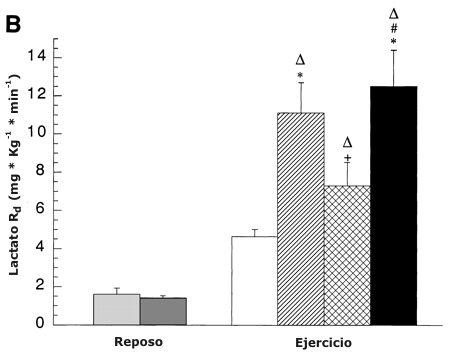
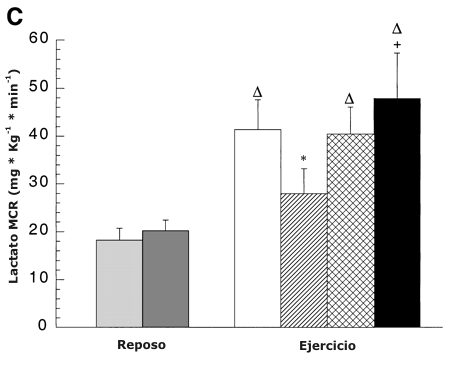
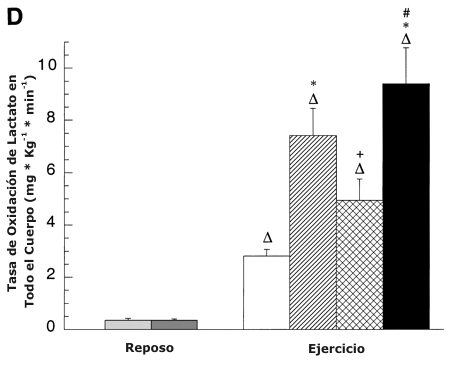
Figura 5. A: Efectos de la intensidad del ejercicio y del entrenamiento sobre
la tasa de aparición de lactato (RA). Los valores son presentados como medias ±DS
para 8-9 sujetos. Hay una relación lineal positiva entre la RA de lactato en
todo el cuerpo y la liberación total de lactato [LTOT; r =0.99; pre-entrenamiento:
RA de lactato = 1.32 (LTOT) + 1.65, post-entrenamiento: RA de lactato = 1.35 (LTOT)
+ 1.03]. B: Efectos de la intensidad del ejercicio y del entrenamiento sobre la
tasa de desaparición de lactato (RD). Los valores son presentados como medias ±DS
para 8-9 sujetos. Hay una relación lineal positiva entre la RD de todo el cuerpo
y la captación de lactato de la pierna [r =0.99; pre-entrenamiento: RD de
lactato = 2.18 (captación de lactato de la pierna) + 1.09, post-entrenamiento:
RD = 1.81 (captación de lactato de la pierna) + 0.79]. C: Efectos de la
intensidad del ejercicio y del entrenamiento sobre la tasa de clearence
metabólico de lactato (MCR). Los valores son presentados como medias ±DS para
8-9 sujetos. D: Efectos de la intensidad del ejercicio y el entrenamiento sobre
la tasa de oxidación de lactato en todo el cuerpo. Los valores son presentados
como medias ±DS para 8-9 sujetos.
∆ = Significativamente diferente de la condición de reposo, P <0.05. * =
significativamente diferente con respecto a la condición pre-entrenamiento (45
%) a P <0.05. + =significativamente diferente con respecto a la condición pre-entrenamiento
(65 %) a P <0.05. # =significativamente diferente con respecto a la condición
post-entrenamiento (viejo 65 %) a P <0.05.
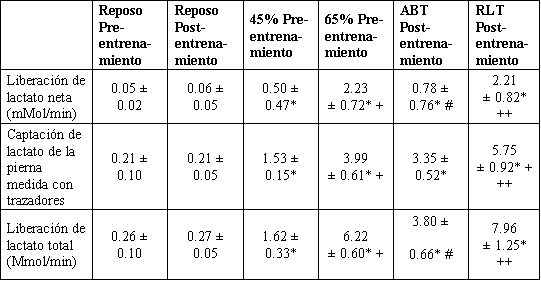
Tabla 4. Liberación neta de lactato de la pierna, captación de lactato medida
con trazadores y liberación total de lactato durante el reposo y durante los
últimos 30 min de ejercicio en los hombres antes y después del entrenamiento.
Los valores son presentados como medias ±DS para 7-9 sujetos, n =9 sujetos. *
Significativamente diferente de la condición de reposo, P <0.05. +
Significativamente diferente de la condición de reposo y 45 % en pre-entrenamiento,
P <0.05. # Significativamente diferente con respecto al 65 % pre-entrenamiento,
P <0.05. ++ Significativamente diferente con respecto al post-entrenamiento (ABT),
P <0.05.
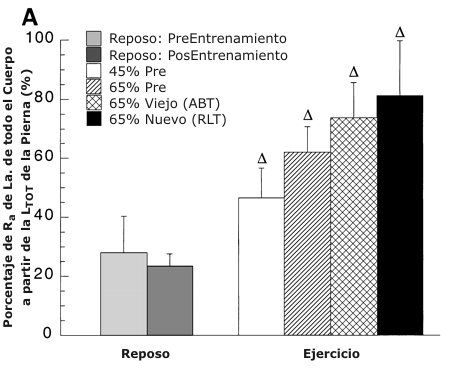
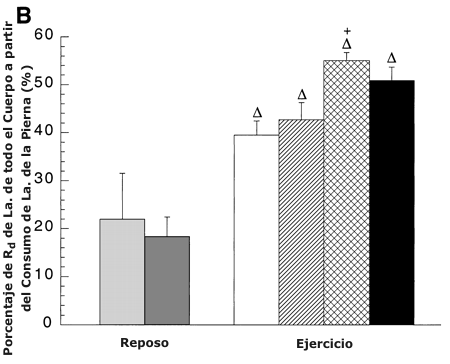
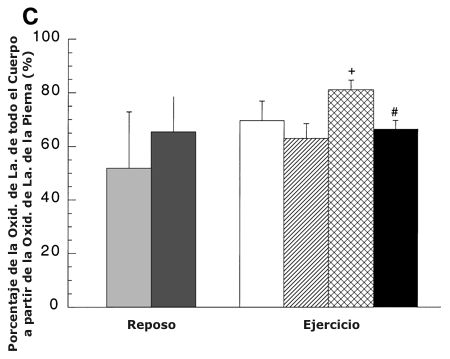
Figura 6. A: Porcentaje de RA de lactato de todo el cuerpo a partir de la
LTOT de la pierna antes y después del entrenamiento. Los valores son presentados
como medias ±DS para 5-8 sujetos. Hay una relación lineal positiva entre el % de
RA de lactato a partir de la LTOT de la pierna y la intensidad de ejercicio [r
=0.99; pre-entrenamiento: % RA a partir de LTOT = 0.59 (% del pico de consumo de
oxígeno (VO2 pico)) + 21.99, post-entrenamiento: % RA a partir de la LTOT = 1.05
(% VO2 pico) + 14.47]. B: % de RD de lactato de todo el cuerpo a partir de la
captación de lactato de la pierna medida con trazadores antes y después del
entrenamiento. Los valores son presentados como medias ±DS para 7-9 sujetos. Hay
una relación lineal positiva entre el % de RD de lactato a partir de la
captación de lactato de la pierna y la intensidad de ejercicio [r =0.98; pre-entrenamiento:
% RD a partir de la captación de lactato = 0.38 (% VO2 pico) + 19.58, r = 0.96
post-entrenamiento: % RD a partir de la captación de lactato = 0.65 (% VO2 pico)
+ 31.80]. C: % de la oxidación de lactato de todo el cuerpo a partir de la
oxidación de lactato de la pierna antes y después del entrenamiento. Los valores
son presentados como medias ±DS para 6-8 sujetos.
∆ = Significativamente diferente de la condición de reposo, P <0.05. * =
significativamente diferente con respecto a la condición pre-entrenamiento (45
%) a P <0.05. +=significativamente diferente con respecto a la condición pre-entrenamiento
(65 %) a P <0.05. # =significativamente diferente con respecto a la condición
post-entrenamiento (viejo 65 %) a P <0.05.
La oxidación de lactato en todo el cuerpo no fue significativamente diferente entre los estados de entrenamiento y se incremento durante el ejercicio sin tener en cuenta la intensidad (Figura 5 D). Antes del entrenamiento, la oxidación de lactato se incrementó (P <0.05) un 700 y 2000 % durante el ejercicio en comparación con el reposo al 45 y 65 % del VO2 pico, respectivamente. Después del entrenamiento, la oxidación de lactato durante el ejercicio también se incrementó a partir del reposo en 1300 y 2500% en ABT y RLT, respectivamente. De manera similar a la producción de lactato (RA y RD), la oxidación de lactato se incremento (P <0.05) en un 160 % al 65 % vs. 45 % del VO2 pico antes del entrenamiento, y un 90 % después del entrenamiento en RLT en comparación con ABT. En comparación con el 65 % del VO2 pico pre-entrenamiento, la oxidación de lactato después del entrenamiento fue un 30 % más baja en ABT (P <0.05) y no cambió en RLT.
La Tabla 3 muestra que durante el ejercicio, el porcentaje de RD de lactato oxidado se incremento desde el reposo sin tener en cuenta el estado de entrenamiento o la intensidad de ejercicio. Bajo todas las condiciones, la mayor parte (60-80 %) del lactato fue consumida a través de la oxidación. El porcentaje de RD oxidada se incrementó significativamente con los incrementos de la intensidad del ejercicio, tanto antes como después del entrenamiento, sin diferencias durante ABT o RLT en comparación con los valores obtenidos durante el intento con el 65 % del VO2 pico pre-entrenamiento. La contribución de la oxidación de lactato en todo el cuerpo a la oxidación de carbohidratos en todo el cuerpo es también mostrada en la Tabla 3. El porcentaje del CO2 total derivado de carbohidratos explicado por la oxidación de lactato se incrementó en la transición del reposo al ejercicio, cuando la oxidación de lactato explicó el 15-20 % del CO2 total derivado de carbohidratos. No hubo diferencias en reposo debido al entrenamiento, con un incremento de las contribuciones en comparación con el reposo al 65 % del VO2 pico pre-entrenamiento y RLT. Después del entrenamiento el porcentaje de oxidación de carbohidratos en todo el cuerpo a partir de la oxidación de lactato de todo el cuerpo fue un 47 % mayor (P <0.05) en RLT en comparación con ABT.
Captación de Trazadores de Lactato y LTOT
La L subestimó a la LTOT en reposo y durante todas las intensidades de ejercicio, tanto antes como después del entrenamiento (Tabla 4). La LTOT fue dramáticamente mayor que la L debido a una captación de lactato de los miembros simultánea. La LTOT fue mayor que la L en un 220 % al 45 % del VO2 pico pre-entrenamiento. Después del entrenamiento, la LTOT fue mayor que la L en un 390 y 260 % en ABT y RLT, respectivamente. Así, sin tener en cuenta la intensidad de ejercicio, la L subestimó a la LTOT en ≈ 200 %.
Contribución Activa de los Miembros a la Cinética del Lactato en todo el Cuerpo
En reposo, antes y después del entrenamiento, la LTOT explicó porcentajes similares (≈ 20 %) de RA de todo el cuerpo (Figura 6 A). Sin embargo, durante el ejercicio los miembros que trabajaban explicaron la mayor parte (50-80 %) de la RA de lactato.
A pesar de la tendencia aparente, no fue detectado un efecto de entrenamiento sobre el porcentaje de RA de lactato de las piernas. Antes del entrenamiento, durante el ejercicio en comparación con el reposo, el porcentaje de RA de lactato a partir de la LTOT se incrementó un 70 y 120 % al 45 y 65 % del VO2 pico pre-entrenamiento, respectivamente (P <0.05). Durante el ejercicio después del entrenamiento, la contribución de la LTOT de los miembros que trabajaban a la RA de lactato de todo el cuerpo se incrementó desde el reposo en un 210 y 250 % en ABT y RLT, respectivamente (P <0.05). En comparación con la prueba al 65 % del VO2 pico pre-entrenamiento, no hubo diferencias en el porcentaje de RA de lactato en ABT y RLT. Hubo una relación lineal positiva entre el porcentaje de RA de lactato a partir de la LTOT y la intensidad de ejercicio [r = 0.99; pre-entrenamiento: % RA a partir de LTOT = 0.59 (% VO2 pico) + 21.99; post-entrenamiento: % RA a partir de LTOT = 1.05 (%VO2 pico) + 14.47].
Durante el ejercicio, aproximadamente la mitad de la RD de lactato de todo el cuerpo pudo ser explicada por la captación de lactato de los miembros activos, la cual fue mayor durante el ejercicio en comparación con el reposo (Figura 6 B). El incremento de la intensidad de ejercicio antes y después del entrenamiento no alteró el porcentaje de la RD de lactato, explicada por la captación de lactato de los miembros. Después del entrenamiento, en ABT la captación de lactato de las piernas explicó un 30 % de la RD de lactato en comparación con el 65 % del VO2 pico pre-entrenamiento. Aunque las piernas activas explicaron la mayor parte del consumo de lactato durante ABT y RLT después del entrenamiento (Figura 6 B), las piernas activas contribuyeron más a la RA de lactato (Figura 6 A) que a la RD (Figura 6 B). Hubo una relación lineal positiva entre el porcentaje de RD de lactato a partir de la captación de lactato de las piernas y la intensidad de ejercicio [r = 0.98; pre-entrenamiento: % RD a partir de la captación de lactato de las piernas = 0.38 (% VO2 pico) + 19.58; r =0.96 post-entrenamiento: % RD a partir de la captación de lactato de las piernas = 0.65 (% VO2 pico) + 13.80].
No hubo ningún efecto de entrenamiento sobre el porcentaje de la oxidación de lactato en todo el cuerpo atribuible a las piernas en la condición de reposo (Figura 6 C). Los miembros activos explicaron la mayor parte (70 %) de la oxidación de lactato de todo el cuerpo durante el ejercicio, antes y después del entrenamiento (Figura 6 C). El porcentaje de oxidación de lactato de los miembros no se incrementó durante el ejercicio en comparación con el reposo antes y después del entrenamiento. Después del entrenamiento, el porcentaje de oxidación de lactato en todo el cuerpo a partir de los miembros activos se incrementó en ABT, un 30 % en comparación con el 65 % del VO2 pico pre-entrenamiento, y un 20 % en comparación con RLT.
Hubo fuertes correlaciones (r =0.99) entre nuestras dos mediciones de producción de lactato (RA y LTOT) durante el reposo y el ejercicio tanto antes como después del entrenamiento (Figura 5 A). Similarmente, hubo fuertes correlaciones (r =0.97) entre la RD de lactato de todo el cuerpo y la captación de lactato de las piernas antes y después del entrenamiento (Figura 5 B).
DISCUSIÓN
Está es la primera investigación longitudinal acerca de los efectos del entrenamiento sobre el metabolismo del lactato, usando la combinación de la tecnología con trazadores y las mediciones de intercambio neto de los miembros. Nuestra propuesta dio dos estimaciones de producción de lactato durante el reposo y ejercicio: RA de lactato sanguíneo y LTOT derivadas de los trazadores. En general, los valores están altamente correlacionados (r =0.99, Figura 5 A) y muestran que el músculo activo es el sitio predominante, pero no el exclusivo de producción y remoción de lactato durante el ejercicio.
Nuestros datos indican que los mecanismos para disminuir la concentración arterial de lactato después del entrenamiento de resistencia varían dependiendo de la intensidad de ejercicio. A la misma carga de trabajo absoluta, los miembros activos entrenados mantienen una ROX de lactato similar, a pesar de la producción atenuada de lactato de todo el cuerpo y de la concentración arterial atenuada, debido al incremento de la FEX. Así durante el ejercicio de moderada intensidad después del entrenamiento (i.e., ABT), las RA y LTOT, disminuidas y el clearence muscular de lactato incrementado contribuyen a la disminución de la concentración arterial de lactato. Sin embargo, a una intensidad relativa fija (i.e., RLT) la producción de lactato fue la misma antes como después del entrenamiento, pero la oxidación de lactato de las piernas y el clearence de lactato de todo el cuerpo y de las piernas se incrementó.
Con respecto a la concentración de lactato circulante durante el ejercicio, encontramos que la liberación de lactato por los miembros activos no puede explicar la elevación mantenida de la concentración arterial de lactato (Figura 1 A) ya que la L de los miembros cayó a cerca de cero al final del ejercicio bajo todas las condiciones (Figura 1 C). De este modo, otros tejidos deben liberar lactato en una base neta a medida que la duración del ejercicio progresa.
Finalmente con respecto al uso de la L como una medida de producción de lactato, la misma subestimo a la LTOT antes y después del entrenamiento. Debido a que los miembros captan y liberan lactato simultáneamente, L sola no puede cuantificar la producción de lactato de los miembros. Críticamente, las mediciones de las diferencias entre las concentraciones arteriales y venosas pierden importantes parámetros de captación y oxidación de lactato muscular
Adaptaciones al Entrenamiento
Nuestro programa de 9 semanas promovió adaptaciones metabólicas significativas (Tabla 1). Los sujetos incrementaron significativamente el VO2 pico (15 %), disminuyeron el índice de intercambio respiratorio a una carga de trabajo absoluta dada (3.2%), incrementaron la potencia para producir el umbral del lactato en un 22 %, disminuyeron la concentración arterial de lactato a la misma carga relativa (2.6 %) y a una carga de trabajo absoluta (55 %), e incrementaron la concentración de glucógeno muscular en reposo (62 %) (2).
Concentración Muscular de Lactato
Nuestros datos para la concentración de lactato muscular inmediatamente después del ejercicio fueron similares a aquellos de reportes previos (19, 28). Henriksson (19) reportó concentraciones de lactato del músculo vasto lateral en reposo sin cambios después del entrenamiento, así como concentraciones musculares de lactato no significativamente diferentes después de 50 min de ejercicio a la misma intensidad relativa, en hombres. Kiens et al. (28) también encontraron concentraciones de lactato en el vasto lateral sin cambios entre sujetos entrenados y desentrenados en reposo e inmediatamente después de 2 horas de ejercicio a la misma carga de trabajo absoluta. Nuestros datos no están de acuerdo con aquellos de otros que reportaron concentraciones musculares de lactato disminuidas en sujetos entrenados en comparación con entrenados después de un ejercicio a una intensidad absoluta dada (39) o a una intensidad relativa (22). Posiblemente, esta diferencia es debido a los controles nutricionales que nosotros impusimos en el transcurso de tiempo de la respuesta de lactato muscular que primero subió, pero luego cayo, a medida que el ejercicio continuaba (1, 11).
Varias investigaciones han reportado concentraciones de lactato muscular significativamente disminuidas al inicio del ejercicio en sujetos entrenados en comparación son sujetos desentrenados (16, 26). Esos datos son consistentes con nuestras observaciones acerca de un efecto de entrenamiento que disminuye más drásticamente al inicio del ejercicio (Figura 1 B, y C). Concentraciones de lactato muscular bajas después del entrenamiento (Tabla 2) son atribuibles a una ROX alta (Figuras 4 y 5 D).
Intercambio de Lactato en los Miembros
Nuestros resultados demuestran que el entrenamiento de resistencia disminuye la L a la misma intensidad absoluta, pero no a la misma intensidad relativa (Figura 1 C, Tabla 4). Estos datos son similares a aquellos de otros que demostraron L bajas y sin cambios en reposo (19, 22, 28, 39) y L disminuidas a través de 1 h de ejercicio a una carga de trabajo absoluta dada del después del entrenamiento (39). Adicionalmente, nuestros resultados son similares a aquellos que reportaron una L sin cambios durante el ejercicio en sujetos entrenados en comparación con desentrenados a una intensidad relativa dada (44).
Las tasas de L muscular calculadas a partir de diferencias arteriovenosas y de flujo sanguíneo disimulan la captación y oxidación de lactato durante la L (11, 12, 42). Stanley et al. (42) reportaron que la LTOT (L + captación de lactato medida con trazadores) era aproximadamente el doble que la L usando una infusión de lactato [3-14C] durante ciclismo de intensidad gradual en hombres. Subsecuentemente, usando una infusión con lactato [3-13C], Brooks et al. (11) reportaron que la LTOT era un 400 % mayor que la L durante ciclismo al 51 % del VO2 pico. Nosotros encontramos resultados similares en el presente estudio, con una LTOT media un 280 % mayor que la L pre-entrenamiento y un 320 % mayor que la post-entrenamiento (Tabla 4). Así, los resultados de nuestro estudio demuestran que la concentración sanguínea y L son mediciones inadecuadas del metabolismo del lactato en todo el cuerpo o en un tejido.
Nuestros datos muestran una disminución de la L de un miembro activo, la cual estuvo cerca de 0 después de 45 min de ejercicio (Figura 1 C), donde la concentración arterial de lactato permaneció elevada (Figura 1 A). Resultados similares han sido reportados antes (1, 11, 19, 45). Nosotros interpretamos los datos para sugerir que el músculo contribuye a elevar la concentración arterial de lactato al comienzo del ejercicio en estado estable, pero a medida que la duración del ejercicio progresa, otros tejidos se convierten en importantes para mantener la concentración de lactato circulante y proveer el lactato como un sustrajo para los músculos que trabajan. Ha sido demostrado que varios otros tejidos, incluyendo a la piel (24), el tejido adiposo (23) y el intestino (40), liberan lactato en una base neta. Es posible que la L se incremente en estos tejidos a medida que la duración del ejercicio progresa. Así, nuestros datos, así como los de otros (1, 19, 45) sugieren que el músculo no es el responsable de mantener una concentración arterial de lactato elevada después de tan poco como 45 min de ejercicio a velocidad estable.
Metabolismo Intramuscular de Lactato
Los estudios inicialmente realizados de manera independiente por Juel (25) y Watt et al. (46) en ratas y preparados de músculos de ratas, respectivamente, y subsecuentemente confirmados por Roth y Brooks (37, 38) sobre vesículas aisladas de sarcolema de ratas, indicaron que el intercambio de lactato en el miocito es mediado por una proteína transportadora de lactato. Los análisis indicando una expresión incrementada de la proteína transportadora de lactato en el sarcolema, el transportador monocarboxílico 1 (MCT 1) después del entrenamiento de corta duración (5) han sido interpretados como que el entrenamiento disminuye la producción muscular neta de lactato facilitando el intercambio de lactato entre las fibras glucolíticas y oxidativas de acuerdo a la “hipótesis del transporte de lactato célula-célula” (7). Los análisis de las biopsias obtenidas de nuestros sujetos (H. Dubouchaud, G. E. Butterfield, E. E. Wolfel, B. C. Bergman, and G. A. Brooks, observaciones no publicadas) indican que 9 semanas de entrenamiento incrementan significativamente la expresión de la isoforma de MCT 1 muscular. Sin embargo, el incremento de los transportadores de lactato del sarcolema, inducido por el entrenamiento, no puede explicar ya sea los resultados publicados en el presente o aquellos previamente publicados. Nuestros datos (Figuras 2-4, 5 D, y 6; Tablas 3 y 4) muestran que los músculos humanos que trabajan toman y oxidan lactato y que el entrenamiento incrementa el clearence intramuscular de lactato principalmente incrementando la oxidación. Recientemente, Brooks et al. (8) demostraron que las mitocondrias del músculo, el corazón, y el hígado toman y oxidan lactato directamente debido a las reservas de LDH y MCT (lactato-piruvato). Sobe esta base, y con referencias para apoyar los datos RMN (resonancia magnética nuclear) demostrando oxidación mitocondrial directa de lactato por una variedad de células y tejidos (4, 6, 43), fue propuesto un “transporte intracelular de lactato”. Así, nuestros resultados son consistentes con la expresión incrementada de proteínas y constituyentes mitocondriales del músculo, inducidos por el entrenamiento, incluyendo a la LDH y MCT mitocondriales, así facilitando la oxidación intramuscular de lactato y la acción del transporte intracelular de lactato.
Cinética del Lactato en todo el Cuerpo
Esta bien documentado que la producción y remoción de lactato se incrementan como una función directa de la intensidad de ejercicio (11, 13, 14, 30, 31, 41). Nuestros datos son consistentes con resultados previos, con respecto a que la RA y RD se incrementan significativamente como los incrementos de la intensidad de ejercicio, tanto antes como después del entrenamiento (Figura 5 A, B). Ha sido reportado que a una carga de trabajo absoluta después del entrenamiento de resistencia, la RA de lactato permanece sin cambios, mientras que la MCR se incremento significativamente en ambos, ratas (14) y humanos (33). De este modo, fue concluido que el incremento de la MCR de lactato fue el responsable en disminuir la concentración de lactato circulante después del entrenamiento.
Nuestros resultados divergen de la literatura sobre los efectos del entrenamiento de resistencia sobre la producción y remoción de lactato ya que nosotros encontramos una RA de lactato significativamente disminuida durante ABT, después del entrenamiento en comparación con aquellos parámetros determinados durante la misma tarea antes del entrenamiento (Figura 5 A y B). Así nuestros datos sugieren que el entrenamiento de resistencia promueve una disminución de la concentración arterial de lactato a una carga de trabajo absoluta dada por medio de la disminución de la RA de lactato en todo el cuerpo (Figura 5 A), la producción total de lactato de las piernas activas (Tabla 4) y la L (Figura 1 C y Tabla 4). Nosotros señalamos con respecto a esto que el incremento en la MCR de lactato en todo el cuerpo, inducido por el entrenamiento, se acerco pero no alcanzó significancia en ABT (P =0.06).
Hay varios mecanismos potenciales que pueden haber promovido la disminución de la producción de lactato (RA y LTOT) durante el ejercicio en ABT, después del entrenamiento. En un músculo que trabaja, una disminución en la degradación de glucógeno después del entrenamiento a una carga de trabajo absoluta dada (2, 22, 39) debería resultar en menos formación de lactato debido a una disminución del flujo glucolítico. Similarmente aunque el entrenamiento incrementa el contenido de los GLUT-4 musculares, menos son traslocados al salcolema durante el ejercicio a un apotencia dada después del entrenamiento (35). Quizás más importante es, que el incremento de la masa mitocondrial aumenta la oxidación intramuscular de piruvato y lactato y de este modo disminuye la L después del entrenamiento (8). En otros tejidos, la glucogenólisis que condujo a la producción de lactato pudo haber sido atenuada por la declinación de la epinefrina circulante. Consistente con esta interpretación, el bloqueo β-adrenérgico disminuye la concentración arterial de lactato, mientras que la L muscular es minimamente afectada (10).
Donovan y Brooks (14) y Phillips et al. (33) reportaron una producción y remoción de lactato sin cambios y una MCR incrementada en ratas y humanos, respectivamente, ejercitándose a una carga de trabajo absoluta dada, después de entrenamiento de resistencia. Como los investigadores anteriormente citados, nosotros encontramos que la MCR de lactato en todo el cuerpo tendió a incrementarse después del entrenamiento de resistencia en ABT (P =0.06) (Figura 5 C), sin embargo, nosotros encontramos una producción y remoción disminuidas en ABT. Phillips et al. emplearon un programa de entrenamiento corto de 10 días, lo que puede explicar porque no encontraron una disminución en la RA de lactato de todo el cuerpo en ABT. Donovan y Brooks (14) también reportaron una producción y remoción sin cambios después de un entrenamiento de resistencia en ratas. Posiblemente, la inhabilidad de controlar precisamente la intensidad de ejercicio de las ratas durante la carrera en la cinta puedo explicar la falta de concordancia con el presente estudio. Así, los datos previos sobre carrera en ratas pueden haberse parecido más a los presentes resultados obtenidos durante RLT que en ABT.
El nuestro es el primer estudio en reportar efectos del entrenamiento de resistencia sobre la cinética del lactato a una intensidad relativa dada, bajo condiciones de estado estable. Nuestros datos sugieren que el entrenamientote resistencia no altera la aparición de lactato en todo el cuerpo en RLT (Figura 5 A), pero incrementa la oxidación y el clearence de lactato en todo el cuerpo y en las piernas (Figuras 4 y 5 C y D; Tabla 4). Adicionalmente, L (Figura 1 C) y LTOT (Tabla 4) no cambiaron el RLT en comparación con el 65 % del VO2 pico pre-entrenamiento. Nosotros atribuimos a la falta de un efecto de entrenamiento sobre el flujo de lactato en todo el cuerpo y al incremento en al oxidación de lactato de las piernas en RLT después del entrenamiento, al efecto de la contracción muscular sobre la glucólisis. En comparación con el estado pre-entrenamiento, la potencia requerida para producir el 65 % del VO2 pico se incremento en 22 W, o en un 15 %, lo que provocó un flujo glucolítico similar o mayor. Así, tanto antes como después del entrenamiento de resistencia, la cinética del lactato en todo el cuerpo emparejo de cerca de la producción de lactato de los músculos que trabajaban, y la intensidad de ejercicio relativa dictó el metabolismo del lactato en todo el cuerpo y en los músculos activos.
Donovan y Brooks (14) y Brooks y Gaesser (9) reportaron por primera vez que la oxidación era el mayor destino del lactato durante y después del ejercicio, respectivamente, con un 75-80% de oxidación de los trazadores infundidos. Similarmente, usando lactato[1-13] en humanos que realizaban ejercicio, Mazzeo et al. (31) reportó un 82 % de oxidación de la RD de lactato al 50 % del máximo consumo de oxígeno y un 78 % de oxidación al 75 % del máximo consumo de oxígeno. Nuestros datos son consistentes con la literatura, mostrando a la oxidación como el destino principal de la RD de lactato durante el ejercicio (Tabla 3, Figura 5 D). En reposo, solo un 20 y 25 % del la RD de lactato fue oxidada antes y después del entrenamiento, respectivamente. Sin embargo, el ejercicio incremento dramáticamente la oxidación de lactato ya que, antes del entrenamiento, la oxidación explicó un 60 y 70 % de la RD de lactato al 45 y 65 % del VO2 pico. Después del entrenamiento, un 70 y 80 % de la RD de lactato fue oxidada en ABT y RLT, respectivamente. Así, la oxidación es el principal destino de la eliminación del lactato en todo el cuerpo durante el ejercicio, la oxidación de lactato se incrementa con la intensidad de ejercicio y también en RLT después del entrenamiento.
La producción total de lactato de las piernas explicó un 54 % de la RA de lactato de todo el cuerpo antes del entrenamiento y un 77 % después del entrenamiento (Figura 6 A). Así, nuestros datos sugieren que la mayor parte de la disminución de la RA de lactato después del entrenamiento puede haber sido atribuida a la disminución de la liberación de lactato del músculo activo. El músculo esquelético activo fue ligeramente menor influyente en la determinación de la RD de lactato de todo el cuerpo, con solo un 41 % de la RD de lactato que puede ser atribuible a la captación de lactato por el músculo activo antes del entrenamiento, y un 53 % después del entrenamiento (Figura 6 B). Otros tejidos, como el hígado y el músculo esquelético inactivo (34), tienen que haber contribuido al clearence de lactato durante el ejercicio antes y después del entrenamiento. La mayor parte de la oxidación de lactato en todo el cuerpo ocurrió solo debido a la oxidación de lactato por el músculo activo. La oxidación en las piernas explicó un 70 % de la oxidación de lactato en todo el cuerpo, antes y después del entrenamiento (Figura 6 C). Así, parece que el músculo activo es ampliamente responsable de las alteraciones en la producción y oxidación de lactato en todo el cuerpo durante el ejercicio, tanto antes como después del entrenamiento.
Presunciones y Limitaciones
Nosotros hemos hecho repetidas referencias al metabolismo del lactato en el músculo activo por todo este artículo científico con la presunción de que la mayor parte del metabolismo del lactato en los miembros es atribuible a alteraciones en el músculo esquelético. Sin embargo, las diferencias arteriovenosas a través de un miembro no representan exclusivamente el metabolismo del músculo esquelético, sino que las mismas está influenciadas por otros tejidos, incluyendo a la piel, el tejido adiposo subcutáneo y a los adipositos localizados entre las fibras musculares. Debido a que ambos, la piel (24) y el tejido adiposo (23) son conocidos por consumir glucosa y liberar lactato en una base neta, nuestro método de medición de intercambio de lactato en un miembro puede haber sobreestimado la L del músculo esquelético.
Con la falta de especificidad de las mediciones de concentración de lactato venoso, una técnica de termodilución es incapaz de determinar alteraciones en el flujo sanguíneo en diferentes tipos de fibras musculares. Nosotros asumimos que el flujo sanguíneo a una fibra muscular individual no cambiaba después del entrenamiento de resistencia, y que las alteraciones en el metabolismo del lactato de la pierna se debieron a cambios en el metabolismo celular del músculo esquelético. Es posible que el incremento de la densidad capilar alrededor de las fibras tipo I después del entrenamiento (29) pudo haber disminuido el tiempo de transporte específicamente en las fibras tipo I, resultando en una alteración de los patrones de perfusión de las fibras musculares, que pudo alterar el intercambio de lactato.
Diferentes ecuaciones fueron usadas para calcular la captación y oxidación de lactato durante el reposo y el ejercicio. 90 minutos de reposo fueron insuficientes para alcanzar un equilibrio isotópico en las cantidades de CO2, como nosotros encontramos en la liberación de 13CO2 en los miembros en reposo. De este modo, para estimar la oxidación de lactato durante el reposo nosotros determinamos la captación de lactato a partir de una dilución isotópica de lactato en la vena femoral en comparación con la sangre de la arteria. Así, nosotros podemos haber sobreestimado la oxidación de lactato de los miembros en reposo. Adicionalmente, la extracción fraccional de trazadores fue altamente variable durante el ejercicio, y nosotros estimamos la captación muscular de lactato a partir de la liberación de 13CO2 entre los miembros. Los datos variables de captación de trazadores podrían ser explicados en parte por la liberación del lactato[13C] en la sangre venosa a partir de la glucogenólisis del glucógeno marcado con 13C, almacenado durante el reposo. Sin embargo esto es improbable, ya que el período de descanso fue muy corto para que la glucosa sanguínea (2) o las reservas de glucógeno muscular se marcaran extensivamente con la glucosa[13C]. Alternativamente, nosotros consideramos si la liberación de 13CO2 a partir del músculo activo podría haberse debido a una equilibración isotópica en ciclo de Krebs durante la gluconeogénesis. Para el presente, nosotros estamos seguros de que la liberación de 13CO2 a través de los músculos que trabajan proporciona una estimación mínima aceptable de captación de lactato, ya que la descarboxilación del trazador lactato [3-13C] en los músculos que trabajan es debido a la oxidación en el ciclo de Krebs y no a la perdida de la marcación durante la gluconeogénesis, debido a que las enzimas llave de la gluconeogénesis (e.g., fosfoenolpiruvato carboxiquinasa) no están expresadas en el músculo esquelético.
Finalmente, ha habido controversia acerca de si los trazadores de lactato miden producción y remoción de lactato o piruvato, y de este modo oxidación total de carbohidratos. Las inquietudes acerca del uso de trazadores de lactato para cuantificar la producción y remoción de lactato frenan a la realización de estudios (36), en los cuales la infusión con trazadores de lactato o piruvato resulta en enriquecimientos similares de lactato y piruvato en la sangre después de varios minutos. Sin embargo, los autores fallaron en apreciar, que el equilibrio piruvato-lactato en la sangre, debido a la acción de la LDH en los eritrocitos, deja a casi todos los trazadores como lactato, debido a que el índice lactato-piruvato aumenta desde 10 a 50 o más durante el ejercicio. Por lo tanto, los trazadores de lactato infundidos permanecen como lactato en la sangre.
Más importante aún, con respecto al uso de trazadores, nuestros datos sugieren que la producción y remoción de lactato no mide la producción y remoción de piruvato, debido al índice de oxidación de lactato de las piernas y de todo el cuerpo, en relación a la oxidación de carbohidratos de las piernas y de todo el cuerpo fue siempre mucho menor que 1 (Tabla 3). Como ya fue discutido, nosotros obtuvimos excelentes correlaciones entre la RA de lactato y la LTOT (Figura 5 A). De este modo, nuestros datos sugieren que los trazadores de lactato marcados con carbono pueden ser usados para cuantificar el flujo sanguíneo de lactato.
Conclusiones
Nosotros encontramos que el entrenamiento de resistencia disminuyo la producción de lactato de todo el cuerpo y de los músculos que trabajaron (piernas) e incremento el clearence de lactato por el músculo activo a cargas de trabajo dadas de moderada intensidad. Sin embargo, a intensidades de ejercicio relativas altas, el entrenamiento de resistencia incrementa el clearence de lactato de todo el cuerpo y del músculo activo, pero no influencia la producción del mismo de todo el cuerpo o de los músculos. Así, los mecanismos para la disminución de la concentración arterial de lactato después del entrenamiento de resistencia varían dependiendo de la intensidad de ejercicio. Nosotros también encontramos que el músculo esquelético que trabaja extrae y oxida el lactato durante la L, indicando que la diferencia arteriovenosa sola subestima la producción de lactato de los miembros. Adicionalmente, el músculo esquelético activo parece contribuir a la elevación de la concentración de lactato arterial durante el comienzo del ejercicio a velocidad estable. Sin embargo, el músculo inactivo y otros tejidos deben liberar lactato durante el ejercicio para explicar el mantenimiento de concentraciones arteriales de lactato elevadas, ya que el músculo activo consume y oxida lactato sanguíneo, mientras la L de los músculos activos cae cerca de cero luego de 45 min de ejercicio. Los resultados muestran una producción y oxidación de lactato simultáneas en los músculos activos, así como otros tejidos brindan funciones de apoyo a los transportes de lactato célula-célula e intramusculares in vivo.
Agradecimientos
Los investigadores agradecen a los sujetos por participar en nuestro estudio y por cumplir el programa de entrenamiento. Es apreciada la asistencia del staff de enfermeras y dietistas del Geriatric Research, Education, and Clinical Center in the Palo Alto Veterans Affairs (VA) Health Care System. Nosotros también agradecemos a David Guido por realizar las biopsias musculares y a Jacinta Mawsan por los análisis de gases y de sangre. Agradecemos a los entrenadores de los estudiantes, que fueron vitales en el transporte y entrenamiento de los sujetos. Apreciamos enormemente al ayuda de Barry Braun y Shannon Dominick en la obtención de las muestras de sangre durante las pruebas VA. Son extendidos agradecimientos especiales a Lou Tomimatsu, Dept. of Clinical Pharmacology, Univ. of California, San Francisco, por la prepareción de los cocktails de trazadores y a Steven L. Lehman, Dept. of Integrative Biology, Univ. of California, Berkeley, por los comentarios de crítica.
Notas al Pie: Este trabajo fue apoyado por la National Institutes of Health Grants AR-42906 y DK-19577.
Dirección para pedido de reimpresiones y otras correspondencias: G. A. Brooks, Exercise Physiology Laboratory, Dept. of Integrative Biology, 5101 Valley Life Sciences Bldg., Univ. of California, Berkeley, Berkeley, CA 94720-3140 (correo electrónico: gbrooks@socrates.berkeley.edu).
Referencias
1. Ahlborg, G., and P. Felig (1982). Lactate and glucose exchange across the forearm, legs, and splanchnic bed during and after prolonged exercise. J Clin Invest 69: 45-54
2. Bergman, B., G. Butterfield, E. Wolfel, G. Lopaschuk, G. Casazza, M. Horning, and G. Brooks (1999). Muscle net glucose uptake and glucose kinetics after endurance training in men. Am J Physiol 277 (Endocrinol. Metab. 40): E81-E92
3. Bergman, B. C., G. E. Butterfield, E. E. Wolfel, G. A. Casazza, G. D. Lopaschuk, and G. A. Brooks (1999). An evaluation of exercise and training on muscle lipid metabolism. Am J Physiol 276 (Endocrinol. Metab. 39): E106-E117
4. Bertocci, L. A., and B. F. Lujan (1999). Oxidative incorporation and utilization of [3-13C] lactate and [1,2-13C]acetate by rat skeletal muscle. J Appl Physiol 86: 2077-2089
5. Bonen, A., K. J. McCullagh, C. T. Putman, E. Hultman, N. L. Jones, and G. J. Heigenhauser (1998). Short-term training increases human muscle MCT1 and femoral venous lactate in relation to muscle lactate. Am J Physiol 274 (Endocrinol. Metab. 37): E102-E107
6. Bouzier, A. K., P. Voisin, R. Goodwin, P. Canioni, and M. Merle (1998). Glucose and lactate metabolism in C6 glioma cells: evidence for the preferential utilization of lactate for cell oxidative metabolism. Dev Neurosci 20: 331-338
7. Brooks, G. A (1985). Lactate: glycolytic end product and oxidative substrate during sustained exercise in mammals the lactate shuttle. In: Circulation, Respiration, and Metabolism,Current Comparative Approaches, edited by R. Gilles. Berlin: Springer-Verlag, p. 208-218
8. Brooks, G. A., H. Dubouchaud, M. Brown, J. P. Sicurello, and C. E. Butz (1999). Role of mitochondrial lactate dehydrogenase and lactate oxidation in the intracellular lactate shuttle. Proc Natl Acad Sci USA 96: 1129-1134
9. Brooks, G. A., and G. A. Gaesser (1980). End points of lactate and glucose metabolism after exhausting exercise. J Appl Physiol 49: 1057-1069
10. Brooks, G. A., E. E. Wolfel, G. E. Butterfield, A. Cymerman, A. C. Roberts, R. S. Mazzeo, and J. T. Reeves (1998). Poor relationship between arterial [lactate] and leg net release during exercise at 4,300-m altitude. Am J Physiol 275 (Regulatory Integrative Comp. Physiol. 44): R1192-R1201
11. Brooks, G. A., E. E. Wolfel, B. M. Groves, P. R. Bender, G. E. Butterfield, A. Cymerman, R. S. Mazzeo, J. R. Sutton, R. R. Wolfe, and J. T. Reeves (1992). Muscle accounts for glucose disposal but not blood lactate appearance during exercise after acclimatization to 4,300 m. Appl Physiol 72: 2435-2445
12. Consoli, A., N. Nurjhan, J. J. Reilly, Jr., D. M. Bier, and J. E. Gerich (1990). Contribution of liver and skeletal muscle to alanine and lactate metabolism. Am J Physiol 259 (Endocrinol. Metab. 22): E677-E684
13. Depocas, F., Y. Minaire, and J. Chatonnet (1969). Rates of formation and oxidation of lactic acid in dogs at rest and during moderate exercise. Can. J Physiol Pharmacol 47: 603-610
14. Donovan, C. M., and G. A. Brooks (1983). Endurance training affects lactate clearance, not lactate production. Am J Physiol 244 (Endocrinol. Metab. 7): E83-E92
15. Douglas, A., N. Jones, and J. Reed (1988). Calculation of whole blood CO2 content. J Appl Physiol 65: 473-477
16. Favier, R. J., S. H. Constable, M. Chen, and J. O. Holloszy (1986). Endurance exercise training reduces lactate production. J Appl Physiol 61: 885-889
17. Finegan, B. A., G. D. Lopaschuk, C. S. Coulson, and A. S. Clanachan (1993). Adenosine alters glucose use during ischemia and reperfusion in isolated rat hearts. Circulation 87: 900-908
18. Gutmann, I., and A. Wahlefeld (1974). L-(+)-lactate determination with lactate dehydrogenase and NAD. In: Methods of Enzymatic Analysis. (2nd ed.), edited by H. Bergmeyer. New York: Academic, pp. 1464-1468
19. Henriksson, J (1977). Training induced adaptation of skeletal muscle and metabolism during submaximal exercise. J Physiol (Lond.) 270: 661-675
20. Hurley, B., J. Hagberg, W. Allen, D. Seals, J. Young, R. Cuddihee, and J. Holloszy (1984). Effect of training on blood lactate levels during submaximal exercise. J Appl Physiol 56: 1260-1264
21. Jackson, A., and M. Pollock (1978). Generalized equations for predicting body density of men. Br J Nutr 40: 497-504
22. Jansson, E., and L. Kaijser (1987). Substrate utilization and enzymes in skeletal muscle of extremely endurance-trained men. J Appl Physiol 62: 999-1005
23. Jansson, P. A., U. Smith, and P. Lonnroth (1990). Evidence for lactate production by human adipose tissue in vivo. Diabetologia 33: 253-256
24. Johnson, J. A., and R. M. Fusaro (1972). The role of the skin in carbohydrate metabolism. Adv Metab Disord 60: 1-55
25. Juel, C (1988). Intracellular pH recovery and lactate efflux in mouse soleus muscles stimulated in vitro: the involvement of sodium/proton exchange and a lactate carrier. Acta Physiol Scand 132: 363-371
26. Karlsson, J., L. Nordesjo, L. Jorfeldt, and B. Saltin (1972). Muscle lactate, ATP, and CP levels during exercise after physical training in man. J Appl Physiol 33: 199-203
27. Kelman, G (1967). Digital computer procedure for the conversion of PCO2 into blood content. Respir Physiol 3: 111-115
28. Kiens, B., B. Essen-Gustavsson, N. Christensen, and B. Saltin (1993). Skeletal muscle substrate utilization during submaximal exercise in man: effect of endurance training. J Physiol (Lond.) 469: 459-478
29. Klausen, K., L. B. Andersen, and I. Pelle (1981). Adaptive changes in work capacity, skeletal muscle capillarization and enzyme levels during training and detraining. Acta Physiol Scand 113: 9-16
30. MacRae, H., S. Dennis, A. Bosch, and T. Noakes (1992). Effects of training on lactate production and removal during progressive exercise in humans. J Appl Physiol 72: 1649-1656
31. Mazzeo, R. S., G. A. Brooks, D. A. Schoeller, and T. F. Budinger (1986). Disposal of blood [1-13C] lactate in humans during rest and exercise. J Appl Physiol 60: 232-241
32. Pendergrass, M., E. Fazioni, D. Collins, and R. A. DeFronzo (1998). IGF-I increases forearm blood flow without increasing forearm glucose. Am J Physiol 275 (Endocrinol. Metab. 38): E345-E350
33. Phillips, S., H. Green, M. Tarnopolsky, and S. Grant (1995). Increased clearance of lactate after short-term training in men. J Appl Physiol 79: 1862-1869
34. Richter, E., B. Kiens, B. Saltin, N. Christensen, and G. Savard (1988). Skeletal muscle glucose uptake during dynamic exercise in humans: role of muscle mass. Am J Physiol 254 (Endocrinol. Metab. 17): E555-E561
35. Richter, E. A., P. Jensen, B. Kiens, and S. Kristiansen (1998). Sarcolemmal glucose transport and GLUT-4 translocation during exercise are diminished by endurance training. Am J Physiol 274 (Endocrinol. Metab. 37): E89-E95
36. Romijn, J. A., D. L. Chinkes, J. M. Schwarz, and R. R. Wolfe (1994). Lactate-pyruvate interconversion in blood: implications for in vivo tracer studies. Am J Physiol 266 (Endocrinol. Metab. 29): E334-E340
37. Roth, D. A., and G. A. Brooks (1990). Lactate and pyruvate transport is dominated by a pH gradient-sensitive carrier in rat skeletal muscle sarcolemmal vesicles. Arch Biochem Biophys 279: 386-394
38. Roth, D. A., and G. A. Brooks (1990). Lactate transport is mediated by a membrane-bound carrier in rat skeletal muscle sarcolemmal vesicles. Arch Biochem Biophys 279: 377-385
39. Saltin, B., K. Nazar, D. Costill, E. Stein, E. Jansson, B. Essen, and P. Gollnick (1976). The nature of the training response: peripheral and central adaptations to one-legged exercise. Acta Physiol Scand 96: 289-305
40. Stanley, W. C., E. W. Gertz, J. A. Wisneski, D. L. Morris, R. A. Neese, and G. A. Brooks (1985). Systemic lactate kinetics during graded exercise in man. Am J Physiol 249 (Endocrinol. Metab. 12): E595-E602
41. Stanley, W. C., E. W. Gertz, J. A. Wisneski, R. A. Neese, D. L. Morris, and G. A. Brooks (1986). Lactate extraction during net lactate release in legs of humans during exercise. J Appl Physiol 60: 1116-1120
42. Sumegi, B., B. Podanyi, P. Forgo, and K. E. Kover (1995). Metabolism of [3-13C]pyruvate and [3-13C]propionate in normal and ischaemic rat heart in vivo: 1H- and 13C-NMR studies. Biochem J 312: 75-81
43. Turcotte, L., E. Richter, and B. Kiens (1992). Increased plasma FFA uptake and oxidation during prolonged exercise in trained vs. untrained humans. Am J Physiol 262 (Endocrinol. Metab. 25): E791-E799
44. Wahren, J., P. Felig, G. Ahlborg, and L. Jorfeldt (1971). Glucose metabolism during leg exercise in man. J Clin Invest 50: 2715-2725
45. Watt, P. W., P. A. MacLennan, H. S. Hundal, C. M. Kuret, and M. J. Rennie (1988). L(+)-lactate transport in perfused rat skeletal muscle: kinetic characteristics and sensitivity to pH and transport inhibitors. Biochim Biophys Acta 944: 213-222
46. Wolfe, R. R (1992). Radioactive and Stable Isotope Tracers in Biomedicine: Principles and Practice of Kinetic Analysis. New York: Wiley-Liss