Cómo afecta la adiposidad sobre la insulina con ejercicios de fuerza en mujeres no diabéticas.
Publicado 3 de enero de 2014, 14:54
Gran parte de la población adulta de los países desarrollados sufre de obesidad y tienen un alto riesgo de padecer diabetes tipo II. Como se sabe, la adiposidad daña la tolerancia a la glucosa en una gran magnitud induciendo resistencia a la insulina y empeorando la función de las células β (células del páncreas, que sintetizan y segregan la insulina, una hormona que controla los niveles de glucosa en la sangre) (Despres y cols. 2001; Abdul-Ghani y cols. 2006; Samuel y Shulman. 2012). El ejercicio de fuerza puede ser una buena alternativa al ejercicio aeróbico convencional porque requiere menos tiempo, intensifica la función física vía una mayor fuerza muscular, reduce los factores de riesgo cardiometabólicos, y mejora el control glucémico (Cheng y cols. 2007; Karelis y cols. 2008; Potteiger y cols. 2011). El ejercicio de fuerza mejora la regulación de la glucosa en parte intensificando la sensibilidad de la insulina (Cuff y cols. 2003; Holten y cols. 2004; Ishii y cols. 1998; Reed y cols. 2012), y reduciendo la contribución de las células β para librar la insulina (Fenicchia y cols. 2004; Fluckey y cols. 1994). Aunque la pérdida de grasa corporal es a menudo un objetivo primario para mejorar la regulación de la glucosa, la obesidad puede despuntar las mejoras en sí sobre la sensibilidad de la insulina después del ejercicio aeróbico e intervenciones dietéticas (Thamer y cols. 2007). Una complicación en la sensibilidad variable al ejercitarse es el sexo. Las mujeres son reportadas de tener respuestas glucémicas más pobres al ejercicio de fuerza comparado a los hombres (Hurlbut y cols. 2002; Schmitz y cols. 2002). Esta última observación es potencialmente problemática ya que las mujeres son más comúnmente diagnosticadas con tolerancia anormal a la glucosa que los hombres (Anderwald y cols. 2011; Blake y cols. 2004). Como hay diferencias en la grasa corporal entre los géneros, la comprensión de los efectos de la adiposidad en las mujeres sobre la eficacia del ejercicio de fuerza agudo y crónico para prevenir el deterioro de la tolerancia a la glucosa es de suma importancia. Así tenemos un muy reciente estudio del Laboratorio de Metabolismo Energético, del Departamento de kinesiología de la Universidad de Massachusetts (EEUU), que probó la hipótesis de que la grasa corporal excesiva atenuaría la mejora en la sensibilidad de la insulina y en la reducción en la secreción de insulina estimulada por la glucosa después del ejercicio de fuerza agudo y crónico. Saber estos resultados tiene tanto relevancia clínica como de salud pública ya que la obesidad representa un factor de riesgo primario para la enfermedad metabólica, y la obesidad también puede actuar como un indicador de sensibilidad metabólica inducida por el ejercicio.
Para tal fin, se reclutaron 26 mujeres jóvenes (ver en Tabla 1, las características) sedentarias y sin diabetes tipo II. No tenían experiencias en ejercicios de fuerza, solamente de ejercicio aeróbico liviano (60’ por semana). Se les realizaron medidas antropométricas: circunferencias de cadera y cintura, talla, peso, absorsiometría DXA para determinar masa libre de grasa y grasa corporal, y para devidir los grupos. La grasa corporal 'androide' fue definida en una distancia que iguala el 20% sobre la posición superior de la pelvis. La grasa corporal 'ginecoide' se expresó como la grasa localizada entre la cima de la pelvis y la parte superior del trocánter mayor. La grasa corporal normal (NBF, normal body fat) fue definida como <35%, mientras la grasa corporal alta (HBF, high body fat) fue definida como >40%, de tal manera que las respuestas en las mujeres de grasa corporal normal (~25%) y de grasa corporal elevada (~45%) podrían compararse (Heyward. 2002). Las mediciones antropométricas fueron repetidas dentro de 72 hs después de completar la intervención de 7 semanas.
Tabla 1. Las características de los sujetos (mujeres) antes y después del entrenamiento de la fuerza progresivo (PRT).
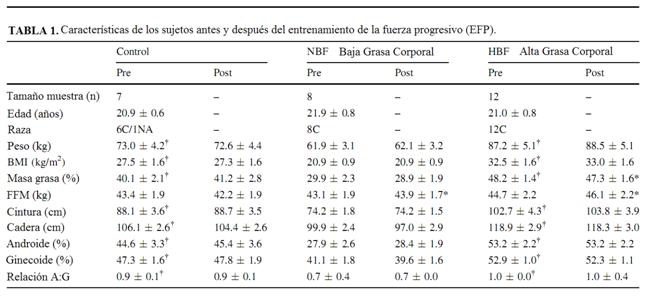
Los datos son promedios ± SEM
C, población caucásica (blanca); NA, americano nativo; FFM, masa libre de grasa; BMI, índice de masa corporal; 1-MR, una máxima repetición; A:G, grasa androide:ginecoide
Comparado a pre * p ≤ 0.01
Comparado a NBF pre † p <0.01
Antes de la intervención, la fuerza fue medida para un test de una máxima repetición (1-MR) (Baechle y Earle 2008) para determinar las cargas apropiadas de trabajo de los ejercicios. Los tests de fuerza post-estudio fueron determinados dentro de las 72 hs de la intervención. La fuerza total fue definida por la suma del press de piernas y de pecho.
Protocolo de Ejercicio de fuerza agudo (EFA)
Las mujeres completaban un precalentamientos de 5–10 minutos. El EFA incluyó diez ejercicios (press de pecho, press de piernas, estocadas, curls de isquiotibiales, elevación de pantorrillas, remo de polea sentado, press de hombros, curls de bíceps, extensiones de tríceps, y ejercicio abdominal) que se realizaron al 60% de 1-MR para tres series de 10–12 repeticiones con 30–90 segundos de descanso entre las series. La sesión concluía con 5–10 minutos de estiramiento estático. Todos los ejercicios se realizaron según el criterio de la NSCA (Baechle y Earle 2008).
El Protocolo de entrenamiento de fuerza progresivo (EFP)
Todos los ejercicios realizados durante el entrenamiento eran idénticos a los llevados a cabo en el día de prueba de EFA. Las mujeres fueron sometidas a las sesiones de ejercicio totalmente supervisadas 3 días/semana por aproximadamente 60 min/sesión, al 60% 1-MR. Ellas realizaron 3 series de 8–12 repeticiones con 90–120 segundos de pausa entre las series. Las cargas de entrenamiento eran aumentadas por un método de progresión, cuando ellas ganaban fuerza (Baechle y Earle 2008). Cada sesión empezaba y terminaba con 5–10 minutos de estiramiento estático de cuerpo completo. Esta prescripción de ejercicio fue seleccionada porque obedece a las recomendaciones de la NSCA, y era probable de promover la adhesión en mujeres sedentarias desentrenadas. La adhesión fue definida por el número de sesiones de ejercicio completas dentro de la intervención de 7 semanas. También se les dijo a las mujeres que mantengan una actividad física habitual y hábitos de dieta a lo largo del estudio.
Con respecto a la sensibilidad de la insulina y la secreción de la insulina estimulada por glucosa, un test OGTT de 75g estándar fue realizado para evaluar los niveles de glucosa y la de insulina en 0, 60, y 120 minutos (es un test de tolerancia a la glucosa oral estándar de 75g). A partir del OGTT, la sensibilidad de la insulina fue determinada usando el índice de Matsuda: 10,000/H[(glucosa en ayuno (mg/dl) x insulina en ayuno (μU/ml) x (glucosa posprandial promedio (mg/dl) x media la insulina posprandial (lU/ml))] (DeFronzo y Matsuda 2010; Miyazaki y cols. 2008). La glucosa total y el área bajo la curva de insulina (AUC) fueron calculados usando el método trapezoidal. La secreción de insulina estimulada por glucosa fue calculada dividiendo la insulina por la AUC de glucosa a partir de los primeros 60 minutos del OGTT (es decir INS0-60/GLC0-60). El índice de disposición oral (DI), una medida de la función de las células β pancreáticas en respuesta a la sensibilidad de la insulina, fue calculado como: INS0-60/GLC0-60 x índice Matsuda (Abdul-Ghani y cols. 2006; Miyazaki y cols. 2008). Todas las mujeres completaron la evaluación metabólica dentro de las 12–24 hs del último turno de ejercicio y se reportaron al laboratorio en el mismo momento de día para todos los tests OGTT.
Muestras de sangre fueron tomadas en los grupos de control, de NBF y de HBF al azar. Allí se analizaron niveles de glucosa e insulina en Pre-intervención, durante y post-intervención.
Los resultados
Antropometría y fuerza
La adhesión del ejercicio físico fue excelente en los grupos NBF y HBF (97.3 ± 1.4 vs. 96.8 ± 1.3%, respectivamente; p = 0.83). El peso corporal no cambió después de la intervención en cualquiera de los grupos, pero los dos grupos de ejercicio aumentaron la FFM (Tabla 1; p <0.05). El entrenamiento disminuyó la grasa corporal total por aproximadamente 2% en los dos grupos de ejercicio, sin embargo, esto fue estadísticamente sólo significativo en las mujeres de HBF (Tabla 1, p ≤ 0.05). No hubo ningún cambio estadístico en las circunferencias cadera/cintura, grasa corporal androide y ginecoide después del EFP para ambos grupos (Tabla 1). Tanto el grupo NBF como el grupo HBF aumentaron la fuerza después del entrenamiento comparado a los controles (p <0.05; Tabla 2).
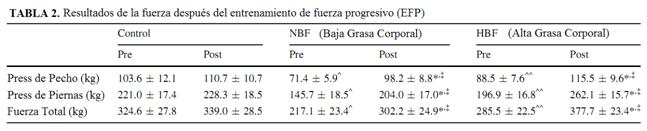
Los datos son ± SEM promedios. Fuerza total = Press de pecho + Press de Piernas a partir del test de 1-MR
Comparado a pre * p ≤0.01
Comparado a delta control (post-pre)‡ p ≤0.01
Comparado a control pre ^ p <0.05, ^^ p <0.07
Las respuestas metabólicas
Se dirigieron los tests OGTT a través de los grupos antes de la intervención, después del EFA y luego después de 7 semanas de entrenamiento (EPF). La duración del último turno de ejercicio antes de la evaluación metabólica fue similar entre las mujeres de los grupos NBF y HBF (NBF agudo 16.7 ± 1.3 vs. 17.0 ± 0.4 hs, p = 0.84; entrenamiento NBF 16.8 ± 1.4 vs. HBF 16.3 ± 0.9 hs, p = 0.77), indicando que la diferencia entre los grupos en respuesta a la carga de carbohidratos no fue debido a las variaciones en el tiempo después del último turno de ejercicio.
Respuestas de la glucosa y de la insulina
No hubo ninguna diferencia basal para cualquier medida de glucosa para los grupos. Es más, los niveles de glucosa de ayuno y post-prandiales estuvieron inalterados tanto en EFA como EFP (Tabla 3). Sin embargo, como podría esperarse antes de la intervención, las mujeres de HBF tuvieron los niveles más altos de insulina de ayuno y la AUC de insulina comparado a las mujeres de NBF (p\0.05; Tabla 3). El EFA no tuvo un efecto estadísticamente significativo en la insulina de ayuno o AUC de insulina en cualquiera de los grupos. Sin embargo, el EFP produjo niveles menores de insulina en ayuno y la insulina de 120 minutos en las mujeres del grupo de NBF (aproximadamente 32% y 45% más bajos, respectivamente), comparado a la línea de base y a las mujeres del grupo HBF (p <0.05). Posteriormente, la AUC de insulina fue un 34% inferior después del entrenamiento en las mujeres del grupo NBF (p = 0.05; Tabla 3), mientras permaneció inalterada en el grupo de HBF.
La sensibilidad de la insulina
Las mujeres del grupo NBF tenían la sensibilidad de la insulina superior (vía índice Matsuda) comparado a las mujeres de HBF antes de la intervención (p <0.05; Fig. 1a). La sensibilidad de la insulina no mejoró estadísticamente después del EFA tanto en NBF (p = 0.06) como en HBF (p = 0.92). Sin embargo, el EFP aumentó la sensibilidad de la insulina por aproximadamente un 95% en las mujeres del grupo NBF comparado a los controles y a las mujeres del grupo HBF (p <0.05; Fig. 1a).
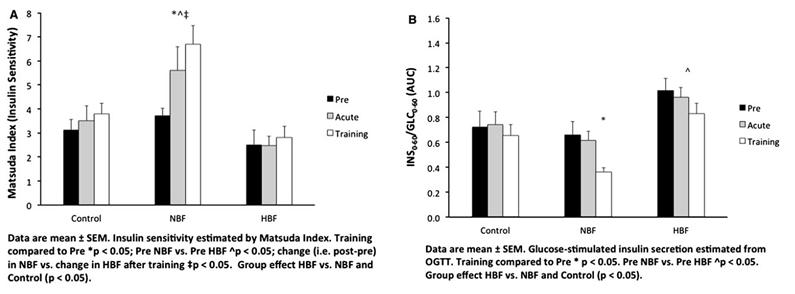
Figura 1. Efecto del entrenamiento de la fuerza agudo (EFA) y
el entrenamiento de la fuerza progresivo (EFP) sobre la sensibilidad de la
insulina (a) y sobre la secreción de la insulina estimulada por la glucosa (INS0-60/GLC0-60)
(b)
Secreción de insulina
Las mujeres de HBF tenían
una superior secreción de la insulina estimulada por glucosa (es decir,
INS0-60/GLC0-60) comparado al grupo de NBF antes de la intervención (efecto de
grupo; p <0.05; Fig. 1b). El EFA no tuvo efecto sobre la secreción de
insulina y, por lo tanto, en el índice de disposición oral (es decir, la
función de las células B) en cualquiera de los grupos. Sin embargo, el EFP
redujo significativamente la secreción de la insulina estimulada por glucosa
por aproximadamente un 32% en el grupo de NBF que fue significativamente
diferente de las mujeres de HBF (p <0.05; Fig. 1b). Puesto que la
sensibilidad de la insulina aumentó y la secreción de insulina disminuyó en el
grupo de NBF después del entrenamiento, no hubo cambios en el índice de
disposición oral comparado a la pre-evaluación (Tabla 3). Ni el EFA ni el EFP
mejoraron la secreción de insulina estimulada por glucosa estadísticamente en
las mujeres del grupo HBF (p = 0.38 y p = 0.07, respectivamente).
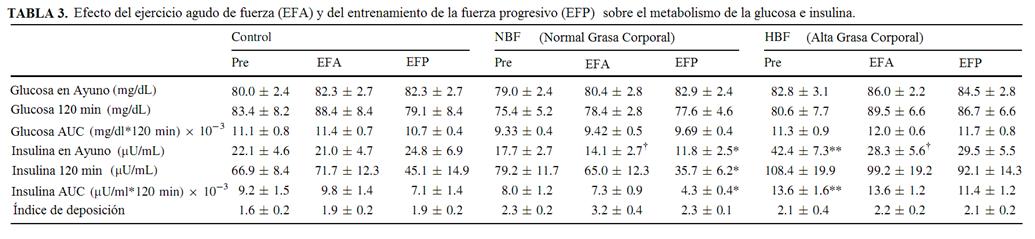
Los datos son ± SEM promedios.
AUC área bajo la curva, índice de Disposición = es decir, liberación de insulina estimulada por la glucosa x índice de Matsuda. Los datos de glucos e insulina de obtuvieron de un test de tolerancia de glucosa oral de 75gr. Convertir la glucosa a mmol/L multiplicado por 0.0555. Para convertir la insulina a pmol/L multiplicar por 6.945
Comparado a pre * p ≤ 0.05; † p <0.07
HBF comparado a NBF pre * * p <0.05
Las correlaciones
La sensibilidad aumentada de la insulina basal fue asociada con la grasa corporal total inferior (r = -0.46, cada p <0.01) y la grasa corporal androide (r = -0.43, p <0.02). La secreción elevada de la insulina estimulada por glucosa basal se correlacionó con la grasa corporal total mayor (r = 0.55, p <0.01) y la grasa corporal androide (r = 0.51, cada p <0.02), y la sensibilidad de la insulina baja (r = -0.61, p = 0.008).
El cambio (pre-post) en la sensibilidad de la insulina después del EFP también se relacionó inversamente al cambio en la liberación de insulina estimulada por la glucosa (r = -0.71; p <0.001), la insulina en ayuno (r = -0.71; p <0.001), y la AUC de insulina (r = -0.85, p <0.001). La fuerza total mayor se correlacionó con la menor insulina en ayuno después del EFP (r = -0.39; p <0.05).
Análisis de los Resultados
El hallazgo principal de este estudio fue que la obesidad debilitó las mejoras en la sensibilidad de la insulina y en la secreción de la insulina estimulada por glucosa después del EFP en mujeres normoglucémicas jóvenes (Fig. 1a, b). Estos resultados son consistentes con recientes trabajos que demuestran que la obesidad atenúa las mejoras en la sensibilidad de la insulina después del ejercicio aeróbico y pérdida de peso en adultos de mediana edad (Thamer y cols. 2007). Sin embargo, los resultados del actual estudio son nuevos porque solamente mujeres obesas y mujeres jóvenes previamente sedentaria, no-diabética se compararon a la grasa corporal normal, contrario a una salud mejor. Estos resultados también proveen una visión en trabajos previos que indican que las mujeres que típicamente tienen más grasa corporal que los hombres tienen mejoras más pobres en el control glucémico después del entrenamiento (Hurlbut y cols. 2002; Schmitz y cols. 2002). Globalmente, nuestros datos indican que las mujeres obesas jóvenes tienen reducida la sensibilidad de la acción de insulina después del entrenamiento de fuerza agudo y progresivo.
Hay varias posibles explicaciones para el efecto negativo de la obesidad sobre las mejoras crónicas inducidas por entrenamiento sobre la sensibilidad de la insulina en este estudio. Puesto que las mujeres del grupo HBF tenían grasa corporal androide significativamente superior, es posible que la grasa central contribuyera a respuestas pobres de la acción de insulina al EFP. Sin embargo, la pérdida de grasa fue mínima después del EFP y comparable entre los grupos. Así, los datos indican que la mayor sensibilidad de la insulina después del EFP puede ser en sí independiente de los cambios en la masa grasa. Alternativamente, las ganancias atenuadas en la sensibilidad de la insulina después del EFP en las mujeres del grupo HBF pueden ser debidas a la baja fuerza muscular inicial, que a su vez, se vieron comprometidas la capacidad de trabajo y las ganancias 'empeoradas' de fuerza inducidas por el entrenamiento (Ibanez y cols. 2008). Esto es poco probable que haya influido en la sensibilidad de la insulina en el actual estudio aunque puesto que la fuerza en los valores de base y en respuesta al EFP fue comparable entre los grupos NBF y HBF. Es más, la adhesión del ejercicio fue excelente (~97% en cada grupo de ejercicio), indicando que el estímulo del ejercicio fue equivalente entre las mujeres de los grupos NBF y HBF. Independiente de las ganancias de fuerza, las respuestas de la masa muscular absoluta y respuestas anabólicas al ejercicio de fuerza han sido implicadas en la regulación del consumo de glucosa (Ishii y cols. 1998; Nilsson y cols. 2010; Stickland y cols. 1994). En efecto, algunos han indicado que la obesidad puede debilitar las respuestas anabólicas del músculo esquelético al ejercicio de fuerza (Nilsson y cols. 2010). En este estudio, la FFM aumentó comparablemente entre los grupos de ejercicio después del EFP, lo que indica que la mejora atenuada en la acción de la insulina después del EFP en las mujeres de grupo HBF fue independiente de los cambios en la masa muscular. Porque la sensibilidad de la insulina refleja el consumo de glucosa del músculo esquelético ampliamente, y la obesidad perjudicó la mejora en la sensibilidad de la insulina, las diferencias observadas en este estudio pueden ser intrínsecas al metabolismo de la glucosa y la insulina en el músculo esquelético (por ejemplo GLUT-4, Akt, PGC1-α, AMPK, etc.) (Holten y cols. 2004; Layne y cols. 2011; Nilsson y cols. 2010). Se necesitan más estudios acerca de la influencia de la grasa corporal sobre los mediadores celulares de la sensibilidad de la insulina del músculo esquelético en mujeres normoglucémicas obesas al realizar entrenamiento de la fuerza, ya que los datos de este estudio indican que puede haber un umbral de masa grasa crítico sobre el que se debilitan las mejoras metabólicas inducidas por el ejercicio. El efecto de la grasa corporal excesiva en la atenuación de la mejora en la acción de insulina después del EFP en este estudio puede atribuirse a la resistencia de la insulina relacionada a la obesidad. Globalmente, los datos de este estudio indican que el ejercicio de fuerza eleva la sensibilidad de la insulina y reduce la insulina sanguínea a una magnitud mayor en mujeres que ya son más sensibles a la hormona. En realidad, las mujeres de grupo NBF eran más sensibles a la insulina (estimado por el índice de Matsuda, la AUC de insulina, o los niveles de insulina en ayunas) antes del entrenamiento, y los del grupo NBF aumentaron la acción de la insulina más que las mujeres más obesas después del EFP. Aunque la intensidad del ejercicio usada en este estudio fue moderada (es decir 60% de 1-MR), el programa tuvo éxito en lograr una mayor FFM y en la fuerza total en los grupos NBF y HBF.
Desde una perspectiva clínica, estos datos indican que pueden requerirse terapias más agresivas para las mujeres obesas para mejorar la regulación de la glucosa, pero si una intensidad superior, o una duración más larga, o un ejercicio de fuerza más frecuente supera el efecto debilitante de la adiposidad en la acción de la insulina en las mujeres, se mantiene incierto (Metcalfe y cols. 2012; Reed y cols. 2012). Cuando la sensibilidad de la insulina de todo el cuerpo mejora sin cambio en los niveles de glucosa sanguínea, es razonable esperar una menor secreción de insulina (Kahn y cols. 1993). Se pudo observar una correlación fuerte entre la sensibilidad de la insulina mejorada y una reducida secreción de insulina estimulada por glucosa después del EFP (r = -0.71, p <0.001).
En conclusión, este estudio demostró que la adiposidad atenúa las mejoras en la acción de la insulina después del entrenamiento de la fuerza en mujeres no-diabéticas jóvenes. Sin embargo, se advierte que los datos no desalientan a las mujeres obesas a realizar ejercicios de fuerza, ya que este estudio se dirigió durante sólo 7 semanas. Es más, no se evaluó ningún marcador cardiovascular o inflamatorio que refleje condiciones patofisiológicas, y la mejor evidencia indica beneficios cardiometabólicos del ejercicio de fuerza (Potteiger y cols. 2011). Se mantiene como posible que el ejercicio de fuerza a largo plazo sólo, o en combinación con el entrenamiento aeróbico, podría inducir efectos más favorables en la regulación glucémica (Church y cols. 2010; Jenkins y Hagberg 2011).
Tomados juntos, estos datos indican que la obesidad puede comprometer la eficacia de intervenciones de ejercicios de fuerza diseñadas para bajar el riesgo de enfermedades metabólicas cuando es comparado a individuos de peso normal. Estos datos merecen la necesidad de un trabajo adicional para evaluar los efectos de la obesidad sobre la sensibilidad en modalidades de ejercicio diferentes, de tal manera que puedan ajustarse a terapias de estilo de vida para que los individuos minimicen el riesgo de enfermedad metabólica.
Referencias
Malin SK, Hinnerichs KR, Echtenkamp BG, Evetovich TK, Engebretsen BJ. (2013). Effect of adiposity on insulin action after acute and chronic resistance exercise in non-diabetic women. Eur J Appl Physiol. 2013 Dec;113(12):2933-41.
Abdul-Ghani M, Tripathy D, DeFronzo R (2006) Contributions of bcell dysfunction and insulin resistance to the pathogenesis of impaired glucose tolerance and impaired fasting glucose.Diabetes Care 29:1130–1139.
Despres JP, Lemieux I, Prud’homme D (2001) Treatment of obesity: need to focus on high risk abdominally obese patients. BMJ 322:716–720.
Black SE, Mitchell E, Freedson PS, Chipkin SR, Braun B (2005) Improved insulin action following short-term exercise training: role of energy and carbohydrate balance. J Appl Physiol 99:2285
Blake D, Meigs J, Muller D, Najjar S, Andres R, Nathan D (2004) Impaired glucose tolerance, but not impaired fasting glucose, is associated with increased levels of coronary heart disease risk factors: results from the Baltimore longitudinal study on aging. Diabetes 53:2095–2100.
Bouchard C, Blair SN, Church TS, Earnest CP, Hagberg JM, Hakkinen K, Jenkins NT, Karavirta L, Kraus WE, Leon AS, Rao DC, Sarzynski MA, Skinner JS, Slentz CA, Rankinen T (2012) Adverse metabolic response to regular exercise: is it a rare or common occurrence? PLuS ONE 7:e37887.
Potteiger J, Claytor R, Hulver M et al (2011) Resistance exercise and aerobic exercise when paired with dietary energy restriction both reduce the clinical components of metabolic syndrome in previously physically inactive males. Eur J Appl Physiol 112(6):2035–2044.
Church T, Blair S, Cocreham S et al (2010) Effects of aerobic and resistance training on hemoglobin A1c levels in patients with type 2 diabetes: a randomized controlled trial. JAMA 304:2253–2262.
Heyward VH (2002) Advanced fitness assessment and exercise prescription. Human Kinetics, Champaign.
Holten MK, Zacho M, Gaster M, Juel C, Wojtaszewski JFP, Dela F (2004) Strength training increases insulin-mediated glucose uptake, GLUT4 content, and insulin signaling in skeletal muscle in patients with type 2 diabetes. Diabetes 53:294–305.
Hurlbut DE, Lott ME, Ryan AS et al (2002) Does age, sex, or ACE genotype affect glucose and insulin responses to strength training? J Appl Physiol 92:643–650.
Metcalfe R, Babraj J, Fawkner S, Vollaard NBJ (2012) Towards the minimal amount of exercise for improving metabolic health: beneficial effects of reduced-exertion high-intensity interval training. Eur J Appl Physiol 112:2767–2775.
Reed M, Ben Ezra V, Biggerstaff K, Nichols D (2012) The effects of two bouts of high- and low-volume resistance exercise on glucose tolerance in normoglycemic women. J Strength Cond Res 26:251–260.
Nilsson M, Greene N, Dobson J et al (2010) Insulin resistance syndrome blunts the mitochondrial anabolic response following resistance exercise. Am J Physiol Endocrinol Metab 299:E466–E474.
Kahn SE, Prigeon RL, McCulloch DK et al (1993) Quantification of the relationship between insulin sensitivity and b-cell function in human subjects. Evidence for a hyperbolic function. Diabetes 42:1663–1672.
Jenkins N, Hagberg J (2011) Aerobic training effects on glucose tolerance in prediabetic and normoglycemic humans. Med Sci Sports Exerc 43:2231–2240
Baechle TR, Earle RW (2008) Essentials of strength training and conditioning. Human Kinetics, Champaign.
Balkau B, Mhamdi L, Oppert J et al (2008) Physical activity and insulin sensitivity: the RISC study. Diabetes 57:2613.