Contenido Mineral Óseo en Atletas Amenorreicas y Eumenorreicas
Barbara L Drinkwater, Karen Nilson, Charles H Chesnuh III, William J Bremner, Sydney Shainholtz y Molly B Southworth
Artículo publicado en el journal PubliCE, Volumen 0 del año 1984.
Publicado 20 de enero de 2006
Resumen
Palabras clave: masa ósea, densidad mineral ósea, menorrea, mujer
INTRODUCCION
La prevalencia de amenorrea secundaria entre las deportistas mujeres ha variado entre un 3,4 y un 43%, dependiendo de la definición de amenorrea utilizada por los investigadores y de la selección de los sujetos (1,2). Por ejemplo, entre un grupo de atletas de resistencia altamente entrenadas, entre el 25 y el 40% reportaron tener menos de tres períodos menstruales por año (2,3). Las preocupaciones acerca de las implicaciones clínicas de este fenómeno se centraron originalmente sobre los posibles efectos negativos en la función reproductiva. Más recientemente, se ha prestado atención a las posibles consecuencias adversas de los bajos niveles de estrógeno sobre la masa ósea.
A pesar que se desconoce el mecanismo específico por el cual el estrógeno afecta la mineralización ósea, numerosos estudios han mostrado que bajos niveles de estrógeno, tales como aquellos observados en la hiperprolactinemia o luego de la menopausia quirúrgica o natural, están asociados con bajos niveles de masa ósea esquelética (4-6). La hipótesis que las atletas amenorreicas hipoestrogénicas pueden presentar, también, niveles de masa ósea disminuida, parecería plausible si no fuera por el hecho que la actividad física inhibe y hasta revierte la pérdida ósea en mujeres postmenopáusicas (7,8).
Debido a que la frecuencia, duración e intensidad de los entrenamientos para las atletas de resistencia exceden aquellos prescriptos para las mujeres postmenopáusicas, se podría suponer que el ejercicio ejercería un efecto de protección contra la pérdida de masa ósea en las atletas amenorreicas. Este estudio está diseñado para evaluar tal presunción.
METODOS
Sujetos
Veintiocho deportistas mujeres participaron en este estudio luego de firmar su consentimiento, de acuerdo con los procedimientos establecidos por el Comité de Revisión de Sujetos Humanos de la Universidad de Washington. Catorce de las mujeres eran amenorreicas, las que no habían tenido más de un período menstrual en los doce meses precedentes al estudio. De un gran “pool” de potenciales sujetos, 14 eumenorreicas fueron seleccionadas para igualar a las atletas amenorreicas en las siguientes variables y en este orden de prioridad: deporte, edad, peso, estatura, frecuencia y duración de las sesiones diarias de entrenamiento. Once sujetos en cada grupo eran corredoras; las tres restantes, remeras. Entrevistas previas al estudio con uno de los autores (K. N.) eliminó la posibilidad de que tomaran parte del mismo aquellas amenorreicas que tenían desórdenes alimenticios, que participaban de alguna terapia de reemplazo de hormonas, o cuya amenorrea o irregularidades menstruales comenzaron previo al entrenamiento deportivo. Todas las mujeres eran no fumadoras, gozaban de buena salud, y no habían utilizado anticonceptivos orales durante los seis meses precedentes al estudio. Todas habían tenido la menarca, y la mayoría de las atletas amenorreicas, 12 de las 14, habían tenido ciclos normales antes de comenzar el entrenamiento. Las otras dos comenzaron a entrenar antes de la menarca.
Protocolo
Las deportistas se presentaron en el laboratorio a las ocho de la mañana, luego haber ayunado durante la noche, en cuatro oportunidades diferentes con intervalos de siete días. Se obtuvo una muestra de sangre de 30ml luego de haber descansado durante 20 minutos. Se dejó coagular la sangre y luego se la centrifugó; el suero fue guardado a menos 20ºC hasta que fuera analizado el estradiol, la progesterona, la testosterona y la prolactina. Durante el mismo mes se convocó a las mujeres para determinar la masa ósea a través de la técnica de la absorciometría, y la densidad corporal a través de peso densitométrico subacuático. Durante la primera visita, cada participante completó un breve cuestionario concerniente a su historia menstrual y a sus actividades deportivas.
Una nutricionista se reunió con las deportistas durante una de las cuatro sesiones de laboratorio, para explicarles cómo completar la encuesta alimentaria de tres días. Las encuestas fueron devueltas directamente a la nutricionista, quien luego se reunió con cada una para verificar la información antes de codificarla, para su posterior análisis.
Medición de la masa ósea regional
Se utilizó la absorciometría fotónica simple (SPA) y fotónica dual (DPA) para medir la masa ósea regional en el radio distal y en las vértebras lumbares, respectivamente. Las mediciones con SPA fueron hechas en el brazo menos hábil con un Analizador Mineral Oseo Norland-Cameron, Modelo 78, en dos lugares: S1 y S2 (una décima parte y una quinta parte, respectivamente de la longitud del antebrazo). S1 contiene ambas clases de hueso, cortical y trabecular (12 a 20%), mientras que S2 está compuesto, principalmente, de hueso cortical (9). El contenido mineral óseo fue medido en gramos por centímetro; la densidad mineral ósea en gramos por centímetro cuadrado; esta última, fue derivada de la división del contenido mineral óseo por el diámetro del radio. En nuestro laboratorio esta técnica tiene un coeficiente de variación de 2% en S1 y de 3% en S2.
La densidad mineral ósea fue determinada a través de técnicas de absorciometría fotónica dual, originalmente descriptas por Mazess y cols. (10) y Riggs y cols. (11). Esta técnica mide la transmisión de fotones de 2 energías distintas (42 y 100 keV) a través del hueso y tejido blando. Se obtienen los datos de transmisión contando los rayos gamma de gadolinium-153 de 42-keV y 100-keV, luego de haber sido atenuados por el hueso y el tejido blando; la diferente dependencia de energía de los coeficientes de absorción de los rayos gamma en los 2 medios permite la determinación de la cantidad de hueso presente, sin importar la cantidad de tejido blando.
Para las mediciones en la columna, se determinó el contenido mineral de cada vértebra, desde L1 a L4. Se estima que las vértebras en este sitio contienen del 50 al 66% de hueso trabecular (12). La densidad mineral ósea, expresada en gramos por centímetro cuadrado, se derivó dividiendo el contenido mineral por el área proyectada de la columna vertebral (L1 a L4). Este valor incluye al vertebral, más los espacios entre discos. En nuestro laboratorio, esta técnica tiene un coeficiente de variación del 3%.
Análisis hormonal
El estradiol y la testosterona fueron medidos mediante análisis radioinmunológico previamente descripto (13, 14). La progesterona fue medida también a través de este análisis, pero con el uso de reactivos adquiridos a Diagnostics Products. Para el análisis de prolactina se utilizó un preparado de referencia (RP-1) y un anticuerpo primario (AFP-C 11590), obtenidos del Programa Nacional de Hipófisis y hormonas. La prolactina radioiodinada fue adquirida a Diagnostic Products.
Peso Densitométrico Subacuático
Para esta técnica se utilizó un tanque acuático de inmersión a una temperatura entre 36 y 39º C. El peso calculado en sumersión fue corregido, por el remanente de aire en pulmones, luego de una exhalación forzada, midiendo el volumen residual antes de la inmersión, con el uso del método de dilución de nitrógeno descripto por Wilmore (15). Se estimaron los porcentajes de masa adiposa utilizando la fórmula de Brozek y cols.: porcentaje de masa adiposa= 100.[(4,570/D)-4,142](16).
ANALISIS DE DATOS
Las comparaciones entre los grupos de amenorreicas y eumenorreicas se hicieron a través de t-test de Student para muestras no relacionadas. El coeficiente correlación Pearson fue utilizado para describir las relaciones entre las variables elegidas.
RESULTADOS
Las características físicas y los entrenamientos de los 2 grupos de deportistas fueron similares (Tabla 1). Aunque la composición corporal no fue controlada en las muestras, tantos las amenorreicas como las eumenorreicas tuvieron porcentajes similares de masa adiposa. La única diferencia entre estos 2 grupos fue la cantidad de millas que corrían por semana.
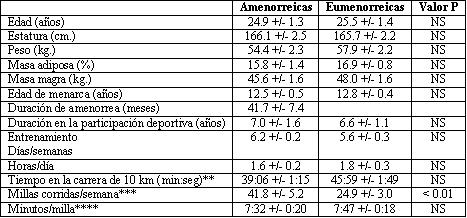
Tabla 1. Características físicas y regímenes de entrenamiento de 14 atletas
amenorreicas y 14 eumenorreicas.(*)
*Los valores +/- son las medias SEM. NS denota “no significancia”
**N= ocho atletas eumenorreicas y siete atletas amenorreica
***N=12 atletas eumenorreicas y 10 atletas amenorreicas
****Tiempo de carrera de distancia, larga y lenta.
Si bien ni el contenido ni la densidad mineral ósea en los dos sitios del radio fueron diferentes entre los grupos (Tabla 2), la densidad mineral de las vértebras lumbares fue significativamente menor en el grupo de amenorreicas. A pesar de que el contenido y la densidad mineral en S1 y S2 tuvieron una correlación estadísticamente significativa (r= 0,72), no hubo una correlación significativa entre la densidad de las vértebras y la densidad en los puntos del radio (S1, r=0,31; S2, r= 0,34).
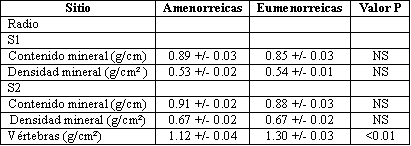
Tabla 2. Contenido y densidad mineral ósea en 14 atletas amenorreicas y 14
eumenorreicas en dos sitios en el antebrazo (radio) y en las vértebras lumbares
L1 a L4. (*)
*Los valores +/- son las medias SEM. NS denota no significancia.
Los niveles de estradiol expresados, tanto como el promedio de las cuatro muestras o como el valor pico, fueron significativamente menores en el grupo de amenorreicas (Tabla 3). Ocho de estas deportistas tuvieron valores de estradiol por debajo de los 45 pg por mililitro en cada una de las cuatro muestras. Tres de las otras participantes tuvieron al menos una muestra en la cual este valor estuvo entre 45 y 100 pg por mililitro, y las tres restantes tuvieron una o más muestras con valores excediendo los 100 pg por mililitro. Doce de las eumenorreicas tuvieron un perfil de estradiol característico de las mujeres con ciclos regulares, y al menos un valor de estradiol estuvo por encima de los 130 pg por mililitro. Las otras dos mujeres reportaron haber menstruado dentro de los 12 días de haber comenzado el estudio y haber tenido ciclos regulares durante los 12 meses previos.
Los cuatro valores de progesterona para 13 de las amenorreicas fue menor a 0,65 ng por mililitro, los que sugieren que no se había producido la ovulación. Una participante tuvo una concentración pico de 13,1 ng por mililitro que coincidió con un nivel de estradiol de 93,6 pg por mililitro, pero ella no experimentó flujo menstrual. Las concentraciones de progesterona para el grupo eumenorreico indicaron la presencia de ciclos ovulatorios en 11 de las deportistas. El nivel pico de progesterona en dos de las otras mujeres fue menor a 2,0 ng por mililitro, lo que sugiere la presencia de un ciclo anovulatorio. Ambas mujeres tuvieron niveles pico de estradiol de más de 250 pg por mililitro. No pudimos arribar a conclusiones a cerca de la restante deportista en este grupo, ya que dos de sus muestras se perdieron debido a errores técnicos.
Los niveles de prolactina también difirieron entre los grupos (Tabla 3). Dos mujeres tuvieron al menos un valor de prolactina por encima de 70 ng por mililitro, y un promedio, en las cuatro muestras, superior a 60 ng por mililitro. Ambas estaban en el grupo de eumenorreicas y reportaron haber tenido ciclos regulares durante los últimos 12 meses. La relación entre la prolactina y el estradiol fue significativa, tanto para los valores medios (r= 0,54, P<0,01) como para las concentraciones picos (r= 0,44, P<0,02).
Los niveles de testosterona no difirieron entre los grupos y estuvieron dentro de los rangos normales para las mujeres (Tabla 3).
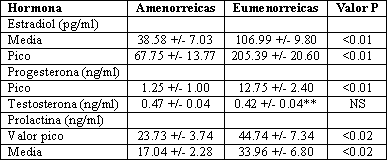
Tabla 3. Niveles hormonales en 14 atletas amenorreicas y 13 atletas
eumenorreicas. (*)
*Los valores +/- son las medias SEM. NS denota no significancia
**N= 14
La ingesta alimentaria de los dos grupos fue similar (Tabla 4). Sin embargo la menor ingesta total de calorías (P<0,06) y de grasas (P<0,06) del grupo amenorreico casi alcanza el nivel de significancia (&= 0,05) establecido para este estudio. No hubo diferencias entre los dos grupos en la ingesta de calcio, ya sea a través de la dieta, o de la dieta más suplementos. Para ambos grupos la ingesta superó el valor recomendado de 800 mg por día.
A pesar de que tanto los valores medios como picos de estradiol fueron significativamente diferentes entre los grupos, ningún valor estuvo correlacionado con la densidad mineral ósea en ningún sitio. Con la excepción de una correlación significativa entre la edad y la densidad mineral del radio (S1, r= 0,52; S2, r=0,48), ninguna de las características físicas, factores de entrenamiento, niveles hormonales, o variables alimentarias estuvieron correlacionadas con la densidad mineral del radio o de la columna lumbar.
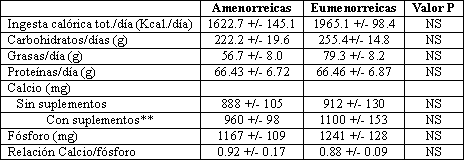
Tabla 4. Encuesta alimentaria de tres días en 14 atletas amenorreicas y 14
eumenorreicas. (*)
DISCUSION
Ni la actividad física ni el estado menstrual se desviaron marcadamente de la norma en la mineralización ósea, predominantemente cortical, del radio. Los valores observados en el contenido mineral óseo en ambos grupos de atletas estuvieron entre 0,02 g/centímetro (S1) y 0,04 g/centímetro (S2) de la norma para las no atletas con ciclos regulares, que fueron evaluadas en el mismo laboratorio. Cuando se compararon los valores de la densidad mineral ósea en la columna, con aquellos reportados por Riggs y cols. (17) en 120 mujeres con un amplio rango de edad, el promedio de la densidad mineral ósea de las mujeres eumenorreicas fue cercano al obtenido por una ecuación de regresión basada en la edad (1,33 g por cm2). Por el contrario, el promedio de la densidad mineral ósea de las deportistas amenorreicas fue similar al de las mujeres de 51,2 años de edad. Dos de estas deportistas tuvieron una densidad mineral vertebral por debajo del umbral de fractura, definido por Riggs y cols. (11) como 0,965 g por cm2.
Cann y cols. (18) recientemente, arribaron a las mismas conclusiones en un estudio descriptivo con mujeres amenorreicas, incluyendo un subgrupo de once mujeres que tenían amenorrea hipotalámica. La participación regular en actividades físicas en 10 mujeres de este grupo hizo suponer que hubo una posible asociación entre la amenorrea inducida por el ejercicio y la disminución del contenido mineral en las vértebras. Debido a que el estudio no fue originalmente diseñado para examinar la relación entre la “amenorrea deportiva” y el contenido mineral óseo, hubo algunos cuestionamientos sobre si la amenorrea estaba realmente relacionada con el ejercicio, y si otros factores que no habían sido controlados podrían explicar la disminución del contenido mineral de la columna. Por ejemplo, el porcentaje extremadamente bajo de tejido graso en el tronco del grupo de amenorreicas hipotalámicas, que fue 11% del valor control, aumentó la posibilidad de que factores alimenticios pudieran contribuir tanto a la amenorrea como al contenido mineral óseo. Los resultados del presente estudio, diseñado para comprobar la probabilidad de que la amenorrea este asociada al ejercicio, y además, para examinar los factores relacionados con la dieta y el programa de entrenamiento, deberían alentar a los médicos sobre la posibilidad de que algunas atletas amenorreicas puedan tener realmente una disminución en la densidad ósea. Esto puede ser debido a su estado hipoestrogénico, a la interacción de los bajos niveles de estrógenos con alguna otra variable, o a otros factores que todavía no han sido identificados.
A pesar de que se acepta que los bajos niveles de estrógenos luego de la menopausia, o en la premenopausia en mujeres con disfunciones endócrinas, están relacionados con la osteopenia observadas en estos grupos, no está totalmente entendido cual es el rol del estrógeno en la dinámica ósea. Debido a que no se han encontrado receptores de estrógenos en el hueso, se presume que su efecto es indirecto (19). Una de tales rutas indirectas puede ser el efecto del estrógeno sobre el balance de calcio, debido a que hay amplia evidencia que la falta de estrógeno aumenta los requerimientos diarios de calcio (20). No hubo diferencias en la ingesta de calcio en nuestras participantes amenorreicas y eumenorreicas, tanto con o sin suplementos. Ambos grupos alcanzaron los niveles diarios recomendados (800 mg/d). Sin embargo, la disminución en la absorción de calcio y el aumento en la excreción del mismo en mujeres estrógeno-deficientes, ha llevado a Heaney (20) a recomendar un consumo diario de 1,5 g para mantener un balance de calcio en los estados hipoestrogénicos. Si se aplican estos criterios, nuestras mujeres amenorreicas tienen deficiencia de calcio, mientras que las eumenorreicas alcanzan sus requerimientos diarios. Cuando se utilizan las figuras derivadas por Heaney (20) con mujeres postmenopáusicas, la diferencia en el balance de calcio entre los grupos alcanza los 30 miligramos diarios.
La cantidad de actividad física reportada por nuestras deportistas amenorreicas no era suficiente para protegerlas de una aparente pérdida de masa ósea vertebral. Esto no debe ser interpretado como una negación al valor del ejercicio para mantener la integridad ósea, si no que sugiere que existe una interacción entre el estrógeno y el ejercicio, en sus efectos sobre algunas áreas óseas específicas. Tanto en nuestro estudio como en el de Cann y cols. (18), el radio, que es predominantemente un hueso cortical, no se vio afectado, mientras que el contenido mineral de las vértebras, que tienen más masa ósea trabecular, fue menor en el grupo de amenorreicas. Se observó lo contrario en un grupo de corredores varones. Dalen y Olsson (21), utilizando un método de espectrofotometría con rayos-X, reportó una media en el contenido mineral óseo aproximadamente 20% mayor en el hueso apendicular de corredores de cross-country que en el grupo control, pero no observó diferencias significativas entre los grupos, en la 3º vértebra lumbar. Además los maratonistas varones tuvieron mayores índices de masa ósea que los sedentarios, pero ambas mediciones del contenido mineral óseo (activación total de los neutrones corporales y absorciometría fotónica del radio), reflejan predominantemente al hueso cortical (22). Hasta el presente no hay datos suficientes para llegar a conclusiones firmes acerca de los efectos de la actividad física y el estrógeno sobre la masa ósea cortical y trabecular. Sin embargo los datos disponibles brindan una base para recomendar que los sitios que tengan una alta proporción de hueso trabecular sean incluidos en las evaluaciones sobre los efectos de la disminución de estrógeno sobre el contenido mineral óseo en atletas amenorreicas.
Nuestros resultados no deben ser vistos como una señal para que las atletas amenorreicas cesen el entrenamiento intenso, sino como la necesidad de seguir investigando para llegar a un mayor entendimiento de esta problemática. Es necesario que nuestras observaciones sean verificadas para asegurar que nuestros resultados puedan generalizarse. Deben ser evaluadas otras deportistas amenorreicas que no sean corredoras, particularmente atletas de deportes que ponen menos énfasis en bajos porcentajes de masa grasa y que provocan mayor stress sobre la columna. Nuestro grupo de remeras amenorreicas, por ejemplo, tuvo un promedio de 1,22 g por cm2 en la densidad mineral de la columna, el cual fue 0,13 g por cm2 mayor que el de las corredoras amenorreicas. Por otro lado, también deben ser examinadas otras áreas óseas, particularmente aquellas que son proclives a recibir un mayor stress mecánico mientras se corre, por ejemplo el fémur y la tibia. Numerosas preguntas acerca de los efectos a la largo plazo de la amenorrea sobre la integridad ósea de las deportistas, permanecen aún sin respuesta.
Agradecemos a Robert Muram, Barbara Lewellen, Nancy Lewis, Helen Backus, Florida Flor, Lorraine Shen, Patricia Gosciewski, Collen Johnson, y Barbara Bruemmer por su asistencia técnica.
Referencias
1. Lutter JM, Cushman S (1982). Menstrual patterns in female runners. Physician Sportsmed; 10 (9): 60-72
2. Feisht CB, Johnson TS, Martin BJ, Sparkes KE, Wagner WW Jr (1978). Secondary amenorrhea in athletes. Lancet; 2: 1145-6
3. Sanborn CF, Martin BJ, Wagner WW Jr (1982). Is athletic amenorrhea specific to runners?. Am J Obstet Gynecol; 143: 859-61
4. Lindsay R, Hart DM, Forrest C, Baird C (1980). Prevention of spinal osteoporosis in oophorectomised women. Lancet; 2: 1151-7
5. Meema S, Bunker ML, Meema HE (1975). Preventive effects of estrogen on post-menopausal bone loss: a follow-up study. Arch Intern Med; 135: 1436-40
6. Klibanski A, Neer RM, Beitins IZ, Ridgway EC, Zervas NT, McArthur JW (1980). Decreased bone density in hyperprolactinemic women. N Engl J Med; 303: 1511-4
7. Smith EL Jr, Reddan WW, Smith PE (1981). Physical activity and calcium modalities for bone mineral increase in aged women. Med Sci Sports Exerc; 13: 60-4
8. Krolner B, Toft B, Nielsen SP, Tondevold E (1983). Physical exercise as prophylaxis against involutional vertebral bone loss: a controlled trial. Clin Sci; 64: 541-6
9. Manzke E, Chesnut CH III, Wergedal JE, et al (1975). Relationship between local and total bone mass in osteoporosis. Metabolism; 24: 605-15
10. Mazess RB, Hanson J, Kan W, et al (1974). Progress in dual photon absorptiometry of bone. In: Shmeling P, ed. Proceedings: Symposium on Bone Mineral Determinations. Vol. 2. Studsvik, Sweden: Aktiebolaget Atomenergi: 40-52
11. Riggs BL, Wahner HW, Dunn WL, Mazess RB, Offord KP, Melton LJ III (1981). Differential changes in bone mineral density of the appendicular and axial skeleton with aging: relationship to spinal osteoporosis. J Clin Invest; 67: 328-35
12. Snyder WS, Cook MJ, Nasset ES, et al (1975). Report of the Task Group on Reference Man. Oxford: Pergamon Press: 67. International Commission on Radiological Protection pamphlet no. 23
13. Bremner WJ, Matsumoto AM, Sussman AM, Paulsen CA (1981). Follicle-stimulating hormone and human spermatogenesis. J Clin Invest; 68: 1044-52
14. Matsumoto AM, Paulsen CA, Hopper BR, Rebar RW, Bremner WJ (1983). Human chorionic gonadotropin and testicular function: stimulation of testosterone, testosterone precursors, and sperm production despite high estradiol levels. J Clin Endocrinol Metab; 56: 720-8
15. Wilmore JH (1969). A simplified method for determination of residual lung volumes. J Appl Physiol; 27:. 96-100
16. Brozck J, Grande F, Anderson JT, Keys A (1963). Densitometric analysis of body composition: revision of some quantitative assumptions. Ann NY Acad Sci; 110: 113-40
17. Riggs BL, Wahner HW, Seeman E, et al (1982). Changes in bone mineral density of the proximal femur and spine with aging: differences between the post-menopausal and senile osteoporosis syndromes. J Clin Invest; 70: 716-23
18. Cann CE, Martin MC, Genant HK, Jaffe RB (1984). Decreased spinal mineral content in amenorrheic women. JAMA; 251: 626-9
19. Hammond CB, Maxson WS (1982). Current status of estrogen therapy for the menopause. Fertil Steril; 37: 5-25
20. Heaney RP (1982). Nutritional factors and estrogen in age-related bone loss. Clin Invest Med; 5: 147-55
21. Dalen N, Olsson KE (1974). Bone mineral content and physical activity. Acta Orthop Scand; 45: 170-4
22. Aloia JF, Cohn SH, Babu T, Abesamis C, Kalici N, Ellis K (1978). Skeletal mass and body composition in marathon runners. Metabolism; 27: 1793-6