Crecimiento y Maduración del Deportista Joven. Aplicación Para el Desarrollo de la Fuerza
Growth and Maturation of the Young Sportsman. Application for Strength Development
Mikel Izquierdo1 y Javier Ibañez1
Centro de Estudios, Investigación y Medicina del Deporte. Gobierno de Navarra. (España.
Artículo publicado en el journal Revista de Educación Física, Volumen 35, Número 1 del año 2017.
Publicado 5 de mayo de 2017
Resumen
Palabras clave: Niños, jóvenes, fuerza muscular, ejercicio, entrenamiento, maduración, desarrollo.
Abstract
Keywords: Children, youth, muscular strength, exercise, training, maturation, development
INTRODUCCION
Es un hecho generalmente aceptado que la práctica regular de ejercicio físico (incluyendo el entrenamiento de fuerza) es importante para obtener un normal crecimiento y maduración del niño (Malina y Bouchard 1991; Borer 1995) y, además, una herramienta muy útil, tanto en adultos como en niños, para prevenir el desarrollo de enfermedades crónicas degenerativas como la osteoporosis y las enfermedades cardiovasculares (Riddoch y col. 1991; Baranowski y col. 1992).
Sin embargo, en las últimas décadas, a raíz del significativo incremento observado en volumen e intensidad de ejercicio de ciertos programas de entrenamiento diseñados para jóvenes que practican deporte de competición (Mero y col, 1989; Malina y Bouchard, 1991), diversas organizaciones científicas y profesionales han alertado sobre algunos riesgos que podrían acompañar al desarrollo de estos programas de entrenamiento (AMA y ADA, 1991; Malina, 1994). Así, en un comunicado conjunto de la American Medical Association y de la American Dietetic Association (1991) se puede leer: “algunos programas para la mejora de la aptitud física podrían ser perjudiciales para los adolescentes si conllevan un tipo de ejercicio intenso y prolongado y /o un porcentaje graso corporal muy bajo para optimizar sus márgenes competitivos…. Estos regímenes podrían retrasar la maduración sexual, disminuir el crecimiento óseo y, con ello, la estatura…”.
En definitiva, parece que algunos programas de entrenamiento podrían acompañarse de ciertos desequilibrios hormonales, concretamente a nivel de las hormonas que intervienen simultáneamente tanto en el crecimiento y maduración, como en la respuesta al estrés provocada por el entrenamiento (AMA y ADA, 1991; Fry y col. 1993; Warren y Shangold, 1997). Es decir, un entrenamiento físico “excesivo” podría tener un efecto adverso sobre el crecimiento establecido genéticamente para una persona y, en general, sobre su normal desarrollo, desequilibrando los procesos fisiológicos anabólicos comprometidos, por un lado, con las adaptaciones de los tejidos a la actividad física, y por otro, con el crecimiento/ maduración (Cooper 1994; Warren y Shangold, 1997).
Si nos centramos más concretamente en el entrenamiento de la fuerza, durante décadas este tipo de entrenamiento en niños y en adolescentes ha sido un asunto controvertido. Hasta no hace mucho, para una gran parte de la comunidad médica y científica el entrenamiento de la fuerza no era recomendable en estas edades por dos razones(Malina y Bouchard, 1991): 1) se creía que los bajos niveles de andrógenos impedirían, teóricamente, el desarrollo de la fuerza (Mero y col 1989); y 2) se temía que en este grupo de población favorecería la aparición de diversas lesiones musculoesqueléticas (Mero y col. 1989; Malina y Bouchard 1991; Kraemer y Fleck 1993). Sin embargo, en los últimos años numerosas organizaciones científicas han preconizado el entrenamiento de fuerza en jóvenes basándose en estudios recientes que muestran cómo, siguiendo ciertas pautas, los niños y adolescentes pueden aumentar su fuerza muscular sin perjudicar su normal crecimiento y maduración (p.e. la Sociedad Americana para la Medicina del Deporte (1990), la Asociación Americana de Pediatría (1993), la Asociación Americana para el Acondicionamiento Físico y la Fuerza (1996) y el Comité Olímpico Americano).
Por lo tanto, quizá sería más conveniente insistir, como dice McKeag (1991), en que “hasta que puedan ser definidos los límites de un rango de ejercicio físico saludable, debería prevalecer el sentido común”. Para ello, es imprescindible que los profesionales del deporte que trabajan en categorías infantiles y juveniles conozcan un poco mejor los procesos de maduración y crecimiento del chico y de la chica que practican regularmente deporte o que se encuentran inmersos en un programa de entrenamiento orientado al alto rendimiento deportivo. En este contexto, existen varias preguntas importantes que trataremos de aclarar y que sería conveniente tener presente a la hora de planificar un programa de entrenamiento para un deportista de estas edades (Malina, 1994):
- ¿Qué sabemos sobre el papel desempeñado por la actividad física regular en el crecimiento y maduración del niño/ adolescente?,
- ¿Puede un programa de entrenamiento físico llegar a inhibir el crecimiento y retrasar su maduración?,
- ¿Qué influencia tiene la maduración biológica de un niño en su rendimiento físico?,
- ¿En qué momento del desarrollo de un niño/ adolescente se produce una mejor tolerancia a una carga de entrenamiento determinada?,
- ¿Hasta qué punto un niño/ adolescente puede desarrollar la fuerza y la masa muscular?,
- ¿Cómo es la entrenabilidad de los niños/ adolescentes en comparación con la de los adultos?,
- Durante un periodo de desentrenamiento, ¿cuánto tiempo se conservan las mejoras obtenidas con el entrenamiento?, ¿Qué beneficios y riesgos potenciales van asociados al entrenamiento de fuerza en estas edades?.
CRECIMIENTO Y MADURACION DEL DEPORTISTA JOVEN
INFLUENCIA DEL EJERCICIO FÍSICO SOBRE EL CRECIMEINTO
Estatura y Peso
En lo que se refiere a la estatura, diversos estudios sugieren que la práctica regular de una actividad física, o la participación en un programa de entrenamiento físico, no influye en el crecimiento estatural del niño (Beunen y col, 1992; Malina 1989; Seefeldt y col, 1986) porque en un niño bien alimentado la estatura está regulada, principalmente, por su herencia genética. En realidad, la estatura media observada en los deportistas jóvenes varía según el deporte. Entre las gimnastas y nadadoras, por ejemplo, las primeras son más pequeñas que la media de las niñas de su edad y las segundas más altas, y esto se observa ya antes de ser incluidas en los programas de entrenamiento de ese deporte (Astrand y col, 1963; Peltenburg y col, 1984). Pero, además, los padres de estas gimnastas son más pequeños que los de las nadadoras (Peltenburg y col, 1984) lo que, efectivamente, apunta hacia un factor genético como responsable principal de la estatura de una persona.
Sin embargo, en general, en estudios longitudinales desarrollados con chicos y chicas que participan en diferentes deportes desde los 8 hasta los 18 años, se ha visto que son, de media, más altos y también más pesados que los chicos y chicas que no practican una actividad física regular. Este mayor peso probablemente resulta del incremento de la masa muscular reflejo de una pubertad avanzada (el patrón de crecimiento de los chicos, en la mayoría de los deportes, es el de una madurez avanzada ya que se encuentra adelantada tanto la edad ósea como el PHV) y del efecto del entrenamiento, sin olvidar la posible mejora del factor alimentación (Ver figura 1) (Malina, 1994).
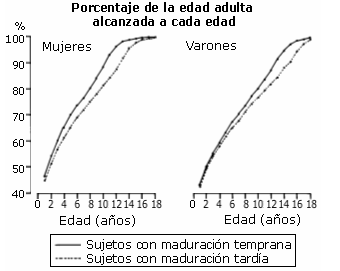
Figura 1. Porcentaje de la estatura media alcanzada en chicas (izquierda)
y chicos (derecha) en diferentes edades y madurez (adelantada, línea continua; o
retrasada, línea de puntos) (Malina y Bouchard, 1991).
¿Cómo puede dejar de crecer un niño que practica un deporte?. Existen una serie de prácticas asociadas a la participación en diversos deportes que pueden reducir el crecimiento estatural potencialmente establecido en los genes de un niño o adolescente (Mc Keag 1991; Blimkie, 1993; Warren y Shangold, 1997):
Pérdida de peso: mantener un peso corporal y un porcentaje graso bajos forman parte de la preparación física de muchos deportes (gimnasia, ballet, atletismo de fondo,…). Un/a deportista joven que todavía está creciendo puede seguir dietas drásticas, en muchos casos muy bajas en calorías, que no aportan las necesidades mínimas de carbohidratos, proteínas, hierro y otros nutrientes, y puede encontrarse con problemas derivados de su bajo peso corporal. Este tipo de alteraciones en los hábitos de alimentación, mucho más frecuentes en las chicas, también puede acompañarse de una pérdida de parte del potencial de crecimiento estatural establecido genéticamente.
Uso de medicamentos para mejorar el rendimiento físico: especialmente los esteroides anabolizantes. Algunos deportistas buscan en los esteroides anabolizantes mejorar el tamaño y la fuerza de sus músculos. Sin embargo, además de estar incluidos en las listas de dopaje, estos esteroides son particularmente dañinos en el deportista joven que todavía no ha completado su crecimiento y maduración. En el adolescente, uno de los efectos secundarios más preocupante de estos medicamentos es el cierre prematuro de las epífisis (la zona donde crecen los huesos), con lo que evidentemente queda comprometido su potencial de crecimiento estatural. A pesar de estos efectos secundarios, algunos estudios recientes advierten de que el adolescente también abusa de este tipo de medicación. En una revisión realizada por Blimkie (1993) se observa una prevalencia de uso de esteroides anabolizantes entre los adolescentes deportistas americanos que va desde el 1.4% hasta el 12.5% (Ver figura 2A). Entre los deportes en los que existe una mayor evidencia de uso de estos medicamentos están el fútbol americano, la lucha, el baloncesto y el atletismo (Ver figura 2B). Para esta autora, la razón de este mayor uso de esteroides en estos deportes probablemente se deba a la frecuente incorporación de ciclos de entrenamiento de fuerza con objeto de optimizar la condición física del deportista (Blimkie 1993). Es decir, parece que en algunos entrenadores y deportistas existe la creencia, errónea, de que para obtener un incremento óptimo de la fuerza en un adolescente es inevitable la asociación de esteroides anabolizantes al programa de entrenamiento.
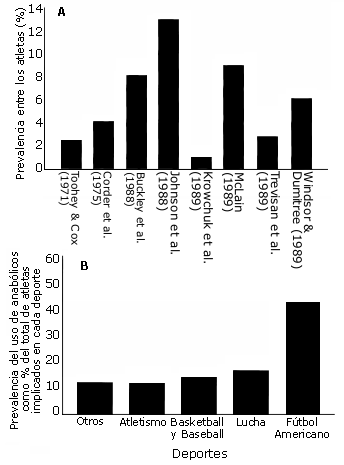
Figura 2 (A y B). A) Revisión de diversos estudios sobre el uso de
esteroides anabolizantes en deportistas adolescentes. B) Deportes en los que se
da una mayor prevalencia de uso de esteroides anabolizantes entre los
adolescentes (En: Blimkie 1993; págs 157- 158).
Composición Corporal
En la regulación de la composición corporal intervienen de forma muy importante tanto una actividad física regular como el entrenamiento específico para un deporte, porque ambos se asocian con un descenso en el porcentaje graso y, ocasionalmente, con un aumento de la masa muscular, más frecuentemente en varones (Boileau y col, 1985; Parizkova, 1974).
En relación con la masa muscular, algunos estudios longitudinales (recogidos en Malina 1994) muestran que niños activos, que entrenaban en un deporte 6 horas/ semana, a los que se siguió de los 11 a los 17 años, tenían una mayor masa muscular y menos porcentaje graso que los niños con niveles bajos o moderados de actividad física. Sin embargo, estas diferencias en la masa muscular reflejaban, en parte, una diferencia asociada a una madurez avanzada (reflejado en la edad del PHV y en la madurez ósea), puesto que los niños más activos eran más altos y pesados que los niños de los otros dos grupos. Los niños moderadamente activos y los que mantenían una baja actividad física no diferían en sus niveles de madurez; en los moderadamente activos el porcentaje graso corporal era más bajo, aunque no se diferenciaban en la masa muscular, lo que podría sugerir que es necesario un tipo de entrenamiento físico más intenso para que se induzcan cambios en la masa muscular.
En lo que se refiere al porcentaje graso corporal, se ha visto que los niños y adolescentes deportistas tienen un menor porcentaje graso, en relación con los no deportistas. Este descenso del porcentaje graso depende, fundamentalmente, del gasto calórico extra diario (minutos de entrenamiento x Kcal/ minuto = Kcal extras gastadas), y de la restricción calórica que se pueda realizar a través, por ejemplo, de una dieta. En los varones, tanto deportistas como no deportistas, se observa un descenso en el porcentaje graso durante la adolescencia, aunque los deportistas tienden a tener un porcentaje graso menor. En las chicas deportistas, no se observa un aumento en la masa grasa corporal durante la adolescencia como ocurre en las no deportistas (Ver figura 3) (Malina y Bouchard, 1991).
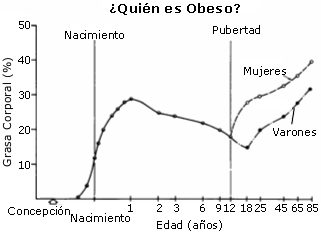
Figura 3. Cambios en la composición corporal a lo largo de la vida de una
persona (Bray 1976; en: Warren y Shangold, 1997).
Sin embargo, es difícil separar los efectos propios del entrenamiento de los asociados a la edad durante el crecimiento normal del adolescente. Cuando los datos recogidos sobre masa muscular se relacionan con la evolución de la madurez somática, con el PHV, se observan diferencias entre sexos (Tanner y col 1981). Los chicos tienen un incremento en el tamaño de la masa muscular del brazo que es aproximadamente el doble del observado en las chicas. Sin embargo, el pico de crecimiento de la masa muscular de la pantorrilla es sólo ligeramente mayor en el chico (Ver figura 4, A y B). Los picos de velocidad de ganancia de la musculatura en brazo y pantorrilla ocurren después del PHV. En los chicos, para el brazo ocurre alrededor de los 3- 4 meses después del PHV, y en las chicas alrededor de 6 meses después. En la pantorrilla, la ganancia de masa muscular parece ser más o menos constante desde aproximadamente 1 año antes hasta alrededor de 1.5 años después del PHV.
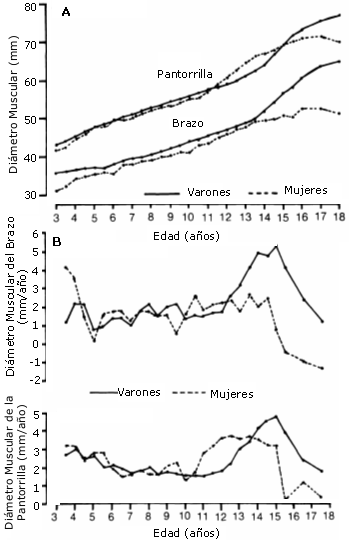
Figura 4 (A y B). A) Evolución de la masa muscular en brazo (arm) y
pantorrilla (calf) de niños y niñas desde los 3 a los 18 años. B) Crecimiento de
la masa muscular de brazo y pantorrilla en mm por año en niños y niñas desde los
3 a los 18 años (En: Malina y Bouchard, 1991).
INFLUENCIA DEL EJERCICIO FISICO SOBRE LA MADURACION
En las ciencias del deporte, la madurez de una persona se mide habitualmente usando uno o más de los índices con que se mide la madurez somática, sexual y ósea. Aunque ninguno de ellos, de manera aislada, nos da una completa descripción del tempo de crecimiento y maduración, existe una alta concordancia entre ellos (Beunen, 1989).
Maduración Ósea
Valoración de la Madurez Ósea
La maduración ósea es, quizá, el mejor método para la valoración de la edad biológica o el estado de maduración de un niño. El progreso de maduración del esqueleto (los huesos de mano y muñeca izquierda han sido tradicionalmente los más utilizados para este propósito) puede ser monitorizado, y su evolución fácilmente controlada y evaluada mediante la estandarización de placas de rayos X. La edad ósea de un niño se relaciona siempre con su edad cronológica, y con ello se sabe si un niño tiene una maduración ósea adelantada, retrasada o está en la media.
Los dos métodos más comúnmente utilizados para valorar la maduración ósea son el Greulich- Pyle y el Tanner- Whitehouse. Básicamente, con el método Greulich- Pyle, por ejemplo, se compara la radiografía de un niño con unos modelos estandarizados de desarrollo para una edad concreta. De tal modo que si la radiografía de un niño de 7 años se ajusta con la radiografía standard para niños de 8 años, la edad ósea de ese niño es de 8 años.
Influencia del Ejercicio Físico sobre la Maduración Ósea
El proceso de la maduración ósea de la mano y la muñeca no se ve afectado por el entrenamiento deportivo. Estudios longitudinales con niños que entrenaban habitualmente en diferentes deportes (gimnasia, tenis, ciclismo o remo) indican un aumento paralelo en la edad cronológica y en la ósea durante un periodo de 3 a 4 años (Kotulan y col, 1980; Novotny, 1981). Concretamente, en un estudio, alrededor del 80% permanecieron en la misma categoría después de 3 a 4 años de entrenamiento; y aquellos que cambiaron de categoría lo hicieron sin un patrón muy consistente (Novotny, 1981).
Por otro lado, en lo que se refiere a deportistas jóvenes de élite, se ha visto que las chicas relacionadas con el ballet, la gimnasia y el atletismo tienden a presentar una edad ósea retrasada, mientras las nadadoras, en general, presentan una edad ósea algo avanzada con relación a su edad cronológica (Claessens y col, 1992; Malina y col, 1986; Malina, 1988; Warren, 1980). Por su parte, los chicos que destacan en el beisbol, atletismo, natación, ciclismo y remo presentan, en general, una edad ósea avanzada respecto a la edad cronológica (Malina y col, 1986; Malina, 1988).
Maduración Sexual
Valoración de la Madurez Sexual
La valoración de la madurez sexual está basada en el estudio del desarrollo de los caracteres sexuales secundarios: eldesarrollo del pecho y menarquia (la primera regla) en chicas; el desarrollo del pene y testículos en niños, y del vello pubiano en ambos sexos. Estudiar la evolución en el desarrollo de estos caracteres sexuales secundarios como indicadores del status de madurez obviamente limitan su utilización a la edad puberal solamente, mientras que la maduración ósea permite el estudio de la madurez biológica de una persona desde la niñez hasta la edad de adulto joven.
El estudio del desarrollo de los caracteres sexuales secundarios se resume habitualmente en 5 estadios para cada uno de ellos. Los criterios habitualmente utilizados para la maduración del pecho, vello pubiano y maduración genital son los descritos por Tanner (1962). En esta escala de 5 estadios, el estadio 1 indica un estado prepuberal de desarrollo (es decir, ausencia de desarrollo en ninguno de los caracteres sexuales descritos). El estadio 2 indica que se ha iniciado el desarrollo de cada uno de los caracteres sexuales secundarios (la elevación inicial de los pechos en las niñas, el agrandamiento inicial de los genitales en el niño, y la aparición de vello pubiano en ambos sexos). Los estadios 3 y 4 a veces son más difíciles de evaluar e indican una continuidad en la maduración de cada uno de los caracteres. El estadio 5 está relacionado con el estado adulto.
La clasificación en uno de los diferentes estadios de maduración sexual se realiza habitualmente por medio de la observación visual en un examen clínico. Por lo tanto, esta valoración puede tener sus limitaciones, porque el método requiere la invasión de la intimidad de la persona; sobre todo teniendo en cuenta que este es un asunto de especial importancia para muchos jóvenes en edad puberal.
En la práctica, la valoración de la maduración sexual se utiliza como sigue: una chica puede estar situada en un estadio 2 de desarrollo del pecho (B2) y en el estadio 1 para el vello pubiano (PH1). Esta valoración indica que el desarrollo del pecho ha comenzado y que el vello pubiano no ha aparecido todavía. Con ello, se puede considerar que esta chica está en el comienzo de la pubertad; esta elevación inicial de los pechos (B2) es habitualmente el primer signo evidente de maduración sexual en chicas. De modo parecido, un chico puede ser clasificado en el estadio 2 del desarrollo genital (G2) y en el estadio 1 del vello pubiano (PH1). En este caso, también se considera que ha comenzado la pubertad, porque el agrandamiento inicial de testículos (G2) es el primer signo más común de maduración sexual en niños.
Por otro lado, la menarquia, el primer período menstrual, es el indicador de madurez más comúnmente utilizado en las mujeres púberes.
Las edades a las que, por ejemplo, una chica alcanza los diversos estadios para el desarrollo del pecho y vello pubiano, y alcanza la menarquia se obtienen generalmente a partir de estudios longitudinales en los que esa chica será examinada a intervalos pequeños durante su pubertad, habitualmente cada 3 meses (Ver figura 5).
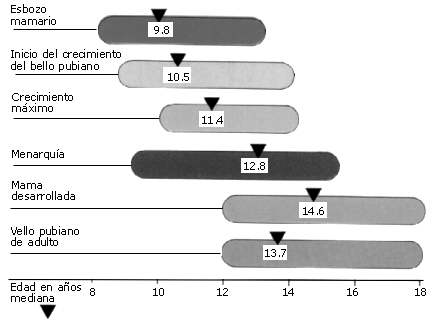
Figura 5. Ejemplo de evolución de los caracteres sexuales secundarios en
una chica. Obsérvese como cada uno de ellos evoluciona, desde que comienzan a
desarrollarse hasta que alcanzan el desarrollo propio de la mujer adulta, en
diferentes edades cronológicas (Breckwoldt y col, 1994).
Influencia del Ejercicio Físico sobre la Maduración Sexual
Los estudios publicados sobre esta materia se centran fundamentalmente en la edad de aparición de la menarquia en las chicas que practican deporte comparada en relación con la de la población en general. Numerosos estudios han encontrado que, de media, la edad de la menarquia de las chicas que entrenan en un deporte es más tardía, concluyendo a partir de estos resultados que la práctica de un entrenamiento físico regular conlleva un retraso en el comienzo de los ciclos menstruales (Malina, 1983). Por ejemplo, la edad de la menarquia en las chicas americanas sanas sucede, de media, a los 12.3- 12.8 años, mientras que la mayoría de estudios señalan que en las deportistas la menarquia comienza a los 13- 14 años o incluso más tarde (Rogol 1988). Algunos autores han apuntado que por cada año de entrenamiento antes de la primera regla, en el caso de nadadoras, atletas y chicas que hacen ballet, la menarquia se retrasa alrededor de medio año (Frisch y col, 1981; Hamilton 1988).
Sin embargo, el retraso de la menarquia en las deportistas sigue siendo un tema controvertido porque realmente sigue sin saberse si es una consecuencia directa del entrenamiento. Frisch y Ravelle (1971) propusieron hace ya bastantes años que el ejercicio físico intenso antes de la pubertad crea un consumo excesivo de energía que evita que las chicas alcancen un peso corporal “crítico” o un porcentaje graso mínimo necesarios para desencadenar el comienzo de los ciclos menstruales. De acuerdo con esta teoría, se necesita un peso (48 Kg) y un % graso (17%) mínimos para que una chica sea capaz de concebir y ser madre, pero el entrenamiento físico previene o retrasa que muchas deportistas alcancen este umbral. Hasta hoy no se entiende muy bien el mecanismo fisiológico, incluso esta teoría tiene sus detractores; sin embargo, es generalmente aceptada porque existen numerosos datos que apoyan el papel jugado por los cambios de la composición corporal y por el estrés que supone el propio ejercicio en el normal desarrollo de los ciclos menstruales (Vanderbroucke y col, 1983) (Ver figura 6).
No obstante, para Malina (1994) estos datos hay que tomarlos con cautela; en primer lugar, porque aunque efectivamente se ha visto que cuando se trata de chicas que entrenan en diversos deportes, su menarquia aparece más tarde que en las chicas que no practican deporte, también es cierto que existen deportistas que tienen su primera regla en la media de edad o incluso antes que las chicas no deportistas; y porque, por ejemplo, se ha visto que las madres de las chicas que hacen ballet tuvieron la menarquia más tarde que la media de las madres de chicas que no hacen deporte (Brooks- Gunn y Warren, 1988). Es decir, hay que considerar una predisposición familiar para ese retraso en la maduración. Por otro lado, el entrenamiento deportivo probablemente interactúa o es confundido con otros factores, además de la predisposición familiar, por lo que el efecto específico del entrenamiento per se podría resultar bastante difícil de aislar. Por ejemplo, un físico longilíneo se asocia a un retraso en la maduración (Malina y Bouchard, 1991) y en algunos deportes como en el ballet, el atletismo de fondo y la gimnasia priman las personas delgadas. Algunas prácticas alimenticias asociadas a un ansia por mantener el porcentaje graso lo más ajustado posible pueden ser un factor adicional: las demandas del ejercicio físico compiten con los procesos del crecimiento y maduración por la energía disponible. La capacidad para permanecer delgado varía considerablemente entre unas personas y otras, y probablemente está regulada genéticamente. Aquellas deportistas que no pueden mantener fácilmente una delgadez considerada como adecuada para rendir físicamente en condiciones óptimas, se ven abocadas a seguir dietas rigurosas y son más vulnerables a retrasos en la menarquia y, más adelante, a otros problemas relacionados con el ciclo menstrual (oligomenorreas, amenorreas secundarias, etc). Estos problemas ocurren, por lo tanto, más frecuentemente en las chicas que participan en el alto rendimiento deportivo y no discrimina entre deportes (p.e. gimnastas y atletas de fondo).
Además de los factores genéticos, de las dietas y de la pérdida de peso, existen otros relacionados con el estrés psicológico y el sobreentrenamiento que también pueden contribuir a este retraso en la menarquia. En muchos casos, este retraso puede tener un origen en varias de estas posibles causas. La situación se asemeja a la de las alteraciones del ciclo menstrual de las deportistas, donde pueden estar implicadas varias causas además del entrenamiento (Warren y Shangold 1997).
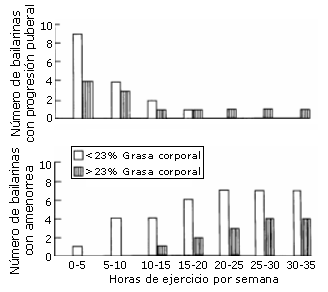
Figura 6. Relación del ejercicio físico con la progresión de la pubertad
(definida como un cambio en el estadio de Tanner en relación con el desarrollo
del pecho o la aparición de la menarquia) y la amenorrea en chicas que hacen
ballet. Los datos fueron obtenidos en 15 chicas a lo largo de un periodo de 3
años. El nivel de ejercicio físico de los 4 meses precedentes se promedió en
base a la actividad semanal (Warren 1980)
En relación con la maduración sexual de los chicos que hacen deporte, la información existente es escasa. Algunos estudios con deportistas jóvenes, varones, no indican evidencia alguna de alteraciones en el desarrollo de los caracteres sexuales secundarios. Por ejemplo, Rowland y col (1987) no encontraron cambios en los niveles de testosterona sérica en 15 adolescentes, atletas de fondo, durante el curso de 8 semanas de competición.
Madurez Somática.
Valoración de la Madurez Somática
El indicador más utilizado de madurez somática en estudios longitudinales de la pubertad es la edad en la que sucede el pico de velocidad de crecimiento (PHV), o edad de máximo crecimiento durante la etapa del “estirón” del adolescente (Ver Figura 7).
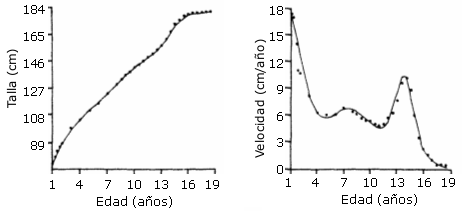
Figura 7. Un ejemplo de una curva de crecimiento de la estatura en un
niño. Los puntos indican las diferentes estaturas observadas (izquierda) y la
velocidad de crecimiento (derecha). La edad del inicio del “estirón” del
adolescente para este niño son los 11.8 años, y la edad del PHV son los 13.8
años (el Lozy 1978; en: Malina y Bouchard, 1991)
Influencia del ejercicio físico sobre la Maduración Somática
La edad en la que sucede el PHV y la magnitud de este pico no se ven afectadas por la práctica de una actividad física regular o por el entrenamiento deportivo (Beunen y col, 1992; Kobayashi y col, 1978).
Clasificación de los Niños según su Status de Madurez (Malina y Bouchard 1991)
Una persona en edad prepuberal o puberal puede ser agrupada, generalmente, dentro de una de las siguientes tres categorías de madurez: avanzada, en la media o retrasada. Y esta clasificación se realiza en base a su edad ósea, a la edad de la menarquia, a la edad del PHV o de un carácter sexual secundario.
Si se utiliza la edad ósea como criterio para diferenciar el grado de madurez de un grupo de chicos, por ejemplo, tendremos que aquel cuya edad ósea esté en ±1 año con relación a su edad cronológica estará dentro del grupo clasificado como de madurez dentro de la media. Un chico cuya edad ósea sea >1 año con relación a su edad cronológica será clasificado como de madurez temprana o avanzada. Finalmente, un chico cuya edad ósea sea <1 año con relación a su edad cronológica será clasificado en el grupo de madurez tardía o retrasada.
De forma similar, un grupo de chicas de las que disponemos su edad de menarquia puede ser subdividido en las tres categorías reseñadas. Asumiendo que la edad media de la menarquia para el grupo es 13 años, aquellas chicas cuya edad de menarquia esté comprendida en ± 1 año de esta edad (esto es, entre los 12 y 14 años) son clasificadas como de madurez dentro de la media. Las chicas con una edad para la primera regla por debajo de los 12 años son clasificadas como de madurez temprana, y las que estén por encima de los 14 años son clasificadas como de madurez tardía.
De igual manera se procede cuando se trata de comparar la edad del PHV o la de un carácter sexual secundario. Es evidente que esta manera de proceder tiene sus limitaciones y un cierto grado de arbitrariedad; sin embargo, sirven para ilustrar las variaciones asociadas a la maduración relacionadas con el crecimiento y el rendimiento físico.
INFLUENCIA DEL EJERCICIO FISICO SOBRE LOS TEJIDOS OSEO Y MUSCULAR
Tejido Óseo
Estudios realizados en adultos indican que aquellos que tienen una historia de actividad física regular o han participado en un entrenamiento físico durante su niñez y juventud tienen más masa ósea (Bailey y col, 1986; Bailey y McCulloch, 1990), lo que en principio nos indicaría que la mineralización del hueso se ha visto favorecida por la práctica de ejercicio físico durante los primeros años de vida.
Desgraciadamente, los estudios realizados directamente en niños son muy limitados. En el trabajo de Watson (1975) se observa que los jugadores de beisbol amateurs tienen un mayor contenido mineral en el húmero del brazo dominante. Además, esta diferencia entre brazos sigue aumentando con la edad, lo que sugiere un efecto de entrenamiento, asumiendo que los más mayores participaron más tiempo en la actividad específica de lanzar la bola. Aunque limitadas, estas observaciones son importantes porque el contenido mineral del hueso alcanzado durante la niñez y juventud puede ser determinante para el contenido mineral del hueso del adulto/ anciano (Bailey y McCulloch, 1990). Efectivamente, sabemos que la masa ósea de una persona aumenta durante la infancia y la adolescencia, alcanza un pico en la tercera o comienzo de la cuarta década de la vida y, a partir de ese momento, comienza a descender progresivamente (Ver figura 8). Por otro lado, también se conoce que en una persona joven y sana, este pico de Masa Osea está estrechamente ligado a hábitos de vida como el ejercicio físico y el consumo de Calcio, Tabaco y Alcohol (Valimaki y col, 1994).
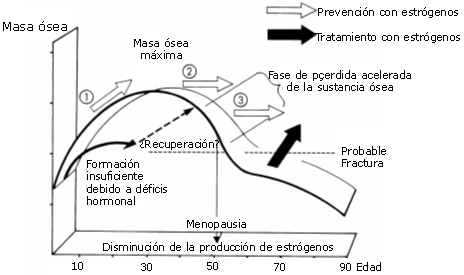
Figura 8. Evolución de la Masa Ósea con la edad y la influencia hormonal
en la misma.
En este sentido, Välimäki y cols. (1994), después de analizar los resultados obtenidos en un estudio realizado durante 11 años con niños y jóvenes de edades comprendidas entre los 9 y 18 años, concluyen que practicar ejercicio regular, evitar el tabaco y adecuar la ingesta de calcio son factores importantes en la adquisición de un pico elevado de masa ósea. En su estudio, estos autores observan que la densidad mineral ósea en fémur y en la región lumbar alcanza el valor máximo en el grupo de jóvenes con los niveles más altos de ejercicio físico; sin embargo, los varones con los mayores índices de tabaquismo tienen un valor más bajo de densidad mineral ósea del fémur.
No obstante, la actividad física regular parece tener un efecto beneficioso sobre la integridad del tejido óseo hasta un cierto punto. Efectivamente, parece existir un umbral a partir del cual el entrenamiento deportivo puede tener una influencia negativa sobre la integridad ósea, sobre todo cuando se acompaña de alteraciones menstruales y una dieta insuficiente en calcio. Por ejemplo, se ha visto que el entrenamiento “excesivo” asociado con alteraciones menstruales contribuye a que el hueso se desmineralice, pierda densidad, y con ello aumenta la susceptibilidad para sufrir fracturas de estrés (Drinkwater y col, 1984; Warren y col, 1986; Warren y Shangold, 1997).
En el caso de la mujer, es un hecho comprobado que algunas jóvenes que practican deporte con unos volúmenes e intensidades de entrenamiento elevados, tienen problemas de alteraciones en su ciclo menstrual y presentan niveles bajos de estrógenos; y parece existir una estrecha correlación entre la regularidad menstrual y la densidad mineral ósea; por ejemplo, Lloyd y col (1988) observan que las deportistas moderadamente oligomenorréicas (perdida menstrual escasa) tienen una densidad mineral ósea media equivalente a un 88% de la observada en un grupo de deportistas eumenorréicas (ciclos menstruales normales) con características físicas y entrenamiento semanal idénticos a las primeras. Pero, además, las deportistas con una oligomenorrea severa tienen una densidad ósea media que supone sólo un 69% de la del grupo de deportistas eumenorréicas. Se ha visto que el porcentaje de mujeres atletas con amenorrea secundaria (pérdida de la regla) se incrementa notablemente conforme aumentan el número de kilómetros de entrenamiento semanal afectando, en ese trabajo, al 43% de las entrenan por encima de los 95 Km/ semana (Ver figura 9). Además, dos estudios han apuntado que la masa ósea en estas mujeres permanece por debajo de lo normal incluso después de recuperar sus reglas normales (Cann y col, 1988; Drinkwater Y col, 1990). Y parece ser que estas atletas hipoestrogénicas tendrían una mayor incidencia de fracturas de estrés que las atletas eumenorréicas, despertando la inquietud de que también puedan tener mayor riesgo de sufrir una osteoporosis prematura (Ver figura 10) (Lloyd y col, 1986; Myburgh y col, 1990).
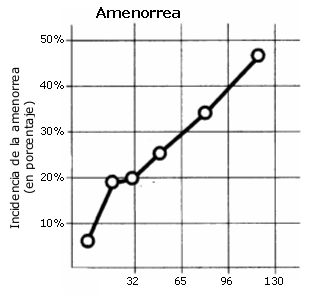
Figura 9. Incidencia de amenorrea secundaria en atletas de fondo en
relación con el volumen de entrenamiento semanal (Secondary amenorrhoea in
athletes. Lancet 25; pp: 1145. 1978).
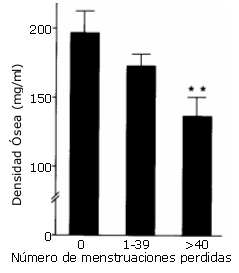
Figura 10. Relación entre la densidad mineral ósea (bone density, mg/ mL)
en atletas y el número de reglas perdidas (number of menses missed) en los
últimos 6 años (Lloyd y col, 1988)
La mejor solución para estas mujeres es, sin duda, la vuelta a los ciclos menstruales normales que habitualmente ocurre cuando la intensidad de entrenamiento disminuye o la deportista gana un poco de peso. Sin embargo, hay muchas deportistas que llevan años dedicadas a su deporte y no están dispuestas a moderar su entrenamiento o a ganar algo de peso por miedo a empeorar su rendimiento físico. ¿Hay algún otro medio efectivo para proteger a estas chicas?. Sí, aunque tiene que ser el médico quien determine y controle el tratamiento. Este consistiría, básicamente, en un tratamiento dietético con calcio y un tratamiento hormonal sustitutorio (Drinkwater 1989).
En el caso del varón, varios estudios han demostrado que cargas muy elevadas de entrenamiento de carrera continua pueden tener también un efecto negativo sobre el hueso. Se ha visto en atletas jóvenes, 28 años de edad media, con un volumen medio de entrenamiento de 92 Km por semana y con una ingesta diaria de calcio superior a lo recomendado, que su densidad mineral ósea lumbar es significativamente menor que la que se encuentra en sujetos sedentarios o moderadamente activos (Bilanin y col, 1989). Ante esto, se ha especulado que del elevado volumen de entrenamiento semanal de este grupo de atletas podrían resultar unos niveles bajos de testosterona y altos de cortisol, dando lugar a un efecto catabólico sobre el hueso.
Por lo tanto, se comienza a hablar de la posibilidad de un nivel de umbral de ejercicio que estimularía la formación de hueso, por encima del cual se conseguiría el efecto contrario, la reducción de la masa ósea (Chilibeck y col, 1995). Se ha visto que atletas varones de edades comprendidas entre los 20 y los 45 años, que corren de 20 a 32 Km por semana tienen una mayor densidad mineral ósea en extremidades inferiores que aquellos que entrenan sólo 8 a 16 Km por semana o que no entrenan (McDougall y col, 1992); sin embargo, con volúmenes superiores a 32 Km por semana, no se observa ganancia adicional en la densidad mineral ósea, y en el grupo de atletas que entrenan por encima de los 95 km/semana, la masa ósea es similar a la del grupo control, sedentario. Estos resultados indican que un volumen de entrenamiento de 20 a 30 Km por semana pudiera afectar positivamente al hueso, mientras que volúmenes de carrera por encima de estas distancias podrían acompañarse de efectos negativos, ¿con respuestas hormonales alteradas?.
En el caso de otros deportes, la respuesta ósea a diferentes volúmenes e intensidades de entrenamiento y/o a dietas rigurosas sería similar (Ver Figura 11).
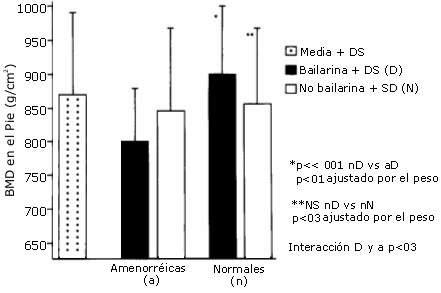
Figura 11. Las barras negras representan la densidad mineral ósea del pie
en chicas que hacen ballet y tienen ciclos menstruales normales (NORMAL) y en
chicas que hacen ballet y son amenorréicas (AMENORRHEIC) en comparación con un
grupo control de chicas que no hacen deporte (barra blanca punteada). Múltiples
comparaciones estadísticas muestran que las chicas amenorréicas que hacen ballet
difieren de sus compañeras con ciclos menstruales normales incluso cuando son
comparadas en relación a la misma edad y el peso (Warren y col, 1991)
Decimos que las alteraciones menstruales pueden jugar un papel importante en la pérdida de masa ósea de una deportista, ¿sucede lo mismo con el retraso de la menarquia?. Una menarquia retrasada, en sí misma, no parece ser un factor de riesgo de las fracturas de estrés para algunos autores (Malina, 1994); sin embargo, otros encuentran una relación del retraso de la menarquia con el riesgo de sufrir fracturas de estrés (Warren y Shangold, 1997). Factores como la dieta, errores en el entrenamiento, la superficie donde se corre en los entrenamientos, etc, también parece que están relacionados con este tipo de lesiones.
Tejido Muscular
Los datos existentes sobre el efecto del entrenamiento físico sobre el tejido muscular del niño que está creciendo, aunque escasos, indican cambios que van en la misma dirección de los observados en los adultos jóvenes (Malina, 1994). Estos cambios son específicos del tipo de programa de entrenamiento. En chicos adolescentes generalmente se observa una hipertrofia muscular después de entrenamiento de fuerza, mientras que en chicos preadolescentes esta adaptación muscular puede manifestarse de forma menos evidente, o puede no manifestarse. Además, no está nada claro que en un deportista preadolescente pueda modificarse la distribución del tipo de fibra (I, IIa, IIb) como resultado del entrenamiento físico (Eriksson y col, 1974; Fournier y col, 1982).
En lo que se refiere al entrenamiento aeróbico, se ha visto que en chicos de 11 años un entrenamiento de este tipo se asocia a un aumento en la concentración de las enzimas succinato deshidrogenasa (SDH) y de la fosfofructoquinasa (PFK) (Eriksson y col, 1974) (Ver figura 12). Sin embargo, 3 meses de entrenamiento aeróbico en chicos de 16 años se acompaña, sólo, de un aumento en la actividad de la SHD, mientras que el mismo tiempo de entrenamiento de velocidad sólo da lugar a un aumento de la actividad de la PFK (Fournier y col, 1982). Puede que esta diferencia de resultados entre chicos de 11 y 16 años pueda deberse a la diferencia de protocolos de entrenamiento utilizados. Por otro lado, los adolescentes entrenados en resistencia aeróbica también mostraron un incremento de las áreas de las fibras tipo I y II; sin embargo, los entrenados en velocidad no muestran esta adaptación. Después de 6 meses de entrenamiento no supervisado, sin embargo, la actividad de las enzimas SDH y PFK retornaron a sus valores anteriores al entrenamiento (Fournier y col, 1982).
Es posible obtener una buena estimación de la capacidad de un músculo para recuperar la energía gastada (ATP) midiendo el contenido (actividad máxima) de una de sus enzimas. Los enzimas que se miden más habitualmente son:

Figura 12. La estimación de la capacidad metabólica muscular (la
capacidad de una vía metabólica está limitada principalmente por la cantidad de
enzimas de esa vía contenida en la célula; y, generalmente, los cambios en la
capacidad metabólica de una vía, por ejemplo como resultado de un período de
entrenamiento, se acompañan de un cambio en la misma dirección en el contenido
de todos los enzimas (Henriksson, 1992)).
MADUREZ BIOLOGICA Y RENDIMIENTO FISICO
Durante la adolescencia, el rendimiento físico está relacionado con la madurez biológica. Sin embargo, esta asociación es más manifiesta en los chicos que en las chicas. En los niños prepúberes, la relación estadística entre rendimiento físico y los índices de la maduración ósea y sexual tiende a ser modesta (Beunen y col, 1981); mientras que entre los chicos de 13 y 16 años de edad esta relación tiende a ser más marcada. Por el contrario las correlaciones entre la madurez ósea y sexual y el rendimiento físico en las chicas son bajas, y en muchos casos negativas (Beunen y col, 1976). Una posible explicación a estas diferencias entre sexos podría estar relacionada con el mayor aumento de tamaño de la masa muscular en el niño, como consecuencia de la pubertad, comparado con un mayor incremento del porcentaje graso en las niñas. El peso del músculo de los niños prepúberes supone sólo alrededor del 25 al 30% del peso total, mientras que con la pubertad, como consecuencia de la influencia androgénica, este porcentaje sube hasta un 40- 45% en comparación con alrededor de un 35 al 38% en las chicas. (Wells 1985) (Ver figura 13). La ganancia de grasa en las niñas no contribuye a incrementar el VO2 max, ni la fuerza o la potencia, como lo hace el incremento extra de músculo en el niño. Este hecho, junto a una mayor concentración de SHD en las fibras de los músculos activos de los chicos (Pate y Kiska, 1984) y a unos niveles inferiores de hemoglobina en sangre de las chicas, entre otros posibles factores (Bale 1992), pueden explicar en gran parte el “deterioro” del rendimiento físico de las chicas en comparación con los chicos.
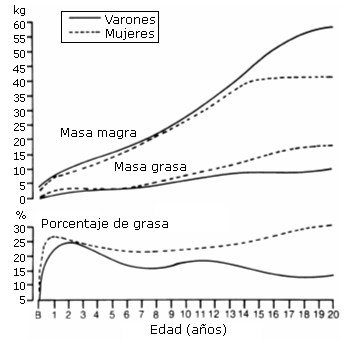
Figura 13. Arriba: curvas de crecimiento para masa muscular (fat- free
mass); y abajo: masa grasa (fat mass) y porcentaje graso de niños (boys) y niñas
(girls) en relación con la edad (Malina y Bouchard, 1991).
Por lo tanto, los niños con una madurez biológica avanzada, para cualquier edad cronológica, es bastante probable que tengan una ventaja biológica sobre aquellos que maduran más tardíamente. Se sabe que la edad ósea, concretamente, predice mejor el rendimiento físico que la edad cronológica (Cumming y col, 1972). Así, en un estudio de revisión sobre el crecimiento y desarrollo de los deportistas jóvenes de diferentes deportes (baloncesto, hockey hielo, natación, ciclismo, remo), se observó que un gran número de deportistas varones tenían edades óseas que se podían clasificarse como adelantadas (Malina 1994). Una madurez adelantada influye positivamente sobre diferentes variables relacionadas con la aptitud física y se asocia a niños más altos (Malina 1994; Baxter- Jones 1995) con una mayor masa muscular y un mayor volumen cardiaco, entre otras adaptaciones (Malina 1994; Beunen y col, 1981); todo lo cual ejerce un efecto positivo en el desarrollo de la potencia aeróbica (Ver figura 15-1), la fuerza muscular y la resistencia aeróbica (para profundizar en este tema ver Baxter- Jones 1995). Así, por ejemplo, Szabó y col (1972) demostraron que los nadadores que tienen una madurez adelantada rendían mejor en la prueba de 100 m libres que los nadadores de su misma edad pero de madurez tardía.
Si tomamos como índice de madurez el PHV (madurez somática), y lo comparamos con diversas variables relacionadas con el rendimiento físico, encontramos que el desarrollo de la fuerza máxima ocurre después de los picos en la velocidad de crecimiento de la estatura y del peso en los chicos (Carron y Bailey, 1974) Sin embargo, el patrón de desarrollo de la fuerza máxima en chica no es tan evidente; el pico de desarrollo de la fuerza máxima ocurre más frecuentemente después del PHV, pero existe una variación considerable (Faust 1977). Algunos estudios, como el de Beunen y col (1988), han examinado en chicos con un rango de edad entre los 10 y los 18 años, mediante diversos tests (salto vertical, flexiones de brazos, salto horizontal y otros), la relación entre los resultados de estos tests de fuerza, de rendimiento motor y la edad del PHV. Los resultados indican que la mejora es más evidente justo antes o inmediatamente después de alcanzar el pico de velocidad de incremento en la estatura (Ver figura 14).
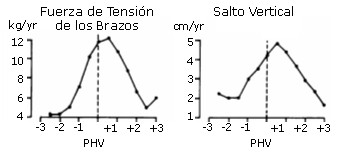
Figura 14. Mejoras medias en dos tests de fuerza, fuerza de tensión de
los brazos (arm pull) y salto vertical (vertical jump) en relación con el PHV en
Niños belgas (Beunen y col, 1988).
Por otro lado, varios trabajos han estudiado la relación VO2 máx./ PHV (Cunningham y col, 1984; Kemper 1985; Mirwald y Bailey, 1986; Rutenfranz y col, 1982). Aunque existen diferencias metodológicas entre estos estudios, los resultados obtenidos en niños son razonablemente consistentes: el VO2 máx, medido en valores absolutos (litros de O2/min), comienza a aumentar alrededor de 5 a 6 años antes del PHV y continua aumentando durante el “estirón” puberal (Ver figura 15). El VO2 máx., medido en valores relativos (ml de O2/kg/min), es más variable en estos cuatro estudios, pero generalmente comienza a declinar alrededor de 1 año antes del PHV. En las chicas, el VO2 máx., medido en valores absolutos (litros de O2/ min) también comienza a aumentar varios años antes del PHV y continúa incrementándose durante varios años después del mismo. Los resultados de la medición de los valores relativos del VO2 máx. (ml de O2/kg/ min) son más variables. Comienzan a descender, generalmente, de 2 a 3 años antes del PHV y continúa descendiendo a lo largo del “estirón” puberal.
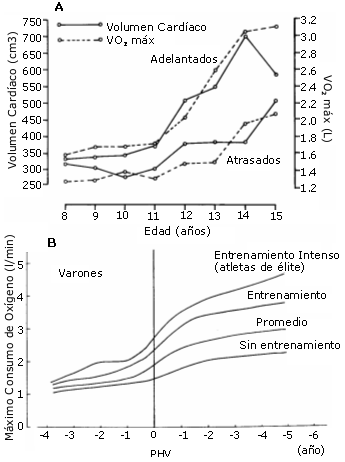
Figura 15 (A y B). A) Valores absolutos del volumen cardiaco (heart
volume) y del VO2 máx. en niños belgas de 8 a 15 años con una madurez
ósea avanzada (advanced) o retrasada (delayed) (Hollman y col, 1967; en: Malina
y Bouchard, 1991; pág 299). B) Cambios en los valores absolutos del VO2
máx. en relación con la edad del PHV y el grado de participación en actividades
físicas. La línea superior representa la mejora del VO2 máx. en
deportistas de alto nivel; la segunda línea representa el VO2 max
para niños entrenados; la tercera representa el VO2 máx. medio para
un estudiante, y la línea inferior representa los valores encontrados en chicos
sedentarios (Kobayashi y col, 1978).
Cuando hablamos de rendimiento físico aeróbico, hay que tener siempre en cuenta dos variables fisiológicas fundamentales: 1) el VO2 máx., del que ya hemos hablado; y 2) el Umbral Anaeróbico (Uan). El Uan, tal y como se define en estos momentos, depende de la acumulación de lactato en la sangre. Este nivel de lactato resulta de un equilibrio entre el lactato producido en las fibras musculares durante la resíntesis de ATP por la vía de la glucolisis anaeróbica, su tasa de liberación a la sangre, su distribución en el agua corporal y su consumo por otros tejidos del cuerpo (Sargeant 1989). Diversos estudios sobre el Uan en niños (para revisión ver Bale 1992) indican que en niños y niñas entre los 6 y los 12 años, el UAn (4 mmol/l) se encuentra en un 50% del VO2 máx., lo que representa 20 a 35 ml de O2/kg/min (Cooper y col, 1984; Washington y col, 1988). En general, los niños tienen un UAn más elevado que las niñas en todas las edades estudiadas.
Por otro lado, en niños de 11 años, los niveles de lactato después de un ejercicio máximo no superan los 7.5- 8 mmol/l (Shephard y col, 1969). Es decir, la vía de la glucolisis anaeróbica no está completamente desarrollada en estas edades, por lo que los niños tienen una menor potencia anaeróbica, expresada en valores absolutos o relativos, que los adultos (Bar- Or 1983; Zwiren 1989) (Ver figura 16). Los niveles de lactato en sangre han sido utilizados habitualmente como un indicador del metabolismo anaeróbico; se asume que una mayor producción de ácido láctico en el músculo se acompaña de un incremento paralelo de lactato en sangre, y que cuanto mayor sea el pico de lactato en sangre, mayor será la contribución del metabolismo anaeróbico en la resíntesis del ATP. Con la edad esta vía de la glucolisis anaeróbica madura y se produce un significativo aumento en la concentración máxima de lactato en sangre, alcanzado los niveles del adulto a los 13- 16 años (Bar- Or 1984).
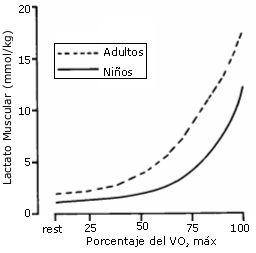
Figura 16. Diferencias entre niños (boys) (alrededor de 14 años) y
varones adultos (adults) en cuanto a la concentración muscular de ácido láctico
(muscle lactate) durante ejercicios de diferentes intensidades, medidas en
porcentaje del VO2 máx. (percent of VO2 max) (Eriksson,
1990; En: Malina y Bouchard, 1991; pág 215).
EL CONCEPTO DE LA ENTRENABILIDAD
El concepto de entrenabilidad se refiere a la respuesta que ofrecen diferentes niños que están desarrollándose (por lo tanto, que se encuentran en diferentes estadios de crecimiento y madurez) a un estímulo de entrenamiento (Malina y Bouchard, 1991). Mas concretamente, se refiere al grado de adaptaciones (cambios fisiológicos) que se producen en diversos tejidos y órganos de un organismo que está creciendo y desarrollándose como consecuencia de un tipo de entrenamiento físico concreto. A menudo se piensa que los jóvenes son más susceptibles de obtener efectos beneficiosos del entrenamiento en los períodos del crecimiento rápido (alrededor del PHV); es decir, en la adolescencia (Malina y Bouchard, 1991).
En el capítulo siguiente vamos a centrarnos en todo lo relacionado con el entrenamiento de fuerza y tocaremos también este aspecto de la entrenabilidad de la fuerza. Por eso, para acabar este capítulo, vamos a ver someramente algunos aspectos relacionados con la entrenabilidad de una variable fisiológica fundamental para estudiar el Potencial Aeróbico de una persona: el Consumo Máximo de Oxígeno (VO2 máx.).
Algunos estudios longitudinales indican que los niños y adolescentes clasificados como sedentarios tienen unas cifras de VO2 máx., en valor absoluto y relativo, más bajas que los que son más activos físicamente. Sin embargo, los datos de que disponemos señalan que los niños menores de 10 años tienen una baja entrenabilidad del VO2 máx.Generalmente los cambios en esta variable fisiológica no van más allá del 5% e, incluso, en algunos estudios se encuentran resultados negativos. No se sabe si estos resultados son la consecuencia de una baja entrenabilidad (un bajo potencial para adaptarse a un entrenamiento aeróbico) o, por el contrario, se trata simplemente de programas de entrenamiento inadecuados. Por ejemplo, si asumimos que los niños más jóvenes en su vida diaria son habitualmente físicamente más activos que los adolescentes o los adultos, habría que pensar en la posibilidad de que para ellos serían necesarios, probablemente, programas de entrenamientos más intensos para conseguir mejoras significativas de su VO2 máx.
Entre los niños más mayores, las respuestas encontradas con diferentes programas de entrenamiento para la mejora del VO2 máx. indican que se produce una mejora, pero en estos casos los resultados tampoco son completamente consistentes. Estas inconsistencias probablemente tengan que ver con las variaciones metodológicas y las diferencias entre las muestras de individuos seleccionados; así, en algunos estudios han trabajado con deportistas, otros han seleccionado a jóvenes razonablemente activos, y en otros han trabajado con sedentarios. No obstante, cuando los jóvenes seleccionados eran sedentarios, un programa de entrenamiento de varias semanas a meses se acompañaba generalmente de mejoras del VO2 máx. similares a las encontradas en los adultos jóvenes (Malina y Bouchard, 1991).
En los estudios con adolescentes, las respuestas se confunden en parte por las variaciones individuales en el proceso de maduración; por lo tanto, se hace difícil separar las mejoras del VO2 máx. debidas al entrenamiento de las asociadas al crecimiento del individuo (Ver figuras 15, 1 y 2). Las cifras absolutas (litros de O2/ min) de VO2 máx. muestran una clara relación con el pico de máximo crecimiento (PHV) en el adolescente.
Referencias
1. Ainsworth, J (1970). The effects of isometric-resistive exercises with the Exer-Genie on strength and speed in swimming. Doctoral Dissertation. University of Arkansas
2. American Academy of Pediatrics (1990). Strength training, weigth and power lifting and body building by children and adolescents. Pediatr. 86:801-803
3. American College of Sports Medicine (1993). The prevention of sports injuries of children and adolescents. Med. Sci. Sports. Exerc. 25(8):1-7
4. ACSM (1998). Position Stand on the Recommended Quantity and Quality of Exercise for developing and Maintaining Cardiorespiratory and Muscular Fitness, and Flexibility in Healthy Adults. Med. Sci. Sports. Exerc. 30 (6) 975-991
5. American Association of Cardiovascular and Pulmonary Rehabilitation (1995). Guidelines for cardiac rehabilitation programs 2nd ed. Champaign, IL, Human kinetics
6. American Association of Cardiovascular and Pulmonary Rehabilitation (1998). Guidelines for pulmonary rehabilitation programs 2nd ed. Champaign, IL, Human kinetics
7. American Heart Association (1983). Exericse testing and training of Individuals with heart disease or at high risk for its development: a handbook for physicians. Dallas
8. American Medical Association/ American Dietetic Association (1991). Targets for adolescent health: nutrition and physical fitness. Chicago; American Medical Association
9. Astrand PO, Engstrom L, Eriksson BO, Karlberg P, Nylander I, Saltin B, Thoren C (1963). Girl swimmers. Acta Paediat (Suppl) 147
10. Bailey DA, Malina RM, Mirwald RL (1986). Physical activity and growth of the child. En: Falkner F, Tanner JM (eds) Human Growth vol 2. Postnatal growth, neurobiology. Plenum Press: New York; pp: 147- 170
11. Bailey DA, McCulloch RG (1990). Bone tissue and physical activity. Can J Sport Sci 15: 229- 239
12. Bale P (1992). The functional performance in children in relation to growth, maturation and exercise. Sports Med 13: 151- 159
13. Baronowski T, Bouchard C, Bar- Or O, y col (1992). Med Sci Sports Exerc; 6: 237- 247
14. Bar- Or O (1983). Pediatric sports medicine for the practitioner. Springer- Verlag, New York
15. Bar- Or O (1984). Children exercise and training: possibilities and limits. En: Saris WH (ed) Pediatric work physiology XI, Human Kinetics Publishers, Champaign, IL
16. Baxter- Jones ADG (1995). Growth and development of young athletes. Should competition levels be age related?. Sports Med 20: 59- 64
17. Beunen G (1989). Biological age in pediatric exercise research. En: Advances in Pediatric Sport Sciences Vol 3, Bar- Or (ed), Champaign, IL: Human Kinetics, pp: 1- 40
18. Beunen G, Ostyn M, Reson R, Simons J, Van Gerven D (1976). Skeletal maturation and physical fitness of girls aged 12 through 16. Hermes (Leuven) 10: 445- 457
19. Beunen G, Simons J, Renson R, Van Gerven D, Ostyn M (1981). Chronological and biological age as related to physical fitness in boys 12 to 19 years. Ann Hum Biol 8: 321- 331
20. Beunen G, Malina RM, Renson R, Simons J, Ostyn M, Lefevre J (1992). Physical activity and growth, maturation and performance: A longitudinal study. Med Sci Sports Exerc 24: 576- 585
21. Beunen, G.P., Malina, R.M., Lefevre, J. y col (1997). Skeletal Maturation, Somatic Growth and Physical fitness in Girls 6-16 years of age. Int. J. Sports. Med. 18: 413-419
22. Bilanin JE, Blanchard MS, Russek-Cohen E (1989). Lower vertebral bone density in male long distance runners. Med Sci Sports Exerc 21: 66-70
23. Blimkie, C.J.R; Ramsay,J; Sale,D; MacDougall,D; Smith,K; Garner,S (1989). Effects of 10 weeks of resistance training on strength development in prepubertal boys. In: Oseid & Carlsen (Eds) Children and Exercise XIII 183-197. Human Kinetics Champaing
24. Blimkie, C.J; MacDougall,J.D; Sale, D (1990). Resistance training during pre - and early puberty: efficacy, trainability, mechanisms and persistence. McMaster University. School of Physical Education and Athletics, McMaster University, Hamilton
25. Blimkie, C.J.R (1993). Resistance training during preadolescence. Issues and controversies Sports medicine 5(6): 389-407
26. Blimkie C.J.R (1993). Benefits and risks of resistance training in children. Intensive participation in children is sports. American Orthopaedic Society for Sport Medicine. Human Kinetics Publishers, Champaign, IL; pp: 133-165
27. Blimkie, C.J.R., Bar Or, O (1996). Trainability of muscle strength, power and endurance during childhood. International Olympic Committee. Medical Commission
28. Boileau RA, Lohman TG, Slaughter MH (1985). Exercise and body composition of children and youth. Scand J Sports Sci 7: 17- 27
29. Borer KT (1995). The effects of exercise on growth. Sports Med; 20: 375- 397
30. Brooks- Gunn J, Warren MP (1988). Mother- daughter differences in menarcheal age in adolescent girls attending national dance company schools and non- dancers. Ann Hum Biol 15: 35- 43
31. Cann CE, Cavanaugh DJ, Schnurpfiel K y cols (1988). Menstrual history is the primary determinant of trabecular bone density in women. Med Sci Sports Exerc 20 (suppl 2): S59
32. Carron AV, Bailey DA (1974). Strentgh development in boys from 10 through 16 years. Monographs of the Society for Research in Child Development 39 (Nº 157)
33. Claessens AL, Malina RM, Lefevre J, y col (1987). Growth and menarcheal status of elite female gymnasts: participants at the 24th world championship artistic gymnastics. Rotterdam, The Netherlands, Med Sci Sports Exerc 24: 755- 763
34. Cooper DM (1994). Med Sci Sports Exerc; 26: 733- 740
35. Cooper DM, Weiler- Ravell D, Whipp BJ, Wasserman K (1984). Aerobic parameters of exercise as a function of body size during growth in children. J Appl Physiol 561: 528- 634
36. Cumming GR, Garand T, Borysyk L (1972). Correlation of performance in track and field events with bone age. J Pediatr 80: 970- 973
37. Cunningham DA, Paterson DH, Blimkie CJR, Donner AP (1984). Development of cardiorespiratory function in circumpuberal boys: A longitudinal study. J Appl Physiol 56: 302- 307
38. Chilibeck P D, Sale DG, Webber CE (1995). Exercise and Bone Mineral Density. Sports Med 19: 103- 122
39. Drinkwater BL (1989). Amenorrheic Athletes: At Risk for Premature Osteopororsis?. First IOC World Congress on Sport Sciences; pp: 151-155
40. Drinkwater BL, Nilson K, Chestnut CH, y col (1984). Bone mineral of amenorrheic and eumenorrheic athletes. N Engl J Med 311: 277- 281
41. Drinkwater BL, Bruemmer B, Chesnut CH (1990). Menstrual history as a determinant of current bone density in young athletes. JAMA 263: 545
42. Eriksson BO, Gollnick PD, Saltin B (1974). The effect of physical training on muscle enzyme activities and fiber composition in 11- year- old boys. Acta Paediatr Belg (Suppl) 28: 245-252
43. Faigenbaum, A.D., Kraemer, W.J., Cahill, B., Chandler, J., Dziados, J. Elfrink, L.D., Forman, E., Gaudiose, M., Micheli, L., Nitka, M., Roberts, S (1996). Strength and conditioning; 18(6): 62-75
44. Faust MS (1977). Somatic development of adolescent girls. Monographs of the Society for Research in Child Development 42 (Nº 162)
45. Feigenbaum, M.S. and M.L. Pollock (1999). Prescription of resistance training for health and disease. Med. Sci. Sports. Exerc. 31 (1) 38-45
46. Fournier M, Ricci J, Taylor AW, y col (1982). Skeletal muscle adaptation in adolescent boys: Sprint and endurance tarining and detraining. Med Sci Sports Exerc 14: 453-456
47. Frisch RE, Revelle R (1971). Height and weigth at menarche and a hypothesis of menarche. Arch Dis Childhood 46: 695- 701
48. Frisch RE, Gotz- Welbergen AB, McArthur JW y col (1981). Delayed menarche and amenorrhea of college athletes in relation to age of onset of training. JAMA 246: 1559- 1563
49. Fry AC, Kraemer WJ, Stone MH y col (1993). Int J Sport Nutr; 3: 306- 322
50. Gorostiaga, E., Izquierdo, M., Iturralde, P. Ruesta, M. Ibanez, J (1999). Effects of strength trainign on maximal and explosive force production, endurance and serum hormones in adolescent handball players. Eur. J. Appl. Physiol. En imprenta
51. Gonzalez, JJ (1999). Entrenamiento de la fuerza en deportes de fuerza-velocidad. Modulo Master de alto rendimiento deportivo. COE
52. Hamilton LH, Brooks- Gunn J, Warren MP, Hamilton WG (1988). The role of selectivity in the pathogenesis of eating problems in ballet dancers. Med Sci Sports Exerc 20: 560- 565
53. Kanehisa, H, Ikegawa, S, Tsumoda, N, Fukunaga, T (1995). Strength and cross-sectional areas of reciprocal muscle groups in the upper arm and thigh during adolescence. International journal of sports medicine 16(1): 54-6
54. Kemper HCG (ed) (1985). Growth, health and fitness in teenagers. Basel: Karger
55. Kobayashi K, Kitamura K, Miura M, Sodeyama H, Murase Y, Miyashita M, Matsui H (1978). Aerobic power as related to body growth and training in Japanese boys: a longitudinal study. J Appl Physiol 44: 666- 672
56. Kotulan J, Reznickova M, Placheta Z (1980). Exercise and growth. En: Placheta Z (ed) Youth and physical activity. Brno, Czechoslovakia: JE Purkyne University Medical Faculty; pp: 61-117
57. Kraemer WJ, Fleck SJ (1993). Strength training for young athletes. Human Kinetics Publishers
58. Krotkiewski M, Kral JG, Karlsson J (1980). Effects of castration and testosterone substitution on body composition and muscle metabolism in rats. Acta Physiol Scand 109: 233- 237
59. Loko J, Sikkut T, Aule, R (1996). Sensitive periods in physical development. Modern athlete and coach 34(2): 26-29
60. Lloyd T, Triantafyllou ST, Baker ER y cols (1986). Women athletes with menstrual irregularity have increased musculoskeletal injuries. Med Sci Sports Exerc 18: 374
61. Lloyd T, Buchanan JR, Myers C (1988). Collegiate women athletes with irregular menses during adolescence have decreased bone densities. Obst Gynecol 72: 639- 642
62. Malina RM (1983). Menarche in athletes: Asynthesis and hypothesis. Ann Hum Biol 10: 1- 24
63. Malina RM (1988). Biological maturity status of young athletes. En: Malina RM (ed) Young athletes: Biological, psychological and educational perspectives. Human Kinetics Publishers, Champaign IL; pp: 121- 140
64. En: Malina RM (ed) Young athletes: Biological, psychological and educational perspectives. Human Kinetics Publishers, Champaign IL; pp: 121- 140 (1989). Growth and maturation: Normal variation and effect of training. Perspectives in exercise science and sports medicine, vol 2. Youth, exercise and sport. Indianapolis: Benchmark Press; pp: 223- 265
65. Malina RM (1994). Physical activity: relationship to growth, maturation, and physical fitness. Physical activity, fitness and health. International proceedings and consensus statement. Human Kinetics Publishers, Champaign IL
66. Malina RM, Beunen G, Wellens R, Claessens A (1986). Skeletal maturity and body size of teenage Belgian track and field athletes. Ann Hum Biol 13: 331- 339
67. Malina RM, Bouchard C (1991). Growth, maturation, and physical activity. Human Kinetic Pub
68. McDougall JD, Webber CE, Martin J y cols (1992). Relationship among running mileage, bone density, and serum testosterone in male runners. J Appl Physiol 73: 1165- 1170
69. McKeag DB (1991). The role of exercise in children and adolescents. Clin Sports Med 10: 117- 130
70. Mirwald RL, Bailey DA (1986). Maximal aerobic power: A longitudinal analysis. London, Ontario: Sports Synamics
71. Myburgh K, Hutchins J, Fataar AB y cols (1990). Low bone density as an etiological factor for stress fractures in athletes. Ann Intern Med 113: 754
72. Narici, M.V., Roi, G.S. Landoni, L. y col (1989). Changes in force, cros-sectional area and neural activation during strength training and detraining of the human quadriceps. Eur. J. Appl. Physiol. 59:310-319
73. National strength and Conditioning Asociation (1996). Youth resistance training: Position Stament paper and literature Review. Strength and Conditioning. 18(6) 62-75
74. Novotny V (1981). Veranderungen des knochenalters im verlauf einer mehrjahrigen sportlichen belastung. Med Sport 21: 44- 47
75. O'Hagan, F.T., Sale, D.G., MacDougall, JD, Garner, SH (1995). Response to resistance training in young women and men. International journal of sports medicine 16(5): 314-321
76. Parizkova J (1974). Particularities of lean body mass and fat development in growing boys as related to their motor activity. Acta Paeditr Belg (Suppl) 28: 233- 242
77. Pate RR, Kiska A (1984). Physiological basis of the sex difference in cardiorespiratory endurance. Sports Med 1: 87- 98
78. Peltenburg AL; Erich WBM, Zonderland ML, Bernink MJE, van der Brande JL, Huisveld IA (1984). A retrospective growth study of female gymnasts and girls swimmers. Int J Sports Med 5: 262- 267
79. Ramsay, J.A., Blimkie, C.J., Smith, K., Garner, S., MacDougall, J.D., Sale, D (1990). Strength training effects in prepubescent boys. Medicine and science in sports and exercise; 22(5): 605-614
80. Ramos, E., Frontera, W.R. Llopart, A., Feliciano, D (1998). Muscle strength and hormonal levels in Adolescents: Gender Related Differences. nt J. Sports. Med 19:526-5331
81. Riddoch C, Savage JM, Murphy N y col (1991). Arch Dis Child; 66: 1426- 1433
82. Rogol (1988). Pubertal development in endurance- trained female athletes. En: Brown EW y Branta CF (eds) Competitive sports for children and youth. Human Kinetics, Champaign, IL; pp: 173- 194
83. Rowland TW, Morris AH, Kelleher JF, Haag BL, Reiter EO (1987). Serum testosterone response to training in adolescent runners. Am J Dis Child 141: 881- 883
84. Rutenfranz J, Andersen K, Seliger V, Ilmarinen J, Klimmer F, Kylian H, Rutenfranz M, Ruppel M (1982). Maximal aerobic power affected by maturation and body growth during childhood and adolescence. Eur J Pediat 139: 106- 112
85. Sale, D.G (1989). Strength training in children. In: Perspectives in Exercise Science and sports medicine. G.V. Gisolfi and D.R Lamb, eds. Indianapolis: Benchmark 165-216
86. Sargeant AJ (1989). Short- term muscle power in children and adolescents. En: Bar- Or (ed) Advances in Pediatric Sport Sciences, vol 3. Human Kinetics Publishers, Champaign, IL; pp: 41- 66
87. Seefeldt V, Haubenstricker J, Branta C, McKeag D (1986). Anthropometric assessment of body size and shape of young runners and control subjects. En: Weiss MR, Gould D (eds) Sport for children and youths. Human Kinetics Publishers, Champaign IL
88. Shephard RJ, Allen C, Bar- Or O, Davies CT, Deare S y col (1969). The working capacity of Toronto School Children Part I. Can Med Assoc J 100: 560- 566
89. Stager JM, Halter LK (1988). Menarche in athletes: The influence of genetics and prepubertal training. Med Sci Sports Exerc 20: 369- 373
90. Suurnakki T, Illmarinen J, Nygard GH, Komi PV, Karlsson J (1986). Anaerobic strain in children during a cross- country skiing competition. En: Rutenfranz J y col (eds) Children and exercise XII. Human Kinetics Publishers, Champaign IL; pp: 67- 75
91. Tanner JM (1962). Growth and adolescence, 2nd ed. Blackwell, Oxford
92. Tanner JM, Hughes PCR, Whitehouse RH (1981). Radiographically determined widths of bone muscle and fat in the upper arm abd calf from age 3- 18 years. Ann Hum Biol 8: 495- 517
93. Vanderbroucke NP, van Laar A, Valkenburg HA (1983). Synergy betwen thinness and intensive sport activity in delaying menarche. Br Med J 284: 1907- 1908
94. Viru, A., Loko, J., Volver, A., Laaneots, L., Sallo, M., Smirnava, T., Karelson, K (1996). Alterations in foundations for motor development in children and adolecents. Coaching and sports Science Journal, 1(4): 11-19
95. Warren MP (1980). The effects of exercise on pubertal progresion and reproductive function in girls. J Clin Endocrinol Metab 51: 1150- 1157
96. Warren MP, Brooks- Gunn J, Fox RP, y col (1991). Lack of bone accretion and amenorrhea: evidence for a relative osteopenia in weight bearing bones. J Clin Endocrinol Metab 72: 847- 853
97. Warren MP, Brooks- Gunn J, Hamilton LH, y col (1986). Scoliosis and fractures in young ballet dancers: relation to delayed menarche and secondary amenorrhea. N Engl J Med 314: 1348- 1353
98. Warren MP, Shangold MM (1997). Sports Gynecology. Problems and care of the athletic female. Blackwell Science
99. Warren MP, Shangold MM (1997). Sports Gynecology. Problems and care of the athletic female. Blackwell Science
100. Washington RL, Von Gundy JC, Cohen C Sandheimer HM, Wolfe RR (1988). Normal aerobic and anaerobic exercise data for North American school- age children. J Pediatr 112: 223- 233
101. Watson RC (1975). Bone growth and physical activity in young males. En: Mazzes RB (ed) International conference on bones minimal measurement. Washington DC: Department of Health, Education and Welfare; pp: 380- 386
102. Wells CL (1985). The limits of female performance. En: Clarke DH, Eckert HM (eds) American Academy of Physical Education Papers 18. Human Kinetics Publishers, Champaign, IL; pp: 81- 92
103. Williams CA (1997). Childrens and adolescents anaerobic performance during cycle ergometry. Sports Med 24: 227- 240
104. Zwiren LD (1989). Anaerobic and aerobic capacities of children. Pediat Exerc Sci 1: 31- 44