Efectos de la Administración Oral de DHEA Sobre la Testosterona Sérica y sobre las Adaptaciones al Entrenamiento de la Fuerza en Hombres Jóvenes
Matthew Vukovich1, Amanda Brown1, Rick L Sharp1, Tracy A Reifenrath1, Kerry A Parsons1 y Douglas S King1
Exercise Biochemistry Laboratory, Department of Health and Human Performance, Iowa State University, Ames, Iowa 50011.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1999.
Publicado 15 de marzo de 2006
Resumen
Palabras clave: insulina, transaminasas hepáticas, lípidos séricos, estrógenos séricos, entrenamiento de la fuerza
INTRODUCCION
La dehidroepiandrosterona (DHEA; 3β-hidroxi-5-androsten-17-ona) y su sulfato conjugado (DHEA-S) son hormonas esteroides de gran abundancia en la sangre. Aunque el/los rol/es fisiológico/s de la DHEA y de la DHEA-S no están claros, los niveles anormales en sangre de DHEA y DHEA-S pueden estar relacionados con la obesidad (16) y con la resistencia a la insulina (2, 16). Además, las concentraciones sanguíneas de DHEA y DHEA-S disminuyen en los hombres después de los 25 años de edad (31).
La DHEA sanguínea puede ser convertida en androstenediona o en androstenediol, los cuales a su vez pueden ser convertidos en testosterona. Sin embargo, la DHEA, la testosterona, el androstenediol y la androstenediona pueden ser aromatizados a estrógenos o reducidos a dihidrotestosterona (DHT) por la 5α-reductasa en los tejidos periféricos (24), lo cual puede mitigar cualquier incremento en la concentración sérica de testosterona luego de la ingesta de DHEA. Aunque se ha demostrado que la ingesta de DHEA produce un incremento de los niveles sanguíneos de androstenediona (27-30, 39), DHEA (27-29, 39) y de DHEA-S (25, 27-30, 38, 39), no está claro si la administración oral de DHEA produce un incremento en los niveles sanguíneos de testosterona en hombres (25, 27-30, 39). Además, se ha demostrado que el incremento artificial de la concentración sanguínea de testosterona suprime la producción de testosterona a través de la retroalimentación negativa del eje hipotalámico-pituitario-adrenal (5, 22). Por lo tanto, uno de los propósitos de este estudio fue determinar el efecto de una única ingesta de 50 mg de DHEA y la ingesta de 150 mg de DHEA/día sobre las concentraciones séricas de hormonas esteroides.
El entrenamiento de la fuerza provoca la hipertrofia de las fibras musculares, particularmente de las fibras tipo II (36). Se reconoce que la utilización de testosterona exógena y de anabólicos esteroides conjuntamente con el entrenamiento de la fuerza incrementan las ganancias en la masa muscular y en la fuerza asociadas con el entrenamiento de sobrecarga (5, 22). Aunque la masa muscular puede también aumentarse solo mediante la suplementación con DHEA (27, 30, 39), no se sabe cual es el impacto de la suplementación con DHEA durante el entrenamiento de la fuerza sobre la masa muscular y la fuerza. La utilización de anabólicos esteroides produce una reducción del porcentaje de grasa corporal (5, 22) y se ha reportado que este porcentaje permanece sin cambios (27, 28, 38) o se reduce (10, 13, 14, 27, 30, 39) en respuesta a la ingesta crónica de DHEA. No existen datos disponibles acerca del efecto de la suplementación con DHEA sobre la composición corporal durante el entrenamiento de la fuerza. Por lo tanto otro de los propósitos de este estudio fue explorar los efectos de la ingesta de DHEA durante el entrenamiento de la fuerza sobre la masa muscular, el diámetro de las fibras musculares, la fuerza muscular y sobre la grasa corporal.
La reducción en los niveles sanguíneos de DHEA ha sido asociada con la hiperglucemia y con la resistencia a la insulina (2, 16). Algunos autores no han observado cambios en la sensibilidad a la insulina en respuesta a la ingesta crónica de DHEA (27, 28, 30, 39), mientras que otros han observado un incremento (29) o una reducción (7, 10, 13) en la respuesta de la insulina ante el incremento de la glucosa luego de la suplementación con DHEA. En contraste, reportes recientes sugieren que la DHEA puede mejorar la acción de la insulina incrementando las actividades de la fosfatidilinositol 3-quinasa (13) y de la proteína quinasa C (35). Aunque la tolerancia a la glucosa no cambia o mejora luego del entrenamiento de la fuerza, la reducción observada en la respuesta de la insulina plasmática a la administración oral de glucosa indica una sensibilidad de la insulina incrementada (9, 26, 34). Se sabe que esteroides anabólicos-androgénicos incrementan el riesgo de enfermedades cardiovasculares como resultado de la reducción en las concentraciones de lipoproteínas de alta densidad (HDL-C) y del incremento en las concentraciones séricas de lipoproteínas de baja densidad (LDL-L). La función hepática también puede verse afectada por la elevación en las concentraciones sanguíneas de testosterona (19, 22, 23). Se ha demostrado que la ingesta crónica de DHEA reduce (28, 29) o no tiene efectos (30, 38) sobre las concentraciones sanguíneas de HDL-C. El efecto de la ingesta crónica de DHEA sobre la función hepática en hombres jóvenes también es desconocido. Por lo tanto otro de los propósitos de este estudio fue determinar el efecto de la ingesta de DHEA conjuntamente con el entrenamiento de la fuerza sobre la tolerancia a la glucosa y la sensibilidad a la insulina, sobre los perfiles lipídicos sanguíneos y sobre la función hepática.
METODOS
Sujetos
Un total de 30 hombres jóvenes saludables (19 a 29 años de edad) fueron reclutados para el estudio, el cual fue aprobado por el Comité para la Utilización de Sujetos Humanos de la Universidad Estatal de Iowa. Todos los participantes completaron un cuestionario acerca de la utilización de suplementos nutricionales o acerca de su participación en programas para el entrenamiento de la fuerza antes de su participación en el estudio. Los sujetos no reportaron estar actualmente utilizando o haber utilizado suplementos nutricionales o haber participado en programas para el entrenamiento de la fuerza. Todos los sujetos estaban libres de enfermedades cardiovasculares u ortopédicas que pudieran contraindicar la realización de ejercicios.
Administración Aguda de DHEA
Los efectos de la ingesta aguda de DHEA sobre las concentraciones séricas de androstenediona, testosterona libre, testosterona total, estradiol (E2), hormona luteinizante (LH) y hormona folículo estimulante (FSH) fueron estudiados en 10 hombres (23±4 años de edad). En dos ocasiones separadas por ≥1 semana y luego de una noche de ayuno, se le administraron a los sujetos 50 mg de DHEA (un tercio de la dosis diaria dada durante el entrenamiento de la fuerza) o placebo (PL, 83 mg de harina de arroz) con un diseño doble ciego aleatorio. Se obtuvieron muestras sanguíneas antes y cada 30 minutos durante las 6 horas posteriores a la ingesta. Las concentraciones séricas de hormonas fueron determinadas como se describe más abajo.
Suplementación con DHEA durante el Entrenamiento de la Fuerza
Luego de ser evaluados, 20 de los sujetos fueron asignados aleatoriamente con un diseño doble ciego a grupos que ingirieron 150 g de DHEA/día o PL (250 g de harina de arroz) durante las semanas 1-2, 4-5 y 7-8 de las 8 semanas del entrenamiento de la fuerza (Figura 1). Esta dosis de DHEA fue tal que excedió la dosis recomendada (50-100 mg/día) por muchos suministradores de DHEA. La suplementación fue administrada utilizando un patrón cíclico que consistió en dos semanas de suplementación seguido de una semana sin suplementación para de esta manera simular el régimen de suplementación recomendado por muchos suministradores de suplementos para físicoculturistas. Se pensó que este patrón cíclico permitiría un período de lavado, reduciendo la probabilidad de efectos secundarios negativos, tales como ginecomastia y anormalidades en el metabolismo del colesterol asociados con la utilización de suplementos androgénicos. Los suplementos fueron tomados en tres dosis iguales antes de las 9:00 am, a las 3:00 pm, y a la hora de acostarse. La DHEA (Experimental and Applied Sciences, Golden, CO) es un producto comercialmente disponible extraído del ñame silvestre (Dioscorea villosa) y dos laboratorios independientes, que realizaron análisis de HPLC, reportaron que el grado de pureza era de un 98 y un 99% (Biomedical Laboratories, Petaluma, CA, y Integrated Biomolecule, Tucson, AZ, respectivamente). Para estimular el cumplimiento, los sujetos mantuvieron un registro de las ingestas del suplemento y se les pidió que devolvieran los suplementos no utilizados al finalizar el estudio.
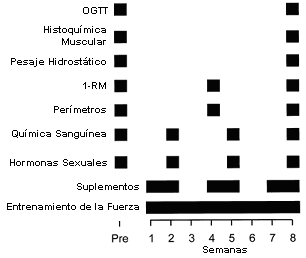
Figura 1. Diseño experimental. OGTT, test de tolerancia a la glucosa
oral; RM, repetición máxima, Pre; pre ejercicio.
Entrenamiento de la Fuerza
Los sujetos realizaron entrenamientos de la fuerza 3 días/semana en días no consecutivos utilizando los ejercicios de press de banca, press de hombros, extensiones de rodilla, flexiones de rodilla izquierda y derecha, mariposa vertical, press de piernas, press de pantorrillas, curl de bíceps, curl de tríceps, y tirones en polea. Los sujetos fueron instruidos acerca de la técnica apropiada de levantamiento y fueron supervisados durante todas las sesiones de entrenamiento. El programa para el entrenamiento de la fuerza fue diseñado para incrementar la fuerza muscular en todos los principales grupos musculares del cuerpo. Los sujetos realizaron 3 series de 10 repeticiones en las dos primeras semanas del entrenamiento. En las últimas 6 semanas de entrenamiento, los sujetos realizaron tres series de ocho repeticiones. Se utilizó una carga igual al 80-85% de una repetición máxima (1RM) tomada cuando a los sujetos se los consideraba desentrenados. Luego de la determinación de la 1RM en la semana 4 de entrenamiento, la intensidad del entrenamiento fue ajustada al 80-85% de la nueva 1RM. En cada sesión de entrenamiento se registró la cantidad de peso levantado, el número de series y el número de repeticiones realizadas. Los sujetos fueron instruidos para que limitaran la realización de ejercicio al régimen de entrenamiento prescrito durante todo el estudio.
Evaluación de la Fuerza
Antes del entrenamiento y después de las semanas 4 y 8, se realizaron a los sujetos evaluaciones de 1RM. Se permitió que los sujetos realizaran una breve entrada en calor utilizando cargas ligeras, y luego se los estimuló para que alcanzaran su 1RM dentro de cinco pruebas durante las cuales se incrementó la carga (1). La repetición máxima fue evaluada en los ejercicios de press de banca, press de hombros, extensiones de rodilla, flexión de rodilla izquierda y derecha, curl de bíceps, curl de tríceps, tirones de polea y mariposa vertical. Todos los entrenamientos de la fuerza y la evaluación de la 1RM fueron llevados a cabo con un equipo multiestación de resistencia isotónica (model FTX, Paramount Fitness Equipment, Los Angeles, CA).
Composición Corporal
Antes y después de las semanas 4 y 8 de entrenamiento se determinaron la talla, el peso y los perímetros corporales. Los perímetros fueron medidas por el mismo investigador, el cual midió los perímetros del hombro, bíceps, pecho, abdomen, cintura, caderas, glúteos, muslo y pantorrillas utilizando los métodos especificados por el Colegio Americano de Medicina del Deporte (1). La composición corporal fue determinada mediante pesaje hidrostático utilizando una celda de carga con una interfase a una computadora y un programa estándar de computadora, antes del entrenamiento y después de las semanas 4 y 8 de entrenamiento y suplementación. El programa de computadora utiliza la ecuación de Siri para determinar la grasa corporal (33) y la ecuación de Goldman-Becklake para calcular el volumen residual pulmonar (12).
Análisis Clínicos de la Química Sanguínea y Análisis Hormonales
Las muestras sanguíneas fueron obtenidas luego de una noche de ayuno para realizar los análisis clínicos de la química de la sangre y los análisis hormonales, antes del entrenamiento y luego de las semanas 2, 5 y 8 del entrenamiento y la suplementación. La sangre fue recolectada sin estasis insertando un catéter en la vena antecubital. Un laboratorio comercial (Labcorp, Kansas City, MO) realizó todos los análisis clínicos de la química sanguínea. Otra muestra sanguínea fue centrifugada, y el suero fue congelado a -80ºC hasta los análisis. Las concentraciones séricas de testosterona libre y testosterona total, androstenediona, estrona (E1), E2 y estriol (E3) fueron medidos con el análisis RIA utilizando instrumental disponible comercialmente (Diagnostic Products, Los Angeles, CA, and Diagnostic Systems Laboratories, Webster, TX). Las concentraciones séricas de LH y FSH fueron medidas utilizando instrumental comercialmente disponible para el análisis inmunoradiométrico (Diagnostic Product). Todas las muestras de cada sujetos fueron analizadas en la misma corrida. Los coeficientes de variación intra-ensayo fueron 7.3, 7.7, 6.7, 4.7, 3.9, 8.2, 6.0, y 7.3% para la testosterona libre, testosterona total, androstenediona, LH, FSH, E1, E2, y E3 respectivamente.
Test de Tolerancia a la Administración Oral de Glucosa
Antes del entrenamiento y nuevamente dentro de los tres días (48±1 h) posteriores a la última sesión de entrenamiento, los sujetos realizaron un test de tolerancia de glucosa oral (OGTT) de 2 h de duración durante el cual se le administraron a los sujetos 75 g de glucosa por vía oral y el cual se llevó a cabo entre las 5 y las 10 am luego de 8 a 12 horas de ayuno. Se obtuvieron muestras sanguíneas (~10 ml) a los minutos 0, 30, 60, 90 y 120 insertando un catéter flexible en la vena antecubital. El plasma fue separado y guardado a -80ºC hasta que se realizaran los análisis para la determinación de las concentraciones de glucosa e insulina. Las concentraciones plasmáticas de glucosa fueron medidas espectrofotométricamente utilizando el método de la hexoquinasa (Sigma Chemical, St. Louis, MO). Las concentraciones plasmáticas de insulina fueron determinadas mediante el análisis RIA (Diagnostic Products). El coeficiente de variación intra-ensayo para la insulina fue de 7.1%.
Se les dio instrucciones a los sujetos para que mantuvieran sus dietas regulares excepto que estas deberían contener 150 g de carbohidratos por día. Se llevaron registros dietarios durante 3 días antes del OGTT inicial, luego de lo cual los sujetos fueron provistos con copias de estos registros dietarios y se les pidió que repitieran la misma dieta para el OGTT postentrenamiento. La composición de las dietas registradas fue valorada utilizando un programa informático para el análisis de alimentos (Food Comp, Iowa State University). Los sujetos también fueron instruidos para que mantuvieran sus regímenes dietarios normales a lo largo de todo el estudio.
Histoquímica Muscular
Se realizaron biopsias musculares antes y después del entrenamiento de la fuerza para determinar la distribución de los tipos de fibras en los músculos esqueléticos y el área media de sección transversal. Las muestras musculares (~100 mg) fueron obtenidas en la parte lateral del músculo vasto lateral de los sujetos utilizando la técnica de biopsia con aguja descrita por Bergstrom (4). Los especímenes musculares fueron colocados en un medio de soporte y congelados en isopentano enfriado a temperatura de nitrógeno líquido para su posterior seccionado y tinción. Las secciones transversales congeladas (~ 10 μm) fueron cortadas en un histostat (Histostat Microtome, AO Scientific Instruments) a -20ºC. El porcentaje de fibras tipo I y tipo II fue determinado en secciones teñidas para medir la actividad de la ATPasa a un pH de 9.4 luego de ser preincubadas a un pH de 4.3. Además las muestras fueron contrateñidas con una tinta eosin Y para incrementar la intensidad del color y ayudar de esta manera al análisis mediante imágenes de los diferentes tipos de fibras musculares. La distribución de los tipos de fibras musculares y el área de las fibras musculares fueron determinados utilizando un sistema de análisis de imágenes operado por computadora (Neosis Visilog Image Analysis Software, SGI-Computer; cámara modelo DXC-3000A, Sony). El sistema captura imágenes microscópicas, traza los límites de las fibras musculares, cuenta las fibras musculares claras y oscuras, y mide el área de sección transversal de todas las fibras. Para determinar el porcentaje de distribución de las fibras tipo I y tipo II, se utilizaron todas las fibras viables. El área media de sección transversal de las fibras fue determinada en 20 fibras seleccionadas al azar para cada tipo de fibra. Para la determinación del área media de sección transversal de las fibras tipo I y tipo II, se seleccionaron agrupaciones de fibras claramente definidas, y un técnico, ajeno a los tratamientos, seleccionó aleatoriamente 20 fibras de cada tipo.
Cálculos y Estadística
Las áreas de incremento bajo la curva para la insulina y la glucosa fueron calculadas utilizando el modelo trapezoidal con un programa estándar de computadora. Los análisis estadísticos se llevaron a cabo utilizando el análisis de varianza ANOVA de dos vías para mediciones repetidas. Cuando se observaron interacciones significativas, las diferencias específicas en las medias se encontraron utilizando el test de Newman-Keuls de comparaciones múltiples. Todos los análisis estadísticos fueron llevados a cabo con un programa comercial (Sigma Stat 1.0, Jandel Scientific, San Rafael, CA) y fueron evaluados a p<0.05.
RESULTADOS
Sujetos
De los 30 sujetos que iniciaron el proyecto, 1 de los sujetos del grupo DHEA que participaba en el programa de entrenamiento de la fuerza se retiró del estudio. Este estudio fue parte de una mayor investigación que involucraba diferentes tipos de suplementos, y los datos de los sujetos a los cuales se les administró PL se han reportado en otros artículos (20). No se hallaron diferencias entre los grupos de tratamiento en términos de aptitud física, edad o experiencia en la realización de ejercicios.
Respuesta Aguda a la Administración de DHEA
La ingesta de 50 mg de DHEA resultó en un incremento en las concentraciones séricas de androstenediona dentro de los 30 min de la administración (Figura 2, p<0.05) cuyo pico fue del 150% del valor basal a los 60 min posteriores la ingesta. Las concentraciones séricas de androstenediona tendieron a disminuir luego de los 60 min, pero se mantuvieron significativamente elevadas durante los 360 minutos posteriores a la ingesta de DHEA (p<0.05). La ingesta de placebo no produjo cambios en las concentraciones séricas de androstenediona. Las concentraciones séricas de LH y FSH tampoco se vieron alteradas durante los 360 min posteriores a la ingesta de DHEA o de PL. La ingesta de DHEA o de PL no alteró las concentraciones séricas de testosterona libre o de testosterona total. Las concentraciones séricas de E2 se incrementaron significativamente en los 60 min posteriores a la ingesta de PL y DHEA (efecto principal para el tiempo, p<0.05) y no fueron diferentes entre los grupos.
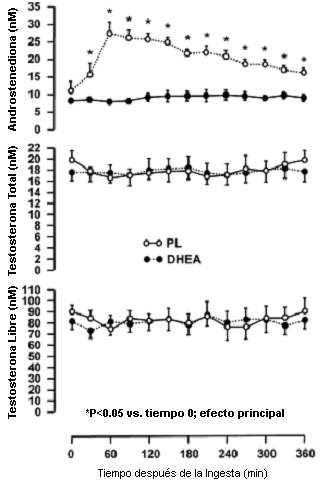
Figura 2. Concentraciones séricas de androstenediona, testosterona libre
y testosterona total luego de la ingesta de 50 mg de dehidroepiandrosterona (DHEA)
o placebo (PL). Los valores son presentados como medias±EE (n=10).
*Significativamente diferente con respecto al tiempo 0 para la ingesta de DHEA
(p<0.05)
Entrenamiento de la Fuerza
No se hallaron diferencia significativas entre la suplementación con PL y con DHEA con respecto al número de series o repeticiones ejecutadas por sesión de ejercicio o en la intensidad relativa de cada sesión de ejercicio. Cuando los datos de todos los sujetos fueron combinados, se observó que los sujetos se ejercitaron a una intensidad del 81±2% de 1RM durante las primeras 4 semanas de entrenamiento y al 83±1% de 1RM durante las últimas 4 semanas de entrenamiento. La fuerza media total producida por sujeto en cada día fue de 46±1 kN en las primeras 4 semanas de entrenamiento y de 43±1 kN en las últimas 4 semanas de entrenamiento, sin observarse diferencias significativas entre los grupos. La menor cantidad de fuerza producida durante las semanas 4-8 se debió al menor número de repeticiones realizadas durante cada sesión de ejercicio.
Respuesta Hormonal a la Administración de DHEA durante el Entrenamiento de la Fuerza
Debido a la pérdida de potencia del congelador del laboratorio y al derretimiento de las muestras de suero, no pudimos medir las concentraciones séricas de DHEA o de DHEA-S. Las concentraciones séricas de androstenediona (Figura 3) se incrementaron significativamente en los sujetos tratados con DHEA en las semana 2 (13±1 nM) y en la semana 5 (17±2 nM) en comparación con la semana 0 (10±1 nM, p< 0.05). En la semana 8, las concentraciones séricas de androstenediona no fueron significativamente diferentes de las observadas en la semana 0. Las concentraciones séricas de androstenediona no fueron afectadas por el entrenamiento o la suplementación en los sujetos que fueron tratados con PL. El tamaño del efecto calculado para la comparación de las concentraciones de androstenediona fue muy grande (1.1). Este cálculo destaca el efecto de la DHEA en el incremento de las concentraciones séricas de androstenediona.
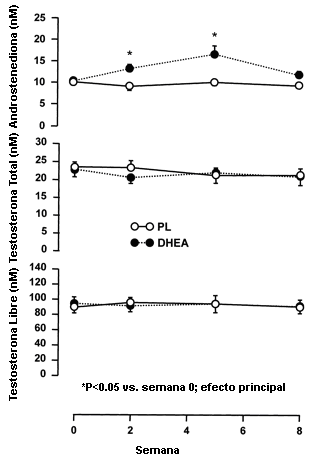
Figura 3. Concentraciones séricas de androstenediona y de testosterona
libre y testosterona total, antes y durante el entrenamiento de la fuerza
combinado con la suplementación con 150 mg de DHEA/día (n=9) y PL (n=10). Los
suplementos fueron administrados durante las semanas 1-2, 4-5, 7-8. Los valores
son presentados como medias±EE. *Significativamente diferente con respecto a la
semana 0 para la administración de DHEA (p<0.05).
Las concentraciones séricas de LH no fueron alteradas por las suplementación y el entrenamiento en los sujetos tratados con DHEA (3.5±0.7 vs. 3.4±0.8 mIU/ml) o en los sujetos tratados con PL (2.5±0.6 vs. 2.9±0.6 mIU/ml). La suplementación y el entrenamiento tampoco alteraron las concentraciones séricas de FSH en los sujetos tratados con DHEA (2.9±1.1 vs. 3.1±1.2 mIU/ml) o con PL (2.6±0.6 vs. 3.0 ± 0.6 mIU/ml).
Las concentraciones de testosterona libre y testosterona total (Figura 3) no fueron alteradas por las 8 semanas de entrenamiento de la fuerza y la suplementación tanto en los sujetos tratados con PL como en los sujetos tratados con DHEA.
Debido a que uno de los sujetos del grupo PL tuvo concentraciones séricas iniciales de E2 muy altas (0.46 nM) sus datos fueron excluidos de los análisis estadísticos de las concentraciones séricas de E2. Las concentraciones séricas de E1, E2, y E3 no fueron alteradas significativamente por las 8 semanas de entrenamiento de la fuerza y suplementación, tanto en los sujetos tratados con PL como en aquellos tratados con DHEA (Figura 4).
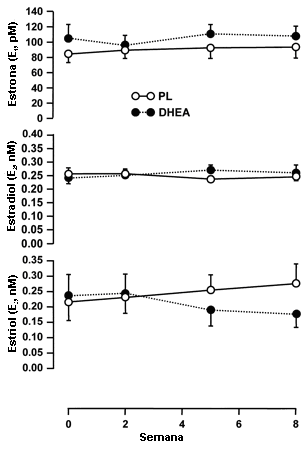
Figura 4. Concentraciones séricas de estrona, estradiol y estriol antes y
durante el entrenamiento de la fuerza combinado con la administración de 150 mg
de DHEA/día (n=9) y PL (n=10). Los suplementos fueron administrados durante las
semanas 1-2, 4-5, y 7-8. Los valores son presentados como medias±EE.
Fuerza Muscular
La fuerza muscular no fue significativamente diferente entre los sujetos tratados con PL y los sujetos tratados con DHEA antes del entrenamiento o después de las 4 u 8 semanas de entrenamiento. Para facilitar la presentación de los datos (Figura 5), la fuerza del tren superior fue calculada como la suma de las 1RM en los ejercicios de press de banca, press de hombros y tirones en polea. La fuerza del tren superior se incrementó de manera similar en los sujetos tratados con PL y en los sujetos tratados con DHEA luego de la semana 4 de entrenamiento y suplementación (efecto principal, p<0.05). La fuerza del tren superior mostró un incremento adicional en todos los grupos en las 4 semanas finales del entrenamiento de la fuerza y suplementación (efecto principal, p<0.05). El incremento total en la fuerza del tren superior desde la semana 0 hasta la semana 8 no fue diferente entre los sujetos tratados con PL (2016±170 vs. 2492±203 N) y aquellos tratados con DHEA (1815±187 vs. 2242±279 N). El cálculo del tamaño del efecto con los datos de la fuerza del tren superior reveló un tamaño del efecto de 0.18. Con una potencia asumida del 80% y con p=0.05, se hubiera requerido una muestra de 475 sujetos para determinar un efecto de este tamaño. Estos cálculos enfatizan la falta de efecto de la DHEA sobre la fuerza muscular durante un programa para el entrenamiento de la fuerza. La fuerza del tren inferior fue calculada como la suma de las 1RM en los ejercicios de extensión de rodilla y de flexión de la rodilla izquierda y derecha. La fuerza del tren inferior se incrementó de manera similar durante las primeras 4 semanas del entrenamiento y suplementación en los sujetos tratados con PL y en aquellos tratados con DHEA (efecto principal, p<0.05). Las últimas 4 semanas de entrenamiento de la fuerza y suplementación resultaron en incrementos adicionales en la fuerza del tren inferior en ambos grupos (efecto principal, p<0.05). El incremento total en la fuerza del tren inferior entre la semana 0 y la semana 8 no fue diferente entre los sujetos tratados con PL (1387±55 vs. 1980±70 N) y aquellos tratados con DHEA (1349±61 vs. 1912±62 N). Cuando se combinaron los datos de ambos grupos y de todos los sujetos, la ganancia media en la fuerza muscular corporal total en las primeras 4 semanas de entrenamiento fue de 17±2% mientras que las últimas 4 semanas de entrenamiento de la fuerza resultaron en un incremento adicional en la fuerza muscular del 11 ±2%.
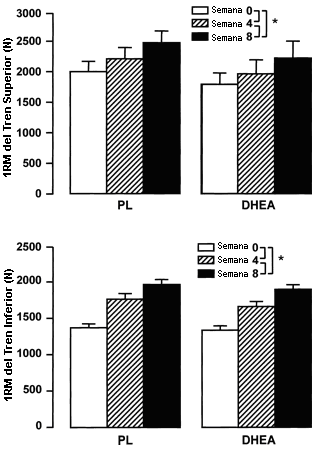
Figura 5. Fuerza del tren superior e inferior, antes y después del
entrenamiento de la fuerza combinado con la suplementación de 150 mg de DHEA/día
(n=9) o PL (n=10). Los suplementos fueron administrados durante las semanas 1-2,
4-5, y 7-8. La fuerza del tren superior fue calculada como la suma de las 1RM en
los ejercicios de press de banca, press de hombros y tirones en polea. La fuerza
del tren inferior fue calculada como la suma de las 1RM en los ejercicio de
extensiones de rodilla y flexiones de la rodilla izquierda y derecha. Los
valores son presentados como medias±EE. * Significativamente diferente con
respecto al valor previo al entrenamiento de la fuerza (efecto principal
significativo, p<0.05).
Histoquímica Muscular
Debido a la pérdida de potencia del congelador del laboratorio y al derretimiento de algunas de las muestras musculares, solo se obtuvieron secciones viables en nueve sujetos tratados con PL y en cinco sujetos tratados con DHEA. El porcentaje de fibras tipo I antes del entrenamiento de la fuerza y la suplementación fue similar entre los sujetos tratados con PL (44±6%) y aquellos tratados con DHEA (53±5%) y no se observaron cambios luego del entrenamiento de la fuerza ni aquellos sujetos tratados con PL (45±5%) ni en aquellos tratados con DHEA (52±4%). El área media de sección transversal de las fibras tipo I (Figura 6) no fue alterada por el entrenamiento de la fuerza y la suplementación en aquellos sujetos tratados con PL (3980±411 vs. 4102±604 µm2) o en aquellos sujetos tratados con DHEA (4054±369 vs. 4285±356 µm2). El área media de sección transversal de las fibras tipo II se incrementó (efecto principal significativo, p<0.05) tanto en los sujetos tratados con PL (5271±485 vs. 5728 ±451 µm2) como en los sujetos tratados con DHEA (5724±456 vs. 5829±354 µm2).
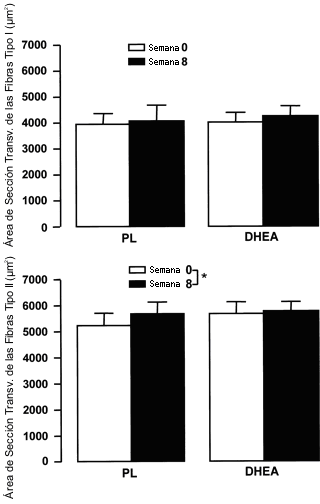
Figura 6. Cambio medio en las áreas de sección transversal de las fibras
musculares tipo I y tipo II extraídas del músculo vasto lateral, antes y después
del entrenamiento de la fuerza combinado con la administración de 150 mg de DHEA/día
(n=5) o PL (n=9). Los suplementos fueron administrados durante las semanas 1-2,
4-5, y 7-8. Los valores son presentados como medias±EE. * Significativamente
diferente con respecto al valor previo al entrenamiento de la fuerza para ambos
grupos (efecto principal significativo, p<0.05).
Datos Antropométricos
No se hallaron diferencias significativas entre los sujetos tratados con DHEA y los sujetos tratados con PL en cuanto a los cambios en la composición corporal observados como consecuencia del entrenamiento de la fuerza (Tabla 1). Se observaron incrementos significativos en los perímetros del bíceps, hombro y pecho (efecto principal, p<0.05), mientras que los perímetros abdominal, de la cintura, de la cadera y del glúteo se redujeron durante el entrenamiento de la fuerza, tanto en los sujetos tratados con DHEA como en aquellos tratados con PL (efecto principal, p<0.05). Además, el programa para el entrenamiento de la fuerza redujo significativamente (efecto principal, p<0.05) el porcentaje de grasa en ambos grupos.
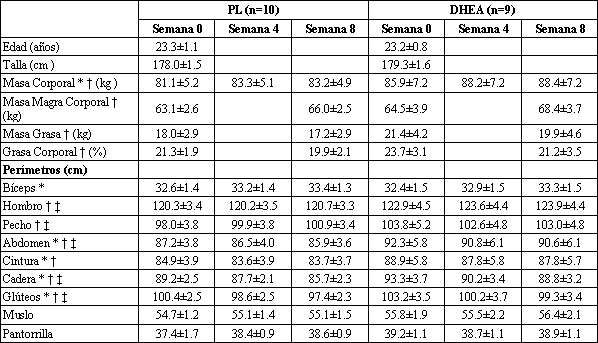
Tabla 1. Datos antropométricos durante el entrenamiento de la fuerza y la
suplementación con DHEA o PL. Los valores son presentados como medias±EE para
todos los datos de dehidroepiandrosterona (DHEA, 150 mg/día) y placebo (PL); n,
número de sujetos. Los sujetos realizaron un programa de entrenamiento de la
fuerza de 8 semanas e ingirieron PL o DHEA. * Semana 4 significativamente
diferente de la semana 0 (efecto principal p<0.05). † Semana 8
significativamente diferente de la semana 0 (efecto principal, p<0.05). ‡ Semana
8 significativamente diferente de la semana 4 (efecto principal, p<0.05).

Tabla 2. Datos de los lípidos séricos durante el entrenamiento de la
fuerza y la suplementación con DHEA o PL. Los valores son presentados como
medias±EE; n, nro. de sujetos. Los sujetos realizaron entrenamiento de la fuerza
durante 8 semanas e ingirieron PL o DHEA (150 mg/día). HDL, lipoproteínas de
alta densidad, LDL, lipoproteínas de baja densidad; VLDL, lipoproteínas de muy
baja densidad; GTT, γ-glutamil tanspeptidasa; SOGT, glutamato-oxalacetato
transaminasa; SGPT, glutamato-piruvato transaminasa.
Química Clínica de la Sangre
El período de 8 semanas de entrenamiento no afectó las concentraciones séricas de colesterol total, HDL-C, LDL-C, y lipoproteínas de muy baja densidad, o de triacilglicéridos (Tabla 2). Las concentraciones séricas de las enzimas de la función hepática no fueron alteradas por el entrenamiento ni por la suplementación. El hierro total, el hematócrito y las concentraciones de Hb tampoco fueron significativamente alteradas por las 8 semanas de entrenamiento de la fuerza o por la suplementación.
Control Dietario
La ingesta dietaria total de energía (9547±179 vs. 9983±214 kJ/día), de carbohidratos (229±5 vs. 246±7 g/día) o de proteínas (89 ± 6 vs. 83 ± 5 g/día) no fueron diferentes entre los sujetos tratados con DHEA y aquellos tratados con PL antes de cada OGTT. La ingesta energética dietaria fue algo menor a la esperada, posiblemente debido a que los sujetos reportaron una menor cantidad de la que era real. Sin embargo, la comparación de las respuestas de la glucosa y de la insulina en los sujetos tratados con DHEA y aquellos tratados con PL es apropiada, ya que los sujetos reprodujeron sus dietas antes del segundo OGTT luego del entrenamiento. Además, los sujetos fueron instruidos para que mantengan sus regímenes normales a lo largo de todo el estudio, y todos indicaron que sus prácticas dietarias no cambiaron durante el curso del estudio.
Tolerancia a la Glucosa y Respuestas de la Insulina
Las 8 semanas de entrenamiento de la fuerza y suplementación no resultaron en alteraciones significativas en el área de incremento bajo la curva de glucosa (Figura 7) para los sujetos tratados con PL o tratados con DHEA. Las ocho semanas de entrenamiento de la fuerza y suplementación resultaron en una atenuación significativa en el área bajo la curva para la insulina, tanto en los sujetos tratados con PL como en los sujetos tratados con DHEA, lo cual fue independiente del tratamiento (efecto principal, p<0.05). Para proveer información acerca del efecto del entrenamiento y la suplementación sobre la sensibilidad a la insulina, se calculó el producto entre las áreas de incremento de las curvas de la glucosa y la insulina (índice IG). El índice IG (mM.min.pM.min.106) se redujo significativamente luego del entrenamiento (efecto principal, p<0.05) y no fue diferente entre los sujetos tratados con DHEA y aquellos tratados con PL antes (8.6±5.7 y 12.9±2.5 para los sujetos tratados con DHEA y aquellos tratados con PL, respectivamente) o después (10.3±2.8 y 11.9±5.4 para los sujetos tratados con DHEA y aquellos tratados con PL, respectivamente) del entrenamiento y la suplementación. Aunque el área incremental bajo la curva de la insulina y el índice IG antes del entrenamiento y la suplementación tendieron a ser mayores en los sujetos tratados con DHEA que en aquellos tratados con PL, esto fue resultado de un área incremental bajo la curva de la insulina extremadamente grande en uno de los sujetos (99.2 pM.min.103), ya que la diferencia de las medias entre los grupos no se acercó a la significación. La remoción de los datos de este sujetos de los análisis estadísticos no afecto los resultados, por lo tanto, estos datos están incluidos en la Figura 7.
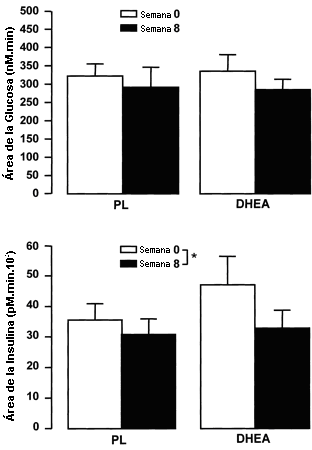
Figura 7. Área incremental sobre la línea de base y bajo las curvas de
las respuestas de la insulina y la glucosa durante los OGTT de 75 g, antes y
después del entrenamiento de la fuerza combinado con la administración de 150 g
de DHEA/día (n=9) o PL (n=10). Los suplementos fueron administrados durante las
semanas 1-2, 4-5, y 7-8. Los valores son presentados como medias±EE. *
Significativamente diferente con respecto al valor previo al entrenamiento de la
fuerza para ambos grupos (efecto principal significativo, p<0.05).
DISCUSION
La administración aguda de 50 mg de DHEA y la administración crónica de 150 mg de DHEA/día no incrementaron las concentraciones séricas de testosterona en hombres jóvenes. En mujeres se han observado incrementos en las concentraciones de testosterona luego de la administración de DHEA (21, 25, 27-29, 39) pero no en hombres normotestosterogénicos (21, 27, 28, 30, 39). Por ejemplo, Morales et al. (28) observaron un incremento del 203% en la concentración de testosterona sérica luego de la ingesta de 50 mg de DHEA en mujeres de mediana edad, mientras que la concentración sérica de testosterona no se vio afectada en los hombres. Además, dosis diarias de 1600 mg de DHEA no han incrementado las concentraciones séricas de testosterona en hombres jóvenes saludables (30). Tomados en conjunto con los presentes resultados, estos datos sugieren que la suplementación oral con DHEA puede incrementar las concentraciones séricas de testosterona solo en mujeres postmenopáusicas.
Se ha reportado que la ingesta diaria de 50 y 100 mg de DHEA por hombres ancianos provocó un incremento en las concentraciones séricas de androstenediona en un 20 y un 100%, respectivamente (27, 28). En el único artículo publicado sobre las respuestas de la androstenediona sérica a la suplementación con DHEA en hombres jóvenes, la ingesta de 1600 mg de DHEA/día provocó un incremento del 100% en las concentraciones séricas de androstenediona (30). Recientemente, nosotros hemos reportado un incremento del 100% en la androstenediona sérica en hombres jóvenes en respuesta a la ingesta diaria de 300 mg de androstenediona (20). Estos datos, conjuntamente con el incremento del 61% en la androstenediona sérica luego de la ingesta de 150 mg de DHEA/día en el presente estudio, indican que la ingesta de DHEA y androstenediona provocan incrementos en las concentraciones séricas de androstenediona sin un incremento en las concentraciones séricas de testosterona. Estos hallazgos son consistentes con los resultados de Horton y Tait (18), quienes mostraron que la androstenediona sanguínea no contribuye significativamente a la testosterona sanguínea en hombres.
No sabemos cual/es es/son el/los mecanismo/s responsable/s del incremento significativo en las concentraciones séricas de androstenediona, observado luego de la ingesta de DHEA en las semanas 2 y 5, pero no en la semana 8. Mortola y Yen (29) hallaron una patrón similar en la respuesta de la androstenediona sérica a la ingesta de 1600 mg de DHEA/día y especularon que la reducción en las concentraciones de androstenediona con la suplementación continua podría deberse a un incremento en la tasa de clearance metabólico o a una reducción en la entrada de DHEA a la circulación. Una tercera posibilidad para la reducción en la androstenediona sérica observada en la semana 8 puede ser la reducción en la actividad de la 3β-hidroxiesteroide deshidrogenasa, ya que se ha observado que la DHEA inhibe directamente la actividad de la 3β-hidroxiesteroide deshidrogenasa en muestras de placenta (37) y en microsomas adrenales (6).
Aunque la androstenediona sanguínea puede ser convertida en testosterona tanto en hombres como en mujeres, parece que la androstenediona sanguínea es un precursor de la testosterona cuantitativamente más importante para las mujeres, ya que solo el 1.8% de la androstenediona sanguínea es convertida a testosterona en hombres en comparación con el 60% en las mujeres (18). Investigaciones recientes llevadas a cabo en este laboratorio han hallado que, aunque la ingesta de androstenediona por hombres jóvenes no afecto las concentraciones séricas de testosterona, las concentraciones séricas de estrógenos se elevaron significativamente, indicando que una porción significativa de la androstenediona ingerida sufrió el proceso de aromatización (20). El hallazgo de que la suplementación con DHEA no afecta significativamente las concentraciones séricas de estrógenos, a pesar del incremento en las concentraciones séricas de androstenediona (presente estudio, 21, 28, 30, 39) es algo sorprendente y difícil de explicar. Es posible que la incrementada cantidad de androstenediona sérica luego de la ingesta de DHEA sea convertida en DHT por la 5α-reductasa y, subsecuentemente, a metabolitos de DHT. Sin embargo, se han observado incrementos en las concentraciones séricas de DHT luego de la ingesta de DHEA en mujeres, pero no en hombres (27-29, 39). Labrie et al. (21) hallaron que la administración percutánea de DHEA en hombres provocaba el incremento en las concentraciones de glucurónido de androsterona, glucurónido de androstano-3α,17β-diol, glucurónido de androstano-3β,17β-diol y sulfato de androsterona, pero no de DHT, sugiriendo que la administración de DHEA resulta solo en la formación de metabolitos esteroides inactivos.
La utilización de esteroides anabólicos o de testosterona exógena provoca la depresión de las concentraciones séricas de LH y FDH como resultado de una retroalimentación negativa del eje hipotalámico-pituitario-adrenal (5, 22). Los hallazgos del presente estudio son similares a los hallazgos de Mortola y Yen (29), demostrando que la ingesta de DHEA no afecta las concentraciones séricas de FSH o LH y sugiriendo que la regulación hipotalámica-pituitaria-adrenal de la producción de testosterona no es alterada por la ingesta de DHEA.
Los incrementos en la fuerza muscular hallados en el presente estudio demuestran la efectividad del protocolo para el entrenamiento de la fuerza utilizado. El hallazgo de un incremento en la fuerza sin diferencias entre los grupos de tratamiento en el presente estudio indica que la ingesta de DHEA no es efectiva para promover incrementos en la fuerza muscular durante un programa para el entrenamiento de la fuerza en hombres jóvenes. El presente hallazgo de que la suplementación con DHEA no tiene efectos sobre la fuerza muscular también indica que el incremento en la androstenediona sérica no incrementa las ganancias en la fuerza muscular, posiblemente debido a la debilidad de la androstenediona como esteroide androgénico anabólico (32).
Si bien la ingesta de DHEA puede tener un efecto protector contra la adiposidad en animales (10, 13, 14), el efecto de la DHEA sobre la composición corporal en humanos es equívoco (27-30, 38, 39). Morales et al. (27) hallaron que la ingesta de 100 mg de DHEA/día durante 6 meses produjo un incremento en la masa muscular y en la fuerza muscular en hombres ancianos que no realizaron entrenamientos de la fuerza. Nestler et al. (30) observaron que el consumo de 1600 mg de DHEA/día durante 28 días produjo una reducción de la grasa corporal y un incremento de la masa muscular en hombres jóvenes. En contraste, Welle et al. (38) observaron que la ingesta de 1600 mg de DHEA/día durante 4 semanas no alteró el metabolismo energético o el metabolismo proteico, el peso corporal o los dos índices de masa magra corporal (agua corporal total y potasio corporal total). En el presente estudio, la reducción en la grasa corporal y el incremento en la masa magra corporal observados con el entrenamiento de la fuerza no fueron afectados por la suplementación diaria con 150 mg de DHEA. Aunque todavía es desconocido el efecto de dosis mayores de DHEA sobre la composición corporal, estos datos indican que la ingesta de 150 mg de DHEA/día es insuficiente como para promover cambios en la composición corporal y en la fuerza más allá de aquellos cambios normales asociados con el entrenamiento de la fuerza en hombres jóvenes saludables.
La reducida respuesta de la insulina plasmática durante el OGTT, a pesar de la normal o la mejorada tolerancia a la glucosa luego del entrenamiento de la fuerza, indica que el programa de entrenamiento de la fuerza mejoró la acción de la insulina, y esto también ha sido previamente reportado (9, 26, 34). Aunque el/los mecanismo/s responsable/s para la mejorada acción de la insulina observada luego del entrenamiento de la fuerza continúan siendo desconocidos, es posible que sean importantes los cambios en el número de transportadores de glucosa y/o de translocación (17) y cambios en la señalización intracelular (15). En ratas, la DHEA no incrementa el contenido muscular de GLUT-4 (13), pero mejora la acción corporal total de la insulina incrementando las actividades de la fosfatidilinositol 3-quinasa (13) y de la proteína quinasa C (35). En contraste, la mejora en la acción corporal total de la insulina observada con el entrenamiento de la fuerza en el presente estudio no fue aumentada por la ingesta diaria de 150 mg de DHEA. Este hallazgo es consistente con reportes previos en donde la ingesta crónica de DHEA por humanos en dosis diarias de 50 mg (28) y 100 mg (27), no alteró la acción corporal total de la insulina. Además, es improbable que dosis diarias de DHEA mayores a las utilizadas en el presente estudio resulten en una mejora de la acción de la insulina, ya que estudios previos han mostrado que la administración de 1600 mg de DHEA/día no mejoran la acción de la insulina en hombres jóvenes (30) y pueden provocar una reducción en la sensibilidad a la insulina en mujeres postmenopáusicas (29). Aunque el hallazgo de que la acción de la insulina es mejorada por la administración de DHEA en ratas (13, 35), pero no en humanos (presente estudio, 27-30) es difícil de explicar, el déficit de la DHEA para aumentar la mejorada acción de la insulina observada con el entrenamiento de la fuerza en el presente estudio sugiere que cualquier efecto de la DHEA sobre la acción de la insulina en humanos puede estar oscurecido por la mejora en la acción de la insulina concomitante con el entrenamiento de la fuerza.
Se ha demostrado que la utilización de anabólicos esteroides provoca resistencia a la insulina (8, 11), y que la elevación de los niveles sanguíneos de testosterona está correlacionada con la reducción en la sensibilidad a la insulina (2). En la presente investigación se hallaron reducidos niveles de insulina plasmática durante el OGTT luego del entrenamiento de la fuerza en ambos grupos, a pesar de los incrementados niveles de androstenediona sérica con la suplementación con DHEA. Debido a que la androstenediona es una hormona androgénica más débil que la testosterona (32) es probable que la mejorada acción de la insulina fuese provocada por el entrenamiento de la fuerza más que por una compensación de cualquier efecto deletéreo de la androstenediona sobre la acción de la insulina.
Se ha mostrado que los esteroides anabólicos androgénicos reducen la concentración de HDL-C e incrementan las concentraciones séricas de LDL- C (19, 22, 23). Aunque al menos un estudio previo ha reportado que la DHEA provoca la reducción de la concentración de LDL-C (30), reportes más recientes (28, 38), como así también el presente estudio, sugieren que la DHEA no afecta las concentraciones séricas de LDL-C. El hallazgo de que la suplementación con DHEA no provoca cambios en las concentraciones séricas de HDL-C en el presente estudio, también coincide con reportes previos (28, 30, 38). Estos resultados sugieren que la suplementación con DHEA no altera significativamente el perfil lipídico sanguíneo.
Investigaciones previas acerca de la utilización de anabólicos esteroides han hallado una incrementada actividad de las transaminasas hepáticas (19, 23). Se ha reportado que los niveles plasmáticos de transaminasas en cerdos de guinea no son alterados por la administración exógena de DHEA-S (3). Los presentes hallazgos extienden estos resultados y demuestran que la ingesta de DHEA no afecta la actividad de las transaminasas hepáticas en hombres jóvenes.
En resumen, la suplementación oral con DHEA resultó en un incremento en la concentraciones séricas de androstenediona pero no afectó las concentraciones séricas de testosterona libre o testosterona total ni las concentraciones séricas de estrógenos. La suplementación con DHEA no mejoró los efectos producidos por el entrenamiento de la fuerza sobre la tolerancia a la glucosa, la sensibilidad a la insulina, la fuerza muscular o la composición corporal. Por último, la suplementación con DHEA durante el entrenamiento de la fuerza no afectó los perfiles lipídicos sanguíneos ni la función hepática en hombres jóvenes saludables.
Agradecimientos
Apreciamos la asistencia técnica de Emily Martini, Trina Radske y Vicki Strissel, sin quienes el proyecto no hubiese podido terminarse. También agradecemos al Dr. Murray Kaplan por la utilización del contador gamma en su laboratorio. También estamos extremadamente agradecidos a los Dres. Jerry Thomas y Kathy Thomas por su ayuda con los análisis estadísticos.
Notas al Pie
Esta investigación fue respaldada por Experimental and Applied Sciences.
Dirección para el pedido de reimpresiones y otra correspondencia
D. S. King, Dept. of Health and Human Performance, 248 Forker Bldg., Iowa State University, Ames, IA 50011 (correo electrónico: dsking@iastate.edu).
Referencias
1. American College of Sports Medicine (1995). Guidelines for Exercise Testing and Prescription (5th ed.). Media, PA: Williams & Wilkins, p. 53-81
2. Barrett-Connor, E (1992). Lower endogenous androgen levels and dyslipidemia in men with non-insulin-dependent diabetes mellitus. nn. Intern. Med. 117: 807-811
3. Bergheim, E., and G. W. Oertel (1976). Effects of exogenous dehydroepiandrosterone sulphate on various enzymes and on steroid metabolism in the guinea-pig. J. Endocrinol. 70: 11-17
4. Bergstrom, J (1967). Muscle electrolytes in man. Scand. J. Clin. Lab. Invest. Suppl. 17: 68-110
5. Bhasin, S., T. W. Storer, N. Berman, C. Callegari, B. Clevenger, J. Phillips, T. J. Bunnell, R. Tricker, A. Shirazi, and R. Casaburi (1996). The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men. N. Engl. J. Med. 335: 1-7
6. Byrne, G. C., Y. S. Perry, and J. S. Winter (1986). Steroid inhibitory effects upon human adrenal 3 -hydroxysteroid dehydrogenase activity. J. Clin. Endocrinol. Metab. 62: 413-418
7. Cleary, M. P., and J. F. Zisk (1986). Anti-obesity effect of two different levels of dehydroepiandrosterone in lean and obese middle-aged female Zucker rats. Int. J. Obes. 10: 193-204
8. Cohen, J. C., and R. Hickman (1987). Insulin resistance and diminished glucose tolerance in powerlifters ingesting anabolic steroids. J. Clin. Endocrinol. Metab. 64: 960-963
9. Craig, B. W., J. Everhart, and R. Brown (1989). The influence of high-resistance training on glucose tolerance in young and elderly subjects. Mech. Ageing Dev. 49: 147-157
10. Gansler, T. S., S. Muller, and M. P. Cleary (1985). Chronic administration of dehydroepiandrosterone reduces pancreatic -cell hyperplasia and hyperinsulinemia in genetically obese Zucker rats. Proc. Soc. Exp. Biol. Med. 180: 155-162
11. Godsland, I. F., N. M. Shennan, and V. Wynn (1986). Insulin action and dynamics modeled in patients taking the anabolic steroid methandienone (Dianabol). Clin. Sci. (Colch.) 71: 665-673
12. Goldman, H. I., and M. R. Becklake (1959). Respiratory function tests. Am. Rev. Tuber. Pulmon. Dis. 79: 457-467
13. Han, D. H., P. A. Hansen, M. M. Chen, and J. O. Holloszy (1998). DHEA treatment reduces fat accumulation and protects against insulin resistance in male rats. J. Gerontol. B Psychol. Sci. Soc. Sci. 53: B19-B24
14. Hansen, P. A., D. H. Han, L. A. Nolte, M. Chen, and J. O. Holloszy (1997). DHEA protects against visceral obesity and muscle insulin resistance in rats fed a high-fat diet. Am. J. Physiol. 273 (Regulatory Integrative Comp. Physiol. 42): R1704-R1708
15. Hayashi, T., S. D. Dufresne, D. Aronson, D. J. Sherwood, M. F. Hirshman, M. D. Boppart, R. A. Fielding, and L. J. Goodyear (1997). Intracellular signalling pathways in contracting skeletal muscle. In: Biochemistry of Exercise X, edited by M. Hargreaves, and M. Thompson. Champaign, IL: Human Kinetics, p. 19-34
16. Herranz, L., A. Megia, C. Grande, P. Gonzalez-Gancedo, and F. Pallardo (1995). Dehydroepiandrosterone sulphate, body fat distribution and insulin in obese men. Int. J. Obes. Relat. Metab. Disord. 19: 57-60
17. Holloszy, J. O., S. H. Constable, and D. A. Young (1986). Activation of glucose transport in muscle by exercise. Diabetes Metab. Rev. 1: 409-423
18. Horton, R., and J. F. Tait (1966). Androstenedione production and interconversion rates measured in peripheral blood and studies on the possible site of its conversion to testosterone. J. Clin. Invest. 45: 301-313
19. Kantor, M. A., A. Bianchini, D. Bernier, S. P. Saday, and P. D. Thompson (1985). Androgens reduce HDL2-cholesterol and increase hepatic triglyceride lipase activity. Med. Sci. Sports Exerc. 17: 462-465
20. King, D. S., R. L. Sharp, M. D. Vukovich, G. A. Brown, T. A. Reifenrath, N. L. Uhl, and K. A. Parsons (1999). Effect of oral androstenedione on serum testosterone and adaptations to resistance training in young men. JAMA 281: 2020-2028
21. Labrie, F., A. Belanger, L. Cusan, and B. Candas (1997). Physiological changes in dehydroepiandrosterone are not reflected by serum levels of active androgens and estrogens but of their metabolites: intracrinology. J. Clin. Endocrinol. Metab. 82: 2403-2409
22. Lamb, D. R (1984). Anabolic steroids in athletics: how well do they work and how dangerous are they?. Am. J. Sports Med. 12: 31-38
23. Lenders, J. W., P. N. Demacker, J. A. Vos, P. L. Jansen, A. J. Hoitsma, A. van't Laar, and T. Thien (1988). Deleterious effects of anabolic steroids on serum lipoproteins, blood pressure, and liver function in amateur bodybuilders. Int. J. Sports Med. 9: 19-23
24. Longcope, C (1996). Dehydroepiandrosterone metabolism. J. Endocrinol. 150, Suppl.: S125-S127
25. Mahesh, V. B., and R. B. Greenblatt (1962). The in vivo conversion of dehydroepiandrosterone and androstenedione to testosterone in the human. Acta Endocrinol. 41: 400-406
26. Miller, W. J., W. M. Sherman, and J. L. Ivy (1984). Effect of strength training on glucose tolerance and post-glucose insulin response. Med. Sci. Sports Exerc. 16: 539-543
27. Morales, A. J., R. H. Haubrich, J. Y. Hwang, H. Asakura, and S. S. C. Yen (1998). The effect of six months treatment with a 100 mg daily dose of dehydroepiandrosterone (DHEA) on circulating sex steroids, body composition and muscle strength in age-advanced men and women. Clin. Endocrinol. (Oxf.) 49: 421-432
28. Morales, A. J., J. J. Nolan, J. C. Nelson, and S. S. Yen (1994). Effects of a replacement dose of dehydroepiandrosterone in men and women of advancing age. J. Clin. Endocrinol. Metab. 78: 1360-1367
29. Mortola, J. F., and S. S. C. Yen (1990). The effects of oral dehydroepiandrosterone on endocrine-metabolic parameters in postmenopausal women. J. Clin. Endocrinol. Metab. 71: 696-703
30. Nestler, J. E., C. O. Barlascini, J. N. Clore, and W. G. Blackard (1988). Dehydroepiandrosterone reduces serum low density lipoprotein levels and body fat but does not alter insulin sensitivity in normal men. J. Clin. Endocrinol. Metab. 66: 57-61
31. Orentreich, N., J. L. Brind, R. L. Rizer, and J. H. Vogelman (1984). Age changes and sex differences in serum dehydroepiandrosterone sulfate concentrations throughout adulthood. J. Clin. Endocrinol. Metab. 59: 551-555
32. Savard, K., M. Gut, R. I. Dorfman, J. L. Gabrilove, and L. J. Soffer (1961). Formation of androgens by human arrhenoblastoma tissue in vitro. J. Clin. Endocrinol. Metab. 21: 165-173
33. Siri, W. E (1961). Body composition from fluid spaces and density. In: Techniques for Measuring Body Composition, edited by J. Brozek, and R. A. Henschel. Washington, DC: Natl. Acad. Sci., p. 223-244
34. Smutok, M. A., C. Reece, P. F. Kokkinos, C. M. Farmer, P. K. Dawson, J. DeVane, J. Patterson, A. P. Goldberg, and B. F. Hurley (1994). Effects of exercise training modality on glucose tolerance in men with abnormal glucose regulation. Int. J. Sports Med. 15: 283-289
35. Tatsuo, I., K. Kajita, A. Miura, M. Ishizawa, Y. Kanoh, S. Itaya, M. Kimura, N. Muto, T. Mune, H. Morita, and K. Yasuda (1999). DHEA improves glucose uptake via activations of protein kinase C and phosphatidylinositol 3-kinase. Am. J. Physiol. 276 (Endocrinol. Metab. 39): E196-E204
36. Tesch, P. A (1988). Skeletal muscle adaptations consequent to long-term heavy resistance exercise. Med. Sci. Sports Exerc. 20: S132-S134
37. Watanabe, H., K. Hirato, M. Hashino, T. Kosaki, T. Kimura, T. Nakayama, and T. Yanaihara (1990). Effects of DHA-S on placental 3 -hydroxysteroid dehydrogenase activity, progesterone, and 20 -dihydroprogesterone concentrations in placenta and serum. Endocrinol. Jpn. 37: 69-77
38. Welle, S., R. Jozefowicz, and M. Statt (1990). Failure of dehydroepiandrosterone to influence energy and protein metabolism in humans. J. Clin. Endocrinol. Metab. 71: 1259-1264
39. Yen, S. S., A. J. Morales, and O. Khorram (1995). Replacement of DHEA in aging men and women. Potential remedial effect. Ann. NY Acad. Sci. 774: 128-142