Efectos del Ejercicio por Intervalos de Alta Intensidad Sobre la Función Cerebrovascular: Una Revisión Sistemática
Effects of High Intensity Interval Exercise on Cerebrovascular Function: A Systematic Review
Alicen A. Whitaker1, Mohammed Alwatban1, Andrea Freemyer1, Jaime Perales-Puchalt2,3 y Sandra A. Billinger1,3,4
1Department of Physical Therapy and Rehabilitation Science, University of Kansas Medical Center, Kansas City, KS, United States of America
2University of Kansas Alzheimer’s Disease Center, Fairway, KS, United States of America
3Department of Neurology, University of Kansas Medical Center, Kansas City, KS, United States of America
4Department of Physical Medicine and Rehabilitation, University of Kansas Medical Center, Kansas City, KS, United States of America
Artículo publicado en el journal Revista de Educación Física, Volumen 4, Número 160 del año 2020.
Publicado 5 de noviembre de 2020
Resumen
Palabras clave: ejercicio intervalos, alta intensidad, efectos cerebro vasculares
Abstract
Keywords: interval exercise, high intensity, cerebrovascular effects
Disponibilidad de datos: todos los datos relevantes están dentro del artículo y en sus archivos de información de respaldo.
Financiamiento: El espacio de laboratorio de Georgia Holland Research in Exercise and Cardiovascular Health (REACH) fue financiado por el Georgia Holland Endowment Fund. Los patrocinadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Conflictos de intereses: los autores han declarado que no existen conflictos de intereses.
INTRODUCCIÓN
El ejercicio por intervalos de alta intensidad (HIIE) ha surgido a la vanguardia de los regímenes de ejercicio debido al menor tiempo de actividad necesario para lograr beneficios [1-3]. El HIIE confiere un aumento del fitness aeróbico similar o significativo en comparación con el ejercicio continuo convencional de intensidad moderada [1,4-7]. Si bien el fitness aeróbico es una medida del aumento de la salud cardiovascular, todo el sistema vascular (incluido el sistema vascular cerebral) puede mejorarse tras un mayor fitness aeróbico [8]. Con el envejecimiento, un mayor fitness aeróbico se asocia con un menor riesgo de accidente cerebrovascular y demencia [9,10]. Una revisión y meta-análisis del HIIE en adultos sanos ha mostrado aumentos significativos en el fitness aeróbico [1,5,6,11]. La evidencia preliminar también ha demostrado que el HIIE puede mejorar la función cognitiva [12]. Sin embargo, los efectos del HIIE sobre la función cerebrovascular no se han revisado sistemáticamente.
La función cerebrovascular es la capacidad de los vasos sanguíneos cerebrales para suministrar oxígeno y nutrientes para el metabolismo neuronal y mantener el flujo sanguíneo cerebral a través de la autorregulación dinámica (dCA). La dCA es la capacidad del cerebro para mantener un flujo sanguíneo cerebral constante a pesar de las grandes fluctuaciones en la presión arterial periférica [13,14]. Durante las condiciones de reposo, el flujo sanguíneo cerebral responde a las fluctuaciones de la presión arterial, el metabolismo neuronal, la activación cortical, los gases arteriales sanguíneos y el gasto cardíaco [15]. El flujo sanguíneo cerebral se puede medir en reposo mediante resonancia magnética o ecografía Doppler transcraneal (TCD). La velocidad sanguínea de la arteria cerebral media (MCAv) medida por TCD es la única técnica para medir el flujo sanguíneo cerebral durante el ejercicio, con alta resolución temporal [16]. La MCAv está relacionada linealmente con el flujo sanguíneo cerebral con la salvedad de que el diámetro de la MCA permanece sin cambios [17].
Una respuesta cerebrovascular normal al ejercicio continuo moderado submáximo da como resultado un aumento de la MCAv [18-20], un aumento de la oxigenación cerebral [21,22] y una dCA sostenida [23,24]. Se ha demostrado que la MCAv aumenta concomitantemente a medida que aumenta la intensidad del ejercicio, hasta una intensidad moderada [15,18,25-28]. La MCAv se ve afectada de manera diferente durante el ejercicio de alta intensidad. Durante el ejercicio continuo de alta intensidad e hiperventilación, la MCAv disminuye debido a una reducción del dióxido de carbono (CO2) arterial [29,30], lo que provoca la constricción de las arteriolas descendientes [15,31]. La reactividad cerebrovascular es la capacidad de los pequeños vasos del cerebro para provocar vasodilatación y vasoconstricción en respuesta a los niveles fluctuantes de CO2 [32,33]. La respuesta cerebrovascular al HIIE puede diferir del ejercicio continuo de alta intensidad debido a los episodios repetitivos de los intervalos cortos que aumentan rápidamente la presión arterial, lo que puede causar hiperperfusión cerebrovascular [34,35]. Si los mecanismos neuroprotectores del cerebro, como la dCA, no responden rápidamente a los aumentos repetitivos y rápidos de la presión arterial, el HIIE podría elevar el riesgo de fuga dentro de la barrera hematoencefálica [34,36]. Para las poblaciones clínicas con deterioro cerebrovascular, como el accidente cerebrovascular [37-39], la respuesta cerebrovascular al HIIE puede desempeñar un papel importante en la orientación de la prescripción del ejercicio [36].
Los posicionamientos científicos anteriores y las revisiones narrativas han relatado los procesos moleculares, hemodinámicos y estructurales (es decir, CO2, óxido nítrico, presión arterial sistémica, distensibilidad de los vasos, integridad de las células gliales) asociados con la respuesta cerebrovascular que puede ocurrir durante el HIIE [36,40]. Sin embargo, estas revisiones narrativas detalladas [41,42] no informaron los hallazgos estadísticos de estudios previos que mostraban la función cerebrovascular durante el HIIE. Hasta donde sabemos, nuestra revisión sistemática actual es la primera en buscar e informar sistemáticamente los resultados de la respuesta cerebrovascular dinámica durante el HIIE. Informar la respuesta cerebrovascular durante el EHII es importante porque proporciona resultados objetivos para respaldar las declaraciones narrativas descritas anteriormente sobre los procesos hemodinámicos durante el HIIE [41,42]. El propósito de esta revisión sistemática fue abordar la brecha en el conocimiento e informar los diversos resultados de estudios de HIIE sobre la función cerebrovascular en comparación con el ejercicio continuo moderado o condiciones de reposo. Examinamos sistemáticamente los resultados de los estudios del HIIE en individuos sanos basados en la operacionalización de los resultados cerebrovasculares.
Métodos
Esta revisión sigue las directrices para los elementos de notificación preferidos para las revisiones sistemáticas [43]. Se realizaron búsquedas y revisiones bibliográficas utilizando PubMed y las bases de datos Cumulative Index to Nursing and Allied Health Literature (CINAHL). Se utilizó el sistema de biblioteca en línea del Centro Médico de la Universidad de Kansas para acceder a estas bases de datos en febrero, marzo y junio de 2020. En esta revisión sistemática, incluimos manuscritos revisados por pares escritos en inglés desde enero de 2010 hasta junio de 2020.
Las palabras clave utilizadas para buscar en las bases de datos incluyeron "entrenamiento por intervalos de alta intensidad", "HIIT", "ejercicio por intervalos de alta intensidad", "HIIE" Y "flujo sanguíneo cerebral", "velocidad sanguínea cerebral", "autorregulación dinámica". Creemos que estas palabras clave reflejan principalmente la intervención del intervalo de alta intensidad y las medidas de la función cerebrovascular. Los principales resultados de esta revisión sistemática fueron la MCAv, una medida indirecta del flujo sanguíneo cerebral, y la dCA, una medida de la homeostasis cerebrovascular durante los cambios de la presión arterial periférica [30,44-48]. La MCAv suministra oxígeno y nutrientes a las neuronas, mientras que la dCA mantiene una perfusión estable [49]. Sin embargo, también se incluyeron medidas cerebrovasculares adicionales, como la hemoglobina oxigenada [50-52], la reactividad cerebrovascular [46,53], el índice de conductancia cerebrovascular y el índice de resistencia cerebrovascular [45,54]. La hemoglobina oxigenada es una medida importante del metabolismo aeróbico dentro del tejido cerebral mediante espectrometría de infrarrojo cercano [55]. La reactividad cerebrovascular es una medida de la regulación cerebrovascular [56] y muestra la capacidad de los vasos de vasodilatarse o vasocontraerse ante un estímulo [57].
El índice de conductancia cerebrovascular es una medida de la conductancia de la presión sanguínea periférica a la velocidad sanguínea cerebral y se calcula como la MCAv/presión arterial MCA (PAM) [45]. El índice de resistencia cerebrovascular (MAP/MCAv) mide la resistencia de la presión de perfusión cerebral a la velocidad de la sangre cerebral [45].
Los resúmenes identificados de PubMed y CINAHL se examinaron utilizando los siguientes criterios de inclusión: 1) experimental o cuasi-experimental, 2) ejercicio aeróbico identificado como el medio principal para realizar el HIIE, 3) las medidas cerebrovasculares fueron resultados primarios o secundarios y 4) sujetos humanos a lo largo de la vida sin ninguna enfermedad actual. Después de eliminar los duplicados, dos investigadores seleccionaron títulos/resúmenes para los criterios de inclusión (A.W. y M.A.). Se examinaron los textos completos y se extrajeron los datos (A.W. y M.A.). Si los autores no podían llegar a un acuerdo, un tercer autor moderó la incongruencia (A.F.).
Se realizó una revisión de la calidad de cada artículo utilizando la versión modificada de los criterios de Sackett de 1981 [58]. Analizamos críticamente el diseño del estudio de cada artículo, la población, los protocolos HIIE, los resultados y los resultados cerebrovasculares. Si un artículo no proporcionaba suficiente información para determinar criterios de calidad suficientes, se le daba una calificación de “No”. Los artículos se clasificaron según el nivel de evidencia, incluyendo el nivel I para los grandes ensayos controlados aleatorios, el nivel II para los ensayos aleatorios pequeños, el nivel III para el diseño no aleatorio, el nivel IV para las series de casos y el nivel V para los informes de casos [59].
Resultados
Los métodos de búsqueda dieron como resultado 67 artículos. Después de eliminar los duplicados, se identificaron 15 [45,46,50,53,60-69] artículos en PubMed y 5 [47,51,70-72] artículos nuevos en CINAHL. Durante la selección inicial de títulos/resúmenes, se excluyeron 11 artículos debido a que el HIIE no era el protocolo experimental primario realizado (n = 6), estudios que no midieron arterias cerebrales (n = 4) y un estudio en animales (n = 1). Los estudios que combinaron otras intervenciones con el HIIE fueron excluidos debido a las variables de confusión que podrían afectar los resultados cerebrovasculares (ver Tabla S1). Después de la evaluación del texto completo, se excluyeron dos artículos por no cumplir con los criterios experimentales o cuasi experimentales (n = 2). Consulte la figura 1 para ver el diagrama de flujo de la selección de los artículos.
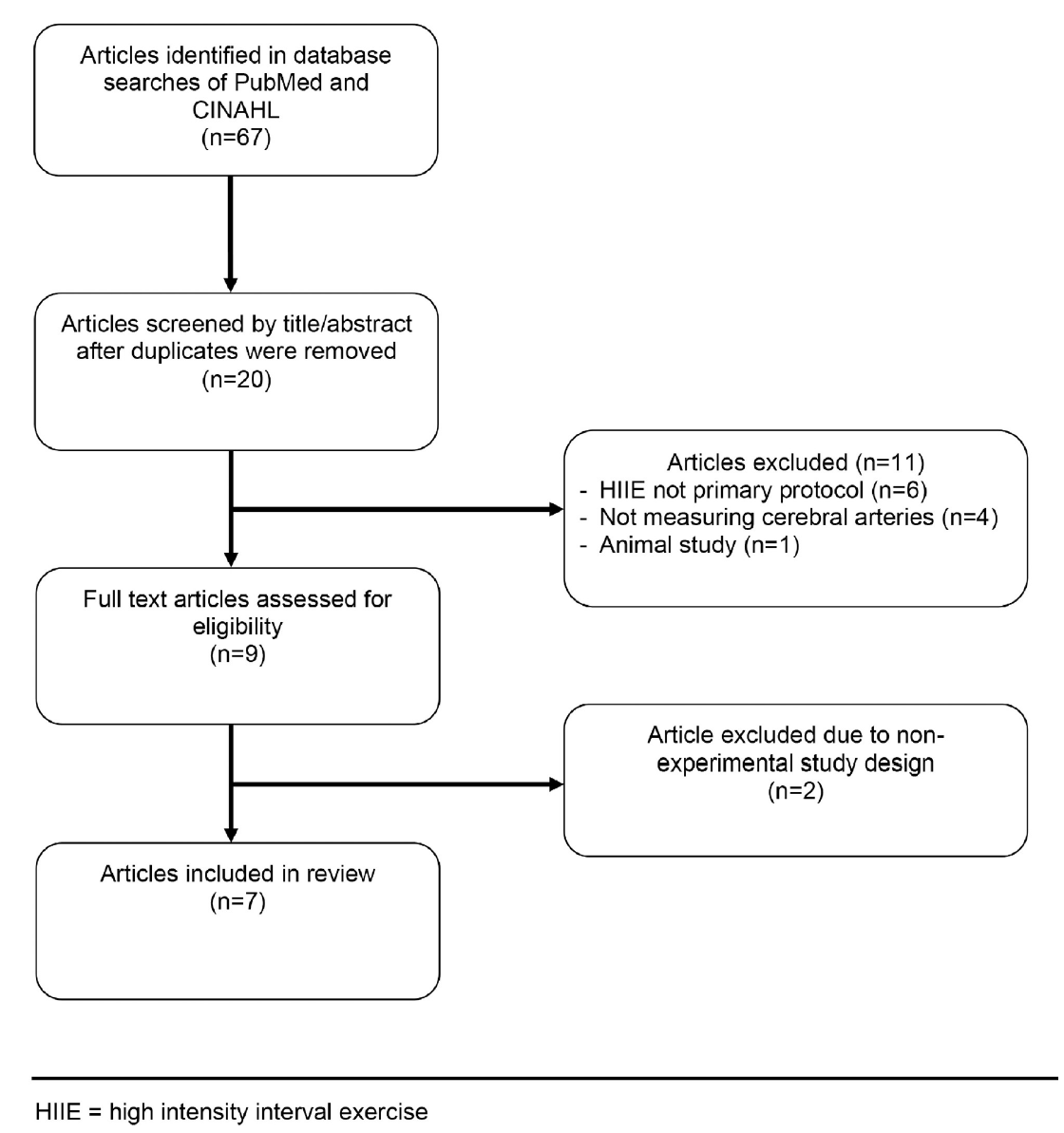
Figura 1. Diagrama de flujo de la selección de artículos.
https://doi.org/10.1371/journal.pone.0241248.g001
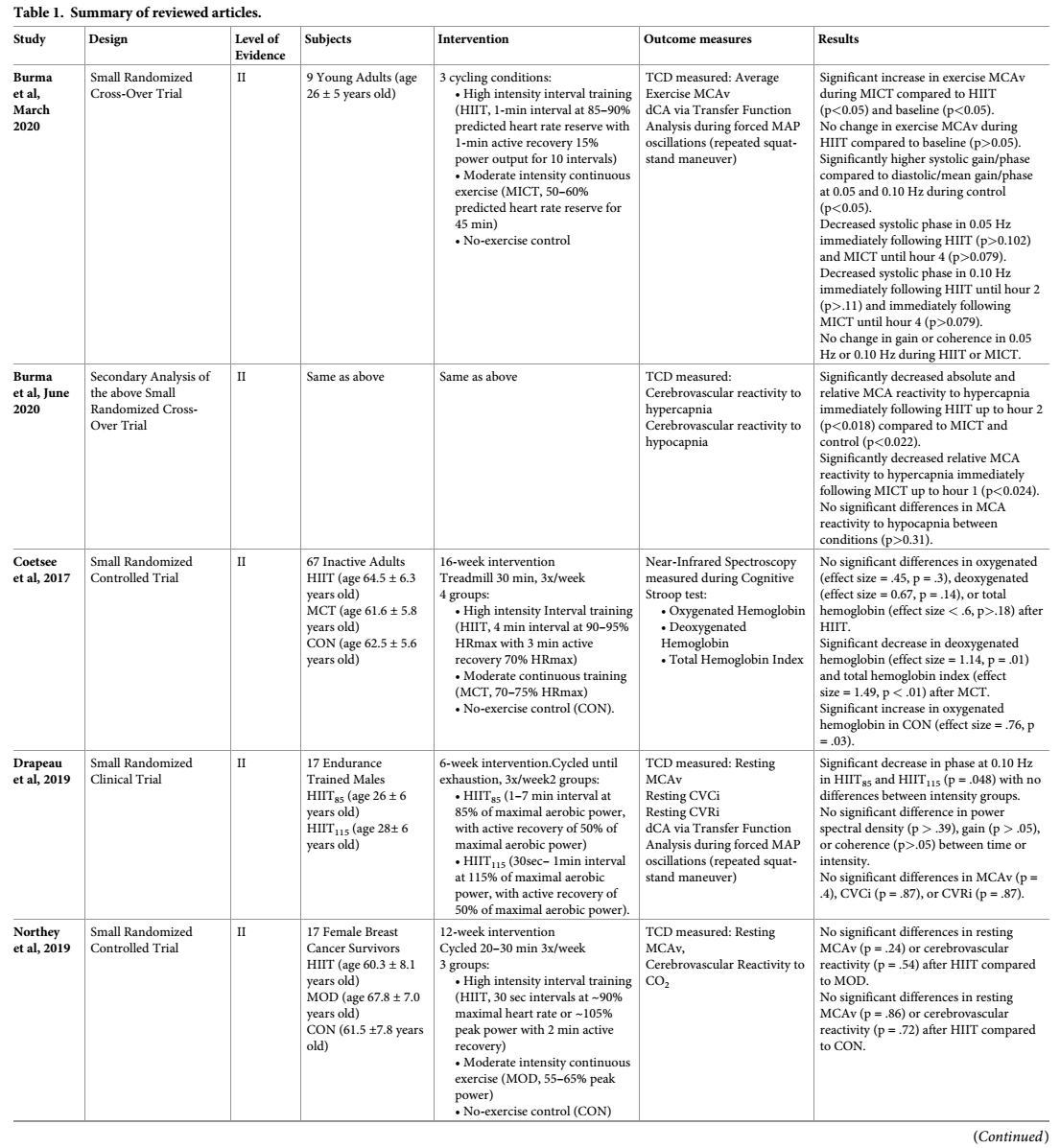
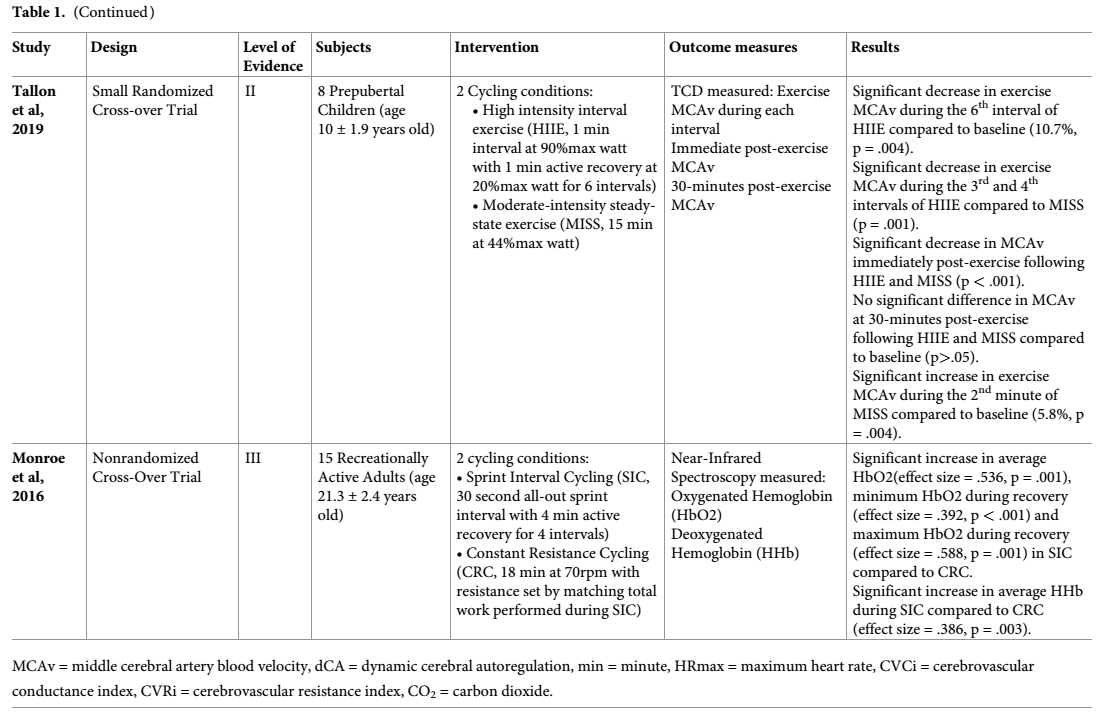
Se incluyeron siete artículos que describen los resultados cerebrovasculares después de un HIIE dentro de esta revisión [44-47,50,51,53]. Los textos completos se describen en la Tabla 1. De los artículos revisados, seis eran pequeños ensayos aleatorizados y un ensayo cruzado no aleatorizado. Todos los estudios incluyeron individuos sanos, aunque algunos estudios sólo incluyeron hombres (n = 1) [45], mujeres (n = 1) [46] o niños (n = 1) [47]. Los niveles de actividad previa de los participantes iban desde inactivos [50], recreacionalmente activos [51] y entrenados en resistencia [45].
Tabla 1. Resumen de artículos revisados.
https://doi.org/10.1371/journal.pone.0241248.t001
Protocolos de intervalos de alta intensidad
Los métodos para prescribir HIIE variaban enormemente y dificultaron las comparaciones entre los estudios. Los protocolos de HIIE incluyeron intervenciones de ejercicio de 6 a 16 semanas (n = 3) [45,46,50] o una sola sesión de ejercicio (n = 4) [44,47,51,53]. Al examinar de 6 a 16 semanas de HIIE, se estudiaron los efectos crónicos o a largo plazo de esta intervención. Al examinar un sólo turno de HIIE, se informaban los efectos inmediatos o agudos del ejercicio. Además de la variabilidad de la duración, se encontró que el modo del HIIE también difirió entre los estudios incluidos. Un estudio utilizó una cinta de correr como modalidad de ejercicio con intervalos de 4 minutos de frecuencia cardíaca máxima del 90-95% durante 30 minutos [50]. Los seis estudios restantes utilizaron el ciclismo como modalidad de ejercicio, pero difirieron en parámetros que iban desde 30 segundos [46,51] a intervalos de 7 minutos [45] del 85% al 115% de los vatios máximos [45,47,51] u ~85% al 90% de la frecuencia cardíaca máxima [44,46,50,53]. Una constante entre todos los estudios incluyó un intervalo de recuperación activo (en lugar de pasivo) entre los sprints. Sin embargo, la intensidad y la duración de los intervalos de recuperación difieren mucho.
Medidas de índices cerebrovasculares
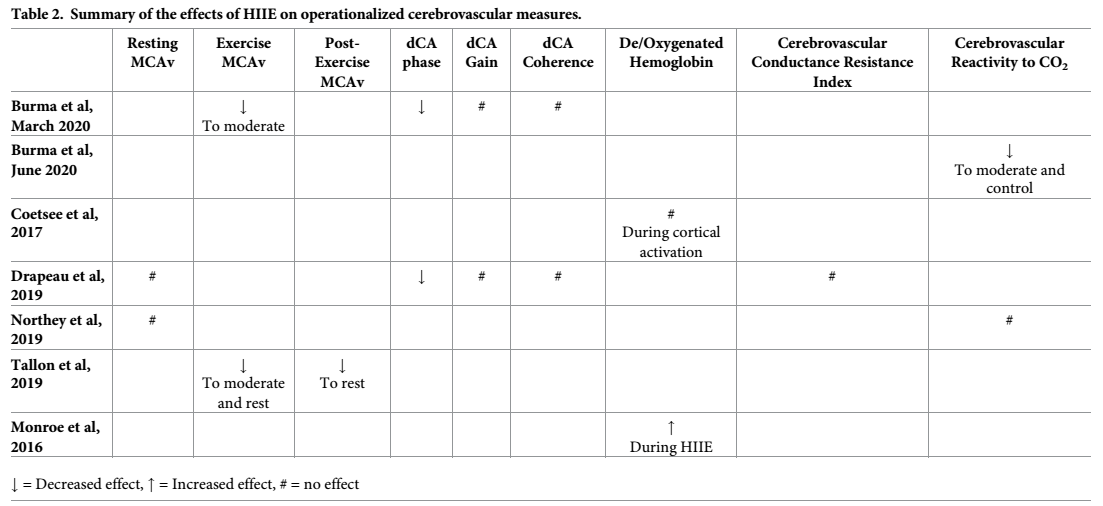
Los resultados de esta revisión pueden ser operacionalizados en función de las variables de medidas de los resultados durante el HIIE, como la MCAv (n = 4) [44-47], la dCA (n = 2) [44,45], la hemoglobina cerebral desoxigenada (n = 2) [50,51], la reactividad cerebrovascular al CO2 (n = 2) [46,53] y el índice de conductancia/resistencia cerebrovascular (n = 1) [45]. La Tabla 2 describe si el HIIE aumentó, disminuyó o no tuvo influencia sobre las medidas cerebrovasculares operacionales. No se realizó un meta-análisis debido al bajo número de estudios (≤2) que informaron cada medida cerebrovascular operacionalizada.
Tabla 2. Resumen de los efectos del HIIE sobre medidas cerebrovasculares operacionales.
https://doi.org/10.1371/journal.pone.0241248.t002
MCAv.
De los estudios que informaron resultados de la MCAv, se utilizaron MCAv en reposo (n = 2) [45,46], MCAv de ejercicio (n = 2) [44,47] y MCAv inmediatamente después del ejercicio (n = 1) [47]. No se encontraron diferencias significativas para la MCAv en reposo después de 6 o 12 semanas de HIIE en comparación con el ejercicio continuo moderado o el control [45,46]. Durante un turno agudo de HIIE, la MCAv del ejercicio se redujo significativamente en comparación con el ejercicio continuo moderado [44,47]. Se encontraron resultados contradictorios entre dos estudios que compararon la MCAv de ejercicio con el reposo. Burma y cols. [44] no informaron diferencias significativas entre la MCAv promedio de ejercicio y el descanso en adultos. Sin embargo, en lugar de informar la MCAv de ejercicio promedio de todo el turno de HIIE, Tallon y cols. [47] informaron una MCAv de ejercicio para cada intervalo de sprint de 1 minuto de HIIE. Durante el sexto intervalo de sprint de HIIE, Tallon y cols. [47] informaron una disminución significativa de la MCAv del ejercicio en comparación con el reposo que permaneció inmediatamente después del ejercicio [47].
dCA.
El análisis de la función de transferencia de la dCA se informó en las bandas de muy baja y baja frecuencia (n = 2) [44,45]. Drapeau y cols. [45] realizaron una intervención de 6 semanas de HIIE y reportaron una disminución significativa en la fase en comparación con el descanso sin cambios significativos en la coherencia o ganancia. Burma y cols. [44] realizó un sólo turno de HIIE e informó una disminución de la fase sistólica de la MCAv inmediatamente después del ejercicio que se extendió hasta cuatro horas después.
Hemoglobina des/oxigenada.
Se notificaron hemoglobina oxigenada y desoxigenada durante un sólo turno de HIIE (n = 1) [51] y durante una intervención de HIIE de 16 semanas (n = 1) [50]. Monroe y cols. [51] realizaron una sola sesión de HIIE e informaron un aumento en la hemoglobina oxigenada y desoxigenada durante un HIIE en comparación con el ejercicio continuo moderado. Coetsee y cols. [50] realizaron una intervención de 16 semanas de HIIE y no informaron cambios significativos duraderos en la hemoglobina oxigenada o desoxigenada durante la activación cortical.
Reactividad cerebrovascular.
Se notificó reactividad cerebrovascular al CO2 durante un único turno de HIIE (n = 1) [53] y durante una intervención de EHII de 12 semanas (n = 1) [46]. Después de un único turno de HIIE, la reactividad cerebrovascular al CO2 más alto, o una hipercapnia, se redujo significativamente en un 37% y se mantuvo una hora más tarde [53]. La reducida reactividad cerebrovascular a la hipercapnia también fue significativamente diferente de la intensidad moderada y el control. La reactividad cerebrovascular para reducir el CO2, o la hipocapnia, no fue significativamente diferente después de un sólo turno de HIIE [53]. La reactividad cerebrovascular al CO2 tampoco fue significativamente diferente después de 12 semanas de HIIE [46].
Conductancia y resistencia cerebrovascular.
El índice de conductancia cerebrovascular y el índice de resistencia cerebrovascular sólo se informaron en un único estudio [45]. Una intervención de HIIE de 6 semanas no informó cambios significativos en el índice de conductancia cerebrovascular o en el índice de resistencia cerebrovascular [45].
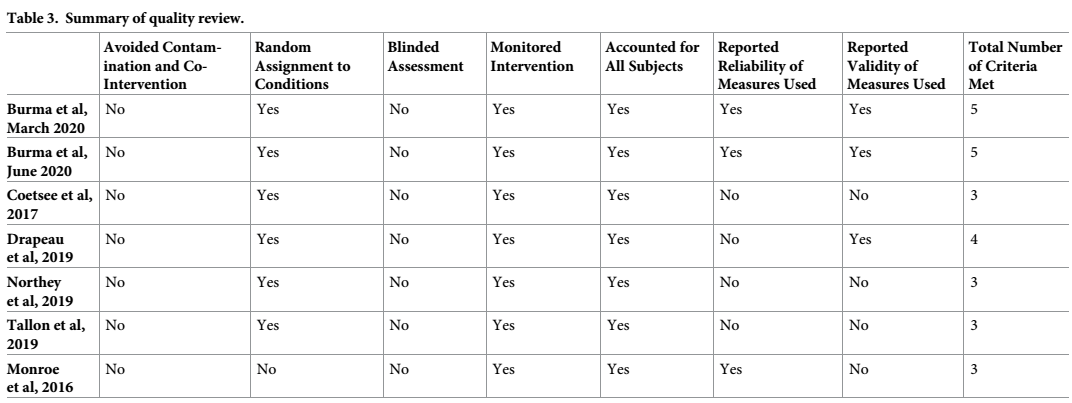
Revisión de calidad
La revisión de la calidad de cada estudio se presenta en la Tabla 3. De siete criterios de calidad totales, 2 estudios informaron cinco criterios de calidad [44,53], un estudio informó cuatro criterios de calidad [45] y los cuatro estudios restantes informaron tres criterios de calidad [46,47,50,51]. Por lo tanto, los resultados generales de los criterios de calidad fueron moderadamente malos. Todos los estudios tuvieron en cuenta los sujetos y controlaron los parámetros del protocolo HIIE. Ningún estudio informó la evitación de la contaminación o la cointervención. Ningún estudio informó el cegamiento de las evaluaciones de resultado. Sólo Burma y cols. [44,53] y Monroe y cols. [51] reportaron su confiabilidad a través del coeficiente de reproducibilidad y coeficientes de intraclase en sus medidas. Y sólo Burma y cols. [44,53] y Drapeau y cols. [45] informaron la validez de sus respectivos resultados cerebrovasculares.
Tabla 3. Resumen de la revisión de calidad.
https://doi.org/10.1371/journal.pone.0241248.t003
Discusión
Esta revisión cumplió el objetivo de informar los resultados de varios estudios de HIIE y los efectos sobre la función cerebrovascular operacionalizada en individuos sanos. Esta revisión es la primera en informar los efectos del HIIE sobre la función cerebrovascular en comparación con el ejercicio continuo moderado y el reposo en individuos sanos. En general, encontramos que los efectos agudos y crónicos del HIIE sobre la función cerebrovascular varían en gran medida según los métodos y resultados medidos.
MCAv
En estos estudios, las intervenciones de HIIE de 6 a 12 semanas no tuvieron ningún efecto sobre la MCAv en reposo en individuos sanos. Ningún cambio significativo en la MCAv en reposo puede deberse a que la duración de la intervención de HIIE sea demasiado corta. También se puede observar un efecto 'techo' para individuos jóvenes y sanos y podría explicar que no haya cambios en la MCAv en reposo [19]. Durante un sólo turno de HIIE, la hiperventilación y la vasoconstricción de las arteriolas descendentes pueden explicar las disminuciones agudas en la MCAv de ejercicio en comparación con el ejercicio continuo moderado [15,31,73,74]. La vasoconstricción puede desempeñar un papel protector durante el EHII debido al aumento de la presión sanguínea periférica que puede causar una hiperperfusión [75] o daño a la barrera hematoencefálica [36]. Durante un sólo turno de HIIE, hay evidencia contradictoria que compara la MCAv de ejercicio con la de reposo. Un estudio no informó cambios en la MCAv promedio de ejercicio en comparación con el reposo [44]. Otro estudio informó una disminución de la MCAv de ejercicio después de seis intervalos de sprint de HIIE y permaneció disminuida en comparación con el reposo inmediatamente después del HIIE [47]. Las diferencias informadas en la MCAv de ejercicio en comparación con la de reposo podrían deberse a la edad [19] (adultos vs niños prepúberes) o al análisis de la MCAv durante el HIIE (promedio de todo el ejercicio vs intervalos de sprint separados). Las disminuciones en la MCAv de ejercicio en comparación con la de reposo pueden ocurrir sólo en los últimos intervalos del HIIE, durante la hiperventilación [76]. Por lo tanto, la MCAv de ejercicio debe informarse para cada intervalo de HIIE en lugar de un promedio de toda la sesión de ejercicio.
dCA
Después de una intervención de 6 semanas y un sólo turno de HIIE, la fase dCA disminuyó en comparación con el reposo. Los efectos crónicos del HIIE sobre la fase dCA pueden deberse a un elevado fitness cardiorrespiratorio en individuos entrenados en resistencia que se asocian con una dCA atenuada [45,48]. En individuos sanos, el aumento de la frecuencia dentro de las formas de onda de la MCAv y de la MAP (que puede ocurrir con el HIIE) puede causar una reducción en la fase debido a que la dCA es un filtro de alto paso [77,78]. Burma y cols. [44] también sugieren que la fase sistólica puede revelar mayores cambios en la dCA como tanto la fase diastólica como la media.
Después de un sólo turno de HIIE, la reducción de la fase sistólica se extendió hasta 4 horas y, por lo tanto, el enfoque común de abstenerse de ejercicio 12 horas antes de los estudios de investigación [79-81] puede ser demasiado conservador [44].
Aunque no se incluye en esta revisión debido al diseño del estudio observacional, se ha informado de pruebas contradictorias de la dCA sostenida durante el HIIE [63]. Las diferencias en los parámetros de ejercicio entre el HIIE pueden ser la causa de resultados contradictorios debido al ejercicio exhaustivo que muestra una disminución de la dCA [34,82]. Se necesitan más estudios para confirmar las disminuciones agudas y crónicas de la dCA después del HIIE.
Hemoglobina des/oxigenada
Después de una intervención de HIIE de 16 semanas, la hemoglobina oxigenada y desoxigenada durante la activación cortical no cambió [50]. Sin embargo, la intervención de HIIE de 16 semanas disminuyó el tiempo de reacción durante la activación cortical y, por lo tanto, puede aumentar la eficiencia del uso de oxígeno cortical [50]. Durante una sesión única de HIIE, la hemoglobina oxigenada y desoxigenada aumentó en comparación con el ejercicio continuo moderado [51]. Como sugirieron Coetsee y cols., el aumento de la hemoglobina oxigenada durante la activación neuronal puede sugerir la participación de regiones adicionales del cerebro [50]; mientras que la hemoglobina oxigenada disminuida puede indicar una actividad neuronal reducida debido a la eficiencia en la tarea [50]. Los efectos agudos y crónicos del HIIE sobre la hemoglobina oxigenada y desoxigenada aún necesitan más investigación debido a que cada uno sólo se informó en un único estudio.
Reactividad cerebrovascular
Una intervención de HIIE de 12 semanas no cambió significativamente la reactividad cerebrovascular, lo que podría deberse a la desensibilización vascular por exposición crónica al CO2 durante el HIIE [36,83]. Después de un sólo turno de HIIE, la reactividad cerebrovascular a la hipercapnia se redujo, lo que muestra la incapacidad del sistema cerebrovascular para vasodilatar al máximo. La capacidad máxima de vasodilatación después de un HIIE puede reducirse después del HIIE debido a la vasoconstricción cerebrovascular prolongada que se produce con hiperventilación durante el propio HIIE [36,53]. La reactividad cerebrovascular a la hipocapnia no se modificó después de un sólo turno de HIIE debido a la capacidad de los vasos de vasocontraerse, permaneciendo intactos [53]. La reducción de la reactividad cerebrovascular al CO2 más alto permanece una hora después del HIIE. Por lo tanto, los autores concluyen nuevamente que el enfoque común de abstenerse de hacer ejercicio 12 horas antes de los estudios de investigación [54,80,84] puede ser demasiado conservador [53].
Conductancia y resistencia cerebrovascular
La conductancia y la resistencia cerebrovasculares no se modificaron significativamente después de una intervención de HIIE de 6 semanas. Mientras que una intervención de HIIE de 6 semanas mejoró significativamente la conductancia y la resistencia arterial periférica [4], este cambio en las arterias periféricas puede no demostrarse en la conductancia o resistencia arterial cerebrovascular [41,45]. Sin embargo, debido a que la conductancia cerebrovascular o el índice de resistencia se informa en un sólo estudio, no se pueden determinar efectos concluyentes del HIIE.
Futura investigación
Recomendamos que las investigaciones futuras sobre los efectos del HIIE sobre la función cerebrovascular deben incluir: 1) examinar la respuesta cerebrovascular durante el HIIE antes y después de una intervención de HIIE, 2) analizar los resultados cerebrovasculares durante cada intervalo separado de HIIE en lugar de un promedio de todo el turno , 3) medir simultáneamente la MCAv, la presión arterial, la frecuencia cardíaca y el CO2 durante el HIIE, 4) medir los resultados cerebrovasculares durante el HIIE, inmediatamente después del HIIE y en un seguimiento de 30 minutos a 4 horas después del ejercicio.
Limitaciones
Los autores reconocen el riesgo de sesgo de publicación al incluir sólo artículos revisados por pares escritos en inglés y no incluyeron literatura 'gris'. Las medidas de función cerebrovascular incluidas en esta revisión varían mucho y tienen una gran heterogeneidad. La calidad general de los estudios es moderadamente mala debido a la falta de evitación de contaminación, al no cegar la evaluación y al escaso informe de la confiabilidad y la validez de los resultados medidos. Estos estudios informan los efectos del HIIE sobre la función cerebrovascular en individuos jóvenes sanos, lo que limita la generalización y no se puede traducir a poblaciones clínicas con función cerebrovascular alterada al inicio del estudio, como el accidente cerebrovascular [37,39,85,86].
Si bien el HIIE no es un modo nuevo de ejercicio, estudiar las medidas cerebrovasculares durante el HIIE es novedoso. Existen limitaciones potenciales para el uso de TCD durante el HIIE y la MCAv puede subestimarse [87]. La oxigenación cerebral también puede subestimarse debido a que el espectrómetro de infrarrojo cercano de dos canales no mide la corteza motora, occipital o parietal [50,51]. Los autores sólo pudieron identificar siete estudios pequeños y el artículo más antiguo data de 2015. El resultado primario de la MCAv (n = 4) y de la dCA (n = 2) se informó en pocos estudios con bajo poder estadístico. Por lo tanto, no se pudo realizar un meta-análisis debido a una combinación matemática insuficiente.
Conclusión
Esta revisión ha proporcionado información preliminar que estudia los efectos del HIIE sobre la función cerebrovascular. Actualmente, hay un número escaso de estudios de investigación con criterios de calidad moderadamente deficientes que han informado los efectos agudos y crónicos del HIIE sobre la función cerebrovascular. Se necesita una mayor cantidad de estudios y una mayor calidad de la investigación para evitar la contaminación, cegar las evaluaciones y reportar confiabilidad y validez. Se necesitan ensayos controlados aleatorios con tamaños de muestra grandes para realizar un meta-análisis para combinar y analizar estadísticamente los resultados resumidos del HIIE sobre la función cerebrovascular. Además, se necesitan más estudios para determinar los parámetros de intervalos óptimos del HIIE para proporcionar una dosis de ejercicio constante entre los estudios.
Con un mayor interés en el envejecimiento cerebral saludable y la implementación de intervenciones para mantener o mejorar la salud del cerebro [88], es fundamental estudiar los efectos de las intervenciones de HIIE [41,42]. Si bien esta revisión sólo incluyó individuos sanos, proporcionamos una referencia temprana para comprender los efectos fisiológicos "normales" del HIIE sobre la función cerebrovascular y la necesidad de comparar con poblaciones clínicas. Los investigadores deben hacer más esfuerzos para investigar e informar los efectos del HIIE en distintas medidas de la función cerebrovascular. Para ello, es imperativo que los investigadores implementen criterios de alta calidad dentro de la planificación de estudios futuros.
Información de apoyo
S1 Checklist. PRISMA 2009 checklist.
https://doi.org/10.1371/journal.pone.0241248.s001
S1 Fig. PRISMA 2009 diagrama de flujo
https://doi.org/10.1371/journal.pone.0241248.s002
S1 Tabla. Exclusión de estudios a partir de la revisión sistemática.
https://doi.org/10.1371/journal.pone.0241248.s003
Referencias
1. Batacan RB Jr. , Duncan MJ, Dalbo VJ, Tucker PS, Fenning AS. (2017). Effects of high-intensity interval training on cardiometabolic health: a systematic review and meta-analysis of intervention studies. Br J Sports Med. 2017;51(6). :494–503. Epub 2016/11/01. pmid:27797726.
2. Costa EC, Hay JL, Kehler DS, Boreskie KF, Arora RC, Umpierre D, et al. (2018). Effects of High-Intensity Interval Training Versus Moderate-Intensity Continuous Training On Blood Pressure in Adults with Pre- to Established Hypertension: A Systematic Review and Meta-Analysis of Randomized Trials. Sports Med. 2018;48(9). :2127–42. Epub 2018/06/28. pmid:29949110.
3. Ramos JS, Dalleck LC, Tjonna AE, Beetham KS, Coombes JS. (2015). The impact of high-intensity interval training versus moderate-intensity continuous training on vascular function: a systematic review and meta-analysis. Sports Med. 2015;45(5). :679–92. Epub 2015/03/17. pmid:25771785.
4. Rakobowchuk M, Tanguay S, Burgomaster KA, Howarth KR, Gibala MJ, MacDonald MJ. (2008). Sprint interval and traditional endurance training induce similar improvements in peripheral arterial stiffness and flow-mediated dilation in healthy humans. Am J Physiol Regul Integr Comp Physiol. 2008;295(1). :R236–42. Epub 2008/04/25. pmid:18434437; PubMed Central PMCID: PMC2494806.
5. Tabata I, Nishimura K, Kouzaki M, Hirai Y, Ogita F, Miyachi M, et al. (1996). Effects of moderate-intensity endurance and high-intensity intermittent training on anaerobic capacity and VO2max. Med Sci Sports Exerc. 1996;28(10). :1327–30. Epub 1996/10/01. pmid:8897392.
6. Cunningham DA, McCrimmon D, Vlach LF. (1979). Cardiovascular response to interval and continuous training in women. Eur J Appl Physiol Occup Physiol. 1979;41(3). :187–97. Epub 1979/07/02. pmid:488084.
7. Edge J, Bishop D, Goodman C. (2006). The effects of training intensity on muscle buffer capacity in females. Eur J Appl Physiol. 2006;96(1). :97–105. Epub 2005/11/12. pmid:16283370.
8. Ainslie PN, Cotter JD, George KP, Lucas S, Murrell C, Shave R, et al. (2008). Elevation in cerebral blood flow velocity with aerobic fitness throughout healthy human ageing. J Physiol. 2008;586(16). :4005–10. Epub 2008/07/19. pmid:18635643; PubMed Central PMCID: PMC2538930.
9. Prestgaard E, Mariampillai J, Engeseth K, Erikssen J, Bodegard J, Liestol K, et al. (2018). Change in Cardiorespiratory Fitness and Risk of Stroke and Death. Stroke. 2018: STROKEAHA118021798. Epub 2018/12/26. pmid:30580727.
10. Tari AR, Nauman J, Zisko N, Skjellegrind HK, Bosnes I, Bergh S, et al. (2019). Temporal changes in cardiorespiratory fitness and risk of dementia incidence and mortality: a population-based prospective cohort study. Lancet Public Health. 2019;4(11). :e565–e74. Epub 2019/11/05. pmid:31677775.
11. Bayati M, Farzad B, Gharakhanlou R, Agha-Alinejad H. (2011). A practical model of low-volume high-intensity interval training induces performance and metabolic adaptations that resemble 'all-out' sprint interval training. J Sports Sci Med. 2011;10(3). :571–6. Epub 2011/01/01. pmid:24150635; PubMed Central PMCID: PMC3737829.
12. Hsieh SS, Chueh TY, Huang CJ, Kao SC, Hillman CH, Chang YK, et al. (2020). Systematic review of the acute and chronic effects of high-intensity interval training on executive function across the lifespan. J Sports Sci. 2020:1–13. Epub 2020/08/12. pmid:32780634.
13. Aaslid R, Lindegaard KF, Sorteberg W, Nornes H. (1989). Cerebral autoregulation dynamics in humans. Stroke. 1989;20(1). :45–52. Epub 1989/01/01. pmid:2492126.
14. Li Z, Zhang M, Xin Q, Luo S, Zhou W, Cui R, et al. (2013). Assessment of cerebral oxygenation oscillations in subjects with hypertension. Microvasc Res. 2013; 88:32–41. Epub 2013/04/16. pmid:23583904.
15. Smith KJ, Ainslie PN. (2017). Regulation of cerebral blood flow and metabolism during exercise. Exp Physiol. 2017;102(11). :1356–71. Epub 2017/08/09. pmid:28786150.
16. Brassard P, Ainslie PN, Secher NH. (2014). Cerebral oxygenation in health and disease. Front Physiol. 2014; 5:458. Epub 2014/12/17. pmid:25505422; PubMed Central PMCID: PMC4241837.
17. Serrador JM, Picot PA, Rutt BK, Shoemaker JK, Bondar RL. (2000). MRI measures of middle cerebral artery diameter in conscious humans during simulated orthostasis. Stroke. 2000;31(7). :1672–8. Epub 2000/07/08. pmid:10884472.
18. Witte E, Liu Y, Ward JL, Kempf KS, Whitaker A, Vidoni ED, et al. (2019). Exercise intensity and middle cerebral artery dynamics in humans. Respir Physiol Neurobiol. 2019; 262:32–9. Epub 2019/02/03. pmid:30710650; PubMed Central PMCID: PMC6393201.
19. Ward JL, Craig JC, Liu Y, Vidoni ED, Maletsky R, Poole DC, et al. (2018). Effect of healthy aging and sex on middle cerebral artery blood velocity dynamics during moderate-intensity exercise. Am J Physiol Heart Circ Physiol. 2018;315(3). :H492–H501. Epub 2018/05/19. pmid:29775407; PubMed Central PMCID: PMC6172645.
20. Brugniaux JV, Marley CJ, Hodson DA, New KJ, Bailey DM. (2014). Acute exercise stress reveals cerebrovascular benefits associated with moderate gains in cardiorespiratory fitness. J Cereb Blood Flow Metab. 2014;34(12). :1873–6. Epub 2014/10/02. pmid:25269518; PubMed Central PMCID: PMC4269737.
21. Davenport MH, Hogan DB, Eskes GA, Longman RS, Poulin MJ. (2012). Cerebrovascular reserve: the link between fitness and cognitive function? Exerc Sport Sci Rev. 2012;40(3). :153–8. Epub 2012/04/17. pmid:22504726.
22. Fisher JP, Hartwich D, Seifert T, Olesen ND, McNulty CL, Nielsen HB, et al. (2013). Cerebral perfusion, oxygenation and metabolism during exercise in young and elderly individuals. J Physiol. 2013;591(7). :1859–70. Epub 2012/12/12. pmid:23230234; PubMed Central PMCID: PMC3624856.
23. Brys M, Brown CM, Marthol H, Franta R, Hilz MJ. (2003). Dynamic cerebral autoregulation remains stable during physical challenge in healthy persons. Am J Physiol Heart Circ Physiol. 2003;285(3). :H1048–54. Epub 2003/08/14. pmid:12915389.
24. Ogoh S, Fadel PJ, Zhang R, Selmer C, Jans O, Secher NH, et al. (2004). Middle cerebral artery flow velocity and pulse pressure during dynamic exercise in humans. Am J Physiol Heart Circ Physiol. 2005;288(4). :H1526–31. Epub 2004/12/14. pmid:15591094.
25. Steventon JJ, Hansen AB, Whittaker JR, Wildfong KW, Nowak-Fluck D, Tymko MM, et al. (2018). Cerebrovascular Function in the Large Arteries Is Maintained Following Moderate Intensity Exercise. Front Physiol. 2018;9: 1657. Epub 2018/12/07. pmid:30519192; PubMed Central PMCID: PMC6258791.
26. Herholz K, Buskies W, Rist M, Pawlik G, Hollmann W, Heiss WD. (1987). Regional cerebral blood flow in man at rest and during exercise. J Neurol. 1987;234(1). :9–13. Epub 1987/01/01. pmid:3102697.
27. Jorgensen LG, Perko M, Hanel B, Schroeder TV, Secher NH. (1992). Middle cerebral artery flow velocity and blood flow during exercise and muscle ischemia in humans. J Appl Physiol (1985). 1992;72(3). :1123–32. Epub 1992/03/01. pmid:1568967.
28. Thomas SN, Schroeder T, Secher NH, Mitchell JH. (1989). Cerebral blood flow during submaximal and maximal dynamic exercise in humans. J Appl Physiol (1985). 1989;67(2). :744–8. Epub 1989/08/01. pmid:2507500.
29. Hellstrom G, Wahlgren NG. (1993). Physical exercise increases middle cerebral artery blood flow velocity. Neurosurg Rev. 1993;16(2). :151–6. Epub 1993/01/01. pmid:8345909.
30. Moraine JJ, Lamotte M, Berre J, Niset G, Leduc A, Naeije R. (1993). Relationship of middle cerebral artery blood flow velocity to intensity during dynamic exercise in normal subjects. Eur J Appl Physiol Occup Physiol. 1993;67(1). :35–8. Epub 1993/01/01. pmid:8375362.
31. Ogoh S, Ainslie PN. (2009). Regulatory mechanisms of cerebral blood flow during exercise: new concepts. Exerc Sport Sci Rev. 2009;37(3). :123–9. Epub 2009/06/25. pmid:19550203.
32. Maeda H, Matsumoto M, Handa N, Hougaku H, Ogawa S, Itoh T, et al. (1993). Reactivity of cerebral blood flow to carbon dioxide in various types of ischemic cerebrovascular disease: evaluation by the transcranial Doppler method. Stroke. 1993;24(5). :670–5. Epub 1993/05/01. pmid:8488521.
33. Willie CK, Macleod DB, Shaw AD, Smith KJ, Tzeng YC, Eves ND, et al. (2012). Regional brain blood flow in man during acute changes in arterial blood gases. J Physiol. 2012;590(14). :3261–75. Epub 2012/04/13. pmid:22495584; PubMed Central PMCID: PMC3459041.
34. Bailey DM, Evans KA, McEneny J, Young IS, Hullin DA, James PE, et al. (2011). Exercise-induced oxidative-nitrosative stress is associated with impaired dynamic cerebral autoregulation and blood-brain barrier leakage. Exp Physiol. 2011;96(11). :1196–207. Epub 2011/08/16. pmid:21841038.
35. Phillips AA, Matin N, Jia M, Squair JW, Monga A, Zheng MMZ, et al. (2017). Transient Hypertension after Spinal Cord Injury Leads to Cerebrovascular Endothelial Dysfunction and Fibrosis. J Neurotrauma. 2018;35(3). :573–81. Epub 2017/11/17. pmid:29141501; PubMed Central PMCID: PMC6421994.
36. Lucas SJ, Cotter JD, Brassard P, Bailey DM. (2015). High-intensity interval exercise and cerebrovascular health: curiosity, cause, and consequence. J Cereb Blood Flow Metab. 2015;35(6). :902–11. Epub 2015/04/03. pmid:25833341; PubMed Central PMCID: PMC4640257.
37. Aries MJ, Elting JW, De Keyser J, Kremer BP, Vroomen PC. (2010). Cerebral autoregulation in stroke: a review of transcranial Doppler studies. Stroke. 2010;41(11). :2697–704. Epub 2010/10/12. pmid:20930158.
38. Castro P, Azevedo E, Sorond F. (2018). Cerebral Autoregulation in Stroke. Curr Atheroscler Rep. 2018;20(8). :37. Epub 2018/05/23. pmid:29785667.
39. Kempf KS, Whitaker AA, Lui Y, Witte E, Perdomo SJ, Ward JL, et al. (2019). The Effect of Stroke on Middle Cerebral Artery Blood Flow Velocity Dynamics During Exercise. J Neurol Phys Ther. 2019;43(4). :212–9. Epub 2019/08/27. pmid:31449179; PubMed Central PMCID: PMC6744289.
40. Franklin BA, Thompson PD, Al-Zaiti SS, Albert CM, Hivert MF, Levine BD, et al. (2020). Exercise-Related Acute Cardiovascular Events and Potential Deleterious Adaptations Following Long-Term Exercise Training: Placing the Risks Into Perspective-An Update: A Scientific Statement From the American Heart Association. Circulation. 2020;141(13). :e705–e36. Epub 2020/02/27. pmid:32100573.
41. Lucas SJE, Cotter JD, Brassard P, Bailey DM. (2015). High-intensity interval exercise and cerebrovascular health: curiosity, cause, and consequence. J Cerebr Blood F Met. 2015;35(6). :902–11. WOS:000355575600003. pmid:25833341
42. Calverley TA, Ogoh S, Marley CJ, Steggall M, Marchi N, Brassard P, et al. (2020). HIITing the brain with exercise: mechanisms, consequences and practical recommendations. J Physiol. 2020;598(13). :2513–30. Epub 2020/04/30. pmid:32347544.
43. Moher D, Liberati A, Tetzlaff J, Altman DG, Group P. (2009). Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. BMJ. 2009;339:b2535. Epub 2009/07/23. pmid:19622551; PubMed Central PMCID: PMC2714657.
44. Burma JS, Copeland P, Macaulay A, Khatra O, Wright AD, Smirl JD. (2020). Dynamic cerebral autoregulation across the cardiac cycle during 8 hr of recovery from acute exercise. Physiol Rep. 2020;8(5). :e14367. Epub 2020/03/13. pmid:32163235; PubMed Central PMCID: PMC7066871.
45. Drapeau A, Labrecque L, Imhoff S, Paquette M, Le Blanc O, Malenfant S, et al. (2019). Six weeks of high-intensity interval training to exhaustion attenuates dynamic cerebral autoregulation without influencing resting cerebral blood velocity in young fit men. Physiol Rep. 2019;7(15). :e14185. Epub 2019/08/03. pmid:31373166; PubMed Central PMCID: PMC6675921.
46. Northey JM, Pumpa KL, Quinlan C, Ikin A, Toohey K, Smee DJ, et al. (2019). Cognition in breast cancer survivors: A pilot study of interval and continuous exercise. J Sci Med Sport. 2019;22(5). :580–5. Epub 2018/12/18. pmid:30554923.
47. Tallon CM, Simair RG, Koziol AV, Ainslie PN, McManus AM. (2019). Intracranial Vascular Responses to High-Intensity Interval Exercise and Moderate-Intensity Steady-State Exercise in Children. Pediatr Exerc Sci. 2019;31(3). :290–5. Epub 2019/03/06. pmid:30832540.
48. Labrecque L, Rahimaly K, Imhoff S, Paquette M, Le Blanc O, Malenfant S, et al. (2017). Diminished dynamic cerebral autoregulatory capacity with forced oscillations in mean arterial pressure with elevated cardiorespiratory fitness. Physiol Rep. 2017;5(21). Epub 2017/11/11. pmid:29122957; PubMed Central PMCID: PMC5688778.
49. Fantini S, Sassaroli A, Tgavalekos KT, Kornbluth J. (2016). Cerebral blood flow and autoregulation: current measurement techniques and prospects for noninvasive optical methods. Neurophotonics. 2016;3(3). :031411. Epub 2016/07/13. pmid:27403447; PubMed Central PMCID: PMC4914489.
50. Coetsee C, Terblanche E. (2017). Cerebral oxygenation during cortical activation: the differential influence of three exercise training modalities. A randomized controlled trial. Eur J Appl Physiol. 2017;117(8). :1617–27. Epub 2017/06/02. pmid:28567669.
51. Monroe DC, Gist NH, Freese EC, O'Connor PJ, McCully KK, Dishman RK. (2016). Effects of Sprint Interval Cycling on Fatigue, Energy, and Cerebral Oxygenation. Med Sci Sports Exerc. 2016;48(4). :615–24. Epub 2015/11/13. pmid:26559448.
52. Auger H, Bherer L, Boucher E, Hoge R, Lesage F, Dehaes M. (2016). Quantification of extra-cerebral and cerebral hemoglobin concentrations during physical exercise using time-domain near infrared spectroscopy. Biomed Opt Express. 2016;7(10). :3826–42. Epub 2016/11/22. pmid:27867696; PubMed Central PMCID: PMC5102543.
53. Burma JS, Macaulay A, Copeland P, Khatra O, Bouliane KJ, Smirl JD. (2020). Comparison of cerebrovascular reactivity recovery following high-intensity interval training and moderate-intensity continuous training. Physiol Rep. 2020;8(11). :e14467. Epub 2020/06/09. pmid:32506845; PubMed Central PMCID: PMC7276190.
54. Claassen JA, Zhang R, Fu Q, Witkowski S, Levine BD. (2007). Transcranial Doppler estimation of cerebral blood flow and cerebrovascular conductance during modified rebreathing. J Appl Physiol (1985). 2007;102(3). :870–7. Epub 2006/11/18. pmid:17110510.
55. Scheeren TW, Schober P, Schwarte LA. (2012). Monitoring tissue oxygenation by near infrared spectroscopy (NIRS). : background and current applications. J Clin Monit Comput. 2012;26(4). :279–87. Epub 2012/04/03. pmid:22467064; PubMed Central PMCID: PMC3391360.
56. Duffin J, Sobczyk O, McKetton L, Crawley A, Poublanc J, Venkatraghavan L, et al. (2018). Cerebrovascular Resistance: The Basis of Cerebrovascular Reactivity. Front Neurosci. 2018;12:409. Epub 2018/07/06. pmid:29973862; PubMed Central PMCID: PMC6020782.
57. Fierstra J, Sobczyk O, Battisti-Charbonney A, Mandell DM, Poublanc J, Crawley AP, et al. (2013). Measuring cerebrovascular reactivity: what stimulus to use? J Physiol. 2013;591(23). :5809–21. Epub 2013/10/02. pmid:24081155; PubMed Central PMCID: PMC3872753.
58. Sackett DL. (1982). How to read clinical journals. Can Med Assoc J. 1982;126(12). :1373. Epub 1982/06/15. pmid:20313761; PubMed Central PMCID: PMC1863136.
59. Sackett DL. (1993). Rules of evidence and clinical recommendations for the management of patients. Can J Cardiol. 1993;9(6). :487–9. Epub 1993/07/01. pmid:8221340.
60. Dupuy O, Tremblay J. (2019). Impact of Carbohydrate Ingestion on Cognitive Flexibility and Cerebral Oxygenation during High-Intensity Intermittent Exercise: A Comparison between Maple Products and Usual Carbohydrate Solutions. Nutrients. 2019;11(9). Epub 2019/08/31. pmid:31466305; PubMed Central PMCID: PMC6770040.
61. Willis SJ, Borrani F, Millet GP. (2019). Leg- vs arm-cycling repeated sprints with blood flow restriction and systemic hypoxia. Eur J Appl Physiol. 2019;119(8). :1819–28. Epub 2019/06/13. pmid:31187281.
62. Klein T, Bailey TG, Abeln V, Schneider S, Askew CD. (2019). Cerebral Blood Flow during Interval and Continuous Exercise in Young and Old Men. Med Sci Sports Exerc. 2019;51(7). :1523–31. Epub 2019/02/16. pmid:30768552.
63. Tsukamoto H, Hashimoto T, Olesen ND, Petersen LG, Sorensen H, Nielsen HB, et al. (2019). Dynamic Cerebral Autoregulation Is Maintained during High-Intensity Interval Exercise. Med Sci Sports Exerc. 2019;51(2). :372–8. Epub 2018/09/27. pmid:30252775.
64. Hanssen H, Minghetti A, Magon S, Rossmeissl A, Rasenack M, Papadopoulou A, et al. (2018). Effects of different endurance exercise modalities on migraine days and cerebrovascular health in episodic migraineurs: A randomized controlled trial. Scand J Med Sci Sports. 2018;28(3). :1103–12. Epub 2017/11/22. pmid:29161767.
65. Kirkham AA, Shave RE, Bland KA, Bovard JM, Eves ND, Gelmon KA, et al. (2017). Protective effects of acute exercise prior to doxorubicin on cardiac function of breast cancer patients: A proof-of-concept RCT. Int J Cardiol. 2017; 245:263–70. Epub 2017/07/25. pmid:28735755.
66. Gjellesvik TI, Becker F, Tjonna AE, Indredavik B, Nilsen H, Brurok B, et al. (2020). Effects of High-Intensity Interval Training after Stroke (The HIIT-Stroke study). —A Multicenter Randomized Controlled Trial. Arch Phys Med Rehabil. 2020. Epub 2020/03/08. pmid:32145280.
67. Scott JM, Tucker WJ, Martin D, Crowell JB, Goetchius E, Ozgur O, et al. (2019). Association of Exercise and Swimming Goggles With Modulation of Cerebro-ocular Hemodynamics and Pressures in a Model of Spaceflight-Associated Neuro-ocular Syndrome. JAMA Ophthalmol. 2019;137(6). :652–9. Epub 2019/04/19. pmid:30998818; PubMed Central PMCID: PMC6567831.
68. Saoi M, Percival M, Nemr C, Li A, Gibala M, Britz-McKibbin P. (2019). Characterization of the Human Skeletal Muscle Metabolome for Elucidating the Mechanisms of Bicarbonate Ingestion on Strenuous Interval Exercise. Anal Chem. 2019;91(7). :4709–18. Epub 2019/03/06. pmid:30835436.
69. Labrecque L, Drapeau A, Rahimaly K, Imhoff S, Billaut F, Brassard P. (2020). Comparable blood velocity changes in middle and posterior cerebral arteries during and following acute high-intensity exercise in young fit women. Physiol Rep. 2020;8(9). : e14430. Epub 2020/04/29. pmid:32342622; PubMed Central PMCID: PMC7186567.
70. Peyravi A, Yazdanpanahi N, Nayeri H, Hosseini SA. (2020). The effect of endurance training with crocin consumption on the levels of MFN2 and DRP1 gene expression and glucose and insulin indices in the muscle tissue of diabetic rats. J Food Biochem. 2020;44(2). : e13125. Epub 2019/12/19. pmid:31849103.
71. Komiyama T, Tanoue Y, Sudo M, Costello JT, Uehara Y, Higaki Y, et al. (2020). Cognitive Impairment during High-Intensity Exercise: Influence of Cerebral Blood Flow. Med Sci Sports Exerc. 2020;52(3). :561–8. Epub 2019/10/15. pmid:31609297.
72. Hansen RK, Nielsen PS, Schelske MW, Secher NH, Volianitis S. (2020). CO2 supplementation dissociates cerebral oxygenation and middle cerebral artery blood velocity during maximal cycling. Scand J Med Sci Sports. 2020;30(3). :399–407. Epub 2019/10/28. pmid:31650627.
73. Gonzalez-Alonso J, Dalsgaard MK, Osada T, Volianitis S, Dawson EA, Yoshiga CC, et al. (2004). Brain and central haemodynamics and oxygenation during maximal exercise in humans. J Physiol. 2004;557(Pt 1). :331–42. Epub 2004/03/09. pmid:15004212; PubMed Central PMCID: PMC1665053.
74. Linkis P, Jorgensen LG, Olesen HL, Madsen PL, Lassen NA, Secher NH. (1995). Dynamic exercise enhances regional cerebral artery mean flow velocity. J Appl Physiol (1985). 1995;78(1). :12–6. Epub 1995/01/01. pmid:7713801.
75. Brassard P, Kim YS, van Lieshout J, Secher NH, Rosenmeier JB. (2012). Endotoxemia reduces cerebral perfusion but enhances dynamic cerebrovascular autoregulation at reduced arterial carbon dioxide tension. Crit Care Med. 2012;40(6). :1873–8. Epub 2012/05/23. pmid:22610190.
76. Ogoh S, Ainslie PN. (2009). Cerebral blood flow during exercise: mechanisms of regulation. J Appl Physiol (1985). 2009;107(5). :1370–80. Epub 2009/09/05. pmid:19729591.
77. van Beek AH, Claassen JA, Rikkert MG, Jansen RW. (2008). Cerebral autoregulation: an overview of current concepts and methodology with special focus on the elderly. J Cereb Blood Flow Metab. 2008;28(6). :1071–85. Epub 2008/03/20. pmid:18349877.
78. Hamner JW, Cohen MA, Mukai S, Lipsitz LA, Taylor JA. (2004). Spectral indices of human cerebral blood flow control: responses to augmented blood pressure oscillations. J Physiol. 2004;559(Pt 3). :965–73. Epub 2004/07/16. pmid:15254153; PubMed Central PMCID: PMC1665190.
79. Ainslie PN, Barach A, Murrell C, Hamlin M, Hellemans J, Ogoh S. (2007). Alterations in cerebral autoregulation and cerebral blood flow velocity during acute hypoxia: rest and exercise. Am J Physiol Heart Circ Physiol. 2007;292(2). :H976–83. Epub 2006/10/03. pmid:17012355.
80. Ainslie PN, Hamlin M, Hellemans J, Rasmussen P, Ogoh S. (2008). Cerebral hypoperfusion during hypoxic exercise following two different hypoxic exposures: independence from changes in dynamic autoregulation and reactivity. Am J Physiol Regul Integr Comp Physiol. 2008;295(5). :R1613–22. Epub 2008/09/05. pmid:18768767.
81. Smirl JD, Hoffman K, Tzeng YC, Hansen A, Ainslie PN. (2015). Relationship between blood pressure and cerebral blood flow during supine cycling: influence of aging. J Appl Physiol (1985). 2016;120(5). :552–63. Epub 2015/11/21. pmid:26586907; PubMed Central PMCID: PMC4773644.
82. Ogoh S, Dalsgaard MK, Yoshiga CC, Dawson EA, Keller DM, Raven PB, et al. (2005). Dynamic cerebral autoregulation during exhaustive exercise in humans. Am J Physiol Heart Circ Physiol. 2005;288(3). :H1461–7. Epub 2004/10/23. pmid:15498819.
83. Thomas BP, Yezhuvath US, Tseng BY, Liu P, Levine BD, Zhang R, et al. (2013). Life-long aerobic exercise preserved baseline cerebral blood flow but reduced vascular reactivity to CO2. J Magn Reson Imaging. 2013;38(5). :1177–83. Epub 2013/03/26. pmid:23526811; PubMed Central PMCID: PMC3695025.
84. Battisti-Charbonney A, Fisher J, Duffin J. (2011). The cerebrovascular response to carbon dioxide in humans. J Physiol. 2011;589(Pt 12). :3039–48. Epub 2011/04/28. pmid:21521758; PubMed Central PMCID: PMC3139085.
85. Alexandrov AV, Bladin CF, Norris JW. (1994). Intracranial blood flow velocities in acute ischemic stroke. Stroke. 1994;25(7). :1378–83. Epub 1994/07/01. pmid:7912863.
86. Aoi MC, Hu K, Lo MT, Selim M, Olufsen MS, Novak V. (2012). Impaired cerebral autoregulation is associated with brain atrophy and worse functional status in chronic ischemic stroke. PLoS One. 2012;7(10). :e46794. Epub 2012/10/17. pmid:23071639; PubMed Central PMCID: PMC3469603.
87. Coverdale NS, Gati JS, Opalevych O, Perrotta A, Shoemaker JK. (2014). Cerebral blood flow velocity underestimates cerebral blood flow during modest hypercapnia and hypocapnia. J Appl Physiol (1985). 2014;117(10). :1090–6. Epub 2014/07/12. pmid:25012027.
88. Gorelick PB, Furie KL, Iadecola C, Smith EE, Waddy SP, Lloyd-Jones DM, et al. (2017). Defining Optimal Brain Health in Adults: A Presidential Advisory From the American Heart Association/American Stroke Association. Stroke. 2017;48(10). :e284–e303. Epub 2017/09/09. pmid:28883125; PubMed Central PMCID: PMC5654545.