Efectos del Entrenamiento de Resistencia sobre la Acumulación de Glucógeno en Humanos
Jeffrey S Greiwe1, Robert C Hickner1, Polly A Hansen1, Susan B Racette1, May M Chen1 y John O Holloszy1
Washington University Scholl of Medicine, St. Louis, Missuori 63110.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1999.
Publicado 26 de mayo de 2003
Resumen
Palabras clave: transportador de glucosa GLUT -4, supercompensación de glucógeno, actividad de la glucógeno sintetas
INTRODUCCIÓN
Los individuos que se ejercitan con regularidad generalmente tienen niveles superiores de glucógeno muscular que sus pares sedentarios (26, 30, 32). Esto es esperado, debido a que las sesiones de ejercicio que resultan en la depleción de glucógeno muscular son seguidas por la supercompensación de glucógeno, cuando es ingerida una cantidad adecuada de carbohidratos (CHO) (1). El músculo esquelético se adapta al ejercicio de resistencia con un incremento de la isoforma de la proteína transportadora de glucosa, GLUT-4 (5-8, 15, 25, 28, 29). En la ausencia de resistencia a la insulina, la estimulación del transporte de glucosa es proporcional al contenido muscular de GLUT-4, y el incremento en los GLUT-4 musculares inducido por el ejercicio esta asociado con incrementos proporcionales en la insulina y en el transporte de glucosa estimulado por la contracción muscular (25, 28, 29).
En este contexto, parece posible que el entrenamiento podría además resultar en una capacidad incrementada para la supercompensación de glucógeno muscular. De este modo, fueron conducidos estudios en ratas para evaluar la posibilidad de que el entrenamiento aumente la supercompensación de glucógeno muscular. Se encontró que los músculos de ratas que se han adaptado al ejercicio con un incremento en los GLUT-4, acumulan glucógeno mas rápidamente, y en niveles muchos mayores, que músculos desentrenados, si la glucosa se hace disponible después de un ejercicio de depleción de glucógeno (22, 28). Parece que en ratas y ratones, el transporte de glucosa es el paso limitante de la tasa de acumulación de glucógeno muscular bajo condiciones fisiológicas (14, 27, 28). Como el transporte de glucosa o la actividad de la glucógeno sintetasa limitan la síntesis de glucógeno en el músculo humano, continúa siendo un tema de controversia (2, 3). Por ello, no puede ser asumido que un ejercicio que induzca un aumento en los GLUT-4 musculares también este asociado con un incremento en la supercompensación de glucógeno después de un ejercicio que produzca depleción de glucógeno en humanos.
Como un primer acercamiento a este punto, nosotros realizamos un estudio comparando ciclistas altamente entrenados con sujetos desentrenados (11). Se encontró que la tasa de acumulación de glucógeno en respuesta al consumo de CHO fue dos veces más rápida en los ciclistas que en los sujetos desentrenados durante las primeras 6 horas posteriores a un ejercicio de depleción de glucógeno. Además, el nivel de glucógeno muscular alcanzado en 48 o 72 h después del ejercicio fue ~66% mayor en los ciclistas. La concentración de GLUT-4 muscular fue tres veces mayor en los ciclistas que en los sujetos desentrenados. Esta es una diferencia notablemente amplia en el contenido de los transportadores GLUT-4 musculares, comparados con los incrementos que se han comprobado que ocurren con el entrenamiento en sujetos humanos (5, 8, 15). Debería ser considerada entonces, la posibilidad de que factores genéticos, además del estado de entrenamiento, pudieran haber contribuido a las diferencias en la acumulación de glucógeno muscular entre los ciclistas y los sujetos desentrenados. Las posibles diferencias genéticas son, por supuesto, siempre un factor de confusión potencial en este tipo de estudios. De este modo, las comparaciones de atletas con no atletas son generalmente útiles como una evaluación de proyección inicial para determinar cuándo es necesario un estudio longitudinal que someta a los sujetos a un período de entrenamiento.
En este contexto, el propósito de esta investigación fue determinar, como un período de entrenamiento de resistencia provoca un aumento en la supercompensación de glucógeno en respuesta al consumo de CHO, después de un ejercicio de depleción de glucógeno.
MÉTODOS
Sujetos
Seis sujetos saludables y desentrenados (4 mujeres y 2 hombres) participaron en esta investigación. Cada sujeto presentó un informe de consentimiento. Esta investigación fue aprobada por el Comité de Estudios Humanos de la Escuela de Medicina de la Universidad de Washington.
Consumo de O2
El pico de consumo de O2 (VO2 pico) fue medido durante una evaluación continua en cicloergómetro hasta el agotamiento, tres semanas antes de la prueba de depleción de glucógeno y nuevamente al final de un programa de entrenamiento de 10 semanas. El protocolo para alcanzar el VO2 pico consistió en pedalear a 50, 100, y 150 W durante 3 min por cada intensidad de ejercicio, seguidos por incrementos de 25 W cada minuto hasta el agotamiento. El aire expirado fue colectado y analizado inmediatamente a lo largo del ejercicio con un sistema automatizado en línea (Max-1, Physio-Dyne Instrument, Farmingdale, NY).
Prueba de Depleción de Glucógeno
Los sujetos se presentaron en el laboratorio en ayunas, habiendo permanecido en este estado desde la noche anterior. Realizaron después una serie de ejercicio de depleción de glucógeno, la cual consistió en pedalear al ~75% del VO2 pico por cuatro períodos de 30 minutos con periodos de 4 min de descanso entre series. Posteriormente los sujetos realizaron cinco series de 1 minuto de ejercicio al ~100% del VO2 pico con periodos de 3 min de pausa entre series. Para asegurarse que los sujetos se estuvieran ejercitando al ~75% del VO2 pico se midió el consumo de oxígeno durante ~10 min en cada serie de 30 min de ejercicio. Este protocolo fue realizado antes y después de un programa de entrenamiento de 10 semanas.
Biopsias Musculares
Se tomó una biopsia del músculo vasto lateral del cuadriceps femoral 15 min después de la serie de depleción de glucógeno. Las biopsias también fueron tomadas a las 6 y 48 h después que los sujetos comenzaran su primer comida (~15 min después de la biopsia inicial) del vasto lateral de la pierna contralateral y a ~3 cm de distancia del sitio de biopsia inicial, respectivamente. Las muestras de músculo fueron inmediatamente congeladas en nitrógeno líquido y guardadas a –80 °C para los análisis subsecuentes. Las muestras de los músculos de todos los tiempos fueron analizadas para concentración de glucógeno (23) y glucógeno sintetasa (24). Las muestras musculares tomadas a los 15 min posteriores al ejercicio fueron analizadas para GLUT-4 y el contenido de la proteína citrato sintetasa y actividad de la hexoquinasa. La actividad de la hexoquinasa muscular fue determinada a 30 °C, como fue descrito por Uyeda y Racker (33). El contenido muscular de GLUT-4 y citrato sintetasa fueron determinados a través de un papel secante como se describió previamente (9). Brevemente, el contenido de proteínas fue detectado con anticuerpos policlonados de conejo directamente contra GLUT-4 o citrato sintetasa, seguido por peroxidasa conjugada horseradish donkey anti-rabbit IgG. La proteína ligadora de anticuerpos fue visualizada utilizando quimioluminisencia aumentada (Amersham). La intensidad de las bandas fue determinada por densitometría (modelo GS-670, Bio-Rad).
Dieta
A los sujetos se les suministró comida durante las 48 hs previas y posteriores a la prueba de depleción de glucógeno. La composición de la dieta antes de la prueba de depleción de glucógeno consistió en 50% CHO, 30% de grasas, y 20% de proteínas y fue preparada para contener 37 kcal • kg peso corporal–1. Después de la serie de ejercicio de depleción de glucógeno, las comidas fueron ingeridas a los 15 min, 2 h, y 4 h después de la biopsia inicial y a condición de 1.4 g CHO • kg de peso corporal–1 por 6 h. Durante las 42 h siguientes la dieta suministró 10 g CHO • kg de peso corporal–1, y la composición de la dieta fue 80% CHO, 7% de grasas, y 13% de proteínas. La composición y contenido de la dieta fueron iguales antes y después del entrenamiento.
Muestras y Análisis Sanguíneos
Se insertó un catéter de polietileno dentro de una vena antecubital y se mantuvo abierto a lo largo de la prueba de depleción de glucógeno. Las muestras de sangre fueron obtenidas en los siguientes tiempos: inmediatamente antes del ejercicio, al final de la última serie de ejercicio de 30 minutos, después del último sprint, y cada 0.5 h. durante las 6 h después que el sujeto comenzó a ingerir la primer comida luego de la biopsia inicial. Las muestras de sangre fueron colectadas en tubos de ensayo que contenían heparina, para la determinación de la glucosa plasmática (método de oxidación de glucosa, Beckman Instruments, Fullerton, CA), Trasylol para la determinación de insulina (20) y péptido C (18), y glutatión reducido y ETGA para la determinación de catecolaminas (31). Las muestras fueron sujetas a centrifugación (15 min a 2000 g) y la parte separada fue colectada y guardada a 80 °C antes de los análisis subsecuentes.
Programa de Entrenamiento.
Los sujetos comenzaron un programa de entrenamiento 72 h después de la prueba de depleción de glucógeno. El programa consistió en ejercicio de cicloergómetro de alta intensidad y de carrera continua, ambos realizados 3 días por semana (12). El ejercicio en cicloergómetro consistió de cuatro series de ejercicio de 5 min al ~90-100% del VO2 pico durante las primeras 2 semanas. Las series de 5 minutos de ejercicio fueron separadas por períodos de recuperación de 2 min, durante los cuales los sujetos pedaleaban a ~ 50-100W. Después de la segunda semana el protocolo de ciclismo se incrementó a cinco series de 5 minutos por las 8 semanas restantes. La potencia en el cicloergómetro fue ajustada a lo largo del protocolo de entrenamiento para compensar el incremento de la máxima capacidad de ejercicio de los sujetos. El ejercicio de carrera consistió en una carrera continua durante 30 min/día durante la primer semana, 35 min/día durante la segunda semana, y 40 min/día para el resto de las 8 semanas. Se alentó a los sujetos a correr a un paso tan rápido como pudieran mantener durante las sesiones de ejercicio.
Análisis Estadísticos
Los valores son presentados como medias ± DS. Las variables de tejido muscular en estado entrenado y desentrenado, tanto como el área bajo las curvas para las variables sanguíneas fueron analizados con un test-t apareado. Se determinó el coeficiente de correlación de Pearson para la concentración de glucógeno vs. GLUT-4 y el porcentaje de la enzima glucógeno sintetasa I. La significancia estadística para todo los análisis estadísticos fue aceptada a un nivel α de P<0.05.
RESULTADOS
Peso Corporal y Consumo de Oxígeno
El programa de entrenamiento no tuvo efecto sobre el peso corporal (Tabla 1). El incremento promedio en el VO2 pico en respuesta a 10 semanas de entrenamiento fue ~ 22% (P<0.05).

Tabla 1. Características de los Sujetos. Los valores son presentados como media
± DS.
VO2 pico, pico de consumo de O2. *Diferencia significativa con respecto al
estado desentrenado (P<0.05).
Glucógeno Muscular
Las concentraciones de glucógeno muscular fueron muy bajas inmediatamente después del ejercicio en los estados entrenados y desentrenados. En todos los momentos luego de la serie de ejercicio de depleción de glucógeno, la concentración de glucógeno muscular fue significativamente mayor en el estado entrenado que en el estado desentrenado (Fig. 1). La tasa de acumulación de glucógeno muscular desde los 15 min hasta las 6 h después del ejercicio de depleción de glucógeno fue aproximadamente dos veces superior en el estado entrenado que en el estado desentrenado (10.5 ±0.2 y 4.5 ±1.3 mmol ∙ kg de peso-1 húmedo ∙ h-1, respectivamente, P<0.05). El incremento total en el glucógeno muscular durante el período de 48 h de supercompensación de glucógeno también fue mucho mayor en el estado entrenado: 95.3 ±19.0 y 170.7 ±23.8 mmol/kg de peso húmedo, antes y después de el entrenamiento, respectivamente (P<0.05).
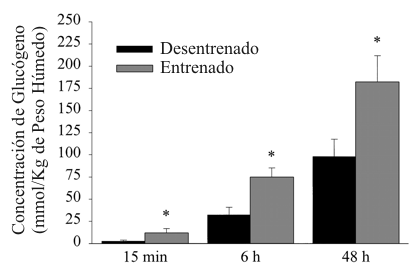
Figura 1. Concentración de glucógeno muscular en estados desentrenados y
entrenados, 15 min, 6 h, 48 h luego de una serie de depleción de glucógeno. Los
valores se presentan como medias ± DS. *Significativamente diferente al estado
desentrenado (P<0.05).
Contenido de Transportadores GLUT-4 Musculares
El contenido de los GLUT-4 musculares fue dos veces mayor en el estado entrenado que en el desentrenado (Tabla 2). La concentración de glucógeno muscular 6 h después del ejercicio estuvo significativamente correlacionada con el contenido de los GLUT-4 musculares (Fig. 2).

Tabla 2. Efectos del entrenamiento sobre la proteína GLUT-4 del músculo
esquelético, la proteína citrato sintetasa, y la actividad de la hexoquinasa. Los
valores se presentan como medias ± DS y están expresados en unidades
densitométricas arbitrarias (para las proteínas citrato sintetasa y GLUT-4) y en
µmol• min-1• g proteína-1 (para la hexoquinasa). * Significativamente diferente
del estado desentrenado (P<0.05).
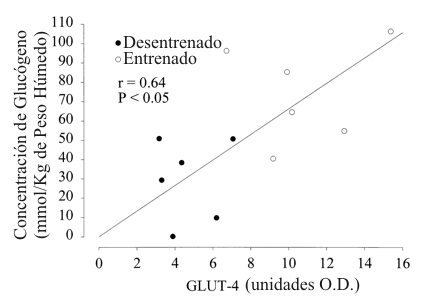
Figura 2. Relación entre el contenido muscular de GLUT-4 y la
concentración de glucógeno muscular 6 horas después de la serie de ejercicio de
depleción de glucógeno (P<0.05). OD, densidad óptica.
Actividad de la Glucógeno Sintetasa Muscular
La actividad de la glucógeno sintetasa muscular total fue similar en los estados desentrenados y entrenados: 2.88 ±0.52 y 2.85 ±0.74 µmol • g -1 • min-1 antes y después del entrenamiento, respectivamente. El porcentaje de la glucógeno sintetasa I a los 15 min después del ejercicio fue ligeramente mayor (28%) en el estado entrenado que en el estado desentrenado, pero esta diferencia no fue estadísticamente significativa (Fig. 3). El porcentaje de la glucógeno sintetasa I muscular no estuvo significativamente correlacionado con la concentración de glucógeno muscular 6 h después al ejercicio (r =0.29, P =0.36).
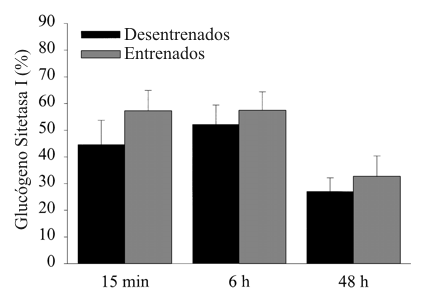
Figura 3. Porcentaje de la glucógeno sintetasa I muscular en los estados
desentrenados y entrenados 15 min, 6 h, y 48 h después de una serie de ejercicio
de depleción de glucógeno. Los valores son presentados como medias ± DS.
Citrato sintetasa y actividad de la hexoquinasa
El contenido de la proteína citrato sintetasa muscular fue significativamente mayor después del entrenamiento (Tabla 2). La actividad de la hexoquinasa muscular fue un 62% mayor en el estado entrenado que en el desentrenado, pero esta diferencia no fue estadísticamente significativa (Tabla 2).
Hormonas y Metabolitos
El área bajo la curva para la concentración de glucosa plasmática después del ejercicio de depleción de glucógeno fue menor (P<0.05) en el estado entrenado que en el desentrenado (Figura 4). Las concentraciones de insulina plasmática, péptico C, epinefrina, y norepinefrina en el estado entrenado no fueron significativamente diferentes a aquellas del estado desentrenado, después del ejercicio de depleción de glucógeno (datos no mostrados).
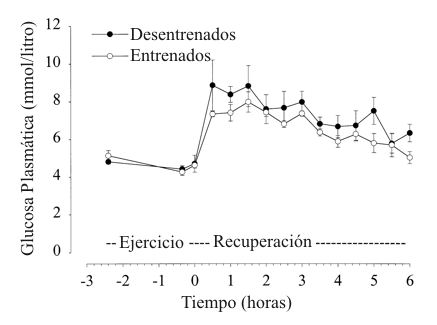
Figura 4. Glucosa plasmática antes del ejercicio (-2,4h), después del
ciclismo (-0,35 h), después del sprint final (0), y cada 0.5 h durante 6 h
después del ejercicio. Los valores son presentados como medias ± DS. El área
bajo la curva después del ejercicio de depleción de glucógeno fue menor (P<0.05)
en el estado entrenado que en el estado desentrenado.
DISCUSIÓN
Los presentes hallazgos muestran que el entrenamiento de resistencia incrementa marcadamente la supercompensación de glucógeno muscular en respuesta a la ingesta de CHO después de un ejercicio de depleción glucógeno. Previamente fue hallado que el entrenamiento incrementa la tasa y la cantidad de acumulación de glucógeno muscular en ratas alimentadas con CHO después de una serie de ejercicio de depleción de glucógeno (22, 28). Además, Hickner et al. (1) encontraron una tasa de acumulación de glucógeno dos veces mayor en ciclistas altamente entrenados que en individuos desentrenados, suministrando evidencia a favor de que el entrenamiento de resistencia también podría incrementar la capacidad del músculo humano de incrementar la acumulación de glucógeno. Sin embargo, aunque los estudios transversales son útiles para la evaluación inicial de una hipótesis, es necesario realizar investigaciones complementarias sobre individuos estudiados antes y después del entrenamiento para asegurar que los hallazgos transversales no fueran causados por diferencias genéticas. Los resultados de este estudio longitudinal muestran claramente, en individuos estudiados antes y después de 10 semanas entrenamiento de resistencia, que el entrenamiento produce adaptaciones que incrementan la habilidad del músculo para acumular glucógeno después del ejercicio.
El entrenamiento de resistencia induce incrementos en los transportadores GLUT-4 del músculo esquelético que, como en este estudio, son generalmente mayores que los incrementos en las enzimas mitocondriales y la hexoquinasa (5-8, 15, 25, 28, 29). Un creciente cuerpo de evidencia sostiene la interpretación que la tasa de transporte de glucosa esta correlacionada con el contenido muscular de transportadores GLUT-4 (10, 17, 25, 28, 29). Existe también considerable evidencia acerca de que el transporte de glucosa es el paso limitante de la tasa de consumo de glucosa y síntesis de glucógeno en el músculo esquelético (para revisión ver Ref. 13). Los hallazgos de esta investigación demostraron que la concentración de glucógeno 6 h después del ejercicio está correlacionada con la concentración muscular de GLUT-4 en sujetos que recibieron CHO después de un ejercicio de depleción de glucógeno. Esta relación coincide con los hallazgos de MacCoy et al. (19) y Hickner et al. (11). Los resultados de este estudio coinciden con aquellos estudios previos sobre ratas y demuestran que el incremento en los GLUT-4 musculares, inducido por el entrenamiento, está asociado con los incrementos en la tasa y cantidad de supercompensación de glucógeno muscular después de un ejercicio de depleción de glucógeno (14, 22). Esta claro desde el hallazgo, que los niveles de glucosa e insulina plasmática no fueron superiores en el estado entrenado que en el desentrenado y que los cambios en esta variable no jugaron un rol en el incremento de la supercompensación de glucógeno en el estado entrenado.
Se ha sugerido que la activación de la glucógeno sintetasa es responsable de la supercompensación de glucógeno después de un ejercicio de depleción del mismo (3). Los hallazgos de esta investigación así como aquellos de otros estudios no sostienen este concepto (4, 11, 14, 22, 27). En el presente estudio, la glucógeno sintetasa total y el porcentaje de la glucógeno sintetasa I en el estado entrenado no fueron significativamente diferentes a aquellos en el estado desentrenado. Además, el porcentaje de la glucógeno sintetasa I sólo explica una pequeña porción de la variabilidad en la acumulación de glucógeno muscular 6 h después del ejercicio. Aunque el aumento en el porcentaje de la glucógeno sintetasa I juega aparentemente un importante rol en el rápido incremento inicial del glucógeno muscular, aparentemente no juega un rol en el fenómeno de la supercompensación de glucógeno. Esto es evidenciado por los hallazgos que el glucógeno continúa incrementándose hasta los “niveles supercompensados” después de que el aumento en el porcentaje de la glucógeno sintetasa I se ha invertido (2, 4, 22). Un número de investigaciones ha reportado que el entrenamiento induce un incremento en la actividad de la glucógeno sintetasa total en el músculo esquelético (16, 21, 32). En el presente estudio nosotros estuvimos imposibilitados de detectar un incremento en la actividad de la glucógeno sintetasa total en el músculo esquelético. No tenemos explicación para esta aparente discrepancia.
En conclusión, los resultados de este estudio demuestran que el incremento de la isoforma GLUT-4 muscular del transportador de glucosa que sucede en respuesta al entrenamiento, está asociado con un incremento en: 1) la tasa de acumulación temprana de glucógeno durante la recuperación y 2) la intensidad de la supercompensación de glucógeno muscular, en mujeres y hombres que consumen CHO después de un ejercicio de depleción de glucógeno. Es aparentemente probable que esta adaptación ayude a prevenir y/o aumentar la anulación de la fatiga muscular asociada con la depleción de glucógeno.
Agradecimientos
Los autores agradecen ampliamente la asistencia de Victoria Reckamp para la preparación del manuscrito. Los autores agradecen al Dr. Mike Mueckler por su generosa donación de los anticuerpos GLUT-4.
Notas al Pie
Esta investigación fue avalada por el National Institute of Diabetes and Digestive and Kidney Diseases; Subsidio DK-18986, General Clinical Research Center; Subsidio 5 M01 RR-00036, y el Diabetes Research and Training Center; Subsidio DK-20579. J. S. Greiwe, R.C. Hickner, y S.B. Racette fueron subvencionados por la Beca AG-00078 del National Institute on Aging Institutional National Service Research Service.
Dirección para solicitud de reimpresiones y otras correspondencias
J.O Holloszy, Div. of Geriatrics and Gerontology, Washington University School of Medicine, 4566 Scott Ave., campus Box 8113, St. Louis, MO 63110. (Correo electrónico: jholloszy@imgate.wustl.edu).
Referencias
1. Bogardus, C., S. Lillioja, K. Stone, and D. Mott (1984). Correlation between muscle glycogen synthase activity and in vivo insulin action in man. J Clin Invest; 73: 1185-1190
2. Conlee, R. K., R. C. Hickson, W. W. Winder, J. M. Hagberg, and J. O. Holloszy (1978). Regulation of glycogen resynthesis in muscle of rats following exercise. Am J Physiol;. 235 (Regulatory Integrative Comp. Physiol. 4): R145-R150
3. Dela, F., A. Handberg, K. J. Mikines, J. Vinten, and H. Galbo (1993). GLUT4 and insulin receptor binding and kinase activity in trained human muscle. J Physiol (Lond); 469: 615-624
4. Friedman, J. E., W. M. Sherman, M. J. Reed, C. W. Elton, and G. L. Dohm (1990). Exercise-training increases glucose transporter protein GLUT4 in skeletal muscle of obese Zucker (fa/fa) rats. FEBS Lett; 268:13-16
5. Goodyear, L. J., M. F. Hirshman, P. M. Valyou, and E. S. Horton (1992). Glucose transporter number, function, and subcellular distribution in rat skeletal muscle after exercise training. Diabetes; 41: 1091-1099,(Abstract)
6. Gulve, E. A., and R. J. Spina (1995). Effect of 7-10 days of cycle ergometer exercise on skeletal muscle GLUT-4 protein content. J Appl Physiol; 79: 1562-1566
7. Hansen, P. A., T. J. McCarthy, E. N. Pasia, R. J. Spina, and E. A. Gulve (1996). Effects of ovariectomy and exercise training on muscle GLUT-4 content and glucose metabolism in rats. J Appl Physiol; 80: 1605-1611
8. Henriksen, E. J., R. E. Bourey, K. J. Rodnick, L. Koranyi, M. A. Permutt, and J. O. Holloszy (1990). Glucose transporter protein content and glucose transport capacity in rat skeletal muscles. Am J Physiol; 259 (Endocrinol Metab 22): E593-E598
9. Hickner, R. C., J. S. Fisher, P. A. Hansen, S. B. Racette, C. M. Mier, M. J. Turner, and J. O. Holloszy (1997). Muscle glycogen accumulation after endurance exercise in trained and untrained individuals. J Appl Physiol; 83: 897-903
10. Hickson, R. C., H. A. Bomze, and J. O. Holloszy (1977). Linear increase in aerobic power induced by a strenuous program of endurance exercise. J Appl Physiol; 42: 372-376
11. Holloszy, J. O., and P. A. Hansen (1996). Regulation of glucose transport into skeletal muscle. In: Reviews of Physiology, Biochemistry and Pharmacology, edited by M. P. Blaustein, p. 99-193
12. Host, H. H., P. A. Hansen, L. A. Nolte, M. M. Chen, and J. O. Holloszy (1998). Glycogen supercompensation masks the effect of a training-induced increase in GLUT-4 on muscle glucose transport. J Appl Physiol;. 85: 133-138
13. Houmard, J. A., M. H. Shinebarger, P. L. Dolan, N. Leggett-Frazier, R. K. Bruner, M. R. McCammon, R. G. Israel, and G. L. Dohm (1993). Exercise training increases GLUT-4 protein concentration in previously sedentary middle-aged men. Am J Physiol; 264 (Endocrinol. Metab. 27): E896-E901
14. Jeffress, R. N., J. B. Peter, and D. R. Lamb (1968). Effects of exercise on glycogen synthetase in red and white skeletal muscle. Life Sci; 7: 957-960
15. Kern, M., J. A. Wells, J. M. Stephens, C. W. Elton, J. E. Friedman, E. B. Tapscott, P. H. Pekala, and G. L. Dohm (1990). Insulin responsiveness in skeletal muscle is determined by glucose transporter (GLUT 4) protein level. Biochem J; 270: 397-440
16. Kuzuya, H., P. M. Blix, D. L. Horwitz, D. F. Steiner, and A. H. Rubenstein (1977). Determination of free and total insulin and C-peptide in insulin treated diabetics. Diabetes; 26: 22-29, (Abstract)
17. McCoy, M., J. Proietto, and M. Hargreaves (1996). Skeletal muscle GLUT-4 and postexercise muscle glycogen storage in humans. J Appl Physiol; 80: 411-415
18. Morgan, D. R., and A. Lazarow (1963). Immunoassay of insulin: two antibody system. Diabetes; 12: 115-126
19. Morgan, T. E., L. A. Cobb, F. A. Short, R. Ross, and D. R. Gunn (1971). Effect of long-term exercise on human muscle mitochondria. In: Muscle Metabolism During Exercise, edited by B. Pernow, and B. Saltin. New York: Plenum, p. 87-95
20. Nakatani, A., D.-H. Han, P. A. Hansen, L. A. Nolte, H. H. Host, R. C. Hickner, and J. O. Holloszy (1997). Effect of endurance exercise training on muscle glycogen supercompensation in rats. J Appl Physiol;. 82: 711-715
21. Passoneau, J. V., and V. R. Lauderdale (1974). A comparison of three methods of glycogen measurement in tissues. Anal Biochem; 60: 405-412
22. Passonneau, J. V., and O. H. Lowry (Editors) (1993). Enzymatic Analysis: A Practical Guide. Totowa, NJ: Humana
23. Ploug, T., B. M. Stallknecht, O. Pedersen, B. B. Kahn, T. Ohkuwa, J. Vinten, and H. Galbo (1990). Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle. Am J Physiol; 259 (Endocrinol. Metab. 22): E778-E786
24. Putman, C. T., N. L. Jones, E. Hultman, M. G. Hollidge-Horvat, A. Bonen, D. R. McConachie, and G. J. F. Heigenhauser (1998). Effects of short-term submaximal training in humans on muscle metabolism in exercise. Am J Physiol; 275 (Endocrinol. Metab. 38): E132-E139
25. Ren, J., B. A. Marshall, E. A. Gulve, J. Gao, D. W. Johnson, J. O. Holloszy, and M. Mueckler (1993). Evidence from transgenic mice that glucose transport is rate-limiting for glycogen deposition and glycolysis in skeletal muscle. J Biol Chem; 268: 16113-16115,(Abstract)
26. Ren, J.-M., C. F. Semenkovich, E. A. Gulve, J. Gao, and J. O. Holloszy (1994). Exercise induces rapid increases in GLUT4 expression, glucose transport capacity, and insulin-stimulated glycogen storage in muscle. J Biol Chem; 269: 14396-14401,(Abstract)
27. Rodnick, K. J., E. J. Henriksen, D. E. James, and J. O. Holloszy (1992). Exercise training, glucose transporters, and glucose transport in rat skeletal muscles. Am J Physiol; 262 (Cell Physiol. 31): C9-C14
28. Saltin, B., and P. D. Gollnick (1983). Skeletal muscle adaptability: significance for metabolism and performance. In: Handbook of Physiology. Skeletal Muscle. Bethesda, MD: Am. Physiol. Soc., sect.10, chapt.19, p.555-631
29. Shah, S. D., W. E. Clutter, and P. E. Cryer (1985). External and internal standards in the single isotope derivative (radioenzymatic) assay of plasma norepinephrine and epinephrine in normal humans and patients with diabetes mellitus or chronic renal failure. J Lab Clin Med; 106: 624-629
30. Taylor, A. W., R. Thayer, and S. Rao (1972). Human skeletal muscle glycogen synthetase activities with exercise and training. Can J Physiol Pharmacol; 50: 411-415
31. Uyeda, K., and E. Racker (1965). Regulatory mechanisms in carbohydrate metabolism. VII. Hexokinase and phosphofructokinase. J Biol Chem;. 240: 4682-4688