El ejercicio induce diferentes respuestas moleculares en músculos humanos entrenados y no entrenados
Publicado 8 de diciembre de 2020, 12:09
Mantener o aumentar la masa y la fuerza muscular se asocia con un riesgo reducido de discapacidad motriz, enfermedad cardiovascular, diabetes tipo 2 y cáncer (McLeod 2016). En esto, el entrenamiento de fuerza tiene un papel clave en el desarrollo muscular y es un componente crítico de un envejecimiento saludable. Dado que el músculo esquelético generalmente se vuelve más resistente al estímulo de crecimiento con la edad, lo que se acompaña de una pérdida gradual de masa muscular y fuerza (Burd 2013), se sugiere que el entrenamiento de la fuerza debe iniciarse en la edad adulta temprana y posteriormente mantenerse. Esta noción se ejemplifica cuando se descubre que los atletas expertos tienen una aptitud muscular comparable a la de los adultos jóvenes (McKendry 2018). Es importante destacar que también se argumenta que si los individuos han tenido un historial de entrenamiento de la fuerza antes de un período de menos o ningún entrenamiento, la masa muscular vuelve a crecer más rápidamente, o en mayor medida, con un nuevo estímulo de entrenamiento (Ogasawara 2013, Staron 1991, Seaborne 2018). Los datos indican, en otras palabras, que el músculo previamente entrenado es más sensible a nuevos estímulos o posee una "memoria".
El proceso de hipertrofia muscular es impulsado por la estimulación aguda de los procesos de transcripción y traslación en la fibra muscular después de cada sesión de ejercicios de fuerza. Más específicamente, esto se relaciona con un objetivo mecanicista de la estimulación de la síntesis de proteínas dependiente del complejo de rapamicina 1 (mTORC1) (Goodman 2011), así como con la expresión inducida de genes relacionados con la estructura muscular, la miogénesis, el recambio de proteínas, la matriz extracelular y la angiogénesis (Liu 2010). Durante la hipertrofia, la eficiencia de los resultados y la capacidad de traducción del ARNm y la transcripción de los genes también se ven influenciadas por la adición mionuclear inducida por células satélite (Adams 2006), la biogénesis ribosómica (Stec 2016) y las modificaciones epigenéticas (Seaborne 2018). Con respecto a la existencia de una “memoria muscular”, se ha prestado mucha atención a los aumentos en el contenido mionuclear inducidos por el entrenamiento de la fuerza, núcleos que se conservan durante la atrofia y pueden permitir una rápida hipertrofia a la sobrecarga (Bruusgaard 2010, Egner 2013, Lee 2018). Sin embargo, la evidencia científica actual de tal memoria se limita a modelos animales y aún no se ha demostrado en humanos (Psilander 2019)
Numerosos estudios han demostrado que el entrenamiento continuo tiene un efecto claro sobre el grado de respuesta de señalización celular aguda inducida por el ejercicio, la expresión génica y la tasa de síntesis de proteínas después del tipo de ejercicio de fuerza y resistencia (Ogasawara 2013, Wilkinson 2008, Kim 2005). Aunque la mayoría de estos estudios han demostrado una atenuación general de la respuesta molecular aguda, algunos estudios han demostrado que algunos procesos moleculares pueden sensibilizarse. Los mecanismos que subyacen a estas respuestas agudas alteradas después de un período de entrenamiento, y la cuestión de que si estas alteraciones se conservan después de un período de desentrenamiento aún están por determinarse. Sin embargo, las modificaciones epigenéticas pueden influir. Seaborne y cols. (2018) demostró recientemente que las modificaciones epigenéticas inducidas por el entrenamiento de la fuerza se mantienen después de 7 semanas de desentrenamiento y podrían explicar parcialmente la respuesta hipertrófica aumentada a la re-sobrecarga. Por el contrario, Lindholm y cols. (2016) no encontraron diferencias en el transcriptoma inducidas por el entrenamiento de la resistencia entre las piernas previamente entrenadas y no entrenadas después de un período de desentrenamiento de 40 semanas.
Aunque los estudios de Lindholm y cols. (2016) y Seaborne y cols. (2018) han proporcionado datos importantes sobre la memoria muscular inducida por el entrenamiento en el músculo esquelético humano en reposo, ningún investigador ha explorado el potencial de una memoria muscular en relación con la expresión génica aguda inducida por el ejercicio y la respuesta de señalización celular.
Es decir, se cree que el músculo esquelético humano tiene una mayor sensibilidad al estímulo del ejercicio cuando ha sido previamente entrenado (es decir, posee "memoria muscular"). Recientemente, Marcus Moberg, de la The Swedish School of Sport and Health Sciences (Suecia), investigó a través de un estudio, si la expresión génica basal y aguda inducida por el ejercicio de fuerza y los eventos de señalización celular están influenciados por el historial previo de entrenamiento de la fuerza.
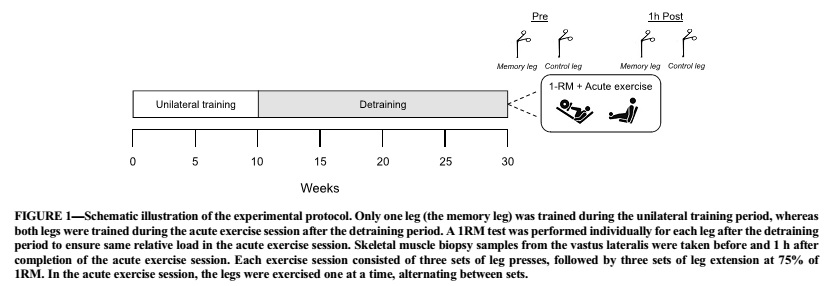
En consecuencia, en ese estudio, mujeres y hombres jóvenes y completamente desentrenados se sometieron a un programa de entrenamiento de la fuerza unilateral de piernas de 10 semanas seguido de un período de desentrenamiento de 20 semanas. Este período fue seguido de una sesión de entrenamiento de fuerza aguda que involucró tanto a las piernas previamente entrenadas como a las no entrenadas (control). Se recogieron muestras de biopsia de músculo esquelético en reposo y 1 h después del ejercicio para determinar la expresión génica, el contenido de proteínas y el estado de fosforilación de las proteínas tanto basales como las inducidas por el ejercicio, que se sabe que responden de forma aguda a los estímulos del entrenamiento de la fuerza. Se planteó la hipótesis de que las piernas previamente entrenadas y no entrenadas mostrarían diferencias, lo que indica cambios cualitativos de larga duración en la maquinaria molecular que regula las adaptaciones musculares al ejercicio de fuerza.
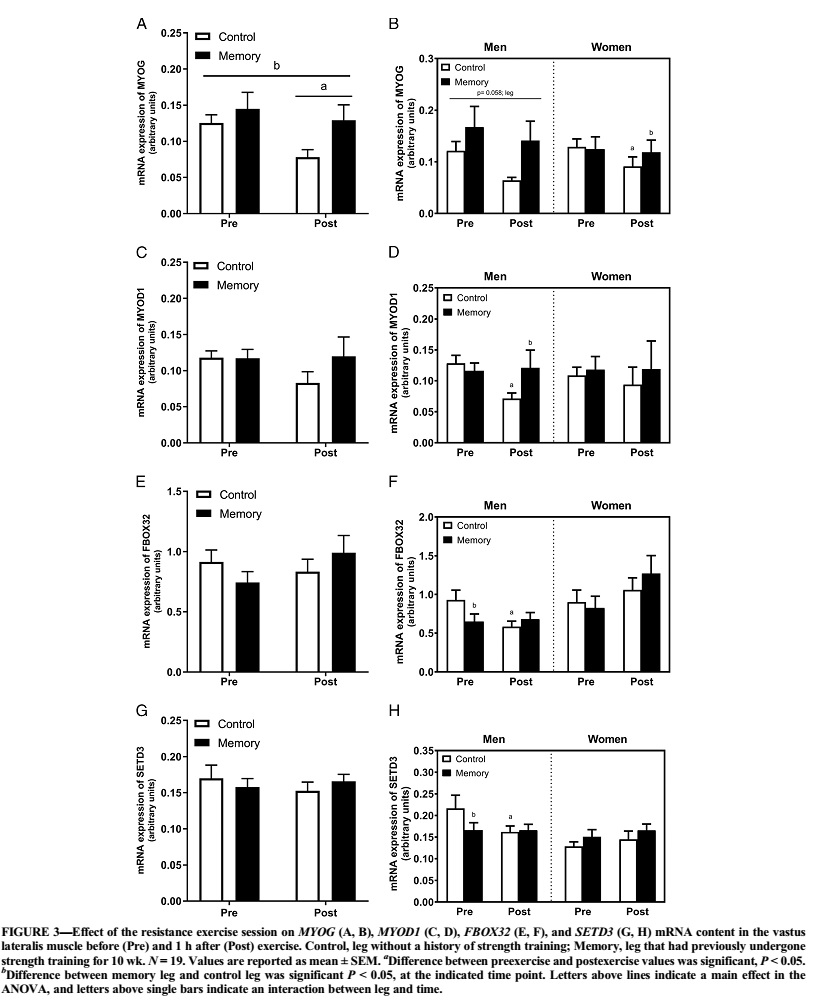
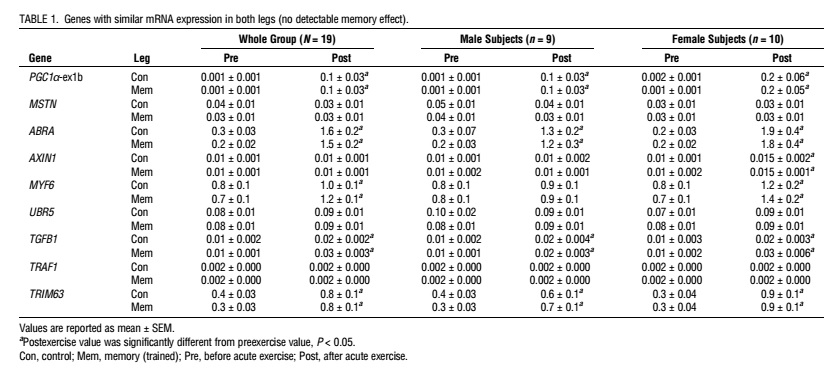
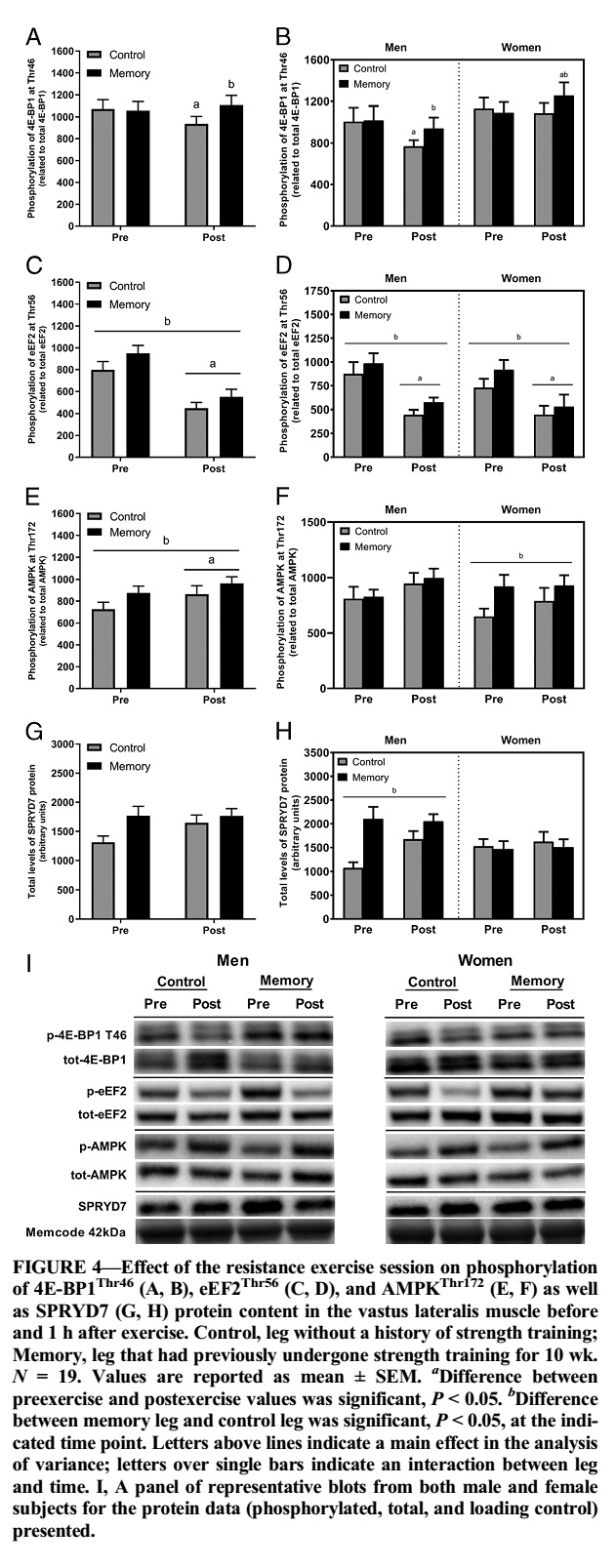
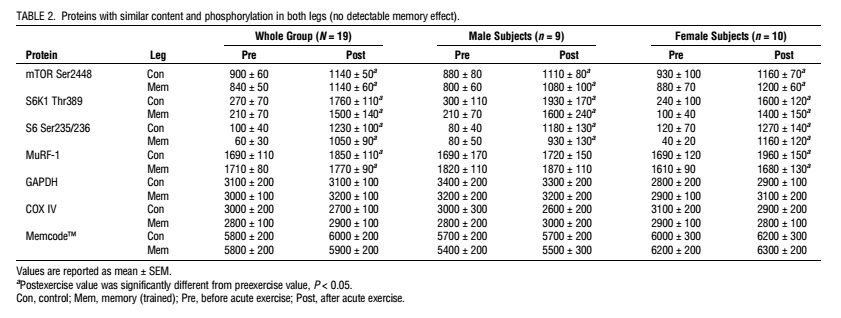
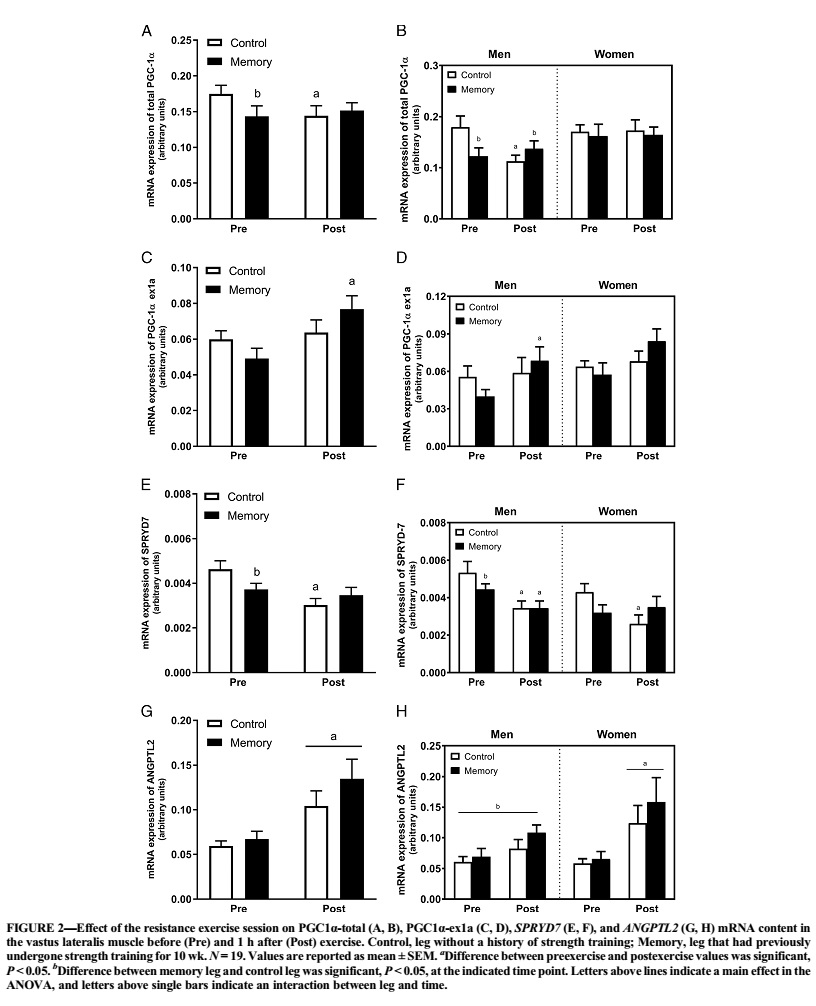
La fosforilación de la AMPKThr172 y eEF2Thr56 fue mayor en la pierna con memoria que en la de control en ambos puntos de tiempo. La fosforilación posterior al ejercicio de la 4E-BP1Thr46 y Ser65 fue mayor en la pierna con memoria que en la pierna de control. La pierna con memoria tenía niveles de ARNm basal más bajos de la PGC1α total y, a diferencia de la pierna de control, exhibía aumentos en las transcripciones de la PGC1α-ex1a después del ejercicio. En los genes relacionados con la miogénesis (SETD3, MYOD1 y MYOG), los niveles de ARNm diferían entre la pierna con memoria y la pierna desentrenada; estos efectos fueron evidentes principalmente en los sujetos masculinos. La expresión del nuevo gen SPRYD7 fue menor en la pierna con memoria en reposo y disminuyó después del ejercicio sólo en la pierna de control, pero los niveles de proteína SPRYD7 fueron más altos en la pierna con memoria.
En conclusión, varios genes y proteínas reguladoras clave involucrados en las adaptaciones musculares al ejercicio de fuerza están influenciados por el historial del entrenamiento previo. Aunque la relevancia y la explicación por mecanismos de estos hallazgos necesitan más investigación, respaldan el punto de vista de una memoria muscular molecular en respuesta al entrenamiento. Esta noción está respaldada por datos previos que indican que los procesos moleculares en el músculo entrenado están regulados via ascendentes y regulados vías descendentes y enfatiza que el efecto del historial de entrenamiento debe evaluarse de una manera específica de genes y proteínas. En conjunto, estos resultados indican que algunas de las características moleculares del músculo entrenado con la fuerza pueden conservarse después de 20 semanas de desentrenamiento. La relevancia práctica de estos hallazgos, así como los mecanismos moleculares que explican las alteraciones sostenidas, claramente justifican una mayor investigación.