Embarazo y postparto: afectación muscular abdominal, obesidad y diabetes
Publicado 4 de febrero de 2015, 13:06
IICEFS
Fernando Mata
Raúl Domínguez
Guillermo Peña
Juan R. Heredia
Aunque a día de hoy la realización de ejercicio físico durante el embarazo se considera una recomendación para todas las mujeres en dicha etapa fisiológica de la vida (Artal y O´Tole, 2003; Wolfe y Mottola, 2002), esto no siempre ha sido así (Smith y Campbell, 2013). De hecho, en el año 1985 desde el Colegio Americano de Obstetras y Ginecólogos se puso limitaciones en relación a la práctica de ejercicio físico durante el embarazo, limitando la duración a 15 minutos consecutivos y la intensidad de ejercicio a un máximo de 140 pulsaciones/minuto (ACOG, 1985). Sin embargo, dichas restricciones se fueron eliminando en posteriores posicionamientos, limitando las mismas en cuanto a duración e intensidad (ACOG, 1994). Más adelante, las recomendaciones sobre la práctica de ejercicio se extenderían también al grupo de mujeres que fueran previamente sedentarias al embarazo (ACOG, 2002). Muchas de las consideraciones generales a este respecto ya fueron abordadas con antelación (Ejercicio físico y embarazo: ¿es realmente saludable para ambos?; Ejercicio físico de fuerza durante el embarazo y postparto) y se realizó un webinar específico sobre ello (webinar)
Musculatura abdominal durante el embarazo y postparto.
Algunos de los problemas más comunes asociados al embarazo y al parto son el dolor lumbar, el dolor en la región de la cintura pélvica, la diástasis del recto abdominal, un pobre control de la musculatura abdominal profunda, y problemas respiratorios, entre otros. El dolor lumbar suele incrementar en prevalencia e intensidad a lo largo del embarazo, especialmente en el tercer trimestre (Yoo et al., 2015). El dolor en la región de la cintura pélvica tiene una prevalencia de aproximadamente el 45% durante la gestación y del 20-25% al comienzo del periodo del postparto (Lee y col., 2008).
Otros problemas de índole uroginecológico son la incontinencia urinaria y fecal, y los prolapsos de órganos internos, que además están relacionados con el dolor lumbar y desórdenes respiratorios (Smith y col., 2006). Lee y col. (2008)comentan que el 45% de las mujeres experimentaron incontinencias urinarias 7 años después del parto y que un 27% que eran inicialmente incontinentes al comienzo del postparto recuperaron la continencia, mientras que un 31% que eran continentes se volvieron incontinentes. La disfunción postparto de la musculatura del suelo pélvico o periné es una afectación muscular del embarazo y del parto que puede explicar tales síntomas. Pero dicha musculatura no sólo tiene un papel crucial en la función uroginecológica, sino también en la estabilidad del tronco y respiración (Hodges y col., 2007), por lo que la integración de su activación conjunta con el resto de la musculatura abdominal debería ser una consigna que enseñar y practicar en los programas preventivos y rehabilitadores.
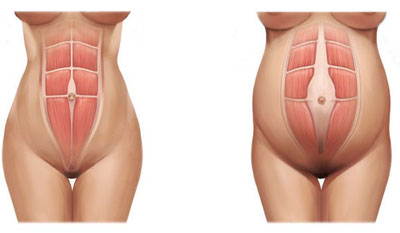
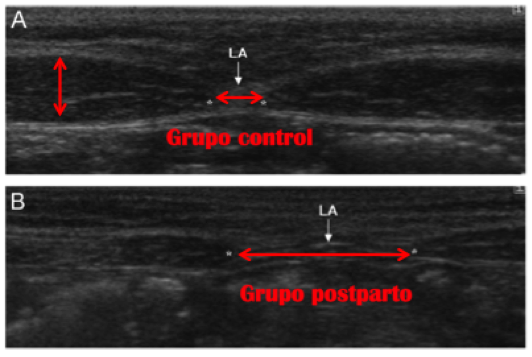
De forma paralela, a medida que se desarrolla el feto en el vientre materno la pared abdominal se expande y protruye, por lo que el recto abdominal tiene que elongarse a lo ancho y largo. Los dos vientres abdominales del recto se curvan alrededor del abdomen separándose entre sí, especialmente a la altura del ombligo, por lo que irremediablemente la línea alba se ve particularmente afectada.Esta brecha o separación que se crea suele denominarse “diástasis o divergencia del recto”. La distancia de los vientres del recto abdominal entre sí a nivel de la línea alba (distancia inter-rectos) puede variar sustancialmente.La distancia, medida habitualmente mediante ultrasonidos, a partir de la cual puede considerarse anómala varía de unos autores a otros, aunque puede considerarse que la normalidad no debería ser mayor de 2,7 cm. (Rath y col., 1996).Por tanto, esta separación cuando no es patológica puede variar de 2 a 3 cm. de ancho aproximadamente, y de 2 a 5 cm. de largo hasta 20 cm. ancho a lo largo de toda la longitud del recto abdominal (Polden y Mantle, 1990). Esta afectación músculo-fascial presenta una incidencia en las mujeres del 27% en el segundo trimestre y del 66% en el tercer trimestre, de las cuales el 53% continuaron teniendo diástasis inmediatamente después del parto (Boissanault y Blaschak, 1988).
Algunos estudios como el de Coldron y col. (2008) han observado mediante escáner de ultrasonidos que 12 meses después del parto el recto abdominal seguía siendo más delgado, ancho y largo que en los controles, y que la distancia inter-rectos promedio era de 2,3 cm. (las mediciones variaban entre 1,2 cm. y 4,2 cm., con una tercera parte de las mujeres presentando una separación más ancha que la media). Uno de los factores de riesgo que se asocian a dicha separación excesiva entre rectos es la ausencia de práctica de ejercicio físico pre y perinatal.De hecho, aunque la mismapueda reponerse parcialmente entre el primer día y la 8ª semana postparto, si no hay ninguna intervención de ejercicio este cierre no muestra mejoras al final del primer año (Coldron y col., 2007).
Ante estas evidencias parece incuestionable inferir que la diástasis de los rectos durante y después del embarazo pueda afectar el soporte y rigidez del tronco, y por tanto suponer una desventaja mecánica para poder transferir fuerzas eficazmente. De hecho, la participación sinérgica y coordinada de todos los músculos del core/tronco es necesaria para poder transferir las cargas de forma eficaz y segura a través del complejo lumbo-pélvico y garantizar la estabilidad del raquis (McGill y col, 2003), de modo que la afectación de cuºalquier eslabón (músculo) podrá afectar su estabilidad.Coldron y col. (2008) comentan, a raíz de la diástasis, que los cambios en la rigidez podrían conllevar un desequilibrio muscular y por tanto una pobre coordinación con los otros músculos abdominales debido a su interconexión con el recto anterior a través de la aponeurosis circundante y de la línea alba.Además, una de las alteraciones comunes en el postparto es el sobreuso del oblicuo externo y la infra utilización de la musculatura abdominal profunda (v.g.: Transverso abdominal) (Lee y col., 2008). Dicho todo esto parece obvio tratar mediante un programa de entrenamiento la musculatura del core, con el propósito de recuperar el “timing” (ajuste temporal de la respuesta) y la co-activación conjunta entre del transverso abdominal con el suelo pélvico.

Ejercicio físico y obesidad durante el embarazo.
Los valores de sobrepeso en la mujer embarazada se han asociado con un mayor riesgo de sufrir partos prematuros, hipertensión y diabetes gestacional (Callaway y col., 2006; Doherty y col., 2006). Para el bebé se han registrado un mayor riesgo de muerte perinatal, anomalías congénitas, lesiones en el parto y macrosomia (Callaway y col., 2006; Doherty y col., 2006; Martínez-Frías y col., 2005; Henriksen, 2006). Además, en la actualidad cada día cobran más importancia las teorías que postulan que gran parte del riesgo de sufrir enfermedad metabólica en la edad adulta están determinadas por las exposiciones que ocurren en el período perinatal (Ryckman y col., 2013).

Durante el embarazo se ha venido observando que se produce un descenso en la actividad física diaria, siendo las mujeres embarazadas más inactivas (Gaston y Carmp, 2011). Dado que la actividad física incluye mejoras a nivel cardiovascular, de tolerancia a la glucosa, en el remodelado óseo y muscular, así como en la reducción del sobrepeso y la obesidad como de sus complicaciones (Clapp, 2008; Adamu, Sani y Adamu, 2006), no es de extrañar que desde distintas instituciones se dicten directrices para realizar 30 minutos de ejercicio de intensidad moderada la mayoría de días (Egger y col., 2001), alentando a este grupo poblacional a participar en programas sistemáticos de ejercicio con objeto de mantener la condición física a lo largo del embarazo (Sui y Dodd, 2013).
Y es que, en base a distintos estudios de intervención, se ha observado un menor incremento del peso corporal en mujeres que se someten a lo largo de los tres trimestres del embarazo a un programa sistemático de ejercicio aeróbico (Kramer, 2002; Claesson y col., 2011; Huang, Yeh y Tsai, 2011; Asbee y col., 2009), así como menores incrementos en los pliegues cutáneos (Márquez-Sterling y col., 2000). De este modo, se reduciría el riesgo de sufrir diabetes gestacional, hipertensión, parto por cesárea, nauseas, ardor de estómago, insomnio, calambres en las piernas y un control de la masa corporal (Morris y Johnson, 2005).
Por último, indicar que habría que restringir las ganancias de peso durante el embarazo hasta llegar a rangos situados entre 11,4 y 15,9 kg en las mujeres con normopeso antes de quedar embarazadas y a franjas de entre 6,8 y 11,4 kg en las mujeres con obesidad antes del embarazo (Lederman, 1993; Parker y Abrams, 1992). Además, una observación importante es que incrementos de peso por encima de estos rangos harían que la retención de peso postembarazo sea el doble con respecto a ganancias situadas dentro de las recomendaciones (Abrams, Altman y Pickett, 2000). De hecho, siempre habría que controlar el incremento de peso durante el ambarazo, pues podría contribuir al desarrollo de la obesidad en mujeres jóvenes (Haakstad y Bo, 2011).
Ejercicio físico y diabetes gestacional
Una de las complicaciones que pueden surgir durante el embarazo -y que suele asociarse con el grado de actividad física, el sobrepeso (Linné, 2004) y la obesidad (Blanco y col., 1998)- es la diabetes gestacional (Sui y Dodd, 2013), que se define como cualquier grado de intolerancia a la glucosa que conlleva a una hiperglucemia en la mujer embarazada (American Diabetes Association, 2003). La gravedad de la diabetes gestacional radica en que se trata de un factor de riesgo, tanto para la madre como para el hijo, de sufrir hospitalizaciones, desarrollar obesidad, sufrir diabetes tipo 2 y accidentes cardiovasculares en el futuro (Bellami y col., 2009; Ekelund y col., 2009; O´Reilly y col., 2010; O´Reilly y col., 2011; Vääräsmäki y col., 2009).
La resistencia a la insulina, alteración hormonal que disminuye la captación de glucosa por parte de los músculos (Artal, 2003) podría ser importante para favorecer el crecimiento fetal (Golbidi y Laher, 2013).

De los factores causantes de la diabetes gestacional se ha establecido que cada unidad incrementada en el índice de masa corporal previo al embarazo incrementa casi un 1% la posibilidad de sufrir diabetes gestacional (Torloni y col., 2009). Además, a corto plazo se podría producir una disfunción de las células beta pancreáticas debido a la hipersecreción de insulina (Catalano y col., 1993) que puede incrementarse en las mujeres con diabetes gestacional hasta en un 250% veces los valores normales para mantener la glucemia estable (Metzger y col., 2007).
En las personas en estadios previos a desarrollar diabetes tipo 2 se ha observado que disminuciones en la masa corporal y en el perímetro de la cintura reducen el riesgo de desarrollar esta alteración metabólica (Infanti y col., 2013; Moore y col., 2011).
Además de los posibles efectos del ejercicio en la regulación de la composición corporal, entre los beneficiosos del ejercicio a este nivel estarían mediados por el efecto del entrenamiento sobre la enzima GLUT-4 que, ante la disponibilidad de glucosa y por mediación de la insulina captará glucógeno a nivel muscular (Domínguez, 2012). A nivel general, se observa una asociación entre los niveles de GLUT-4 y la capacidad oxidativa (Krainou y col., 2000) explicando en parte por qué la población deportista es capaz de captar mayores cantidades de glucógeno y en un menor tiempo (Greiwe y col., 1999). Estas adaptaciones serían las que explicarían por qué el ejercicio mejoraría la función de la insulina y la tolerancia a la glucosa no solo en individuos sanos (King y col., 1987) sino que, también en sujetos con obesidad (Goodpaster, Katsiaras y Kelley, 2003) y con diabetes (Bruce y col., 2004; Poirier y col., 2002).
En relación con la diabetes gestacional concretamente se ha observado como un programa de ejercicio aeróbico de únicamente 3 sesiones semanales al 50% VO2 máximo resulta suficiente para mantener la euglucemia sin necesidad de recurrir a una terapia con insulina (Bung y col., 1991).También, otros estudios han podido comprobar que el ejercicio de fuerza con intensidad moderada tiene efectos positivos sobre el control glucémico en mujeres con sobrepeso y diabetes gestacional (De Barros y col.,2010; Grabielle y col., 2004; Brankston y col., 2004).
Se ha indicado que participar en un programa de ejercicio sistemático durante las primeras 20 semanas de embarazo reduce en un 50% la posibilidad de sufrir diabetes gestacional (Dempsey y col., 2004). Así mismo, en cuanto a la actividad física realizada en los fases previos al embarazo, indicar que ésta se ha relacionado con un efecto preventivo a la hora de desarrollar este desorden hormonal (Golbidi y Laher, 2013), como ha sido recientemente confirmado en un metaanálisis acerca de la realización de ejercicio físico durante el embarazo y el riesgo de sufrir diabetes gestacional (Yin y col., 2013).
Referencias bibliográficas.
1.Abrams, B., Altman, S.L. y Pickett, K.E. (2000). Pregnancy weight gain: still controversial. American Journal of Clinical Nutrition, 71, 1233S–1241S.
2.Adamu, B. y Sani, M.U. (2006). Abdu A. Physical exercise and health: a review. Nigerian Journal of Medicine, 15(3),190–196.
3.American College of Obstetrics and Gynecology (ACOG) (1985). Technical Bulletin: Exercise During Pregnancy and the Postnatal Period. ACOG: Washington.
4.American College of Obstetrics and Gynecology (ACOG) (1994). ACOG Technical Bulletin Number 189: exercise during pregnancy and the postpartum period,” International Journal of Gynaecology and Obstetrics, 45(1), 65–70.
5.American College of Obstetrics and Gynecology (ACOG) (2002). Committee opinion number 267: exercise during pregnancy and the postpartum period. Obstetrics and Gynecology, 99 (1), 171–173.
6.American Diabetes Association (2003). Position statements: gestational diabetes mellitus. Diabetes Care, 26(1), 103–105.
7.Artal, R. (2003). Exercise: the alternative therapeutic intervention for gestational diabetes. Clinical Obstetrics and Gynecology, 46 (2), 479–487.
8.Artal, R. y O’Toole, M. (2003). Guidelines of the american college of obstetricians and gynecologists for exercise during pregnancy and the postpartum period. British Journal of Sports Medicine, 37, 6-12.
9.Boissonnault, J.S., Blaschak, M.J., (1988). Incidence of diastasis recti abdominis during the childbearing year. Physical Therapy 68, 7.
10.Asbee, S.M., Jenkins, T.R., Butler, J.R., White, J., Elliot, M. y Rutledge, A. (2009). Preventing Excessive Weight Gain During Pregnancy Through Dietary and Lifestyle Counseling:A Randomized Controlled Trial. Obstetrics and Gynecology, 113, 305–12.
11.Bellamy, L., Casas, J.P., Hingorani, A.D. y Williams, D. (2009). Type 2 diabetes mellitus after gestational diabetes: a systematic review and meta-analysis. Lancet, 373, 1773–1779.
12.Blanco, A.T., Semilen, S.W., Davis, Y., Lopez, S., Lapinski, R. Lockwood, C.J. (1998). Pregnancy outcome and weight gain recommendations for the morbidly obese women, Obstetrics and Gynecology, 91 (1), 97–102.
13.Brankston GN, Mitchell BF, Ryan EA, Okun NB. (2004). Resistance exercise decreases the need for insulin in overweight women with gestational diabetes mellitus. Am J Obstet Gynecol. 190:188–193.
14.Bruce, C.R., Kriketos, A.D., Cooney, G.J. y Hawley, J.A. (2004). Disassociation of muscle triglyceride content and insulin sensitivity after exercise training in patients with Type 2 diabetes. Diabetologia, 47 (1), 23–30.
15.Bung, P., Artal, R., Khodiguian, N. y Kjos, S. (1991). Exercise in gestational diabetes: an optional therapeutic approach? Diabetes, 40 (2), 182–185.
16.Callaway, L.K., Prins, J.B., Chang, A.M. y McIntyre, H.D. (2006). The prevalence and impact of overweight and obesity in an Australian obstetric population. Medical Journal of Australia, 184 (2), 56–59.
17.Catalano, P.M., Tzybir, E.D., Wolfe, R.R., Calles, J., Roman, N.M., Amini, S.B. y Sims, E.A. (1993). Carbohydrate metabolism during pregnancy in control subjects and women with gestational diabetes,” American Journal of Physiology, 264, 60–67.
18.Claesson, I., Sydsjö, G., Brynhildsen, J., Blomberg, M., Jeppsson, A., Sydsjö, A. y Josefsson, A. (2011). Weight after childbirth: A 2-year follow-up of obese women in a weight-gain restriction program. Acta Obstetricia et Gynecologica Scandinavica, 90(1), 103-110.
19.Clapp, J.F. (2008). Long-term outcome after exercising throughout pregnancy: fitness and cardiovascular risk. American Journal of Obstetrics and Gynecology, 189 (5), 489.
20.Coldron Y, Stokes MJ, Newham DJ, Cook C. Postpartum characteristics of rectus abdominis on ultrasound imaging. Manual Therapy 13 (2008): 112-121.
21.Dempsey, J.C. Butler, C.L., Sorensen, T.K., Lee, I.M., Thompson, M.L., Frederick, I.O. y Williams, M.A. (2004). A casecontrol study of maternal recreational physical activity and risk of gestational diabetes mellitus,” Diabetes Research and Clinical Practice, 66 (2), 203–215.
22.De Barros MC, Lopes MA, Francisco RP, Sapienza AD, Zugaib M. (2010). Resistance exercise and glycemic control in women with gestational diabetes mellitus. Am J Obstet Gynecol. 203(6):556 e1-6.
23.Doherty, D.A., Magann, E.F., Francis, J., Morrison, J.C. y Newnham, J.P. (2006). Pre-pregnancy body mass index and pregnancy outcomes. International Journal of Gynaecology and Obstetrics, 95 (3),242–247.
24.Domínguez, R. (2012). Necesidades de hidratos de carbono en el deportista de resistencia. Motricidad Humana, 13 (1), 60-66.
25.Egger, G., Donovan, R.J., Giles-Corti, B., Bull, F. y Swinburn, B. (2001). Developing national physical activity guidelines for Australians. Australian and New Zeland Journal of Public Health, 25(6), 561–563.
26.Ekelund, U., Brage, S., Griffin, S.J. y Wareham, N.J. (2009). Objectively measured moderate- and vigorous-intensity physical activity but not sedentary time predicts insulin resistance in high-risk individuals. Diabetes Care, 32, 1081–1086.
27.Gabrielle N, Brankston BF, Mitchell MD, Edmond A, Ryan MD, Nanette B, Okun MD. (2004). Resistance exercise decreases the need for insuline in overweight women with gestational diabetes mellitus. American Journal of Obstetrics and Gynecology 190, 188-93.
28.Gaston, A. y Cramp, A. (2011). Exercise during pregnancy: a review of patterns and determinants. Journal of Science and Medicine Sport, 14, (4), 299–305.
29.Goodpaster, B.H., Katsiaras, A. y Kelley, D.E. (2003). Enhanced fat oxidation through physical activity is associated with improvements in insulin sensitivity in obesity. Diabetes, 52 (9), 2191–2197.
30.Golbidi, S. y Laher, I. (2013). Potential mechanisms of exercise in gestational diabetes. Journal of Nutrition and Metabolism, 16.
31.Greiwe, J.S., Hickner, R.C., Hansen, P.A., Racette, S.B., Chen, M.M. y Holloszy, J.O. (1999). Effects of endurance exercise training on muscle glycogen accumulation in humans. Journal of Applied Physiology, 78, 288-292.
32.Haakstad, L.A. y Bo, K. (2011). Effect of regular exercise on prevention of excessive weight gain in pregnancy: a randomised controlled trial. European Journal of Contraception and Reproductive Health Care, 16(2), 116-25.
33.Henriksen, T. (2006). Nutrition and pregnancy outcome. Nutrition Review, 64(5), 19–23.
34.Huang, T., Yeh, C. y Tsai, Y. (2011). A diet and physical activity intervention for preventing weight retention among Taiwanese childbearing women: A randomised controlled trial. Midwifery, 27, 257–264.
35.Infanti, J., Dunne, F.P., O´Dea, A., Gillespie, P., Gibson, I., Glynn, L.G., Noctor, E., Newells, J. y McGuire, B. (2013). An evaluation of Croí MyAction community lifestyle modification programme compared to standard care to reduce progression to diabetes/pre-suabetes in women with prior gestational diabetes mellitus (GDM): study protocol for a randomised controlled trial. Trials Journal, 14 (121).
36.King, D.S., Dalsky, G.P., Staten,M.A., Clutter, W.E., Van Houten, D.R. y Holloszy, J.O. Insulin action and secretion in endurance-trained and untrained humans. Journal of Applied Physiology, 63 (6), 2247–2252.
37.Krainou, Y., Cameron-Smith, D., Misso, M., Collier, G. y Hargreaves, M. (2000). Effects of exercise on GLUT-4 and glycogening gene expression in human skeletal muscle. Journal of Applied Physiology, 88, 794-796.
38.Kramer, M.S. (2002). Aerobic exercise for women during pregnancy. Cochrane Database of Systematic Reviews, 2, CD000180.
39.Lederman, S.A. (1993). Recent issues related to nutrition during pregnancy. Journal of the American College of Nutrition, 12, 91-100.
40.Hodges, P., Sapsford, R., Pengel, L. Postural and respiratory functions of the pelvic floor muscles. Neurology and Urodynamics 2007, 26, 362.
41.Lee D G, Lee LJ, McLaughlin L. Stability, continence and breathing - The role of fascia in both function and dysfunction and the potential consequences following pregnancy and delivery. Journal of Bodywork and Movement Therapies 2008,12, 333-348.
42.Linne, Y. (2004). Effects of obesity on women’s reproduction andcomplications during pregnancy. Obesity Reviews, 5 (3), 137–143.
43.McGill SM, Grenier S, Kavcic N, Cholewicki J. (2003) Coordination of muscle activity to assure stability of the lumbar spine. J Electromiograph Kinesiolo. 13(4): 353-9.
44.Marquez-Sterling, S., Perry, A.C., Kaplan, T.A., Halberstein, R.A. y Signorile, J.F. (2000). Physical and psychological changes with vigorous exercise in sedentary primigravidae. Medicine and Science in Sports and Exercise, 32, 58-62.
45.Martínez-Frias, M.L., Frias, J.P., Bermejo, E., Rodriguez-Pinilla, E., Prieto, L. y Frias, J.L. (2005). Pre-gestational maternal body mass index predicts an increased risk of congenital malformations in infants of mothers with gestational diabetes. Diabetic Medicine, 22 (6), 775–781.
46.Metzger, B.E., Buchanan, T.A., Coustan, D.R., de Leiva, A., Dunger, D.B., Hadden, D.R., Hod, M., Kitzmiller, J.L., Kjos, S.L., Oats, J.N., Pettitt, S., Sackis, D.A. y Zoupas, C. (2007). Summary and recommendations of the Fifth International Workshop-Conference on Gestational Diabetes Mellitus. Diabetes Care, 30 (2), 251–260.
47.Moore, S.M., Hardie, E.A., Hackworth, N.J., Critchley, C.R., Kyrios, M., Buzwell, S.A. y Crafti, N.A. (2011). Can the onset of type 2 diabetes be delayed by a group-based lifestyle intervention? A randomised control trial. Psychology Health, 26, 485–499.
48.Morris, S.N. y Johnson, N.R. (2005). Exercise during pregnancy: a critical appraisal of the literature. Journal of Reproductive Medicine, 50, 181-188.
49.O’Reilly, M.W., Avalos, G., O’Sullivan, E.P., Dennedy, M.C. y Dunne, F. (2010). High prevalence of metabolic syndrome postpartum associated with adverse maternal outcomes in women with gestational diabetes. Irish Journal of Medical Science, 179 (13), 523.
50.O’Reilly, M.W., Avalos, G., Dennedy, M.C., O’Sullivan, E.P. y Dunne, F. (2011). Atlantic DIP: high prevalence of abnormal glucose tolerance post partum is reduced by breast-feeding in women with prior gestational diabetes mellitus. European Journal of Endocrinology, 165, 953–959.
51.Parker, J.D. y Abrams, B. (1992). Prenatal weight gain advice: an examination of the recent prenatal weight gain recommendations of the Institute of Medicine. Obstetrics and Gynecology, 79, 664.
52.Poirier, P., Tremblay, A., Broderick, T., Catellier, C., Tancrède, G. y Nadeau, A. (2002). Impact of moderate aerobic exercise training on insulin sensitivity in type 2 diabetic men treated with oral hypoglycemic agents: is insulin sensitivity enhanced only in nonobese subjects? Medical Science Monitor, 8 (2), 59–65.
53.Ryckman, K.K., Borowski, K.S., Parikh, N.I. y Saftlas, A.F. (2013). Pregnancy complications and the risk of metabolic syndrome for the offspring. Current Cardiovascular Risk Reports, 7 (3), 217-223.
54.Polden M, Mantle J. Physiotherapy in obstetrics and gynaecology. Oxford: Butterworth Heinemann; 1990. p. 222–80 [Chapter 7].
55.Rath, A.M., Attali, P., Dumas, J.L., et al., 1996. The abdominal linea alba: an anatomo-radiologic and biomechanical study. Surgical Radiologic Anatomy 18, 281–288.
56.Smith, K.M. y Campbell, C.G. (2013). Physical activity during pregnancy: Impact of applying different physical activity guidelines. Journal of Pregnancy, 1-9.
57.Smith, M.D., Russell, A., Hodges, P.W., 2006a. Disorders of breathing and continence have a stronger association with back pain than obesity and physical activity. Australian Journal of Physiotherapy 52, 11.
58.Sui, Z. y Dodd, J.M. (2013). Exercise in obese pregnant women: positive impacts and current perceptions. International Journal of Women´s Health, 5, 289-298.
59.Torloni, M.R., Betrán, A.P. y Horta, B.L., Nakamura, M.U., Atallah, A.N., Moron, A.F. y Valente, O. (2009). Prepregnancy BMI and the risk of gestational diabetes: a systematic review of the literature with meta-analysis: diagnostic in Obesity and Complications. Obesity Reviews, 10 (2), 194–203.
60.Vääräsmäki, M., Pouta, A., Elliot, P., Tapanainen, P., Sovio, U., Ruokonen, A., Hartikainen, A.L., McCarthy, M. y Järvelin, M.R. (2009). Adolescent manifestations of metabolic syndrome among children born to women with gestational diabetes in a general-population birth cohort. American Journal of Epidemiology, 169, 1209–125.
61.Wolfe, L. y Mottola, M. (2002). PARmed-X for pregnancy. Ottawa: Canadian. Society for Exercise Physiology, 1–4.
62.Yin, Y.N., Li, X.L., Tao, T.J., Luo, B.R. y Liao, S.J. (2013). Physical activity during pregnancy and the risk of gestational diabetes mellitus: a systematic review and meta-analysis of randomized controlled trials. British Journal of Sports Medicine, Sep 13 [Epub ahead of print].
63.Yoo H, Shin D, Song C. Changes in the spinal curvature, degree of pain, balance ability, and gait ability according to pregnancy period in pregnant and nonpregnant women (2015). J. Phys. Ther. Sci. 27: 279–284, 2015
