Entrenamiento de Fuerza para Adultos Mayores
Resistance Training for Older Adults
Maren S. Fragala, Eduardo L. Cadore, Sandor Dorgo, Mikel Izquierdo, William J. Kraemer, Mark D. Peterson y Eric D. Ryan
1Quest Diagnostics, Secaucus, New Jersey
2School of Physical Education, Physiotherapy and Dance, Exercise Research Laboratory, Federal University of Rio Grande do Sul, Porto Alegre, Brazil
3Department of Kinesiology, University of Texas at El Paso, El Paso, Texas
4Department of Health Sciences, Public University of Navarre, CIBER of Frailty and Healthy Aging (CIBERFES), Navarrabiomed, Pamplona, Navarre, Spain
5Department of Human Sciences, The Ohio State University, Columbus, Ohio
6Department of Physical Medicine and Rehabilitation, University of Michigan-Medicine, Ann Arbor, Michigan
7Department of Exercise and Sport Science, University of North Carolina-Chapel Hill, Chapel Hill, North Carolina
Artículo publicado en el journal Revista de Educación Física, Volumen 4, Número 156 del año 2019.
Publicado 19 de septiembre de 2019
Resumen
El envejecimiento, incluso en ausencia de enfermedad crónica, está asociado con una variedad de cambios biológicos que pueden contribuir a la disminución de la masa, fuerza y función del músculo esquelético. Tales pérdidas disminuyen la resiliencia fisiológica y aumentan la vulnerabilidad a eventos catastróficos. Como tal, las estrategias tanto para la prevención como para el tratamiento son necesarias para la salud y el bienestar de los adultos mayores. El propósito de esta Declaración de Posición es proporcionar una visión general de la bibliografía actual e importante y proporcionar recomendaciones basadas en la evidencia para el entrenamiento de la fuerza para adultos mayores. Tal como se presenta en esta Declaración de Posición, la investigación actual ha demostrado que contrarrestar el desuso muscular mediante el entrenamiento de la fuerza es una intervención poderosa para combatir la pérdida de fuerza y masa muscular, la vulnerabilidad fisiológica y sus consecuencias debilitantes sobre el funcionamiento físico, la movilidad, la independencia, el control de enfermedades crónicas, el bienestar psicológico, la calidad de vida y la esperanza de vida saludable. Esta Declaración de Posición proporciona evidencia para respaldar las recomendaciones para un entrenamiento de fuerza exitoso en adultos mayores relacionado con 4 partes: (a) variables de diseño del programa, (b) adaptaciones fisiológicas, (c) beneficios funcionales, y (d) consideraciones de fragilidad, sarcopenia, y otras condiciones crónicas. El objetivo de esta Declaración de Posición es a) ayudar a fomentar un enfoque más unificado y holístico del entrenamiento de la fuerza para adultos mayores, b) promover los beneficios funcionales y de salud del entrenamiento de fuerza para adultos mayores, y c) prevenir o minimizar los temores y otras barreras a la implementación de programas de entrenamiento de fuerza para adultos mayores.
Declaraciones Resumidas
El propósito de esta declaración de posición es proporcionar una visión general de la bibliografía actual e importante, evaluar las variables del programa de ejercicios y proporcionar recomendaciones basadas en la evidencia para el entrenamiento de la fuerza para adultos mayores. Las investigaciones actuales han demostrado que contrarrestar el desuso muscular mediante el entrenamiento de la fuerza es una intervención poderosa para combatir la pérdida de fuerza muscular, la pérdida de masa muscular (sarcopenia), la vulnerabilidad fisiológica (fragilidad) y sus consecuencias debilitantes sobre el funcionamiento físico, la movilidad, la independencia, el manejo de enfermedades crónicas, el bienestar psicológico y la calidad de vida.
A continuación se presenta una lista de 11 declaraciones resumidas para el entrenamiento de fuerza eficaz en adultos mayores en 4 partes. Los objetivos de estas recomendaciones son (a) ayudar a fomentar un enfoque más unificado y holístico del entrenamiento de la fuerza para adultos mayores, (b) promover los beneficios funcionales y de salud del entrenamiento de fuerza para adultos mayores, y (c) prevenir o minimizar los temores y otras barreras a la implementación de programas de entrenamiento de fuerza para adultos mayores.
Parte 1: Variables del Programa de Entrenamiento de Fuerza
1. Un programa de entrenamiento de fuerza adecuadamente diseñado con las instrucciones apropiadas para la técnica de ejercicio y la detección adecuada es seguro para los adultos mayores sanos.
2. Un programa de entrenamiento de fuerza adecuadamente diseñado para adultos mayores debe incluir un enfoque individualizado y periodizado que trabaje hacia 2-3 series de 1-2 ejercicios multiarticulares por grupo muscular principal, logrando intensidades del 70-85% de 1 repetición máxima (1RM), 2-3 veces por semana, incluyendo ejercicios de potencia realizados a velocidades más altas en movimientos concéntricos con intensidades moderadas (p.e., 40-60% de 1RM).
3. Los programas de entrenamiento de fuerza para adultos mayores deben seguir los principios de individualización, periodización y progresión.
Parte 2: Adaptaciones Fisiológicas Positivas al Entrenamiento con Ejercicios de Fuerza en Adultos Mayores
4. Un programa de entrenamiento de fuerza adecuadamente diseñado puede contrarrestar los cambios relacionados con la edad en la función contráctil, la atrofia y la morfología del músculo esquelético humano envejecido.
5. Un programa de entrenamiento adecuadamente diseñado puede mejorar la fuerza muscular, la potencia y el funcionamiento neuromuscular de los adultos mayores.
6. Las adaptaciones al entrenamiento de la fuerza en adultos mayores están mediadas por adaptaciones neuromusculares, neuroendocrinas y hormonales al entrenamiento.
Parte 3: Beneficios Funcionales del Entrenamiento con Ejercicios de Fuerza para Adultos Mayores
7. Un programa de entrenamiento de fuerza adecuadamente diseñado puede mejorar la movilidad, el funcionamiento físico, el rendimiento en las actividades de la vida diaria (ADL, por sus siglas en inglés) y preservar la independencia de los adultos mayores.
8. Un programa de entrenamiento de fuerza adecuadamente diseñado puede mejorar la resistencia de un adulto mayor a lesiones y eventos catastróficos como caídas.
9. Un programa de entrenamiento de fuerza adecuadamente diseñado puede ayudar a mejorar el bienestar psicosocial de los adultos mayores.
Parte 4: Consideraciones para Fragilidad, Sarcopenia u otras Afecciones Crónicas
10. Los programas de entrenamiento de fuerza pueden adaptarse para adultos mayores con fragilidad, limitaciones de movilidad, deterioro cognitivo u otras afecciones crónicas.
11. Los programas de entrenamiento de fuerza pueden adecuarse (con equipamiento portátil y alternativas de ejercicios en sedestación) para adaptar a los adultos mayores que residen en centros de vivienda asistida y de enfermería especializada.
Palabras clave: entrenamiento de fuerza, ancianos, frágiles, adultos mayores, ejercicio, ejercicio de resistencia
Abstract
Keywords: strength training, elderly, frail, seniors, exercise, resistance exercise
DECLARACIONES RESUMIDASEl propósito de esta declaración de posición es proporcionar una visión general de la bibliografía actual e importante, evaluar las variables del programa de ejercicios y proporcionar recomendaciones basadas en la evidencia para el entrenamiento de la fuerza para adultos mayores. Las investigaciones actuales han demostrado que contrarrestar el desuso muscular mediante el entrenamiento de la fuerza es una intervención poderosa para combatir la pérdida de fuerza muscular, la pérdida de masa muscular (sarcopenia), la vulnerabilidad fisiológica (fragilidad) y sus consecuencias debilitantes sobre el funcionamiento físico, la movilidad, la independencia, el manejo de enfermedades crónicas, el bienestar psicológico y la calidad de vida. Parte 1: Variables del Programa de Entrenamiento de Fuerza Parte 2: Adaptaciones Fisiológicas Positivas al Entrenamiento con Ejercicios de Fuerza en Adultos Mayores Parte 3: Beneficios Funcionales del Entrenamiento con Ejercicios de Fuerza para Adultos Mayores Parte 4: Consideraciones para Fragilidad, Sarcopenia u otras Afecciones Crónicas |
INTRODUCCIÓN
Efecto de la Edad en la Masa Muscular Esquelética y la Fuerza
El envejecimiento, incluso en ausencia de enfermedad crónica, está asociado con una variedad de cambios biológicos que pueden contribuir a la disminución de la masa, la fuerza y la función del músculo esquelético, lo que conduce a una disminución general de la resiliencia fisiológica (capacidad de tolerar y recuperarse de los factores estresantes) y de la vulnerabilidad a eventos catastróficos (355). Como un fenómeno complejo y multidimensional, el envejecimiento se manifiesta de manera diferente entre individuos a lo largo de la vida y está altamente condicionado por las interacciones entre las características genéticas, ambientales, de comportamiento y demográficas (52). El crecimiento de la población adulta mayor (a menudo definida por la edad cronológica de 65 años y más), debido a la menor mortalidad y al aumento de la esperanza de vida, ha llevado a una diversificación y crecimiento de la morbilidad por enfermedades crónicas (49). Este crecimiento incluye una mayor prevalencia de los problemas de movilidad relacionados con el envejecimiento y una reducción sustancial del número de años sin discapacidad en los Estados Unidos (32,233,649). Incluso con un envejecimiento saludable (envejecimiento en ausencia de enfermedad), las reducciones en la resiliencia fisiológica a menudo conducen a discapacidad física, deterioro de la movilidad, caídas y disminución de la independencia y la calidad de vida (638). Las afecciones de salud crónicas, que suelen acompañar al envejecimiento, como las enfermedades cardiovasculares o metabólicas, pueden exacerbar la vulnerabilidad a dichas afecciones y la pérdida de la resiliencia fisiológica.
La pérdida de masa muscular relacionada con la edad (originalmente llamada sarcopenia) (395,519) tiene una prevalencia estimada del 10% en adultos mayores de 60 años (538), que se eleva a >50% en adultos mayores de 80 años (39). Las tasas de prevalencia son más bajas en los adultos mayores que viven en la comunidad que en los que residen en centros de vivienda asistida y de enfermería especializada (139). La pérdida de masa muscular es generalmente gradual, comenzando después de los 30 años y acelerando después de los 60 años (413). Estudios longitudinales previos (199,225) han sugerido que la masa muscular disminuye en un 1,0-1,4% por año en las extremidades inferiores, lo que es más que la tasa de pérdida informada en los músculos de las extremidades superiores (207,298). La sarcopenia se considera parte de la vía causal de pérdida de fuerza (200,494), discapacidad y morbilidad en las poblaciones de adultos mayores (518). Sin embargo, la debilidad muscular está altamente asociada tanto con la mortalidad como con la discapacidad física, incluso cuando se ajusta para la sarcopenia, lo que indica que la pérdida de masa muscular puede ser secundaria a los efectos de la pérdida de fuerza (124).
La contribución de las pérdidas de masa muscular relacionadas con la edad a la disminución funcional está mediada en gran parte por la reducción de la fuerza muscular (409,456,632). La tasa de disminución de la fuerza muscular con la edad es de 2 a 5 veces mayor que la disminución del tamaño muscular (155). Como tal, se han establecido (14) umbrales de debilidad muscular clínicamente relevantes (fuerza de agarre de <26 kg en hombres y <16 kg en mujeres) como biomarcadores de la discapacidad relacionada con la edad y la mortalidad temprana. Se ha demostrado que estos umbrales están estrechamente relacionados con las limitaciones de movilidad por incidentes y la mortalidad (409). Además, el Grupo de Trabajo Europeo sobre Sarcopenia en Personas Mayores (European Working Group on Sarcopenia in Older People) actualizó recientemente sus recomendaciones para centrarse en la baja fuerza muscular como característica clave de la sarcopenia y utilizar la detección de baja cantidad y calidad muscular para confirmar el diagnóstico de sarcopenia (138). Dados estos vínculos, la fuerza de agarre (un indicador indirecto de la fuerza general) (192) se ha etiquetado como un "biomarcador del envejecimiento" (526). Las pérdidas de fuerza pueden traducirse en desafíos funcionales porque se observan disminuciones en la fuerza y la potencia específicas (155,225,292,412). Se ha demostrado que la disminución de la potencia muscular es más importante que la fuerza muscular en la capacidad de realizar las actividades diarias (37,292). Además, una gran cantidad de evidencia relaciona la debilidad muscular con una gran cantidad de resultados negativos relacionados con la edad, incluyendo la diabetes (469), la discapacidad (407,409), el deterioro cognitivo (13,74,85,590), la osteoporosis (406) y la mortalidad temprana multicausal (367,409,470,653).
Los cambios relacionados con la edad en la masa, la fuerza y la función del músculo esquelético pueden atribuirse a una variedad de mecanismos, incluyendo el desuso, el deterioro en la síntesis de proteínas y la inflamación crónica. Con respecto al desuso muscular, se ha encontrado que los individuos que son físicamente inactivos tienen el doble de riesgo de limitación de movilidad en el futuro en comparación con aquellos que cumplen con las recomendaciones del Cirujano General de los Estados Unidos para la actividad física (US Surgeon General's recommendations for physical activity) (634). Además, varios estudios han demostrado un deterioro en la síntesis de proteínas y una disminución del anabolismo muscular con el envejecimiento (145,247,253,325,325,511,628,640). Las disminuciones en la síntesis de proteínas perjudican la función contráctil muscular, la fuerza y la calidad de las proteínas (26,123,253). También existe un consenso creciente de que la inflamación crónica de bajo grado en el envejecimiento (inflamación) es un fuerte factor de riesgo tanto para la morbilidad como para la mortalidad en adultos mayores (193) y puede representar un fuerte mecanismo que relaciona el aumento de la adiposidad y la desregulación metabólica relacionados con la edad con la sarcopenia y la debilidad muscular (41,311).
Entrenamiento de Fuerza para Contrarrestar las Consecuencias del Envejecimiento y el Desuso
Dadas las consecuencias físicas indeseables del envejecimiento, las estrategias tanto para la prevención como para el tratamiento son necesarias para la salud y el bienestar de los adultos mayores. Entre los factores que contribuyen al proceso de envejecimiento, el desuso muscular es un factor prevenible y reversible. El "uso" de los músculos en forma de entrenamiento con ejercicios de fuerza se ha demostrado sistemáticamente como un medio viable y eficaz para contrarrestar la debilidad muscular y la fragilidad física (184), atenuar la infiltración adiposa intramuscular relacionada con la edad (223), mejorar el rendimiento físico (61,242) y aumentar el área de fibra muscular (242), mejorar la calidad muscular (174,184,223), la densidad ósea (397), la salud metabólica y la sensibilidad a la insulina (146), el tratamiento de enfermedades crónicas (268), la calidad de vida (152), el bienestar psicológico (108,119,660), la vida independiente prolongada (567) y reducir del riesgo de caídas y fracturas en adultos mayores (553). Además, el ejercicio de fuerza puede mejorar la capacidad metabólica del músculo esquelético al mejorar la homeostasis de la glucosa, prevenir la acumulación intramuscular de lípidos, aumentar la capacidad de las enzimas oxidativas y glicolíticas, aumentar la absorción de aminoácidos y la síntesis de proteínas, y cambiar el medio anabólico/catabólico hacia el anabolismo a través de la liberación (173,304,364).
El entrenamiento de fuerza se considera un componente importante de un programa completo de ejercicios para complementar los efectos positivos ampliamente conocidos del entrenamiento aeróbico sobre la salud y las capacidades físicas (480,541). Existen pruebas sólidas de que el entrenamiento de fuerza puede mitigar los efectos del envejecimiento sobre la función neuromuscular y la capacidad funcional (66,88,91,465,553,573). Varias formas de entrenamiento de fuerza tienen el potencial de mejorar la fuerza muscular, la masa y la potencia de salida (243,291). La evidencia revela una relación dosis-respuesta donde el volumen y la intensidad están fuertemente asociados con las adaptaciones al ejercicio de fuerza (573). Además, el ejercicio de fuerza crónico mejora la densidad mineral ósea y disminuye la masa grasa abdominal y visceral (142,438,539,543,643); en adultos con diabetes tipo 2, el ejercicio de fuerza reduce la hemoglobina A1c (HbA1c) en comparación con el entrenamiento aeróbico (87). Por estas razones, el ejercicio de fuerza a menudo se considera un "medicamento" (542,643).
A pesar de los beneficios conocidos del entrenamiento de fuerza, sólo el 8,7% de los adultos mayores (>75 años de edad) en los Estados Unidos participan en actividades de fortalecimiento muscular como parte de su tiempo libre (570). Las barreras informadas para la participación en el ejercicio de fuerza para adultos mayores incluyen seguridad, miedo, preocupaciones de salud, dolor, fatiga y falta de apoyo social (86). Las bajas tasas de participación y los amplios beneficios para la salud subrayan la necesidad de guías y recomendaciones basadas en la evidencia para que los adultos mayores realicen ejercicios de fuerza para incorporar de manera segura y beneficiosa el entrenamiento de fuerza en sus vidas.
Cuando se realiza regularmente (2-3 días a la semana) y se logra una intensidad y un volumen adecuados (70-85% de 1RM) y (2-3 series por ejercicio) a través de la periodización, el ejercicio de fuerza resulta en adaptaciones neuromusculares favorables tanto en adultos mayores sanos como en aquellos con afecciones crónicas. Estas adaptaciones se traducen en mejoras funcionales de las actividades de la vida diaria, especialmente cuando se incluye el entrenamiento con ejercicios de potencia. Además, el entrenamiento de fuerza puede mejorar el equilibrio, preservar la densidad ósea, la independencia y la vitalidad, reducir el riesgo de numerosas enfermedades crónicas como las cardiopatías, la artritis, la diabetes tipo 2 y la osteoporosis, al tiempo que mejora los beneficios psicológicos y cognitivos.
PROCEDIMIENTOS
Utilizando un enfoque práctico basado en la evidencia, los autores integraron la evidencia científica, la experiencia profesional y las consideraciones del usuario final para desarrollar recomendaciones sobre los intereses, valores, necesidades y opciones de los adultos mayores. Los pasos clave en el enfoque práctico basado en la evidencia involucraron (a) enmarcar cada declaración como una hipótesis, (b) recopilar la evidencia, (c) evaluar la evidencia, (d) integrar la evidencia con aspectos prácticos, y (e) hacer cada recomendación basada en la evidencia (21). Como la evidencia se extrajo de una variedad de metodologías basadas en la investigación, no existía un enfoque único que fuera idóneo para evaluar la solidez de toda la evidencia científica existente (642). Por lo tanto, la Declaración de Posición presenta una revisión crítica de los principales trabajos publicados relevantes utilizando una revisión de la bibliografía (610) de acuerdo con los criterios de inclusión especificados. Dado que existe una amplia variación biológica entre los adultos mayores de edad cronológica similar y que los cambios relacionados con la edad en el músculo esquelético generalmente comienzan durante la mediana edad, no se consideró adecuada ninguna definición estándar de "edad avanzada" basada en la edad cronológica. En cambio, debido a la amplia diversidad fisiológica y funcional, y al inicio de las consecuencias relacionadas con la edad en el músculo esquelético, los estudios incluyeron sujetos de 50 años de edad y mayores.
Criterios de Inclusión de las Publicaciones
- Publicación de artículos completos (no sólo un resumen)
- Publicación revisada por pares
- Años de publicación (1965-2018)
- Publicación en inglés
- Sujetos de estudio de 50 años de edad y mayores
- Asignación aleatoria a los grupos de intervención
- Presencia del grupo de comparación
- Uso de un método validado de medición de resultados
EVIDENCIA DE LAS DECLARACIONES RESUMIDAS
Parte 1: Variables del Programa de Entrenamiento de Fuerza
Un Programa de Entrenamiento de Fuerza Adecuadamente Diseñado con las Instrucciones Apropiadas para la Técnica de Ejercicio y la Observación Adecuada es Seguro para los Adultos Mayores Sanos
Tanto la investigación como la experiencia clínica indican que el entrenamiento de fuerza es seguro para los adultos mayores sanos (404), los adultos mayores frágiles (fisiológicamente vulnerables) (94,621) y los individuos con enfermedades (404). Una revisión sistemática sobre los efectos del entrenamiento de fuerza en ancianos físicamente frágiles (de 70 a 92 años de edad y mayores) informó sólo un caso de dolor de hombro con entrenamiento de fuerza en 20 estudios y 2.544 sujetos (96). Por otro lado, se han informado algunos casos de lesiones asociadas con el entrenamiento de fuerza en individuos mayores, principalmente en aquellos sujetos sin experiencia. Estas lesiones se relacionan principalmente con una combinación de carga de trabajo pesada y repetitiva, posicionamiento desfavorable o técnica y selección de ejercicios incorrectas (563). Se debe tener especial cuidado con el complejo articular del hombro, debido a su susceptibilidad, así como con las estructuras de la cadera, rodilla y columna vertebral (334,361). Para mantener la seguridad, se requiere el diseño apropiado del programa, y se necesita cuidado especial y consideración en el entrenamiento con ejercicios de fuerza para algunas poblaciones de adultos mayores para reducir el riesgo asociado con su condición específica. Por ejemplo, la prescripción de ejercicios para un adulto mayor con hipertensión no controlada debe tener en cuenta las elevaciones agudas de la presión arterial, que ocurren con el entrenamiento de fuerza. Al igual que con el entrenamiento aeróbico, los riesgos cardiovasculares asociados al entrenamiento de fuerza pueden aumentar con la edad y también dependen de la actividad física habitual y del nivel de estado físico, así como de la intensidad del entrenamiento (647). Interesantemente, algunas pruebas indican que el entrenamiento de fureza puede resultar en un equilibrio más favorable en el suministro y demanda de oxígeno miocárdico que el ejercicio aeróbico debido a una menor frecuencia cardíaca y una mayor presión de perfusión miocárdica (diastólica) (179). El entrenamiento de fuerza debe prescribirse en combinación con el entrenamiento aeróbico porque ambos tipos de ejercicio producen beneficios distintos, como mejoras en las funciones neuromusculares y cardiovasculares (91), respectivamente, y tanto la fuerza muscular como la aptitud aeróbica están inversamente asociadas con la mortalidad multicausal en individuos mayores (521).
La realización de ejercicios de fuerza hasta el fallo concéntrico provocará un marcado aumento de la presión arterial, la frecuencia cardíaca y el gasto cardíaco (404) y, por lo tanto, este tipo de entrenamiento de fuerza debe evitarse en adultos mayores con hipertensión arterial no controlada. La investigación ha respaldado el ejercicio de fuerza como generalmente seguro en individuos con hipertensión controlada (217,227), y el entrenamiento puede ayudar a controlar la presión arterial alta. Cuando se controla la hipertensión y el examen médico y la autorización preceden al ejercicio, el ejercicio de fuerza es seguro. En un estudio de más de 26.000 sujetos sanos de 20 a 69 años de edad (todos ellos con presión arterial en reposo <160/90 mm Hg) que se sometieron a un examen médico preliminar (227), no se informaron eventos cardiovasculares significativos con una prueba de fuerza de 1RM.
A pesar de la seguridad informada, el examen médico puede ayudar a evaluar la idoneidad para el entrenamiento con ejercicios de fuerza y puede identificar a los adultos mayores con condiciones médicas inestables que pueden estar en mayor riesgo. Debido al riesgo potencial de elevaciones peligrosas de la presión arterial, especialmente durante la maniobra de Valsalva, existen algunas contraindicaciones absolutas y relativas al entrenamiento de fuerza. Las contraindicaciones absolutas incluyen: cardiopatía coronaria inestable, insuficiencia cardíaca descompensada, arritmias no controladas, hipertensión pulmonar grave (presión arterial pulmonar media > 55 mm Hg), estenosis aórtica grave y sintomática, miocarditis, endocarditis, o pericarditis aguda, hipertensión no controlada (>180/110 mm Hg), disección aórtica, síndrome de Marfan y entrenamiento de fuerza de alta intensidad (80-100% de 1RM) en pacientes con retinopatía proliferativa activa o retinopatía diabética no proliferativa moderada o peor. Las contraindicaciones relativas (deben consultar a un médico antes de participar) incluyen: factores de riesgo importantes para cardiopatía coronaria inestable, diabetes en cualquier edad, hipertensión no controlada (presión arterial sistólica >160 mm Hg y/o presión arterial diastólica >100 mm Hg), baja capacidad funcional (<4 equivalentes metabólicos), limitaciones musculoesqueléticas, y personas que tienen marcapasos o desfibriladores (110,217,644). La progresión del ejercicio de intensidad baja a moderada antes de intentar una intensidad alta o vigorosa permite evaluar más eficazmente la tolerancia al ejercicio. Además, la intensidad y la progresión del entrenamiento deben establecerse mediante la individualización y la consideración de la experiencia de entrenamiento. Además de ser seguro, el ejercicio de fuerza está relativamente libre de posibles efectos secundarios no deseados causados por medicamentos comunes que se recetan en pacientes con comorbilidades múltiples (90). También se deben tener en cuenta consideraciones especiales con respecto al dolor articular o la inestabilidad causada por la osteoartritis (OA) u otras causas. Estas condiciones requieren formas alternativas de entrenar los mismos grupos musculares, considerando diferentes ejercicios (por ejemplo, prensa de piernas en lugar de sentadillas en la OA de rodilla), intensidades más bajas, diferente tipo de contracción, amplitud de movimiento reducida (transitoria o permanente), entre otros. Todas estas estrategias deben ser aplicadas para evitar el empeoramiento del dolor y de la condición clínica (392,442).
Un Programa de Entrenamiento de Fuerza Adecuadamente Diseñado para Adultos Mayores Debe Incluir un Enfoque Individualizado y Periodizado que Trabaje hacia 2-3 Series de 1-2 Ejercicios Multiarticulares por Grupo Muscular Principal, Logrando Intensidades de 70-85% de 1 Repetición Máxima (1RM), 2-3 Veces por Semana, Incluyendo Ejercicios de Potencia Realizados a Velocidades Más Altas en Movimientos Concéntricos con Intensidades Moderadas (p.e., 40-60% de 1RM): Intensidad (Tabla 1)
La intensidad del entrenamiento de fuerza se define clásicamente como la carga de entrenamiento (es decir, en porcentaje o valor absoluto) relativa a la fuerza dinámica máxima (es decir, 1RM) (16,18). Algunos estudios originales han mostrado aumentos de fuerza similares entre el entrenamiento de fuerza de intensidad moderada a alta (es decir, >70% de 1RM) en comparación con el entrenamiento moderado de fuerza (es decir, 51-69% de 1RM) (78,629). Sin embargo, algunos meta-análisis y revisiones sistemáticas han sugerido mayores efectos del entrenamiento de fuerza de alta intensidad sobre la fuerza en comparación con el entrenamiento de fuerza de intensidad moderada y baja, así como mayores efectos de la intensidad moderada sobre la fuerza muscular en comparación con el entrenamiento de fuerza de baja intensidad (66,465,553,573), incluso en adultos mayores frágiles (621). Fisiológicamente, las unidades motoras humanas se reclutan para aumentar el tamaño de la motoneurona, de acuerdo con el "principio del tamaño" para adaptarse al aumento de la intensidad o de la carga (148,169).
Steib et al. (573) realizaron un meta-análisis que incluyó 22 artículos que compararon el efecto de diferentes protocolos de entrenamiento de fuerza (es decir, investigación de dosis-respuesta directa) sobre la fuerza muscular y las pruebas funcionales de rendimiento en adultos mayores (de 65 y 80 años de edad). Estos autores observaron que las intensidades superiores al 75% de 1RM lograron un mayor efecto en la mejora de la fuerza máxima que las intensidades moderadas (55-75% de 1RM) o inferiores (menos del 55% de 1RM). Además, la intensidad moderada (55-75% de 1RM) logró mayores efectos sobre la fuerza máxima que las intensidades bajas (55% de 1RM) (573). En este meta-análisis, sólo se incluyeron tres estudios que comparaban diferentes intensidades de las pruebas funcionales, y no se observaron diferencias en los resultados funcionales entre las diferentes intensidades de entrenamiento (573). Además, un meta-análisis, que incluyó 25 ensayos clínicos aleatorizados (RCT, por sus siglas en inglés) que investigaron los efectos del entrenamiento de fuerza en adultos mayores sedentarios (edad media de 65 años y más), encontró que las intensidades del 70-79% de 1RM indujeron efectos mayores sobre la fuerza muscular (diferencias de medias estandarizadas [SMD, por sus siglas en inglés] entre grupos = 1,89) que las intensidades inferiores (66).
Sin embargo, no se observó lo mismo al evaluar los efectos del entrenamiento de fuerza sobre la morfología muscular (tamaño y forma): las intensidades moderadas de 51-69% de 1RM (SMD = 0,43; 9 estudios incluidos en el análisis) produjeron efectos mayores que las intensidades inferiores o superiores (66). Petersen et al. (465) realizaron un meta-análisis que incluyó 47 estudios que investigaron los efectos del entrenamiento de fuerza en la fuerza del tren inferior y superior del cuerpo de sujetos mayores (la edad media en la mayoría de los estudios fue de 60 a 75 años de edad). Estos autores observaron que el único predictor entre-estudios que tuvo una asociación significativa con la mejora de la fuerza fue la intensidad del entrenamiento (es decir, el aumento gradual de intensidad en el subgrupo indujo un cambio en las ganancias máximas de fuerza de 5,3%) (465). Además, en un meta-análisis que comparaba los efectos del entrenamiento de fuerza entre intensidades altas (es decir, intensidades que progresaban hasta el 80% de 1RM) e intensidades bajas a moderadas (es decir, intensidades que progresaban hasta el 60% de 1RM), Csapo et al. (140) encontraron que los aumentos en la fuerza eran del 43% para la intensidad alta y del 35% para la intensidad baja a moderada, y que los incrementos promedio en el tamaño del músculo eran del 11% y del 9%, respectivamente (edad media de 67 años de edad, sólo 2 de los 15 estudios incluían sujetos con edades comprendidas entre los 50 y 60 años de edad).
En resumen, en adultos sanos mayores de 60 años, la intensidad del entrenamiento de fuerza debe alcanzar el 70-85% de 1RM durante la periodización del entrenamiento para optimizar el aumento de la fuerza. Los cambios en la morfología muscular y el rendimiento funcional también se pueden lograr a intensidades bajas a moderadas (aproximadamente 50-70% de 1RM). Aunque los programas de entrenamiento de fuerza periodizados y no periodizados pueden provocar adaptaciones neuromusculares similares, se pueden utilizar intensidades más bajas (o a veces más altas) para variar el entrenamiento, prevenir el aburrimiento y también promover adaptaciones al entrenamiento en programas periodizados a medida que la intensidad progresa hasta el 85% de 1RM.
Volumen
El volumen de entrenamiento se refiere a la cantidad total de peso levantado durante una sesión de entrenamiento (449). Más específicamente, volumen-carga se refiere a la suma del número total de series multiplicado por el número de repeticiones por serie, multiplicado por el peso levantado para cada repetición (449). Esta subsección proporcionará evidencia con respecto al número más efectivo de series por ejercicio, repeticiones y tiempo bajo tensión para optimizar la fuerza y el tamaño muscular.
En las primeras fases del entrenamiento de fuerza, el número de series por ejercicio no parece ser la variable principal responsable del aumento de la fuerza muscular en los adultos mayores. Se han mostrado resultados similares en mujeres mayores cuando se comparan de 1 a 3 series durante períodos de entrenamiento a corto plazo (es decir, de 6 a 12 semanas de entrenamiento) (6,486). Sin embargo, se ha observado una ventaja a favor de 3 series durante períodos de entrenamiento de fuerza más largos (209,486).
Los resultados de un meta-análisis que investigó los efectos del entrenamiento de fuerza sobre la masa corporal magra de los adultos mayores mostraron que un mayor número de series por sesión se asoció con un mayor aumento de la masa corporal magra (465). Además, en un meta-análisis de Borde et al. (66), 2-3 series por ejercicio y 7-9 repeticiones produjeron los mayores efectos sobre la fuerza muscular y la morfología muscular (SMD media de 2,99 y 1,98 para la fuerza muscular, y 0,78 y 0,49 para la morfología muscular, respectivamente). Además, un análisis de metarregresión reveló que un volumen moderado (definido por el producto de series × repeticiones) (es decir, 24 repeticiones) aumentaba la potencia muscular más que un bajo volumen (es decir, <24 repeticiones) y un alto volumen de entrenamiento de fuerza (es decir, >24 repeticiones) (580). El número de repeticiones está fuertemente determinado por el porcentaje de 1RM, y por esta razón, menores repeticiones pueden inducir mayores ganancias de fuerza debido a la mayor intensidad de entrenamiento utilizada. Sin embargo, las repeticiones al fallo no son necesarias y no promueven adaptaciones fisiológicas adicionales en individuos mayores (92,141). En general, el 50-70% del número máximo de repeticiones posibles realizadas en buena forma es suficiente para obtener mejorías neuromusculares, mientras se evitan las malas formas y las lesiones.
En resumen, se deben prescribir de 2 a 3 series de 6 a 12 repeticiones al 50-85% de 1RM por grupo muscular para promover un aumento máximo de la fuerza y del tamaño muscular. El número de repeticiones depende de la intensidad (es decir, de la carga) utilizada y debe ajustarse en consecuencia, teniendo en cuenta que las repeticiones al fallo no son necesarias para optimizar las adaptaciones neuromusculares. Se debe prescribir un ejercicio multiarticular para los principales grupos musculares, aunque las extremidades inferiores pueden responder mejor a dos ejercicios (es decir, prensa de piernas y extensión de rodilla) (141).
Frecuencia
La frecuencia de entrenamiento representa el número de sesiones de entrenamiento de fuerza realizado por semana, por grupo muscular. En un metanálisis de Steib et al. (573), en el que se incluyeron dos ensayos controlados aleatorios en los análisis de frecuencia de entrenamiento, entrenar dos veces por semana produjo una mayor SMD que entrenar una vez por semana (SMD entre grupos = 1,55) (160), y entrenar tres veces por semana alcanzó una mayor SMD en la fuerza máxima que entrenar una vez por semana (SMD entre grupos = 2,57) (589). Un meta-análisis de Borde et al. (66) mostró que 2-3 sesiones por semana produjeron mayores efectos sobre las medidas de fuerza muscular (SMD entre los grupos de intervención y control de 2,13 y 1,49 para 2 y 3 veces por semana, respectivamente). Además, 2-3 sesiones por semana también resultaron en aumentos en el tamaño del músculo (66). Cabe destacar que 8 de los 9 ensayos controlados aleatorios incluidos en el meta-análisis examinaron los efectos del entrenamiento de fuerza sobre la masa muscular mediante una frecuencia de entrenamiento de 3 veces por semana.
En resumen, una frecuencia de entrenamiento de 2 a 3 veces por semana, por grupo muscular, proporciona el estímulo óptimo para maximizar los aumentos de fuerza y el tamaño del músculo esquelético en adultos mayores.
Velocidad del Movimiento y Potencia
El entrenamiento de fuerza realizado a la máxima velocidad durante la fase concéntrica (es decir, el entrenamiento de fuerza explosiva en el que los músculos ejercen la máxima fuerza en intervalos cortos de tiempo) puede promover mejoras funcionales mayores que el entrenamiento de fuerza realizado a velocidades más lentas en adultos mayores (71,488). Esto puede reflejar la capacidad de realizar las ADL, que puede depender más de la capacidad de aplicar la fuerza rápidamente que de la capacidad de ejercer la máxima fuerza (105,245,291,500).
Algunos estudios han mostrado mayores mejoras funcionales comparando el entrenamiento de fuerza explosiva y el entrenamiento de fuerza tradicional en adultos mayores (44,71,416,488). En un meta-análisis de Steib et al. (573), el entrenamiento de fuerza explosiva fue más efectivo que el entrenamiento de fuerza tradicional para mejorar el rendimiento de levantarse desde la silla (SMD = 1,74), y algo efectivo para la capacidad de subir escaleras (SMD = 1,27), mientras que no se observaron diferencias entre los modos de entrenamiento de fuerza en cuanto a la velocidad de la marcha, el Test Up and Go cronomentrado (TUG) y la fuerza máxima. Como era de esperar, el entrenamiento de fuerza explosiva indujo un mayor aumento de la potencia máxima que el entrenamiento de fuerza tradicional (SMD = 1,66).
Más recientemente, Straight y cols. (580) realizaron un meta-análisis que incluyó 12 RCTs que evaluaron la potencia muscular de la parte inferior del cuerpo (sólo uno de los 12 RCTs incluyó individuos menores de 60 años de edad). Estos autores demostraron que el entrenamiento de fuerza explosiva fue más efectivo que el entrenamiento de fuerza tradicional para aumentar la potencia muscular de la parte inferior del cuerpo. Curiosamente, no se observaron efectos de la intensidad del entrenamiento en la potencia muscular de la parte inferior del cuerpo. Una característica interesante del entrenamiento de fuerza explosiva prescrito en adultos mayores es que la fuerza y la potencia máximas, así como el tamaño del músculo y las mejoras en el rendimiento funcional, se logran a intensidades bajas a moderadas (es decir, 40-60% de 1RM) (88,488).
Estudios individuales también han demostrado que realizar entrenamiento de fuerza explosiva a intensidades bajas, moderadas y altas induce adaptaciones neuromusculares y funcionales similares en adultos mayores (150,501). Esto puede explicarse porque la realización de acciones musculares a altas velocidades incluye el reclutamiento de unidades motoras de umbral alto compuestas de fibras musculares tipo II (4). Además, debido a que la fuerza es el producto de la masa desplazada y la aceleración, incluso a intensidades moderadas, la realización de repeticiones a una velocidad más rápida aumenta considerablemente la fuerza neta. Además, dado que la velocidad del movimiento está inversamente asociada a la intensidad relativa, puede considerarse un indicador directo de la intensidad del entrenamiento (524).
Varios RCTs y meta-análisis han proporcionado pruebas de que los programas de entrenamiento de fuerza que utilizan alta velocidad de movimiento durante la fase concéntrica con intensidades moderadas (es decir, 40-60% de 1RM) inducen aumentos en la fuerza máxima, la potencia muscular, la masa muscular y la capacidad funcional en adultos mayores (44,71,88,416,488,573); sin embargo, faltan datos que comparen diferentes números de series y diferentes frecuencias de entrenamiento de este tipo específico de entrenamiento de fuerza.
Evidencia reciente sugiere que tanto una como tres series de entrenamiento de fuerza realizadas durante 12 semanas mejoran la fuerza dinámica e isométrica, el impulso contráctil y el rendimiento funcional en mujeres mayores (487). Además, para optimizar la potencia de salida durante las series y evitar la fatiga muscular, no se deben realizar repeticiones hasta el fallo concéntrico (230). La fatiga muscular puede plantear riesgos para la seguridad y no es necesaria para las respuestas de adaptación de fuerza y de potencia (230). Los ejercicios diseñados y prescritos para el desarrollo de la fuerza deben ser implementados con especial atención y con la forma y técnica adecuadas para reducir el riesgo de lesiones. Antes de progresar en carga, velocidad o intensidad, se debe lograr una forma adecuada. Además, los ejercicios para el desarrollo de la potencia deben evitar la desaceleración (mantener la barra/carga) para maximizar los estímulos neuromusculares. Los movimientos balísticos en ejercicios de cadena abierta como la extensión de rodilla y el press de pecho deben evitarse en la OA de rodilla y la lesión del manguito rotador, respectivamente. Además, el ejercicio de prensa de piernas debe evitarse en la degeneración discal y en las condiciones de la OA de la columna lumbar, así como en la OA de cadera.
Debido a que existe una discordancia entre la magnitud de las adaptaciones neuromusculares inducidas por el entrenamiento de fuerza explosiva a intensidades moderadas y el entrenamiento de fuerza tradicional de alta intensidad, se recomiendan ambos tipos de entrenamiento y deben combinarse a lo largo de un programa de entrenamiento de fuerza periodizado.
En resumen, el entrenamiento de fuerza debe incluir ejercicios de potencia realizados a altas velocidades en movimientos concéntricos con intensidades moderadas (es decir, 40-60% de 1RM) para beneficiar las mejoras funcionales.
Maximizar las Adaptaciones en la Fuerza y la Resistencia Cardiorrespiratoria
El entrenamiento de fuerza y de resistencia tiene adaptaciones cardiovasculares y neuromusculares específicas que son de naturaleza diferente. Las principales adaptaciones al entrenamiento de fuerza incluyen hipertrofia de células musculares, aumento en el reclutamiento de la unidad motora máxima, aumento de la velocidad de disparo de la unidad motora máxima, aumento de la excitabilidad motoneuronal espinal y aumento del impulso motor eferente (339). Estas adaptaciones neuromusculares dan como resultado una mejor fuerza y potencia (4). Por el contrario, el entrenamiento de resistencia induce adaptaciones centrales y periféricas que mejoran el VO2máx y la capacidad de los músculos esqueléticos para generar energía a través del metabolismo oxidativo. Estas adaptaciones incluyen un aumento de la biogénesis mitocondrial, el contenido de mioglobina, la densidad capilar, las reservas de sustrato y las actividades de las enzimas oxidativas, así como un aumento del gasto cardíaco máximo (94).
Tanto con el ejercicio aeróbico (72) como con el entrenamiento de fuerza (275,601), hay una variación considerable entre los individuos en las respuestas al entrenamiento. Tanto los respondedores como los no respondedores al entrenamiento son aparentes, incluso cuando se toman en cuenta factores como la edad, el sexo y el origen étnico (72,275,601). Por lo tanto, las diferencias genéticas son parcialmente atribuibles a la variación interindividual tanto en las adaptaciones con el entrenamiento como en los cambios relacionados con la edad (210,624). De hecho, los estudios de herencia muestran que hasta un 76% de la masa muscular (5) y un 65% de la fuerza muscular (103,495) se han atribuido a la genética. Múltiples genes en oposición a polimorfismos específicos parecen contribuir a la disminución de la fuerza, el tamaño y la función muscular con la edad (210). Sin embargo, algunas pruebas sugieren que la contribución relativa de la genética a la fuerza disminuye con el envejecimiento, ya que los factores ambientales (103) y las enfermedades crónicas (194) juegan un papel más importante.
Una combinación de entrenamiento de fuerza, potencia y resistencia (es decir, "entrenamiento concurrente") en adultos mayores parece ser la estrategia más efectiva para contrarrestar la disminución de la masa muscular, la fuerza, el estado cardiorrespiratorio, la función neuromuscular y la capacidad funcional (89). El entrenamiento concurrente también aumenta la actividad física general para la prevención y el control de las enfermedades cardiometabólicas.
Sin embargo, la promoción concomitante de las adaptaciones neuromusculares y cardiorrespiratorias puede ser un reto porque un volumen e intensidad excesivos, especialmente en la prescripción del entrenamiento de resistencia, pueden comprometer las adaptaciones neuromusculares inducidas por el entrenamiento de fuerza (es decir, el efecto de interferencia) (95,203,267,345,434). Por lo tanto, para optimizar la prescripción de entrenamiento concurrente, parece importante identificar la combinación más efectiva de variables de entrenamiento (es decir, intensidad, volumen, frecuencia semanal y orden de los ejercicios) para promover las adaptaciones neuromusculares y cardiovasculares en los adultos mayores. El volumen y la frecuencia del entrenamiento desempeñan un papel fundamental en las adaptaciones inducidas por el entrenamiento concurrente en adultos mayores. Un estudio sugirió que una frecuencia semanal mínima de entrenamiento concurrente (1 sesión por semana de fuerza y 1 sesión por semana de entrenamiento de resistencia de ciclismo) puede promover aumentos marcados en la fuerza, el tamaño muscular y el rendimiento de resistencia en sujetos adultos mayores no entrenados previamente (293). Si las limitaciones de tiempo impiden que una persona cumpla con las recomendaciones de frecuencia, se puede utilizar una frecuencia mínima de 1 vez por semana para prevenir la atrofia muscular.
Los estudios que investigan programas de entrenamiento con mayores volúmenes semanales informan que el entrenamiento concurrente induce adaptaciones similares de la fuerza usando 2 sesiones semanales de cada tipo de entrenamiento (es decir, fuerza y resistencia) en días separados (es decir, 4 días de entrenamiento total: 2 días de entrenamiento de fuerza + 2 de entrenamiento de resistencia) en comparación con el entrenamiento de fuerza solo (551). Sin embargo, 3 veces por semana de entrenamiento concurrente con entrenamiento de fuerza y de resistencia realizado en el mismo día puede resultar en un "efecto de interferencia" en esta población (95). Se han observado mayores aumentos de la fuerza con el entrenamiento de fuerza en comparación con el entrenamiento concurrente cuando se realiza 3 veces por semana (95). A pesar del potencial efecto de interferencia, las ganancias de fuerza observadas fueron comparables con las de los estudios en los que los grupos de entrenamiento concurrente y de fuerza aumentaron la fuerza de forma similar (293,551,650). Además, la secuencia de ejercicios dentro de la sesión también puede influir en la magnitud de las adaptaciones de fuerza en los adultos mayores (554). Realizar entrenamiento de fuerza antes del ejercicio de resistencia puede optimizar las adaptaciones neuromusculares en esta población; sin embargo, debe tenerse en cuenta que ambos ordenes de ejercicios promovieron aumentos similares de hipertrofia muscular y resistencia (91). También se ha demostrado que el entrenamiento concurrente tanto 2 como 3 veces por semana induce cambios neuromusculares y cardiovasculares similares en adultos mayores previamente bien entrenados (180).
En resumen, los protocolos de entrenamiento concurrente deben realizarse de 2 a 3 veces por semana. La menor frecuencia de entrenamiento concurrente (1 sesión semanal de fuerza y 1 sesión semanal de entrenamiento de resistencia como el ciclismo) también puede promover cambios neuromusculares y cardiovasculares marcados en adultos mayores no entrenados. En el caso de que tanto el entrenamiento de fuerza como el de resistencia se realicen el mismo día, los cambios de fuerza se pueden optimizar con el entrenamiento de fuerza realizado antes del ejercicio de resistencia durante las secuencias de ejercicios dentro de las sesiones.
Tabla 1. Recomendaciones generales sobre el entrenamiento de fuerza para adultos mayores sanos.†
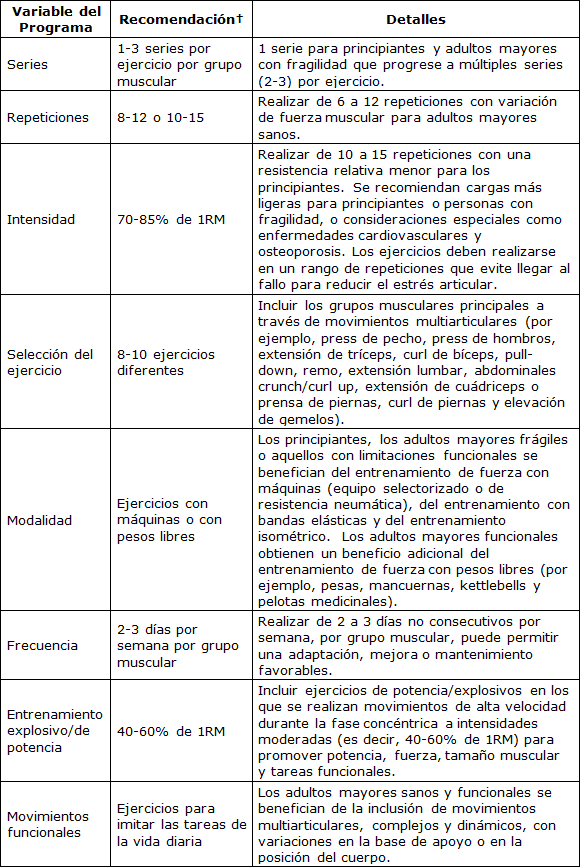
Movimiento Funcional
Se recomienda el entrenamiento de fuerza progresivo para prevenir o reducir la discapacidad en adultos mayores (42,533). Algunos estudios han resaltado que una vez que la fuerza muscular ha alcanzado un cierto umbral, las mejoras adicionales en la fuerza podrían no proporcionar beneficios adicionales para el rendimiento de las ADL (69,144,323,324,359,378,380,410,559). Por lo tanto, la incorporación de ejercicios de entrenamiento funcional a un programa de entrenamiento multicomponente es beneficiosa para mejorar el rendimiento de las ADL (162,168,394). El entrenamiento funcional se centra en movimientos multiarticulares, complejos y dinámicos e incorpora variaciones para mejorar la capacidad funcional para ejecutar una determinada tarea de la vida diaria (557). El entrenamiento funcional mejora el rendimiento de las ADL a través del entrenamiento con especificidad de movimiento, donde los ejercicios realizados requieren patrones de movimiento similares a los de las ADL y los movimientos diarios. Algunos ensayos muestran que los programas de entrenamiento funcional tienen efectos positivos sobre el rendimiento de las ADL y pueden mantenerse incluso 6 meses después de la finalización del entrenamiento (125,151,220).
La disminución de la función física relacionada con la edad sólo puede explicarse en parte por la pérdida de masa muscular o de fuerza muscular. Otros aspectos esenciales del control motor también influyen fuertemente en el rendimiento funcional de las ADL de un adulto mayor, incluyendo el deterioro del equilibrio dinámico y la coordinación del movimiento (534). A través de movimientos progresivos, complejos y coordinados, el entrenamiento funcional puede incorporar múltiples aspectos de control motor para simular mejor el rendimiento de las ADL (378). Estudios anteriores aplicaron el entrenamiento funcional mediante ejercicios de entrenamiento de fuerza basados en el equilibrio dinámico, como los step-ups con peso (374) para mejorar la fuerza funcional de la parte inferior del cuerpo, añadiendo peso a los movimientos funcionales diarios, como levantarse de la silla (559), o practicando movimientos funcionales a diferentes velocidades (349). También se ha utilizado una combinación de actividades de equilibrio y coordinación, como practicar una ADL en una postura que desafía el equilibrio (125). Además, los ejercicios pueden ser modificados a un rango de movimiento limitado, según sea necesario, mientras se sigue mejorando el rango de movimiento, la fuerza y la función (571). No se ha comparado la eficacia de estos distintos métodos, y dicha comparación es difícil debido a la variedad de diseños y métodos de evaluación utilizados en los estudios de entrenamiento funcional pertinentes. Sin embargo, se ha recomendado que los programas de ejercicios integrales que incluyen entrenamiento de fuerza dinámica para mejorar la fuerza muscular, la potencia y la resistencia, combinados con tareas de equilibrio dinámico y movimiento funcional, pueden mejorar la capacidad física y prevenir el deterioro funcional en adultos mayores (315). Al igual que el entrenamiento de fuerza progresivo, los ejercicios de entrenamiento funcional, la intensidad y el rango de movimiento deben individualizarse en función de la capacidad de la persona.
En resumen, el equilibrio dinámico y el entrenamiento funcional en combinación con el entrenamiento de fuerza dinámica pueden mejorar la capacidad física y prevenir el deterioro funcional en los adultos mayores.
Los Programas de Entrenamiento de Fuerza para Adultos Mayores Deben Seguir los Principios de Individualización, Periodización y Progresión.
El diseño del programa de entrenamiento de fuerza para adultos mayores debe hacer uso de los mismos principios que han sido bien establecidos para las poblaciones más jóvenes (17,341), sin embargo, la individualización puede ser aún más importante para el adulto mayor. Cuando se trabaja con cualquier persona mayor, se deben realizar evaluaciones de necesidades y modificaciones individualizadas de los ejercicios y programas de entrenamiento de fuerza. Lo ideal es que los programas de entrenamiento y los ejercicios se supervisen y diseñen para que se ajusten a los desafíos físicos, psicológicos y médicos únicos del individuo y aborden cualquier comorbilidad, problema ortopédico, movilidad y/o tolerancia de la modalidad de entrenamiento (p. ej., entrenamiento de resistencia, fuerza y potencia o funcional), a fin de cumplir secuencialmente con sus objetivos cambiantes de salud/aptitud física a lo largo del tiempo. Además, la supervisión de los ejercicios en un programa de entrenamiento de fuerza puede ser importante para facilitar mejoras óptimas en el músculo, la fuerza y el equilibrio (354).
Es importante considerar las variables agudas del programa con respecto al diseño de los entrenamientos individuales y luego la progresión durante un período de entrenamiento. Dichos diseños deben basarse en la recuperación y la posible necesidad de modificar el programa de entrenamiento de fuerza. La selección de ejercicios determina la musculatura que puede beneficiarse de la mejora de la fuerza, la potencia y la resistencia muscular local. Se deben tomar decisiones sobre programas para todo el cuerpo versus grupos musculares muy específicos o unos cuantos ejercicios dedicados para un grupo muscular (por ejemplo, extensores de rodilla). Muchos estudios de investigación están diseñados para examinar los efectos del entrenamiento para un grupo muscular específico y por lo tanto pueden incorporar sólo de 1 a 3 ejercicios para ese grupo muscular. Sin embargo, la aplicación práctica para esto cuando los individuos están entrenando todo el cuerpo sigue siendo incierta. Además, el tipo o modalidad (por ejemplo, pesos libres, máquinas, isoinerciales o tipo de acciones de repetición) afectará varias características del sistema neuromuscular. El orden de los ejercicios será importante para los programas debido a la progresión de la fatiga durante de un entrenamiento. Típicamente, los grandes grupos musculares se entrenan en la primera parte de un programa. El orden de los ejercicios también es crítico para los protocolos tipo-circuito, donde los diferentes ejercicios se realizan en secuencia con intervalos de descanso cortos, debido al desarrollo de la fatiga con diferentes secuencias de ejercicios.
La carga de entrenamiento utilizada en los estudios de adultos mayores suele ser del 30 al 90% de 1RM y suele depender de los esquemas de progresión y periodización utilizados, así como de la duración de la intervención (66,465). En varios estudios se ha utilizado la repetición máxima y el entrenamiento en zona de RM, pero se debe controlar el estrés articular y el dolor articular cuando se entrena a altas intensidades. El ejercicio isoinercial con volante (s) de inercia tiene beneficios potenciales en ciertas poblaciones envejecidas que están listas para un esfuerzo de ejercicio de mayor resistencia (596). El número de series contribuye al volumen total de trabajo y ha oscilado entre 1 y 4 series para un ejercicio y es relativo a los enfoques de progresión y los posibles conceptos de periodización (17). La cantidad de tiempo tomado para los períodos de descanso entre las series y los ejercicios ha variado de 1,5 a 3,0 minutos en varios estudios en poblaciones de adultos mayores, pero nuevamente se basa en la tolerancia del protocolo con la necesidad de una progresión libre de síntomas (sin mareos y sin náuseas, etc.).
Se han publicado formatos generales para la progresión en los programas de entrenamiento de fuerza con respecto a los adultos mayores sanos (17). La preocupación básica para la progresión en los adultos mayores es la tolerancia de la carga de trabajo y la recuperación óptima. Muchos estudios iniciales han utilizado carga constante y cambios de volumen asociados con las ganancias de fuerza inherentes (201,358,425,483). Otros estudios han utilizado diferentes ciclos de carga y volumen, lo que ha dado lugar progresivamente a cargas de resistencia más pesadas (12,238,504). Unos pocos estudios han utilizado la periodización no lineal con diferentes resistencias en diferentes días para proporcionar variaciones (342,441). Sin embargo, aunque se informan muchas opciones en la bibliografía, sólo un estudio ha hecho una comparación directa de diferentes enfoques. En un estudio histórico sobre el envejecimiento y el entrenamiento de fuerza, Conlon et al. (132) hicieron la primera comparación directa de entrenamiento no periodizado, con periodización por bloques y periodización ondulada en grupos de hombres (72 años de edad) y mujeres (70 años de edad). Para cada uno de los biomarcadores de salud y aptitud física, incluyendo la presión arterial sistólica, los biomarcadores sanguíneos, la composición corporal, la fuerza máxima, la capacidad funcional y la confianza en el equilibrio, se observaron mejoras significativas con ambos protocolos de entrenamiento periodizados. Sin embargo, no se demostraron diferencias entre los grupos de entrenamiento después de 22 semanas usando un programa de entrenamiento de fuerza específico (132), a diferencia de las poblaciones más jóvenes, donde los programas periodizados parecen ser superiores a los programas no periodizados para mejorar la fuerza muscular (172). Sin embargo, algunas pruebas sugieren que la variación de la resistencia puede mejorar el rendimiento físico en los adultos mayores en comparación con la resistencia constante (279).
Por lo tanto, parece posible aplicar múltiples enfoques al entrenamiento de fuerza, con mucha más investigación necesaria sobre este tema. Los estudios futuros también deben abordar los patrones de respuesta individuales y los efectos de la variación del programa durante períodos más prolongados de entrenamiento para la adherencia. En última instancia, cada programa debe progresar de una manera relacionada con la tolerancia individual y ser específico para los objetivos definidos para el individuo.
Parte 2: Adaptaciones Fisiológicas Positivas al Entrenamiento con Ejercicios de Fuerza en Adultos Mayores
Un Programa de Entrenamiento de Fuerza Adecuadamente Diseñado Puede Contrarrestar los Cambios Relacionados con la Edad en la Función Contráctil, la Atrofia y la Morfología del Músculo Esquelético Humano Envejecido.
Muchos estudios (66,278,468) han examinado el efecto del entrenamiento de fuerza sobre las medidas de la masa corporal magra total, el área de sección transversal (CSA, por sus siglas en inglés) de los músculos apendiculares específicos (es decir, el cuádriceps) y las fibras musculares individuales mediante biopsias. Un meta-análisis de Peterson et al. (468) demostró que los adultos mayores (hombres y mujeres de 65,5 + 6,5 años de edad) que realizan entrenamiento de fuerza de todo el cuerpo durante un promedio de 20,5 semanas, experimentaron un aumento de 1,1 kg en la masa corporal magra. Los autores (468) también señalaron que el volumen de entrenamiento y la edad de los participantes influyeron en la eficacia del entrenamiento de fuerza para mejorar la masa corporal magra, y que un mayor volumen de entrenamiento se asoció con un mayor aumento de la masa corporal magra.
Se ha demostrado que el entrenamiento de fuerza aumenta el CSA del músculo esquelético, incluso en los ancianos (85 años de edad y más) (183,352). Estudios previos han informado incrementos de 4-33% en el CSA anatómica (50,245,251,290,310,342,427,496,510,516); sin embargo, estos cambios son a menudo menores que los incrementos comúnmente informados para las mejoras en la fuerza muscular después del entrenamiento de fuerza en adultos más jóvenes (generalmente de 18 a 35 años de edad) (66,140). La investigación sobre la efectividad del entrenamiento de fuerza en el tamaño del músculo en adultos mayores también puede estar influenciada por el sexo (hombres > mujeres (288)), los músculos examinados (la magnitud de los aumentos difiere entre los 4 músculos del cuádriceps (245)), la longitud del músculo (el mayor aumento cerca de la región media del músculo (245,496,510)) y la medida del tamaño del músculo (p.ej., CSA anatómica versus fisiológica) (496). También se han informado aumentos inducidos por el entrenamiento en el tamaño de las fibras musculares individuales (201,241,243,352). Evidencia previa sugiere que la hipertrofia de la fibra puede estar influenciada por el sexo (29,277) y aminorada en edad avanzada (337,399,472,492). De manera similar, la función contráctil de una sola fibra (es decir, fuerza máxima, potencia y velocidad de acortamiento) mejora después del entrenamiento de fuerza en adultos mayores (492,609); sin embargo, estas adaptaciones también parecen estar influenciadas por el sexo (608) y la edad avanzada (561).
En resumen, el entrenamiento de fuerza puede contrarrestar los cambios relacionados con la edad en la función contráctil, la hipertrofia y la morfología del músculo esquelético humano envejecido.
Un Programa de Entrenamiento Adecuadamente Diseñado puede Mejorar la Fuerza Muscular, la Potencia y el Funcionamiento Neuromuscular de los Adultos Mayores: Fuerza Muscular
La dinapenia se ha utilizado para describir la pérdida de fuerza muscular relacionada con la edad (395). Estudios anteriores han indicado que los adultos mayores sanos experimentan una disminución de la fuerza del 0,8-3,6% por año, que puede ser más pronunciada en adultos muy mayores (199,225,373). El entrenamiento de fuerza ha demostrado ser un modo eficaz de actividad física para mitigar la pérdida de fuerza muscular relacionada con la edad. Por ejemplo, la fuerza de la parte superior e inferior del cuerpo puede mejorarse significativamente después del entrenamiento de fuerza (66,465) con aumentos que van del 9 al 174% (7,28,40,53,63,71,81,101,102,115,143,154,177,178,183,232,236,254,257,258,264,271,272,279,281,284) (286,290,291,308-310,342,366,387,416,428,454,477,482,483,491,497,502,503,516,540,579,581,594,606,630,641). En particular, el entrenamiento de fuerza produce mejoras en la fuerza muscular incluso en personas muy ancianas (>85 años de edad) (183,184,351). Varios estudios han sugerido que los adultos mayores experimentan aumentos similares en el porcentaje de fuerza en comparación con los adultos jóvenes (241,243,271,441); sin embargo, otros han informado mayores mejoras en los adultos jóvenes (365,389). Varios meta-análisis y revisiones recientes han informado que las adaptaciones de la fuerza están influenciadas por la duración del entrenamiento (66) y la intensidad del entrenamiento (66,465,552,573). Sin embargo, otros han sugerido que las diferencias entre las intensidades más altas y más bajas se minimizan cuando se igualan para el volumen total del entrenamiento (140,493). Tomados en conjunto, los adultos mayores pueden experimentar aumentos de fuerza en respuesta al entrenamiento de fuerza que dependen de la duración, intensidad y volumen.
Potencia Muscular
La potencia muscular esquelética puede definirse como el producto de la fuerza o torque de una contracción muscular y su velocidad. Investigaciones previas han sugerido que la potencia muscular esquelética disminuye a un ritmo mayor (68,292,412,414,414,558) y está más estrechamente relacionada con las limitaciones funcionales (43,45) en comparación con la fuerza muscular en adultos mayores. El entrenamiento de fuerza ha demostrado mejoras notables en la potencia muscular esquelética que van del 14 al 97% (150,186,262,263,274,383,398,489,499,528,559). Los meta-análisis recientes han indicado que el entrenamiento de fuerza a alta velocidad puede ser más efectivo para mejorar la potencia muscular en comparación con el entrenamiento tradicional de fuerza a baja velocidad (573,580). Además, se ha informado que los menores volúmenes de entrenamiento se asocian con grandes mejoras en la potencia muscular (580).
Tasa de Desarrollo de la Fuerza
La tasa de desarrollo de la fuerza/torque (RFD/RTD, por sus siglas en inglés) es una medida de fuerza explosiva o rápida que se deriva comúnmente del aumento temprano de la fuerza/torque durante una contracción isométrica voluntaria máxima (MVC, por sus siglas en inglés). Las reducciones relacionadas con la edad en la fuerza de la MVC (es decir, fuerza máxima) están bien documentadas (51,161,216,272,272,292,602,603). Sin embargo, se ha informado que la RFD/RTD disminuye a una magnitud mayor que la fuerza máxima (161,216,292,330,602,603) y se ha sugerido que es más importante para la función (451,452) y el riesgo de caídas (54,453) en adultos mayores. Se ha demostrado que la fuerza rápida de la parte superior e inferior del cuerpo aumenta significativamente después del entrenamiento de fuerza en adultos mayores (34,107,241,243,245,272,583,619).
Activación Muscular
Se ha informado que la activación muscular voluntaria de los músculos agonistas y la coactivación de los músculos antagonistas disminuyen (60,296,426,429,619,659) y aumentan (292,331,390), respectivamente, en adultos mayores en función del envejecimiento. Sin embargo, como se señaló en revisiones anteriores (280,329), estas conclusiones no son universales. Se ha demostrado que el entrenamiento de fuerza crónico aumenta la activación muscular agonista (428,496,497,529,619), mientras que otros no han informado cambios (181,251,333). Es posible que los aumentos en la activación sean más notables entre los sujetos con niveles iniciales de activación más bajos (529). Además, se ha informado una fuerte relación positiva entre el cambio en la activación voluntaria y el cambio en la fuerza isométrica (r = 0,92) y la fuerza específica (r = 0,86) después del entrenamiento de fuerza en los ancianos (251). Los hallazgos con respecto a los cambios en la coactivación inducidos por el entrenamiento, también se mezclan con los estudios previos que informan disminuciones (241,243), ningún cambio (427,428,496), y un aumento (147) en los adultos mayores. Se ha sugerido que la disminución de la coactivación antagonista después del entrenamiento de fuerza puede ocurrir en adultos mayores que demuestran una coactivación antagonista elevada (4).
Arquitectura Muscular
Investigaciones anteriores han informado resultados mixtos con respecto a los cambios relacionados con la edad en la arquitectura muscular. Por ejemplo, estudios previos han informado que el envejecimiento resulta en disminuciones en la longitud del fascículo y el ángulo de penación (436), disminuciones en el ángulo de penación solamente (216,429,604), disminuciones en la longitud del fascículo solamente (575), y ningún cambio en la arquitectura muscular (314). No obstante, se ha demostrado que el entrenamiento de fuerza crónico aumenta la longitud del fascículo (496) y el ángulo de penación (427,496,584). Sin embargo, Suetta et al. (585) demostraron que los adultos mayores pueden tener un cambio atenuado en la arquitectura muscular inducido por el entrenamiento de fuerza en comparación con los adultos jóvenes después de un período de inmovilización.
Inflamación Crónica
La inflamación crónica suele acompañar al envejecimiento (193,443) y se cree que contribuye mecánicamente a la pérdida de masa y función del músculo esquelético (460). Los marcadores inflamatorios circulantes (citoquinas y reactivos de fase aguda) son típicamente de 2 a 4 veces más altos en adultos mayores (443). Sin embargo, se ha informado una relación dosis-respuesta inversa e independiente entre la inflamación (medida por la concentración de proteína C reactiva plasmática) y el nivel de actividad física (443). El entrenamiento de fuerza a largo plazo parece mejorar la inflamación (98). Específicamente, como se describió en un meta-análisis reciente, los volúmenes de entrenamiento con un mayor número de ejercicios (>8), una frecuencia semanal más alta (3 veces por semana), y duraciones más largas (≥12 semanas) mostraron reducciones en la inflamación (según lo medido por la proteína C reactiva y TNF-α circulantes) (525). Curiosamente, la evidencia sugiere que esta relación puede estar mediada por la masa muscular (525).
Entrenamiento de Fuerza de Por Vida
La mayoría de los estudios de entrenamiento de fuerza incluyen períodos de entrenamiento que pueden durar de 6 a 52 semanas (66), y sin embargo, el envejecimiento de los grandes deportistas ha sido utilizado como modelo para investigar los efectos del entrenamiento de fuerza en la función y morfología muscular, implementado durante toda la vida del individuo. Estudios previos han informado que los grandes deportistas que compiten en levantamiento de pesas tienen mayor fuerza, potencia, RFD, volumen muscular y media de CSA en las fibras tipo II en comparación con los controles no entrenados de la misma edad (3,459,620). Además, un estudio reciente indicó que los grandes deportistas demostraron una mayor activación voluntaria en comparación con los adultos mayores sedentarios y recreativamente activos y tenían valores similares a los de los adultos más jóvenes (620). Estos resultados sugieren que el entrenamiento de fuerza puede ser un modo importante de actividad física para contrarrestar los cambios relacionados con la edad en la función neuromuscular (620). Estos estudios también informaron que los deportistas entrenados en fuerza de manera crónica demostraron reducciones similares de fuerza y potencia relacionadas con la edad en comparación con los controles no entrenados (459); sin embargo, los levantadores de pesas de 85 años demostraron una potencia similar a los controles de 65 años, lo que sugiere una ventaja de aproximadamente 20 años con el entrenamiento de fuerza crónico (459). Además, se ha demostrado que los adultos mayores entrenados en fuerza (∼68 años de edad) tienen características musculares (torques isométricos máximos, velocidad de movimiento, CSAs, tensiones específicas y un contenido de isoformas de miosina y tropomiosina) similares a las de los adultos 40 años más jóvenes (332). Por último, Kennis et al. (321) demostraron que los adultos mayores previamente sedentarios, que realizaron un entrenamiento crónico de fuerza durante un año, aún poseían mayores valores de fuerza después de 7 años de desentrenamiento en comparación con un grupo de control de igual edad, a pesar de una tasa similar de disminución de la fuerza durante los 7 años de seguimiento.
En resumen, a pesar de las disminuciones relacionadas con la edad, los adultos mayores que se involucran en un entrenamiento de fuerza a largo plazo, preservan la fuerza, la potencia, la masa y la función muscular.
Las Adaptaciones al Entrenamiento de Fuerza en Adultos Mayores están Mediadas por Adaptaciones Neuromusculares, Neuroendocrinas y Hormonales al Entrenamiento: Neuromuscular
Las principales adaptaciones al ejercicio de fuerza en adultos mayores se observan en el dominio neuromuscular mejorado directamente relacionado con la aplicación de la carga sobre el músculo. La investigación clásica de Moritani y deVries en 1980 reveló que los cambios neuronales pueden ser el principal mecanismo de mediación para el aumento de la fuerza en individuos mayores en la fase inicial del entrenamiento (425). La fuerza y la hipertrofia del músculo aumentan con el entrenamiento de fuerza en diferentes momentos (483), lo que indica dos mecanismos distintos en funcionamiento en el curso de tiempo de adaptación. Los aumentos en el tamaño muscular que resultan de la mejora de la función neural son vistos como los sellos distintivos del cambio adaptativo.
El sistema neuromuscular experimenta distintos efectos de envejecimiento (280). Los efectos de la edad han sido especulados para impactar la función de la unidad motora, ya sea por la pérdida apoptótica con la edad o por la falta de uso (439). La pérdida de unidades motoras, incluso en individuos activos sanos, es un factor primario subyacente a las reducciones de fuerza asociadas a la edad (163-166). Los investigadores han estimado que hay una reducción del 47% en el número de unidades motoras en individuos mayores (60-81 años de edad) (165,166). Sin embargo, los adultos mayores tienden a reclutar grandes unidades motoras durante la activación muscular, mientras que las unidades motoras más pequeñas generalmente se reclutan en individuos más jóvenes durante la contracción muscular (439). Sin embargo, a pesar de la pérdida de unidades motoras, los adultos mayores todavía son capaces de activar completamente sus músculos durante el entrenamiento de fuerza (84,473). Por lo tanto, no se cree que la debilidad muscular que ocurre con el envejecimiento sea causada por una falla en la activación muscular relativa.
El entrenamiento de fuerza mitiga la tasa y la magnitud de las disminuciones relacionadas con la edad en el sistema neuromuscular (4,197,199,547). Se ha demostrado que el entrenamiento de fuerza en adultos mayores produce varios cambios neurológicos, incluyendo una mayor activación del sistema nervioso central, una mayor amplitud de la actividad electromiográfica máxima (EMG) que resulta en una mayor magnitud de la actividad neuromuscular, mejoras en la RFD, aumentos en la frecuencia máxima de disparo de la motoneurona, un mejor control motor fino, mejoras en la activación muscular agonista y en la coactivación muscular antagonista, una mayor estabilidad de la fuerza y una reducción de las influencias inhibitorias en la columna vertebral, tal como fueron revisadas por Aagaard et al. (4). Los aumentos en las EMGs máximas integradas de los músculos entrenados se observan principalmente durante las primeras 8 semanas de entrenamiento, lo que indica una actividad neural alterada para mejorar el rendimiento (238-240,248). Con un entrenamiento de fuerza de intensidad moderada a alta a largo plazo (durante todo el año) (3 series de 8 repeticiones al 75% de 1RM, 3 veces a la semana), la fuerza aumenta rápidamente a lo largo de 3 meses, luego se mantiene en meseta con aumentos que van desde el 30% (extensores de cadera) hasta el 97% (flexores de cadera) en adultos mayores (edad promedio de 68 años de edad) (483).
Hipertrofia
En varias revisiones se ha demostrado que el entrenamiento de fuerza es un medio viable para mejorar colectivamente la fuerza, estructura y función en hombres y mujeres mayores (4,58,89,94,96,106,132,208,259,282,388,391,437,474,498,527,580,615,648). Más específicamente, el entrenamiento de fuerza puede aumentar el tamaño muscular y afectar las adaptaciones de las características estructurales de los músculos y tendones al aumentar la stiffness y la funcionalidad (498). Ocurren aumentos drásticos en la fuerza y el tamaño muscular usando entrenamiento en circuito del 50 al 75% de 1RM (611) al 75-90% de 1RM (658) en hombres mayores (60 años de edad).
Algunos estudios han mostrado aumentos similares en hombres y mujeres mayores (238,240,607), mientras que otros han mostrado respuestas de mayor tamaño muscular al entrenamiento de fuerza en hombres mayores que en mujeres (287,307). Sin embargo, mientras que los cambios en el CSA pueden ser mayores en los hombres que en las mujeres, el volumen muscular parece no mostrar diferencias de sexo en las adaptaciones a 6 meses de entrenamiento (516). Además, aunque 10 semanas de entrenamiento de fuerza de todo el cuerpo, no lineal y periodizado son efectivas para aumentar la fuerza y el tamaño muscular en hombres mayores, las adaptaciones no son tan profundas como las observadas en hombres jóvenes (342). Esto se debe probablemente a las diferencias en las influencias neuronales y/u hormonales.
A nivel de la fibra, se ha observado hipertrofia con entrenamiento de fuerza de carga ligera y muchas repeticiones en hombres mayores de alrededor de 65 años de edad (358). Se ha demostrado que el tamaño de las fibras musculares de ambos tipos I y II aumenta en el tamaño del área de sección transversal (33 y 27% respectivamente), con tomografías computarizadas que también demuestran un aumento general en el tamaño muscular del cuádriceps (201). Después de 30 semanas de entrenamiento de fuerza, el CSA tanto de tipo I (58%) como de tipo II (67%) aumenta (483). Interesantemente, el músculo esquelético de hombres y mujeres sin entrenamiento parece mostrar algunas diferencias en los aspectos estructurales de las fibras tipo I y tipo II (202). Sin embargo, el entrenamiento crónico de fuerza, puede disminuir las diferencias entre los sexos, observadas en la hipertrofia de los distintos tipos de fibras.
En resumen, el entrenamiento de fuerza puede mejorar las estructuras y funciones neuromusculares que se sabe que se deterioran con la edad. Aunque el proceso de envejecimiento en el sistema neuromuscular no se puede detener, es obvio a partir del trabajo de los últimos 50 años que se puede atenuar en magnitud y tasa de disminución a través de los diversos sistemas neuromusculares.
Adaptaciones Endocrinas
Las respuestas hormonales agudas al ejercicio de fuerza median adaptaciones al entrenamiento de fuerza (346). Una combinación de la respuesta hormonal aguda a un periodo de ejercicio y los estímulos mecánicos de la contracción muscular, que afecta a los receptores citoplásmicos de esteroides, estimula el crecimiento y la remodelación muscular, lo que resulta en un aumento de la fuerza muscular y la hipertrofia (346). Como el estrés del ejercicio de fuerza juega un papel en las capacidades secretoras, así como en las concentraciones basales cambiantes de las hormonas (338), la toma de muestras sanguíneas de las hormonas en reposo o después del ejercicio de fuerza ha proporcionado información sobre el papel que juega el ejercicio y el entrenamiento de fuerza en las adaptaciones (631). Con la edad, las células y los tejidos que componen varias glándulas endocrinas conocidas, como casi todas las células del cuerpo humano, cambian no sólo su estructura sino también sus capacidades secretoras (159,382). Como se evidencia en diferentes revisiones de la bibliografía, el ejercicio de fuerza tiene un impacto diferencial en varias vías de señalización hormonal y molecular, incluso con el envejecimiento (4,531,566,631). Debido a la naturaleza anabólica del entrenamiento de fuerza, se ha pensado durante mucho tiempo que el ejercicio de fuerza mejorará la estructura y función de estas glándulas y desempeñará un papel en la mitigación de los procesos de envejecimiento (513,517). La interfaz de la señalización hormonal con el envejecimiento y la sarcopenia se hizo evidente durante las décadas de 1980 y 1990 (549).
La bibliografía clínica ha demostrado que los hombres mayores muestran menores concentraciones de testosterona en sangre, llamada "andropausia", no obstante, la progresión y la variación individual ha sido polémica (59,175,319,463). Sin embargo, cuando la función hipogonadal ha sido diagnosticada adecuadamente con el conjunto de síntomas más allá de la testosterona baja, se presenta una multitud de efectos adversos en la función fisiológica de los hombres (36,104). Un artículo de revisión de 2010 señaló que los niveles de testosterona en sangre en reposo en los hombres disminuyen a una tasa de 1-3% por año después de los 40 años (631). En las mujeres, a pesar de los valores inherentemente más bajos, el envejecimiento ve una disminución en la testosterona total con una estabilización o ligeros aumentos después de la menopausia (175). Con el entrenamiento de fuerza, las concentraciones de testosterona en reposo no parecen cambiar en hombres y mujeres mayores, pero los efectos dependen del tipo de ejercicio y/o la duración del entrenamiento (10,12,67,137,201,244,246,289,299,342,504,636). Sin embargo, en respuesta a un período agudo de ejercicio de fuerza, los hombres mayores producen un aumento significativo en la testosterona circulante (10,246), especialmente con protocolos de ejercicio que involucran grandes masas musculares como las sentadillas (342). Aún no está claro si la expresión del ARNm del receptor de andrógenos aumenta en respuesta al entrenamiento de fuerza en hombres mayores con estudios que informan resultados contradictorios (10,12,276). Sin embargo, se ha demostrado que el contenido de receptores androgénicos intramusculares influye en la hipertrofia muscular esquelética después del entrenamiento de fuerza en hombres jóvenes (430). Aunque el ejercicio de fuerza puede aumentar el contenido de proteína androgénica (mediante el análisis de Western Blot) después del ejercicio de fuerza, el momento de la medición, el protocolo utilizado y el estado nutricional influyen en el aumento (347,631). Además, la testosterona también tiene muchas interfaces no genéticas con los tejidos, especialmente con el músculo esquelético (347).
El eje hipotalámico-hipofisario-adrenal está involucrado en el estrés, la fuerza y la culpabilidad de las personas mayores por patologías relacionadas con la edad (205,212). Se estima que el cortisol, una hormona catabólica, aumenta en un 20% de 50 a 89 años de edad tanto para hombres como para mujeres (360). Con el entrenamiento de fuerza, las concentraciones de cortisol en reposo permanecen inalteradas en los adultos mayores (89,244,291). Las respuestas de las concentraciones de cortisol en reposo al entrenamiento de fuerza en hombres y mujeres mayores son mixtas, y algunos individuos muestran disminuciones transitorias o ningún cambio (67,95,244,246,291,291,342,440). El patrón de respuesta aguda del cortisol al ejercicio de fuerza es similar en adultos mayores y jóvenes, pero la magnitud puede disminuir en adultos mayores (67,342,636). Sin embargo, tales hallazgos dependen del tipo de prueba de ejercicio utilizada, el programa de entrenamiento y/o la duración del mismo.
La hormona del crecimiento (GH) incluye una superfamilia de agregados, variantes de splicing y proteínas de unión (340,447,520). La forma bioactiva de la GH existe en concentraciones más altas en la sangre que la forma inmunorreactiva (343). En mujeres más jóvenes, el entrenamiento de fuerza provoca aumentos en las concentraciones de la GH bioactiva en la sangre (340,344,447). Se ha demostrado que la GH bioactiva es significativamente menor en mujeres mayores (61 años de edad) que en mujeres jóvenes (23 años de edad) después del ejercicio de fuerza agudo (228). Además, más de la mitad de los hombres y mujeres mayores (60-90 años de edad) muestran concentraciones extremadamente bajas o no tienen concentraciones detectables de GH bioactiva en su sangre (343), lo que sugiere que en algunos hombres y mujeres mayores, la síntesis pituitaria y las funciones secretoras disminuyen dramáticamente con la edad.
En cuanto a la GH inmunorreactiva, que se encuentra en concentraciones muy inferiores a la GH bioactiva, los valores de reposo no parecen verse afectados por el entrenamiento de fuerza (108,137,244,249,249,342,611,614). Como la respuesta aguda de la GH inmunorreactiva está relacionada con el tipo de ejercicio y los cambios en el pH sanguíneo (229,507), la respuesta al ejercicio de fuerza agudo en hombres y mujeres mayores es variable. Sin embargo, el ejercicio agudo típicamente lleva a poco o ningún cambio en la GH inmunorreactiva (219,299,348,611,622,636).
El factor de crecimiento similar a la insulina también representa una superfamilia de péptidos, proteínas de unión y variantes de splicing (213,446). El factor de crecimiento similar a la insulina I (IGF-I, por sus siglas en inglés) ha sido documentado como un biomarcador importante con respecto a la reparación y el metabolismo de los tejidos con implicaciones significativas para la salud y la aptitud física (401,446,448). Los cambios relacionados con la edad en el IGF-I pueden influir en una serie de mecanismos anabólicos diferentes relacionados con el crecimiento de los tejidos (565) y la función neuromuscular (450). Así, el IGF-I ha sido utilizado como un biomarcador para el envejecimiento y se ha demostrado que está asociado con los mecanismos inmuno-endocrinos que están relacionados con la fragilidad y las disminuciones funcionales en individuos de mayor edad (65). Un meta-análisis reciente de genoma completo demostró que los IGF-I e IGFBP-3 circulantes (proteína de unión 3) pueden llegar a tener un papel crucial en los mecanismos de mediación de la longevidad (598), y los individuos mayores pueden ver una reducción relacionada con la edad (250).
Los cambios en el IGF-I circulante o en su proteína de unión con ejercicio o entrenamiento de fuerza son altamente variables y no se observan en todos los estudios de hombres y mujeres mayores (614,658). En respuesta al ejercicio de fuerza, no se han observado cambios en reposo o aumentos agudos inducidos por el ejercicio en el IGF-I (484). De manera similar, los niveles basales y las respuestas agudas al entrenamiento de fuerza en el factor de mecano-crecimiento (MGF, por sus siglas en inglés), la quinasa regulada por señales extracelulares (Erk1/2), los niveles de proteína del homólogo celular del virus oncogénico AKT8 (Akt) y la proteína quinasa S6 ribosomal (p70S6K) o la isoforma Ea del factor de crecimiento similar a la insulina-I (IGF-IEa), y la expresión de ARNm del MGF no difieren entre los hombres jóvenes y los de mayor edad (11). Sin embargo, se ha demostrado que las concentraciones en reposo del IGF-I aumentan como resultado del entrenamiento con ejercicios de fuerza periodizados (342) y pesados (80% de 1RM) (108) en adultos mayores. Pero el entrenamiento de fuerza progresiva con bandas elásticas no generó aumentos (269).
En resumen, el sistema endocrino juega un papel vital en la señalización de varias hormonas en respuesta al ejercicio de fuerza. Sin embargo, los cambios en la concentración circulatoria de las respuestas basales/en reposo y al ejercicio agudo con y al entrenamiento de fuerza son variables en hombres y mujeres mayores. Debido a las múltiples interacciones con los receptores de tejido diana y los múltiples componentes celulares que se ven afectados por las secreciones circulantes de las glándulas endocrinas, existe dificultad en la interpretación de los cambios en los valores circulantes que se observan. Las concentraciones hormonales o los cambios con el estrés del ejercicio se han relacionado con cambios en la fuerza, el tamaño muscular y el anabolismo muscular, pero la forma en que estas señales son mediadas a nivel celular aún está por dilucidarse. No hay duda de que el sistema endocrino se activa tanto con los ejercicios como con el entrenamiento de fuerza, pero se necesita más trabajo para demostrar los mecanismos locales que son operativos y median los efectos anabólicos y/o catabólicos en los individuos mayores.
Parte 3: Beneficios funcionales del entrenamiento con ejercicios de fuerza para adultos mayores
Un Programa de Entrenamiento de Fuerza Adecuadamente Diseñado Puede Mejorar la Movilidad, el Funcionamiento Físico, el Rendimiento en las Actividades de la Vida Diaria (ADL) y Preservar la Independencia de los Adultos Mayores.
Las disminuciones asociadas con la edad en la salud y el funcionamiento físico pueden dificultar la capacidad de los adultos mayores para realizar las ADL requeridas para la vida independiente (9,283). Como el funcionamiento físico está relacionado con la fuerza y la potencia muscular (37,184,190), las intervenciones para mantener y desarrollar la fuerza y la potencia en los adultos mayores son necesarias para mantener el funcionamiento físico. La investigación ha demostrado que la actividad física y el ejercicio están relacionados con el retardo de la discapacidad, la preservación de la calidad de vida, la recuperación del funcionamiento independiente (76) y la prolongación de la vida independiente en adultos mayores (567), donde los niveles más altos de ejercicio fueron más efectivos para mejorar las ADL funcionales (353). La incidencia acumulada de discapacidad con las ADL es menor para los adultos mayores que hacen ejercicio (fuerza y/o aeróbico) (37,1%) que para los que no hacen ejercicio (52,5%) (461). Además, el entrenamiento de fuerza añadido al entrenamiento aeróbico resulta en una mayor mejoría de las tareas funcionales (562).
Con respecto al tipo y la cantidad de ejercicio, el ejercicio multimodal (por ejemplo, fuerza, aeróbico, funcional y de equilibrio) parece tener un amplio efecto en la mejora de la fuerza muscular, el equilibrio y el funcionamiento físico (379), mientras que el ejercicio de fuerza ha dado como resultado las ganancias más consistentes en las tareas funcionales (455,605) y aumenta la calidad de vida relacionada con la salud (152). Una revisión de Bray et al. (76) informó que los componentes del entrenamiento aeróbico, de fuerza, de flexibilidad y de equilibrio deben ser incorporados en la prescripción del ejercicio para prevenir el inicio de la fragilidad; las actividades de fuerza y equilibrio deben ser enfatizadas (76). En particular, el entrenamiento de fuerza puede atenuar específicamente los cambios en la movilidad funcional relacionados con la edad, incluyendo mejoras en la velocidad de la marcha, el equilibrio estático y dinámico y la reducción del riesgo de caídas (455). Como tal, el entrenamiento de fuerza solo y en combinación con el entrenamiento funcional (2 veces por semana durante 10 semanas) ha demostrado que mejora la capacidad de realizar las ADL en un 21% y un 26%, respectivamente (394).
Aunque la prescripción de ejercicio para el desempeño de las ADL debe seguir una evaluación de las necesidades y la individualización, la investigación ha demostrado que los adultos mayores deben hacer ejercicio de 2 a 3 veces a la semana, utilizando grandes grupos musculares, durante 30-60 minutos, con 2 minutos de descanso entre series (76,353,455). Se pueden lograr mayores beneficios funcionales al participar 3 veces a la semana que con menos frecuencia que 3 veces a la semana (435). Las sesiones que duran 30 minutos o más se han asociado con menores dificultades en las ADL (353). La intensidad del entrenamiento de fuerza debe basarse en un porcentaje estimado de 1RM. El inicio del programa debe darse al 55% de 1RM (resistencia muscular) y progresar a intensidades más altas del 80% de 1RM (fuerza) según lo tolere el individuo para maximizar las ganancias funcionales (76,455). Para la movilidad, el funcionamiento físico, el rendimiento de las actividades de la vida diaria y la independencia, se debe alentar a los adultos mayores a participar en actividades progresivas de entrenamiento de fuerza, y deben comenzar el entrenamiento de fuerza a un nivel individualizado apropiado para sus capacidades, y progresar hacia las cantidades diarias recomendadas de actividad (455).
En resumen, el entrenamiento de fuerza puede mejorar la movilidad, el funcionamiento físico, el rendimiento de las ADL y preservar la independencia de los adultos mayores.
Un Programa de Entrenamiento de Fuerza Adecuadamente Diseñado Puede Mejorar la Resistencia de un Adulto Mayor a Lesiones y Eventos Catastróficos como Caídas.
Las caídas son un peligro común en la población de adultos mayores en los Estados Unidos, donde el 30% de los adultos mayores experimentan al menos una caída anual, y el 50% de los adultos mayores de 80 años experimentan una caída cada año (24). Aunque las caídas pueden ser catastróficas para los adultos mayores, resultando en fracturas y lesiones graves, también son una causa importante de dolor crónico y discapacidad (111). Tanto la discapacidad física como la fragilidad pueden aumentar la susceptibilidad de los adultos mayores a eventos catastróficos severos (99,200,433,490). Sin embargo, los adultos mayores sin antecedentes de caídas informan más tiempo en sesiones de entrenamiento aeróbico y de fuerza en comparación con aquellos con antecedentes de caídas (15). Además, la importante asociación de protección entre el entrenamiento de fuerza y los incidentes de caídas se refuerza aún más tras el ajuste de las covariables (15).
Varios estudios han informado que las intervenciones con ejercicios multicomponentes pueden reducir la incidencia de caídas y, en consecuencia, prevenir la discapacidad, la morbilidad y la muerte (33,93,96,195,255,385). Un meta-análisis de 44 ensayos con 9.603 sujetos reveló que el ejercicio físico redujo la tasa de caída en un 17% (546). De manera similar, un meta-análisis más reciente de casi 20.000 adultos mayores que viven en comunidad demostró que el ejercicio redujo la tasa de caídas en un 21% (545). Los mayores efectos relativos del ejercicio sobre las tasas de caída se observaron en programas que incluían ejercicios de equilibrio y mayor volumen de ejercicios (546). Varios estudios han demostrado la importancia del ejercicio de fuerza en un régimen de ejercicios para reducir la vulnerabilidad a las caídas (564) y las caídas que causan lesiones (316). Además, las intervenciones con ejercicios en personas mayores que viven en la comunidad reducen el miedo a las caídas (320). Los programas de entrenamiento de fuerza progresiva que incluyen tanto ejercicios de todo el cuerpo con pesos libres como con máquinas, incluyendo ejercicios de pie de cadena cerrada, como sentadillas y sentadillas bulgaras, son efectivos para mejorar el equilibrio estático (221).
Además, los programas que desafían el equilibrio con ejercicios que incluyeron estar en bipedestación con los pies juntos y/o sobre una pierna, apoyo mínimo con las manos y movimientos controlados del centro de masa, pero sin caminar, demostraron los mayores efectos en la prevención de caídas (546). Por lo tanto, la progresión de ejercicios para los adultos mayores con riesgo de caídas puede comenzar con un entrenamiento de fuerza y de equilibrio antes del ejercicio aeróbico, particularmente para aquellos con osteoporosis.
En resumen, la evidencia apoya la eficacia del entrenamiento de fuerza como un medio eficaz para reducir la incidencia y las consecuencias de las caídas en los adultos mayores.
Un Programa de Entrenamiento de Fuerza Adecuadamente Diseñado Puede Ayudar a Mejorar el Bienestar Psicosocial de los Adultos Mayores.
Los trastornos psicológicos o de salud mental afectan aproximadamente al 20% de los adultos mayores (635). Entre los trastornos psicológicos y del estado de ánimo más frecuentes en los adultos mayores se encuentran la demencia, la depresión y la enfermedad de Alzheimer, que afectan al 14% (479), 10% (572) y 10% (479) de los adultos mayores, respectivamente. Tales condiciones parecen estar interrelacionadas, ya que se ha demostrado que la depresión está asociada con el deterioro del funcionamiento, el aumento de la morbilidad, la mortalidad y la demencia (572). Los estilos de vida sedentarios se asocian con un mayor riesgo de depresión (108,599). Además, con el envejecimiento, se cree que la pérdida del estado físico contribuye a la depresión (64,592).
Los programas de entrenamiento de fuerza diseñados adecuadamente ofrecen una variedad de beneficios psicológicos para los adultos mayores. Los programas de ejercicios de fuerza han sido efectivos para reducir los niveles de depresión clasificados por el propio paciente y el terapeuta en adultos mayores que residen en centros de atención a largo plazo (592) o en la comunidad (317,556). Se ha demostrado que el entrenamiento de fuerza ofrece una eficacia antidepresiva similar a la de los tratamientos farmacológicos estándar para los adultos mayores con depresión (556). Además, el entrenamiento de fuerza puede mitigar los problemas de comportamiento (tales como perturbación social, dificultades de comunicación, cuidado personal y confusión) asociados con las etapas avanzadas de la demencia (119).
Los beneficios del ejercicio de fuerza para mejorar los síntomas depresivos son más evidentes en adultos mayores con niveles clínicos de depresión de moderados a severos. Por ejemplo, Chen et al. (119) señalaron que un programa de entrenamiento de fuerza administrado a adultos mayores con demencia que residen en hogares de ancianos redujo la depresión durante un período de 15 meses, mientras que la condición de los sujetos de control que no hacían ejercicio se deterioró. Por otro lado, los estudios que evaluaron los cambios de humor después del entrenamiento de fuerza en adultos sanos y altamente motivados, mostraron beneficios positivos en el estado de ánimo (408,617).
Se ha demostrado que los programas de entrenamiento de fuerza tienen otros beneficios psicológicos y conductuales en los adultos mayores, tales como un mejor estado de ánimo general (108,119,660), cambios positivos en la confusión y el enojo (408), menos ansiedad (108,616,617), mejor calidad del sueño (108,556), menos tensión (408,616,617,617), mayor vigor (408,616,617,660), mayor conciencia espacial y tiempos de reacción visual y física [192], y autoeficacia (556,616).
Los estudios que se centran en los efectos psicológicos del entrenamiento de fuerza en adultos mayores generalmente han utilizado modalidades de entrenamiento con máquinas (108,408,556,616,617,660), mientras que unos pocos estudios utilizaron bandas elásticas (119,592) dirigidas a los principales grupos musculares. Los programas de intervención variaron desde 8 a 12 semanas a corto plazo (556,592,616,617,660) hasta 6 a 15 meses (108,119,317,408). Un estudio documentó que el mayor aumento en la calidad de vida y la disminución de los síntomas depresivos ocurrieron durante los primeros 3 meses del programa de entrenamiento de fuerza y se mantuvieron hasta el final de la intervención de 9 meses (317). Estos autores teorizaron que los grandes avances iniciales en la función física contribuyen a un mejor funcionamiento psicológico, pero tanto los avances físicos como psicológicos pueden estabilizarse después de algunos meses (317). Al mismo tiempo, la evidencia también indica que las mejoras psicológicas regresan al punto de partida si los adultos mayores terminan su participación en programas de entrenamiento de fuerza (317).
La mayoría de los estudios proporcionaron sesiones supervisadas 3 veces por semana (108,119,408,556,592,616,617,660). Un estudio intentó comparar los beneficios psicológicos del entrenamiento de fuerza realizado en 1, 2 ó 3 sesiones por semana (317). Los autores concluyeron que 2 y 3 sesiones por semana produjeron mayores mejorías en la calidad de vida ambiental que 1 sesión por semana. La calidad de vida psicológica y el sentido de coherencia mejoraron en respuesta a 1 y 2 sesiones por semana, mientras que los síntomas depresivos disminuyeron sólo en respuesta a 2-3 sesiones por semana (317). Estos autores sugirieron que dos sesiones por semana podrían ser las más beneficiosas y teorizaron que para los adultos mayores previamente sedentarios, tres sesiones de entrenamiento de fuerza de alta intensidad por semana podrían ser demasiado para su funcionamiento psicológico (317).
La intensidad del entrenamiento de fuerza varió entre los estudios pertinentes. Por ejemplo, dos estudios usaron series de 8-10 repeticiones al 80% de 1RM (108,408), mientras que otro estudio aplicó 10 repeticiones al 80% de 5RM (660). Algunos estudios tenían como objetivo observar la relación entre la intensidad del entrenamiento y los beneficios psicológicos (408,556,616,617). Tsutsumi et al. (616) compararon el entrenamiento de alta intensidad (8-10 repeticiones al 75-85% de 1RM) con el entrenamiento de baja intensidad (14-16 repeticiones al 55-65% de 1RM) y encontraron que ambos protocolos redujeron de manera similar la tensión y la ansiedad, y mejoraron la autoeficacia de los sujetos adultos mayores. Los autores concluyeron que los cambios psicológicos no se correlacionan necesariamente con la intensidad del programa de entrenamiento (616). Tsutsumi et al. adoptaron un protocolo similar de intensidad alta versus moderada (617) y no hubo diferencias entre los grupos experimentales en cuanto a los cambios en el estado de ánimo y ansiedad. Los autores señalaron, sin embargo, que para las mujeres mayores no entrenadas anteriormente, el programa de intensidad moderada era menos exigente y, por lo tanto, podría haber proporcionado una "experiencia más agradable" (617). Singh y cols. (556) también compararon los protocolos de alta intensidad (3 series de 8 repeticiones al 80% de 1RM) y baja intensidad (3 series de 8 repeticiones al 20% de 1RM). Estos autores encontraron un efecto de dosis-respuesta, mientras que el programa de alta intensidad redujo la depresión y la ansiedad, mejoró la confianza en la capacidad física, el bienestar general y la calidad de vida (317,556,616).
La intensidad del entrenamiento se asocia con los beneficios positivos del ejercicio de fuerza, en el que una mayor reducción de los síntomas de depresión es el resultado de un entrenamiento de mayor intensidad y un mayor aumento de la fuerza (556). Se ha demostrado que el aumento de la fuerza como resultado del entrenamiento de la misma está directamente relacionado con la reducción de los síntomas depresivos (556). Además, la reducción de los síntomas depresivos se asocia con un entrenamiento de mayor intensidad (556). El entrenamiento de mayor intensidad se ha asociado con mejoras positivas en la vitalidad, la calidad de vida y los cambios en la calidad del sueño (556). Los autores concluyeron que el entrenamiento de fuerza de alta intensidad es un método de tratamiento factible y seguro para los adultos mayores deprimidos con una mayor eficacia terapéutica que el entrenamiento de baja intensidad y la atención médica general (556). En cuanto a la frecuencia de entrenamiento, el entrenamiento de fuerza dos veces por semana es beneficioso para el funcionamiento psicológico (calidad de vida ambiental y sentido de coherencia) (317).
En resumen, el entrenamiento de fuerza realizado de 2 a 3 veces por semana con intensidades moderadas a altas, proporciona una variedad de beneficios psicosociales y de estado de ánimo positivo para los adultos mayores.
Parte 4: Consideraciones para Fragilidad, Sarcopenia u otras Afecciones Crónicas
Los Programas de Entrenamiento de Fuerza Pueden Adaptarse para Adultos Mayores con Fragilidad, Limitaciones de movilidad, Deterioro Cognitivo u otras Afecciones Crónicas.
Fragilidad
La fragilidad es un síndrome asociado a la edad que se caracteriza por la disminución de la reserva funcional biológica y la resistencia a los factores estresantes debido a cambios en varios sistemas fisiológicos, lo que aumenta la vulnerabilidad a los malos resultados (discapacidad, muerte por caída y hospitalización) de los factores estresantes menores (509) (100,508,509). La fragilidad abarca los cambios que se asocian con el envejecimiento, el estilo de vida, las enfermedades crónicas y las interacciones entre ellas (55,639). La prevalencia de la fragilidad en personas mayores de 65 años es alta (oscilando entre el 7,0 y el 16,3%) y aumenta con la edad (30,196,211), siendo la fragilidad el principal factor de riesgo de discapacidad en el envejecimiento (654). Uno de los principales problemas fisiopatológicos que subyacen al síndrome de fragilidad es la pérdida de fuerza y masa muscular con la edad. La atrofia muscular es exacerbada por la disminución de la actividad física, causando una disminución en la función general que lleva a la fragilidad (424,600). La inactividad física es también un factor clave que contribuye al inicio de la disminución de la masa y función musculares, que a su vez parece ser un aspecto vital relacionado con la fragilidad (509).
El deterioro de salud, la discapacidad y la dependencia no tienen por qué ser consecuencias inevitables del envejecimiento. De hecho, los adultos mayores que practican estilos de vida saludables, que evitan el sedentarismo, participan en ejercicio físico (por ejemplo, caminar, entrenamiento de fuerza o actividad física auto-ajustada), utilizan servicios clínicos preventivos y continúan interactuando con familiares y amigos, tienen más probabilidades de mantenerse saludables, vivir de manera independiente e incurrir en menos costos relacionados con la salud (656). El entrenamiento con ejercicios de fuerza es uno de los componentes más importantes para mejorar la capacidad funcional de los adultos mayores frágiles (96,121,153,381). Los estudios han encontrado que el entrenamiento de fuerza adaptado a esta población puede ayudar a restaurar la función física en adultos mayores frágiles (88,184,255,384,536). Los programas de entrenamiento de fuerza que se realizan 3 veces a la semana, con 3 series de 8-12 repeticiones a una intensidad que comienza entre el 20-30% de 1RM y progresa hasta el 80% de 1RM, producen efectos positivos sobre las velocidades habituales de la marcha, la capacidad de subir escaleras, los niveles generales de actividad física y el aumento de la fuerza y la potencia muscular (88,96,184,261,384,536). El entrenamiento de fuerza parece bien tolerado en las poblaciones de adultos mayores frágiles, ya que no se informaron o supervisaron lesiones o efectos secundarios adversos en varios estudios que investigaron los efectos del entrenamiento de fuerza en adultos mayores frágiles (184,261,359,536,586).
Para optimizar la capacidad funcional, los programas de entrenamiento de fuerza deben incluir la familiarización con el entrenamiento en la que se utiliza la masa corporal del sujeto para la resistencia y en el que se simulan las actividades diarias habituales (como el ejercicio de "sentarse y ponerse de pie") (88). Además, con la programación periódica, se pueden incorporar ejercicios de fuerza que se realizan con una alta velocidad de movimiento para promover mayores mejorías en el rendimiento de las tareas funcionales de los adultos mayores (88,488). Se ha demostrado que doce semanas de entrenamiento con ejercicios multicomponentes, incluido el entrenamiento de fuerza explosiva, mejoran la producción de potencia muscular (96-116%), la fuerza (24-144%), el CSA del músculo y la infiltración de grasa en el músculo (4-8%), así como los resultados funcionales y el rendimiento de tareas duales (7-58%) en frágiles nonagenarios institucionalizados (88). Sin embargo, una forma y ejecución deficientes del ejercicio y la OA severa son contraindicaciones para el entrenamiento de fuerza a alta velocidad. Para el entrenamiento de fuerza explosivo se debe seguir un proceso de familiarización y progresión adecuado. Las intervenciones de entrenamiento de fuerza realizadas 3 veces a la semana, con 3 series de 8-12 repeticiones y una intensidad que comienza entre el 20 y el 30% y progresa hasta el 80% de 1RM, parecen ser bien toleradas por los adultos mayores con fragilidad, lo que resulta en aumentos marcados de la fuerza muscular (94,261,586).
Aunque se ha demostrado que las intervenciones de entrenamiento de fuerza promueven marcadas mejorías en la función neuromuscular, los programas de ejercicios multicomponentes que incluyen entrenamiento de fuerza parecen dar lugar a mayores mejoras generales, presumiblemente porque este tipo de intervención estimula varios componentes de la salud física, como la fuerza, el estado físico cardiorrespiratorio y el equilibrio (62,88,96,195,255). Además, los programas de ejercicio (incluyendo el entrenamiento de fuerza) también conducen a parámetros funcionales mejorados, como la marcha y el equilibrio, y reducen el riesgo de caídas (33,88,96,125,255,385). Los efectos positivos sobre la capacidad funcional se observan con mayor frecuencia cuando más de un componente de acondicionamiento físico (es decir, fuerza, resistencia o equilibrio) comprende la intervención de ejercicio (96,385,627), en comparación con un solo tipo de ejercicio (536,595). Varios estudios también han informado que las intervenciones con ejercicios multicomponentes también pueden reducir la incidencia de caídas y, en consecuencia, prevenir la discapacidad, la morbilidad y la mortalidad temprana (33,88,96,195,255,385).
En resumen, un programa de intervención con ejercicios multicomponentes que consiste en entrenamiento de fuerza, re-entrenamiento de la marcha y entrenamiento del equilibrio parece ser la mejor estrategia para mejorar la marcha, el equilibrio y la fuerza, así como para reducir la tasa de caídas en los adultos mayores y, en consecuencia, mantener su capacidad funcional durante el envejecimiento. Los estudios en los que el entrenamiento de fuerza se realizó solo o como parte de programas de ejercicios multicomponentes, revelaron un mayor aumento de la fuerza en adultos mayores con fragilidad física o disminución funcional severa. La Tabla 2 proporciona un resumen de los principales resultados y características del entrenamiento de algunos estudios que aplicaron programas sistemáticos de entrenamiento de fuerza solos, o que fueron incluidos en programas de ejercicios multicomponentes en adultos mayores frágiles.
Tabla 2. Guías de entrenamiento de fuerza para adultos mayores con fragilidad.†
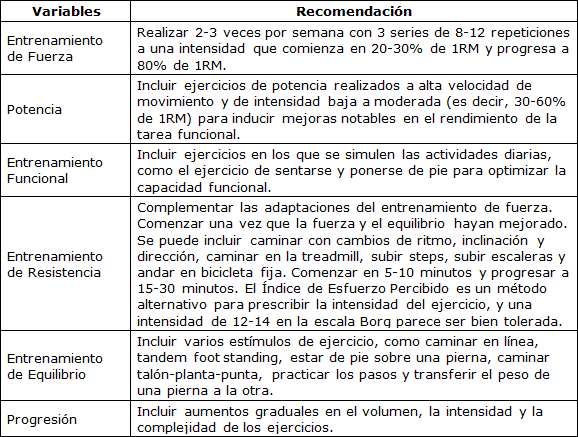
*RM: Repetición Máxima
†Los ejercicios deben realizarse con la forma y la técnica adecuadas. La forma y la técnica deben establecerse antes de la progresión del ejercicio y mantenerse durante la progresión.
Limitaciones de Movilidad
Aproximadamente 53 millones de estadounidenses viven con una discapacidad (198). Las limitaciones de movilidad derivadas de discapacidades físicas pueden surgir de muchas etiologías diferentes, incluyendo congénita (por ejemplo, parálisis cerebral y distrofia muscular), adquirida (por ejemplo, lesión de la médula espinal y amputación de miembros inferiores), o como una función gradual de fragilidad relacionada con el envejecimiento. Independientemente de la etiología, las personas con discapacidades físicas a menudo experimentan muchos resultados negativos secundarios de salud, como una peor calidad de vida (431) y un mayor riesgo de morbilidad crónica (327), así como una mortalidad prematura (191). Además, tener una discapacidad física puede aumentar el riesgo de desarrollar una afección de salud que está directamente relacionada con las deficiencias (por ejemplo, dolor, contracturas articulares, espasticidad muscular, hipertonía/hipotonía y disquinesia) o que ocurre como consecuencia indirecta de la propia deficiencia (por ejemplo, aumento de las conductas sedentarias y de las afecciones relacionadas con la obesidad, como la diabetes y la enfermedad cardiovascular ateroesclerótica [CVD, por sus siglas en inglés]). La inactividad física, uno de los principales impulsores de estos resultados de salud (149,464), es más frecuente en adultos con discapacidades físicas, ya que sólo alrededor de una cuarta parte de los adultos con discapacidades cumplen con las recomendaciones nacionales actuales sobre actividad física y también son significativamente más sedentarios que los adultos sin discapacidades (70,133,402). Por lo tanto, se han hecho recomendaciones para estudios de intervención de actividad física para adultos con discapacidades, tales como el uso de un marco teórico para el cambio de comportamiento, el entrenamiento, la retroalimentación y los modelos de conducta (114,351). De hecho, hay varias consideraciones importantes que determinan la elección de la intervención, junto con la fisiopatología, incluidos todos los diversos aspectos de la Clasificación Internacional del Funcionamiento, la Discapacidad y la Salud (ICF, por sus siglas en inglés) de la Organización Mundial de la Salud (World Health Organization's International Classification of Functioning, Disability and Health) (646) y el entorno psicosocial del paciente.
El veinticuatro por ciento (24%) de los adultos de 65 años de edad y mayores utilizan ayudas para la movilidad (por ejemplo, bastones, andadores o sillas de ruedas), y su uso aumenta con la edad (215). Las ayudas para la movilidad pueden compensar la disminución del equilibrio, la fuerza, la coordinación, la sensibilidad, la reacción y el aumento del riesgo de caídas. La caída presenta un evento prevalente en el envejecimiento, ya que el 35-40% de los adultos que viven en la sociedad, de 65 años de edad y mayores, se caen cada año (113). A medida que han aumentado los esfuerzos de prevención de caídas, también lo ha hecho el uso de ayudas para la movilidad, que han aumentado en 26, 57 y 65% para bastones, andadores y sillas de ruedas, respectivamente, entre todas las edades (357). Considerando la alta prevalencia de problemas de movilidad con el envejecimiento, los ejercicios tradicionales de fuerza realizados en bipedestación sin ayuda pueden no ser realistas para los adultos mayores con equilibrio y movilidad comprometidos. Como tal, los ejercicios pueden adaptarse para que se realicen principalmente en posición de sedestación para los ejercicios en silla (23). Los programas de ejercicios de fuerza en silla pueden ser realizados por adultos mayores con movilidad limitada tanto en hogares de cuidado residencial como en la comunidad y han mostrado mejoras en la movilidad funcional (TUG, tests sit-to-stand, velocidad de la marcha, fuerza y actividad física) (23). Los programas pueden progresar hasta la posición de bipedestación a medida que la fuerza, el equilibrio y la funcionalidad mejoran. La duración de los programas ha fluctuado entre 6 semanas y 6 meses, con una frecuencia que oscila entre diariamente y 3 veces por semana, y un tiempo que va desde 20 a 60 minutos por sesión (23).
La mayoría de los estudios publicados relacionados con el ejercicio de fuerza en adultos mayores ha incorporado pruebas y entrenamientos unilaterales mono-articulares. Estos son vitales para resaltar las asimetrías de fuerza para grupos de músculos individuales, así como para identificar las discrepancias en la relación de fuerza entre los músculos agonistas/antagonistas (por ejemplo, cuádriceps e isquiotibiales). Esto es particularmente importante para adultos con condiciones congénitas como parálisis cerebral o después de un ACV, ya que a menudo hay asimetrías profundas entre las extremidades u osteoporosis. Es importante destacar que, a medida que las personas con parálisis cerebral envejecen, surge una amplia gama de afecciones no psicosociales y no transmisibles, entre las que se incluyen la disminución de la densidad mineral ósea, el aumento de la adiposidad visceral, la atrofia muscular y la sarcopenia, la alteración de la tolerancia a la glucosa y la resistencia a la insulina, la disminución de la participación en la actividad física y las conductas sedentarias exageradas (31,356,456,423,423,471,571,512,544,550,569,569,645). Estos factores colocan a los individuos con parálisis cerebral y otras discapacidades de inicio pediátrico en un riesgo acelerado de afecciones crónicas secundarias relacionadas con la edad como la osteoporosis, la diabetes y la CVD primaria (466,612). Muchas de estas condiciones de salud que enfrentan los individuos con parálisis cerebral no son específicas de la población y, por lo tanto, representan un modelo de envejecimiento prematuro y fragilidad.
En lo que respecta a la capacidad funcional, los protocolos de fortalecimiento mono-articular son intrínsecamente limitados. Sin embargo, los ejercicios de tríceps y la abducción de cadera pueden beneficiar mejoras funcionales en los adultos mayores con riesgo de caídas. En cambio, para los pacientes que pueden tolerar los ejercicios bilaterales de cadena cinética cerrada, éstos representan una indicación muy superior de la capacidad de fuerza coordinada intermuscular. Por lo tanto, las pruebas y el entrenamiento deben reflejar todos los grupos musculares principales de las extremidades superiores e inferiores con prioridad para los movimientos multiarticulares (por ejemplo, prensa de piernas, pararse desde la silla, press de pecho y lat-pull down o remo sentado). Para las personas con impedimentos de movilidad significativos, los ejercicios de bipedestación pueden no ser prácticos o incluso imposibles debido a la fragilidad, el dolor, la espasticidad y las anomalías de la marcha/ortopédicas. En tales casos, los ejercicios de fuerza se pueden realizar en posición de sedestación, y el ejercicio aeróbico complementario puede ser posible usando un cicloergómetro reclinado sentado y/o un escalador, o un ergómetro de miembro superiores. Además, todas las pruebas de ejercicio deben realizarse con precaución, y deben completarse con el propósito de diseñar prescripciones individualizadas de actividad física y ejercicio.
Deterioro Cognitivo Leve y Demencia
El deterioro cognitivo leve se considera un estado de transición entre el envejecimiento cognitivo normal y la demencia temprana (393,588). Estudios recientes han demostrado que los adultos mayores con deterioro cognitivo leve tienen una mayor prevalencia de deterioro en la marcha que los adultos mayores cognitivamente normales (420). La demencia es un síndrome que representa un importante problema de salud pública porque repercute en la capacidad para la vida diaria activa y afecta a las funciones sociales y ocupacionales (265).
El deterioro cognitivo ha estado estrechamente relacionado con el síndrome de fragilidad porque ambas enfermedades comparten algunos mecanismos fisiopatológicos y consecuencias a corto y medio plazo (por ejemplo, hospitalización, incidencia de caídas, discapacidad, institucionalziación y muerte) (105,211). Además, con la progresión de la demencia, los adultos mayores con trastornos cognitivos generalmente se vuelven pacientes frágiles e institucionalizados (265,555). Asimismo, el sistema nervioso central y el muscular comparten vías patógenas comunes en la evolución de la discapacidad, lo que probablemente subyace a la asociación negativa entre la fuerza muscular y el deterioro cognitivo (420). Además, una de las principales consecuencias negativas de la demencia es la grave disminución de la actividad física, que puede atribuirse a varias causas, incluido el uso de restricciones físicas para evitar caídas (56). Las restricciones físicas, que se utilizan comúnmente en adultos mayores que requieren cuidados de enfermería a largo plazo (663), se asocian con resultados sociales, psicológicos y físicos adversos, como pérdida de autonomía, sarcopenia exacerbada, pérdida de fuerza, deterioro de la capacidad para ponerse de pie y caminar, y disminución general del estado funcional y de la calidad de vida (56,663).
El ejercicio físico es una intervención efectiva para contrarrestar las consecuencias físicas del deterioro cognitivo leve y la demencia (185,265,375,478). En un meta-análisis de Heyn et al. (2004) que incluyó 30 ensayos de sujetos con demencia y deterioro cognitivo leve (edad media = 80 años, rango 66-91 años), se demostró que el entrenamiento con ejercicios (varias intervenciones, incluido el entrenamiento de fuerza) mejoró el estado físico, la función física y la función cognitiva. Además, se ha demostrado en otro meta-análisis que las mejoras en la fuerza y la resistencia inducidas por el entrenamiento con ejercicios en pacientes con deterioro cognitivo son similares a las logradas en adultos mayores cognitivamente intactos (266).
Aunque hay pocos estudios que comparen la efectividad de diferentes protocolos de entrenamiento con ejercicios sobre el estado cognitivo y funcional de los adultos mayores con trastornos cognitivos, las intervenciones del entrenamiento de fuerza han mostrado varios beneficios para estos individuos (93,185,265,375,478). Tales beneficios incluyen reducciones en la morbilidad (375), mejoras en la fuerza, el equilibrio y la capacidad de la marcha (93), y la función cognitiva global (185), con el mantenimiento del beneficio ejecutivo y global (185). Se han observado beneficios cognitivos después del entrenamiento de fuerza en diferentes RCTs (185,376,403,623) y meta-análisis (265,266). Además, las intervenciones combinadas de entrenamiento aeróbico y de fuerza demostraron mayores beneficios sobre la función cognitiva que aquellas que sólo incluían entrenamiento aeróbico (129). Los ensayos clínicos aleatorios que examinan los efectos del entrenamiento de fuerza sobre la función cognitiva han demostrado mejorías significativas en las tareas ejecutivas de atención (376), memoria (588), fluidez verbal (588) y función cognitiva global (185,588,593). Sin embargo, las intervenciones de actividad física que incluyen ejercicios de fuerza han mostrado beneficios inconsistentes en la prevención del deterioro cognitivo (313), y se necesitan más estudios que utilicen el entrenamiento de fuerza en particular (313).
Incluso sin beneficios cognitivos consistentes en pacientes con deterioro cognitivo leve o demencia, se ha demostrado que la fuerza por sí sola o incluida en una intervención de ejercicio multicomponente promueve varias mejoras en la función neuromuscular y el rendimiento funcional (256,393,478), incluso en sujetos con deterioro grave del estado funcional (93). En un estudio de Hauer et al. (256), 3 meses de entrenamiento progresivo de fuerza, logrando intensidades de 70-80% de 1RM combinado con entrenamiento funcional dos veces por semana, resultaron en aumentos significativos en la fuerza máxima y el rendimiento funcional en adultos mayores con demencia. Además, se ha demostrado recientemente que 4 semanas de entrenamiento de fuerza de alta velocidad combinado con caminata, ejercicio cognitivo y entrenamiento del equilibrio mejoraron la capacidad de la marcha, el equilibrio y la fuerza muscular (15-30%) y redujeron la incidencia de caídas en pacientes polipatológicos frágiles con demencia después de una restricción física a largo plazo bajo asistencia de enfermería (93). En este estudio, la intensidad del entrenamiento de fuerza comenzó en un 30% de 1RM y progresó al 50% de 1RM. En otro estudio, Mavros et al. (403) demostraron que en adultos mayores (de más de 55 años de edad) con deterioro cognitivo leve, el entrenamiento de fuerza progresiva (80% de 1RM, 2-3 días a la semana durante 6 meses) aumenta la fuerza muscular y el VO2máx. De manera interesante, su estudio mostró que las puntuaciones de fuerza más altas estaban asociadas significativamente con mejoras en la función cognitiva.
En conjunto, el entrenamiento de fuerza puede mejorar la función cognitiva, neuromuscular y las pérdidas de capacidad funcional asociadas con el deterioro cognitivo leve y la demencia (185,265,403,478). Los programas de entrenamiento de fuerza pueden adaptarse (con simplificación e instrucciones visuales) para los adultos mayores con deterioro cognitivo leve y demencia. Las recomendaciones para el entrenamiento de fuerza para individuos con deterioro cognitivo leve y demencia, dependen del estado funcional, y en las primeras fases de estas patologías se pueden aplicar pautas y programas más convencionales con componentes de entrenamiento de fuerza bien establecidos. De esta manera, se recomiendan volúmenes e intensidades progresivas. Con base en los estudios mencionados anteriormente, las intensidades que alcanzan el 70-80% de 1RM son bien toleradas con muy pocos eventos adversos en el músculo esquelético para los adultos mayores con deterioro cognitivo leve y demencia, no diferentes de los adultos mayores con función cognitiva intacta (265,403). Sin embargo, las intensidades más bajas, que oscilan entre el 30 y el 50% de 1RM, realizadas a velocidades más rápidas (es decir, entrenamiento de fuerza explosiva) pueden ser una alternativa para mejorar la capacidad funcional y la función neuromuscular en general (93). A medida que las condiciones progresan con un deterioro funcional de moderado a severo, a menudo se necesitan modificaciones significativas (incluyendo ejercicios e instrucciones más simples, mayor supervisión e instrucción repetitiva y visual) con el fisioterapeuta, el médico y/o el terapista ocupacional.
Las recomendaciones adicionales para mejorar el éxito durante la prescripción de ejercicios de fuerza para individuos con demencia incluyen la consideración de aspectos emocionales, tales como la tranquilidad, el respeto, la empatía y los desafíos de comunicación (328). La estructura simple de las instrucciones, el soporte háptico y el uso de técnicas de espejo en lugar de instrucciones orales complejas pueden apoyar el progreso del entrenamiento y crear una atmósfera de entrenamiento familiar y empática para las personas con demencia (93). Finalmente, el profesional del ejercicio debe estar preparado para manejar cualquier arrebato de ira o agresión con el entendimiento de que estas son consecuencias de un proceso de enfermedad y no de un ataque personal.
Diabetes
La diabetes afecta aproximadamente a 1 de cada 4 adultos mayores ≥65 años de edad en los Estados Unidos (112). A nivel mundial, hay más de 425 millones de personas con diabetes, y la carga económica asociada ha alcanzado casi $550 billones de dólares sólo en los Estados Unidos (8). Los deterioros de la función física y la salud morfológica relacionadas con la edad contribuyen aún más a un riesgo exagerado a nivel individual, y sin embargo, el aumento de la incidencia de diabetes diagnosticada combinado con la disminución de la mortalidad o el aumento de la esperanza de vida han llevado a un mayor riesgo a lo largo de la vida y a un mayor número de años de diabetes y de CVD, a nivel de la población (235). La contribución de la atrofia muscular y la debilidad en la progresión de las enfermedades cardiometabólicas secundarias al envejecimiento y/o la enfermedad (por ejemplo, la fragilidad y la discapacidad de movilidad) es igualmente significativa, y los esfuerzos recientes para identificar los puntos de corte o los umbrales de debilidad entre los adultos mayores (14,409,568) deben permitir que los médicos examinen a los individuos con mayor riesgo.
El entrenamiento de fuerza en sí mismo, incluso en ausencia de ejercicio aeróbico, ha demostrado que disminuye el riesgo de diabetes tipo 2 y CVD (237,548,591). Además, Senechal et al. (535) demostraron que la fuerza baja se asocia de forma independiente con mayores probabilidades de síndrome metabólico en hombres de mediana edad y de edad avanzada, y pudieron identificar puntos de corte para la fuerza baja normalizada, que predijeron mejor el aumento del riesgo. Además, dos estudios recientes del Estudio Longitudinal de Envejecimiento de Baltimore (the Baltimore Longitudinal Study of Aging) han demostrado que una mayor adiposidad (421) y una hiperglucemia crónica (312) (es decir, dos características distintivas de la diabetes) se asocian con una calidad y una fuerza muscular persistentemente inferiores, respectivamente.
Después de controlar la edad, las personas con diabetes son menos activas físicamente y tienen más impedimentos funcionales que las personas sin diabetes (234). Afortunadamente, el entrenamiento de fuerza puede revertir algunos de los efectos negativos funcionales y neuromusculares asociados con la diabetes tipo 2 en adultos mayores (273,364). El entrenamiento de fuerza podría beneficiar a los adultos mayores que viven con diabetes tipo 2 a través de la hipertrofia muscular, la mejora de la calidad muscular, el aumento de la fuerza, la movilidad, la función, la mejora de la composición corporal y el control glucémico (73,109,171,273). Se ha demostrado que el entrenamiento de fuerza mejora las medidas del proceso de la enfermedad diabética, incluyendo la presión arterial, la hemoglobina A1c (HbA1c), la glucosa en ayunas, la insulina y el colesterol (lipoproteína de baja densidad y total) en adultos mayores (273). Además, el entrenamiento de fuerza puede reducir los niveles de HbA1c, aumentar las reservas de glucógeno muscular y reducir la dosis del medicamento recetado para la diabetes (109) en un grado clínicamente similar al entrenamiento aeróbico (657).
Los programas benéficos de entrenamiento de fuerza para adultos mayores con diabetes han incluido entrenamiento de fuerza progresivo de cuerpo completo de intensidad moderada a alta (60-80% 1RM), 3 veces por semana durante 16 semanas a 6 meses (83,109,171). Dado que la diabetes suele estar asociada con otros factores de riesgo y complicaciones, los programas de entrenamiento de fuerza para adultos mayores con diabetes deben ser individualizados y seguir los exámenes y pruebas médicas, las guías y la autorización de los médicos. En particular, las personas con diabetes pueden ser vulnerables a episodios de hipoglucemia (glucosa <70 mg·dl−1) durante el ejercicio de fuerza. Por lo tanto, el nivel de glucosa debe ser monitoreado antes y después de la sesión de ejercicio para reducir el miedo a la hipoglucemia inducida por el ejercicio (128). Además, los adultos mayores con diabetes también son más propensos a CVD, enfermedades nerviosas, enfermedades renales, enfermedades oculares y limitaciones ortopédicas (128). Por lo tanto, se necesitan consideraciones especiales para la supervisión, la intensidad, la selección de ejercicios, la modalidad, el posicionamiento, la examinación y protección de los pies y las limitaciones visuales, tal como se describe en el Position Stand de la Asociación Americana de Diabetes (American Diabetes Association) (128).
Obesidad
Aproximadamente el 39% de los adultos mayores en los Estados Unidos son obesos (189); sin embargo, hay una gran variabilidad entre razas/etnias (blancos no hispanos: 39%; negros no hispanos: 48%; asiáticos: 8%; e hispanos: 39%). Sin embargo, la obesidad es una condición heterogénea que debe ser considerada en los contextos biológicos y de salud pública más amplios en los que está contenida. La adiposidad visceral excesiva para un índice de masa corporal dado puede ser un indicador de tejido adiposo disfuncional, lo que provoca un aumento de la deposición de grasa ectópica (156-158). Las investigaciones en curso han demostrado que la obesidad tiene consecuencias fisiopatológicas sobre la salud y la función tanto de los huesos como de los músculos esqueléticos (77,224,231,626). La infiltración de lípidos en depósitos no adiposos (por ejemplo, músculo e hígado) aparece como una característica de ciertos procesos de enfermedad (por ejemplo, diabetes tipo 2) (206), así como con un comportamiento sedentario prolongado (396) y a menudo se caracteriza por datos morfológicos gruesos de adultos con tomografía computarizada (22,224,661), o tejido adiposo intramuscular localizado, lípido intramiocelular y/o tejido adiposo en médula ósea con tecnologías de resonancia magnética (77,515). Investigaciones anteriores han revelado una relación sólida entre tejido adiposo intermuscular y niveles elevados de hormonas proinflamatorias derivadas de adipocitos y citoquinas (46,662), lo que también puede conducir a la resistencia a la insulina del músculo esquelético y a una disminución de la calidad muscular y ósea (126,633). Por lo tanto, junto con cambios pronunciados en el medio hormonal/metabólico, una adiposidad visceral y muscular excesiva podría dar lugar a un entorno fisiológico inhóspito general que contribuiría a la fragilidad musculoesquelética. Es bien sabido que los adultos mayores sedentarios tienen un riesgo significativamente mayor de padecer debilidad muscular y obesidad sarcopénica (336,522), que se cree que son los principales impulsores de la fragilidad musculoesquelética (131,445,458,618), anomalías cardiometabólicas (371,532) y mortalidad temprana multicausal (27,521,655). Los hallazgos también han indicado que el tejido adiposo localizado dentro y alrededor del músculo está relacionado con la reducción de la calidad muscular (es decir, la fuerza por unidad de masa muscular) en la obesidad y el envejecimiento (155,222,226), así como la discapacidad motriz (632). Una adiposidad excesiva en la edad adulta mayor crearía así un doble efecto negativo, no sólo del aumento de la masa, sino también de la simultánea disminución de la capacidad de un individuo para levantar esa masa debido a la disminución de la calidad del músculo. Por lo tanto, el tratamiento de la obesidad en adultos mayores requiere un enfoque integral para reducir simultáneamente el exceso de adiposidad, pero también para estimular directamente la hipertrofia muscular y la preservación de la masa corporal magra.
El entrenamiento de fuerza ha recibido poca atención de las comunidades clínicas y de salud pública con respecto a su papel en la prevención o el tratamiento de la obesidad, ya que generalmente se cree que es ineficaz para la pérdida de peso. Sin embargo, una base bibliográfica de larga data ha demostrado la utilidad del ejercicio de fuerza para estimular las adaptaciones cardiorrespiratorias, endocrinas, metabólicas, neuromusculares y morfológicas positivas, independientemente de la pérdida de peso. En cuanto a la prescripción de ejercicios, las recomendaciones mínimas actuales para los adultos mayores con obesidad piden que el entrenamiento de fuerza complemente la actividad física general y el ejercicio cardiorrespiratorio y que se realice 2 ó 3 días no consecutivos a la semana, utilizando una única serie de 5-10 ejercicios para todo el cuerpo, y a un nivel moderado de intensidad que permita de 10 a 15 repeticiones. Como se acepta generalmente para los principiantes, la prescripción de entrenamiento de fuerza para los adultos mayores con obesidad debe incluir un período de familiarización en el cual el entrenamiento de dosis muy bajas (es decir, series e intensidades mínimas) se lleva a cabo de 1 a 2 veces por semana. Después de la fase de familiarización, los adultos con obesidad se beneficiarían de aumentos graduales en la dosis para acomodar las mejoras en la fuerza y la hipertrofia muscular. Aunque las pautas mínimas establecidas proporcionan una base para aumentar el estado físico muscular de los individuos no entrenados, ahora hay pruebas suficientes para confirmar la viabilidad del ejercicio de fuerza progresivo para mejorar la fuerza y la masa muscular en todos los adultos mayores. Sugerencias adicionales sobre la progresión en el ejercicio de fuerza incluyen (a) aumentos graduales de intensidad desde muy ligera (40% de 1RM) a ligera (50% de 1RM), moderada (60% de 1RM), y vigorosa (≥70% de 1RM); (b) aumentos graduales en el número de series, de 2 series a 4 series por grupo muscular; (c) disminución gradual del número de repeticiones realizadas para que coincida con una carga progresivamente más pesada, de 10 a 15 repeticiones por serie a aproximadamente 8-12 repeticiones por serie; y (d) progresión en el modo desde ejercicio de fuerza basado principalmente en máquinas a entrenamiento de fuerza en máquina más pesos libres (o ejercicios en sedestación cuando la OA de rodilla o cadera dificulta la bipedestación).
La obesidad sarcopénica, una afección en la que están presentes tanto la sarcopenia como la obesidad, afecta a ∼4-15% de la población (dependiendo de los criterios) (303,574). La presencia combinada de sarcopenia y obesidad presenta una consideración única donde los objetivos son mejorar simultáneamente la composición corporal mediante la reducción de la masa grasa y el aumento de la masa muscular y la mejora del funcionamiento físico (613). Una baja masa muscular en combinación con una alta masa grasa parece amplificar el riesgo de resultados adversos para la salud (613). Sin embargo, los estudios que evalúan el impacto del entrenamiento con ejercicios en individuos con obesidad sarcopénica han mostrado efectividad para la mejora de la composición corporal, la fuerza y la función (118,204). Mientras que los protocolos que combinan el entrenamiento aeróbico y de fuerza han demostrado mejorar la composición corporal en individuos con obesidad sarcopénica, el entrenamiento de fuerza fue particularmente beneficioso, al mejorar el rendimiento de la fuerza (118). Los ejercicios de fuerza pueden modificarse con bandas elásticas o en posición de sedestación para adultos mayores con obesidad sarcopénica en entornos de rehabilitación (369) y residentes en centros asistenciales a largo plazo (120).
Enfermedades Cardiovasculares e Hipertensión
La CVD aterosclerótica es la principal causa de muerte en los Estados Unidos, representando el 35% de las muertes de adultos (432). La enfermedad cardiovascular, incluyendo hipertensión, CHD, insuficiencia cardíaca y accidente cerebrovascular, afecta al 70-75% de los adultos de 60-79 años de edad y al 79-86% de los adultos de 80 años o más (652). La hipertensión, en particular, es muy frecuente entre los adultos mayores y afecta aproximadamente al 60-70% de la población (176). El entrenamiento con ejercicios es efectivo tanto para el tratamiento como para la prevención del desarrollo de la hipertensión y sus complicaciones (422).
Múltiples estudios han demostrado una relación independiente e inversa entre el riesgo cardiometabólico y la baja fuerza muscular (25,127,462,467,469). Además, la pérdida de masa y calidad muscular ha sido identificada como un factor clave que contribuye a un mayor riesgo de CVD en los adultos mayores (582). De manera similar, la pérdida de masa y fuerza muscular relacionada con la edad es un factor de riesgo de CVD no tradicional que con frecuencia se pasa por alto y que mejora con el ejercicio de fuerza (576). Como tal, el ejercicio de fuerza se ha asociado con una reducción del riesgo del 23% para la CHD y una mejoría en la función endotelial (576,591). Además, el entrenamiento de fuerza combinado con el entrenamiento de resistencia en pacientes de edad avanzada con cardiopatía coronaria produce un aumento de la fuerza y la función (270,282). También, el entrenamiento de fuerza puede reducir los principales factores de riesgo de CVD (incluyendo dislipidemia y diabetes tipo 2) (582) y las respuestas de la presión arterial al estrés (214). En dos meta-análisis, el ejercicio de fuerza redujo significativamente la presión arterial sistólica y diastólica en aproximadamente 3 mmHg (136,318). Se han informado reducciones significativas de aproximadamente 6 mmHg en la presión arterial sistólica y aproximadamente 7 mmHg en la presión arterial diastólica después del entrenamiento con ejercicios de fuerza en adultos mayores con pre-hipertensión e hipertensión nunca tratada (260). De manera similar, el ejercicio de fuerza de alto volumen puede promover una reducción de la presión arterial sistólica media de 24 horas en adultos mayores (530). Una reducción de la presión arterial diastólica de 5 mmHg reduce el riesgo de accidente cerebrovascular en un 34% y la cardiopatía isquémica en un 21% (362). Debido a los beneficios conocidos, el entrenamiento de fuerza se considera un tratamiento no farmacológico para reducir la presión arterial (82).
A pesar de los beneficios, el entrenamiento de fuerza se asoció con preocupaciones de seguridad en adultos mayores debido a las elevaciones agudas de la presión arterial mientras se realizaba el ejercicio de fuerza. Aunque la hipertensión no controlada es una contraindicación para el ejercicio de fuerza, cuando la hipertensión está bajo control y es manejada por un médico, el ejercicio de fuerza puede ser una intervención efectiva para mejorar la presión arterial. Independientemente de ello, el ejercicio de fuerza en adultos mayores con hipertensión controlada requiere un seguimiento minucioso y un buen juicio clínico. La magnitud de las elevaciones de la presión arterial durante el ejercicio está determinada por la intensidad (% esfuerzo máximo) (372) y la masa muscular (418) involucrada. Los adultos mayores con CVD que han obtenido autorización médica para realizar ejercicios de fuerza, deben comenzar con una resistencia más baja, progresar lentamente y mantener una intensidad de carga de menor a moderada. Las elevaciones de la presión arterial inducidas por el ejercicio de fuerza se amortiguan en los ejercicios de fuerza de baja a moderada intensidad realizados con el entrenamiento (405) y la técnica de respiración correctos (es decir, evitar la maniobra de Valsalva). Además, algunas pruebas sugieren que el ejercicio de fuerza, en comparación con el ejercicio aeróbico, resulta en un equilibrio más favorable en el suministro y demanda de oxígeno miocárdico debido a una menor frecuencia cardíaca y una mayor presión de perfusión miocárdica (diastólica) (179). Para aquellos que usan medicamentos antihipertensivos, se recomienda una vuelta a la calma prolongada para evitar posibles episodios hipotensivos después del cese abrupto de la actividad (505). Además, se necesitan precauciones especiales, ya que los medicamentos antihipertensivos pueden perjudicar la capacidad de regular la temperatura corporal durante el ejercicio en ambientes calientes y/o húmedos y provocar hipoglucemia (505).
Aunque los riesgos del ejercicio existen para las enfermedades inestables, el entrenamiento con ejercicios también puede tener un efecto positivo en el curso de la insuficiencia cardíaca al prevenir la atrofia del músculo esquelético y la caquexia cardíaca (20). Se han demostrado mejorías en la capacidad de ejercicio sin efectos adversos o complicaciones graves en los pacientes con estabilidad clínica (476). Por lo tanto, se ha recomendado que cuando los beneficios del ejercicio superen los riesgos, el entrenamiento con ejercicios comience lo antes posible para reducir el efecto perjudicial del reposo en la cama (20). Dado que el ejercicio en individuos con inestabilidad hemodinámica crítica puede aumentar el riesgo (188,475), la identificación de la estabilidad clínica es un paso esencial antes del ejercicio (578). La estabilidad clínica incluye síntomas estables, ausencia de síntomas durante el reposo, ausencia de hipotensión postural, ausencia de congestión, equilibrio estable de líquidos, función renal estable y valores normales de electrolitos (578). El entrenamiento de fuerza puede ser particularmente beneficioso para atenuar la atrofia del músculo esquelético en individuos con insuficiencia cardíaca (75). Los programas y la progresión deben adherirse a las restricciones del médico, considerar los riesgos o contraindicaciones, y comenzar con intensidades bien toleradas. El entrenamiento de fuerza puede incluir grupos musculares pequeños, períodos cortos, cargas pequeñas, repeticiones limitadas y progresión cautelosa (475). Cabe esperar que los individuos con insuficiencia cardíaca tengan una respuesta respiratoria exagerada y una respuesta menor de adaptación al ejercicio (122).
Enfermedad Renal Crónica
La enfermedad renal crónica (CKD, por sus siglas en inglés) afecta aproximadamente al 39-46% de la población adulta mayor (134,577) en comparación con aproximadamente el 14% de la población general (444). La CKD sigue a una disminución progresiva de la función renal debido al daño (135) a menudo asociado con la hipertensión y la diabetes. De manera similar, el riñón envejecido se caracteriza por una tasa de filtración glomerular reducida, una regulación deficiente del equilibrio de líquidos y electrolitos (48), una capacidad deficiente para eliminar sal, lo que resulta en un aumento de la vasoconstricción y la resistencia vascular (597), y una tendencia a la deshidratación y la hiperosmolalidad (302). Con la atrofia muscular relacionada con la CKD, la pérdida de fuerza y el deterioro del funcionamiento físico son comunes y progresivos (116,485). La pérdida de músculo en individuos con insuficiencia renal crónica se atribuye a una variedad de factores, incluyendo la desnutrición proteínico-energética (417,485), la degradación y pérdida de proteínas (370), la resistencia a las hormonas anabólicas, una inflamación crónica asociada con el aumento de los niveles de citoquinas proinflamatorias (370), y la alteración de la señalización intracelular de la insulina/IGF-I a través de factores como la inflamación, la acidosis metabólica y las hormonas que estimulan la degradación de las proteínas, lo que resulta en una atrofia muscular (481).
El ejercicio de fuerza proporciona una variedad de beneficios a los individuos con CKD, incluyendo el aumento de la albúmina sérica, el aumento de la fuerza muscular, el aumento de la funcionalidad física, el aumento de la IGF-I, el aumento de la tasa de filtración glomerular (419), la reducción de la inflamación (300), la mejora de la función muscular (294), el aumento de la hipertrofia del músculo esquelético y el aumento de la fuerza muscular, y la mejora de la calidad de vida (117). Además, el ejercicio de fuerza puede atenuar la atrofia muscular y beneficiar la calidad de vida durante el tratamiento de diálisis y después del trasplante de riñón (57,97). Los beneficios del ejercicio de fuerza parecen superar los riesgos para los adultos mayores con CKD (294). Con la aprobación del médico y el control de la condición, se deben realizar ejercicios de fuerza para ayudar a los adultos mayores con CKD a controlar la afección y mejorar la salud general. Además del control médico de la afección, otras consideraciones especiales incluyen asegurar una hidratación adecuada y después de cualquier guía restrictiva para afecciones coexistentes como la diabetes o la hipertensión.
Osteoporosis
La osteoporosis es una enfermedad ósea prevalente que afecta a aproximadamente 1 de cada 12 adultos de 60 a 69 años de edad, y su prevalencia aumenta a 1 de cada 4 adultos de 80 años o más (651). Además de aumentar el riesgo de fracturas óseas, más comúnmente las caderas y la columna vertebral (523), la osteoporosis es una afección dolorosa y debilitante que contribuye al deterioro de la calidad de vida relacionada con la salud (322). Las investigaciones han demostrado que el entrenamiento con ejercicios de fuerza es beneficioso para los adultos mayores con osteoporosis y aumenta el contenido mineral óseo (335), previene las fracturas relacionadas con caídas (335) y mejora significativamente la función física, el dolor, la vitalidad (368) y la calidad de vida relacionada con la salud, mediante la mejora de la autoeficacia de las capacidades físicas y la modificación de la experiencia del dolor de espalda (377).
Los programas de ejercicios de fuerza deben adaptarse a la tolerancia y la capacidad de los adultos mayores con osteoporosis, especialmente en presencia de dolor. Los adultos mayores con osteoporosis deben comenzar a una intensidad más baja y progresar a un ritmo individualizado hacia la realización de 2 a 3 series de 8 a 12 repeticiones para cada grupo muscular principal (218). Se debe tener especial cuidado durante el ejercicio para mitigar el riesgo de caídas y fracturas. Se deben incluir ejercicios de equilibrio y en bipedestación, pero deben tener las medidas adecuadas (asideros) para evitar caídas. Se debe prestar especial atención a la práctica de la forma y la técnica adecuadas y moverse con seguridad, especialmente al realizar giros o flexiones durante las transiciones (218). Además, los ejercicios de postura vertical (extensión de la columna), para contrarrestar la postura hipercifótica pueden ayudar a mejorar el equilibrio. Se ha recomendado que los programas de ejercicio vayan acompañados de una ingesta suficiente de calcio y vitamina D y que aborden los problemas de comorbilidad y seguridad (es decir, evitar la flexión sobrecargada de la columna y modificar el impacto), tal como se describe con más detalle en la Universidad Americana de Medicina Deportiva y Ejercicio y en Ciencias del Ejercicio y Deporte de Australia (American College of Sports Medicine and Exercise and Sports Science Australia) (1,47).
Artritis
La artritis afecta aproximadamente a una cuarta parte de los adultos en los Estados Unidos (457), y al 56% de los hombres mayores y al 69% de las mujeres mayores de 65 años de edad y más (295). La osteoartritis de rodilla (305) y cadera (306) son las formas más frecuentes de artritis. La debilidad muscular se considera un factor de riesgo primario modificable para el dolor de rodilla, la discapacidad y la progresión del daño articular en personas con OA (560). Como tal, los individuos incluso con OA avanzada, artritis reumatoide y alineación incorrecta pueden experimentar ganancias sustanciales en la fuerza después del entrenamiento de fuerza sin aumentos concomitantes en el dolor o efectos adversos (297,326,386).
Para los adultos mayores con artritis, el objetivo de los programas de entrenamiento de fuerza incluye el control del dolor articular mientras se mejora el rango de movimiento, la fuerza muscular y la función. Por lo tanto, una barrera común para el entrenamiento de los individuos con artritis es el miedo a exacerbar el dolor articular. Sin embargo, se ha informado lo contrario, donde las personas con artritis se benefician del entrenamiento de fuerza sin empeorar el dolor o los síntomas (19). Los programas de entrenamiento deben comenzar con la selección de ejercicios individualizados que aborden los impedimentos individuales y progresen hacia las pautas de ejercicio. Aunque las restricciones por el dolor articular y la amplitud de movimiento pueden afectar la capacidad de realizar ejercicios de fuerza en adultos mayores con artritis, los estudios han demostrado que el entrenamiento de fuerza que es progresivo, realizado a una intensidad moderada (50-70% de 1RM), 2-3 veces por semana, tiene mayores efectos sobre la fuerza y la función que el entrenamiento más ligero en adultos mayores con artritis (297,326,386). El entrenamiento de fuerza, 2-3 veces por semana a una intensidad moderada de 6-8 repeticiones y 2-3 series por ejercicio, de manera progresiva de sobrecarga, también es recomendado por la Sociedad Americana de Geriatría (American Geriatrics Society) para adultos mayores con artritis (19). Sin embargo, con la artritis, el rendimiento físico, el dolor y la amplitud de movimiento pueden variar día a día, y los programas de entrenamiento se deben ajustar. Además, aunque las intensidades de moderadas a altas hayan mostrado beneficios, las respuestas individualizadas como el dolor articular durante el ejercicio o de 1 a 2 horas después, la inflamación articular, la fatiga o la debilidad pueden indicar un volumen o intensidad de ejercicio excesivo e informar el nivel de tolerancia individual.
Estratificación de Riesgos para Afecciones Crónicas
Aunque la mayoría de los estudios han examinado a hombres y mujeres mayores sanos, la capacidad de usar intervenciones de entrenamiento de fuerza, apenas está empezando a ser más clara para varias patologías (por ejemplo, artritis, cáncer, enfermedades cardíacas y enfermedades ortopédicas). La multimorbilidad (es decir, la presencia de más de una afección crónica) es cada vez más complicada durante la tercera fase de la transición epidemiológica, que se caracteriza por una compresión de las tasas de mortalidad combinada con una expansión de la población de adultos mayores. A efectos de las pruebas y la prescripción de ejercicio, y de acuerdo con la NSCA y el ACSM, la estratificación preliminar de riesgo para los adultos mayores con múltiples enfermedades crónicas diagnosticadas debe realizarse sobre la base del riesgo general de incidentes cardiovasculares (2). Sin embargo, para aquellos que actualmente están haciendo ejercicio y son asintomáticos, el examen de preparación puede no ser necesario y puede presentar una barrera innecesaria para comenzar y mantener los programas de ejercicio (506). Debido a los estilos de vida sedentarios frecuentemente informados y a la mayor prevalencia de obesidad sarcopénica en adultos mayores, muchos tienen una mayor probabilidad de ser clasificados como de "riesgo moderado" (es decir, "hombres y mujeres asintomáticos que tienen ≥2 factores de riesgo de enfermedad cardiovascular ateroesclerótica (ASCVD, por sus siglas en inglés)") o incluso de "alto riesgo" (es decir, individuos que han tenido enfermedades cardiovasculares, pulmonares o metabólicas o más de un signo/síntoma de estas enfermedades) (2). Identificar los factores de riesgo de las CVD es necesario para el manejo de la enfermedad, identificar a los individuos con mayor riesgo de eventos adversos durante la participación en el ejercicio, e identificar a aquellos que puedan requerir exámenes médicos adicionales. Para las personas con algunas afecciones crónicas como la diabetes, la NSCA y ACSM recomiendan una prueba clínica de esfuerzo antes de hacer ejercicio. Sin embargo, considerando la mayor incidencia de inactividad física y debilidad profunda en la edad adulta mayor (170,409), puede ser aconsejable una evaluación del estado físico muscular para todos los pacientes.
Tabla 3. Resumen de las modificaciones de los ejercicios.*
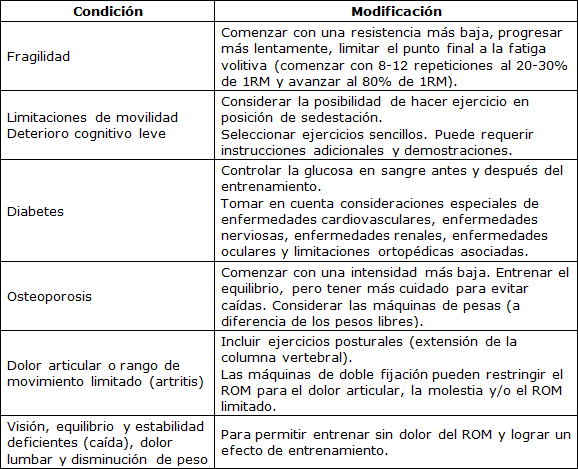
*RM = Repetición máxima
Los Programas de Entrenamiento de Fuerza Pueden Adecuarse (con Equipamiento Portátil y Alternativas de Ejercicios en Sedestación) para Adaptar a los Adultos Mayores que Residen en Centros de Vivienda Asistida y de Enfermería Especializada.
Los centros de vivienda asistida pretenden promover la independencia de los adultos mayores residentes mediante la creación de un entorno hogareño para la integración del cuidado (130). Por el contrario, los asilos de ancianos o las instalaciones de enfermería especializada alojan a los adultos mayores con serios problemas de salud, incluyendo fragilidad, varias condiciones crónicas y comorbilidades, así como discapacidades funcionales (285). Mientras que en estas instituciones, el objetivo es que los residentes adultos mayores permanezcan funcionales e independientes durante el mayor tiempo posible para alcanzar su mayor potencial de calidad de vida; sin embargo, muchas personas se vuelven dependientes del cuidado para sus actividades diarias después de su admisión en una institución (621). A su vez, la participación de estos adultos mayores en la actividad física disminuye drásticamente, lo que resulta en una pérdida acelerada de masa muscular y una mayor disminución de la capacidad funcional (621). La sarcopenia es más prevalente entre los adultos mayores que residen en centros de enfermería especializada que entre los que viven en sociedad (252). Por lo tanto, la participación regular en programas de actividad física basados en el entrenamiento de fuerza es vital para el mantenimiento de la capacidad funcional de estos adultos mayores. Sin embargo, los datos indican que los adultos mayores residentes en hogares de ancianos pasan más del 97% de su tiempo diario sentados o reclinados y casi dos tercios de su tiempo con actividades pasivas (por ejemplo, dormir, ver la televisión, leer) y sólo aproximadamente el 3% de su tiempo diario con actividades de movimiento (285). Para la mayoría de los centros de vivienda asistida y de enfermería especializada, los programas de ejercicios se ofrecen a los residentes como actividades recreativas opcionales, sin considerar el entrenamiento de fuerza como una estrategia efectiva para mantener o aumentar la fuerza muscular y la capacidad funcional (621).
Los datos de las intervenciones de entrenamiento de fuerza entre los adultos mayores que residen en centros de vivienda asistida y de enfermería especializada indican que el entrenamiento de fuerza tiene efectos positivos sobre la masa muscular (88,167), la fuerza muscular (35,79,80,88,167,182,183,187,252,301,363,411,415,514,537,587,625), la resistencia muscular (187,537), y varios resultados de capacidad funcional incluyendo velocidad de la marcha (182,301,514,587), movilidad (35,38,79,80,88,301,363), equilibrio dinámico (38,363,514), y capacidad para subir escaleras (79,182,537). Además, se ha demostrado que una intervención individualizada de ejercicios multicomponentes que incluye ejercicios de entrenamiento de fuerza de baja intensidad (30-60% de 1RM) realizados durante un período corto (5 días) también proporciona un beneficio significativo sobre el cuidado habitual para ayudar a revertir el deterioro funcional asociado con la hospitalización aguda en adultos mayores (400). Por lo tanto, el entrenamiento de fuerza es una actividad efectiva para la prevención de caídas y el mantenimiento de la independencia (621).
Varios estudios han demostrado que se pueden lograr mejoras radicales en la fuerza a través de intervenciones de entrenamiento de fuerza implementadas en hogares de ancianos e instituciones similares. Algunos estudios con intervenciones de entrenamiento de fuerza de ocho semanas informaron aumentos de la fuerza en la parte superior del cuerpo de hasta 23,7% (79) y 62% (350) o 108% (350) y 174% (183), aunque estas intervenciones se dirigieron a adultos mayores muy ancianos (79), con problemas de movilidad (350) o muy frágiles (183). Otro estudio de intervención de 8 semanas informó una mejoría de la fuerza isométrica del 32,8% y de la fuerza concéntrica isocinética del 41,2% en la fuerza compuesta de 8 grupos musculares (415). Otros estudios con intervenciones de entrenamiento de fuerza de 10 semanas informaron mejorías en la fuerza del 57,3% (537), 74% (587) y 95% (184), junto con mejorías significativas en la velocidad de la marcha (184,587), la capacidad para subir escaleras (184,537), la capacidad para levantarse desde sedestación (537,587) y la fuerza muscular (537). Un estudio con una intervención de 12 semanas para la población de edad avanzada informó una mejoría impresionante de fuerza de 1RM del 144% en la parte inferior del cuerpo y del 68% en la parte superior del cuerpo, una fuerza isométrica del 23,6% en la parte inferior del cuerpo y mejoras máximas en la potencia del 116% (88). Sin embargo, otros estudios con intervenciones más largas informaron mejorías más modestas en la fuerza, de 20 a 30% después de los programas de 12 a 15 semanas (35,537,625). Parece que la intensidad de los programas de entrenamiento de fuerza aplicados y la capacidad funcional inicial de los sujetos adultos mayores son dos factores principales que influyen en la magnitud de los aumentos de fuerza. Entre aquellos con una fragilidad más significativa, cuanto mayor sea la magnitud de los cambios en la fuerza, mayor será la posibilidad de lograrlos, incluso en un período relativamente corto (es decir, de 8 a 10 semanas).
El modo de entrenamiento de fuerza varió entre los protocolos de estudio. Varios estudios han utilizado intervenciones de entrenamiento sólo con máquinas de entrenamiento de fuerza, como extensión de piernas (183,184,537), extensión de cadera (183,184,587) o prensa de piernas (587) como su principal modo de intervención del entrenamiento de fuerza. Un estudio utilizó sólo la máquina de extensión de piernas para el entrenamiento de fuerza isométrica (187), mientras que otros estudios utilizaron una variedad de ejercicios en sedestación a través de métodos isotónicos (88,350), isocinéticos (415), isométricos (411) o mediante el uso de máquinas neumáticas (252). Otros estudios aplicaron bandas elásticas (35,38,167,363,625), pesas en los tobillos (38,79,80), pesas ligeras (38,167,363) y mancuernas (35,79,80,625). Varios estudios limitaron sus opciones de ejercicio a ejercicios en sedestación solamente (38,183,184,187,411,537,587,625), mientras que sólo unos pocos estudios aplicaron ejercicios en bipedestación o ejercicios funcionales de cuerpo completo para incluir sentadillas, step-ups y estocadas (79,363,514). Estos estudios que utilizaron ejercicios funcionales de cuerpo completo informaron mejoras significativas en la capacidad funcional de los sujetos, incluyendo la movilidad (363), la velocidad de la marcha o de subir escaleras (79,514), el equilibrio dinámico (363,514) y la capacidad para levantarse desde la sedestación (79,514). Un estudio experimental reciente intentó comparar directamente la efectividad del entrenamiento de fuerza de cuerpo completo con máquinas y con pesos libres en residentes de hogares de ancianos y concluyó que ambos métodos fueron igualmente efectivos para mejorar la fuerza muscular y la movilidad (301).
La intensidad de los programas de entrenamiento de fuerza aplicada no se informó en varios estudios (35,79,80,167,363). Los estudios que informaron intensidades de entrenamiento de fuerza variaron en sus protocolos, incluyendo el uso de resistencia al 80% de 1RM (183,184,537,587), resistencia de 8-12 RM (350,514), resistencia al 50% de 1RM (88,625), resistencia al 75% de 8RM (301), contracciones isométricas máximas (187), o 12-14 en la escala Borg (252,301). La mayoría de las intervenciones de entrenamiento de fuerza en el hogar de ancianos utilizaron 3 sesiones de ejercicios semanales (38,79,80,167,183,184,187,363,415,537,587,625), pero algunos estudios utilizaron sólo 2 sesiones por semana (35,88,252,301,411).
En resumen, estas intervenciones de entrenamiento de fuerza han demostrado que la fuerza y la capacidad funcional de los adultos mayores pueden mejorar significativamente, incluso en entornos de centros de vivienda asistida y de enfermería especializada. Los beneficios conocidos deben motivar a los centros de vivienda asistida y de enfermería especializada a adquirir el equipamiento de entrenamiento adecuado. Mientras tanto, las limitaciones del equipamiento de estas instalaciones pueden superarse utilizando artículos portátiles de bajo costo (por ejemplo, bandas elásticas, pesas ligeras, pesas para tobillos y pelotas medicinales). Las adaptaciones de entrenamiento se pueden obtener incluso para los adultos mayores con limitaciones funcionales o de movilidad utilizando un programa de entrenamiento de fuerza con ejercicios en sedestación solamente, aunque el uso de ejercicios funcionales de cuerpo completo probablemente conducirá a un mayor impacto en la capacidad funcional general de los adultos mayores. Ningún estudio pertinente ha informado incidentes de eventos adversos cardiovasculares o lesiones graves para los sujetos, lo que sugiere que el entrenamiento de fuerza es seguro incluso para las poblaciones residentes en hogares de ancianos con deficiencias funcionales, frágiles y muy ancianos. Las mejoras en la fuerza informadas por los estudios relevantes demuestran que los adultos mayores en centros de vivienda asistida y de enfermería especializada tienen la capacidad de realizar adaptaciones musculares y neuromusculares en respuesta a diversos modelos de programas de entrenamiento de fuerza.
La evidencia recolectada e informada en esta Declaración de Posición demuestra los beneficios sustanciales para la salud de los ejercicios de fuerza para los adultos mayores. Existen pruebas sólidas que apoyan los beneficios del ejercicio de fuerza para contrarrestar muchos procesos relacionados con la edad como la sarcopenia, la debilidad muscular, la pérdida de movilidad, las enfermedades crónicas, la discapacidad e incluso la mortalidad prematura. Además, esta Declaración de Posición proporciona recomendaciones prácticas específicas basadas en la evidencia para ayudar en la implementación de programas de ejercicios de fuerza para adultos mayores sanos y aquellos con consideraciones especiales. Aunque hay casos en los que los programas de baja intensidad y bajo volumen son apropiados (es decir, los programas de inicio para individuos con fragilidad o enfermedades cardiovasculares), los mayores beneficios son posibles con programas de progresión de moderada a mayor intensidad. Si bien las recomendaciones generales tienen en cuenta las circunstancias especiales, en la práctica, todos los programas de ejercicios de fuerza deben ser proporcionales a las necesidades y capacidades individuales específicas de cada adulto mayor.
Referencias
1. American College of Sports Medicine. (1995). Osteoporosis and exercise. Med Sci Sports Exerc 27: i–vii
2. ACSM's Guidelines for Exercise Testing and Prescription. (2009). Philadelphia, PA: Lippincott William & Wilkins. pp. 400.
3. Aagaard P, Magnusson PS, Larsson B, Kjaer M, Krustrup P. (2007). Mechanical muscle function, morphology, and fiber type in lifelong trained elderly. Med Sci Sports Exerc 39: 1989–1996.
4. Aagaard P, Suetta C, Caserotti P, Magnusson SP, Kjaer M. (2010). Role of the nervous system in sarcopenia and muscle atrophy with aging: Strength training as a countermeasure. Scand J Med Sci Sports 20: 49–64,
5. Abney M, McPeek MS, Ober C. (2001). Broad and narrow heritabilities of quantitative traits in a founder population. Am J Hum Genet 68: 1302–1307
6. Abrahin O, Rodrigues RP, Nascimento VC, et al. (2014.). Single- and multiple-set resistance training improves skeletal and respiratory muscle strength in elderly women. Clin Interv Aging 9: 1775–1782
7. Ades PA, Ballor DL, Ashikaga T, Utton JL, Nair KS. (1996). Weight training improves walking endurance in healthy elderly persons. Ann Intern Med 124: 568–572
8. International Diabetes Federation. (2017). Global Picture. In: 8th, ed. IDF Diabetes Atlas. Brussels, Belgium: International Diabetes Federation, 2017. pp. 40–65.
9. Ahlqvist A, Nyfors H, Suhonen R. (2016). Factors associated with older people's independent living from the viewpoint of health and functional capacity: A register-based study. Nurs Open 3: 79–89
10. Ahtiainen JP, Hulmi JJ, Kraemer WJ, et al. (2011.). Heavy resistance exercise training and skeletal muscle androgen receptor expression in younger and older men. Steroids 76: 183–192
11. Ahtiainen JP, Hulmi JJ, Lehti M, et al. (2016). Effects of resistance training on expression of IGF-I splice variants in younger and older men. Eur J Sport Sci 16: 1055–1063
12. Ahtiainen JP, Nyman K, Huhtaniemi I, et al. (2015). Effects of resistance training on testosterone metabolism in younger and older men. Exp Gerontol 69: 148–158
13. Alfaro-Acha A, Al Snih S, Raji MA, Kuo YF, Markides KS, Ottenbacher KJ. (2006). Handgrip strength and cognitive decline in older Mexican Americans. J Gerontol A Biol Sci Med Sci 61: 859–865
14. Alley DE, Shardell MD, Peters KW, et al. (2014). Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci 69: 559–566
15. Alvarez KJ, Kirchner S, Chu S, et al. (2015). Falls reduction and exercise training in an assisted living population. J Aging Res 2015: 957598
16. American College of Sports. (2009). American College of Sports Medicine position stand: Progression models in resistance training for healthy adults. Med Sci Sports Exerc 41: 687–708
17. American College of Sports Medicine. (2009). Progression models in resistance training for healthy adults. Med Sci Sports Exerc 41: 687–708
18. Balady GJ, Foster C, Chaitman B, Froelicher ES. (2002). Position stand: automated external defibrillators in health/fitness facilities. Med Sci Sports Exerc 34: 561–564
19. American Geriatrics Society Panel on Exercise and Osteoarthritisa. (2001). Exercise prescription for older adults with osteoarthritis pain: Consensus practice recommendations. A supplement to the AGS Clinical Practice Guidelines on the management of chronic pain in older adults. J Am Geriatr Soc 49: 808–823
20. Amiya E, Taya M. (2018). Is exercise training appropriate for patients with advanced heart failure receiving continuous inotropic infusion? A review. Clin Med Insights Cardiol 12: 1179546817751438
21. Amonette WE, English KL, Kraemer WJ. (2016). Evidence-Based Practice In Exercise Science: The Six-Step Approach. Champaign, IL: Human Kinetics
22. Anderson DE, D'Agostino JM, Bruno AG, et al. (2013). Variations of CT-based trunk muscle attenuation by age, sex, and specific muscle. J Gerontol A Biol Sci Med Sci 68: 317–323
23. Anthony K, Robinson K, Logan P, et al. (2013). Chair-based exercises for frail older people: A systematic review. Biomed Res Int 2013: 309506
24. Arnold CM, Sran MM, Harrison EL. (2008). Exercise for fall risk reduction in community-dwelling older adults: A systematic review. Physiother Can 60: 358–37
25. Artero EG, Ruiz JR, Ortega FB, et al. (2011). Muscular and cardiorespiratory fitness are independently associated with metabolic risk in adolescents: The HELENA study. Pediatr Diabetes 12: 704–712
26. Balagopal P, Rooyackers OE, Adey DB, Ades PA, Nair KS. (1997). Effects of aging on in vivo synthesis of skeletal muscle myosin heavy-chain and sarcoplasmic protein in humans. Am J Physiol 273(4 Pt 1): E790–E800
27. Balboa-Castillo T, Guallar-Castillon P, Leon-Munoz LM, et al. (201). Physical activity and mortality related to obesity and functional status in older adults in Spain. Am J Prev Med 40: 39–46
28. Ballor DL, Harvey-Berino JR, Ades PA, Cryan J, Calles-Escandon J. (1996). Contrasting effects of resistance and aerobic training on body composition and metabolism after diet-induced weight loss. Metabolism 45: 179–183
29. Bamman MM, Hill VJ, Adams GR, et al. (2003). Gender differences in resistance-training-induced myofiber hypertrophy among older adults. J Gerontol A Biol Sci Med Sci 58: 108–116
30. Bandeen-Roche K, Xue QL, Ferrucci L, et al. (2006). Phenotype of frailty: Characterization in the women's health and aging studies. J Gerontol A Biol Sci Med Sci 61: 262–266
31. Barber LA, Read F, Lovatt Stern J, Lichtwark G, Boyd RN. (2016). Medial gastrocnemius muscle volume in ambulant children with unilateral and bilateral cerebral palsy aged 2 to 9 years. Dev Med Child Neurol 58: 1146–1152
32. Bardenheier B, Lin J, Zhuo X, et al. (2016). Disability-free life-years lost among adults aged ≥50 Years, with and without diabetes. Diabetes Care 39: 1222–1229
33. Barnett A, Smith B, Lord SR, Williams M, Baumand A. (2003). Community-based group exercise improves balance and reduces falls in at-risk older people: A randomised controlled trial. Age Ageing 32: 407–414
34. Barry BK, Warman GE, Carson RG. (2005). Age-related differences in rapid muscle activation after rate of force development training of the elbow flexors. Exp Brain Res 162: 122–132
35. Barthalos I, Dorgo S, KopkÁNÉ Plachy J, et al. (2016). Randomized controlled resistance training based physical activity trial for central European nursing home residing older adults. J Sports Med Phys Fitness 56: 1249–1257
36. Basaria S. Reproductive aging in men. (2013). Endocrinol Metab Clin North Am 42: 255–270.
37. Bassey EJ, Fiatarone MA, O'Neill EF, et al. (1992). Leg extensor power and functional performance in very old men and women. Clin Sci (Lond) 82: 321–327
38. Baum EE, Jarjoura D, Polen AE, Faur D, Rutecki G. (2003). Effectiveness of a group exercise program in a long-term care facility: A randomized pilot trial. J Am Med Dir Assoc 4: 74–80
39. Baumgartner RN, Koehler KM, Gallagher D, et al. (1998). Epidemiology of sarcopenia among the elderly in New Mexico. Am J Epidemiol 147: 755–763
40. Bautmans I, Njemini R, Vasseur S, et al. (2005). Biochemical changes in response to intensive resistance exercise training in the elderly. Gerontology 51: 253–265
41. Baylis D, Ntani G, Edwards MH, et al. (2014). Inflammation, telomere length, and grip strength: A 10-year longitudinal study. Calcif Tissue Int 95: 54–63
42. Bean JF, Herman S, Kiely DK, et al. (2004). Increased Velocity Exercise Specific to Task (InVEST) training: A pilot study exploring effects on leg power, balance, and mobility in community-dwelling older women. J Am Geriatr Soc 52: 799–804
43. Bean JF, Kiely DK, Herman S, et al. (2002). The relationship between leg power and physical performance in mobility-limited older people. J Am Geriatr Soc 50: 461–467
44. Bean JF, Kiely DK, LaRose S, et al. (2000). Increased velocity exercise specific to task training versus the National Institute on Aging's strength training program: Changes in limb power and mobility. (2009). J Gerontol A Biol Sci Med Sci 64: 983–991.
45. Bean JF, Leveille SG, Kiely DK, et al. (2003). A comparison of leg power and leg strength within the InCHIANTI study: Which influences mobility more? J Gerontol A Biol Sci Med Sci 58: 728–733.
46. Beasley LE, Koster A, Newman AB, et al. (2009). Inflammation and race and gender differences in computerized tomography-measured adipose depots. Obesity (Silver Spring) 17: 1062–1069
47. Beck BR, Daly RM, Singh MA, Taaffe DR. (2017). Exercise and Sports Science Australia (ESSA) position statement on exerciseprescription for the prevention and management of osteoporosis. J Sci Med Sport 20: 438–445
48. Beck LH. The aging kidney. (2000). Defending a delicate balance of fluid and electrolytes. Geriatrics 55: 26–28, 2000; 31-2.
49. Beltran-Sanchez H, Jimenez MP, Subramanian SV. (2016). Assessing morbidity compression in two cohorts from the Health and Retirement Study. J Epidemiol Community Health 70: 1011–1016
50. Bemben DA, Fetters NL, Bemben MG, Nabavi N, Koh ET. (2000). Musculoskeletal responses to high- and low-intensity resistance training in early postmenopausal women. Med Sci Sports Exerc 32: 1949–1957
51. Bemben MG, Massey BH, Bemben DA, Misner JE, Boileau RA. (1991). Isometric muscle force production as a function of age in healthy 20- to 74-yr-old men. Med Sci Sports Exerc 23: 1302–1310
52. Ben-Shlomo Y, Cooper R, Kuh D. (2016). The last two decades of life course epidemiology, and its relevance for research on ageing. Int J Epidemiol 45: 973–988
53. Beneka A, Malliou P, Fatouros I, et al. (2005). Resistance training effects on muscular strength of elderly are related to intensity and gender. J Sci Med Sport 8: 274–283
54. Bento PC, Pereira G, Ugrinowitsch C, Rodacki AL. (2010). Peak torque and rate of torque development in elderly with and without fall history. Clin Biomech (Bristol, Avon) 25: 450–454
55. Bergman H, Ferrucci L, Guralnik J, et al. (2007). Frailty: An emerging research and clinical paradigm--issues and controversies. J Gerontol A Biol Sci Med Sci 62: 731–737
56. Berzlanovich AM, Schopfer J, Keil W. (2012). Deaths due to physical restraint. Dtsch Arztebl Int 109: 27–32
57. Bessa B, de Oliveira Leal V, Moraes C, et al. (2015). Resistance training in hemodialysis patients: A review. Rehabil Nurs 40: 111–126
58. Beyer N, Suetta C. (2013). Older patients should be offered strength training early post surgery [in Danish]. Ugeskr Laeger 175: 2421–2424
59. Bhattacharya RK, Bhattacharya SB. (2015). Late-onset hypogonadism and testosterone replacement in older men. Clin Geriatr Med 31: 631–644
60. Bilodeau M, Henderson TK, Nolta BE, Pursley PJ, Sandfort GL. (2001). Effect of aging on fatigue characteristics of elbow flexor muscles during sustained submaximal contraction. J Appl Physiol (1985) 91: 2654–2664
61. Binder EF, Birge SJ, Spina R, et al. (1999). Peak aerobic power is an important component of physical performance in older women. J Gerontol A Biol Sci Med Sci 54: M353–M356
62. Binder EF, Schechtman KB, Ehsani AA, et al. (2002). Effects of exercise training on frailty in community-dwelling older adults: Results of a randomized, controlled trial. J Am Geriatr Soc 50: 1921–1928
63. Binder EF, Yarasheski KE, Steger-May K, et al. (2005). Effects of progressive resistance training on body composition in frail older adults: Results of a randomized, controlled trial. J Gerontol A Biol Sci Med Sci 60: 1425–1431
64. Blazer DG. (2003). Depression in late life: Review and commentary. J Gerontol A Biol Sci Med Sci 58: 249–265
65. Bodart G, Goffinet L, Morrhaye G, et al. (2015). Somatotrope GHRH/GH/IGF-1 axis at the crossroads between immunosenescence and frailty. Ann N Y Acad Sci 1351: 61–67
66. Borde R, Hortobagyi T, Granacher U. (2015). Dose-response relationships of resistance training in healthy old adults: A systematic review and meta-analysis. Sports Med 45: 1693–1720
67. Borst SE, Vincent KR, Lowenthal DT, Braith RW. (2002). Effects of resistance training on insulin-like growth factor and its binding proteins in men and women aged 60 to 85. J Am Geriatr Soc 50: 884–888
68. Bosco C, Komi PV. (1980). Influence of aging on the mechanical behavior of leg extensor muscles. Eur J Appl Physiol Occup Physiol 45: 209–219
69. Boshuizen HC, Stemmerik L, Westhoff MH, Hopman-Rock M. (2005). The effects of physical therapists' guidance on improvement in a strength-training program for the frail elderly. J Aging Phys Act 13: 5–22
70. Boslaugh SE, Andresen EM. (2006). Peer reviewed: Correlates of physical activity for adults with disability. Preventing Chronic Disease 3: A78
71. Bottaro M, Machado SN, Nogueira W, Scales R, Veloso J. (2007). Effect of high versus low-velocity resistance training on muscular fitness and functional performance in older men. Eur J Appl Physiol 99: 257–264
72. Bouchard C, Rankinen T. (2001). Individual differences in response to regular physical activity. Med Sci Sports Exerc 33(6 Suppl): S446–S451, 2001; discussion S52-3.
73. Boule NG, Haddad E, Kenny GP, Wells GA, Sigal RJ. (2001). Effects of exercise on glycemic control and body mass in type 2 diabetes mellitus: A meta-analysis of controlled clinical trials. JAMA 286: 1218–1227
74. Boyle PA, Buchman AS, Wilson RS, Leurgans SE, Bennett DA. (2009). Association of muscle strength with the risk of Alzheimer disease and the rate of cognitive decline in community-dwelling older persons. Arch Neurol 66: 1339–1344
75. Braith RW, Stewart KJ. (2006). Resistance exercise training: Its role in the prevention of cardiovascular disease. Circulation 113: 2642–2650
76. Bray NW, Smart RR, Jakobi JM, Jones GR. (2016). Exercise prescription to reverse frailty. Appl Physiol Nutr Metab 41: 1112–1116
77. Bredella MA, Gill CM, Gerweck AV, et al. (2013). Ectopic and serum lipid levels are positively associated with bone marrow fat in obesity. Radiology 269: 534–541
78. Brentano MA, Cadore EL, Da Silva EM, et al. (2008). Physiological adaptations to strength and circuit training in postmenopausal women with bone loss. J Strength Cond Res 22: 1816–1825
79. Brill PA, Jensen RL, Koltyn KF, et al. (1997). The feasibility of conducting a group-based progressive strength training program in residents of a multi-level care facility. Act Adapt Aging 22: 53–63
80. Brill PA, Matthews M, Mason J, et al. (1998). Improving functional performance through a group-based free weight strength trainingprogram in residents of two assisted living communities. Phys Occup Ther Geriatr 15: 57–69
81. Brochu M, Savage P, Lee M, et al. (2002). Effects of resistance training on physical function in older disabled women with coronary heart disease. J Appl Physiol (1985) 92: 672–678
82. Brook RD, Appel LJ, Rubenfire M, et al. (2013). Beyond medications and diet: Alternative approaches to lowering blood pressure: A scientific statement from the American Heart Association. Hypertension 61: 1360–1383
83. Brooks N, Layne JE, Gordon PL, et al. (2006). Strength training improves muscle quality and insulin sensitivity in Hispanic older adults with type 2 diabetes. Int J Med Sci 4: 19–27
84. Brown AB, McCartney N, Sale DG. (1990). Positive adaptations to weight-lifting training in the elderly. J Appl Physiol (1985) 69: 1725–1733
85. Buchman AS, Wilson RS, Boyle PA, Bienias JL, Bennett DA. (2007). Grip strength and the risk of incident Alzheimer's disease. Neuroepidemiology 29: 66–73
86. Burton E, Farrier K, Lewin G, et al. (2017). Motivators and barriers for older people participating in resistance training: A systematic review. J Aging Phys Act 25: 311–324
87. Bweir S, Al-Jarrah M, Almalty AM, et al. (2009). Resistance exercise training lowers HbA1c more than aerobic training in adults with type 2 diabetes. Diabetol Metab Syndr 1: 27
88. Cadore EL, Casas-Herrero A, Zambom-Ferraresi F, et al. (2014). Multicomponent exercises including muscle power training enhance muscle mass, power output, and functional outcomes in institutionalized frail nonagenarians. Age (Dordr) 36: 773–785
89. Cadore EL, Izquierdo M. (2013). New strategies for the concurrent strength-, power-, and endurance-training prescription in elderlyindividuals. J Am Med Dir Assoc 14: 623–624
90. Cadore EL, Izquierdo M. (2015). Exercise interventions in polypathological aging patients that coexist with diabetes mellitus: Improving functional status and quality of life. Age (Dordr) 37: 64
91. Cadore EL, Izquierdo M, Pinto SS, et al. (2013). Neuromuscular adaptations to concurrent training in the elderly: Effects of intrasession exercise sequence. Age (Dordr) 35: 891–903
92. Cadore EL, Menger E, Teodoro JL, et al. (2018). Functional and physiological adaptations following concurrent training using sets with and without concentric failure in elderly men: A randomized clinical trial. Exp Gerontol 110: 182–190
93. Cadore EL, Moneo AB, Mensat MM, et al. (2014). Positive effects of resistance training in frail elderly patients with dementia after long-term physical restraint. Age (Dordr) 36: 801–811
94. Cadore EL, Pinto RS, Bottaro M, Izquierdo M. (2014). Strength and endurance training prescription in healthy and frail elderly. Aging Dis 5: 183–195
95. Cadore EL, Pinto RS, Lhullier FL, et al. (2010). Physiological effects of concurrent training in elderly men. Int J Sports Med 31: 689–697
96. Cadore EL, Rodriguez-Manas L, Sinclair A, Izquierdo M. (2013). Effects of different exercise interventions on risk of falls, gait ability, and balance in physically frail older adults: A systematic review. Rejuvenation Res 16: 105–114
97. Calella P, Hernandez-Sanchez S, Garofalo C, Ruiz JR, Carrero JJ, Bellizzi V. (2019). Exercise training in kidney transplant recipients: A systematic review. J Nephrol 2019. Epub ahead of print.
98. Calle MC, Fernandez ML. (2010). Effects of resistance training on the inflammatory response. Nutr Res Pract 4: 259–269
99. Campbell AJ, Borrie MJ, Spears GF. (1989). Risk factors for falls in a community-based prospective study of people 70 years and older. J Gerontol 44: M112–M117
100. Campbell AJ, Buchner DM. (1997). Unstable disability and the fluctuations of frailty. Age Ageing 26: 315–318,
101. Campbell WW, Crim MC, Young VR, Evans WJ. (1994). Increased energy requirements and changes in body composition with resistance training in older adults. Am J Clin Nutr 60: 167–175
102. Candow DG, Chilibeck PD, Facci M, Abeysekara S, Zello GA. (2006). Protein supplementation before and after resistance training in older men. Eur J Appl Physiol 97: 548–556
103. Carmelli D, Reed T. (2000). Stability and change in genetic and environmental influences on hand-grip strength in older male twins. J Appl Physiol (1985) 89: 1879–1883
104. Carruthers M. (2013). Testosterone deficiency syndrome: Cellular and molecular mechanism of action. Curr Aging Sci 6: 115–124
105. Casas-Herrero A, Cadore EL, Zambom-Ferraresi F, et al. (2013). Functional capacity, muscle fat infiltration, power output, and cognitive impairment in institutionalized frail oldest old. Rejuvenation Res 16: 396–403
106. Casas Herrero A, Cadore EL, Martinez Velilla N, Izquierdo Redin M. (2015). Physical exercise in the frail elderly: An update [in Spanish]. Rev Esp Geriatr Gerontol 50: 74–81
107. Caserotti P, Aagaard P, Larsen JB, Puggaard L. (2008). Explosive heavy-resistance training in old and very old adults: Changes in rapid muscle force, strength and power. Scand J Med Sci Sports 18: 773–782
108. Cassilhas RC, Antunes HK, Tufik S, de Mello MT. (2010). Mood, anxiety, and serum IGF-1 in elderly men given 24 weeks of high resistance exercise. Percept Mot Skills 110: 265–276
109. Castaneda C, Layne JE, Munoz-Orians L, et al. (2002). A randomized controlled trial of resistance exercise training to improve glycemic control in older adults with type 2 diabetes. Diabetes Care 25: 2335–2341
110. CDC—Centers for Disease Control and Prevention. (2012). Vital signs: Awareness and treatment of uncontrolled hypertension among adults — United States, 2003–2010. MMWR Morb Mortal Wkly Rep 61: 703–709
111. CDC. (2014). Falls Among Older Adults: An Overview. Centers for Disease Control and Prevention. Atlanta, Georgia: National Center for Injury Prevention and Control, Division of Unintentional Injury Prevention
112. Centers for Disease Control and Prevention. (2017). National Diabetes Statistics Report. Atlanta, GA: Centers for Disease Control and Prevention, US Department of Health and Human Services
113. Centers for Disease C, Prevention. (2008). Self-reported falls and fall-related injuries among persons aged ≥65 years—United States, 2006. MMWR Morb Mortal Wkly Rep 57: 225–229
114. Cervantes CM, Taylor WC. (2011). Physical activity interventions in adult populations with disabilities: A review. Quest 63: 385–410
115. Charette SL, McEvoy L, Pyka G, et al. (1991). Muscle hypertrophy response to resistance training in older women. J Appl Physiol (1985) 70: 1912–1916
116. Cheema B, Abas H, Smith B, et al. (2007). Progressive exercise for anabolism in kidney disease (PEAK): A randomized, controlled trial of resistance training during hemodialysis. J Am Soc Nephrol 18: 1594–1601
117. Cheema BS, Chan D, Fahey P, Atlantis E. (2014). Effect of progressive resistance training on measures of skeletal muscle hypertrophy, muscular strength and health-related quality of life in patients with chronic kidney disease: A systematic review and meta-analysis. Sports Med 44: 1125–1138
118. Chen HT, Chung YC, Chen YJ, Ho SY, Wu HJ. (2017). Effects of different types of exercise on body composition, muscle strength, and IGF-1 in the elderly with sarcopenic obesity. J Am Geriatr Soc 65: 827–832
119. Chen KM, Kuo CC, Chang YH, Huang HT, Cheng YY. (2017). Resistance band exercises reduce depression and behavioral problems of wheelchair-bound older adults with dementia: A cluster-randomized controlled trial. J Am Geriatr Soc 65: 356–363
120. Chiu SC, Yang RS, Yang RJ, Chang SF. (2018). Effects of resistance training on body composition and functional capacity among sarcopenic obese residents in long-term care facilities: A preliminary study. BMC Geriatr 18: 21
121. Chou CH, Hwang CL, Wu YT. (2012). Effect of exercise on physical function, daily living activities, and quality of life in the frail older adults: A meta-analysis. Arch Phys Med Rehabil 93: 237–244
122. Clark AL, Volterrani M, Swan JW, Coats AJ. (1997). The increased ventilatory response to exercise in chronic heart failure: Relation to pulmonary pathology. Heart 77: 138–146
123. Clark BC, Manini TM. (2008). Sarcopenia =/= dynapenia. J Gerontol A Biol Sci Med Sci 63: 829–834
124. Clark BC, Manini TM. (2010). Functional consequences of sarcopenia and dynapenia in the elderly. Curr Opin Clin Nutr Metab Care 13: 271–276
125. Clemson L, Fiatarone Singh MA, Bundy A, et al. (2012). Integration of balance and strength training into daily life activity to reduce rate of falls in older people (the LiFE study): Randomised parallel trial. BMJ 345: e4547
126. Cohen A, Dempster DW, Recker RR, et al. (2013). Abdominal fat is associated with lower bone formation and inferior bone quality in healthy premenopausal women: A transiliac bone biopsy study. J Clin Endocrinol Metab 98: 2562–2572
127. Cohen DD, Gomez-Arbelaez D, Camacho PA, et al. (2014). Low muscle strength is associated with metabolic risk factors in Colombian children: The ACFIES study. PloS One 9: e93150
128. Colberg SR, Sigal RJ, Yardley JE, et al. (2016). Physical activity/exercise and diabetes: A position statement of the American Diabetes Association. Diabetes Care 39: 2065–2079
129. Colcombe S, Kramer AF. (2003). Fitness effects on the cognitive function of older adults: A meta-analytic study. Psychol Sci 14: 125–130
130. Coleman BJ. (1995). European models of long-term care in the home and community. Int J Health Serv 25: 455–474
131. Compston J, Watts N, Chapurlat R, et al. (2011). Obesity is not protective against fracture in postmenopausal women. Am J Med 124: 1043–1050
132. Conlon JA, Newton RU, Tufano JJ, et al. (2017). The efficacy of periodised resistance training on neuromuscular adaptation in older adults. Eur J Appl Physiol 117: 1181–1194
133. Control CfD, Prevention. (2007). Physical activity among adults with a disability—United States, 2005. MMWR Morb Mortal Wkly Rep 56: 1021
134. Coresh J, Astor BC, Greene T, Eknoyan G, Levey AS. (2003). Prevalence of chronic kidney disease and decreased kidney function in the adult US population: Third National Health and Nutrition Examination Survey. Am J Kidney Dis 41: 1–12
135. Coresh J, Selvin E, Stevens LA, et al. (2007). Prevalence of chronic kidney disease in the United States. JAMA 298: 2038–2047
136. Cornelissen VA, Fagard RH. (2005). Effect of resistance training on resting blood pressure: A meta-analysis of randomized controlled trials. J Hypertens 23: 251–259
137. Craig BW, Brown R, Everhart J. (1989). Effects of progressive resistance training on growth hormone and testosterone levels in young and elderly subjects. Mech Ageing Dev 49: 159–169
138. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. (2018). Sarcopenia: Revised European consensus on definition and diagnosis. Age Ageing 48: 16–31
139. Cruz-Jentoft AJ, Landi F, Schneider SM, et al. (2014). Prevalence of and interventions for sarcopenia in ageing adults: A systematic review. Report of the International Sarcopenia initiative (EWGSOP and IWGS). Age Ageing 43: 748–759,
140. Csapo R, Alegre LM. (2016). Effects of resistance training with moderate vs heavy loads on muscle mass and strength in the elderly: A meta-analysis. Scand J Med Sci Sports 26: 995–1006
141. da Silva LXN, Teodoro JL, Menger E, et al. (2018). Repetitions to failure versus not to failure during concurrent training in healthy elderly men: A randomized clinical trial. Exp Gerontol 108: 18–27
142. Dalsky GP, Stocke KS, Ehsani AA, et al. (1988). Weight-bearing exercise training and lumbar bone mineral content in postmenopausal women. Ann Intern Med 108: 824–828
143. Daly M, Vidt ME, Eggebeen JD, et al. (2013). Upper extremity muscle volumes and functional strength after resistance training in older adults. J Aging Phys Act 21: 186–207
144. Damush TM, Damush JG Jr. (1999). The effects of strength training on strength and health-related quality of life in older adult women. Gerontologist 39: 705–710
145. Dardevet D, Sornet C, Balage M, Grizard J. (2000). Stimulation of in vitro rat muscle protein synthesis by leucine decreases with age. J Nutr 130: 2630–2635
146. Davidson LE, Hudson R, Kilpatrick K, et al. (2009). Effects of exercise modality on insulin resistance and functional limitation in older adults: A randomized controlled trial. Arch Intern Med 169: 122–131
147. de Boer MD, Morse CI, Thom JM, de Haan A, Narici MV. (2007). Changes in antagonist muscles' coactivation in response to strength training in older women. J Gerontol A Biol Sci Med Sci 62: 1022–1027
148. De Luca CJ, Contessa P. (2012). Hierarchical control of motor units in voluntary contractions. J Neurophysiol 107: 178–195
149. de Rezende LFM, Rey-López JP, Matsudo VKR, do Carmo Luiz O. (2014). Sedentary behavior and health outcomes among older adults: A systematic review. BMC Public Health 14: 333
150. de Vos NJ, Singh NA, Ross DA, et al. (2000). Optimal load for increasing muscle power during explosive resistance training in older adults. (2005). J Gerontol A Biol Sci Med Sci 60: 638–647.
151. de Vreede PL, Samson MM, van Meeteren NL, Duursma SA, Verhaar HJ. (2005). Functional-task exercise versus resistance strength exercise to improve daily function in older women: A randomized, controlled trial. J Am Geriatr Soc 53: 2–10
152. de Vreede PL, van Meeteren NL, Samson MM, et al. (2007). The effect of functional tasks exercise and resistance exercise on health-related quality of life and physical activity. A randomised controlled trial. Gerontology 53: 12–20
153. de Vries NM, van Ravensberg CD, Hobbelen JS, et al. (2012). Effects of physical exercise therapy on mobility, physical functioning, physical activity and quality of life in community-dwelling older adults with impaired mobility, physical disability and/or multi-morbidity: A meta-analysis. Ageing Res Rev 11: 136–149
154. DeBeliso M, Harris C, Spitzer-Gibson T, Adams KJ. (2005). A comparison of periodised and fixed repetition training protocol on strength in older adults. J Sci Med Sport 8: 190–199
155. Delmonico MJ, Harris TB, Visser M, et al. (2009). Longitudinal study of muscle strength, quality, and adipose tissue infiltration. Am J Clin Nutr 90: 1579–1585
156. Despres JP. (2012). Body fat distribution and risk of cardiovascular disease: An update. Circulation 126: 1301–1313
157. Despres JP, Lemieux I. (2006). Abdominal obesity and metabolic syndrome. Nature 444: 881–887
158. Despres JP, Lemieux I, Bergeron J, et al. (2008). Abdominal obesity and the metabolic syndrome: Contribution to global cardiometabolic risk. Arterioscler Thromb Vasc Biol 28: 1039–1049
159. Diamanti-Kandarakis E, Dattilo M, Macut D, et al. (2017). Mechanisms in endocrinology: Aging and anti-aging: A combo-endocrinology overview. Eur J Endocrinol 176: R283–R308
160. DiFrancisco-Donoghue J, Werner W, Douris PC. (2007). Comparison of once-weekly and twice-weekly strength training in older adults. Br J Sports Med 41: 19–22
161. Ditroilo M, Forte R, Benelli P, Gambarara D, De Vito G. (2010). Effects of age and limb dominance on upper and lower limb muscle function in healthy males and females aged 40-80 years. J Sports Sci 28: 667–677
162. Dobek JC, White KN, Gunter KB. (2007). The effect of a novel ADL-based training program on performance of activities of daily living and physical fitness. J Aging Phys Act 15: 13–25
163. Doherty TJ, Brown WF. (1993). The estimated numbers and relative sizes of thenar motor units as selected by multiple point stimulation in young and older adults. Muscle Nerve 16: 355–366
164. Doherty TJ, Stashuk DW, Brown WF. (1993). Determinants of mean motor unit size: Impact on estimates of motor unit number. Muscle Nerve 16: 1326–1331
165. Doherty TJ, Vandervoort AA, Brown WF. (1993). Effects of ageing on the motor unit: A brief review. Can J Appl Physiol 18: 331–358
166. Doherty TJ, Vandervoort AA, Taylor AW, Brown WF. (1993). Effects of motor unit losses on strength in older men and women. J Appl Physiol (1985) 74: 868–874
167. Dorner T, Kranz A, Zettl-Wiedner K, Ludwig C, Rieder A, Gisinger C. (2007). The effect of structured strength and balance training on cognitive function in frail, cognitive impaired elderly long-term care residents. Aging Clin Exp Res 19: 400–405
168. Downs SH, Black N. (1998). The feasibility of creating a checklist for the assessment of the methodological quality both of randomised and non-randomised studies of health care interventions. J Epidemiol Community Health 52: 377–384
169. Duchateau J, Enoka RM. (2011). Human motor unit recordings: Origins and insight into the integrated motor system. Brain Res 1409: 42–61
170. Duchowny KA, Peterson MD, Clarke PJ. (2017). Cut points for clinical muscle weakness among older Americans. Am J Prev Med 53: 63–69
171. Dunstan DW, Daly RM, Owen N, et al. (2002). High-intensity resistance training improves glycemic control in older patients with type 2 diabetes. Diabetes Care 25: 1729–1736
172. Evans JW. (2019). Periodized resistance training for enhancing skeletal muscle hypertrophy and strength: A mini-review. Front Physiol 10: 13
173. Evans W. (1997). Functional and metabolic consequences of sarcopenia. J Nutr 127(5 Suppl): 998S–1003S
174. Evans WJ. (2002). Effects of exercise on senescent muscle. Clin Orthop Relat Res (403 Suppl): S211–S220
175. Fabbri E, An Y, Gonzalez-Freire M, et al. (2016). Bioavailable testosterone linearly declines over a wide age spectrum in men and women from the Baltimore longitudinal study of aging. J Gerontol A Biol Sci Med Sci 71: 1202–1209
176. Fagard RH. (2002). Epidemiology of hypertension in the elderly. Am J Geriatr Cardiol 11: 23–28
177. Fatouros IG, Kambas A, Katrabasas I, et al. (2006). Resistance training and detraining effects on flexibility performance in the elderlyare intensity-dependent. J Strength Cond Res 20: 634–642
178. Fatouros IG, Taxildaris K, Tokmakidis SP, et al. (2002). The effects of strength training, cardiovascular training and their combination on flexibility of inactive older adults. Int J Sports Med 23: 112–119
179. Featherstone JF, Holly RG, Amsterdam EA. (1993). Physiologic responses to weight lifting in coronary artery disease. Am J Cardiol 71: 287–292
180. Ferrari R, Kruel LF, Cadore EL, et al. (2013). Efficiency of twice weekly concurrent training in trained elderly men. Exp Gerontol 48: 1236–1242
181. Ferri A, Scaglioni G, Pousson M, Capodaglio P, Van Hoecke J, Narici MV. (2003). Strength and power changes of the human plantar flexors and knee extensors in response to resistance training in old age. Acta Physiol Scand 177: 69–78
182. Fiatarone MA, Kehayias JJ, Roberts SB, et al. (1994). Exercise training and nutritional supplementation for physical frailty in very elderly people. New Engl J Med 330: 1769–1775
183. Fiatarone MA, Marks EC, Ryan ND, Meredith CN, Lipsitz LA, Evans WJ. (1990). High-intensity strength training in nonagenarians. Effects on skeletal muscle. JAMA 263: 3029–3034
184. Fiatarone MA, O'Neill EF, Ryan ND, et al. (1994). Exercise training and nutritional supplementation for physical frailty in very elderlypeople. N Engl J Med 330: 1769–1775
185. Fiatarone Singh MA, Gates N, Saigal N, et al. (2014). The study of mental and resistance training (SMART) study-resistance training and/or cognitive training in mild cognitive impairment: A randomized, double-blind, double-sham controlled trial. J Am Med Dir Assoc 15: 873–880
186. Fielding RA, LeBrasseur NK, Cuoco A, Bean J, Mizer K, Fiatarone Singh MA. (2002). High-velocity resistance training increases skeletal muscle peak power in older women. J Am Geriatr Soc 50: 655–662
187. Fisher NM, Pendergast DR, Calkins E. (1991). Muscle rehabilitation in impaired elderly nursing home residents. Arch Phys Med Rehabil 72: 181–185
188. Fleg JL, Cooper LS, Borlaug BA, et al. (2015). Exercise training as therapy for heart failure: Current status and future directions. Circ Heart Fail 8: 209–220
189. Flegal KM, Kruszon-Moran D, Carroll MD, Fryar CD, Ogden CL. (2016). Trends in obesity among adults in the United States, 2005 to 2014. JAMA 315: 2284–2291
190. Foldvari M, Clark M, Laviolette LC, et al. (2000). Association of muscle power with functional status in community-dwelling elderlywomen. J Gerontol A Biol Sci Med Sci 55: M192–M199
191. Forman-Hoffman VL, Ault KL, Anderson WL, et al. (2015). Disability status, mortality, and leading causes of death in the United States community population. Med Care 53: 346
192. Fragala MS, Alley DE, Shardell MD, et al. (2016). Comparison of handgrip and leg extension strength in predicting slow gait speed in older adults. J Am Geriatr Soc 64: 144–150
193. Franceschi C, Campisi J. (2014). Chronic inflammation (inflammaging) and its potential contribution to age-associated diseases. J Gerontol A Biol Sci Med Sci 69(Suppl 1): S4–S9
194. Frederiksen H, Gaist D, Petersen HC, et al. (2002). Hand grip strength: A phenotype suitable for identifying genetic variants affecting mid- and late-life physical functioning. Genet Epidemiol 23: 110–122
195. Freiberger E, Haberle L, Spirduso WW, Zijlstra GA. (2012). Long-term effects of three multicomponent exercise interventions on physical performance and fall-related psychological outcomes in community-dwelling older adults: A randomized controlled trial. J Am Geriatr Soc 60: 437–446
196. Fried LP, Tangen CM, Walston J, et al. (2001). Frailty in older adults: Evidence for a phenotype. J Gerontol A Biol Sci Med Sci 56: M146–M156
197. Frontera WR. (2017). What is it about old muscles? J Physiol 595: 4581–4582.
198. Frontera WR, Bean JF, Damiano D, et al. (2017). Rehabilitation research at the National Institutes of Health: Moving the field forward (executive summary). Arch Phys Med Rehabil 98: 795–803
199. Frontera WR, Hughes VA, Fielding RA, et al. (2000). Aging of skeletal muscle: A 12-yr longitudinal study. J Appl Physiol (1985) 88: 1321–1326
200. Frontera WR, Hughes VA, Lutz KJ, Evans WJ. (1991). A cross-sectional study of muscle strength and mass in 45- to 78-yr-old men and women. J Appl Physiol (1985) 71: 644–650
201. Frontera WR, Meredith CN, O'Reilly KP, Knuttgen HG, Evans WJ. Strength conditioning in older men: Skeletal muscle hypertrophy and improved function. J Appl Physiol (1985) 64: 1038–1044, 1988.
202. Frontera WR, Suh D, Krivickas LS, Hughes VA, Goldstein R, Roubenoff R. Skeletal muscle fiber quality in older men and women. Am J Physiol Cell Physiol 279: C611–C618, 2000.
203. Fyfe JJ, Bishop DJ, Stepto NK. (2014). Interference between concurrent resistance and endurance exercise: Molecular bases and the role of individual training variables. Sports Med 44: 743–762
204. Gadelha AB, Paiva FM, Gauche R, de Oliveira RJ, Lima RM. (2016). Effects of resistance training on sarcopenic obesity index in older women: A randomized controlled trial. Arch Gerontol Geriatr 65: 168–173
205. Gaffey AE, Bergeman CS, Clark LA, Wirth MM. (2016). Aging and the HPA axis: Stress and resilience in older adults. Neurosci Biobehav Rev 68: 928–945
206. Gallagher D, Kelley DE, Yim JE, et al. (2009). Adipose tissue distribution is different in type 2 diabetes. Am J Clin Nutr 89: 807–814
207. Gallagher D, Visser M, De Meersman RE, et al. (1997). Appendicular skeletal muscle mass: Effects of age, gender, and ethnicity. J Appl Physiol (1985) 83: 229–239
208. Galvao DA, Newton RU, Taaffe DR. (2005). Anabolic responses to resistance training in older men and women: A brief review. J Aging Phys Act 13: 343–358
209. Galvao DA, Taaffe DR. (2005). Resistance exercise dosage in older adults: Single- versus multiset effects on physical performance and body composition. J Am Geriatr Soc 53: 2090–2097
210. Garatachea N, Lucia A. (2013). Genes and the ageing muscle: A review on genetic association studies. Age (Dordr) 35: 207–233
211. Garcia-Garcia FJ, Gutierrez Avila G, Alfaro-Acha A, et al. (2011). The prevalence of frailty syndrome in an older population from Spain. The Toledo Study for Healthy Aging. J Nutr Health Aging 15: 852–856
212. Gassen NC, Chrousos GP, Binder EB, Zannas AS. (2017). Life stress, glucocorticoid signaling, and the aging epigenome: Implications for aging-related diseases. Neurosci Biobehav Rev 74: 356–365
213. Gatti R, De Palo EF, Antonelli G, Spinella P. (2012). IGF-I/IGFBP system: Metabolism outline and physical exercise. J Endocrinol Invest 35: 699–707
214. Gauche R, Lima RM, Myers J, et al. (2017). Blood pressure reactivity to mental stress is attenuated following resistance exercise in older hypertensive women. Clin Interv Aging 12: 793–803
215. Gell NM, Wallace RB, LaCroix AZ, Mroz TM, Patel KV. (2015). Mobility device use in older adults and incidence of falls and worry about falling: Findings from the 2011–2012 national health and aging trends study. J Am Geriatr Soc 63: 853–859
216. Gerstner GR, Thompson BJ, Rosenberg JG, et al. (2017). Neural and muscular contributions to the age-related reductions in rapid strength. Med Sci Sports Exerc 49: 1331–1339
217. Ghadieh AS, Saab B. (2015). Evidence for exercise training in the management of hypertension in adults. Can Fam Physician 61: 233–239
218. Giangregorio LM, Papaioannou A, Macintyre NJ, et al. (2014). Too fit to fracture: Exercise recommendations for individuals with osteoporosis or osteoporotic vertebral fracture. Osteoporos Int 25: 821–835
219. Gilbert KL, Stokes KA, Hall GM, Thompson D. (2008). Growth hormone responses to 3 different exercise bouts in 18- to 25- and 40- to 50-year-old men. Appl Physiol Nutr Metab 33: 706–712
220. Giné-Garriga M, Guerra M, Pagès E, et al. (2010). The effect of functional circuit training on physical frailty in frail older adults: A randomized controlled trial. J Aging Phys Act 18: 401–424
221. Gonzalez AM, Mangine GT, Fragala MS, et al. (2014). Resistance training improves single leg stance performance in older adults. Aging Clin Exp Res 26: 89–92
222. Goodpaster BH, Carlson CL, Visser M, et al. (2001). Attenuation of skeletal muscle and strength in the elderly: The Health ABC Study. J Appl Physiol 90: 2157–2165
223. Goodpaster BH, Chomentowski P, Ward BK, et al. (2008). Effects of physical activity on strength and skeletal muscle fat infiltration in older adults: A randomized controlled trial. J Appl Physiol (1985) 105: 1498–1503
224. Goodpaster BH, Kelley DE, Thaete FL, He J, Ross R. (2000). Skeletal muscle attenuation determined by computed tomography is associated with skeletal muscle lipid content. J Appl Physiol 89: 104–110
225. Goodpaster BH, Park SW, Harris TB, et al. (2006). The loss of skeletal muscle strength, mass, and quality in older adults: The health, aging and body composition study. J Gerontol A Biol Sci Med Sci 61: 1059–1064
226. Goodpaster BH, Thaete FL, Kelley DE. (2000). Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. Am J Clin Nutr 71: 885–892
227. Gordon NF, Kohl HW III, Pollock ML, et al. (1995). Cardiovascular safety of maximal strength testing in healthy adults. Am J Cardiol 76: 851–853
228. Gordon SE, Kraemer WJ, Looney DP, et al. (2014). The influence of age and exercise modality on growth hormone bioactivity in women. Growth Horm IGF Res 24: 95–103
229. Gordon SE, Kraemer WJ, Vos NH, Lynch JM, Knuttgen HG. (1994). Effect of acid-base balance on the growth hormone response to acute high-intensity cycle exercise. J Appl Physiol (1985) 76: 821–829
230. Gorostiaga EM, Navarro-Amezqueta I, Calbet JA, et al. (2012). Energy metabolism during repeated sets of leg press exerciseleading to failure or not. PLoS One 7: e40621
231. Gower BA, Casazza K. (2013). Divergent effects of obesity on bone health. J Clin Densitom 16: 450–454
232. Granacher U, Gruber M, Gollhofer A. (2009). Resistance training and neuromuscular performance in seniors. Int J Sports Med 30: 652–657
233. Gregg EW, Sattar N, Ali MK. (2016). The changing face of diabetes complications. Lancet Diabetes Endocrinol 4: 537–547
234. Gregg EW, Sorlie P, Paulose-Ram R, et al. (2004). Prevalence of lower-extremity disease in the US adult population >=40 years of age with and without diabetes: 1999–2000 national health and nutrition examination survey. Diabetes Care 27: 1591–1597
235. Gregg EW, Zhuo X, Cheng YJ, Albright AL, Narayan KMV, Thompson TJ. (2014). Trends in lifetime risk and years of life lost due to diabetes in the USA, 1985-2011: A modelling study. Lancet Diabetes Endocrinol 2: 867–874
236. Greiwe JS, Cheng B, Rubin DC, Yarasheski KE, Semenkovich CF. (2001). Resistance exercise decreases skeletal muscle tumor necrosis factor alpha in frail elderly humans. FASEB J 15: 475–482
237. Grontved A, Rimm EB, Willett WC, Andersen LB, Hu FB. (2012). A prospective study of weight training and risk of type 2 diabetes mellitus in men. Arch Intern Med 172: 1306–1312
238. Häkkinen K, Häkkinen A. (1995). Neuromuscular adaptations during intensive strength training in middle-aged and elderly males and females. Electromyogr Clin Neurophysiol 35: 137–147
239. Häkkinen K, Kallinen M, Izquierdo M, et al. (1998). Changes in agonist-antagonist EMG, muscle CSA, and force during strength training in middle-aged and older people. J Appl Physiol (1985) 84: 1341–1349
240. Häkkinen K, Kallinen M, Linnamo V, et al. (1996). Neuromuscular adaptations during bilateral versus unilateral strength training in middle-aged and elderly men and women. Acta Physiol Scand 158: 77–88
241. Häkkinen K, Kraemer WJ, Newton RU, Alen M. (2001). Changes in electromyographic activity, muscle fibre and force production characteristics during heavy resistance/power strength training in middle-aged and older men and women. Acta Physiol Scand 171: 51–62
242. Häkkinen K, Kraemer WJ, Pakarinen A, et al. (2002). Effects of heavy resistance/power training on maximal strength, muscle morphology, and hormonal response patterns in 60-75-year-old men and women. Can J Appl Physiol 27: 213–231
243. Häkkinen K, Newton RU, Gordon SE, et al. (1998). Changes in muscle morphology, electromyographic activity, and force production characteristics during progressive strength training in young and older men. J Gerontol A Biol Sci Med Sci 53: B415–B423
244. Häkkinen K, Pakarinen A. (1994). Serum hormones and strength development during strength training in middle-aged and elderlymales and females. Acta Physiol Scand 150: 211–219
245. Häkkinen K, Pakarinen A, Kraemer WJ, et al. (2001). Selective muscle hypertrophy, changes in EMG and force, and serum hormones during strength training in older women. J Appl Physiol (1985) 91: 569–580
246. Häkkinen K, Pakarinen A, Kraemer WJ, Newton RU, Alen M. (2000). Basal concentrations and acute responses of serum hormones and strength development during heavy resistance training in middle-aged and elderly men and women. J Gerontol A Biol Sci Med Sci 55: B95–B105
247. Häkkinen K, Pakarinen A, Newton RU, Kraemer WJ. (1998). Acute hormone responses to heavy resistance lower and upper extremity exercise in young versus old men. Eur J Appl Physiol Occup Physiol 77: 312–319
248. Häkkinen K, Pastinen UM, Karsikas R, Linnamo V. (1995). Neuromuscular performance in voluntary bilateral and unilateral contraction and during electrical stimulation in men at different ages. Eur J Appl Physiol Occup Physiol 70: 518–527
249. Hameed M, Lange KH, Andersen JL, et al. (2004). The effect of recombinant human growth hormone and resistance training on IGF-I mRNA expression in the muscles of elderly men. J Physiol 555(Pt 1): 231–240
250. Hameed M, Orrell RW, Cobbold M, Goldspink G, Harridge SD. (2003). Expression of IGF-I splice variants in young and old human skeletal muscle after high resistance exercise. J Physiol 547(Pt 1): 247–254
251. Harridge SD, Kryger A, Stensgaard A. (1999). Knee extensor strength, activation, and size in very elderly people following strength training. Muscle Nerve 22: 831–839
252. Hassan BH, Hewitt J, Keogh JWL, et al. (2016). Impact of resistance training on sarcopenia in nursing care facilities: A pilot study. Geriatr Nurs 37: 116–121
253. Hasten DL, Pak-Loduca J, Obert KA, Yarasheski KE. (2000). Resistance exercise acutely increases MHC and mixed muscle protein synthesis rates in 78-84 and 23-32 yr olds. Am J Physiol Endocrinol Metab 278: E620–E626
254. Haub MD, Wells AM, Tarnopolsky MA, Campbell WW. (2002). Effect of protein source on resistive-training-induced changes in body composition and muscle size in older men. Am J Clin Nutr 76: 511–517
255. Hauer K, Rost B, Rutschle K, et al. (2001). Exercise training for rehabilitation and secondary prevention of falls in geriatric patients with a history of injurious falls. J Am Geriatr Soc 49: 10–20
256. Hauer K, Schwenk M, Zieschang T, Essig M, Becker C, Oster P. (2012). Physical training improves motor performance in people with dementia: A randomized controlled trial. J Am Geriatr Soc 60: 8–15
257. Haykowsky M, Humen D, Teo K, et al. (2000). Effects of 16 weeks of resistance training on left ventricular morphology and systolic function in healthy men >60 years of age. Am J Cardiol 85: 1002–1006
258. Haykowsky M, McGavock J, Vonder Muhll I, et al. (2005). Effect of exercise training on peak aerobic power, left ventricular morphology, and muscle strength in healthy older women. J Gerontol A Biol Sci Med Sci 60: 307–311
259. Hazell T, Kenno K, Jakobi J. (2007). Functional benefit of power training for older adults. J Aging Phys Act 15: 349–359
260. Heffernan KS, Yoon ES, Sharman JE, et al. (2013). Resistance exercise training reduces arterial reservoir pressure in older adults with prehypertension and hypertension. Hypertens Res 36: 422–427
261. Hennessey JV, Chromiak JA, DellaVentura S, et al. (2001). Growth hormone administration and exercise effects on muscle fiber type and diameter in moderately frail older people. J Am Geriatr Soc 49: 852–858
262. Henwood TR, Riek S, Taaffe DR. (2008). Strength versus muscle power-specific resistance training in community-dwelling older adults. J Gerontol A Biol Sci Med Sci 63: 83–91
263. Henwood TR, Taaffe DR. (2005). Improved physical performance in older adults undertaking a short-term programme of high-velocity resistance training. Gerontology 51: 108–115
264. Henwood TR, Taaffe DR. (2006). Short-term resistance training and the older adult: The effect of varied programmes for the enhancement of muscle strength and functional performance. Clin Physiol Funct Imaging 26: 305–313
265. Heyn P, Abreu BC, Ottenbacher KJ. (2004). The effects of exercise training on elderly persons with cognitive impairment and dementia: A meta-analysis. Arch Phys Med Rehabil 85: 1694–1704
266. Heyn PC, Johnson KE, Kramer AF. (2008). Endurance and strength training outcomes on cognitively impaired and cognitively intact older adults: A meta-analysis. J Nutr Health Aging 12: 401–409
267. Hickson RC. (1980). Interference of strength development by simultaneously training for strength and endurance. Eur J Appl Physiol Occup Physiol 45: 255–263
268. Hoffmann TC, Maher CG, Briffa T, et al. (2016). Prescribing exercise interventions for patients with chronic conditions. CMAJ 188: 510–518
269. Hofmann M, Schober-Halper B, Oesen S, et al. (2016). Effects of elastic band resistance training and nutritional supplementation on muscle quality and circulating muscle growth and degradation factors of institutionalized elderly women: The Vienna Active Ageing Study (VAAS). Eur J Appl Physiol 116: 885–897
270. Hollings M, Mavros Y, Freeston J, Fiatarone Singh M. (2017). The effect of progressive resistance training on aerobic fitness and strength in adults with coronary heart disease: A systematic review and meta-analysis of randomised controlled trials. Eur J Prev Cardiol 24: 1242–1259
271. Holviala JH, Sallinen JM, Kraemer WJ, Alen MJ, Häkkinen KK. (2006). Effects of strength training on muscle strength characteristics, functional capabilities, and balance in middle-aged and older women. J Strength Cond Res 20: 336–344
272. Hortobagyi T, Tunnel D, Moody J, Beam S, DeVita P. (2001). Low- or high-intensity strength training partially restores impaired quadriceps force accuracy and steadiness in aged adults. J Gerontol A Biol Sci Med Sci 56: B38–B47
273. Hovanec N, Sawant A, Overend TJ, Petrella RJ, Vandervoort AA. (2012). Resistance training and older adults with type 2 diabetes mellitus: Strength of the evidence. J Aging Res 2012: 284635
274. Hruda KV, Hicks AL, McCartney N. (2003). Training for muscle power in older adults: Effects on functional abilities. Can J Appl Physiol 28: 178–189
275. Hubal MJ, Gordish-Dressman H, Thompson PD, et al. (2005). Variability in muscle size and strength gain after unilateral resistance training. Med Sci Sports Exerc 37: 964–972
276. Hulmi JJ, Ahtiainen JP, Selanne H, et al. (2008). Androgen receptors and testosterone in men—Effects of protein ingestion, resistance exercise and fiber type. J Steroid Biochem Mol Biol 110: 130–137
277. Hunter GR, McCarthy JP, Bamman MM. (2004). Effects of resistance training on older adults. Sports Med 34: 329–348
278. Hunter GR, Wetzstein CJ, Fields DA, Brown A, Bamman MM. (2000). Resistance training increases total energy expenditure and free-living physical activity in older adults. J Appl Physiol (1985) 89: 977–984
279. Hunter GR, Wetzstein CJ, McLafferty CL Jr, et al. (2001). High-resistance versus variable-resistance training in older adults. Med Sci Sports Exerc 33: 1759–1764
280. Hunter SK, Pereira HM, Keenan KG. (2016). The aging neuromuscular system and motor performance. J Appl Physiol (1985) 121: 982–995
281. Hurlbut DE, Lott ME, Ryan AS, et al. (2002). Does age, sex, or ACE genotype affect glucose and insulin responses to strength training? J Appl Physiol (1985) 92: 643–650.
282. Hurley BF, Hanson ED, Sheaff AK. (2011). Strength training as a countermeasure to aging muscle and chronic disease. Sports Med 41: 289–306
283. Hyatt RH, Whitelaw MN, Bhat A, Scott S, Maxwell JD. (1990). Association of muscle strength with functional status of elderly people. Age Ageing 19: 330–336
284. Ibanez J, Izquierdo M, Arguelles I, et al. (2005). Twice-weekly progressive resistance training decreases abdominal fat and improves insulin sensitivity in older men with type 2 diabetes. Diabetes Care 28: 662–667
285. Ice GH. (2002). Daily life in a nursing home Has it changed in 25 years? J Aging Stud 16: 345.
286. Igwebuike A, Irving BA, Bigelow ML, et al. (2008). Lack of dehydroepiandrosterone effect on a combined endurance and resistance exercise program in postmenopausal women. J Clin Endocrinol Metab 93: 534–538
287. Ivey FM, Roth SM, Ferrell RE, et al. (2000). Effects of age, gender, and myostatin genotype on the hypertrophic response to heavy resistance strength training. J Gerontol A Biol Sci Med Sci 55: M641–M648
288. Ivey FM, Tracy BL, Lemmer JT, et al. (2000). Effects of strength training and detraining on muscle quality: Age and gender comparisons. J Gerontol A Biol Sci Med Sci 55: B152–B157, 2000; discussion B8-9.
289. Izquierdo M, Häkkinen K, Anton A, et al. (2001). Maximal strength and power, endurance performance, and serum hormones in middle-aged and elderly men. Med Sci Sports Exerc 33: 1577–1587
290. Izquierdo M, Häkkinen K, Ibanez J, et al. (2003). Effects of strength training on submaximal and maximal endurance performance capacity in middle-aged and older men. J Strength Cond Res 17: 129–139
291. Izquierdo M, Häkkinen K, Ibanez J, et al. (2001). Effects of strength training on muscle power and serum hormones in middle-aged and older men. J Appl Physiol (1985) 90: 1497–1507
292. Izquierdo M, Ibanez J, Gorostiaga E, et al. (1999). Maximal strength and power characteristics in isometric and dynamic actions of the upper and lower extremities in middle-aged and older men. Acta Physiol Scand 167: 57–68
293. Izquierdo M, Ibanez J, Kraemer WJ, Larrion JL, Gorostiaga EM. (2004). Once weekly combined resistance and cardiovascular training in healthy older men. Med Sci Sports Exerc 36: 435–443
294. Izumi A, Kitamura M, Izawa KP. (2016). Effects of exercise training on delaying disease progression in patients with chronic kidney disease: A review of the literature. Rev Recent Clin Trials 11: 333–341
295. Jafarzadeh SR, Felson DT. (2017). Updated estimates suggest a much higher prevalence of arthritis in US adults than previous ones. Arthritis Rheumatol 70: 185–192
296. Jakobi JM, Rice CL. (1985). Voluntary muscle activation varies with age and muscle group. J Appl Physiol 93: 457–462
297. Jan MH, Lin JJ, Liau JJ, Lin YF, Lin DH. (2008). Investigation of clinical effects of high- and low-resistance training for patients with knee osteoarthritis: A randomized controlled trial. Phys Ther 88: 427–436
298. Janssen I, Heymsfield SB, Wang ZM, Ross R. (2000). Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol (1985) 89: 81–88
299. Janssen JA. (2016). Impact of physical exercise on endocrine aging. Front Horm Res 47: 68–81
300. Johansen KL, Painter P. (2012). Exercise in individuals with CKD. Am J Kidney Dis 59: 126–134
301. Johnen B, Schott N. (2018). Feasibility of a machine vs free weight strength training program and its effects on physical performance in nursing home residents: A pilot study. Aging Clin Exp Res 30: 819–828
302. Johnson RJ, Rodriguez-Iturbe B, Roncal-Jimenez C, et al. (2014). Hyperosmolarity drives hypertension and CKD—water and salt revisited. Nat Rev Nephrol 10: 415–420
303. Johnson Stoklossa CA, Sharma AM, Forhan M, et al. (2017). Prevalence of sarcopenic obesity in adults with class II/III obesity using different diagnostic criteria. J Nutr Metab 2017: 7307618
304. Johnston AP, De Lisio M, Parise G. (2008). Resistance training, sarcopenia, and the mitochondrial theory of aging. Appl Physiol Nutr Metab 33: 191–199
305. Jordan JM, Helmick CG, Renner JB, et al. (2007). Prevalence of knee symptoms and radiographic and symptomatic knee osteoarthritis in African Americans and Caucasians: The Johnston county osteoarthritis project. J Rheumatol 34: 172–180
306. Jordan JM, Helmick CG, Renner JB, et al. (2009). Prevalence of hip symptoms and radiographic and symptomatic hip osteoarthritis in African Americans and Caucasians: The Johnston county osteoarthritis project. J Rheumatol 36: 809–815
307. Joseph LJ, Davey SL, Evans WJ, Campbell WW. (1999). Differential effect of resistance training on the body composition and lipoprotein-lipid profile in older men and women. Metabolism 48: 1474–1480
308. Judge JO, Whipple RH, Wolfson LI. (1994). Effects of resistive and balance exercises on isokinetic strength in older persons. J Am Geriatr Soc 42: 937–946
309. Kalapotharakos V, Smilios I, Parlavatzas A, Tokmakidis SP. (2007). The effect of moderate resistance strength training and detraining on muscle strength and power in older men. J Geriatr Phys Ther 30: 109–113
310. Kalapotharakos VI, Michalopoulou M, Godolias G, et al. (2004). The effects of high- and moderate-resistance training on muscle function in the elderly. J Aging Phys Act 12: 131–143
311. Kalinkovich A, Livshits G. (2017). Sarcopenic obesity or obese sarcopenia: A cross talk between age-associated adipose tissue and skeletal muscle inflammation as a main mechanism of the pathogenesis. Ageing Res Rev 35: 200–221
312. Kalyani RR, Metter EJ, Egan J, Golden SH, Ferrucci L. (2015). Hyperglycemia predicts persistently lower muscle strength with aging. Diabetes Care 38: 82–90
313. Kane RL, Butler M, Fink HA, et al. (2017). Interventions to Prevent Age-Related Cognitive Decline, Mild Cognitive Impairment, and Clinical Alzheimer´s-Type Dementia. Rockville, MD: Agency for Healthcare Research and Quality (US)
314. Karamanidis K, Arampatzis A. (2006). Mechanical and morphological properties of human quadriceps femoris and triceps surae muscle-tendon unit in relation to aging and running. J Biomech 39: 406–417
315. Karinkanta S, Heinonen A, Sievanen H, et al. (2007). A multi-component exercise regimen to prevent functional decline and bone fragility in home-dwelling elderly women: Randomized, controlled trial. Osteoporos Int 18: 453–462
316. Karinkanta S, Kannus P, Uusi-Rasi K, Heinonen A, Sievanen H. (2015). Combined resistance and balance-jumping exercise reduces older women´s injurious falls and fractures: 5-year follow-up study. Age Ageing 44: 784–789
317. Kekalainen T, Kokko K, Sipila S, Walker S. (2017). Effects of a 9-month resistance training intervention on quality of life, sense of coherence, and depressive symptoms in older adults: Randomized controlled trial. Qual Life Res 27: 455–465
318. Kelley GA, Kelley KS. (2000). Progressive resistance exercise and resting blood pressure: A meta-analysis of randomized controlled trials. Hypertension 35: 838–843
319. Kelsey TW, Li LQ, Mitchell RT, et al. (2014). A validated age-related normative model for male total testosterone shows increasing variance but no decline after age 40 years. PLoS One 9: e109346
320. Kendrick D, Kumar A, Carpenter H, et al. (2014). Exercise for reducing fear of falling in older people living in the community. Cochrane Database Syst Rev 11: CD009848
321. Kennis E, Verschueren SM, Bogaerts A, et al. (2013). Long-term impact of strength training on muscle strength characteristics in older adults. Arch Phys Med Rehabil 94: 2054–2060
322. Kessenich CR. (1998). Health-related quality of life in osteoporosis. J Clin Densitom 1: 27–31
323. Keysor JJ. (2003). Does late-life physical activity or exercise prevent or minimize disablement? A critical review of the scientific evidence. Am J Prev Med 25(3 Suppl 2): 129–136
324. Keysor JJ, Jette AM. (2001). Have we oversold the benefit of late-life exercise? J Gerontol A Biol Sci Med Sci 56: M412–M423.
325. Kimball SR, Jefferson LS. (2002). Control of protein synthesis by amino acid availability. Curr Opin Clin Nutr Metab Care 5: 63–67
326. King LK, Birmingham TB, Kean CO, Jones IC, Bryant DM, Giffin JR. (2008). Resistance training for medial compartment knee osteoarthritis and malalignment. Med Sci Sports Exerc 40: 1376–1384
327. Kinne S, Patrick DL, Doyle DL. (2004). Prevalence of secondary conditions among people with disabilities. Am J Public Health 94: 443–445
328. Kitwood T. (1990). The dialectics of dementia: With particular reference to Alzheimer´s disease. Ageing Soc 10: 177–196
329. Klass M, Baudry S, Duchateau J. (2007). Voluntary activation during maximal contraction with advancing age: A brief review. Eur J Appl Physiol 100: 543–551
330. Klass M, Baudry S, Duchateau J. (2008). Age-related decline in rate of torque development is accompanied by lower maximal motor unit discharge frequency during fast contractions. J Appl Physiol (1985) 104: 739–746
331. Klein CS, Ivanova TD, Rice CL, Garland SJ. (2001). Motor unit discharge rate following twitch potentiation in human triceps brachii muscle. Neurosci Lett 316: 153–156
332. Klitgaard H, Mantoni M, Schiaffino S, et al. (1990). Function, morphology and protein expression of ageing skeletal muscle: A cross-sectional study of elderly men with different training backgrounds. Acta Physiol Scand 140: 41–54
333. Knight CA, Kamen G. (2001). Adaptations in muscular activation of the knee extensor muscles with strength training in young and older adults. J Electromyogr Kinesiol 11: 405–412
334. Kolber MJ, Beekhuizen KS, Cheng MS, Hellman MA. (2010). Shoulder injuries attributed to resistance training: A brief review. J Strength Cond Res 24: 1696–1704
335. Korpelainen R, Keinanen-Kiukaanniemi S, Heikkinen J, Vaananen K, Korpelainen J. (2006). Effect of impact exercise on bone mineral density in elderly women with low BMD: A population-based randomized controlled 30-month intervention. Osteoporos Int 17: 109–118
336. Kortebein P, Symons TB, Ferrando A, et al. (2008). Functional impact of 10 days of bed rest in healthy older adults. J Gerontol A Biol Sci Med Sci 63: 1076–1081
337. Kosek DJ, Kim JS, Petrella JK, Cross JM, Bamman MM. (2006). Efficacy of 3 days/wk resistance training on myofiber hypertrophy and myogenic mechanisms in young vs. older adults. J Appl Physiol (1985) 101: 531–544
338. Kraemer WJ. (1988). Endocrine responses to resistance exercise. Med Sci Sports Exerc 20(5 Suppl): S152–S157
339. Kraemer WJ, Deschenes MR, Fleck SJ. (1988). Physiological adaptations to resistance exercise. Implications for athletic conditioning. Sports Med 6: 246–256
340. Kraemer WJ, Dunn-Lewis C, Comstock BA, Thomas GA, Clark JE, Nindl BC. (2010). Growth hormone, exercise, and athletic performance: A continued evolution of complexity. Curr Sports Med Rep 9: 242–252
341. Kraemer WJ, Fragala MS. (2006). Personalize it: Program design in resistance training. ACSM Health Fitness J 10: 7–17
342. Kraemer WJ, Häkkinen K, Newton RU, et al. (1999). Effects of heavy-resistance training on hormonal response patterns in younger vs. older men. J Appl Physiol (1985) 87: 982–992
343. Kraemer WJ, Kennett MJ, Mastro AM, et al. (2017). Bioactive growth hormone in older men and women: It´s relationship to immune markers and healthspan. Growth Horm IGF Res 34: 45–54
344. Kraemer WJ, Nindl BC, Marx JO, et al. (2006). Chronic resistance training in women potentiates growth hormone in vivo bioactivity: Characterization of molecular mass variants. Am J Physiol Endocrinol Metab 291: E1177–E1187
345. Kraemer WJ, Patton JF, Gordon SE, et al. (1995). Compatibility of high-intensity strength and endurance training on hormonal and skeletal muscle adaptations. J Appl Physiol (1985) 78: 976–989
346. Kraemer WJ, Ratamess NA. (2005). Hormonal responses and adaptations to resistance exercise and training. Sports Med 35: 339–361
347. Kraemer WJ, Ratamess NA, Nindl BC. (1985). Recovery responses of testosterone, growth hormone, and IGF-1 after resistance exercise. J Appl Physiol 122: 549–558, 2017.
348. Kraemer WJ, Spiering BA, Volek JS, et al. (2006). Androgenic responses to resistance exercise: Effects of feeding and L-carnitine. Med Sci Sports Exerc 38: 1288–1296
349. Krebs DE, Scarborough DM, McGibbon CA. (2007). Functional vs. strength training in disabled elderly outpatients. Am J Phys Med Rehabil 86: 93–103,
350. Krist L, Dimeo F, Keil T. (2013). Can progressive resistance training twice a week improve mobility, muscle strength, and quality of life in very elderly nursing-home residents with impaired mobility? A pilot study. Clin Interv Aging 8: 443–448
351. Krops LA, Hols DH, Folkertsma N, et al. (2018). Requirements on a community-based intervention for stimulating physical activity in physically disabled people: A focus group study amongst experts. Disabil Rehabil 40: 2400–2407
352. Kryger AI, Andersen JL. (2007). Resistance training in the oldest old: Consequences for muscle strength, fiber types, fiber size, and MHC isoforms. Scand J Med Sci Sports 17: 422–430
353. Ku PW, Fox KR, Gardiner PA, Chen LJ. (2016). Late-life exercise and difficulty with activities of daily living: An 8-year nationwide follow-up study in Taiwan. Ann Behav Med 50: 237–246
354. Lacroix A, Hortobagyi T, Beurskens R, Granacher U. (2017). Effects of supervised vs. unsupervised training programs on balance and muscle strength in older adults: A systematic review and meta-analysis. Sports Med 47: 2341–2361,
355. Lally F, Crome P. (2007). Understanding frailty. Postgrad Med J 83: 16–20
356. Lampe R, Grassl S, Mitternacht J, Gerdesmeyer L, Gradinger R. (2006). MRT-measurements of muscle volumes of the lower extremities of youths with spastic hemiplegia caused by cerebral palsy. Brain Dev 28: 500–506
357. LaPlante MP, Hendershot GE, Moss AJ. (1992). Assistive technology devices and home accessibility features: Prevalence, payment, need, and trends. Adv Data 16: 1–11
358. Larsson L. (1982). Physical training effects on muscle morphology in sedentary males at different ages. Med Sci Sports Exerc 14: 203–206
359. Latham NK, Anderson CS, Lee A, et al. (2003). A randomized, controlled trial of quadriceps resistance exercise and vitamin D in frailolder people: The frailty interventions trial in elderly subjects (FITNESS). J Am Geriatr Soc 51: 291–299
360. Laughlin GA, Barrett-Connor E. (2000). Sexual dimorphism in the influence of advanced aging on adrenal hormone levels: The Rancho Bernardo study. J Clin Endocrinol Metab 85: 3561–3568
361. Lavallee ME, Balam T. (2010). An overview of strength training injuries: Acute and chronic. Curr Sports Med Rep 9: 307–313
362. Law M, Wald N, Morris J. (2003). Lowering blood pressure to prevent myocardial infarction and stroke: A new preventive strategy. Health Technol Assess 7: 1–94
363. Lazowski DA, Ecclestone NA, Myers AM, et al. (1999). A randomized outcome evaluation of group exercise programs in long-term care institutions. J Gerontol Ser A Biol Sci Med Sci 54: M621–M8
364. LeBrasseur NK, Walsh K, Arany Z. (2011). Metabolic benefits of resistance training and fast glycolytic skeletal muscle. Am J Physiol Endocrinol Metab 300: E3–E10
365. Lemmer JT, Hurlbut DE, Martel GF, et al. (2000). Age and gender responses to strength training and detraining. Med Sci Sports Exerc 32: 1505–1512
366. Lemmer JT, Ivey FM, Ryan AS, et al. (2001). Effect of strength training on resting metabolic rate and physical activity: Age and gender comparisons. Med Sci Sports Exerc 33: 532–541
367. Leong DP, Teo KK, Rangarajan S, et al. (2015). Prognostic value of grip strength: Findings from the prospective Urban Rural epidemiology (PURE) study. Lancet 386: 266–273
368. Li WC, Chen YC, Yang RS, Tsauo JY. (2009). Effects of exercise programmes on quality of life in osteoporotic and osteopenic postmenopausal women: A systematic review and meta-analysis. Clin Rehabil 23: 888–896
369. Liao CD, Tsauo JY, Lin LF, et al. (2017). Effects of elastic resistance exercise on body composition and physical capacity in older women with sarcopenic obesity: A CONSORT-compliant prospective randomized controlled trial. Medicine (Baltimore) 96: e7115
370. Lim PS, Cheng YM, Wei YH. (2000). Large-scale mitochondrial DNA deletions in skeletal muscle of patients with end-stage renal disease. Free Radic Biol Med 29: 454–463
371. Lim S, Kim JH, Yoon JW, et al. (2010). Sarcopenic obesity: Prevalence and association with metabolic syndrome in the Korean longitudinal study on health and aging (KLoSHA). Diabetes Care 33: 1652–1654
372. Lind AR, McNicol GW. (1967). Circulatory responses to sustained hand-grip contractions performed during other exercise, both rhythmic and static. J Physiol 192: 595–607
373. Lindle RS, Metter EJ, Lynch NA, et al. (1997). Age and gender comparisons of muscle strength in 654 women and men aged 20-93 yr. J Appl Physiol (1985) 83: 1581–1587
374. Littbrand H, Lundin-Olsson L, Gustafson Y, Rosendahl E. (2009). The effect of a high-intensity functional exercise program on activities of daily living: A randomized controlled trial in residential care facilities. J Am Geriatr Soc 57: 1741–1749
375. Liu-Ambrose T, Donaldson MG. (2009). Exercise and cognition in older adults: Is there a role for resistance training programmes? Br J Sports Med 43: 25–27.
376. Liu-Ambrose T, Donaldson MG, Ahamed Y, et al. (2008). Otago home-based strength and balance retraining improves executive functioning in older fallers: A randomized controlled trial. J Am Geriatr Soc 56: 1821–1830
377. Liu-Ambrose TY, Khan KM, Eng JJ, et al. (2005). Both resistance and agility training reduce back pain and improve health-related quality of life in older women with low bone mass. Osteoporos Int 16: 1321–1329
378. Liu C, Shiroy DM, Jones LY, Clark DO. (2014). Systematic review of functional training on muscle strength, physical functioning, and activities of daily living in older adults. Eur Rev Aging Phys Activity 11: 95–106
379. Liu CJ, Chang WP, Araujo de Carvalho I, et al. (2017). Effects of physical exercise in older adults with reduced physical capacity: meta-analysis of resistance exercise and multimodal exercise. Int J Rehabil Res 40: 303–314
380. Liu CJ, Latham N. (2011). Can progressive resistance strength training reduce physical disability in older adults? A meta-analysis study. Disabil Rehabil 33: 87–97
381. Liu CK, Fielding RA. (2011). Exercise as an intervention for frailty. Clin Geriatr Med 27: 101–110
382. Liu F, Chang HC. (2017). Physiological links of circadian clock and biological clock of aging. Protein Cell 8: 477–488
383. Lohne-Seiler H, Torstveit MK, Anderssen SA. (2013). Traditional versus functional strength training: Effects on muscle strength and power in the elderly. J Aging Phys Act 21: 51–70
384. Lopez P, Pinto RS, Radaelli R, et al. (2018). Benefits of resistance training in physically frail elderly: A systematic review. Aging Clin Exp Res 30: 889–899
385. Lord SR, Castell S, Corcoran J, et al. (2003). The effect of group exercise on physical functioning and falls in frail older people living in retirement villages: A randomized, controlled trial. J Am Geriatr Soc 51: 1685–1692
386. Lourenzi FM, Jones A, Pereira DF, et al. (2017). Effectiveness of an overall progressive resistance strength program for improving the functional capacity of patients with rheumatoid arthritis: A randomized controlled trial. Clin Rehabil 31: 1482–1491
387. Lovell DI, Cuneo R, Gass GC. (2010). The effect of strength training and short-term detraining on maximum force and the rate of force development of older men. Eur J Appl Physiol 109: 429–435
388. Macaluso A, De Vito G. (2004). Muscle strength, power and adaptations to resistance training in older people. Eur J Appl Physiol 91: 450–472
389. Macaluso A, De Vito G, Felici F, Nimmo MA. (2000). Electromyogram changes during sustained contraction after resistance training in women in their 3rd and 8th decades. Eur J Appl Physiol 82: 418–424
390. Macaluso A, Nimmo MA, Foster JE, Cockburn M, McMillan NC, De Vito G. (2002). Contractile muscle volume and agonist-antagonist coactivation account for differences in torque between young and older women. Muscle Nerve 25: 858–863
391. Maganaris CN, Narici MV, Reeves ND. (2004). In vivo human tendon mechanical properties: Effect of resistance training in old age. J Musculoskelet Neuronal Interact 4: 204–208
392. Magni NE, McNair PJ, Rice DA. (2017). The effects of resistance training on muscle strength, joint pain, and hand function in individuals with hand osteoarthritis: A systematic review and meta-analysis. Arthritis Res Ther 19: 131
393. Makizako H, Doi T, Shimada H, et al. (2012). Does a multicomponent exercise program improve dual-task performance in amnestic mild cognitive impairment? A randomized controlled trial. Aging Clin Exp Res 24: 640–646
394. Manini T, Marko M, VanArnam T, et al. (2007). Efficacy of resistance and task-specific exercise in older adults who modify tasks of everyday life. J Gerontol A Biol Sci Med Sci 62: 616–623
395. Manini TM, Clark BC. (2012). Dynapenia and aging: An update. J Gerontol A Biol Sci Med Sci 67: 28–40
396. Manini TM, Clark BC, Nalls MA, Goodpaster BH, Ploutz-Snyder LL, Harris TB. (2007). Reduced physical activity increases intermuscular adipose tissue in healthy young adults. Am J Clin Nutr 85: 377–384
397. Marques EA, Mota J, Carvalho J. (2012). Exercise effects on bone mineral density in older adults: A meta-analysis of randomized controlled trials. Age (Dordr) 34: 1493–1515
398. Marsh AP, Miller ME, Rejeski WJ, Hutton SL, Kritchevsky SB. (2009). Lower extremity muscle function after strength or power training in older adults. J Aging Phys Act 17: 416–443
399. Martel GF, Roth SM, Ivey FM, et al. (2006). Age and sex affect human muscle fibre adaptations to heavy-resistance strength training. Exp Physiol 91: 457–464
400. Martinez-Velilla N, Casas-Herrero A, Zambom-Ferraresi F, et al. (2018). Effect of exercise intervention on functional decline in very elderly patients during acute hospitalization: A randomized clinical trial. JAMA Intern Med 2018. Epub ahead of print.
401. Matheny RW Jr, Nindl BC, Adamo ML. (2010). Minireview: Mechano-growth factor: A putative product of IGF-I gene expression involved in tissue repair and regeneration. Endocrinology 151: 865–875
402. Matthews CE, Chen KY, Freedson PS, et al. (2008). Amount of time spent in sedentary behaviors in the United States, 2003–2004. Am J Epidemiol 167: 875–881
403. Mavros Y, Gates N, Wilson GC, et al. (2017). Mediation of cognitive function improvements by strength gains after resistance training in older adults with mild cognitive impairment: Outcomes of the study of mental and resistance training. J Am Geriatr Soc 65: 550–559
404. McCartney N. (1999). Acute responses to resistance training and safety. Med Sci Sports Exerc 31: 31–37
405. McCartney N, McKelvie RS, Martin J, Sale DG, MacDougall JD. (1993). Weight-training-induced attenuation of the circulatory response of older males to weight lifting. J Appl Physiol (1985) 74: 1056–1060
406. McGrath RP, Kraemer WJ, Vincent BM, Hall OT, Peterson MD. (2017). Muscle strength is protective against osteoporosis in an ethnically diverse sample of adults. J Strength Cond Res 31: 2586–2589
407. McGrath RP, Ottenbacher KJ, Vincent BM, Kraemer WJ, Peterson MD. (2017). Muscle weakness and functional limitations in an ethnically diverse sample of older adults. Ethn Health 26: 1–12
408. McLafferty CL Jr, Wetzstein CJ, Hunter GR. (2004). Resistance training is associated with improved mood in healthy older adults. Percept Mot Skills 98: 947–957
409. McLean RR, Shardell MD, Alley DE, et al. (2014). Criteria for clinically relevant weakness and low lean mass and their longitudinal association with incident mobility impairment and mortality: The foundation for the National Institutes of Health (FNIH) sarcopenia project. J Gerontol A Biol Sci Med Sci 69: 576–583
410. McMurdo ME, Johnstone R. (1995). A randomized controlled trial of a home exercise programme for elderly people with poor mobility. Age Ageing 24: 425–428
411. McMurdo ME, Rennie LM. (1994). Improvements in quadriceps strength with regular seated exercise in the institutionalized elderly. Arch Phys Med Rehabil 75: 600–603
412. McNeil CJ, Vandervoort AA, Rice CL. (2007). Peripheral impairments cause a progressive age-related loss of strength and velocity-dependent power in the dorsiflexors. J Appl Physiol (1985) 102: 1962–1968
413. Melton LJ III, Khosla S, Crowson CS, O´Connor MK, O´Fallon WM, Riggs BL. (2000). Epidemiology of sarcopenia. J Am Geriatr Soc 48: 625–630
414. Metter EJ, Conwit R, Tobin J, Fozard JL. (1997). Age-associated loss of power and strength in the upper extremities in women and men. J Gerontol A Biol Sci Med Sci 52: B267–B276
415. Meuleman JR, Brechue WF, Kubilis PS, Lowenthal DT. (2000). Exercise training in the debilitated aged: Strength and functional outcomes. Arch Phys Med Rehabil 81: 312–318
416. Miszko TA, Cress ME, Slade JM, et al. (2003). Effect of strength and power training on physical function in community-dwelling older adults. J Gerontol A Biol Sci Med Sci 58: 171–175
417. Mitch WE. (2007). Malnutrition is an unusual cause of decreased muscle mass in chronic kidney disease. J Ren Nutr 17: 66–69
418. Mitchell JH, Payne FC, Saltin B, Schibye B. (1980). The role of muscle mass in the cardiovascular response to static contractions. J Physiol 309: 45–54
419. Moinuddin I, Leehey DJ. (2008). A comparison of aerobic exercise and resistance training in patients with and without chronic kidney disease. Adv Chronic Kidney Dis 15: 83–96
420. Montero-Odasso M, Muir SW, Speechley M. (2012). Dual-task complexity affects gait in people with mild cognitive impairment: The interplay between gait variability, dual tasking, and risk of falls. Arch Phys Med Rehabil 93: 293–299
421. Moore AZ, Caturegli G, Metter EJ, et al. (2014). Difference in muscle quality over the adult life span and biological correlates in the Baltimore Longitudinal Study of Aging. J Am Geriatr Soc 62: 230–236
422. Moraes-Silva IC, Mostarda CT, Silva-Filho AC, Irigoyen MC. (2017). Hypertension and exercise training: Evidence from clinical studies. Adv Exp Med Biol 1000: 65–84
423. Moreau NG, Li L, Geaghan JP, Damiano DL. (2008). Fatigue resistance during a voluntary performance task is associated with lower levels of mobility in cerebral palsy. Arch Phys Med Rehabil 89: 2011–2016
424. Morie M, Reid KF, Miciek R, et al. (2010). Habitual physical activity levels are associated with performance in measures of physical function and mobility in older men. J Am Geriatr Soc 58: 1727–1733
425. Moritani T, deVries HA. (1980). Potential for gross muscle hypertrophy in older men. J Gerontol 35: 672–682
426. Morse CI, Thom JM, Davis MG, et al. (2004). Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. Eur J Appl Physiol 92: 219–226
427. Morse CI, Thom JM, Mian OS, Birch KM, Narici MV. (200). Gastrocnemius specific force is increased in elderly males following a 12-month physical training programme. Eur J Appl Physiol 100: 563–570
428. Morse CI, Thom JM, Mian OS, et al. (2005). Muscle strength, volume and activation following 12-month resistance training in 70-year-old males. Eur J Appl Physiol 95: 197–204
429. Morse CI, Thom JM, Reeves ND, Birch KM, Narici MV. (2005). In vivo physiological cross-sectional area and specific force are reduced in the gastrocnemius of elderly men. J Appl Physiol (1985) 99: 1050–1055
430. Morton RW, Sato K, Gallaugher MPB, et al. (2018). Muscle androgen receptor content but not systemic hormones is associated with resistance training-induced skeletal muscle hypertrophy in healthy, young men. Front Physiol 9: 1373
431. Motl RW, McAuley E. (2010). Physical activity, disability, and quality of life in older adults. Phys Med Rehabil Clin N Am 21: 299–308
432. Mozaffarian D, Benjamin EJ, Go AS, et al. (2015). Heart disease and stroke statistics-2015 update a report from the American heart association. Circulation 131: E29–E322
433. Muhlberg W, Sieber C. (2004). Sarcopenia and frailty in geriatric patients: Implications for training and prevention. Z Gerontol Geriatr 37: 2–8
434. Nader GA. (2006). Concurrent strength and endurance training: From molecules to man. Med Sci Sports Exerc 38: 1965–1970
435. Nakamura Y, Tanaka K, Yabushita N, Sakai T, Shigematsu R. (2007). Effects of exercise frequency on functional fitness in older adult women. Arch Gerontol Geriatr 44: 163–173
436. Narici MV, Maganaris CN, Reeves ND, Capodaglio P. (2003). Effect of aging on human muscle architecture. J Appl Physiol (1985) 95: 2229–2234
437. Narici MV, Reeves ND, Morse CI, Maganaris CN. (2004). Muscular adaptations to resistance exercise in the elderly. J Musculoskelet Neuronal Interact 4: 161–164
438. Nelson ME, Fiatarone MA, Morganti CM, et al. (1994). Effects of high-intensity strength training on multiple risk factors for osteoporotic fractures. A randomized controlled trial. JAMA 272: 1909–1914
439. Nelson RM, Soderberg GL, Urbscheit NL. (1984). Alteration of motor-unit discharge characteristics in aged humans. Phys Ther 64: 29–34
440. Neves SdaC Jr, Lima RM, Simoes HG, et al. (2009). Resistance exercise sessions do not provoke acute immunosuppression in older women. J Strength Cond Res 23: 259–265
441. Newton RU, Häkkinen K, Häkkinen A, McCormick M, Volek J, Kraemer WJ. (2002). Mixed-methods resistance training increases power and strength of young and older men. Med Sci Sports Exerc 34: 1367–1375
442. Nguyen C, Lefevre-Colau MM, Poiraudeau S, Rannou F. (2016). Rehabilitation (exercise and strength training) and osteoarthritis: A critical narrative review. Ann Phys Rehabil Med 59: 190–195
443. Nicklas BJ, Brinkley TE. (2009). Exercise training as a treatment for chronic inflammation in the elderly. Exerc Sport Sci Rev 37: 165–170
444. National Institute of Diabetes and Digestive and Kidney Diseases. (2016). Kidney Disease Statistics for the United States. Atlanta, GA: Centers for Disease Control and Prevention
445. Nielson CM, Srikanth P, Orwoll ES. (2012). Obesity and fracture in men and women: An epidemiologic perspective. J Bone Miner Res 27: 1–10
446. Nindl BC. (2010). Insulin-like growth factor-I, physical activity, and control of cellular anabolism. Med Sci Sports Exerc 42: 35–38
447. Nindl BC, Kraemer WJ, Marx JO, Tuckow AP, Hymer WC. (2003). Growth hormone molecular heterogeneity and exercise. Exerc Sport Sci Rev 31: 161–166
448. Nindl BC, Pierce JR. (2010). Insulin-like growth factor I as a biomarker of health, fitness, and training status. Med Sci Sports Exerc 42: 39–49
449. NSCA. (2008). Essentials of Strength Training and Conditioning. Hum Kinetics, 2016. pp. 462.
450. O´Connor KG, Tobin JD, Harman SM, et al. (1998). Serum levels of insulin-like growth factor-I are related to age and not to body composition in healthy women and men. J Gerontol A Biol Sci Med Sci 53: M176–M182
451. Palmer TB, Thiele RM, Conchola EC, Smith DB, Thompson BJ. (2016). A preliminary study of the utilization of maximal and rapid strength characteristics to identify chair-rise performance abilities in very old adults. J Geriatr Phys Ther 39: 102–109
452. Palmer TB, Thiele RM, Thompson BJ. (2017). Age-related differences in maximal and rapid torque characteristics of the hip extensors and dynamic postural balance in healthy, young and old females. J Strength Cond Res 31: 480–488
453. Palmer TB, Thiele RM, Williams KB, et al. (2015). The identification of fall history using maximal and rapid isometric torque characteristics of the hip extensors in healthy, recreationally active elderly females: A preliminary investigation. Aging Clin Exp Res 27: 431–438
454. Panton LB, Franke WD, Bleil DA, Baier SM, King DS. (2001). Effects of resistance training on cardiovascular responses to lower body negative pressure in the elderly. Clin Physiol 21: 605–611
455. Papa EV, Dong X, Hassan M. (2017). Resistance training for activity limitations in older adults with skeletal muscle function deficits: A systematic review. Clin Interv Aging 12: 955–961
456. Papa EV, Dong X, Hassan M. (2017). Skeletal muscle function deficits in the elderly: Current perspectives on resistance training. J Nat Sci 3: pii: e272
457. Park J, Mendy A, Vieira ER. (2018). Various types of arthritis in the United States: Prevalence and age-related trends from 1999 to 2014. Am J Public Health 108: 256–258
458. Pasco JA, Gould H, Brennan SL, Nicholson GC, Kotowicz MA. (2014). Musculoskeletal deterioration in men accompanies increases in body fat. Obesity (Silver Spring) 22: 863–867
459. Pearson SJ, Young A, Macaluso A, et al. (2002). Muscle function in elite master weightlifters. Med Sci Sports Exerc 34: 1199–1206
460. Penninx BW, Kritchevsky SB, Newman AB, et al. (2004). Inflammatory markers and incident mobility limitation in the elderly. J Am Geriatr Soc 52: 1105–1113
461. Penninx BW, Messier SP, Rejeski WJ, et al. (2001). Physical exercise and the prevention of disability in activities of daily living in older persons with osteoarthritis. Arch Intern Med 161: 2309–2316
462. Peterson M, Duchowny K, Meng Q, et al. (2017). Low normalized grip strength is a biomarker for cardiometabolic disease and physical disabilities among U. S. and Chinese adults. J Gerontol A Biol Sci Med Sci 72: 1525–1531
463. Peterson MD, Belakovskiy A, McGrath R, Yarrow JF. (2018). Testosterone deficiency, weakness, and multimorbidity in men. Sci Rep 8: 5897
464. Peterson MD, Mahmoudi E. (2015). Healthcare utilization associated with obesity and physical disabilities. Am J Prev Med 48: 426–435
465. Peterson MD, Rhea MR, Sen A, Gordon PM. (2010). Resistance exercise for muscular strength in older adults: A meta-analysis. Ageing Res Rev 9: 226–237
466. Peterson MD, Ryan JM, Hurvitz EA, Mahmoudi E. (2015). Chronic conditions in adults with cerebral palsy. JAMA 314: 2303–2305
467. Peterson MD, Saltarelli WA, Visich PS, Gordon PM. (2014). Strength capacity and cardiometabolic risk clustering in adolescents. Pediatrics 133: e896–903
468. Peterson MD, Sen A, Gordon PM. (2011). Influence of resistance exercise on lean body mass in aging adults: A meta-analysis. Med Sci Sports Exerc 43: 249–258
469. Peterson MD, Zhang P, Choksi P, Markides KS, Al Snih S. (2016). Muscle weakness thresholds for prediction of diabetes in adults. Sports Med 46: 619–628
470. Peterson MD, Zhang P, Duchowny KA, et al. (2016). Declines in strength and mortality risk among older Mexican Americans: Joint modeling of survival and longitudinal data. J Gerontol A Biol Sci Med Sci 71: 1646–1652
471. Peterson MD, Zhang P, Haapala HJ, Wang SC, Hurvitz EA. (2015). Greater adipose tissue distribution and diminished spinal musculoskeletal density in adults with cerebral palsy. Arch Phys Med Rehab 96: 1828–1833
472. Petrella JK, Kim JS, Cross JM, Kosek DJ, Bamman MM. (2006). Efficacy of myonuclear addition may explain differential myofiber growth among resistance-trained young and older men and women. Am J Physiol Endocrinol Metab 291: E937–E946
473. Phillips SK, Bruce SA, Newton D, Woledge RC. (1992). The weakness of old age is not due to failure of muscle activation. J Gerontol 47: M45–M49
474. Phillips SM. (2007). Resistance exercise: Good for more than just grandma and grandpa´s muscles. Appl Physiol Nutr Metab 32: 1198–1205
475. Piepoli MF, Conraads V, Corra U, et al. (2011). Exercise training in heart failure: From theory to practice. A consensus document of the heart failure association and the European association for cardiovascular prevention and rehabilitation. Eur J Heart Fail 13: 347–357
476. Pina IL, Apstein CS, Balady GJ, et al. (2003). Exercise and heart failure: A statement from the American heart association Committee on exercise, rehabilitation, and prevention. Circulation 107: 1210–1225
477. Pinto RS, Correa CS, Radaelli R, et al. (2014). Short-term strength training improves muscle quality and functional capacity of elderlywomen. Age (Dordr) 36: 365–372
478. Pitkala K, Savikko N, Poysti M, Strandberg T, Laakkonen ML. (2013). Efficacy of physical exercise intervention on mobility and physical functioning in older people with dementia: A systematic review. Exp Gerontol 48: 85–93
479. Plassman BL, Langa KM, Fisher GG, et al. (2007). Prevalence of dementia in the United States: The aging, demographics, and memory study. Neuroepidemiology 29: 125–132
480. Pollock ML, Franklin BA, Balady GJ, et al. (2007). AHA Science Advisory. Resistance exercise in individuals with and without cardiovascular disease: benefits, rationale, safety, and prescription: An advisory from the Committee on Exercise, Rehabilitation, and Prevention, Council on Clinical Cardiology, American Heart Association; Position paper endorsed by the American C
481. Price SR, Gooch JL, Donaldson SK, Roberts-Wilson TK. (2010). Muscle atrophy in chronic kidney disease results from abnormalities in insulin signaling. J Ren Nutr 20(5 Suppl): S24–S28
482. Pu CT, Johnson MT, Forman DE, et al. (2001). Randomized trial of progressive resistance training to counteract the myopathy of chronic heart failure. J Appl Physiol (1985) 90: 2341–2350
483. Pyka G, Lindenberger E, Charette S, Marcus R. (1994). Muscle strength and fiber adaptations to a year-long resistance training program in elderly men and women. J Gerontol 49: M22–M27
484. Pyka G, Taaffe DR, Marcus R. (1994). Effect of a sustained program of resistance training on the acute growth hormone response to resistance exercise in older adults. Horm Metab Res 26: 330–333
485. Qureshi AR, Alvestrand A, Danielsson A, et al. (1998). Factors predicting malnutrition in hemodialysis patients: A cross-sectional study. Kidney Int 53: 773–782
486. Radaelli R, Botton CE, Wilhelm EN, et al. (2014). Time course of low- and high-volume strength training on neuromuscular adaptations and muscle quality in older women. Age (Dordr) 36: 881–892
487. Radaelli R, Brusco CM, Lopez P, et al. (2018). Higher muscle power training volume is not determinant for the magnitude of neuromuscular improvements in elderly women. Exp Gerontol 110: 15–22
488. Ramirez-Campillo R, Castillo A, de la Fuente CI, et al. (2014). High-speed resistance training is more effective than low-speed resistance training to increase functional capacity and muscle performance in older women. Exp Gerontol 58: 51–57
489. Ramsbottom R, Ambler A, Potter J, Jordan B, Nevill A, Williams C. (2004). The effect of 6 months training on leg power, balance, and functional mobility of independently living adults over 70 years old. J Aging Phys Act 12: 497–510
490. Rantanen T, Guralnik JM, Ferrucci L, Leveille S, Fried LP. (1999). Coimpairments: Strength and balance as predictors of severe walking disability. J Gerontol A Biol Sci Med Sci 54: M172–M176
491. Raso V, Benard G, DA Silva Duarte AJ, Natale VM. (2007). Effect of resistance training on immunological parameters of healthy elderly women. Med Sci Sports Exerc 39: 2152–2159
492. Raue U, Slivka D, Minchev K, Trappe S. (2009). Improvements in whole muscle and myocellular function are limited with high-intensity resistance training in octogenarian women. J Appl Physiol (1985) 106: 1611–1617
493. Raymond MJ, Bramley-Tzerefos RE, Jeffs KJ, Winter A, Holland AE. (2013). Systematic review of high-intensity progressive resistance strength training of the lower limb compared with other intensities of strength training in older adults. Arch Phys Med Rehabil 94: 1458–1472
494. Reed RL, Pearlmutter L, Yochum K, Meredith KE, Mooradian AD. (1991). The relationship between muscle mass and muscle strength in the elderly. J Am Geriatr Soc 39: 555–561
495. Reed T, Fabsitz RR, Selby JV, Carmelli D. (1991). Genetic influences and grip strength norms in the NHLBI twin study males aged 59–69. Ann Hum Biol 18: 425–432
496. Reeves ND, Narici MV, Maganaris CN. (2004). Effect of resistance training on skeletal muscle-specific force in elderly humans. J Appl Physiol (1985) 96: 885–892
497. Reeves ND, Narici MV, Maganaris CN. (2004). In vivo human muscle structure and function: Adaptations to resistance training in old age. Exp Physiol 89: 675–689
498. Reeves ND, Narici MV, Maganaris CN. (2006). Musculoskeletal adaptations to resistance training in old age. Man Ther 11: 192–196
499. Reid KF, Callahan DM, Carabello RJ, et al. (2008). Lower extremity power training in elderly subjects with mobility limitations: A randomized controlled trial. Aging Clin Exp Res 20: 337–343
500. Reid KF, Fielding RA. (2012). Skeletal muscle power: A critical determinant of physical functioning in older adults. Exerc Sport Sci Rev 40: 4–12
501. Reid KF, Martin KI, Doros G, et al. (2015). Comparative effects of light or heavy resistance power training for improving lower extremity power and physical performance in mobility-limited older adults. J Gerontol A Biol Sci Med Sci 70: 374–380
502. Reynolds TH IV, Supiano MA, Dengel DR. (2007). Regional differences in glucose clearance: Effects of insulin and resistance training on arm and leg glucose clearance in older hypertensive individuals. J Appl Physiol (1985) 102: 985–991
503. Rhodes EC, Martin AD, Taunton JE, et al. (2000). Effects of one year of resistance training on the relation between muscular strength and bone density in elderly women. Br J Sports Med 34: 18–22
504. Ribeiro AS, Schoenfeld BJ, Fleck SJ, et al. (2017). Effects of traditional and pyramidal resistance training systems on muscular strength, muscle mass, and hormonal responses in older women: A randomized crossover trial. J Strength Cond Res 31: 1888–1896
505. Ribeiro F, Costa R, Mesquita-Bastos J. (2015). Exercise training in the management of patients with resistant hypertension. World J Cardiol 7: 47–51
506. Riebe D, Franklin BA, Thompson PD, et al. (2015). Updating ACSM´s recommendations for exercise preparticipation health screening. Med Sci Sports Exerc 47: 2473–2479
507. Robergs RA, Ghiasvand F, Parker D. (2004). Biochemistry of exercise-induced metabolic acidosis. Am J Physiol Regul Integr Comp Physiol 287: R502–R516
508. Rockwood K, Mitnitski A. (2007). Frailty in relation to the accumulation of deficits. J Gerontol A Biol Sci Med Sci 62: 722–727
509. Rodriguez-Manas L, Fried LP. (2015). Frailty in the clinical scenario. Lancet 385: e7–e9
510. Roman WJ, Fleckenstein J, Stray-Gundersen J, et al. (1993). Adaptations in the elbow flexors of elderly males after heavy-resistance training. J Appl Physiol (1985) 74: 750–754
511. Rooyackers OE, Adey DB, Ades PA, Nair KS. (1996). Effect of age on in vivo rates of mitochondrial protein synthesis in human skeletal muscle. Proc Natl Acad Sci U S A 93: 15364–15369
512. Rose J, McGill KC. (2005). Neuromuscular activation and motor-unit firing characteristics in cerebral palsy. Dev Med Child Neurol 47: 329–336
513. Rose SJ, Rothstein JM. (1982). Muscle mutability. Part 1. General concepts and adaptations to altered patterns of use. Phys Ther 62: 1773–1787,
514. Rosendahl E, Lindelöf N, Littbrand H, et al. (2006). High-intensity functional exercise program and protein-enriched energy supplement for older persons dependent in activities of daily living: A randomised controlled trial. Aust J Physiother 52: 105–113
515. Rossi A, Zoico E, Goodpaster BH, et al. (2010). Quantification of intermuscular adipose tissue in the Erector spinae muscle by MRI: Agreement with histological evaluation. Obesity (Silver Spring) 18: 2379–2384
516. Roth SM, Ivey FM, Martel GF, et al. (2001). Muscle size responses to strength training in young and older men and women. J Am Geriatr Soc 49: 1428–1433
517. Rothstein JM, Rose SJ. (1982). Muscle mutability. Part 2. Adaptation to drugs, metabolic factors, and aging. Phys Ther 62: 1788–1798,
518. Roubenoff R. (2000). Sarcopenia: A major modifiable cause of frailty in the elderly. J Nutr Health Aging 4: 140–142
519. Roubenoff R, Hughes VA. (2000). Sarcopenia: Current concepts. J Gerontol A Biol Sci Med Sci 55: M716–M724
520. Rubin MR, Kraemer WJ, Kraemer RR, et al. (2003). Responses of growth hormone aggregates to different intermittent exerciseintensities. Eur J Appl Physiol 89: 166–170
521. Ruiz J, Sui X, Lobelo F, et al. (2008). Association between muscular strength and mortality in men: Prospective cohort study. BMJ 337: a439
522. Ryu M, Jo J, Lee Y, Chung YS, Kim KM, Baek WC. (2013). Association of physical activity with sarcopenia and sarcopenic obesity in community-dwelling older adults: The fourth korea National health and nutrition examination survey. Age and Ageing 42: 734–740
523. Sambrook P, Cooper C. (2006). Osteoporos. Lancet 367: 2010–2018
524. Sanchez-Medina L, Gonzalez-Badillo JJ. (2011). Velocity loss as an indicator of neuromuscular fatigue during resistance training. Med Sci Sports Exerc 43: 1725–1734
525. Sardeli AV, Tomeleri CM, Cyrino ES, et al. (2018). Effect of resistance training on inflammatory markers of older adults: A meta-analysis. Exp Gerontol 111: 188–196
526. Sayer AA, Kirkwood TB. (2015). Grip strength and mortality: A biomarker of ageing? Lancet 386: 226–227.
527. Sayers SP. (2008). High velocity power training in older adults. Curr Aging Sci 1: 62–67
528. Sayers SP, Gibson K. (2010). A comparison of high-speed power training and traditional slow-speed resistance training in older men and women. J Strength Cond Res 24: 3369–3380
529. Scaglioni G, Ferri A, Minetti AE, et al. (2002). Plantar flexor activation capacity and H reflex in older adults: Adaptations to strength training. J Appl Physiol (1985) 92: 2292–2302
530. Scher LM, Ferriolli E, Moriguti JC, Scher R, Lima NK. (2011). The effect of different volumes of acute resistance exercise on elderlyindividuals with treated hypertension. J Strength Cond Res 25: 1016–1023
531. Schoenfeld BJ. (2013). Postexercise hypertrophic adaptations: A reexamination of the hormone hypothesis and its applicability to resistance training program design. J Strength Cond Res 27: 1720–1730
532. Schrager MA, Metter EJ, Simonsick E, et al. (2007). Sarcopenic obesity and inflammation in the InCHIANTI study. J Appl Physiol (1985) 102: 919–925
533. Seguin R, Nelson ME. (2003). The benefits of strength training for older adults. Am J Prev Med 25(3 Suppl 2): 141–149
534. Seidler RD, Bernard JA, Burutolu TB, et al. (2010). Motor control and aging: Links to age-related brain structural, functional, and biochemical effects. Neurosci Biobehav Rev 34: 721–733
535. Senechal M, McGavock JM, Church TS, et al. (2014). Cut points of muscle strength associated with metabolic syndrome in men. Med Sci Sports Exerc 46: 1475–1481
536. Serra-Rexach JA, Bustamante-Ara N, Hierro Villaran M, et al. (2011). Short-term, light- to moderate-intensity exercise training improves leg muscle strength in the oldest old: A randomized controlled trial. J Am Geriatr Soc 59: 594–602
537. Seynnes O, Fiatarone Singh MA, Hue O, et al. (2004). Physiological and functional responses to low-moderate versus high-intensity progressive resistance training in frail elders. J Gerontol A Biol Sci Med Sci 59: 503–509
538. Shafiee G, Keshtkar A, Soltani A, et al. (2017). Prevalence of sarcopenia in the world: A systematic review and meta- analysis of general population studies. J Diabetes Metab Disord 16: 21
539. Shah K, Armamento-Villareal R, Parimi N, et al. (2011). Exercise training in obese older adults prevents increase in bone turnover and attenuates decrease in hip bone mineral density induced by weight loss despite decline in bone-active hormones. J Bone Miner Res 26: 2851–2859
540. Sharman MJ, Newton RU, Triplett-McBride T, et al. (2001). Changes in myosin heavy chain composition with heavy resistance training in 60- to 75-year-old men and women. Eur J Appl Physiol 84: 127–132
541. Shaw BS, Shaw I. (2005). Effect of resistance training on cardiorespiratory endurance and coronary artery disease risk. Cardiovasc J S Afr 16: 256–259
542. Shaw BS, Shaw I, Brown GA. (2015). Resistance exercise is medicine: Strength training in health promotion and rehabilitation. Int J Ther Rehabil 22: 385–389
543. Shaw CS, Clark J, Wagenmakers AJ. (2010). The effect of exercise and nutrition on intramuscular fat metabolism and insulin sensitivity. Annu Rev Nutr 30: 13–34
544. Sheridan KJ. (2009). Osteoporosis in adults with cerebral palsy. Dev Med Child Neurol 51(Suppl 4): 38–51
545. Sherrington C, Michaleff ZA, Fairhall N, et al. (2017). Exercise to prevent falls in older adults: An updated systematic review and meta-analysis. Br J Sports Med 51: 1750–1758
546. Sherrington C, Whitney JC, Lord SR, et al. (2008). Effective exercise for the prevention of falls: A systematic review and meta-analysis. J Am Geriatr Soc 56: 2234–2243
547. Shinohara M. (2011). Adaptations in motor unit behavior in elderly adults. Curr Aging Sci 4: 200–208
548. Shiroma EJ, Cook NR, Manson JE, et al. (2017). Strength training and the risk of type 2 diabetes and cardiovascular disease. Med Sci Sports Exerc 49: 40–46
549. Short KR, Nair KS. (1999). Mechanisms of sarcopenia of aging. J Endocrinol Invest 22(5 Suppl): 95–105
550. Shortland A. (2009). Muscle deficits in cerebral palsy and early loss of mobility: Can we learn something from our elders? Dev Med Child Neurol 51(Suppl 4): 59–63.
551. Sillanpaa E, Häkkinen A, Nyman K, et al. (2008). Body composition and fitness during strength and/or endurance training in older men. Med Sci Sports Exerc 40: 950–958
552. Silva NL, Oliveira RB, Fleck SJ, Leon AC, Farinatti P. (2014). Influence of strength training variables on strength gains in adults over 55 years-old: A meta-analysis of dose-response relationships. J Sci Med Sport 17: 337–344
553. Silva RB, Eslick GD, Duque G. (2013). Exercise for falls and fracture prevention in long term care facilities: A systematic review and meta-analysis. J Am Med Dir Assoc 14: 685–689.e2
554. Simao R, de Salles BF, Figueiredo T, Dias I, Willardson JM. (2012). Exercise order in resistance training. Sports Med 42: 251–265
555. Singh MA. (2002). Exercise comes of age: Rationale and recommendations for a geriatric exercise prescription. J Gerontol A Biol Sci Med Sci 57: M262–M282