Expresión de los Genes Activador Tisular de Plasminógeno e Inhibidor del Activador de Plasminógeno I, en el Músculo luego de un Ejercicio Aeróbico Agudo de Intensidad Máxima
Christopher J Womack, Richard L Carpenter, Jeffrey T Lemmer, Ryan M Francis, Jeremy L Knous y Mark A Sarzynski
Department of Kinesiology, Michigan State University, East Lansing, MI, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2010.
Publicado 7 de marzo de 2011
Resumen
Palabras clave: microarreglos, regeneración muscular, zimografía, coagulación, fibrinólisis
INTRODUCCION
Aunque el ejercicio es una parte importante de la prevención de las enfermedades cardiovasculares, aumenta temporalmente el potencial de coagulación de la sangre (28) y el riesgo de eventos cardiovasculares (21). La fibrinólisis es la disgregación de redes de fibrina asociada con los coágulos sanguíneos y contrarresta la coagulación. La respuesta fibrinolítica frente al ejercicio es fundamental para mantener bajo, el riesgo de eventos cardiovasculares tales como el infarto de miocardio y el accidente cerebro vascular, que generalmente son provocados por coágulos oclusivos (8, 17). La fibrinólisis es iniciada por el activador tisular de plasminógeno (tPA) o activador del plasminógeno tipo uroquinasa (uPA; principal activador en ratones), que convierte el plasminógeno a plasmita, una proteasa activa que degrada las redes de fibrina. El tPA es inhibido por el inhibidor del activador del plasminógeno 1 (PAI-1) lo que asegura una precisa regulación de la fibrinólisis. Diferentes estudios han observado aumentos en la actividad de tPA y disminuciones en la actividad de PAI-1 en el plasma, con el ejercicio de máxima intensidad (3, 14, 24, 26, 28, 29), lo que sugiere que la actividad fibrinolítica aumenta con ejercicio agudo, lo que posiblemente brinda protección frente a los trombos oclusivos.
Se ha demostrado en modelos con animales, que la activación del plasminógeno se produce de manera localizada dentro del músculo esquelético luego de una lesión, y que esta activación desempeña un papel en la regeneración del músculo (23). Más específicamente, plasminógeno, tPA/uPA y PAI-1 aumentan inicialmente la expresión en el músculo esquelético luego de una lesión en animales (22). Además, la inactivación del sistema del plasminógeno en los modelos con ratones knockout produce un defecto severo en la regeneración muscular luego de una lesión muscular inducida químicamente (15, 22). Adicionalmente, los ratones deficientes en PAI-1 presentan una mayor recuperación en la fuerza, en los niveles de proteínas y en la morfología muscular, luego de una lesión (11). Estos resultados sugieren que la activación local del plasminógeno en el músculo esquelético es importante para la recuperación del daño muscular provocado por ejercicios o lesiones. Un estudio reciente observó la expresión de tPA y PAI-1 en el músculo esquelético en varones con síndrome metabólico después de entrenamiento aeróbico (9). Los factores de coagulación también pueden estar involucrados dado que ciertos factores de coagulación (Factor Xa y Va) pueden acelerar la activación del plasminógeno inducida por tPA (19). Sin embargo, las respuestas fibrinolíticas y de los factores de coagulación en el músculo esquelético humano, que se producen luego de ejercicio que daña los músculos, no han sido evaluadas. El conocimiento de los mecanismos de reparación y regeneración muscular luego de las lesiones musculares, como por ej. del ejercicio de alta intensidad, podría ser clínicamente útil para atletas o pacientes que estén realizando ejercicios de rehabilitación.
La expresión de tPA se ha observado en el útero, cerebro y corazón pero tradicionalmente se cree que los niveles plasmáticos son producidos por las células del endotelio vascular (10, 25). Como mencionamos antes, la expresión de tPA y PAI-1 se ha observado en el músculo esquelético de seres humanos (9) y animales (15, 22). Los aumentos en la activación del plasminógeno en el músculo de los animales luego de las lesiones, junto con el hallazgo de expresión local de activadores de plasminógeno en el músculo esquelético podrían sugerir que el músculo contribuye con el gran aumento observado con el ejercicio en tPA (3, 14, 24, 26, 28, 29). Esta sugerencia es atractiva ya que el músculo esquelético aporta un tejido muy abundante para la liberación de tPA. Sin embargo, no se ha estudiado con detalle el aporte de tPA y PAI-1 muscular a los niveles plasmáticos.
Por consiguiente, los propósitos de este estudio fueron: 1) evaluar los cambios en la expresión génica de los factores fibrinolíticos y de coagulación en el músculo esquelético 2) evaluar la actividad plasmática de tPA y PAI-1 en respuesta a una sesión aguda de ejercicio aeróbico máximo, 3) determinar si hay alguna relación entre la expresión génica muscular de tPA y PAI-1 y los niveles de actividad plasmática.
METODOS
Sujetos
Seis varones de edad universitaria, saludables participaron en este estudio. En la Tabla 1 se enumeran las características de los sujetos. Los sujetos no podían participar si habían tenido previamente enfermedades como diabetes o problemas cardiovasculares entre los que se incluyen desórdenes en la sangre e hipertensión. No se exigió a los sujetos que estuvieran entrenados y en la Tabla se presentan los valores medios de VO2max. Los antecedentes de salud y ejercicio se determinaron mediante un cuestionario. Todos los sujetos estaban de acuerdo en participar en el estudio y firmaron un consentimiento informado. Este estudio fue aceptado el Comité de Revisión Institucional de la Universidad Estatal de Michigan.
Procedimientos
Pruebas de Ejercicio
El test de intensidad máxima en cinta rodante comenzó con una velocidad de 2,5 millas por hora (4 km.h-1) y aumentaba 0,5 mph (0,8 km.h-1) por minuto, hasta alcanzar una velocidad máxima de 6,0 mph (9,6 km.h-1). Una vez que se alcanzó esta velocidad, la pendiente de la cinta rodante se incrementaba 3% por minuto de manera continua, hasta que los sujetos alcanzaran el agotamiento volitivo. Se controló la frecuencia cardíaca mediante el monitor de frecuencia cardíaca Polar (Electro Inc Polar., Lake Success, NY, EE.UU.) y el consumo de oxígeno fue medido continuamente mediante calorimetría indirecta (Sensor Medics 2900 Metabolic Cart, Yorba Linda, CA, EE.UU.). El mayor consumo de oxígeno alcanzado en un minuto durante el test fue definido como consumo de oxígeno máximo (VO2max). Para asegurar un esfuerzo máximo, los sujetos debían alcanzar dos de los tres siguientes criterios establecidos, (4): 1) alcanzar el 95% de la frecuencia cardíaca máxima para la edad, 2) tener una tasa de intercambio respiratorio mayor o igual a 1,15 y 3) presentar un plateau en el consumo de O2 (ΔO2 ≤ 150 mL O2.min-1) (2).
Recolección de las Muestras de Sangre y de Tejido Muscular
Las muestras de sangre y músculo fueron obtenidas luego de un ayuno de 12 horas. Las muestras fueron recolectadas entre 7 y 10 de la mañana para minimizar los efectos de la variación diurna en la fibrinólisis (1). Antes de la primera extracción de sangre, los sujetos se colocaron en una posición semi-reclinada durante 30 minutos para eliminar los efectos posturales en la fibrinólisis (27). Las muestras de 5 mL de sangre, fueron extraídas de la vena antecubital y colocadas en una solución de citrato acidificada. La sangre fue centrifugada para obtener el plasma libre de plaquetas y guardada a -80oC hasta el momento en que se realizaran las pruebas.
El sitio fijado para obtener biopsias musculares fue la línea media del cuadriceps en el vasto lateral. Las muestras de músculo fueron obtenidas usando una aguja de biopsia Bergstrom de 5 mm y se obtuvieron mediante succión (5). La muestra del músculo se colocó inmediatamente en un vidrio de reloj enfriado con hielo y se le extrajeron todos los rastros visibles de sangre, tejido adiposo y conjuntivo. Una porción de la muestra fue congelada inmediatamente en nitrógeno líquido, y la otra porción de la muestra fue mantenida en RNAlater (Ambion, Austin, TX, EE.UU.). Ambas muestras fueron mantenidas a -80ºC hasta el análisis.
Luego de la extracción inicial de las muestras, los sujetos realizaron el test de ejercicio con cinta, gasa estéril y una venda de presión elástica sobre la incisión de la biopsia. Inmediatamente después del ejercicio, los sujetos fueron ubicados en la camilla de examen en posición supina y se realizó nuevamente la extracción de sangre y la biopsia de tejido muscular en la misma incisión que la biopsia inicial. Todas las muestras de sangre y músculo fueron recolectadas dentro de los 4 minutos de haber finalizado la prueba de ejercicio.
Análisis de la expresión de tPA y PAI-1 en el músculo
Reacción en Cadena de la Polimerasa en Transcripción Reversa (RT-PCR)
Una porción del tejido de la biopsia muscular fue homogeneizada en reactivo Tri (Molecular Research Center, Inc., Cincinnati, OH, USA) en un homogeneizador politrón. El ARN total fue extraído y purificado con una columna RNeasy siguiendo las instrucciones del fabricante (RNeasy kit, Qiagen Inc., Chatsworth, CA, USA.). Posteriormente el ARN fue sometido a un tratamiento con DNasas (DNase Free, Ambion, Austin, TX, EE.UU). El ARN fue cuantificado espectrofotométricamente a 260:280 nm para determinar su concentración y pureza. El ARN total (0,5µg) fue sometido a transcripción reversa mediante el kit de reacción para la síntesis de la primera hebra SuperScriptTM III (Invitrogen, Carlsbad, CA, EE.UU.) siguiendo las instrucciones del fabricante. Cantidades iguales de ADNc fueron amplificadas por PCR utilizando cebadores (primers) específicos para los genes tPA y PAI-1 y un kit de reacción HotStarTaq Master Mix (Qiagen Inc., Chatsworth, CA, EE.UU). La secuencia nucleotídica de los cebadores (primers) utilizados fueron las siguientes: para tPA el cebador sentido (sense primer) fue 5-AGGAGCCAGATCTTACCAAGTGA-3 y el cebador antisentido (antisense primer) 5-CGCAGCCATGACTGATGTTG-3 para un tamaño del producto de 78 pb; mientras que para el gen PAI-1 (30) el cebador sentido fue 5-GTATCTCAGGAAGTCCAGCC-3 y el cebador antisentido 5-TCTAAGGTAGTTGAATCCGAGC-3 para un tamaño de producto de 396 pb. La PCR se realizó con una temperatura de inicial de apareamiento (annealing) de 76oC mientras que la desnaturalización se produjo a 94oC durante 45 segundos para las reacciones de tPA y PAI-1. Después del ciclo inicial de 76oC, en los siguientes cuatro ciclos se disminuyó la temperatura de apareamiento en 2oC hasta que se alcanzó una temperatura de apareamiento final de 66oC para tPA y PAI-1. La extensión se realizó a 72oC durante 1 minuto para tPA y PAI-1. La reacción de PCR se optimizó en 40 ciclos para PAI-1 y 34 ciclos para tPA. Estas condiciones de PCR con cebadores para tPA y PAI-1 fueron optimizadas en nuestro laboratorio y cada muestra fue procesada por duplicado. Luego el ADNc fue sembrado en un gel de agarosa al 2% y fue sometido a electroforesis durante 30 minutos a 120 V. Para analizar la intensidad de la banda se utilizó un procesador de imágenes KODAK 2000R con el software KODAK 1D (versión 4).
Expresión Génica en Microarreglos (microarray)
Una porción del ARN total mencionada previamente se utilizó para el análisis en microarreglos (microarray). Las muestras obtenidas antes del ejercicio (pre) de todos los sujetos fueron agrupadas en una muestra de modo que se utilizara una cantidad igual de ARN de cada sujeto; así se obtuvieron 5µg de ARN para la muestra pre-ejercicio (0,83µg ARN/sujeto, de un total de 6 sujetos) que fueron utilizados en el chip de microarreglo. Las muestras post ejercicio también fueron agrupadas con cantidades iguales de ARN de cada sujeto alcanzando un valor total de 5µg de ARN. A estas muestras de ARN agrupadas se les realizó un marcaje con biotina usando el sistema de marcaje BioArrayTM Single-Round RNA and Biotin Labeling System (Enzo, Life Sciences, Farmingdale, NY, EE.UU). Posteriormente el ARN pre- y post-ejercicio biotilinado, fue cuantificado para determinar su concentración y pureza. La calidad del ARN biotilinado fue analizada utilizando un bioanalizador Agilent 2100 y Agilent ARN 6000 Pico chip (Agilent technologies, Santa Clara, CA, EE.UU.) siguiendo las instrucciones del fabricante. La expresión genómica de ARN biotilinado para las muestras agrupadas pre- y post-ejercicio agrupadas fue cuantificada usando un kit comercial Affymetrix GeneChip U133 Plus 2.0 (Santa Clara, CA, EE.UU) siguiendo las instrucciones del fabricante. La fragmentación y el análisis fueron realizados por el laboratorio de Apoyo en Tecnología Genómica en la Universidad estatal de Michigan. Las proteínas de coagulación y fibrinolisis fueron seleccionadas a partir de la base de datos NetAffx en el sitio web de Affymetrix (http://www.affymetrix.com/analysis/index.affx). Los genes de la vía de la fibrinólisis evaluados fueron: tPA, uPA, plasminógeno, PAI-1 y fibrinógeno. Los genes de la vía de la coagulación evaluados fueron: factores de coagulación II, III, V, VII, VIII, IX, X, XI, XII, XIII, factor de Von Willebrand, proteína S y proteína C.
Análisis de la Actividad de tPA Muscular
A partir del homogenato de tejido muscular se realizó una extracción de proteínas totales utilizando TriReagent™ y las mismas fueron resuspendidas en SDS 0,1% según las instrucciones del fabricante. La concentración de proteínas fue determinada mediante el kit comercial DC Protein Assay Kit (Bio-RAD, Hercules, CA, USA). Cinco microgramos de proteínas fueron sembrados en un gel de poliacrilamida al 12%. Como control positivo se utilizó 0,1 ng de un estándar de tPA. Se realizaron varios estudios de optimización con el estándar de tPA y las muestras de tejido (datos no mostrados). La cantidad de proteína (5 µg) y las condiciones del gel que se utilizaron fueron las óptimas para ver las diferencias entre los controles positivos. Los geles fueron sometidos a electroforesis a 4oC durante 5 h a 180 V, a continuación se realizaron dos lavados de 30 minutos con 2,5% Tritón-X para reactivar el tPA. Entre los lavados, los geles fueron enjuagados brevemente con el agua destilada. Posteriormente fueron incubados durante 19 h a 37oC con un buffer de absorción de colagenasa (pH=7,5) para permitir que el tPA activo presente catalice la ruptura de plasminógeno co-polimerizado en el gel. Se preparó una solución madre de tinción de PhastGel Azul-R (Pharmacia, NY, NY, EE.UU.) 0,2% siguiendo el protocolo del fabricante. Se preparó una solución final de teñido/desteñido al 0,025% mezclando 26,5 mL de la solución de tinción madre con 184ml de solución de desteñido (1:3:6 acido acético glacial:metanol:agua destilada) (12). Cada gel fue sumergido en 200 mL de la solución final de teñido/desteñido y fue suavemente agitado durante 4 h. Para analizar la intensidad neta de las bandas y cuantificar la desintegración del plasminógeno en cada muestra, se utilizó un equipo KODAK 2000R y un software de procesamiento de imágenes KODAK 1D (versión 4).
Análisis del Plasma
Las actividades plasmáticas de tPA y PAI-1 fueron cuantificadas mediante un ensayo de inmunoabsorción biofuncional (Biopool International, Ventura, CA, EE.UU.) siguiendo las instrucciones de fabricante. La concentración plasmática del antígeno tPA fue determinada a través del ensayo de inmunoabsorción enzimática (American Diagnostica, Greenwich, CT, EE.UU) de acuerdo a las instrucciones de fabricante y no se efectuaron correcciones para los cambios en el volumen de plasma.
Análisis Estadísticos
Los cambios en la expresión génica pre-ejercicio vs post-ejercicio mediante microarreglos, fueron analizados con el software operativo GeneChip (GCOS) versión 3.1, y fueron realizados en el Laboratorio de Apoyo para la Tecnología Genómica en la Universidad Estatal de Michigan. Los cambios en las variables dependientes determinadas en músculo y plasma, pre-ejercicio vs post-ejercicio fueron evaluados por medio de test-t para muestras apareadas. Las variables dependientes fueron: ARNm muscular (tPA y PAI-1), actividad de tPA muscular y actividades de tPA y PAI-1 en el plasma. Se evaluaron las correlaciones entre las variables musculares y las variables plasmáticas por medio del coeficiente de correlación de Pearson. Estas pruebas fueron realizadas en SPSS versión 11. La significancia estadística se fijó en p<0,05.
RESULTADOS
Análisis del Tejido muscular
Expresión Génica en RT-PCR
En la Figura 1A y 1B se muestran los valores medios de los ARNm de tPA y de PAI-1 por RT-PCR para todos los sujetos. No se observaron cambios significativos en la expresión de tPA o de PAI-1 entre los valores pre- y post-ejercicio. La Figura 1C muestra la expresión génica para cada sujeto individual y refleja el valor erróneamente alto durante el descanso y una respuesta diferencial para el tPA del sujeto 2 en comparación con los otros sujetos. Por lo tanto, cuando se realizó un análisis donde se excluyó al sujeto #2, se observó un aumento significativo (p<0,05) en la expresión de tPA muscular pre- vs post-ejercicio (Figura 1D). La exclusión del sujeto #2 no cambió los resultados para el ARNm de PAI-1.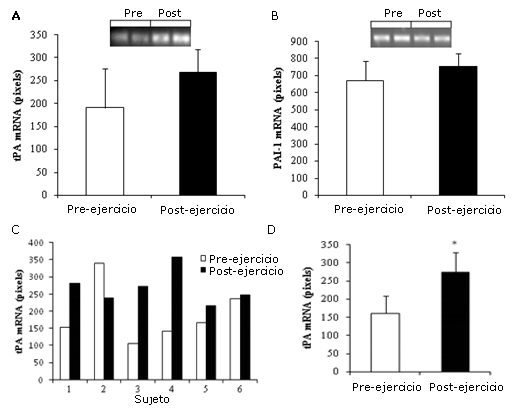
Figura 1. Expresión de los ARNm de tPA y PAI-1 con el ejercicio. Las muestras de tejido fueron extraídas mediante biopsia percutánea justo antes y después de la realización de ejercicio aeróbico agudo de máxima intensidad. El tejido fue homogeneizado y se extrajo el ARN total, que luego fue analizado para determinar el contenido de ARNm a través de RT-PCR semicuantitativa. Panel A: Cuantificación del ARNm de tPA del tejido muscular, establecida a partir de un gel representativo de un sujeto (n=6); Panel B: Cuantificación del ARNm de PAI-1 del tejido muscular, establecida a partir de un gel representativo de un sujeto (n=6); Panel C: ARNm del tPA del tejido muscular, pertenecientes a cada sujeto del estudio, determinados pre-ejercicio (barras blancas) y post-ejercicio (barras negras); Panel D: Cuantificación del ARNm de tPA del tejido muscular luego de la exclusión de los datos del sujeto 2, (n=5). *Representa p<0,05.
Expresión Génica en Microarreglos (Microarray)
Si bien se observaron cambios en la expresión génica, no se observaron cambios en ningún factor fibrinolítico que fuera estadísticamente significativo (Tabla 2), los que indica probablemente que los cambios de la expresión no fueron lo suficientemente importantes para poder ser medidos por el análisis de microarreglos. El factor V fue el único factor de coagulación en el cual se observó un aumento estadísticamente significativo en la expresión génica en el tejido muscular (Tabla 3).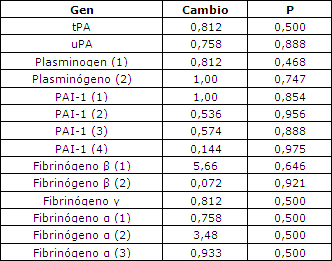
Tabla 2. Expresión de los genes de la fibrinólisis en los microarreglos. Los valores corresponden a la media de todos los sujetos. Los números colocados en cada gen corresponden a las diferentes pruebas utilizadas en el chip de microarreglos.
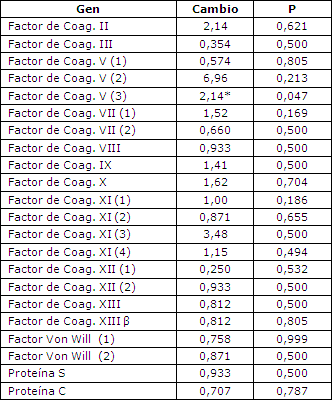
Tabla 3. Expresión en microarreglos de los genes vinculados a la coagulación. Los valores corresponden a la media de todos los sujetos. Los números colocados en cada gen corresponden a las diferentes pruebas utilizadas en el chip de microarreglos.
Actividad Muscular de tPA
La actividad muscular de tPA, evaluada mediante zimografía del plasminógeno en gel, no cambió significativamente con el ejercicio (Figura 2A). La exclusión del sujeto 2 en el análisis, no alteró los resultados para la actividad de tPA en el músculo.
Análisis del Plasma
La actividad de tPA de plasma presentó un aumento significativo (Figura 2B) con el ejercicio, mientras que la actividad plasmática de PAI-1 no mostró ningún cambio estadístico (Figura 2C). No se observó asociación significativa entre las variables del plasma y las variables del tejido muscular (p>0,05).
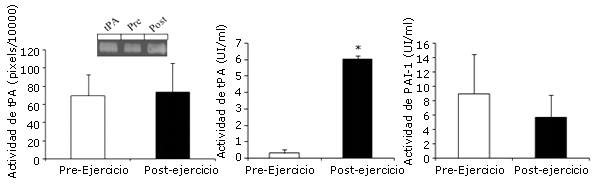
Figura 2. Actividad de las proteínas de tPA y PAI-1. Panel A: El tejido muscular fue extraído por biopsia percutánea, antes e inmediatamente después de la realización del ejercicio aeróbico agudo de intensidad máxima. El tejido fue homogeneizado, y a partir del mismo se realizó la extracción de proteínas. Para el zimografía se utilizaron cantidades iguales de proteínas (ver Materiales y Métodos). La cuantificación de la actividad de tPA muscular se obtuvo del gel, tal como se observa a través de las bandas de un gel representativo. Panel B: Las muestras de sangre fueron recolectadas antes e inmediatamente después del ejercicio aeróbico agudo. La actividad de tPA fue determinada mediante ELISA. Panel C: La actividad de PAI-1 en la sangre fue analizada mediante ELISA.
DISCUSION
La activación de plasminógeno desempeña claramente un papel en la recuperación y regeneración muscular luego de una lesión. La inhibición del uPA provoca una menor fusión y diferenciación de mioblastos (6,18) y una menor proliferación (6, 7). Adicionalmente, el daño muscular químico aumenta la expresión génica de uPA y de los genes miogénicos provocando reparación y regeneración muscular en ratones (15). Además, los ratones deficientes en uPA presentaron una mayor deposición de fibrina y alteraciones en la reparación de los músculos dañados (15). La eliminación de los depósitos de fibrina a través de un veneno de serpiente llamado ancrod, luego de la lesión muscular, produjo una mayor reparación y regeneración muscular (22). Un estudio posterior demostró que los ratones knockout para PAI-1 tienen una habilidad avanzada para la reparación y regeneración muscular (11), lo que indica que éstos activadores del plasminógeno son fundamentales para enfrentar el daño muscular. Los estudios sobre la activación del plasminógeno en células humanas han utilizado sólo uPA (6,7), sin embargo, los resultados de nuestro laboratorio sugieren que tPA es el activador de plasminógeno predominante en los seres humanos (13). A pesar de todo, estos activadores de plasminógeno serían fundamentales para la reparación del músculo después de la lesión.
El presente estudio apoyaría la hipótesis que la activación del plasminógeno desempeña un papel en la reparación de los músculos. Se ha observado un aumento en el tPA en humanos que realizan un programa de ejercicios crónicos, y en varones con enfermedad metabólica (9). Sin embargo, el presente estudio es el primero en demostrar un aumento en el ARNm de tPA en el músculo esquelético humano luego de la realización de ejercicio agudo, de alta intensidad (Figura 1D). En ratones también se observan aumentos similares, aunque en uPA, pero los ratones también muestran un aumento en el ARNm de PAI-1 (22). El presente estudio observó un aumento en tPA pero no en PAI-1, lo que sugiere un posible aumento en el potencial fibrinolítico. A pesar de éstos cambios en el ARNm, nosotros no observamos un aumento significativo en la actividad de tPA en las muestras de músculo entero (Figura 2A). Luego del ejercicio se observó un aumento en la expresión génica del Factor V a pesar de que la forma activa del Factor V es un conocido acelerador de la activación del plasminógeno inducida por tPA (19). Por otra parte, un aumento en la actividad de tPA podría requerir la síntesis de la proteína completa ya que nosotros sólo descubrimos aumentos en el ARNm. Es posible que el presente ejercicio no haya inducido el daño muscular suficiente para aumentar la actividad de tPA. Sin embargo, un reciente estudio con una prueba de esfuerzo progresiva en cinta rodante similar, observó aumentos significativos inmediatamente después del test de ejercicios en los niveles plasmáticos de creatinquinasa, lactato deshidrogenasa y aspartato aminotransferasa, que son todas enzimas marcadoras de daño muscular estructural (20). A pesar de estas inferencias, los resultados pueden ser más pronunciados utilizando protocolos que logren inducir un mayor nivel de daño muscular como la carrera en cinta rodante en descenso.
La recolección de las muestras inmediatamente después de la finalización de los ejercicios pudo haber contribuido con los presentes resultados. No se observó ningún cambio significativo en los microarreglos de los genes fibrinolíticos a pesar de que si se observaron aumentos en tPA mediante PCR. Las muestras de los sujetos fueron obtenidas inmediatamente después del ejercicio, lo que probablemente haya limitado nuestra capacidad de detectar los cambios, dado que la regulación por incremento de los genes es un proceso que depende del tiempo. Esta limitación acentúa el aumento descubierto en la expresión del gen tPA vía RT-PCR y probablemente hubiéramos observado mayores aumentos si se hubieran tomado las muestras musculares mucho tiempo después de la realización de la sesión de ejercicio. Seleccionamos éste momento porque los cambios plasmáticos en tPA se producen durante este intervalo de tiempo, y nos permitiría comparar los cambios en la producción muscular y en el plasma. Se observaron aumentos significativos en el tPA del plasma inmediatamente después del ejercicio (Figura 2B). Sin embargo, no se observó ninguna asociación significativa entre tPA o el ARNm de PAI-1 muscular y los cambios en el plasma, lo que sugeriría que la producción muscular de estos factores no contribuye significativamente con los cambios observados en el plasma inmediatamente después del ejercicio.
Los resultados presentes tienen implicancias interesantes, pero también implican algunas limitaciones. El hecho de considerar sólo seis sujetos, disminuyó la potencia estadística y posee un valor extremo en una de las principales variables de medición. Se decidió remover éste valor extremo porque su respuesta (Figura 1C) fue completamente opuesta a la de todos los otros sujetos, opuesta a los cambios conocidos en tPA del plasma y opuesta a las respuestas del RNAm de tPA de los estudios realizados con animales. La respuesta diferencial nos lleva a concluir que éste sujeto no fue correctamente clasificado mediante el criterio de inclusión/exclusión y por consiguiente debe ser excluido de los resultados y conclusiones. Los cálculos post-hoc de potencia indicaron una potencia de 32% para detectar las diferencias en los niveles de ARNm del tPA con una significancia de 0,05. La exclusión del sujeto con valores extremos disminuyó nuestra potencia un 4%. La exclusión del sujeto produjo un aumento estadísticamente significativo en el ARNm del tPA. Además de este valor extremo, las muestras fueron tomadas a través de la biopsia del músculo entero, lo que indicaría una posible contaminación del músculo analizado con proteínas de capilares y de tejido conjuntivo. Sin embargo, nosotros no encontramos ningún cambio en la actividad de las proteínas musculares de tPA, que suponíamos que podría tener el mayor riesgo de contaminación. Además, hemos observado la expresión de tPA en fibras musculares particulares en humanos, lo que sugiere que estos cambios agudos pueden deberse a cambios inherentes en la fibra, y no en los tejidos adyacentes (13). El diseño del presente estudio también exigió realizar la biopsia muscular post-ejercicio en la misma incisión que la biopsia inicial para recolectar el tejido en el lapso de tiempo requerido. Una segunda recolección en el mismo sitio de la biopsia podría haber inducido cambios en la expresión génica principalmente debidos a la lesión en el tejido. Sin embargo, datos previos indicaron que hasta tres muestreos en el mismo sitio no producen cambios significativos en la expresión génica, tal como se descubriera por PCR en tiempo real (16), lo que sugiere que los datos actuales son válidos.
Conclusiones
El tejido del músculo esquelético humano mostró un aumento en la expresión de tPA luego del ejercicio aeróbico máximo agudo similar a los de estudios en animales, que también sugieren que en los humanos aumenta la activación del plasminógeno luego de ejercicio agudo de alta intensidad. Los niveles plasmáticos de tPA aumentaron dramáticamente después del ejercicio, sin embargo, no se observó ninguna asociación entre el nivel de ARNm en el músculo y la actividad de tPA en el plasma, lo que sugiere que el músculo no contribuye con la actividad plasmática de tPA observada con el ejercicio agudo de alta intensidad. Los estudios futuros deben incluir más sujetos y deben usar una sesión de ejercicio para inducir un mayor daño muscular, como por ejemplo carrera en descenso.
Agradecimientos
Deseamos agradecer al Laboratorio de Investigaciones Energéticas Humanas (HERL) por permitirnos el uso del equipamiento y del espacio. También deseamos agradece al Laboratorio de Apoyo en Tecnología Genómica (GTSF) por su colaboración con la realización de los protocolos de microarreglo y análisis de los mismos. Parte del estudio fue financiado por el Programa de Financiamiento de la Universidad Estatal de Michigan. La agencia de financiación no tiene responsabilidad en el diseño, ejecución del estudio ni en la redacción y envío del manuscrito para su publicación.
Dirección para Envío de Correspondencia
Womack CJ, Ph.D., MSC 2303, James Madison University, Harrisonburg, VA 22801. Teléfono: (540)568-6515; FAX: (540)568-3338; correo electrónico: womackcx@jmu.edu.Referencias
1. Angleton P, Chandler WL, Schmer G (1989). Diurnal variation of tissue-type plasminogen activator and its rapid inhibitor (PAI-1). Circulation 79:101-106
2. Astrand I (1960). Aerobic work capacity in men and women with special reference to age. Acta Physiol Scand 49:1-92
3. Cooper JA, Nagelkirk PR, Coughlin AM, et al (2004). Temporal changes in tPA and PAI-1 after maximal exercise. Med Sci Sports Exerc 36: 1884-1887
4. Duncan GE, Howley ET, Johnson BN (1997). Applicability of VO2max criteria: discontinuous versus continuous protocols. Med Sci Sports Exerc 29: 273-278
5. Evans WJ, Phinney SD, Young VR (1982). Suction applied to a muscle biopsy maximizes sample size. Med Sci Sports Exerc 14: 101-102
6. Fibbi G, Barletta E, Dini G, et al (2001). Cell invasion is affected by differential expression of the urokinase plasminogen activator/urokinase plasminogen activator receptor system in muscle satellite cells from normal and dystrophic patients. Lab Invest 81:27-39
7. Fibbi G, D'Alessio S, Pucci M, et al (2002). Growth factor-dependent proliferation and invasion of muscle satellite cells require the cell-associated fibrinolytic system. Biol Chem 383:127-136
8. Giri S, Thompson PD, Kiernan FJ, et al (1999). Clinical and angiographic characteristics of exertion-related acute myocardial infarction. JAMA 282:1731-1736
9. Hittel DS, Kraus WE, Hoffman EP (2003). Skeletal muscle dictates the fibrinolytic state after exercise training in overweight men with characteristics of metabolic syndrome. J Physiol 548:401-410
10. Holmberg L, Kristofferson AC, Lecander I, et al (1982). Immunoradiometric quantification of tissue plasminogen activator secreted by fetal organs. Scand J Clin Lab Invest 42:347-354
11. Koh TJ, Bryer SC, Pucci AM, Sisson TH (2005). Mice deficient in plasminogen activator inhibitor-1 have improved skeletal muscle regeneration. Am J Physiol Cell Physiol 289:C217-C223
12. Leber TM, Balkwill FR (1997). Zymography: a single-step staining method for quantitation of proteolytic activity on substrate gels. Anal Biochem 249:24-28
13. Lemmer JT, Francis RM, Hackney KJ, et al (2007). Single Muscle Fiber Gene Expression of tPA, uPA, and PAI-1. Med Sci Sports Exer 39(5 Suppl):S469-S470
14. Lin X, el Sayed MS, Waterhouse J, Reilly T (1999). Activation and disturbance of blood haemostasis following strenuous physical exercise. Int J Sports Med 20:149-153
15. Lluis F, Roma J, Suelves M, et al (2001). Urokinase-dependent plasminogen activation is required for efficient skeletal muscle regeneration in vivo. Blood 97:1703-1711
16. Lundby C, Nordsborg N, Kusuhara K, et al (2005). Gene expression in human skeletal muscle: alternative normalization method and effect of repeated biopsies. Eur J Appl Physiol 95:351-360
17. Macko RF, Kittner SJ, Epstein A, et al (1999). Elevated tissue plasminogen activator antigen and stroke risk: The Stroke Prevention In Young Women Study. Stroke 30:7-11
18. Munoz-Canoves P, Miralles F, Baiget M, Felez J (1997). Inhibition of urokinase-type plasminogen activator (uPA) abrogates myogenesis in vitro. Thromb Haemost 77:526-534
19. Pryzdial EL, Bajzar L, Nesheim ME (1995). Prothrombinase components can accelerate tissue plasminogen activator-catalyzed plasminogen activation. J Biol Chem 270:17871-17877
20. Schillinger A, Koenig D, Haefele C, et al (2006). Effect of manual lymph drainage on the course of serum levels of muscle enzymes after exercise. Am J Phys Med Rehabil 85:516-520
21. Siscovick DS, Weiss NS, Fletcher RH, Lasky T (1984). The incidence of primary cardiac arrest during vigorous exercise. N Engl J Med 311:874-877
22. Suelves M, Lopez-Alemany R, Lluis F, et al (2002). Plasmin activity is required for myogenesis in vitro and skeletal muscle regeneration in vivo. Blood 99:2835-2844
23. Suelves M, Vidal B, Ruiz V, et al (2005). The plasminogen activation system in skeletal muscle regeneration: antagonistic roles of urokinase-type plasminogen activator (uPA) and its inhibitor (PAI-1). Front Biosci 10:2978-2985
24. Szymanski LM, Durstine JL, Davis PG, et al (1996). Factors affecting fibrinolytic potential: cardiovascular fitness, body composition, and lipoprotein(a). Metabolism 45:1427-1433
25. Todd AS (1959). The histological localization of fibrinolysin activator. J Pathol 78:281-283
26. van den Burg PJ, Hospers JE, van Vliet M, et al (1995). Unbalanced haemostatic changes following strenuous physical exercise. A study in young sedentary males. Eur Heart J 16:1995-2001
27. Winther K, Hillegass W, Tofler GH, et al (1992). Effects on platelet aggregation and fibrinolytic activity during upright posture and exercise in healthy men. Am J Cardiol 70:1051-1055
28. Womack CJ, Paton CM, Coughlin AM, et al (2003). Coagulation and fibrinolytic responses to manual versus automated snow removal. Med Sci Sports Exerc 35:1755-1759
29. Womack CJ, Rasmussen JM, Vickers DG, et al (2006). Changes in fibrinolysis following exercise above and below lactate threshold. Thromb Res 118:263-268
30. Zhang C, Meng X, Zhu Z, et al (2004). Role of connective tissue growth factor in renal tubular epithelial-myofibroblast transdifferentiation and extracellular matrix accumulation in vitro. Life Sci 75:367-379