Hierro: Metabolismo y Sistema Inmunitario
Publicado 11 de septiembre de 2014, 0:45
El hierro
(Fe) es uno de los metales más abundantes de la Tierra y es un
oligoelemento esencial para la mayoría de las diferentes formas vivientes y
para la fisiología humana, siendo el microelemento más abundante del organismo.
La cantidad promedio de Fe en nuestro organismo es de alrededor de 4,5 g, lo
que representa el 0.01% del peso corporal y las reservas de este mineral se
hallan en hígado, bazo y médula ósea, principalmente en forma de ferritina y en
menor cantidad como hemosiderina. Globalmente, la biodisponibilidad de Fe en un
adulto sano se sitúa entre el 10 y 15% del Fe de la dieta, siendo la absorción
de Fe a nivel de mucosa intestinal el principal punto de regulación, dado que
la cantidad de hierro que elimina el organismo diariamente es fija (entre 1-2 mg/día). El Fe presente en el organismo
se puede clasificar en dos tipos. Por un parte, el Fe hemínico o Fe hemo participa en la estructura del grupo hemo o
Fe unido a porfirina y proviene exclusivamente de alimentos de origen animal,
de donde es fácilmente absorbible. Este Fe hemínico forma parte de la
hemoglobina, mioglobina y otras enzimas tal y como se ha mencionado
anteriormente, como citocromos y enzimas como catalasas y peroxidasas que
participan en procesos oxidativos. Por otra parte, el Fe no hemínico o Fe no hemo tiene su fuente en alimentos de origen
vegetal y animal, y se absorbe en pequeña proporción (3-8%). Su absorción se
incrementa en presencia de vitamina C y otros ácidos orgánicos, ya que
transforman el hierro no hemínico de su forma férrica a hierro ferroso que
puede ser ya absorbido a nivel de mucosa intestinal (Ver figura 1).
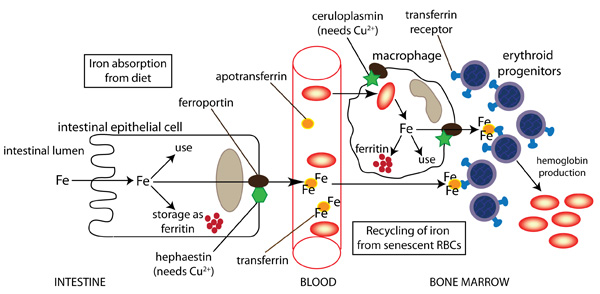
Figura 1. Metabolismo del Hierro. El hierro dietario es absorbido por el intestino (duodeno) y almacenado por la ferritina en el epitelio intestinal o transportado en el plasma como transferrina. El hierro no hemínico se presenta fundamentalmente en el estado férrico en el intestino y es reducido a hierro ferroso mediante la acción de ferrireductasas. En el duodeno esta reducción se lleva a cabo principalmente por la citocromo b duodenal (DCYTB). Existen otras ferrireductasas en los enterocitos intestinales ya que se ha mostrado que ratones que carecen de DCYTB no sufren daños en la absorción de hierro. El hierro ferroso pasa a través de los enterocitos duodenales a través del transportador de metales divalentes tipo 1 (DMT1). DMT1 es miembro de la familia de proteínas transportadoras de solutos y debido a esto también se le conoce como SLC11A2. Por otro lado, el hierro hemínico es captado mediante la proteína 1 transportadora de hemo (HCP1 – heme carrier protein 1). Una vez el enterocito hemo es degradado por acción de la hemeoxigenasa se libera el hierro ferroso, el cual puede ser almacenado en el enterocito al ligarse a la ferritina o puede ser liberado a la circulación sanguínea a través de la ferroportina (también conocida como IREG1). La ferroportina también es miembro de la familia de proteínas transportadoras de solutos y su designación es SLC11A3. El hierro es transportado por el torrente sanguíneo ligado a la transferrina pero sólo lo hace en su estado férrico, así que durante el transporte a través de ferroportina el hierro ferroso es oxidado por una ferrioxidasa identificada como hefaestina (proteína dependiente de Cu2+) [6]. Ahora bien, los progenitores eritroides obtienen hierro gracias a la síntesis de hemoglobina desde la transferrina plasmática o a través del reciclaje de eritrocitos senescentes por macrófagos en la médula ósea, bazo o hígado. El hierro que está en exceso se almacena en los macrófagos como ferritina, la cual es oxidada a hemosiderina. Estos paquetes de hierro pueden ser liberados por los macrófagos cuando el metabolismo lo requiera (ej; eritropoyesis incrementada, etc.).
El Fe es un componente de la hemoglobina necesaria para transportar oxígeno, y de la mioglobina para almacenar oxígeno en el músculo y liberarlo cuando sea necesario durante la contracción. Asimismo, facilita las reacciones de transferencia de electrones en la cadena respiratoria y por lo tanto, es importante en la síntesis de ATP. El hierro forma parte de numerosas enzimas y finalmente, es indispensable en la formación y funcionalidad de los eritrocitos, debido a su elevado contenido en hemoglobina [1].
En relación al Fe y el sistema inmunitariio, en condiciones fisiológicas las células inmunocompetentes captan el Fe plasmático que circula ligado a la transferrina a través del CD71 (receptor de transferrina), a excepción de los neutrófilos, que carecen de dicho receptor y captan Fe a partir de la transferrina plasmática. Los linfocitos T en reposo no expresan CD71 ya que no requieren Fe; no obstante, cuando se produce la activación linfocitaria, en la fase G0 a G1 del ciclo celular se inicia la expresión del receptor, antes de la síntesis de DNA lo cual asegura la presencia de Fe necesario para su biosíntesis, y antes de la secreción de IL-2, citosina con actividad linfoproliferativa. Un proceso similar ocurre en las células Natural Killer (NK), que no expresan CD71 en reposo y sólo o hacen después de su activación. Los linfocitos B en reposo expresan pequeñas cantidades de receptor de transferrina, lo que indica requerimientos reducidos pero constantes de este elemento; tras una estimulación mitogénica la mayoría de linfocitos B aumenta la expresión de CD71 y por tanto la captación celular de Fe. Finalmente, los macrófagos en reposo exhiben CD71 y en situación de un entorno rico en hierro incrementan su expresión para disponer de depósitos de hierro, necesario en su actividad fagocítica y citotóxica.
Por otra parte, se ha descrito la asociación de bajos valores plasmáticos de Fe con la inhibición selectiva de la proliferación de tipo Th1 sin afectar la de linfocitos Th2. Sin embargo, también se ha establecido que valores plasmáticos elevados de Fe interfieren con la citosina interferón gamma (IFN-γ). Además, parece ser que el Fe es componente de metaloenzimas y es importante en la formación de ROS y enzimas clave durante el proceso de “explosión respiratoria” que se da durante la fagocitosis.
Los linfocitos humanos producen varias proteínas cruciales para la regulación de los niveles de Fe, la ferritina, que actúa como un órgano de almacenamiento de hierro (reteniendo el mismo cuando hay demasiado en el cuerpo o liberándolo cuando hay deficiencia), y la ferroportina, que es la “puerta de salida” del Fe de las células (de nuevo liberándolo o reteniéndolo cuando es necesario). El hecho de que los linfocitos tengan ambas proteínas les confiere el potencial para “mover” fácilmente el compartimento de almacenamiento de Fe, característica perfecta para ejercer un papel importante en la homeostasis del Fe. Por otra parte, recientemente se ha profundizado en el conocimiento de la hepcidina, proteína clave en la regulación de los niveles de Fe del cuerpo y que es sintetizada por los propios linfocitos. La hepcidina, además, afecta a la multiplicación linfocitaria, lo que ocurre, por ejemplo, durante una infección, mostrando que la regulación del Fe intraleucocitario y el del organismo está altamente relacionado. La hepcidina durante una infección cierra la “puerta” a través de la cual sale Fe de la célula (ferroportina), reduciendo la disponibilidad de Fe en el plasma sanguíneo y ayudando así a controlar la infección, dado que las bacterias necesitan Fe para dividirse. De hecho, en relación con el ejercicio se ha demostrado que el entrenamiento de alta intensidad incrementa significativamente los niveles de hepcidina generando un aumento significativo de IL-6 y hierro plasmático [2].
Datos acumulados desde varias investigaciones muestran que el ejercicio en sí mismo no podría conducir a una verdadera deficiencia de hierro, o lo que muchos han denominado “anemia deportiva”, en un atleta saludable con una adecuada ingesta diaria de hierro. La mayor predisposición de anemia por deficiencia de hierro en atletas femeninas jóvenes puede no ser el ejercicio mismo, sino probablemente un resultado de elecciones dietéticas impertinentes, ingesta de hierro reducida y la menstruación. Estos factores pueden inducir deficiencia de hierro o anemia en la población general [4]. Sin embargo, el ejercicio afecta leventemente el metabolismo del hierro generando un balance bajo o sub-óptimo, aunque los mecanismos son poco conocidos y sólo existen ciertas conjeturas o análisis de metabolismo que proponen ciertas explicaciones (por ejemplo, una de las hipótesis postula al incremento en óxido nítrico producido por el ejercicio como un mecanismo que podría contribuir a un rendimiento sub-óptimo del metabolismo del hierro) [5].
La influencia del Fe sobre las funciones inmunitarias de tipo innato y adaptativo, ya sea debido a su participación en mecanismos antioxidantes o no, también se ha demostrado por la disminución de ciertas respuestas en población deficitaria de Fe. Concretamente, respecto a la respuesta innata, se ha observado como personas con aporte insuficiente de Fe presenta menor capacidad fagocítica y menor proporción de neutrófilos circulantes. En referencia a la respuesta adaptativa, el bajo aporte de Fe induce un descenso en la capacidad proliferativa por interferencia en la translocación y activación de la proteína cinasa C (PKC), disminución de mensajeros secundarios como el PIP2, menor capacidad de producción de citocinas como TNFα e IL-2, pero sin afectar la síntesis de anticuerpos.
Finalmente, debe considerase que los dos extremos que existen en el estado nutricional de Fe, déficit y sobrecarga, ejercen efectos nocivos sobre la inmunidad innata y adquirida y por ello se aconseja que este elemento puede constituir un arma de doble filo. Así, como se ha mencionado, el déficit de Fe impide de forma selectiva la proliferación linfocítica, en concreto de la subpoblación Th1, sin afectar los linfocitos Th2, disminuye la respuesta de hipersensibilidad retardada (DTH) y modifica la actividad fagocítica, ya que numerosas metaloenzimas que contienen Fe como la mieloperoxidasa de los neutrófilos y catalasa, entre otros, se halla implicadas en la destrucción bacteriana. Por el contrario, el exceso de Fe es tóxico para las propias células del organismo ya que produce peroxidación de membranas celulares y de orgánulos intracelulares. Además la sobrecarga de Fe genera inmunosupresión ya que disminuye la capacidad proliferativa de linfocitos Th y Tc, y aumenta la actividad de los linfocitos Treg. En condiciones normales el Fe presente en el organismo es superior al que requieren los microorganismos, pero se encuentra ligado a proteínas y no está disponible para el crecimiento bacteriano. Por el contrario, cuando se presenta una situación de exceso de hierro se favorece la proliferación bacteriana [3].
Webinar de Nuevas Tendencias Deportivas en la Suplementación con Creatina, Glutamina y Omega 3
Referencias
[1] Wang J & Pantopoulos K. (2011). Regulation of Cellular Iron Metabolism. Biochem J. 434(Pt 3): 365–381.
[2] Peeling P, Dawson B, Goodman C, Landers G, Wiegerinck ET, Swinkels DW & Trinder D. Effects of Exercise on Hepcidin Response and Iron Metabolism during Recovery. Int J Sport Nutr Exerc Metab. 19 (6): 583-597.
[3] Díaz V. (2011). Regulation of Iron Metabolism and Exercise. Medicina Sportiva, Vol. 15 Issue 4, p 230.
[4] Mustafa A & Cagri C. (2013). Iron Metabolism and Importance of Iron in Exercise. International Journal of Academic Research, Vol. 5 Issue 4, p 222.
[5] Qian ZM. (2002). Nitric Oxide and Changes of Iron Metabolism in Exercise. Biol Rev Camb Philos Soc. 77 (4): 529-536.
[6] http://themedicalbiochemistrypage.org/heme-porphyrin.php
