Hipertrofia, Hiperplasia y Densidad Capilar en Fibras Musculares de Hombres Universitarios Luego del Entrenamiento de la Fuerza
Steven J Fleck1, G. E McCall1, W. C Byrnes1, P. M Pattany1 y A. Dickinson1
University of Colorado, Boulder, Colorado 80309
Artículo publicado en el journal PubliCE, Volumen 0 del año 1996.
Publicado 15 de diciembre de 2004
Resumen
Palabras clave: entrenamiento de pesas, adaptación muscular, número de fibras, tipo de fibras, area de sección cruza
INTRODUCCIÓN
El aumento del tamaño muscular como resultados del entrenamiento de la fuerza está tanto documentado como evidenciado en atletas que participan crónicamente en entrenamiento de la fuerza de alta intensidad (6, 9, 16). Sin embargo, hay controversia acerca de si la hipertrofia de las fibras musculares existentes determina enteramente el aumento del tamaño muscular o si también la hiperplasia de las fibras musculares tiene un rol en dicho aumento (4, 30). Aunque algunos modelos en animales han provisto cierta evidencia acerca del rol de la hiperplasia y de la hipertrofia muscular (4), el respaldo para este fenómeno en humanos es limitado.
La mayoría de los estudios transversales en atletas de elite entrenados en fuerza respaldan el rol de la hipertrofia de las fibras en el aumento del tamaño muscular (19, 30). Se ha obtenido evidencia indirecta de un incremento en el número de fibras en atletas de elite entrenados en fuerza (20); sin embargo, otras investigaciones en estos atletas no han hallado incrementos en el número estimado de fibras (19, 25). Algunas investigaciones han reportado correlaciones positivas significativas entre el número estimado de fibras y el área de sección cruzada muscular (CSA) (1, 19, 25). Sin embargo, los estudios transversales no tienen la capacidad de evaluar si el mayor número de fibras esta determinado genéticamente o si el incremento fue producido por el entrenamiento prolongado.
Los estudios longitudinales de entrenamiento de la fuerza en humanos acerca de la hipertrofia muscular varían considerablemente en el diseño, en donde algunos (6, 9) pero no todos (2, 9, 10, 29) los estudios han reportado la hipertrofia de los músculos entrenados. Varios estudios han reportado hipertrofia de las fibras musculares, particularmente de la población de fibras tipo II (6, 13, 29); sin embargo, otros estudios han fallado en inducir la hipertrofia de las fibras musculares (8, 10). Los estudios que han fallado en inducir la hipertrofia de las fibras musculares consistieron en entrenamientos de corta duración (10) y/o de acciones musculares puramente concéntricas (8). Solamente un estudio longitudinal de entrenamiento de la fuerza en humanos evaluó la hiperplasia de las fibras musculares, no hallando hiperplasia en fisicoculturistas de elite durante el período de entrenamiento controlado (2). Sin embargo, debido a que no se evidenció una hipertrofia adicional ni en el CSA muscular total ni en el área de las fibras, las conclusiones que se pueden sacar de este estudio con respecto a la hiperplasia son insustanciales.
Otro enfoque para investigar la hipertrofia muscular en humanos, aunque no inducida por el entrenamiento de la fuerza, fue utilizado por Sjostrom y cols. (28). Utilizando datos de cadáveres, sugirieron que la hiperplasia de las fibras musculares puede ocurrir como resultado del estrés crónico de las actividades diarias; sin embargo, la predisposición genética no se puede descartar como explicación (28). Un tema relacionado a la hipertrofia muscular resultante del entrenamiento de la fuerza es el efecto de la hipertrofia muscular sobre la densidad capilar. Las investigaciones transversales realizadas en atletas entrenados en fuerza no han hallado cambios en el número de capilares por fibra, lo que resulta en una reducción de la densidad capilar expresada por área de fibra (27) y por área muscular (32). Sin embargo, un estudio transversal reportó un incremento en el número de capilares por fibra, sin cambios en la densidad capilar expresada por área muscular (26). Los resultados de estudios longitudinales de entrenamiento de la fuerza en humanos que investigaron los cambios en la densidad capilar también son equívocos. Algunos estudios han reportado que no se observaron cambios en los capilares por área de fibra o por área muscular (18, 31). Sin embargo, Hather y cols. (13) reportaron un incremento en los capilares por fibra, sin cambios en los capilares por área de fibra con el protocolo de entrenamiento de la fuerza que produjo la hipertrofia de fibras más significativa y un incremento en los capilares por área de fibra en las condiciones de entrenamiento que produjeron poca o ninguna hipertrofia de fibras.
En resumen, los resultados de las investigaciones en humanos son equívocos con respecto, tanto a el/los determinante/s de la hipertrofia muscular y los efectos de la hipertrofia muscular sobre la densidad capilar. Por ello, el propósito de este estudio fue evaluar la contribución de la hipertrofia de las fibras musculares y de la hiperplasia al aumento en el tamaño total del músculo como resultado del entrenamiento de la fuerza, así como también los efectos de los cambios en estos parámetros sobre la densidad capilar.
MÉTODOS
Sujetos
Los sujetos fueron varones universitarios de entre 18 y 25 años de edad quienes tenían antecedentes de entrenamiento de la fuerza recreacional. Los levantadores recreacionales fueron identificados utilizando un cuestionario de historia de entrenamiento y definiendo recreacionales como aquellos sujetos que levantaban pesas regularmente pero no realizaban un régimen de entrenamiento formalmente estructurado y/o no tenían un objetivo específico relacionado al entrenamiento de pesas. Se utilizaron levantadores recreacionales para minimizar la influencia de las adaptaciones neuromusculares, ya que se ha demostrado que estas adaptaciones predominan durante las primeras 3-5 semanas de entrenamiento en sujetos que inician el entrenamiento de la fuerza, mientras que las adaptaciones de la hipertrofia muscular son las que predominan a medida que el entrenamiento continúa (21). De los 28 sujetos potenciales que se presentaron como voluntarios para participar en el estudio, 15 cumplieron con los criterios especificados. Después de que fueron seleccionados, todos los sujetos firmaron un documento de consentimiento (aprobado por el Comité de la Universidad para Sujetos Humanos).
Protocolo de Entrenamiento
Los sujetos entrenaron bajo supervisión utilizando resistencia dinámica constante (pesos libres y maquinas) durante 12 semanas, en los días Lunes, Miércoles y Viernes en horario de la mañana. Los ocho ejercicios incluyeron a todos los grupos musculares principales; sin embargo cuatro ejercicios estuvieron destinados a hacer énfasis en los músculos que producen la flexión del codo. Los sujetos comenzaron a entrenar utilizando una resistencia que les permitiera realizar 10 repeticiones máximas (10RM) para cada ejercicio en particular. Los sujetos realizaraban tres series para cada ejercicio con 1 min de reposo entre series y ejercicios. Se instruyó a los sujetos para que en cada serie levantaran el peso hasta la fatiga concéntrica y que utilizaran la asistencia de un ayudante cuando fuera necesario para completar las 10 repeticiones o por razones de seguridad. Cuando los sujetos eran capaces de completar 12 repeticiones sin asistencia en alguna serie o al menos 10 repeticiones sin asistencia en las tres series o si los sujetos habían utilizado la misma carga en cinco sesiones, la carga para la siguiente sesión de entrenamiento era incrementada en un 5% y redondeada hasta aproximadamente 2.27kg. Si alguno de los sujetos no era capaz de realizar al menos 8 repeticiones sin asistencia en las tres series, la resistencia en la siguiente sesión se reducía en un 5%. En la evaluación post-entrenamiento, se utilizo un protocolo de mantenimiento del entrenamiento en donde la resistencia no se incrementó, pero se mantuvo en un nivel en el cual el sujeto pudiera completar al menos 8 repeticiones, pero no más de 12 repeticiones sin asistencia para cada una de las tres series.
Evaluación Dietaria
Durante el transcurso del entrenamiento, se realizaron periódicas evaluaciones dietarias, en las cuales los sujetos registraban su ingesta dietaria de 3 días y la cual abarcaba 2 días de la semana y 1 día del fin de semana. Esta información fue analizada por un programa de computadora (Nutritionist III, N2 Computing, San Bruno, CA) para valorar si los sujetos estaban ingiriendo las cantidades adecuadas de proteínas para permitir el crecimiento del músculo. Los sujetos fueron aconsejados por un nutricionista registrado para que incrementaran su ingesta proteica si estaban ingiriendo <1.5g de proteínas/kg de peso corporal, ya que se ha demostrado que esta cantidad es la necesaria para promover la hipertrofia muscular óptima (16).
Mediciones de Criterio
Antes y después del entrenamiento los sujetos realizaron tres sesiones de evaluación, las cuales ocurrieron en el siguiente orden: mediciones de pliegues cutáneos y determinación del CSA del brazo mediante resonancia magnética nuclear (MRI); biopsias musculares del bíceps braquial para valorar las características morfológicas seleccionadas; y fuerza en una repetición máxima de los flexores del codo (1RM). Además, la fuerza en 1RM se midió cada 3 semanas durante el entrenamiento.
Las mediciones de los pliegues cutáneos se realizaron mediante la utilización de calibres (Lafayette Instruments, Lafayette, IN) en siete sitios, como fue previamente descrito (23). La masa corporal fue determinada semanalmente por los investigadores utilizando la misma balanza médica.
Para el protocolo de MRI, los sujetos se colocaron en posición supina con su brazo extendido al costado del cuerpo a la vez que se realizaba la MRI en el brazo no dominante utilizando un sistema 1.5-T MRI (Picker International, Highland Heights, OH). La distancia media a partir de las tres mediciones fue utilizada para ubicar el sitio del registro a un tercio de la distancia entre el olécranon y el acromion. El scan se alineo perpendicularmente al humero o al brazo y se mantuvo constante durante todas las mediciones de un mismo sujeto. Se utilizó la técnica de gradiente de resonancia, lo cual permitió una buena visualización y delineación de los diferentes grupos musculares del brazo. Los parámetros del scan fueron los siguientes: tiempo de frecuencia-codificación 26ms, tiempo de repetición 350ms, campo de visión 20cm, ancho de sección 5mm, matriz de imagen 192 x 256, 11 secciones. El área (cm2) del bíceps braquial, del braquial, del bíceps braquial y del braquial combinados; del tríceps braquial y del brazo total se midió utilizando la imagen obtenida de la MRI central (i.e., la 6º sección). Se utilizó un digitalizador computarizado para trazar cada área exhibida en el monitor usando un programa provisto por el fabricante. Para cada área se utilizó la media de dos mediciones. Cada determinación subsiguiente fue realizada sin la representación visual del trazado de la medición precedente. Todas las mediciones fueron realizadas por dos investigadores, utilizando el valor medio para los análisis estadísticos
Las biopsias musculares fueron obtenidas 1-5 días antes de la MRI. Un investigador experimentado realizó la biopsia muscular en un solo sitio en el bíceps braquial, utilizando los procedimientos estándar con la modificación de Evans y cols. (12). Si la primera muestra no era adecuada, se obtendría una segunda y ocasionalmente una tercera muestra utilizando la misma incisión. La muestra post-entrenamiento fue tomada aproximadamente a 1cm de la muestra pre-entrenamiento y a una misma profundidad. Las muestras de la biopsia fueron rápidamente congeladas en freon o isopentano enfriado en nitrógeno líquido y guardadas a –70ºC para los posteriores análisis. Antes de ser guardadas las muestras fueron codificadas, y todos los análisis posteriores fueron completados en ciego sin conocer la identidad del sujeto ni el momento en que la muestra fue tomada.
El tejido muscular de la biopsia fue colocado en un OCT mediano a la vez que en un cryostat a –20ºC se cortaban secciones transversales de 10 μm de espesor que se colocaron en una coverslip. Se realizaron análisis histoquímicos para la determinación de las fibras tipo I y II mediante el procedimiento de tinción de la adenosina trifosfatasa (ATPasa) a través de pre-incubación alcalina a un pH de 10.3 (5). Las densidades capilares fueron determinadas por medio de la tinción de las células endoteliales utilizando un sistema lectin de biotinylated Ulex europaeus I (22). Para las mediciones morfológicas se utilizó un digitalizador computarizado (Carl Zeiss, Thornwood, NY) en combinación con un microscopio Zeiss provisto con un tubo de extracción (Carl Zeiss). Para todas las mediciones el factor de escala para el sistema de digitalización fue fijado por medio de la medición de una distancia conocida desde el micrómetro (Bausch and Lomb, Rochester, NY) utilizando la media de 20 pruebas de calibración como el factor de escala. Todas las calibraciones y mediciones fueron hechas amplificando 10 veces el tamaño. Para reducir la variabilidad debida a la heterogeneidad de la distribución de fibras dentro de un mismo sitio (11), se utilizo la media de tres campos para computar la composición fibrilar, la densidad capilar por área muscular y el espacio interfibra.
La composición de fibras tipo I y tipo II fue determinada a partir de la proyección de las tinciones de la ATPasa utilizando un micro proyector (Bioscope 500 series, Southern Precision Instrument, San Antonio, TX). Los campos fueron utilizados para incluir ~100 fibras con la mejor integridad posible. Siempre que fuese posible se utilizaron los fascículos para definir los campos, sin embargo, si la integridad de un área dentro de un fascículo era pobre, los campos se definían por áreas intactas continuas.
Las áreas de las fibras tipo I y tipo II fueron medidas por medio de la tinción capilar a la vez que se observaba en forma simultánea la proyección de la sección serial de la tinción de la ATPasa para la identificación de los tipos de fibras. La media ponderada del área de las fibras fue determinada a partir de las áreas de fibras tipo I y II conjuntamente con los datos de la composición de fibras, utilizando formulas previamente descriptas (19). Para determinar el número de mediciones de fibras requeridas para determinar con precisión el área promedio de las fibras en un individuo, se llevaron a cabo análisis secuenciales de estimación para cada tipo de fibra como fuera previamente descrito para una evaluación similar del tamaño de las células adiposas (7). En el presente estudio, los análisis secuenciales de estimación indicaron una estabilización de la media y el DE luego de la medición de las áreas de 50 fibras para ambos tipos de fibras pre y post entrenamiento. Luego de la medición de 50 fibras, la correlación entre el área media individual y la media de 100 mediciones fue ≥0.97 para ambos tipos de fibra pre y post entrenamiento, indicando que la media individual se había estabilizado. Los cálculos de la media de las áreas de las fibras tipo I y tipo II incluyeron todas las áreas de las fibras medidas para un individuo, con un mínimo de 75 fibras medidas para cada tipo de fibra.
También se llevaron a cabo mediciones del espacio interfibrilar a partir de la tinción capilar por medio de superposición de un campo cuadrado (25cm2) con el tablero digitalizado, midiendo las áreas de las fibras musculares que aparecían en el campo, y entonces midiendo el área del campo. El espacio relativo interfibrilar fue calculado por la sustracción del área de las fibras musculares acumulada al CSA muscular total dentro del campo cuadrado y expresándolo como porcentaje del CSA muscular total. Solamente se incluyeron las áreas con buena integridad dentro del campo. Para 15 de los 66 campos medidos, se utilizó un campo cuadrado pequeño (9cm2) debido a que no había un área de tejido suficientemente grande con buena integridad. Cada campo evaluado fue medido tres veces y para los análisis estadísticos se utilizó la media. Para la estimación del número de fibras, el CSA del bíceps braquial a partir de la MRI fue primero corregida por el espacio interfibrilar calculado a partir de la biopsia muscular para entonces derivar el CSA corregido del bíceps braquial utilizando la siguiente formula:
El número estimado de fibras fue subsecuentemente computarizado y corregido para explicar el acortamiento sarcomérico como fuera previamente descrito (19).
La densidad capilar fue expresada como capilares por fibra (tanto tipo I como tipo II), capilares por área de fibra (tanto tipo I como tipo II) y capilares por área muscular. Los capilares por fibra fueron determinados separadamente para cada tipo de fibra contando el número de capilares alrededor de cada fibra individual y computando la media. También se llevaron a cabo análisis de estimación secuencial para determinar el número de mediciones requeridas para ser representativas del número individual de capilares por fibras tipo I y tipo II (7). Los análisis indicaron una estabilización de la media y del DE luego de medir 25-30 fibras para cada tipo de fibra, pre y post entrenamiento. Luego de la medición de 50 fibras, la correlación entre la media individual de capilares por fibra y la media de 100 mediciones fue ≥0.96 para ambos tipos de fibras, pre y post entrenamiento, indicando que las medias individuales se habían estabilizado.
El número de capilares por área de fibra (μm2) fue calculado dividiendo el número de capilares al borde de cada fibra por el área de fibra a la cual eran adyacentes. El número medio de capilares por área de fibra fue entonces calculado para cada tipo de fibra. El número de capilares por área muscular (mm2) fue determinado a partir de los mismos campos utilizados para determinar el espacio interfibrilar.
La evaluación de la fuerza máxima se llevo a cabo 4-7 días después de la realización de las biopsias musculares. La fuerza en 1RM fue determinada con una precisión de 1.3kg durante la fase concéntrica del ejercicio de curl de bíceps en banco scott y fue evaluada pre y post-entrenamiento y en las semanas 3, 6 y 9 durante el entrenamiento. Para la toma de la barra se utilizo la posición da agarre cerrado (los dedos meñiques separados a 6 pulgadas). Para la sesión inicial de evaluación de 1RM, se les pidió a los sujetos que estimaran su 1RM, y se utilizó el 70% para realizar 3 a 4 repeticiones de entrada en calor. La carga fue incrementada por el investigador hasta obtener la 1RM en cinco o seis intentos. Se les permitió a los sujetos un descanso de 2min entre cada intento y se realizó solo una repetición por prueba luego de la entrada en calor. Para las evaluaciones subsiguientes, se intentó la 1RM en la tercera prueba. Los pesos fueron cubiertos para ayudar a controlar cualquier factor motivacional que pudiera ocurrir si los sujetos estaban conscientes del peso que estaban tratando de levantar. Los sujetos fueron estimulados verbalmente durante toda la evaluación. El mismo investigador condujo todas las sesiones de evaluación de la fuerza. Los pesos utilizados para el evaluación de 1RM fueron verificados utilizando una balanza certificada. Luego de la evaluación inicial de 1RM en curl de bíceps en banco scott, se determinó la fuerza en 10RM con una precisión de 2.27kg para cada ejercicio del régimen de entrenamiento, para de esta manera establecer la carga inicial de entrenamiento. Esto también se realizó en cinco a seis intentos para cada ejercicio, con 2 minutos de pausa entre cada prueba. La posición de las manos y de los pies fue estandarizada y controlada durante el entrenamiento.
Evaluación de las Metodologías
Para evaluar la confiabilidad de la ubicación del sitio para la MRI, siete sujetos fueron re-medidos para ubicar el sitio de escaneo y fueron escaneados por segunda vez dentro de la misma sesión de evaluación. No hubo diferencias significativas entre las medias de las imágenes, en el CSA de los músculos braquial y bíceps braquial combinados, con una correlación de 0.99 (p<0.05) entre los dos escaneos.
Para la MRI y para los procedimientos de tinción histoquímica se evaluaron la confiabilidad intrainvestigador y la objetividad interinvestigador. No hubo diferencias significativas en los valores medios intra o inter investigadores para ninguna de las mediciones, con excepción de la evaluación intra investigador para las mediciones de área en donde se utilizó el sistema Zidas, en el cual las medias difirieron en no mas del 3.28%. Las correlaciones entre investigadores fueron 0.99 (p<0.05) tanto para las mediciones del área de fibra como para las del CSA muscular.
Análisis Estadísticos
Se utilizó la prueba t para mediciones repetidas para comparar las diferencias entre las condiciones de pre y el post-entrenamiento. Para comparar las diferencias entre los tipos de fibra I y II, así como también para comparar las diferencias pre y post-entrenamiento se utilizó el análisis de varianza (ANOVA) de dos vías. Se utilizó en análisis de X2 para comparar las diferencias en la distribución del área de fibras entre el pre y el post-entrenamiento. Para evaluar diferencias en la ingesta dietaria y en la fuerza en 1RM a lo largo del entrenamiento se utilizó el análisis de varianza ANOVA de una vía. Se utilizaron las pruebas t para datos apareados y para datos no apareados, para evaluar la confiabilidad de medición y la objetividad de las mediciones del área de las fibras mediante la MRI. Se establecieron coeficientes de correlación de Pearson producto-momento para evaluar las relaciones entre las variables seleccionadas. Para todos los análisis estadísticos, se utilizo un nivel de significancia de 0.05. Los análisis estadísticos fueron realizados en un microprocesador Apple-Macintosh utilizando el programa estadístico Statview.
RESULTADOS
Doce sujetos completaron el estudio; sin embargo, un sujeto no fue biopsiado debido a preocupaciones por su historial de salud. El número promedio de sesiones de entrenamiento completadas fue 33.25±0.75, completando todos los sujetos ≥ 32 sesiones. Los cambios en el peso corporal (73.65±6.80kg pre-entrenamiento; 74.46±7.60kg post-entrenamiento) y en la sumatoria de pliegues cutáneos (77.33±20.01 pre-entrenamiento; 73.78±17.84 post-entrenamiento) no fueron significativos. Los análisis dietarios indicaron que la ingesta media de proteínas no cambió a lo largo del entrenamiento y nunca cayó por debajo de los 1.5g/kg de peso corporal. Uno de los sujetos fue aconsejado para que incremente la ingesta de proteínas durante el transcurso del estudio. El porcentaje medio calorías proteicas se mantuvo relativamente constante (15.6-17.7% del total de kilocalorías) a través del entrenamiento. La ingesta total de kilocalorías tampoco cambió significativamente a lo largo del entrenamiento y se la considero adecuada dado que ninguno de los sujetos redujo su peso corporal durante el curso de la investigación.
Fuerza en 1RM
Los cambios en la fuerza en 1RM están ilustrados en la Figura 1. La 1RM se incrementó significativamente entre el pre-entrenamiento y todas las sesiones de evaluación subsiguientes (p<0.05); sin embargo, solamente se produjeron incrementos significativos entre sesiones adyacentes de evaluación, entre la evaluación pre-entrenamiento y la evaluación en la semana 3 y entre la evaluación en la semana 9 y la evaluación post entrenamiento (p<0.05).
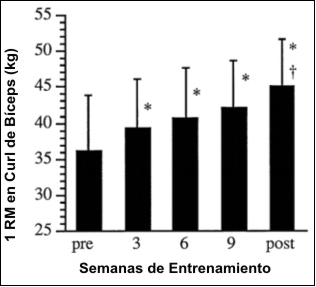
Figura 1. Valores de fuerza en una repetición máxima (1RM) en el ejercicio de curl de bíceps en banco scott pre-entrenamiento (pre) y post entrenamiento
(post) y cada 3 semanas durante el entrenamiento. Los valores son presentados
como medias±DE. *Significativamente diferente con respecto al valor pre-entrenamiento
(p<0.05); †Significaticamente diferente con respecto al valor de la semana 9
(p<0.05).
CSA Muscular
Los resultados del cambio en el CSA muscular (cm2) están presentados en la Tabla 1. En cuatro de los sujetos, la delineación entre los músculos bíceps braquial y braquial a partir de la MRI tanto pre como post-entrenamiento no fue suficientemente clara como para ser determinada por al menos un investigador; por lo tanto se utilizaron los resultados de ocho sujetos. Como resultado del entrenamiento, se produjeron incrementos significativos (p<0.05) en el CSA del bíceps braquial (12.6%), del bíceps braquial y del braquial combinados (9.9%), del tríceps braquial (25.1%) y del brazo total (14.6%); sin embargo el incremento en el braquial (7.7%) no fue significativo.

Tabla 1. Valores del CSA del brazo pre y post-entrenamiento medidos por medio de
la MRI. Los valores son presentados como medias±DE; n, número de sujetos. CSA,
área de sección transversal; MRI, resonancia magnética. * bíceps braquial y
braquial combinados. † Significativamente diferente con respecto al valor pre-entrenamiento,
p<0.05.
Área de las Fibras
Los resultados de las áreas de fibras pre y post-entrenamiento son ilustrados en la Figura 2. El análisis de varianza ANOVA 2 x 2 (tipo de fibra por nivel de entrenamiento) indicó efectos significativos principales (p<0.05), tanto para el nivel de entrenamiento como para el tipo de fibra, sin interacciones entre los tipos de fibras pre y post entrenamiento (p=0.09). De esta manera, el área de las fibras tipo II fue significativamente mayor que el área de las fibras tipo I, y el entrenamiento resultó en una hipertrofia significativa en el área de las fibras tipo I (10%) y en las fibras tipo II (17.1%). Aunque el término de interacción del ANOVA no fue significativo entre los tipos de fibra, la prueba t indico que el cociente de las áreas de las fibras II/I se incremento significativamente (p<0.05) desde 1.53±0.31 en la condición de pre-entrenamiento hasta 1.63±0.29 en la condición post-entrenamiento. Además, la prueba t indicó un incremento significativo (p<0.05) en el área media de las fibras (17.7 %).
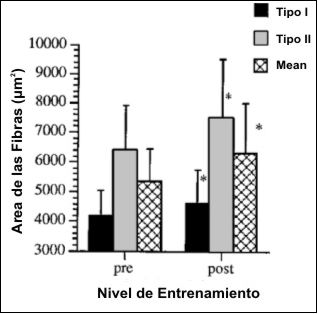
Figura 2. Valores del área de las fibras tipo I y II y área media de las
fibras musculares pre y post-entrenamiento. Los valores son presentados como
medias±DE; n=11 sujetos; * significativamente diferente con respecto a los
valores pre-entrenamiento (p<0.05).
El análisis X2 indicó que el área de distribución de ambos tipos de fibras cambió significativamente como resultado del entrenamiento (Figuras 3A y 3B). Luego del entrenamiento hubo una mayor frecuencia de fibras más grandes en ambos tipos de fibras. Además, el patrón de hipertrofia fue diferente entre las fibras tipo I y tipo II. En la población de fibras tipo I la hipertrofia ocurrió en las fibras de tamaño mediano, mientras que en la población de fibras tipo II se hipertrofió el rango completo de fibras. Por último la distribución de las fibras tipo II fue mucho más amplia que la de las fibras tipo I antes y después del entrenamiento.
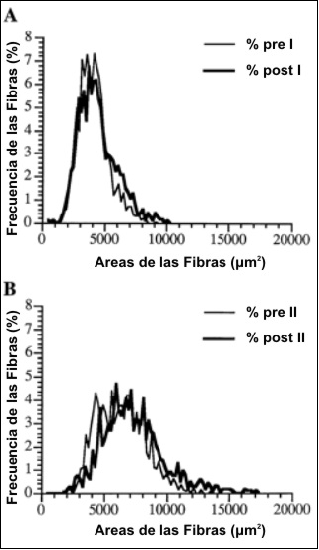
Figura 3. Distribución de la frecuencia del área de las fibras pre y
post-entrenamiento para las fibras tipo I (A) y para las fibras tipo II (B).
Composición Fibrilar
Para la determinación de la composición fibrilar pre-entrenamiento, se contaron una media de 131±38 fibras para cada uno de los tres campos, el número medio de fibras contadas por campo fue de 122±26. No se hallaron diferencias entre los campos que contribuyeron a la determinación de la composición de las fibras tipo I (rango: 50.1 a 52.3% pre-entrenamiento y 42.9 a 49.3% post-entrenamiento). No se produjeron cambios en la composición del porcentaje de fibras tipo I como consecuencia del entrenamiento (51.11±9.58% pre-entrenamiento; 45.55±10.09% post-entrenamiento, p=0.07).
Espacio Interfibra
El espacio interfibra relativo no cambió como resultado del entrenamiento. El espacio interfibra fue 9.39±1.68% pre-entrenamiento y 8.76±2.3% post-entrenamiento.
Estimación del Número de Fibras
Las estimaciones del número de fibras fueron posibles solamente para ocho de los sujetos cuyas CSA del bíceps braquial pudieron ser medidas tanto antes como después del entrenamiento. No hubo cambios en el número estimado de fibras en el bíceps braquial como resultado del entrenamiento. Cuando se corrigió por el acortamiento sarcomérico, la estimación del número de fibras fue 293.2±61.5 x 103 pre-entrenamiento y 297.5±69.5 x 103 post-entrenamiento.
Densidad Capilar
Los resultados de los datos de la densidad capilar son presentados en la Tabla 2. Uno de los sujetos fue excluido debido a la imposibilidad de medir adecuadamente la población de capilares por fibra en la muestra post-entrenamiento. El análisis de varianza ANOVA 2 x 2 para medidas repetidas (capilares por tipo de fibra por nivel de entrenamiento) indicó un efecto principal significativo (p<0.01) para el incremento en los capilares por tipo de fibra en las fibras tipo I (12.7%) y en las tipo II (22.6%) luego del entrenamiento. No hubo un efecto principal entre fibras (p=0.12), ni hubo interacción entre los tipos de fibras pre y post-entrenamiento (p=0.10). Los capilares por área de fibra no cambiaron como resultado del entrenamiento tanto en las fibras tipo I como en las fibras tipo II. Los capilares por área muscular (mm2) tampoco cambiaron como resultado del entrenamiento (p=0.08), aunque 7 de los 10 sujetos tuvieron incrementos en esta medición de la densidad capilar.

Tabla 2. Valores de densidad capilar pre y post-entrenamiento. *
Significativamente diferente con respecto al valor pre-entrenamiento, p<0.01; †
p>0.05, pero <0.10 para la diferencia con respecto al valor pre-entrenamiento.
DISCUSIÓN
Determinantes de la Hipertrofia Muscular
A pesar de los incrementos similares en el promedio grupal para el área media de las fibras (14.5%) y en el CSA del bíceps braquial (13.3%; corregido por el espacio interfibra) en los ocho sujetos cuya CSA del bíceps braquial pudo ser medida, no existió una correlación entre el incremento en el CSA del bíceps braquial y el área media de las fibras (r=0.191). Además, no hubo una correlación entre el incremento en el CSA del bíceps braquial y el área de las fibras tanto tipo I (r=0.197) como tipo II (r=0.353). Por lo tanto, aunque el número estimado de fibras no cambió luego del entrenamiento en estos sujetos, la hipertrofia muscular total no estuvo relacionada a la magnitud de la hipertrofia fibrilar. La ausencia de correlación pudo resultar de las limitaciones inherentes a los procedimientos utilizados para obtener el CSA de bíceps braquial y para las mediciones del área de las fibras. De esta manera, aunque los incrementos relativos en las medias grupales pueden ser similares, las limitaciones en los procedimientos utilizados para obtener estas mediciones pudieron producir una variabilidad en los valores individuales, resultando en la ausencia de una relación entre los dos índices de hipertrofia. Debido a que las consecuencias de estas limitaciones metodológicas eran conocidas desde un principio, los procedimientos fueron diseñados para, como máximo, limitar su impacto y como mínimo evaluar sus consecuencias.
Con respecto a la MRI utilizada para obtener la CSA del bíceps braquial, la ubicación del sitio de scan o exploración y el alineamiento del scan demostraron ser reproducibles, como se lo indico en los resultados. Además, la capacidad de un investigador de obtener una medición confiable y objetiva del CSA muscular quedo demostrada. Por lo tanto, se hallo que los procedimientos utilizados para obtener las medidas del CSA del bíceps braquial en un individuo fueron tanto validos como confiables. Con respecto a las mediciones del área de las fibras, así como también otros parámetros determinados a partir de las biopsias musculares; el punto central es si la biopsia realizada en un único sitio es apropiada para la determinación de las características musculares, ya que varios investigadores han concluido que el músculo humano es heterogéneo en cuanto a su composición fibrilar (11, 14, 17). Aunque no se sabe si las áreas de las fibras también difieren entre los sitios dentro del músculo, la variabilidad en la composición fibrilar podría influenciar el cálculo del área media de las fibras. Para reducir la variabilidad de la composición fibrilar entre distintos lugares del músculo, se ha recomendado extraer muestras de tres a cinco sitios diferentes (11). Aunque Elder y cols. (11) teorizaron que la variabilidad entre sitios contribuye en gran proporción a la varianza total, la inspección de sus datos revela valores similares para la varianza inter e intra-sitio. Por lo tanto, nosotros proponemos que, tomando la media de varias áreas dentro de un único sitio, la reducción en la variabilidad total podría aproximarse a la variabilidad de las biopsias tomadas en múltiples sitios. Interesantemente, en este estudio no se evidenció variabilidad intra-sitio, quizás debido a que nuestras muestras contenían una pequeña población de fibras en comparación con el tamaño promedio de la muestra en el estudio con cadáveres realizado por Elder y cols. De esta manera la heterogeneidad de la composición fibrilar en algunos sujetos pudo haber contribuido a la variabilidad en el cálculo del área media de las fibras en el presente estudio, a pesar de los esfuerzos realizados para ubicar el sitio y la profundidad de las biopsias pre y post-entrenamiento. Por ejemplo, en un sujeto (sujeto 23), una reducción en la composición de las fibras tipo I (Tabla 3) causo que el área media de las fibras se incrementara a pesar de las pequeñas reducciones en el área de ambos tipos de fibras. Los cambios en la composición fibrilar en humanos, especialmente en esta dirección luego de la sobrecarga muscular, no son respaldados por los datos previos (24), y dichos cambios son probablemente el resultado de la variabilidad entre los sitios de biopsia pre y post-entrenamiento.
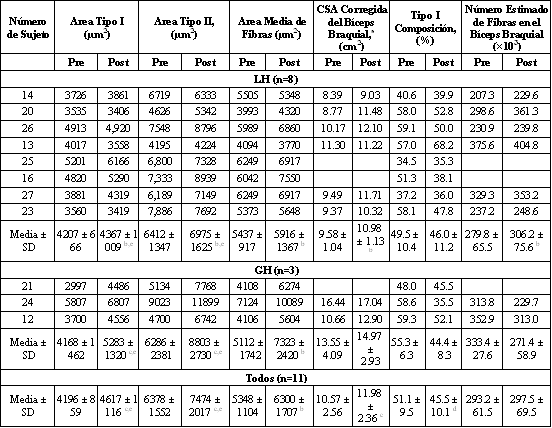
Tabla 3. Valores pre- y post-entrenamiento para todos los sujetos, para los
sujetos con una mayor hipertrofia relativa de fibras tipo II, y para los sujetos
con una menor hipertrofia relativa de fibras tipo II. n, número de sujetos;
Todos, todos los sujetos. GH, mayor hipertrofia relativa de fibras tipo II; LH,
menor hipertrofia relativa de las fibras II. a) n=6 para el subgrupo LH; n=2 para
el subgrupo GH; n=8 para el grupo total. b) Significativamente diferente con
respecto a la condición pre-entrenamiento, p<0.05; c) Significativamente diferente
con respecto a la condición pre-entrenamiento p<0.01; d) p>0.05, pero <0.10 para
la diferencia con respecto a la condición pre-entrenamiento. e) Efecto principal
del nivel de entrenamiento indicado por el análisis de varianza 2 x 2.
Otro punto relevante en la obtención de los valores individuales del área de las fibras, es la población de fibras que debe ser medida para reflejar con precisión al área de las fibras promedio del sitio de la biopsia y presumiblemente del músculo entero. Los presentes investigadores pudieron hallar solamente un estudio que se ocupó de este tema; sin embargo los sujetos eran físicoculturistas altamente entrenados (1). Los análisis secuenciales de estimación indicaron que el número de fibras medidas durante nuestro estudio excedió el punto en donde las medias acumuladas de los sujetos y las DE se volvieron constantes. De esta manera la determinación de cada promedio individual del área de las fibras tipo I y II no estuvo sesgada por una inadecuada población de fibras. Además, se hallo que los procedimientos utilizados para obtener las mediciones del área de las fibras fueron objetivos y que la confiabilidad del investigador que realizó las mediciones del área de las fibras fue aceptable.
Por lo tanto, dentro de las limitaciones de nuestros métodos, en nuestro estudio no fue evidente la hiperplasia de las fibras musculares. Sin embargo, uno debería ser precavido acerca de descartar cualquier posibilidad de hiperplasia fibrilar en los músculos esqueléticos humanos a pesar de la falta de cambio en el número estimado de fibras en el presente estudio, particularmente a la luz de la falta de correlación entre la hipertrofia de las fibras musculares y el incremento en el CSA total del músculo. La precedente discusión ofrece una posible explicación para esta falta de correlación. Otra posible explicación es que la hiperplasia fibrilar fuera un determinante de la hipertrofia muscular en algunos, pero no en todos los sujetos. Luego de la inspección de los datos de 11 sujetos, ofrecemos una interpretación alternativa basada en la magnitud de la hipertrofia de las fibras tipo II. Tres individuos exhibieron una mayor grado de hipertrofia en las fibras tipo II [subgrupo con mayor hipertrofia (GH); rango de incremento desde 31.9 a 51.3%], en comparación con los otros ocho sujetos [subgrupo con menor hipertrofia (LH), rango de incremento desde –5.7 a 21.9%]. Los datos individuales de los sujetos divididos en tres grados de hipertrofia de las fibras tipo II están presentados en la Tabla 3. Para ayudar a proporcionar una base de mérito para esta explicación alternativa, se realizaron comparaciones estadísticas para evaluar la influencia de los sujetos del grupo GH en la media grupal. Aunque los incrementos en el CSA del bíceps braquial fueron de magnitud similar entre los subgrupos LH (15.1±11.5%) y GH (12.3±12.3%), el incremento fue solamente significativo en el subgrupo LH, debido a que la fortaleza estadística estuvo severamente limitada por el pequeño tamaño de la muestra del subgrupo GH. El porcentaje de incremento en la fuerza en 1RM fue significativo y comparable en los dos subgrupos (27.5±15.0% para LH; 27.9±10.6% para GH). En ambos subgrupos el ANOVA 2 x 2 (tipo de fibra por nivel de entrenamiento) indicó un efecto significativo de la hipertrofia luego del entrenamiento.
Con respecto a la estimación del número de fibras, la exclusión de dos sujetos del subgrupo GH cuyo número de fibras fue estimado, resultó en un incremento significativo en el número estimado de fibras (desde 279.8±65.5 x 103 pre-entrenamiento hasta 306.2±75.6 x 103 post-entrenamiento) en los restantes seis sujetos. Por lo tanto, aunque la hipertrofia fibrilar fue un determinante del aumento del tamaño total del músculo para todos los sujetos, la contribución de la hiperplasia fibrilar pudo haber sido dependiente de la magnitud de hipertrofia de las fibras tipo II. Este contraste entre los resultados sugiere que puede haber diferencias en como los individuos alcanzan similares grados de hipertrofia muscular. Estos análisis post hoc deben ser vistos con precaución, especialmente con respecto a al error estadístico Tipo I. El cálculo de la estimación del número de fibras tiene las limitaciones combinadas de los procedimientos utilizados para determinar el CSA y el área de las fibras discutidos anteriormente. Cada una de estas limitaciones se combina para incrementar la variabilidad de los valores para el número estimado de fibras. No hay razón para esperar cualquier error sistemático operado entre las mediciones pre y post-entrenamiento para cualquier variable. Por lo tanto, ya que la consecuencia de una gran variabilidad es la fortaleza estadística reducida para hallar una diferencia real en donde esta exista (i.e., incremento en la probabilidad de error tipo II), nos sentimos confiados de que el incremento significativo en el número estimado de fibras en el subgrupo LH no es resultado de un error tipo I. La existencia de diferencias individuales en los determinantes de la hipertrofia muscular fue inesperada y es especulativa. Por lo tanto, el/los mecanismo/s potencial/es responsables no pueden obtenerse en este estudio. Sin embargo, una breve discusión sobre este punto en relación a los presentes datos podría ayudar en futuras investigaciones. Uno podría anticipar que las característica preexistentes de los sujetos pudieron afectar el/los determinante/s de la hipertrofia muscular. Aunque nuestra muestra no fue homogénea en lo que respecta a las variables pre-entrenamiento, el grado de hipertrofia de las fibras musculares y/o hiperplasia luego del entrenamiento no pareció ser dependiente de los valores pre-entrenamiento para el área de las fibras musculares, el CSA del bíceps braquial o la fuerza en 1RM. Por ejemplo el área de las fibras pre-entrenamiento fue similar cuando los sujetos fueron divididos según la magnitud de la hipertrofia (ver Tabla 3).
Hipertrofia de las Fibras Musculares
La hipertrofia de las fibras musculares en el presente estudio concuerda con
los resultados de otros estudios longitudinales de entrenamiento de la fuerza
que también utilizaron aciones concéntricas y excéntricas (6, 13). Otros
estudios de entrenamiento de la fuerza que utilizaron solamente acciones
concéntricas han fallado en hallar hipertrofia fibrilar (8) o solo hallaron
hipertrofia de las fibras tipo II (13). Recientemente, Hather y cols. (13)
reportaron que la hipertrofia de las fibras tipo I ocurre solamente cuando el
entrenamiento incluye tanto acciones concéntricas como excéntricas. Por ello,
los resultados del presente estudio confirman que las fibras musculares tipo I y
tipo II se hipertrofian en respuesta al entrenamiento de la fuerza que incluye
tanto acciones concéntricas como excéntricas.
La frecuencia en la distribución de las áreas de fibras índica un rango mucho mayor en el área de las fibras tipo II en comparación con el área de las fibras tipo I tanto pre como post-entrenamiento (ver Figuras 3A y 3B). Esta mayor distribución de las áreas de fibras tipo II fue también hallada en un estudio transversal con físicoculturistas mujeres (1). En el presente estudio, la distribución de las áreas de ambos tipos de fibras cambió significativamente luego del entrenamiento, con un patrón de hipertrofia diferente entre los dos tipos de fibras. Aunque el rango entero de las fibras tipo II se hipertrofió, la hipertrofia de las fibras tipo I ocurrió principalmente en las fibras de tamaño medio. Además de las diferencias en las distribuciones de las áreas entre las fibras tipo I y tipo II, también se hallaron diferencias entre los tipos de fibra para el grado relativo de hipertrofia tanto antes como después del entrenamiento. Hubo una mayor hipertrofia relativa de las fibras tipo II como resultado del entrenamiento, indicado por el incremento significativo en el cociente de áreas de fibras tipo II/tipo I. Otros estudios longitudinales de entrenamiento de la fuerza que utilizaron resistencia dinámica constante han también reportado incrementos en el cociente del área de las fibras tipo II/tipo I (6, 13). Los sujetos entrenados recreacionalmente en el presente estudio tuvieron similares cocientes de área de fibras tipo II/tipo I (1.53 pre-entrenamiento; 1.63 post-entrenamiento) a los reportados previamente para el bíceps braquial de mujeres físicoculturistas (rango 1.50-1.57) (1, 2, 25). Además, los sujetos en el presente estudio tuvieron cocientes de área de las fibras tipo II/tipo I mayores a los reportados para hombres desentrenados (rango, 1.10-1.38) (2, 25). Por lo tanto, los sujetos pueden haber alcanzado una hipertrofia preferencial de las fibras tipo II debido a su participación en entrenamiento de la fuerza anterior al estudio, y este cociente estuvo aumentado por el régimen de entrenamiento del presente estudio.
Densidad Capilar
No hubo diferencias en el patrón global de respuesta de la densidad capilar cuando se consideraron separadamente los subgrupos GH y LH, indicando que las respuestas de los capilares al entrenamiento estuvieron en concordancia con la hipertrofia de las fibras musculares. Aunque el incremento en los capilares por fibra no fue significativo en el subgrupo GH (15.1% tipo I; 38.3% tipo II), probablemente debido a la reducida fortaleza estadística de una muestra pequeña, la magnitud de incremento fue en realidad mayor que en el subgrupo LH (12.5% tipo I; 17.7% tipo II) (p<0.01).
Las diferencias en las metodologías pueden hacer confusas las comparaciones con los resultados de estudios previos ya que, aun cuando la densidad capilar aparentemente esta expresada de la misma manera, las metodologías específicas son frecuentemente inprecisas o no están mencionadas (13, 31, 32). Algunas expresiones del índice capilar/fibra no discriminan el tipo de fibra o la composición del área de la muestra (26). Esto podría tener un impacto sobre el índice capilares/fibras si la composición fibrilar no es homogénea o si hay diferencias en el número de capilares que rodean a las fibras tipo I y tipo II (3). El presente estudio ha mejorado significativamente con respecto a estudios previos por medio de la rigurosa evaluación de las metodologías para obtener con precisión valores de densidad capilar y también expresando la densidad capilar con tres métodos diferentes. Además, la tinción capilar utilizada en el presente estudio produce una visualización superior de los capilares en comparación con la tinción con ácido-Schiff comúnmente utilizada (22). Aun con las limitaciones de los estudios previos, la presente investigación no concuerda con los resultados de un reciente estudio longitudinal donde se halló un incremento en el número de capilares alrededor de las fibras tipo I y tipo II en el vasto lateral como resultado del entrenamiento de la fuerza (13). En el presente estudio, la magnitud de incremento fue proporcional al crecimiento de las fibras de manera tal que los capilares por área de fibra no cambiaron para ninguno de los principales tipos de fibras. Los mismos resultados fueron hallados por Hather y cols. (13), pero solo para la condición de entrenamiento de la fuerza que incluyó tanto acciones concéntricas como excéntricas. Otros estudios longitudinales de entrenamiento de la fuerza han fallado en hallar cambios en la densidad capilar expresada como capilares por fibra o por área muscular (18, 31). Sin embargo, ambos estudios también han fallado en producir incrementos en el área de fibras musculares, y por lo tanto las conclusiones con respecto a los efectos de la hipertrofia muscular sobre la densidad capilar son inconsistentes.
Los resultados de estudios transversales que han investigado la densidad capilar en atletas de elite entrenados en fuerza son equívocos (26, 27, 32). Algunos han especulado que puede haber más de un estímulo para incrementar el número de capilares por fibra y por ello se mantiene la densidad capilar por área de fibras y/o área muscular cuando se compara el régimen de entrenamiento de físicoculturistas con el de levantadores de pesas olímpicos o con levantadores de potencia (26, 32). En el presente estudio se utilizo un régimen de entrenamiento de tipo físicoculturista y respalda las observaciones de dichos estudios. Son necesarias futuras investigaciones para explicar el/los mecanismo/s responsable/s del incremento en el número de capilares en respuesta a diferentes regímenes de entrenamiento de la fuerza.
Composición Fibrilar
La mayoría de las investigaciones previas con humanos no respaldan el cambio en la composición fibrilar como resultado del entrenamiento de la fuerza (6, 13, 26). Sin embargo, algunos han sugerido que puede haber transformaciones dentro de los principales tipos de fibras como resultado tanto del entrenamiento “aeróbico” como “anaeróbico” (15) y del entrenamiento de la fuerza (8). Además, los modelos con animales en donde se ha incrementado la masa muscular han hallado un incremento en el porcentaje de fibras musculares lentas (tipo I) con la sobrecarga de los músculos, y en donde se ha reducido la masa muscular se produjeron resultados opuestos (24). Nuestros resultados respaldan el cambio en la composición fibrilar luego del entrenamiento de la fuerza, sin embargo, 9 de los 11 sujeto tuvieron una reducción en las fibras tipo I luego del entrenamiento (ver Tabla 3). Aunque no fue estadísticamente significativo (p=0.07), esta tendencia es desconcertante y a la vez es inconsistente con la evidencia hallada en otros modelos con mamíferos (24).
Espacio Interfiera
El espacio interfibra relativo no cambio significativamente como resultado del entrenamiento (9.39% pre-entrenamiento; 8.76% post-entrenamiento). Por lo tanto, debido a la hipertrofia muscular, hubo un incremento en la cantidad absoluta de espacio interfibra luego del entrenamiento. Con el uso de una técnica estereológica de conteo de puntos, los estudios transversales han reportado cantidades relativas similares de “colágeno y otros tejidos no contráctiles” en el bíceps braquial tanto de hombres desentrenados [13.4% (Ref.19); 14.4% (Ref. 25)] como de físicoculturistas varones [12.1-13.0% (Ref. 19); 12.0% (Ref.25)]. De esta manera parece que el incremento en el espacio interfibra y el área de fibras musculares están acoplados durante el entrenamiento de la fuerza.
Resumen y Conclusiones
La hipertrofia de las fibras musculares fue el determinante del aumento del tamaño del músculo total como resultado del entrenamiento de la fuerza. Aunque tanto las fibras tipo I como las tipo II se hipertrofiaron, las fibras tipo II mostraron una mayor capacidad de hipertrofia, fueron más variadas en su rango de tamaños, y tuvieron mayor tamaño que las fibras tipo I tanto antes como luego del entrenamiento. En el grupo de sujetos cuyo número de fibras pudo ser estimado, no hubo evidencia de hiperplasia fibrilar, sin embargo, no hubo correlación entre la hipertrofia de las fibras musculares y la hipertrofia total del músculo. Esto pudo atribuirse a limitaciones inherentes al uso de biopsias musculares en un único sitio.
Alternativamente, el potencial para la hiperplasia fibrilar como determinante del aumento del tamaño muscular pudo haber sido influenciado por la magnitud de la hipertrofia de las fibras tipo II. En aquellos sujetos con una menor hipertrofia relativa de las fibras tipo II, la hiperplasia pudo haber sido un determinante adicional del aumento del tamaño total del músculo. En contraste, los pocos sujetos que exhibieron una mayor hipertrofia relativa de las fibras tipo II no exhibieron hiperplasia, a pesar de que sufrieron un incremento comparable en el CSA del músculo y en la fuerza.
La examinación de los parámetros evaluados en el presente estudio no pudo proveer una explicación acerca de las diferencias individuales en la respuesta al entrenamiento.
El segundo hallazgo principal del presente estudio fue que el incremento en el número de capilares se puede producir en respuesta de la hipertrofia inducida por el entrenamiento de la fuerza. El incremento en el número de capilares fue proporcional al crecimiento de las fibras musculares, de manera tal que la densidad por área de fibra permaneció sin cambios.
En conclusión, el entrenamiento de la fuerza resultó en una hipertrofia del CSA total del músculo y del área de las fibras sin cambios en el número estimado de fibras, mientras que los cambios en los capilares fueron proporcionales al crecimiento de las fibras musculares.
Dirección para el pedido de reimpresiones
G. McCall, Dept. of Physiological Science, 2301 Life Sciences, 621 Circle Drive S., Los Angeles, CA 90095-1527.
Referencias
1. Alway, S. E., W. H. Grumbt, W. J. Gonyea, and J. Stray-Gundersen (1989). Contrasts in muscle and myofibers of elite male and female bodybuilders. J. Appl. Physiol. 67: 24-31
2. Alway, S. E., W. H. Grumbt, J. Stray-Gundersen, and W. J. Gonyea (1992). Effects of resistance training on elbow flexors of highly competitive bodybuilders. J. Appl. Physiol. 72: 1512-1521
3. Andersen, P (1975). Capillary density in skeletal muscle of man. Acta Physiol. Scand. 95: 203-205
4. Antonio, J., and W. J. Gonyea (1993). Skeletal muscle fiber hyperplasia. Med. Sci. Sports Exercise 25: 1333-1345
5. Brooke, M. H., and K. K. Kaiser (1970). Muscle fiber types: how many and what kind?. Arch. Neurol. 23: 369-379
6. Brown, A. B., N. McCartney, and D. G. Sale (1990). Positive adaptations to weight-lifting training in the elderly. J. Appl. Physiol. 69: 1725-1733
7. Clarkson, P. M., F. I. Katch, W. Kroll, R. Lane, and G. Kamen (1980). Regional adipose cellularity and reliability of adipose cell size determination. Am. J. Clin. Nutr. 33: 2245-2252
8. Cote, C., J. A. Simoneau, P. Lagasse, M. Boulay, M. C. Thibault, M. Marcotte, and C. Bouchard (1988). Isokinetic strength training protocols: do they induce skeletal muscle fiber hypertrophy?. Arch. Phys. Med. Rehabil. 69: 281-285
9. Cureton, K. J., M. A. Collins, D. W. Hill, and F. M. McElhannon, Jr (1988). Muscle hypertrophy in men and women. Med. Sci. Sports Exercise 20: 338-344
10. Dons, B., K. Bollerup, F. Bonde-Petersen, and S. Hancke (1979). The effect of weight-lifting exercise related to muscle fiber composition and muscle cross-sectional area in humans. Eur. J. Appl. Physiol. Occup. Physiol. 40: 95-106
11. Elder, G. C., K. Bradbury, and R. Roberts (1982). Variability of fiber type distributions within human muscles. J. Appl. Physiol. 53: 1473-1480
12. Evans, W. J., S. D. Phinney, and V. R. Young (1982). Suction applied to a muscle biopsy maximizes sample size. Med. Sci. Sports Exercise 14: 101-102
13. Hather, B. M., P. A. Tesch, P. Buchanan, and G. A. Dudley (1991). Influence of eccentric actions on skeletal muscle adaptations to resistance training. Acta Physiol. Scand. 143: 177-185
14. Henriksson-Larsen, K. B., J. Lexell, and M. Sjostrom (1983). Distribution of different fibre types in human skeletal muscles.I. Method for the preparation and analysis of cross-sections of whole tibialis anterior. Histochem. J. 15: 167-178
15. Jansson, E., B. Sjodin, and P. Tesch (1978). Changes in muscle fibre type distribution in man after physical training. A sign of fibre type transformation?. Acta Physiol. Scand. 104: 235-237
16. Lemon, P. W (1991). Protein and amino acid needs of the strength athlete. Int. J. Sport Nutr. 1: 127-145
17. Lexell, J., K. Henriksson-Larsen, and M. Sjostrom (1983). Distribution of different fibre types in human skeletal muscles. 2. A study of cross-sections of whole m. vastus lateralis. Acta Physiol. Scand. 117: 115-122
18. Luthi, J. M., H. Howald, H. Claassen, K. Rosler, P. Vock, and H. Hoppeler (1986). Structural changes in skeletal muscle tissue with heavy-resistance exercise. Int. J. Sports Med. 7: 123-127
19. MacDougall, J. D., D. G. Sale, S. E. Alway, and J. R. Sutton (1984). Muscle fiber number in biceps brachii in bodybuilders and control subjects. J. Appl. Physiol. 57: 1399-1403
20. MacDougall, J. D., D. G. Sale, G. C. Elder, and J. R. Sutton (1982). Muscle ultrastructural characteristics of elite powerlifters and bodybuilders. Eur. J. Appl. Physiol. Occup. Physiol. 48: 117-126
21. Moritani, T., and H. A. deVries (1979). Neural factors versus hypertrophy in the time course of muscle strength gain. Am. J. Phys. Med. 58: 115-130
22. Parsons, D., K. McIntyre, W. Schultz, and J. Stray-Gundersen (1993). Capillarity of elite cross-country skiers: a lectin (Ulex europaeus I) marker. Scand. J. Med. Sci. Sports 3: 89-98
23. Pollack, M. L., D. H. Schmidt, and A. S. Jackson (1980). Measurement of cardio-respiratory fitness and body composition in the clinical setting. Compr. Ther. 6: 12-27
24. Roy, R. R., K. M. Baldwin, and V. R. Edgerton (1991). The plasticity of skeletal muscle: effects of neuromuscular activity. Exercise Sport Sci. Rev. 19: 269-312
25. Sale, D. G., J. D. MacDougall, S. E. Alway, and J. R. Sutton (1987). Voluntary strength and muscle characteristics in untrained men and women and male bodybuilders. J. Appl. Physiol. 62: 1786-1793
26. Schantz, P (1982). Capillary supply in hypertrophied human skeletal muscle. Acta Physiol. Scand. 114: 635-637
27. Schantz, P (1983). Capillary supply in heavy-resistance trained non-postural human skeletal muscle. Acta Physiol. Scand. 117: 153-155
28. Sjostrom, M., J. Lexell, A. Eriksson, and C. C. Taylor (1991). Evidence of fibre hyperplasia in human skeletal muscles from healthy young men? A left-right comparison of the fibre number in whole anterior tibialis muscles. Eur. J. Appl. Physiol. Occup. Physiol. 62: 301-304
29. Staron, R. S., E. S. Malicky, M. J. Leonardi, J. E. Falkel, F. C. Hagerman, and G. A. Dudley (1990). Muscle hypertrophy and fast fiber type conversions in heavy resistance-trained women. Eur. J. Appl. Physiol. Occup. Physiol. 60: 71-79
30. Taylor, N. A., and J. G. Wilkinson (1986). Exercise-induced skeletal muscle growth. Hypertrophy or hyperplasia?. Sports Med. 3: 190-200
31. Tesch, P. A., A. Thorsson, and E. B. Colliander (1990). Effects of eccentric and concentric resistance training on skeletal muscle substrates, enzyme activities and capillary supply. Acta Physiol. Scand. 140: 575-580
32. Tesch, P. A., A. Thorsson, and P. Kaiser (1984). Muscle capillary supply and fiber type characteristics in weight and power lifters. J. Appl. Physiol. 56: 35-38