Importancia de la Mioglobina (Mb) durante el ejercicio intermitente.
Publicado 16 de septiembre de 2013, 12:15
Un aspecto muy importante y clave durante el ejercicio intermitente, es el relacionado a la mioglobina y su acción durante dicho tipo de ejercicio. Detallaremos a continuación sus funciones e importancia.
Características.
La Mb es una proteína citoplasmática relativamente pequeña, que consiste de 154 amino-ácidos y cuyo exterior de la molécula está compuesto de residuos hidrófilos, con una mínima interacción friccional, lo cual es una propiedad que favorece la difusión del O2 facilitada por la Mb dentro del sarcoplasma.
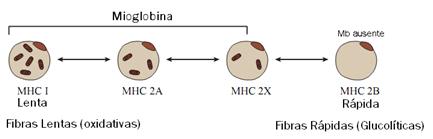
Figura 1. La Mb está expresada en las miofibrillas esqueléticas oxidativas. (MHC I) Fibras Tipo I; (MHC IIa) Fibras Tipo IIa; (MHC IIb) Fibras Tipo IIb; (MHC IIx) Fibras Tipo IIx ; MHC, significa que expresan distintos tipos de isoforma de cadena pesada de miosina.
Como la hemoglobina (Hb), la mioglobina se une reversiblemente al O2 y así puede facilitar el transporte de O2 desde los glóbulos rojos hacia la mitocondria durante períodos de mayor actividad metabólica o sirve también como reservorio de O2 durante condiciones hipóxicas (poco oxígeno) o anóxicas (sin oxígeno). A diferencia de la Hb, sin embargo, la Mb con un único sitio de vinculación de O2, tiene una curva hiperbólica de saturación de O2, en vez de una curva de forma sigmoidea vista en la Hb (Figura 2).
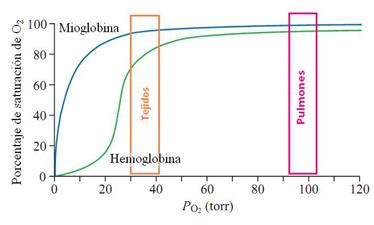
Figura 2. La Mb se vincula al O2 con avidez. La Mb y la Hb funcionan como transportadores de O2. La Mb muestra una curva de vinculación con el oxígeno de forma hiperbólica mientras que la Hb muestra una curva de forma sigmoidea. La liberación de O2 por la Mioglobina no se inicia hasta que la PO2 es muy baja, cuando la hemoglobina se halla ya prácticamente disociada por completo y ha cedido casi la totalidad del O2 que transportaba.
Como ocurre con la distribución de las enzimas glucolíticas, la concentración de Mb parece ser más alta en la banda-I que en la banda-A. Esta región del sarcómero también contiene un volumen más grande de densidad mitocondrial. A partir de esto, uno podría especular que las mitocondrias localizadas en la banda-I podrían beneficiarse de la liberación directa de O2 mediada por la oximioglobina (Mb saturada) para la cadena respiratoria, lo cual ha sido demostrado de ser importante en las fibras musculares cardíacas. En una variedad de músculos, se demostró que las mitocondrias se distribuyen en un gradiente que es más alto cerca de los capilares y disminuye con la distancia hacia el centro de la fibra muscular. Si la distancia de difusión para el O2 o cualquier otro sustrato metabólico desde los capilares hacia las mitocondrias fuera un factor crítico en el metabolismo mitocondrial, entonces todas las mitocondrias deberían localizarse cerca de los capilares. Pero, si la distancia para el intercambio de los componentes de fosfatos de alta energía entre las mitocondrias y las miofibrillas fueran críticas para el ritmo del trabajo muscular, entonces las mitocondrias deberían ser distribuidas uniformemente entre las miofibrillas. La distribución real de las mitocondrias en la mayoría de los músculos es intermedia entre los dos casos. Esto indica un equilibrio entre demandas opuestas. Por ejemplo, en músculos entrenados en resistencia aeróbica, hay un aumento en el contenido total de mitocondrias de las fibras musculares, con un contenido mayor relativo a la población del subsarcolema que en la población interfibrilar. Ambos tipos de mitocondrias podrían tener distintos equipamientos enzimáticos.
Concentración de Mb en el músculo.
La concentración de Mb en las fibras musculares esqueléticas está muy vinculada al requerimiento por el trabajo físico sostenido. En la naturaleza hay claras variaciones en la concentración de la Mb que apoya el rol de la Mb en el flujo de O2 desde la sangre hacia los músculos aeróbicamente activos: el músculo del pecho de una gallina que no vuela es ‘blanco’ y le falta esta proteína, mientras que en los patos, que sí pueden volar, el mismo músculo es ‘rojo’ y rico en Mb. El contenido de Mb de los músculos aumenta dramáticamente con el ejercicio y aún aumenta en un músculo predominantemente ‘blanco’ (fibras rápidas) con inervación ‘cruzada’ de un músculo de fibras lentas. El contenido de Mb de los músculos es proporcional al contenido de la citocromoxidasa (enzima clave en el sistema de la cadena respiratoria en las mitocondrias). Esencialmente todo el oxígeno consumido por el músculo esquelético y el corazón es tomado por la citocromoxidasa; así, la Mb está desarrollada en el músculo más o menos en proporción al contenido muscular de esta enzima. Puesto que la Mb no puede atravesar la membrana exterior mitocondrial, la citocromoxidasa, alojada en la membrana interna mitocondrial en las crestas, debe ser abastecida por el O2 disuelto que se difunde desde el sarcoplasma. La membrana exterior mitocondrial extremadamente delgada, apenas impedirá la difusión del O2. La concentración en el músculo esquelético puede ser más alta y está quizás correlacionado con el tamaño celular más grande y capilares más ampliamente esparcidos. Por ejemplo, la concentración de O2 unido a la Mb en el sarcolema del músculo esquelético que realiza un trabajo estable sostenido, excede la concentración del O2 disuelto. La relación del O2 unido a la Mb/oxígeno libre se aproxima a 30:1.
En cuanto a los niveles de Mb
en las fibras musculares en humanos, un estudio de Nemeth intentó determinar el contenido de Mb y su
relación con enzimas metabólicas musculares. En la Tabla 1 se pueden observar
distintos valores de contenidos de Mb.
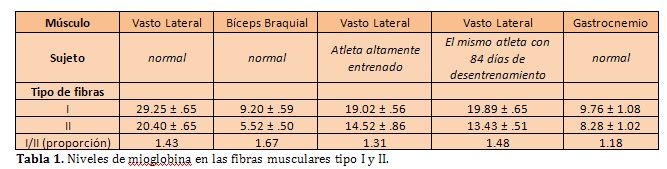
También se concluyó que el desentrenamiento de atletas altamente entrenados resultó en un marcado descenso en las enzimas relacionadas con los procesos energéticos, sin que la Mb fuera afectada en cualquiera de los dos tipos de fibras del músculo vasto lateral por el desentrenamiento (Ver Figuras 3 y 4). También se evidenció en ese estudio que un cambio en la condición de entrenamiento, que llevó a cambios en las enzimas oxidativas, no afectó los niveles de mioglobina de las mismas células.
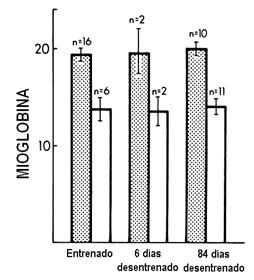
Figura 3. Concentración de Mb (mg/kg ± SD) en fibras musculares tipo I (columnas rellenas) y tipo II (columnas blancas) de atletas ciclistas entrenados, en su pico de entrenamiento y después de 6 días de desentrenamiento y después de 84 días de desentrenamiento; n número de muestras de fibras.
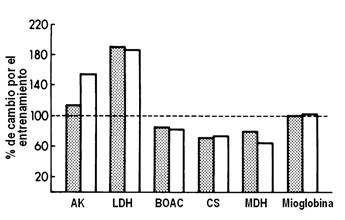
Figura 4. Porcentaje de cambio en las actividades de las enzimas metabólicas y de la Mioglobina en las mismas fibras tipo I (columnas rellenas) y tipo II (columnas blancas) del músculo vasto lateral de un atleta después de 84 días de desentrenamiento. AK: adenilato kinasa; LDH: lactatodeshidrogenasa; BOAC: ß-hidroxiacil-coenzima A deshidrogenasa; CS: citrato sintetasa; MDH: malato deshidrogenasa.
Sin embargo, Duteil y col. encontraron que la concentración de Mb era significativamente más alta en los músculos de la pantorrilla de los atletas de resistencia (corredores) que en atletas de sprint (velocistas de 100-200 mts)(Ver Figura 5). Adicionalmente, la concentración de Mb se correlacionó negativamente con el tiempo de llegar a la hiperemia máxima (r = 0.58, P = 0.008) y se correlacionó positivamente con la producción oxidativa mitocondrial de ATP (r =0.70, P = 0.008). También en los atletas de resistencia se correlacionó fuertemente la reoxigenación intracelular y la recuperación metabólica.
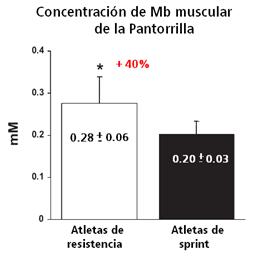
Figura 5. Concentración de mioglobina en distintos tipos de atletas.
Por otro lado, en una revisión de Laursen P.B. y Jenkins D.G. se menciona que los atletas se tornan hipoxémicos durante el ejercicio de alta intensidad, aumentando los niveles de mioglobina en respuesta al estrés hipóxico. Pero otros autores (Gödecke, por ejemplo) descubrieron múltiples mecanismos compensatorios en ratas a las que se les bloqueó la mioglobina, sosteniendo la idea de que la Mb de hecho no tiene un rol en la fisiología del suministro de O2 y en la producción de energía en los músculos de fibras lentas. Ya veremos también que el contenido de Mb es proporcional al déficit en el suministro de O2 en la demanda máxima de O2.
Por lo tanto, a lo largo de la
literatura científica, se pueden identificar tres roles funcionales potenciales
para la Mioglobina en los músculos ‘aeróbicos’ en animales terrestres: 1) como
depósito o reservorio de O2; 2) como agente transportador de O2,
y 3) como un catalizador celular (buffer intracelular). También han surgido
otros roles secundarios.
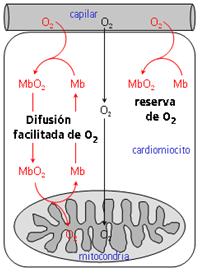
Figura 6. Dibujo esquemático que resume las funciones de la Mb en el citosol y mitocondria.
Como reservorio de O2.
Ya Christensen observó que
cuando un sujeto se ejercitaba intermitentemente en turnos de 10”, hay una
dilatación de los vasos sanguíneos que irrigan a los músculos más activos, lo
cual asegura un buen aporte de sangre y, en consecuencia, un buen aporte de
oxígeno tanto durante el ejercicio como en la pausa. Además, hay una reserva de
O2 en la mioglobina que puede consumirse durante el turno de
ejercicio. Aunque las reservas de O2 en la mioglobina son
relativamente pequeñas, alrededor de 500 ml por masa muscular, tiene un papel
importante en el suministro de energía en el trabajo inicial y de corta
duración, de forma que las reservas de O2 en la mioglobina
constituyen un 20% de la energía requerida para un trabajo intensivo de 15
segundos. Durante el siguiente período de descanso,
este depósito se rellena fácilmente con O2, siendo esta
reposición de aproximadamente la mitad de las reservas de O2 de la
mioglobina.
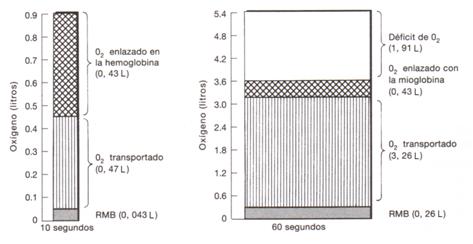
Figura 7.
Así, Åstrand P-O. y Col. tenían la hipótesis de que el depósito de O2 (representado por la mioglobina) era usado en la fase inicial de trabajo antes que la respiración y la circulación sean capaces de alcanzar los valores que corresponden a la demanda real de O2. La reserva de O2 calculada en el experimento de Åstrand P-O., era de alrededor de 0.43 litros. Con el turno de 60 minutos de ejercicio, se calculó que faltaban 1.9 litros de O2, y que, en consecuencia, debía haber procesos anaeróbicos que prestaban su constitución. Estas fluctuaciones de las reservas de O2 estimularían el aumento de la capacidad de la mioglobina. En consecuencia, las duraciones básicas de trabajo para la capacidad de la mioglobina tendrían que ser igual a 10-15 segundos. Así, Åstrand P-O. y Christensen E.H. explicaron los bajos valores de ácido láctico durante los turnos cortos de ejercicio y descanso, proponiendo que la mioglobina funciona como un depósito de O2 durante los períodos cortos de trabajo muscular pesado.
Como transportador de O2
El transporte intracelular de O2 en las fibras musculares es ampliamente ayudado por la Mb. De acuerdo a Wittenberg, tres condiciones deben encontrarse para la contribución de la difusión facilitada por la Mb al flujo de O2 que excede a la del O2 disuelto libre: a) la Mb debe estar presente en concentraciones significativas, b) la Mb debe estar parcialmente desaturada, y c) la Mb debe estar libre para someterse a la difusión translacional (de translación) en el sarcoplasma.
Se ha demostrado, ya en 1959 por Wittenberg, que la Mb mejora el flujo difusivo del O2 in vivo, y también otros autores demostraron que es precisamente la naturaleza rápida de casi equilibrio de las cinéticas de vinculación de la Mb, junto con su constante de disociación del O2 cerca de la PO2 del músculo activo y su alta concentración comparada con la difusión de O2, que mejora la mioglobina para la ‘difusión facilitada de O2’. Experimentos subsecuentes demostraron que la inhibición de la vinculación del oxígeno con la Mb (bloqueo), por ejemplo con H2O2 (agua oxigenada), disminuyó el VO2máx en el músculo aislado, y por los años 1990 la importancia de la Mb para el transporte del O2 en los músculos ‘aeróbicos’ fue ampliamente aceptada. Con lo cual, el mantenimiento de la función aeróbica a pesar de este bloqueo de la Mb indica que no hay un vínculo obligado entre la Mb y la fosforilación oxidativa.
También, hay evidencia de que el trabajo muscular con baja presión de O2 es dependiente de la Mb funcional, ya que cae la resíntesis de ATP y CP. Es interesante observar también en un estudio de Cole que durante la función contráctil el flujo de sangre en el músculo se mantuvo sin cambios, y la extracción de O2 disminuyó, lo cual indica que la ‘mioglobina funcional’ transporta O2 a las mitocondrias. Estos resultados establecen inequívocamente que la Mb sostiene la disponibilidad de O2 en las mitocondrias de los músculos que operan en estados fisiológicamente normales.
En el estudio de Richardson se
estudió si durante el ejercicio, la PO2 intracelular era mucho menor
que la PO2 capilar, lo cual podría confirmar la importancia de la
conductancia de O2 desde la sangre a la mitocondria en la
determinación del VO2máx. Se
comprobó una rápida desaturación de la Mb en un ejercicio submáximo (50% del VO2máx),
y esta desaturación ocurre muy rápidamente (dentro de un tiempo de 20”). Así,
hay evidencia de un gradiente sustancial de O2 desde la sangre al
tejido, indicando una resistencia a la difusión de O2 entre los
glóbulos rojos y el sarcolema, y que esto está presente aún durante el
ejercicio submáximo. En tanto la carga de trabajo aumenta y la demanda de O2
se eleva, el flujo de O2 puede ser incrementado a pesar de esta
limitación de la difusión, presumiblemente aumentando el área disponible para
dicha difusión, elevando tanto el reclutamiento capilar como el flujo sanguíneo.
En la Figura, se puede observar la ‘cascada de O2 desde el aire a
los tejidos’. Así, durante el VO2máx muscular, la conductancia de
difusión de O2 en los tejidos es igual, y significa que la PO2
capilar, la PO2 de la Mioglobina y el VO2máx son cada uno
reducidos proporcionalmente en hipoxia, sosteniendo el concepto de que el
suministro de O2 juega un rol clave en la determinación del VO2máx.
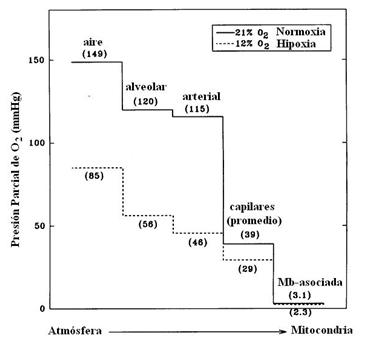
Figura 8. La cascada completa de
oxígeno desde la atmósfera hasta el tejido muscular durante el ejercicio máximo
de extensión de piernas tanto en normoxia como en hipoxia. Nótese los valores
de la PO2 casi similares a nivel mitocondrial, en ambas condiciones
atmoféricas.
En el mismo estudio de Richardson los datos con NMR (resonancia magnética nuclear) revelaron que la concentración de Mb es mayor en el músculo humano con una alta capacidad oxidativa y una vasculatura altamente sensible de adaptarse, y el ritmo al cual la Mb se resatura (que se vincula al O2) está bien correlacionado con la tasa de refosforilación de la creatina (formación de CP), que implica un rol fundamental de la Mb en el transporte de O2 en el músculo esquelético altamente oxidativo.
Así es como la Mb se desatura rápidamente al comienzo de un ejercicio muscular, aumentando el gradiente de PO2 desde los capilares sanguíneos al citoplasma. Además, la Mb desaturada cerca de la membrana celular, se vincula entonces al O2 y se ‘difunde’ a la mitocondria, proporcionando una vía paralela que suplementa la simple difusión del O2 disuelto. Por lo tanto, las propiedades de la Mb hacen que se ajuste a un rol en el transporte de O2 por su alta concentración, su saturación promedio cerca de la PO2 in vivo y su cinética muy rápida.
En una gran revisión de Conley se establece que la conductancia, y no la concentración, de la Mb, es importante. El contenido de Mb solamente, es un pobre predictor de su rol en el suministro de O2, ya que la concentración sola no determina la conductancia a la Mb, sino que el radio de la fibra muscular es también un factor crítico. Es decir, la conductancia representa solamente la capacidad para el suministro de O2, mientras que el flujo real vía difusión de O2 y O2 unido a la Mb (oximioglobina) depende de los niveles de PO2 y gradientes en el músculo.
Se ha encontrado que el contenido más bajo de Mb se observa en aquellas fibras sin una limitación de la difusión. Por lo tanto, se indica que la Mb era necesaria como un suministro de O2 y que el contenido de Mb aumentaba en proporción al tamaño de la limitación de difusión a las demandas mitocondriales de O2. También la concentración de Mb aumenta en ambientes de reducidas demandas máximas de O2. Otra cuestión es la fuerza de conducción para el suministro de O2 desde la sangre, que aumenta en tanto el tamaño corporal disminuye. A esto se le suma que también la PO2 es más alta en pequeños sujetos. Así, esto explica la menor concentración de Mb en tanto el tamaño corporal disminuye, ya que es menos necesario el suministro de O2 suplementario a causa de una mayor capacidad de difusión en sujetos más pequeños.
En esta misma revisión, se observó que la desaturación del O2 de la Mb es clara aún al 50% del VO2máx (como vimos anteriormente) y esta desaturación ocurre muy rápidamente. Y hay una re-saturación cuando el ejercicio cesa durante al menos 45”. Esta rápida desaturación de la Mb al 50-60% (aún en ejercicios submáximos) es indicativo del uso inmediato de al menos la mitad de los depósitos de O2 de la Mb, como sostenía Ǻstrand en la década del sesenta.
 Así la velocidad y la magnitud
de esta respuesta puede tener varias funciones: i) la inmediata disponibilidad
del 50% del O2 guardado asociado con la Mb, puede ser una importante
fuente de O2 para el mayor metabolismo oxidativo al comienzo del
ejercicio; ii) esta desaturación de la Mb reduce la región depletada por el
transportador, maximizando el gradiente de la PO2 desde la sangre a
la célula (ver Figura 9). En consecuencia, el sistema de transporte pasivo
responsable para el influjo de O2 hacia la célula muscular es
facilitado por esta rápida desaturación, aún durante el ejercicio liviano. La
mayor respuesta de la Mb sin vinculación al O2 en hipoxia y la
elevación concurrente en la conductancia de difusión de O2 en
hipoxia a través del ejercicio submáximo, sostiene estos conceptos.
Así la velocidad y la magnitud
de esta respuesta puede tener varias funciones: i) la inmediata disponibilidad
del 50% del O2 guardado asociado con la Mb, puede ser una importante
fuente de O2 para el mayor metabolismo oxidativo al comienzo del
ejercicio; ii) esta desaturación de la Mb reduce la región depletada por el
transportador, maximizando el gradiente de la PO2 desde la sangre a
la célula (ver Figura 9). En consecuencia, el sistema de transporte pasivo
responsable para el influjo de O2 hacia la célula muscular es
facilitado por esta rápida desaturación, aún durante el ejercicio liviano. La
mayor respuesta de la Mb sin vinculación al O2 en hipoxia y la
elevación concurrente en la conductancia de difusión de O2 en
hipoxia a través del ejercicio submáximo, sostiene estos conceptos.
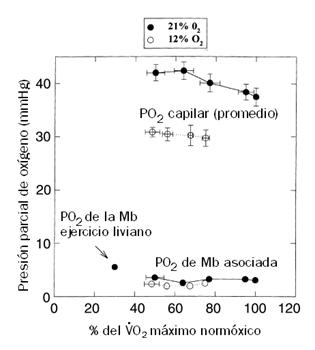
Figura 9. PO2 promedio
capilar y PO2 celular asociada a la Mb en relación al porcentaje del VO2máx en normoxia tanto en
normoxia (21% O2) como en
hipoxia (12% O2). Nótese la gran diferencia entre la PO2
disponible en los capilares y la PO2 a nivel celular, aún en ritmos
de ejercicio submáximos.
Por ejemplo, la PO2 en la sangre durante el ejercicio era 11-12 veces más alto que en el citoplasma en un ritmo de carga submáxima (50% del VO2máx de una pierna) y se mantenía 8-10 veces más alta aún en cargas máximas de ejercicio.
Por lo tanto, hay una desaturación (‘vaciamiento de O2’) de la Mb constante, a pesar del ejercicio que progresa en forma intensa. Por lo tanto, en el transcurso de ejercicios dinámicos de intensidad moderada o baja no participa el O2 combinado a la Mb.
 Otro dato que se puede
relacionar con la PO2 es el lactato. Por ejemplo, se ha reconocido
que elevadas concentraciones de lactato sanguíneo deberían ser causados por
otros factores que simplemente una tasa de síntesis de ATP mitocondrial
limitada por el O2. Conley recientemente apoya esta conclusión dando
datos in vivo en hombres, que indican
que el PO2 intracelular se mantiene por arriba de esos valores aún
en ejercicios máximos en hipoxia, con producción de lactato que se eleva
rápidamente (ver Figura 10).
Otro dato que se puede
relacionar con la PO2 es el lactato. Por ejemplo, se ha reconocido
que elevadas concentraciones de lactato sanguíneo deberían ser causados por
otros factores que simplemente una tasa de síntesis de ATP mitocondrial
limitada por el O2. Conley recientemente apoya esta conclusión dando
datos in vivo en hombres, que indican
que el PO2 intracelular se mantiene por arriba de esos valores aún
en ejercicios máximos en hipoxia, con producción de lactato que se eleva
rápidamente (ver Figura 10).
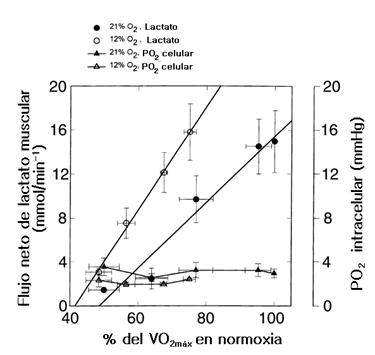
Figura 10. Flujo neto de lactato muscular y PO2 intracelular como una función del consumo de oxígeno en condiciones de normoxia e hipoxia. Obsérvese la constancia de los valores de la PO2 intracelular a pesar del aumento de lactato.
Con el reconocimiento de que la producción de lactato muscular puede ser el resultado de la hipoxia celular, los datos son sugestivos de un PO2 ‘crítico’ mucho más alto in vivo en el músculo esquelético humano entrenado, ya que el ritmo metabólico mitocondrial máximo parece estar significativamente comprometido cuando el PO2 intracelular cae desde un nivel de 4 mmHg.
Y con respecto al concepto de ‘umbral anaeróbico’, estos datos demuestran que durante el ejercicio incremental, las células del músculo esquelético no se tornan ‘anaeróbicos’ en tanto los niveles de lactato suben rápidamente, aún en ejercicios submáximos (ver Figura 9), lo cual no refleja una anoxia celular, sino una alta tasa de flujo glucolítico que es necesaria para sostener la fosforilación oxidativa.
En un estudio de Christmass M.A. y Col., una disminución en la hemoglobina relativa al comienzo de un ejercicio de carrera intermitente intenso (120% del VO2pico, 12” de trabajo por 18” de pausa) indicó que los mecanismos de suministros de O2 no podían igualar inmediatamente la demanda, y por lo tanto, mantener la concentración capilar de O2 en los valores básicos. A través de una espectroscopía cercano infrarrojo (NIRS, near-infrared spectroscopy), se pudo observar el nivel de estado estable de la hemoglobina relativa durante el ejercicio intermitente, que era caracterizado por una declinación cíclica en la oxigenación durante los períodos de trabajo, seguido por una re-oxigenación durante la recuperación (Ver Figura 11). Como se puede ver en la figura 11, el punto más bajo alcanzado de la hemoglobina durante el ejercicio intermitente comparado al ejercicio submáximo continuo (60% del VO2pico, 0% de inclinación en cinta ergométrica), refleja una discrepancia comparablemente mayor entre la demanda de O2 y el suministro. En este contexto, recordemos que Katz y Sahlin en 1987, definían a la hipoxia del músculo esquelético como una declinación en la disponibilidad del O2 (suministro) relativa a la tasa de utilización de O2 (demanda) en el tejido. También, en el estudio de Christmass M.A. se sostuvo una correlación entre la velocidad de carrera y la declinación en el contenido de O2 en la hemoglobina a través de los distintos protocolos.
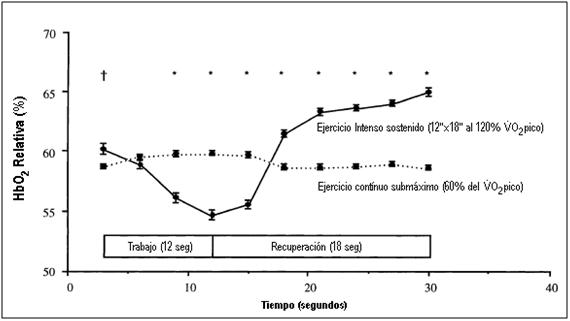
Figura 11. Oxigenación relativa del músculo cuádriceps durante el período de análisis (un ciclo de trabajo y pausa) de datos en el ejercicio intermitente sostenido y ejercicio continuo submáximo. † P < 0.05, * P < 0.001, diferencias significativa entre los protocolos de ejercicio.
Otro estudio del mismo
autor, se observa que en un ejercicio intermitente durante 2 protocolos de
24”x36” y de 6”x9”, de trabajo y pausa (igual relación 1:1,5 de trabajo y pausa)
a igual intensidad (65 y 71% del VO2pico respectivamente) en cinta
ergométrica e igual duración total de trabajo (40 minutos), después de una
declinación global a través de varios ciclos de trabajo:pausa, la hemoglobina
muscular relativa alcanzó un estado estable dinámico en ambos protocolos (Ver
Figura 12).
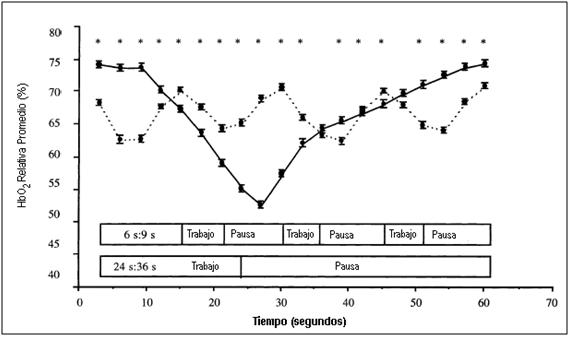
Figura 12. Oxigenación relativa del músculo cuádriceps durante el período de análisis de datos en el ejercicio intermitente largo (24”:36”, líneas sólidas) y el ejercicio intermitente corto (6”:9”, líneas punteadas) de similar duración e intensidad global. * P < 0.001 Diferencia significativa entre los protocolos de ejercicio.
Este dato demuestra nuevamente la discrepancia entre el suministro y la demanda de O2 requerido durante el ejercicio intermitente. De allí, la importancia del período de recuperación para lograr un estado estable entre la desoxigenación y la reoxigenación para ser alcanzados con estos protocolos. En la Figura 18 se puede observar una hipoxia relativa a pesar de una intensidad de ejercicio baja, en donde la declinación en el estado de la hemoglobina es una consecuencia de la duración del período de trabajo.
También, tengamos en cuenta que durante breves intervalos de recuperación, como ocurre en un trabajo intermitente de alta a moderada intensidad, al menos alguna parte del ATP, PCr y de oximioglobina es restablecida, tomando un tiempo de 10” a 80” la reposición de los depósitos de oxigeno-mioglobina.
Referencias
Tomlin D.L., Wenger H.A. The relationship between aerobic fitness and recovery from high intensity intermittent exercise. Sports Med 31(1):1-11 (2001).
Christmass M.A., Dawson B., Passeretto P., Arthur P.G. A comparison of skeletal muscle oxygenation and fuel use in sustained continuous and intermittent exercise. Eur J Appl Physiol Occup Physiol, Oct 1999; 80(5): 423-35.
Christmass M.A., Dawson B., Arthur P.G. Effect of work and recovery duration on skeletal muscle oxygenation and fuel use during sustained intermittent exercise. Eur J Appl Physiol Occup Physiol, Oct 1999; 80(5): 436-47.
Ayupov N.S., Guseva A.A. Myogenic mechanism of exercise hyperemia. Электронный журнал "ИсследовановРоссии", (Diario Científico del Intituto Físico-técnico de Moscú)161е,стр.1501-1508,2006.
Conley, K.E., Ordway, G.A., Richardson, R.S. Deciphering the mysteries of myoglobin in striated muscle. Acta Physiol Scand. 168, 623–634 (2000).
Barbany Cairó J.R. Fundamentos de fisiología del ejercicio y del entrenamiento. Editorial Barcanova, S.A., España. 1990. ISBN 84-7533-542-X.
Richardson S.R, Noyszewski E.A., Kendrick K.F., Leigh J.S., Wagner P.D. Myoglobin O2 desaturation during exercise. Evidence of limited O2 transport. J Clin Inves. 96(4): 1916-1926 (1995).
Ordway G.A., Garry D.J. Myoglobin: an essential hemoprotein in striated muscle. Journal of Experimental Biology 207: 3441–3446 (2004).
Nemeth, P. M., Lowry O.H. Myoglobin levels in individual human skeletal muscle fibers of different types. J. Histochem. Cytochem. 32: 1211-1216, 1984.
Meyer R.A. Aerobic performance and the function of myoglobin in human skeletal nuscle. Am J Physiol Regul Integr Comp Physiol 284:R1304-R1305. 2004.
Wittenberg B.A., Wittenberg, J.B. Transport of oxygen in muscle.Ann. Rev. Physiol.51,857 -878 (1989).
Wittenberg J.B., Wittenberg B.A. Myoglobin function reassessed.J Exp Biol.2003; 206: 2011–2020.
Hoppeler, H., Billeter, R. Conditions for oxygen and substrate transport in muscles in exercising mammals. J. Exp. Biol. 160,263 -283 (1991).
Colli R. L’allenamento intermittente: Principi generali e metodologici (2004).
Christensen E.H., Hedman R., Saltin B. Intermittent and continuous running. Acta Physiol Scand 1960; 50: 269-87.
Ǻstrand I., Ǻstrand P.O., Christensen E.H.. Intermittent muscular work. Acta Physiol Scand 1960; 48: 448-53.
Clifford P.S., Hellsten Y. Vasodilatory mechanisms in contracting skeletal muscle. J Appl Physiol 2004;97:393-403.
Wray D.W., Donato A.J., Abhimanyu Uberoi J.P. Merlone, Richardson R.S. Onset exercise hyperaemia in humans: partitioning the contributors. J Physiol 565.3 (2005) pp 1053–1060.