Influencia del Contenido de Glucógeno Muscular en la Regulación Metabólica
Sandra M. Weltan, Andrew N. Bosch, Steven C Dennis y Timothy D Noakes
Department of Physiology, University of Cape Town Medical School, Observatory 7925, South Africa
Artículo publicado en el journal PubliCE del año 2014.
Publicado 7 de marzo de 2014
Resumen
El estado euglicémico se mantuvo en 13 sujetos que poseían un contenido de glucógeno muscular bajo [glucógeno bajo, euglicémicos (LGE), n = 8; glucógeno bajo, euglicémicos con hiperinsulinemia (LGEI), n = 5] y 6 sujetos con contenido de glucógeno muscular normal (NGE), mientras que el estado de hiperglicemia se mantuvo en 8 sujetos con contenido de glucógeno muscular bajo (LGH). Todos los participantes pedalearon durante 145 min a 70% del consumo de oxígeno máximo durante las infusiones. En el grupo LGEI la insulina se infundió a 0,2 mU kg-1 min-1. Durante el ejercicio, la tasa de intercambio respiratorio (RER) fue menor y la norepinefrina (noradrenalina) fue mayor en el grupo LGE que en el grupo NGE. La RER al comienzo del ejercicio fue igual en los grupos LGEI y LGH a la del grupo LGE pero no disminuyó como lo hizo en LGE. La concentración de ácidos grasos libres (FFA) fueron mayores y las concentraciones plasmáticas de insulina fueron mas bajas en el grupo LGE que en NGE, LGEI o LGH durante los primeros 45min de ejercicio. La tasa de infusión de glucosa (Ri) y la tasa de oxidación de glucosa (Rox) fueron mayores en LGH y LGEI que en NGE o LGE, y Ri alcanzó a Rox en todos los grupos excepto en LGH en el cual Ri fue mayor que Rox. La desaparición del glucógeno muscular fue mayor en NGE que en LGE, LGEI, o LGH, pero los últimos tres grupos no presentaron diferencias entre si. En conclusión, este estudio demostró que el bajo contenido de glucógeno muscular produce una disminución en la RER, un aumento en FFA, oxidación de grasas y en la norepinefrina tanto en reposo como durante el ejercicio, y no afecta Rox cuando la euglicemia se mantiene solo por la infusión de glucosa. La tasa de oxidación de glucosa (Rox) sólo aumentó con la insulina y la hiperglucemia.
Palabras clave: hiperglicemia, euglicemia, glucógeno muscular, tasa de intercambio respiratorio
INTRODUCCION
La disminución en la oxidación de carbohidratos (CHO), indicada por una menor tasa de intercambio respiratorio (RER) después de una dieta con bajo contenido de CHO (8, 10, 13), ha sido descripta en reposo (8, 13) y durante el ejercicio a diferentes intensidades (8, 10, 13). Además, el consumo de una dieta con bajo contenido de CHO o la realización de ayuno antes de realizar ejercicios se ha asociado con una disminución en las concentraciones plasmáticas de insulina (8, 10, 12) y lactato (10) y un aumento en la concentración plasmática de norepinefrina (8, 12), epinefrina (adrenalina) (8, 12), glucagón (8, 12), hormona de crecimiento (GH; ver la Referencia. 8), cortisol (8), glicerol (8, 13), cetona (8, 12) y ácidos grasos libres (FFA; ver las Referencia 8, 10, 12, 13). Sin embargo, no está claro si en estos estudios los efectos observados en el metabolismo de sustratos y las respuestas hormonales se debieron al agotamiento del glucógeno muscular o hepático o, a excepción de aquellos casos en los cuales se infundió glucosa durante el ejercicio (8, 12), se debieron a una "deficiencia general de CHO", es decir, una escasez de CHO totales disponibles para la oxidación. En algunos estudios, los sujetos realizaron un ayuno de toda la noche (10) o se volvieron hipoglucémicos a pesar de la ingesta una comida pequeña antes de realizar el ejercicio (13). En un esfuerzo por excluir los efectos de una deficiencia general de CHO, en algunos estudios se infundió glucosa durante el ejercicio (8, 12), pero, en un estudio (12), los sujetos que ingirieron una dieta con bajo contenido de CHO tenían un ayuno de toda la noche mientras que los sujetos del grupo control que consumieron una dieta normal consumieron una comida con 60% de CHO 3 horas antes del ejercicio; en el otro estudio (8), los sujetos realizaron un ayuno de toda la noche y la infusión de glucosa solo se inició una vez que los sujetos habían alcanzado el agotamiento.
Cuando el euglicemia se mantiene por la infusión de glucosa durante el ejercicio, la glucosa que desaparece de la circulación es remplazada por la glucosa infundida. Esto debe evitar cualquier efecto metabólico u hormonal como consecuencia de una inadecuada disponibilidad extra muscular y extra hepática de CHO. Por lo tanto si los efectos metabólicos del agotamiento de glucógeno descriptos en los estudios citados (8, 10, 12, 13) persisten en los sujetos que poseen un bajo contenido de glucógeno muscular, a pesar del mantenimiento de la euglicemia, esto indicaría que las respuestas están relacionadas específicamente a una menor disponibilidad intramuscular o intrahepática de CHO.
Debido a que la hiperinsulinemia tiene efectos mínimos en el consumo de glucosa hepática en ausencia de hiperglicemia (4), el efecto predominante de la infusión de insulina durante un ejercicio en el cual se mantiene la euglicemia, es un aumento en el consumo de glucosa muscular (5). Por lo tanto, si los efectos metabólicos del agotamiento de glucógeno son contrarrestados por la infusión de insulina durante los ejercicios en condiciones de euglucemia, los efectos de la disponibilidad intramuscular e intrahepática de CHO podrían ser diferenciados y proporcionarán evidencia que los efectos metabólicos descriptos previamente (8, 10, 12, 13) están específicamente relacionados con la disponibilidad intramuscular de CHO.
Finalmente, en los sujetos con un contenido de glucógeno normal, el mantenimiento de la hiperglicemia produce un aumento en la oxidación de glucosa durante ejercicio en comparación con el mantenimiento de la euglicemia (11). Sin embargo, a diferencia de la euglicemia, la tasa de oxidación de glucosa es menor que la tasa de infusión de glucosa cuando se mantiene la hiperglicemia durante el ejercicio (11). Por consiguiente, planteamos la hipótesis que el "exceso" de glucosa que no fue oxidada en los sujetos que tenían un contenido de glucógeno muscular normal durante la hiperglicemia (11) sería oxidado cuando disminuyera el glucógeno muscular.
Por consiguiente, el primer objetivo de este estudio fue investigar el efecto del contenido de glucógeno muscular bajo, sin fatiga concomitante, en la utilización de sustratos combustibles durante el ejercicio prolongado, de intensidad moderada manteniendo la euglicemia y manipulando las concentraciones de insulina plasmáticas para proporcionar una fuente alternativa de CHO intramuscular. Segundo, intentamos determinar si los efectos metabólicos y hormonales del bajo contenido de glucógeno muscular podrían ser superados proporcionando un exceso de CHO oxidables mediante la infusión intravenosa de glucosa.
MÉTODOS
Sujetos
Veintisiete ciclistas de sexo masculino entrenados en resistencia participaron en este estudio, que fue aceptado por el Comité de Ética e Investigación de la Facultad de Medicina de la Universidad de Ciudad del Cabo. Se seleccionaron aquellos ciclistas que entrenaban regularmente ≥250 km/semana y que había completado una competencia de ciclismo de 105km en <3,5 h. Las características de los sujetos se presentan en la Tabla 1. A medida que se ingirieron los marcadores radiomarcados y se obtuvieron las biopsias musculares y las muestras de sangre, se explicaron los procedimientos y los riesgos a los sujetos quienes posteriormente dieron su consentimiento informado por escrito.
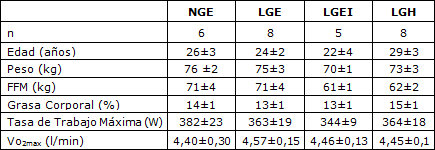
Tabla 1. Características de los sujetos. Los valores se expresan en forma de Media ± error estándar (SE); n= número de sujetos. LGE= Grupo con contenido de glucógeno muscular bajo y euglicémicos; NGE=Grupo con contenido de glucógeno muscular normal, y euglicémicos; LGEI= Grupo con contenido de glucógeno muscular bajo, euglicémicos e hiperinsulinemicos; LGH= Grupo con contenido de glucógeno muscular bajo e hiperglicémicos; FFM= Masa magra; VO2max= Consumo de oxígeno máximo. No se observaron diferencias significativas entre los grupos.
La dosis de radiación total recibida por cada sujeto fue aprox. 0,11 mSv. En la exposición a la radioactividad, una dosis de radiación de 1 mSv/año se considera segura para el público y para el ámbito profesional la dosis segura es de 20 mSv/año (comunicación personal, Dr. M. Shackelton, Depto. de Física Médica, Hospital Groóte Schuur, Ciudad del Cabo, Sudáfrica).
Mediciones Realizadas antes de Efectuar la Modificación del Contenido de Glucógeno
El primer día de la prueba, los sujetos consumieron un desayuno liviano (~1,200 kJ, 30g de CHO) 3 horas antes de llegar al laboratorio a las 9:15 AM. Posteriormente los sujetos fueron pesados y se les estimó el porcentaje de grasa corporal a partir de la suma de las mediciones de pliegues corporales de bíceps, tríceps, subescapular y suprailíaco, usando fórmulas estándar (7).
Determinación del Consumo de Oxígeno Máximo
El consumo de oxígeno máximo (VO2max) de cada sujeto se determinó durante un test de ejercicio incremental hasta el agotamiento. El ejercicio realizado en una bicicleta ergométrica con freno electrónico (Lode, Groningen, Países Bajos) comenzó con una tasa de trabajo equivalente a 3,3 W/kg masa corporal y primero se incrementó 50W después de 150s y luego 25W cada 150s hasta que la frecuencia de pedaleo cayera por debajo de 50 revoluciones/min (rpm). El consumo de oxígeno (VO2) se midió con un sistema computarizado en línea (Oxycon Alfa, Jaeger-Mijnhart, Países Bajos), y se registró la producción de potencia máxima y el VO2max. Esta información fue utilizada para ajustar la tasa de trabajo en las fases siguientes de la prueba para que cada sujeto realizara ejercicio a una intensidad equivalente a 70% de VO2max. Dado que las respuestas metabólicas y hormonales estarían relacionadas a la tasa de trabajo relativa y no a la absoluta (16), la tasa de trabajo fue ajustada durante la prueba (en caso de ser necesario) para mantener el ejercicio en esta intensidad.
Manejo del Contenido de Glucógeno Muscular
Después de realizar el test del VO2max, los sujetos descansaron durante 20 min y luego pedalearon durante otros 90 min a 70% de VO2max con intervalos de 5 min a 90% de VO2max cada 20 min para agotar el glucógeno muscular. Después de este procedimiento, los sujetos fueron asignados al azar a uno de los siguientes cuatro grupos: Contenido de glucógeno bajo y euglicémicos (LGE; n = 8); Contenido de glucógeno normal y euglicémicos (NGE; n = 6); Contenido de glucógeno bajo, euglicémicos e hiperinsulinémicos (LGEI; n = 5); contenido de glucógeno bajo e hiperglicemicos (LGH; n=8).
Los sujetos de los grupos con contenido de glucógeno bajo (LGE, LGEI, y LGH) consumieron una dieta con bajo contenido de CHO durante 48 h después del régimen de agotamiento. Se les proporcionó una lista opciones de alimentos que les proporcionarían una ingesta de energía diaria de aprox. 6800 kJ (16% de CHO). Los sujetos del grupo NGE siguieron una dieta sin restricciones. Se instruyó a los participantes para que realizaran sólo entrenamiento liviano el segundo día (~1 h de ciclismo de baja intensidad). En los grupos anteriores se estableció la dieta con bajo contenido de CHO junto con entrenamiento liviano durante este período para limitar la nueva síntesis de glucógeno muscular, mientras se permitía la recuperación de los efectos agotadores de la prueba de agotamiento de glucógeno. En contraste, en el último grupo la dieta normal combinada con entrenamiento liviano permitió la recuperación del contenido normal de glucógeno muscular.
Protocolo Experimental después de la Modificación del Contenido de Glucógeno Muscular
Mediciones en Reposo
Nuevamente se solicitó a los sujetos que consumieran un desayuno liviano (~1200 kJ, 30g de CHO) 3 horas antes de arribar al laboratorio, a las 9:15 AM, en el tercer día de evaluación. Poco después que los sujetos arribaran al laboratorio, se les colocó en la vena del antebrazo derecho una cánula de teflón de calibre 18 (Jelco; Johnson y Johnson, Halfway House, Sudáfrica) y la misma fue conectada a una llave de paso de tres vías (Uniflex; Mallinckrodt Medical, HennefSieg, Alemania). En esta etapa no se tomaron muestras de sangre por si acaso la punción venosa produjera un aumento en las concentraciones de catecolaminas circulantes. Para la determinación del VO2 y la producción de dióxido carbono (VCO2) en reposo, los sujetos permanecieron sentados y relajados y posteriormente se les solicitó una muestra de orina para la determinación de cetonas urinarias. Veinte minutos después de la colocación de la cánula se obtuvo una muestra de 20ml de sangre para medir las concentraciones plasmáticas de glucosa, lactato, insulina, glucagón, epinefrina, norepinefrina y las concentraciones séricas de FFA y GH. Alícuotas de la muestra de sangre se colocaron en tubos que contenían oxalato de potasio y fluoruro de sodio (glucosa, lactato), heparina de litio (insulina, epinefrina, norepinefrina) y EDTA y 100 µl de Aprotinina (Midran; Novo Nordisk, Johannesburgo, Sudáfrica) (glucagón) y en tubos separadores de suero (Beckton-Dickinson) para determinar FFA y GH.
Los tubos fueron colocados inmediatamente en hielo y después de 20 min, fueron centrifugados a 500g a 4°C durante 20 min. Luego el sobrenadante (plasma o suero) fue transferido a tubos de plástico que fueron sellados y mantenidos a -20°C para luego realizar las determinaciones de glucosa, lactato, insulina y glucagón o fueron colocados a -80°C para las determinaciones posteriores de epinefrina, norepinefrina, GH y FFA.
Desaparición del Glucógeno Muscular en las Piernas
Se extrajeron muestras del músculo vastus lateralis antes de comenzar e inmediatamente después de finalizar el ejercicio por medio de una técnica de biopsia descrita previamente (1). Las muestras fueron colocadas inmediatamente en nitrógeno líquido para la posterior determinación de la concentración de glucógeno muscular por medio de métodos convencionales (24).
Infusión de Glucosa e Insulina
Una cánula de teflón calibre 20 se colocó en una vena del antebrazo izquierdo para la infusión de glucosa (todos los grupos) e insulina (grupo LGEI) durante los 145 min del ejercicio realizado en bicicleta ergométrica a 70% del VO2max. La concentración de glucosa plasmática se mantuvo en ~4,5 mmol/1 (sujetos euglicémicos) o ~9 mmol/1 (sujetos hiperglucémicos) infundiendo una solución estéril de glucosa 25% masa/volumen utilizando las técnicas de pinzamiento euglicémicos (LGE, NGE), euglicémicos, hiperinsulinémicos (LGEI) hiperglicémicos (LGH) (6), modificadas por medio del agregando de tasas conocidas de aumento en la oxidación de glucosa sanguínea durante el transcurso del ejercicio a 70% de VO2max obtenidas en investigaciones previas en este laboratorio (1). En el grupo LGEI, la insulina (Actrapid; Novo Nordisk) fue infundida en solución salina normal en una velocidad determinada por un estudio piloto de 0,2 mU3 kg-13 min-1. Todas las infusiones fueron controladas usando bombas de infusión a jeringas automáticas calibradas (Laboratorios Travenol, Hooksett, NJ). Las muestras de sangre se obtuvieron en intervalos de 5 min y se determinó la concentración de glucosa en sangre con un medidor de glucosa de bolsillo (Accutrend; Boehringer Mannheim, Mannheim, Alemania) para ajustar la velocidad de infusión de glucosa, con el fin de mantener la concentración de glucosa sanguínea seleccionada. La exactitud del medidor de glucosa se verificó por comparación con un analizador de glucosa Beckman (Glucose Analizer2; Beckman Instruments, Fullerton, CA). Al final del ejercicio, se recolectó una segunda muestra de orina para determinar si la infusión de glucosa había producido glucosuria.
Determinaciones de la Oxidación de Sustratos y de las Concentraciones de Hormonas durante el Ejercicio
Las tasas de oxidación de glucosa fueron determinadas mediante un radioisótopo de glucosa [U-14C]. Doscientos kilo-becquerels de glucosa [U-14C] 7400 kBq/mmol (Amersham International, Buckinghamshire, REINO UNIDO) se agregaron a 1,8 litros de un placebo acuoso con sabor artificial. Los estudios piloto demostraron que la actividad específica plasmática de glucosa [U-14C], la actividad específica de 14CO2 y las tasas calculadas de oxidación de glucosa (descriptas en el apartado de Actividad específica de glucosa y lactato plasmáticos) eran similares independientemente de si el marcador había sido ingerido o infundido. El marcador fue ingerido siguiendo un protocolo fijo para posteriormente incluir un estudio en el cual la glucosa había sido ingerida durante el ejercicio. Mientras los sujetos realizaban la entrada en calor (~5 min) antes del test de ejercicios de 145-min, los sujetos bebieron un bolo de la bebida de 400-ml de que contenía 111 kBq/1 del radioisótopo glucosa [U-14C]. Cada 10 min después del comienzo del test de ejercicio, ingirieron 100 ml adicionales, lo que hace un total de 600 ml/h.
Después de 5 min de ejercicio a 70% de VO2max y en intervalos de 20-min durante el ejercicio, se tomaron muestras de sangre de ~20 ml y las mismas fueron procesadas siguiendo los procedimientos descriptos para las posteriores mediciones de actividad específica plasmática de glucosa [U-14C] y para las mediciones de glucosa, insulina, glucagón, epinefrina, norepinefrina, FFA y GH.
Determinación de VO2, VCO2 y 14CO2 durante el Ejercicio
En el mismo momento en que se obtenían las muestras de sangre, se realizó la determinación de VO2 y VCO2 usando un sistema informatizado en línea (Oxycon Alfa, Jaeger-Mijnhart, Países Bajos) y los gases expirados fueron recolectados para la posterior determinación de la actividad específica de 14CO2. La mezcla para capturar el dióxido de carbono ha sido descripta previamente (1) y consiste en 1 ml de hidróxido de hiamina en metanol (Packard), 1 ml de etanol y dos gotas del indicador fenolftaleína al 1%. El aire expirado se hizo burbujear en la mezcla de captura hasta que la solución se tornara clara, punto en el cual se había absorvido1 mmol de dióxido de carbono. Luego se agregó la mezcla de líquido de centelleo (10 ml de Ready Gel Beckman) y se determinó la radioactividad de 14CO2 en un contador de centelleo (Packard Tri-Carb 1500, Downer´s Grove, IL). Todas las cuentas 14C fueron corregidas automáticamente para eliminar la extinción y la radioactividad de fondo.
Análisis de Laboratorio
Tasa de Oxidación Total de CHO y de Grasas
Las tasas de oxidación de CHO y de grasas fueron calculadas a partir de los valores de VO2 y VCO2 (1/min) utilizando las siguientes fórmulas
CHO (g/min) =4,55 VCO2 – 3,21 VO2
Grasa (g/min) = 1,67 VO2 – 1,67 VCO2
La oxidación total de CHO y grasas se calculó a partir de la curva tasa versus tiempo del test de 145 min de ejercicio.
Concentraciones Plasmáticas de Glucosa y de Lactato
Las concentraciones plasmáticas de glucosa fueron determinadas mediante el método de glucosa oxidasa utilizando un analizador de glucosa (Glucose analyzer 2; Beckman). Las concentraciones de lactato fueron determinadas en las mismas muestras de plasma mediante determinación enzimática (Lactate PAP, bioMérieux, Lyon, Francia) por espectrofotometría (Beckman, modelo 35)
Actividad Específica de Glucosa y Lactato Plasmáticos
Una alícuota de 1 ml de cada una de las muestras de plasma usadas para la determinación de glucosa fueron desproteinizadas por la adición de 70 µl de HClO4 (3,5 M), qué también sirvió para eliminar el [14C]bicarbonato como 14CO2. Luego las muestras fueron centrifugadas a 4°C y el sobrenadante libre de proteínas fue extraído y colocado en frío. A continuación el precipitado fue lavado por resuspención en 0,76 ml de 0,13 M HC1O4, fue centrifugado nuevamente y el sobrenadante obtenido se agregó al otro sobrenadante recolectado. Luego se repitió nuevamente el último paso. El pH de los sobrenadantes juntos se llevó a 7,0 y 8,0 mediante la adición de 132 µl de K2CO3 3M en buffer tris (hidroximetil) aminometano (Tris)-HCl, 0,01M. La muestra se guardó en hielo durante 10 min y luego fue nuevamente centrifugada para extraer el precipitado. Luego el sobrenadante fue pasado a través de una columna de intercambio aniónico (Extra-sep RC SAX; Chromatography Research Supplies, Addison, IL). El volumen vacío que contenía un poco de glucosa fue recolectado y la glucosa restante fue eluída con agua destilada (3x1 ml). Luego se eluyó el lactato con 2 x 1 ml de CaCl2 1M (pH 2). Se procesaron y se corrieron cinco muestras control simultáneamente con las muestras de determinación cada vez que se realizó el análisis y las mismas se utilizaron para confirmar la separación completa de glucosa de los aniones que contenían carbono.
Para reducir la proporción agua-mezcla de líquido de centelleo durante el conteo de radioactividad, las fracciones eluídas (~7 ml) fueron evaporadas casi hasta estar secas (~0,3 ml) a 60°C durante ~20 h. Luego se agregó 1 mililitro de agua destilada al residuo y esto fue mezclado con 15 ml de la mezcla de líquido de centelleo Gel Lista para determinaciones de radioactividad de 14C tal como se describió previamente. Dado que la alícuota de 1 ml de plasma utilizada para el conteo de radiación provenía de la misma muestra de plasma utilizada para la determinación de concentración de glucosa, la actividad específica en desintegraciones por minuto por milimol de glucosa podría calcularse después de que la pequeña (~4%) pérdida de radioactividad durante la preparación de la muestra fuera determinada en las muestras de plasma control. Después del conteo de centelleo, se encontró que las desintegraciones por minuto de lactato eran demasiado bajas para ser confiables para calcular la actividad específica. Por lo tanto estos datos no se utilizaron para calcular la oxidación de lactato. La tasa de oxidación de glucosa (Rox) se calculó a partir de la siguiente fórmula:
Rox = [(14CO2 x 6)/SAGlc] x VCO2 x 1,35
Donde, 14CO2 x 6 es el valor de las desintegraciones por minuto por milimol multiplicado por 6 (6 átomos/moléculas de carbono en glucosa[14C]), SAGlc es la actividad específica plasmática de glucosa [14C] en desintegraciones por minuto por milimol y 1,35 es el número de gramos de glucosa oxidados para producir 1 litro de dióxido de carbono. Las unidades de VCO2 son litros por minuto. La oxidación de glucosa total se calculó como el área debajo de la curva de la tasa de oxidación de glucosa en función del tiempo.
Determinación de las Concentraciones Plasmáticas de Insulina y Glucagón y de las Concentraciones Séricas de GH
Las concentraciones de insulina, glucagón y GH fueron determinadas mediante técnicas de radioinmunoanálisis (Coat-A-Count Insulin and Double Antibody Glucagon, Diagnostic Products, Los Angeles, CA; y radioinmunoanálisis para GH humana, Pharmacia, Uppsala, Suecia).
Concentraciones Plasmáticas de Catecolaminas
Las concentraciones de catecolaminas fueron determinadas por medio de cromatografía líquida de alta eficacia (HPLC) con detector electroquímico. A una alícuota de 1,5 ml de plasma en un tubo de polipropileno se le agregó un estándar interno (10 pg/ml dihidrobenzilamina en HC1, 0,1 N), 0,4 ml de buffer Tris-HCl 2M (pH 8,7) y 10 mg de óxido de aluminio lavado en ácido. La mezcla se agitó durante 15 min y luego el sobrenadante fue descartado y el óxido de aluminio precipitado se lavó tres veces con 1 ml de buffer Tris-HCl 0,02 M (pH 8,1). A continuación, el líquido fue aspirado cuidadosamente y se le agregó 0,1 ml 1% vol/vol de ácido acético glacial y las muestras fueron agitadas y luego centrifugadas a 2000 rpm durante 15 min. El sobrenadante de color claro fue transferido a tubos limpios y fue colocado a -20°C por un lapso no mayor a 2 días antes de realizar la cromatografía. El sobrenadante final se inyectó en la columna de HPLC (Resolve C18-Novapak 3,9 x150 mm, tamaño de partícula 5 µl, temperatura ambiente, Bomba Waters 510, Inyector Waters 712 Wisp) en un volumen de 15 µl. La fase móvil estaba compuesta por acetato de sodio 50 mM, ácido cítrico 20 mM, 1-octano-sulfonato de sodio 3,75 mM, di-n-butilamina 1mM y NaEDTA 0,135 mM en metanol 95%, pH 4,3. La velocidad de flujo fue 1,0 ml/min (presión <14,000 kPa), el potencial de trabajo fue +0,6 V contra el electrodo de referencia Ag/AgCl, la escala de sensibilidad máxima de 0,5 nA y constante de tiempo fijada en 2s (filtro activo encendido). El volumen de la celda era 2,5 µl. La integración fue realizada mediante un integrador del tipo Spectra-Physics SP4400 Chrom Jet Recording Integrator utilizando los siguientes parámetros: atenuación, 64,; velocidad de la carta, 0,5 cm/min; ancho máximo, 6;umbral máximo, 2000.
Concentraciones Séricas de FFA
Las concentraciones séricas de FFA se determinaron mediante una técnica enzimática de colorimetría (Half micro test; Boehringer Mannheim; ver la Referencia 29).
Muestras de Orina
Las muestras de orina recolectadas antes y al final del ejercicio fueron analizadas para la presencia de cetonas y glucosa utilizando pruebas de orina con tira reactiva (Keto-Diabur-Test 5000; Boehringer Mannheim, Lewes, Sussex Oriental, UK).
Análisis Estadísticos
Todos los resultados se presentan en forma de Media ± SE. La significancia estadística (P <0,05) de las diferencias entre los grupos se evaluó mediante un análisis de la varianza con medidas repetidas de dos vías a lo largo del tiempo, seguido por el test de Tukey para n desiguales. Para los datos individuales se utilizó el test t de muestras desapareadas. Para algunas de las mediciones hormonales, se aplicó el test de correlación de Spearman en las mediciones del área debajo de la curva.
RESULTADOS
En la Tabla 1 se presentan las características de los sujetos. No se observaron diferencias significativas entre los grupos en ninguno de los parámetros observados.
Pre-ejercicio
Las concentraciones de glucógeno muscular pre-ejercicio fueron significativamente más altas en NGE que en LGE, LGEI, o LGH (P <0,05; Tabla 2). Al comparar los sujetos con contenido de glucógeno muscular bajo con los sujetos con contenido de glucógeno muscular normal, las concentraciones séricas de FFA y de norepinefrina plasmáticas en reposo antes del ejercicio fueron más altas (1,05±0,16 vs. 0,38±0,08 mmol/1 y 4,71±0,43 vs. 2,92±0,37 nmol/1, respectivamente) y la tasa de intercambio respiratorio (RER) fue mas baja (0,76±0,03 vs. 0,88±0,03; P <0,05; Figura 1). En contraste, no se observaron diferencias significativas en las concentraciones en reposo de glucosa plasmática (4,48±0,12 vs. 5,22±0,41 mmol/1, glucógeno muscular bajo versus glucógeno muscular normal, respectivamente), lactato (1,31±0,10 vs. 1,52±0,16 mmol/1), insulina (4,29±0,63 vs. 5,03±0,37 uU/ml), glucagón (92±4 vs.105±8 pg/ml), epinefrina (0,16±0,06 vs. 0,06±0,01 nmol/1), ni en GH (14±4 vs. 23±12 mU/1) entre los grupos de sujetos con contenido de glucógeno muscular bajo y los grupos de contenido de glucógeno muscular normal. Las muestras de orina Pre y Post ejercicio arrojaron resultados negativos para cetonas y glucosa en el examen con tiras reactivas.
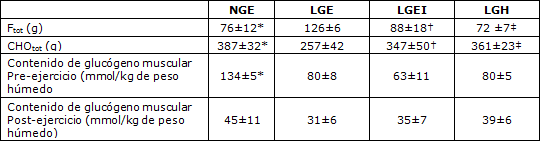
Tabla 2. Oxidación total de carbohidratos y de grasas durante el ejercicio de ciclismo de 145 min y contenido de glucógeno muscular Pre y Post ejercicio en los grupos de sujetos NGE, LGE, LGEI y LGH. Los valores se expresan en forma de Media ± SE. CHOtot = Oxidación total de carbohidratos calculada a partir de los datos de intercambio de gases; Ftot= oxidación total de grasas calculada a partir de los datos de intercambio de gases. *Se observaron diferencias significativas entre NGE y LGE (P<0,05); †se observaron diferencias significativas entre LGE y LGEI (P<0,05); ‡ se observaron diferencias significativas entre LGE y LGH (P<0,05).
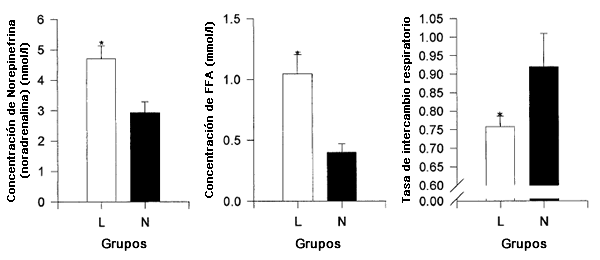
Figura 1. Concentraciones plasmáticas de norepinefrina (noradrenalina), concentraciones séricas de ácidos grasos libres ([FFA]) y tasa de intercambio respiratorio (RER) en reposo en los sujetos con contenido de glucógeno muscular bajo (L) y en sujetos con contenido de glucógeno muscular normal (N). *Se observaron diferencias significativas (P<0,05).
Test de Ejercicio
Los valores de VO2 durante el ejercicio se presentan en la Tabla 3. El VO2 no fue significativamente diferente entre los grupos y no cambió significativamente durante la duración del test, cuando el trabajo se mantuvo a 70% de VO2max.
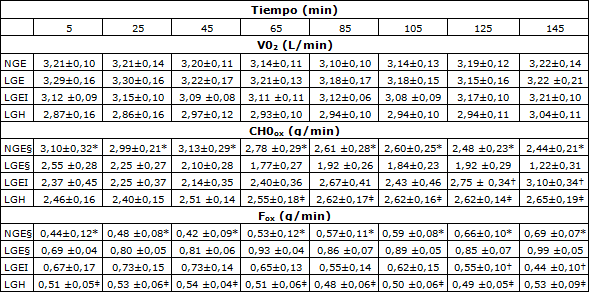
Tabla 3. Datos correspondientes al intercambio gaseoso en estado estable y tasa de oxidación de carbohidratos y grasas durante el ejercicio de ciclismo de145 min en los grupos NGE, LGE, LGEI y LGH. Los valores se expresan en forma de Media ± SE. CHOox= Tasa de oxidación de carbohidratos; Fox= Tasa de oxidación de grasas. *Se observaron diferencias significativas entre los grupos NGE y LGE (P<0,05); †Se observaron diferencias significativas entre los grupos LGE y LGEI (P<0,05); ‡ Se observaron diferencias significativas entre los grupos LGE y LGH (P<0,05); § se observaron cambios significativos a lo largo del tiempo.
La tasa de intercambio respiratorio (RER) (Figura 2), la oxidación total de grasas durante el ejercicio de 145 min, la oxidación total de CHO (Tabla 2), las tasas de oxidación de CHO durante el ejercicio y las tasas de oxidación de grasas fueron similares en LGEI, LGH y NGE, pero en el grupo LGE (P <0,05), RER, la oxidación total de CHO y la tasa de oxidación de CHO (Tabla 3) fueron significativamente menores y la oxidación total de grasas (Tabla 2) y tasa de oxidación de grasas (Tabla 3) fueron significativamente superiores. En los grupos LGEI y LGH, en el comienzo del ejercicio la RER (Figura 2) fue igual que en el grupo LGE pero no cambió significativamente durante el transcurso del ejercicio y así, al final del ejercicio, fue mayor que en LGE y no presentó diferencias significativas con NGE. En LGE y NGE, la tasa de oxidación de CHO disminuyó significativamente a lo largo del ejercicio y la tasa de oxidación de grasas aumentó (P <0,05), esto no se observó en los grupos LGEI o LGH. La concentración de FFA (Figura 3A) fue significativamente mayor en LGE que NGE y LGH durante los primeros 45 min del ejercicio (P<0,05) y aumentó significativamente durante el transcurso del ejercicio en los dos grupos anteriores. En el grupo LGEI, FFA disminuyó significativamente durante el ejercicio (P<0,05) y fue significativamente (P<0,05) menor que en LGE. Durante los primeros 25 min de ejercicio el valor de FFA fue significativamente más alto en LGH que en NGE pero después de esto disminuyó y no fue significativamente diferente de los valores del grupo NGE.
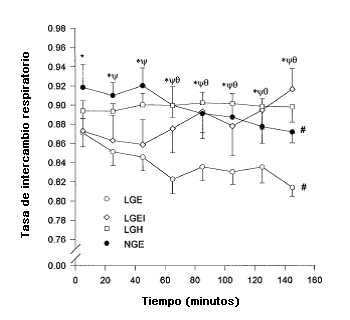
Figura 2. Tasa de intercambio respiratorio (RER) en los sujetos con contenido de glucógeno muscular bajo y euglicemia (LGE), contenido de glucógeno muscular normal y euglicemia (NGE), contenido de glucógeno muscular bajo, euglicemia e hiperinsulinemia (LGEI) y contenido de glucógeno muscular bajo e hiperinsulinemia (LGH). Ψ Se observaron diferencias significativas entre LGE y LGH (P<0,05); Ɵ se observaron diferencias significativas entre LGE y LGEI (P<0,05); *Se observaron diferencias significativas entre LGE y NGE; # se observó una disminución significativa con el tiempo (P<0,05).
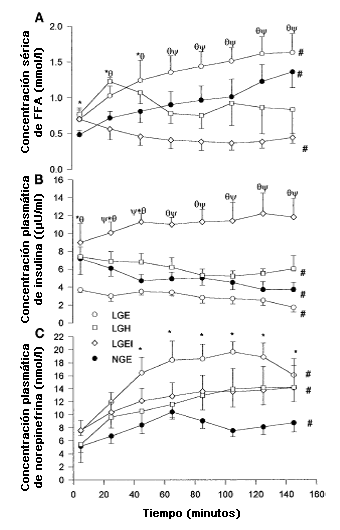
Figura 3. Concentración sérica de [FFA] (A), insulina plasmática (B) y concentraciones plasmáticas de norepinefrina (C) en los sujetos de los grupos LGE, LGEI, LGH y NGE. *Se observaron diferencias significativas entre LGE y NGE (P <0,05); Ψ se observaron diferencias significativas entre LGE y LGH (P<0,05); ƟSe observaron diferencias significativas entre LGE y LGEI (P <0,05); #se observaron cambios significativos a lo largo del tiempo (P <0,05).
Las concentraciones medias de glucosa plasmática (Figura 4A) después de 5 min de ejercicio fueron 4,9±0,1, 5,0±0,1, 5,2 ±0,1, y 9,0±0,1 mmol/1 para LGE, NGE, LGEI y LGH, respectivamente, con un coeficiente de variación dentro de los grupos de 3, 6, 6, y 3% respectivamente. No se encontró glucosa en orina en ningún participante al final del test. Las concentraciones plasmáticas de lactato después de 5 min de ejercicio fueron 2,37±0,44, 2,78±0,78, 2,19±0,25 y 1,70±0,26 mmol/1 y disminuyeron durante el transcurso del ejercicio a 2,23±0,48, 1,34±0,31, 1,76±0,34, y 1,56±0,29 mmol/1, en LGE, NGE, LGEI, y LGH, respectivamente. Sólo la disminución observada en el grupo NGE fue estadísticamente significativa (P<0,05).
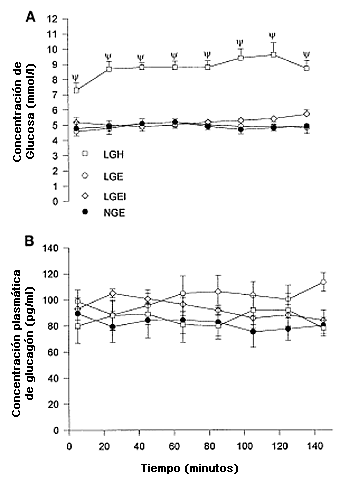
Figura 4. Concentraciones plasmáticas de glucosa (A) y glucagón (B) en los grupos LGE, LGEI, LGH y NGE. Ψ Significativamente superior en LGH que en LGE, LGEI, y NGE. No se observó ningún cambio significativo con el tiempo.
La tasa de infusión de glucosa necesaria para mantener las concentraciones de glucosa sanguínea en aproximadamente 5 mmol/1 (LGE, NGE, y LGEI) o aprox. 9 mmol (LGH; Figura 5A) fue significativamente mayor en LGH que en LGEI y, en estos dos grupos, fue significativamente más alta que en LGE y NGE (P<0,05). La tasa de infusión de glucosa no presentó diferencias entre los últimos dos grupos. En todos los grupos, la tasa de infusión de glucosa aumentó progresivamente a lo largo del ejercicio, con un marcado aumento en LGE entre los 80 y 100 min de ejercicio. La cantidad total de glucosa infundida durante los 145 min de ejercicio (Figura 6) fue más alta en LGH que en LGEI (1,484±125 vs. 956±121 mmol; P<0,05) y fue más alta en estos dos grupos que en NGE o LGE (403±107 y 342±69 mmol, respectivamente).
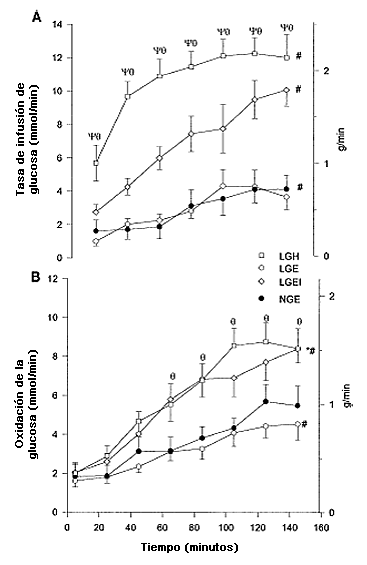
Figura 5. Tasa de infusión de glucosa (A) y tasa de oxidación de glucosa (B) en los grupos LGE, LGEI, LGH y NGE. Ψ Significativamente mayor en LGH que en LGEI; Ɵ Significativamente mayor en LGEI que en LGE y en NGE; *Significativamente mayor en LGH que en LGE y NGE; #Se observó un aumento significativo a lo largo del tiempo (P <0,05)
Las tasas de oxidación de glucosa (Figura 5B) aumentaron progresivamente durante el transcurso del ejercicio en todos los grupos, y las tasas máximas en LGH y LGEI fueron 8,3±0,11 y 8,4±0,7 mmol/min (1,51±0,13 y 1,51±0,19 g/min), respectivamente, en comparación con 5,6±0,9 y 4,5±0,8 mmol/min (1,03±0,16 y 0,82±0,15 g/min) en NGE y LGE, respectivamente (P<0,05). La oxidación total de glucosa (Figura 6) no fue significativamente diferente entre LGE y NGE (389±44 vs. 513±61 mmol; 70±8 vs. 92±11 g), pero ambos grupos presentaron valores menores que los de los grupos LGH y LGEI (840±74 y 785±83 mmol; 151±15 y 141±15 g, respectivamente; P<0,05). En LGE, LGEI y NGE, la oxidación total de glucosa igualó a la cantidad total de glucosa infundida (Figura 6) y mostró un aumento correspondiente durante el transcurso del ejercicio (Figura 5, A y B). Sin embargo, en LGH, se oxidó sólo 66% de la cantidad total de glucosa infundida. La contribución de la glucosa con la oxidación total de CHO se incrementó significativamente {P<0,05) durante el test en todos los grupos a 51±10, 43±7, 56±8, y 58±5% en LGE, NGE, LGEI y LGH, respectivamente (P<0,05 para NGE versus LGH y LGEI).
La contribución de la oxidación de la glucosa con la energía total también fue significativamente (P<0,05) superior en LGH y LGEI que en NGE o LGE, alcanzando valores máximos de 41±4, 37±3, 26±3 y 21±2%, respectivamente.
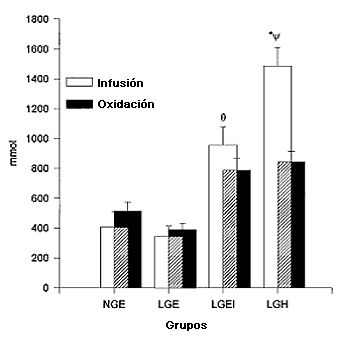
Figura 6. Comparación de la cantidad total de glucosa infundida durante los 145 min de ejercicio y oxidación total de glucosa durante el mismo período. *La infusión de glucosa fue significativamente mayor en LGH que en LGEI (P<0,05), Ɵ La infusión y oxidación de glucosa fueron significativamente mas altas en LGEI que en NGE y LGE (P<0,05); Ψ La oxidación de glucosa en LGH fue significativamente diferente de la infusión, no fue significativamente diferente de la oxidación en LGEI y fue significativamente mayor que en NGE y en LGE (P<0,05).
Las concentraciones de glucógeno muscular (Tabla 1) al comienzo del ejercicio fueron significativamente mayores en NGE que LGE, LGEI o LGH. La desaparición del glucógeno muscular (Figura 7) fue mayor (P<0,05) en NGE que en LGE, LGEI o LGH (90±11 vs. 49±9, 28±14, y 41±4 mmol/kg de peso húmedo, respectivamente), pero los últimos tres grupos no presentaron diferencias significativas. No se observó ninguna diferencia significativa en las concentraciones de glucógeno muscular entre los grupos al final del ejercicio (Tabla 1).
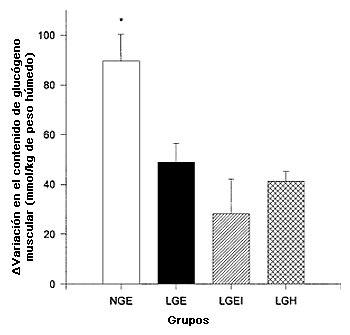
Figura 7. Agotamiento del glucógeno muscular en los sujetos de los grupos LGE, LGEI, LGH y NGE. *Valor significativamente mayor (P<0,05) en NGE que en LGE, LGEI y LGH.
Las concentraciones de insulina plasmática (Figura 3B) fueron significativamente (P<0,05) superiores en LGEI que en NGE, LGH o LGE a lo largo del ejercicio y en NGE fueron significativamente mas altas (P<0,05) que en LGE hasta 45 min. Se observó un aumento significativo (P<0,05) en las concentraciones de insulina plasmática en el trascurso del ejercicio en LGEI y una disminución significativa (P<0,05) en LGE y NGE. En contraste, no se observaron diferencias significativas entre los grupos en las concentraciones plasmáticas de glucagón (Figura 4B) el cual no presentó variaciones significativas durante el ejercicio.
Las concentraciones plasmáticas de norepinefrina (Figura 3C) aumentaron significativamente en el grupo LGE hasta los 125 min de ejercicio y en NGE hasta los 65 min de ejercicio y a partir de allí no se observaron cambios significativos, mientras que en los grupos LGEI y LGH, la norepinefrina aumentó a lo largo del ejercicio (P<0,05). Las concentraciones plasmáticas de norepinefrina fueron significativamente (P<0,05) superiores en LGE que en NGE a lo largo del ejercicio y en LGEI y LGH tomaron valores intermedios entre LGE y NGE pero no fueron significativamente diferentes de los valores de LGE y NGE. Las concentraciones plasmáticas de epinefrina en LGE, NGE, LGEI y LGH a los 5 min de ejercicio fueron 0,06±0,001, 0,07±0,01, 0,68±0,07, y 0,06±0,01 nmol/1, respectivamente (P<0,05 para LGEI versus LGE, LGH, y NGE) y no variaron significativamente desde el inicio a lo largo del ejercicio en LGE, LGH, y NGE. En LGEI, durante todo el ejercicio la epinefrina se mantuvo más alta que en LGE o NGE (P<0,05) pero no cambió significativamente con el tiempo. Las concentraciones séricas medias de GH fueron 58±16, 40±23, 67±12, y 11,72±4,27 pg/ml en LGE, NGE, LGEI, y LGH, respectivamente, pero no se observó ninguna diferencia significativa en el área debajo de la curva y las concentraciones no cambiaron significativamente con el tiempo.
DISCUSIÓN
Los resultados más significativos de este estudio fueron que la tasa de oxidación de glucosa no estuvo influenciada por el nivel de glucógeno muscular, es decir, no fue diferente entre los grupos NGE y LGE que disminuyeron el contenido de glucógeno muscular en el comienzo de ejercicio produciendo un cambio hacia la oxidación de lípidos y que tanto la infusión de insulina como la hiperglicemia neutralizaron los efectos metabólicos del bajo contenido de glucógeno (Figura 8).
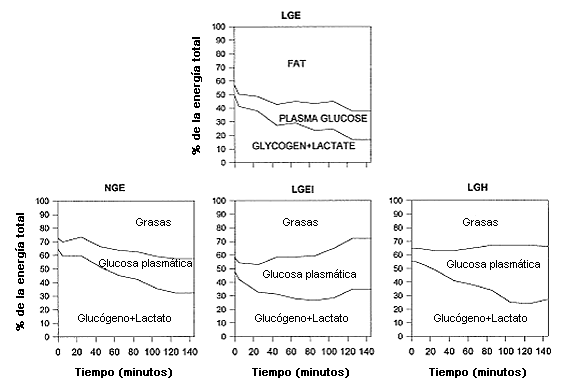
Figura 8. Efectos metabólicos globales de 1) agotamiento del glucógeno durante la euglicemia (LGE contra NGE), 2) concentraciones plasmáticas de glucosa si el contenido de glucógeno muscular es bajo (LGE contra LGH) al comienzo de ejercicio, y 3) la infusión de insulina en el agotamiento del glucógeno (LGE contra LGEI contra NGE). Grasas, oxidación de grasas como % del gasto de energía total; glucosa, oxidación de glucosa como % del gasto de energía total; glucógeno + lactato, oxidación de carbohidratos diferentes a la glucosa (glucógeno y productos con 3 carbonos) como % del gasto de energía total.
Como se observó en otros estudios (8, 13), la RER fue menor y las concentraciones séricas de FFA y de norepinefrina plasmáticas fueron más altas en reposo en los sujetos con contenido de glucógeno muscular bajo (Figura 1). Si bien previamente se ha informado el efecto de las concentraciones en reposo del bajo contenido de glucógeno muscular sobre RER (13) y FFA (8) en estos estudios (8, 13), las concentraciones de glucosa plasmática en reposo fueron menores en los sujetos con un contenido de glucógeno muscular bajo; por lo tanto, no podemos afirmar con certeza que fue la baja concentración de glucógeno y no la baja concentración de glucosa sanguínea lo que provocó los aumentos en RER y FFA. Sin embargo, en el presente estudio las concentraciones de glucosa plasmáticas en reposo eran normales y no fueron diferentes entre los grupos, probablemente porque los sujetos habían ingerido aprox. 64 g de CHO diariamente, 30 g de los cuales se consumían en una mezcla de alimentos cada mañana y 3 horas antes del test. Por lo tanto la menor RER y el aumento en FFA pueden ser atribuidos a un menor contenido de glucógeno muscular o hepático o a ambos. El contenido de glucógeno hepático debería ser bajo puesto que se ha demostrado que disminuye 22-55 mmol/kg de peso húmedo después de seguir durante 3 días una dieta con bajo contenido de CHO (22). Si 29% (15) de los CHO ingeridos en la comida de la mañana fuera incorporado por los tejidos esplácnicos, con una masa hepática de 1,8 kg, el contenido de glucógeno hepático permanecería muy bajo en 49-82 mmol/kg peso húmedo después de la comida. Además, con la infusión de glucosa sólo se produce una recuperación moderada del glucógeno hepático, incluso en aquellos sujetos en reposo (23). Esto fue demostrado en el estudio de Nilsson y Hultman (23) en el cual la infusión de glucosa a una tasa media de 5,8 mmol/min en sujetos en reposo durante 4 h resultaba en un aumento en el contenido de glucógeno hepático de sólo 76 mmol/kg de peso húmedo, aunque las concentraciones de glucosa plasmáticas seguían siendo >10 mmol/1 y aumentaron hasta un valor máximo de ±20 mmol/1 después de 90 min. Por lo tanto es improbable que se produjera la recuperación del glucógeno hepático durante los tests. Sin embargo, en los sujetos con bajo contenido de glucógeno muscular la baja RER se recuperó en los grupos LGEI y LGH hasta valores similares a los del grupo NGE como resultado de la infusión de insulina y de glucosa, respectivamente (Figura 2). Dado que la insulina en ausencia de hiperglicemia (grupo LGEI) aumenta el consumo de glucosa muscular (37) pero no el de glucosa hepática (4), al mayor valor de RER en LGEI y LGH que en LGE sería probablemente el resultado de un aumento en la oxidación de glucosa (Figura 5B) como consecuencia de un aumento en el consumo de glucosa muscular (5, 37).
El aumento significativo en la tasa de oxidación de glucosa durante el transcurso del ejercicio en todos los grupos, pero particularmente la similitud en el aumento entre los grupos LGE y NGE (Figura 5B), concuerda con lo observado en dos estudios recientes en los que no se observó ninguna diferencia en el consumo de glucosa entre los sujetos con contenido de glucógeno bajo o normal (10) y ninguna diferencia en la oxidación de glucosa entre los sujetos con contenido de glucógeno alto o normal (1). Esto indica que no es la disminución gradual en el contenido de glucógeno muscular lo que provoca el aumento progresivo en la oxidación de glucosa durante el ejercicio.
Cuando se considera la duración completa del ejercicio, la RER media no fue significativamente diferente entre los grupos NGE y LGH. Sin embargo se observaron diferencias, entre estos grupos en la fuente de CHO utilizada. En LGH, la contribución de la glucosa a la oxidación total de CHO se incrementó rápidamente, alcanzando un valor de 58±5% a los 105 min, pero en el grupo NGE alcanzó sólo 31±4% en ese momento. El último aumentó a 43±7% durante los últimos 45 min de ejercicio. Dado que el contenido de glucógeno no tiene influencia en la tasa de oxidación de glucosa, tal como se discutió previamente, la mayor tasa de oxidación de glucosa en LGH puede ser atribuida a la elevada concentración de glucosa prevaleciente o a la hiperinsulinemia concomitante o a ambos factores.
La mayor desaparición de glucógeno muscular en NGE que en LGE, LGEI o en LGH (Figura 7) coincide con lo observado en varios estudios que han encontrado que los mayores niveles de glucógeno muscular en el comienzo del ejercicio producen una tasa más alta de utilización de glucógeno muscular durante el ejercicio (1, 10). Aunque no se observaron diferencias significativas en la utilización de glucógeno muscular entre ninguno de los grupos con contenido de glucógeno muscular bajo (LGE, LGEI, y LGH), con la infusión de insulina, existiría una tendencia hacia un efecto de ahorro de glucógeno (LGEI).
Un posible mecanismo de control para las interacciones de sustratos combustibles observadas en este estudio es el "ciclo glucosa-ácidos grasos” (26) que propone que un aumento en la oxidación de FFA produce una inhibición de la piruvato deshidrogenasa y por lo tanto inhibe la oxidación de CHO. Sin embargo, cuando se infundieron FFA (31) en cuartos traseros de ratas aislados y perfundidos con una concentración saturante para el consumo y oxidación de FFA en esta preparación, a diferencia de lo observado en el estudio actual, el consumo de FFA durante la estimulación no fue diferente entre los músculos que tenían bajo contenido de glucógeno y los que tenían un alto contenido de glucógeno, pero el consumo de glucosa fue mayor en el músculo con agotamiento de glucógeno. Así, en la preparación de músculos aislados perfundidos en la cual no hay control nervioso y hormonal, no se estimula el consumo de FFA, pero el consumo de glucosa aumenta en el músculo con glucógeno agotado. Por lo tanto, por descarte, el aumento en la oxidación de lípidos en el estudio actual se debió probablemente a la estimulación de lipólisis como resultado de los factores de control nervioso u hormonal fuera del músculo que aumentaron la disponibilidad de FFA para el mismo. De manera similar, dado que el consumo de glucosa está incrementado en músculos aislados, con agotamiento de glucógeno, la ausencia de un aumento en la oxidación de glucosa en el estudio actual indica inhibición nerviosa u hormonal del consumo de glucosa. Por consiguiente, bajo condiciones fisiológicas normales, la oxidación de glucosa no aumenta con el agotamiento del glucógeno, pero se produce un cambio hacia la oxidación de lípidos debido a los factores nerviosos u hormonales. Sin embargo las concentraciones de insulina elevadas, impiden que se produzca esto. Teleológicamente, éste puede ser un mecanismo para compensar una menor disponibilidad intramuscular de CHO sin predisponer a la hipoglucemia.
La diferencia significativa en las concentraciones plasmáticas de insulina (Figura 3B) entre LGE y NGE durante el ejercicio (pero no en reposo) sugiere que, cuando se mantiene la euglicemia, las concentraciones plasmáticas de insulina son influenciadas por el contenido de glucógeno muscular. Dado que los efectos más importantes de la infusión de insulina en LGEI en comparación con LGE fueron un aumento en la oxidación de glucosa (Figura 5B) y una disminución en FFA (Figura 3A), el consumo de glucosa muscular en LGE estuvo limitado probablemente por las menores concentraciones de insulina (37) y las mayores concentraciones de norepinefrina (3) (Figura 3, A y C). Esto probablemente también ocurrió en el grupo NGE después de la primera hora de ejercicio cuando las concentraciones de glucógeno muscular del grupo NGE se acercaban a las del grupo LGE (1).
Si bien el aumento en la insulina en LGEI (Figura 3B) disminuyó ligeramente la respuesta de la norepinefrina al agotamiento de glucógeno (Figura 3C), la norepinefrina en el grupo LGEI no fue significativamente diferente a la observada en el grupo LGE. Sin embargo, fue significativamente diferente entre los sujetos con contenido de glucógeno bajo y normal (LGE y NGE). Dado que se mantuvo la diferencia en la norepinefrina, sólo se observó una leve atenuación con la infusión de insulina en los sujetos con contenido de glucógeno muscular bajo, esto junto con la insulina, tal como se discutió en el párrafo precedente, son los controladores más probables de los cambios metabólicos debidos al agotamiento de glucógeno muscular observado en este y otros estudios (13). Sin embargo, las concentraciones más bajas de insulina en LGE también podrían ser explicadas por la inhibición de la liberación de insulina por la norepinefrina (28). Las catecolaminas también se oponen a los efectos de la insulina sobre el metabolismo de lípidos y consumo de glucosa (3), lo que produciría un aumento en FFA y en la oxidación de lípidos y una tasa de oxidación de glucosa sanguínea menor a lo esperado en los sujetos con contenido de glucógeno muscular bajo, considerando la disponibilidad de glucosa y la baja disponibilidad de glucógeno endógeno. Sin embargo, en los sujetos del grupo LGE no se observó una menor tasa de oxidación de glucosa sanguínea.
La similitud en RER (Figura 2), FFA séricos y concentraciones plasmáticas de norepinefrina (Figura 3, A y C) y concentraciones de insulina y glucagón (Figura. 3B y 4B) durante el ejercicio en los grupos LGH y NGE sugieren que estos parámetros están controlados de manera recíproca, tanto por las concentraciones plasmáticas de glucosa durante el ejercicio como por el contenido de glucógeno muscular al comienzo del ejercicio.
Una observación interesante es que la menor RER y las mayores concentraciones de FFA y norepinefrina (Figuras. 2, 3A, y 3C) durante el ejercicio en los sujetos con contenido de glucógeno muscular bajo (LGE) en este estudio, son similares a lo observado en pacientes con deficiencia de fosforilasa muscular (enfermedad de McArdle; ver la Referencia. 18), que padecen una alteración en la utilización del glucógeno muscular. Los pacientes con la enfermedad de McArdle tienen una variación de frecuencia cardíaca (∆Q) mayor a la normal por un cambio en VO2 (∆Q/∆VO2) durante ejercicio que ha sido vinculado con una deficiencia de combustible oxidable (19), dado que ∆Q/∆VO2 disminuye cuando el defecto enzimático se soluciona a través de la infusión de glucosa (19).
La retroalimentación nerviosa de los quimiorreceptores para la contracción de los músculos participa en el control cardiovascular (21), y de manera similar, estudios sobre la enfermedad de McArdle vinculan fuertemente los defectos metabólicos y cardiovasculares de esta enfermedad con la retroalimentación nerviosa de los quimiorreceptores para la contracción de los músculos (18, 25, 35). Así, debido a las similitudes llamativas en las diferencias metabólicas y hormonales entre los sujetos de LGE y los pacientes con la enfermedad de McArdle (9, 35) y sus controles respectivos, en el estudio actual hay indicaciones sólidas de señalización metabólica directa similar de que un bajo nivel de glucógeno muscular, produce un aumento en las concentraciones de norepinefrina y de FFA y oxidación de lípidos y una disminución en las concentraciones de insulina. Sin embargo, esta respuesta puede ser modificada si se incrementa el consumo de glucosa en el músculo por un aumento en las concentraciones plasmáticas de glucosa o de insulina, o ambos. Nosotros postulamos que la vía de señalización más probable sería a través de los aferentes musculares de grupo III y IV, dado que se ha observado que en los gatos (33), la estimulación de los mismos influye en las concentraciones de varias hormonas reguladoras, entre las que se incluyen la insulina.
Debido a que 1) los aferentes musculares están conectados con la región de locomoción del hipotálamo a través del núcleo reticular gigantocelular (27), 2) el comportamiento de la glucosa sanguínea y las concentraciones de la glucosa plasmática y de la hormona reguladora de la glucosa pueden estar controlados por el hipotálamo (36), y 3) hay interconexiones entre los diferentes núcleos hipotalámicos y entre los núcleos hipotalámicos y el sistema nervioso simpático y la hipófisis (36), la integración de los resultados de los estudios actuales y previos (17, 25, 32, 34, 36) puede explicar el control metabólico coordinado por medio de un comando central, reflejos neuromusculares y retroalimentación metabólica humoral.
El estimulante real (o inhibidor) de los aferentes musculares no se conoce. Es improbable que el mismo glucógeno actúe como molécula de señalización, porque los pacientes con la enfermedad de McArdle tienen adecuadas reservas de glucógeno muscular pero no pueden utilizarlo, mientras que los sujetos del grupo LGE tenían concentraciones de glucógeno muscular bajas. Después del ejercicio, la glucosa 1-fosfato, glucosa-1,6-bifosfato (G-l,6- P2), glucosa 6-fosfato, fructosa 6-fosfato y glicerol 3-fosfato están todos en menor concentración y el fumarato y IMP están en mayor concentración en los músculos con agotamiento de glucógeno que en los músculos con contenido de glucógeno normal (30). Sin embargo, de los anteriores, sólo G-l,6-P2 se encuentra en baja concentración tanto en los músculos con agotamiento de glucógeno antes del ejercicio (30) como también en el músculo de los pacientes con la enfermedad de McArdle (38). Si esta molécula tiene un efecto en los aferentes musculares del grupo III y IV, las diferencias entre los grupos LGE y NGE en los valores de RER, norepinefrina, y FFA tanto en reposo como durante el ejercicio en este estudio, se explicarían del mismo modo que las respuestas informadas en la enfermedad de McArdle. Previamente se ha señalado que la G-l,6-P2 sería una molécula importante en el control metabólico y se ha demostrado en ratas, que aumenta en el músculo con la infusión de insulina (14) y que disminuye con el entrenamiento (20), una adaptación que coincide con un cambio hacia la oxidación de lípidos después del entrenamiento (2).
En conclusión, en este estudio, 1) el agotamiento del glucógeno muscular antes del ejercicio produjo un aumento en la oxidación de grasas tanto en reposo como durante el ejercicio, pero no tuvo efecto en la tasa de oxidación de glucosa cuando se mantuvo la euglicemia por medio de la infusión de glucosa, 2) la infusión de insulina en los sujetos con contenido de glucógeno muscular bajo aumentó la oxidación de glucosa y disminuyó las concentraciones de FFA y la oxidación de grasas, 3) la oxidación de glucosa no fue mayor en los sujetos con contenido de glucógeno muscular bajo en comparación con los sujetos con contenido de glucógeno muscular normal cuando se mantuvo la euglicemia sin hiperinsulinemia, y 4) en los sujetos con contenido de glucógeno muscular bajo, el cambio hacia el metabolismo de lípidos tanto en reposo como durante el ejercicio, puede estar mediado a través de una vía de aferentes musculares por medio de la norepinefrina o la insulina.
Agradecimientos
Deseamos agradecer a Gary Wilson y Judy Belonje el soporte técnico y a los Drs. Wayne Derman y Martin Schwellnus por realizar las biopsias musculares.
Este estudio fue financiado por las concesiones de la Asociación Azucarera de Sudáfrica, del Concilio de Investigación Médica Sudafricano, y por el subsidio para investigación Nellie Atkinson y Harry Crossley de la Universidad de Ciudad del Cabo. La insulina usada en este estudio fue donada por Novo Nordisk, Sudáfrica.
Correspondencia
Para solicitar el manuscrito, comunicarse con: A. N. Bosch, Bioenergetics of exercise Research Unit, Sport Science Institute of South Africa, Newlands 7700, South Africa.
Referencias
1. Bosch, A. N., S. C. Dennis, and T. D. Noakes. (1993). Influence of carbohydrate loading on fuel substrate turnover and oxidation during prolonged exercise. J. Appl. Physiol. 74: 1921-1927.
2. Brooks, G. A., and J. Mercier. (1994). Balance of carbohydrate and lipid utilization during exercise: the "crossover" concept. J. Appl. Physiol. 76: 2253-2261.
3. Capaldo, B., R. Napoli, L. Di Marino, and L. Sacca. (1992). Epineph rine directly antagonizes insulin-mediated activation of glucose uptake and inhibition of free fatty acid release in forearm tissues. Metabolism 41: 1146-1149
4. Cherrington, A. D., M. J. Pagliassotti, S. R. Myers, B. Adkins-Marshall, and O. P. McGuinness. (1991). Factors which regulate net hepatic glucose uptake in vivo. JPEN J. Parenter. EnteralNutr. 15: 71S-73S
5. DeFronzo, R. A., E. Ferrannini, Y. Sato, P. Felig, and J. Wahren. (1981). Synergistic interaction between exercise and insulin on peripheral glucose uptake. J. Clin. Invest. 68: 1468-1474
6. DeFronzo, R. A., J. D. Tobin, and R. Andres. (1979). Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am. J. Physiol. 237
7. Durnin, J. V, and J. Womersley. (1974). Body fat assessed from total body density and its estimation from skinfold thickness: measurements on 481 men and women aged from 16 to 72 years. Br. J. Nutr. 32: 77-97.
8. Galbo, H., J. J. Hoist, and N. J. Christensen. The effect of different diets and of insulin on the hormonal response to prolonged exercise. Acta Physiol. Scand. 107: 19-32, 1979. 9 Haller, R. G., S. F. Lewis, J. D. Cook, and C. G. (1985). Blomqvist. Myophosphorylase deficiency impairs muscle oxidative metabolism. Ann. Neurol. 17: 196-199.
9. Hargreaves, M., G. McConell, and J. Proietto. (1995). Influence of muscle glycogen on glycogenolysis and glucose uptake during exercise in humans. J. Appl. Physiol. 78: 288-292.
11. Hawley, J. A., A. N. Bosch, S. M. Weltan, S. C. Dennis, and T. D. Noakes. (1994). Glucose kinetics during prolonged exercise in euglycaemic and hyperglycaemic subjects. Pñügers Arch. 426: 378-386.
12. Helie, R., J. M. Lavoie, and D. Cousineau. (1985). Effects of a 24 h carbohydrate-poor diet on metabolic and hormonal responses during prolonged glucose-infused leg exercise. Eur J. Appl. Physiol. 54: 420-426.
13. Jansson, E., P. Hjemdahl, and L. Kaijser. (1982). Diet induced changes in sympatho-adrenal activity during submaximal exercise in relation to substrate utilization in man. Acta Physiol. Scand. 114: 171-178.
14. Johnson, A. B., M. Argyraki, J. C. Thow, B. G. Cooper, G. Fulcher, and R. Taylor. (1992). Effect of increased free fatty acid supply on glucose metabolism and skeletal muscle glycogen synthase activity in normal man. Clin. Sci.
15. Kelley, D., A. Mitrakou, H. Marsh, F. Schwenk, J. Benn, G. Sonnenberg, M. Arcangeli, T. Aoki, J. Sorensen, M. Berger, P. Sonksen, and J. Gerich. (1988). Skeletal muscle glycolysis, oxidation, and storage of an oral glucose load. J. Clin. Invest. 81: 1563-1571.
16. Kjaer, M., J. Bangsbo, G. Lortie, and H. Galbo. (1988). Hormonal response to exercise in humans: influence of hypoxia and physical training. Am. J. Physiol 254
17. Kjaer, M., N. H. Secher, F. W. Bach, H. Galbo, D. R. Reeves, Jr., and J. H. Mitchell. (1991). Hormonal, metabolic, and cardiovascular responses to static exercise in humans: influence of epidural anesthesia. Am. J. Physiol 261
18. Lewis, S. F., and R. G. Haller. (1986). The pathophysiology of McArdle's disease: clues to regulation in exercise and fatigue. J. Appl. Physiol. 61: 391-401.
19. Lewis, S. F., R. G. Haller, J. D. Cook, and C. G. Blomqvist. (1984). Metabolic control of cardiac output response to exercise in McArdle's disease. J. Appl. Physiol. 57: 1749-1753.
20. Mitchell, J. H. (1985). Cardiovascular control during exercise: central and reflex neural mechanisms. Am. J. Cardiol 55: 34D-41D.
21. Mitchell, J. H., M. P. Kaufman, and G. A. Iwamoto. (1983). The exercise pressor reflex: its cardiovascular effects, afferent mechanisms, and central pathways. Annu. Rev. Physiol. 45: 229-242.
22. Nilsson, L. H., and E. Hultman. (1973). Liver glycogen in man—the effect of total starvation or a carbohydrate-poor diet followed by carbohydrate refeeding. Scand. J. Clin. Lab. Invest. 32: 325-330.
23. Nilsson, L. H., and E. Hultman. (1974). Liver and muscle glycogen in man after glucose and fructose infusion. Scand. J. Clin. Lab. Invest. 33:5-10.
24. Passonneau, J. V, and V. R. Lauderdale. (1974). A comparison of three methods of glycogen measurement in tissues. Anal. Bio-chem. 60: 405-412.
25. Pryor, S. L., S. F. Lewis, R. G. Haller, L. A. Bertocci, and R. G. Victor. (1990). Impairment of sympathetic activation during static exercise in patients with muscle phosphorylase deficiency.
26. Randle, P. J., P. B. Garland, C. N. Hales, and E. A. News-holme. (1963). The glucose-fatty acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet 785-789.
27. Richard, C. A., T. G. Waldrop, R. M. Bauer, J. H. Mitchell, and R. W. Stremel. (1989). The nucleus reticularis gigantocellularis modulates the cardiopulmonary responses to central and peripheral drives related to exercise. Brain Res. 482: 49-56.
28. Ruffolo, R. R., Jr., A. J. Nichols, and J. P. Hieble. (1991). Metabolic regulation by alpha 1- and alpha 2-adrenoceptors. Life Sci. 49: 171-183.
29. Shimizu, S., Y. Tani, H. Yamada, M. Tabata, and T. Murachi. (1980). Enzymatic determination of serum-free fatty acids: a colorimet-ric method. Anal. Biochem. 107: 193-198.
30. Spencer, M. K, and A. Katz. (1991). Role of glycogen in control of glycolysis and IMP formation in human muscle during exercise. Am. J. Physiolim
31. Turcotte, L. P., P. Hespel, and E. A. Richter. (1995). Circulating palmitate uptake and oxidation are not altered by glycogen depletion in contracting skeletal muscle. J. Appl. Physiol. 78: 1266-1272.
32. Van Dijk, G., J. Vissing, A. B. Steffens, and H. Galbo. (1994). Effect of anaesthetizing the region of the paraventricular hypo thai amic nuclei on energy metabolism during exercise in the rat. Acta Physiol. Scand. 151: 165-172.
33. Vissing, J., G. A. Iwamoto, I. E. Fuchs, H. Galbo, and J. H. Mitchell. (1994). Reflex control of glucoregulatory exercise responses by group III and IV muscle afferents. Am. J. Physiol 266
34. Vissing, J., G. A. Iwamoto, K. J. Rybicki, H. Galbo, and J. H. Mitchell. (1989). Mobilization of glucoregulatory hormones and glucose by hypothalamic locomotor centers. Am. J. Physiol257
35. Vissing, J., S. F. Lewis, H. Galbo, and R. G. Haller. (1992). Effect of deficient muscular glycogenolysis on extramuscular fuel production in exercise. J. Appl. Physiol. 72: 1773-1779.
36. Vissing, J., J. L. Wallace, A. J. Scheurink, H. Galbo, and A. B. Steffens. (1989). Ventromedial hypothalamic regulation of hormonal and metabolic responses to exercise. Am. J. Physiol 256
37. Wolfe, R. R., E. R. Nadel, J. H. Shaw, L. A. Stephenson, and M. H. Wolfe. (1986). Role of changes in insulin and glucagon in glucose homeostasis in exercise. J. Clin. Invest. 77: 900-907.
38. Yamada, Y, N. Kono, H. Nakajima, T. Shimizu, H. Ki-yokawa, M. Kawachi, A. Ono, T. Nishimura, M. Kuwajima, and S. Tarui. (1991). Low glucose-1,6-bisphosphate and high fructose-2,6-bisphosphate concentrations in muscles of patients with glycogenosis types VII and V Biochem. Biophys. Res. Commun. 176:7-10.