L-Glutamina
Publicado 8 de junio de 2013, 23:29
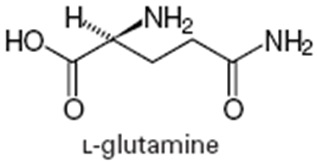
Nombre trivial para la amida del ácido glutámico de fórmula H2N–CO–[CH2]2–CH(NH2)–COOH. Es un α-aminoácido quiral de símbolo Q, Gln o Glu(NH2) que se encuentra codificado durante la síntesis de proteínas por el codón CAA o CAG (anticodón: GUU). En los mamíferos, es un α- aminoácido no esencial, lo que significa que nuestro cuerpo lo puede sintetizar, y glucogénico. La D-Glutamina no es conocida por producirse naturalmente [1].
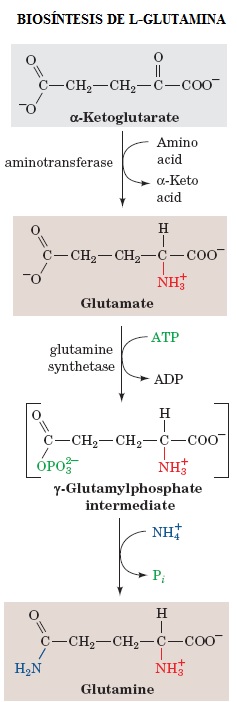
La L-Glutamina es sintetizada desde glutamato (especie ionizada del ácido glutámico) por una reacción de amidación. La Glutamina Sintetasa cataliza la formación de L-Glutamina en una reacción que requiere energía y por lo cual el ATP es hidrolizado a ADP y Pi (fosfato inorgánico) para permitir la formación de un metabolito intermedio conocido como γ-glutamilfosfato, el cual posteriormente recibe la adición del grupo amino con ayuda del grupo donador NH4+. La Glutamina Sintetasa es un punto de control central en el metabolismo del nitrógeno, debido a que la L-Glutamina funciona como un donador de grupos amino en la formación de muchos productos biosintéticos y por lo tanto es una reserva de grupos amonio, así la consecuente posición central de la Glutamina Sintetasa hace de ésta un control vital de éste proceso. De hecho, las glutaminas sintetasas mamíferas son activadas por α-cetoglutarato (un metabolito intermediario del ciclo de Krebs y la producción de energía), un producto de la desaminación oxidativa del glutamato; de esta manera, este control presume la prevención en la acumulación del amonio producida por ésta última reacción de desaminación oxidativa [2].
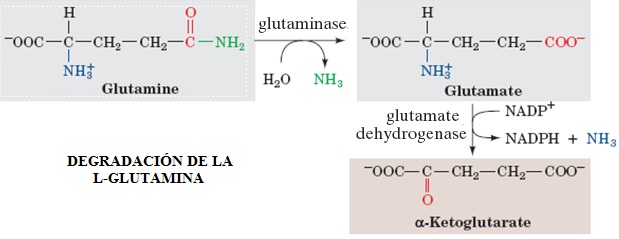
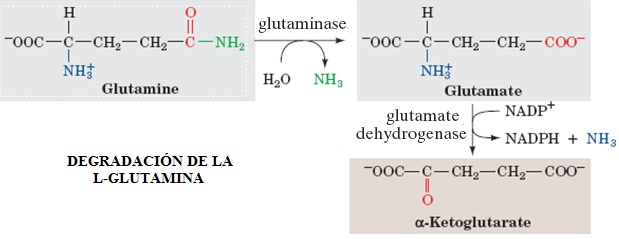
La L-Glutamina, además de ser un monómero para la construcción de las proteínas, es el sustrato preferido por la gluconeogénesis (ruta metabólica que produce glucosa desde compuestos que no son carbohidratos) en la corteza renal. Al igual que la L-Alanina, la L-Glutamina es sintetizada por el músculo esquelético en los estados de ayuno como un medio de exportar los grupos amino de los aminoácidos. En el riñón, los dos grupos amino de la L-Glutamina son removidos por la Glutaminasa y la Glutamato Deshidrogenasa produciendo iones amonio libres y α-cetoglutarato. Los iones amonio sirven como buffer de los ácidos excretados en la orina, mientras que el α-cetoglutarato se provee como sustrato para la gluconeogénesis. Como resultado de ésta conexión entre la generación la generación de iones amonio libres y α-cetoglutarato, la gluconeogénesis en el riñón incrementa significativamente durante condiciones de acidosis así como también durante el ayuno. La oxidación de α-cetoglutarato por medio del ciclo de ácidos tricarboxílicos o ciclo de Krebs produce oxalacetato, el cual después entra en la misma vía metabólica que usa nuestro cuerpo para producir glucosa desde lactato [3].
Bibliografía
[1] Cammack R. (2006). Oxford Dictionary of Biochemistry and Molecular Biology - Revised Edition. Oxford University Press.
[2] Voet D & Voet JG. (2011). Biochemistry Fourth Edition. John Wiley and Sons, Inc.
[3] Glew RH & Rosenthal MD. (2009). Medical Biochemistry Human Metabolism in Health and Disease. John Wiley and Sons, Inc.