L-Glutamina; Suplementación y Bases Metabólicas relacionadas con el Ejercicio
Publicado 27 de junio de 2013, 0:27
1. Introducción
La L-Glutamina es el aminoácido libre más abundante en el tejido sanguíneo y muscular. Nutricionalmente está clasificado como un aminoácido no esencial, debido a que nuestro cuerpo lo puede sintetizar a partir de otros aminoácidos. La L-Glutamina está involucrada en diferentes funciones como la proliferación y desarrollo celular, el balance ácido base, el transporte de iones amonio entre tejidos, donación de esqueletos de carbono para la gluconeogénesis, participación en el sistema antioxidante, entre otros. Ahora bien, un individuo de 70 Kg presenta cerca de 70-80 g de L-Glutamina, distribuida en diversos tejidos corporales, y una concentración sanguínea entre 500 y 700 μmol/L. Sin embargo, tanto la concentración de L-Glutamina tisular como sanguínea puede ser influenciada por la actividad de la glutamina sintetasa o de la glutaminasa. Así, algunos tipos de células como las del sistema inmune, riñones e intestino presentan una elevada actividad de glutaminasa siendo así considerados como tejidos consumidores de L-glutamina. Por otro lado, el músculo esquelético, los pulmones, hígado, cerebro y posiblemente el tejido adiposo tienen elevada actividad de la enzima glutamina sintetasa y por lo tanto son considerados como tejidos sintetizadores de L-glutamina. Cuantitativamente, el tejido principal que sintetiza, almacena y libera L-glutamina es el tejido muscular esquelético. La taza de síntesis de L-glutamina en dicho tejido es de aproximadamente 50 mmol/h, siendo mayor que la de cualquier otro aminoácido. De esta manera, la elevada capacidad de síntesis y liberación de L-glutamina, principalmente en situaciones en las que aumenta su demanda por otros órganos y tejidos, confiere al músculo esquelético un papel metabólico esencial en la regulación de la glutaminemia [4].
2. Efecto del Ejercicio sobre el metabolismo de la L-Glutamina
Inicialmente, el ejercicio promueve una acelerada liberación de L-glutamina desde el tejido muscular, lo que aumenta la concentración plasmática de éste aminoácido. Dicho incremento es transitorio y es debido a la elevada síntesis de amonio proveniente de la desaminación de monofosfato de adenosina (AMP) para producir monofosfato de inosina (IMP), éste último proceso se debe a la alta demanda de ATP durante la contracción muscular. Una marcada reducción en la glutaminemia puede ser observada cuando el ejercicio es realizado por más de una hora, de manera que la magnitud del tiempo de disminución de L-glutamina depende del tipo de deporte practicado. Así, como ocurre con otros aminoácidos, el metabolismo de la L-glutamina en el tejido muscular puede ser alterado por el tipo de ejercicio que se lleve a cabo. Por ejemplo, un estudio mostró que individuos ejercitándose a una intensidad del 70% de su VO2máx presentan un aumento en la concentración muscular de L-glutamina desde 18.9 mmol/L a 23.6 mmol/L, aunque con el proseguimiento del protocolo de ejercicio la concentración de L-glutamina fue disminuyendo. En otra investigación que utilizaba un programa de ejercicio mayor a 3 horas a un 50% de VO2máx se evidenció que la concentración de L-glutamina muscular disminuyó de 21.6 mmol/L a 14.3 mmol/L [3]. Dentro de los mecanismos que conllevan a la reducción de las concentraciones de L-glutamina plasmática y muscular, durante y después de ejercicio físico prolongado, se destaca el aumento en la concentración de cortisol, el cual estimula tanto el eflujo de L-glutamina muscular como la captación de la misma por el hígado. De éste modo, la mayor disponibilidad de L-glutamina en el hígado junto la disminución de las reservas de glucógeno hepático y el aumento en la concentración de cortisol estimulan la gluconeogénesis hepática a partir del esqueleto carbonado de la L-glutamina. Se ha postulado la hipótesis de que el aumento en la captación de L-glutamina por el hígado puede servir para sintetizar el principal antioxidante celular no enzimático, el glutatión (GSH), por medio de una liberación de glutamato. El tejido hepático representa la principal fuente de éste antioxidante durante el ejercicio, ya que al aumentar la cantidad de especies reactivas de oxígeno se podrían estimular los mecanismos de síntesis de antioxidantes.
Otro mecanismo implicado en la disminución de la glutaminemia durante el ejercicio prolongado se relaciona con el aumento en la concentración de lactato sanguíneo, el cual altera el pH de la sangre (acidosis metabólica) y consecuentemente conduce a una mayor captación de L-glutamina por los riñones. Cuanto más intenso es el ejercicio mayor es la producción de iones hidrógeno (H+) y por lo tanto la demanda de los riñones para ejercer su acción buffer contra la acidosis. La eliminación de los iones H+ por los riñones utiliza el amoníaco proveniente de la L-glutamina. Dichas moléculas de amoníaco escapan de las células al túbulo renal por un proceso de difusión pasiva y se unen a los protones H+ para formar iones amonio (NH4+). La excreción de iones H+ ayuda a la manutención del balance ácido/base.
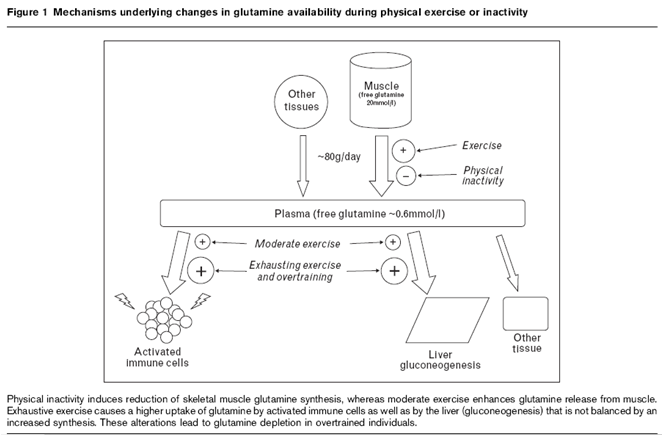
Además de lo anterior, un aumento en la captación de L-glutamina por células del sistema inmune, tales como linfocitos, macrófagos y neutrófilos, puede colaborar en la disminución en la glutaminemia inducida por el ejercicio físico, ya que éstas células utilizan L-glutamina como principal sustrato energético [3], por lo tanto la biodisponibilidad de éste aminoácido es importante para la funcionalidad del sistema inmune. Sesiones de ejercicio exhaustivo sin la preparación requerida al igual que programas de entrenamiento excesivamente demandante (over-training) pueden provocar agotamiento de los depósitos de L-glutamina; tal efecto es mediado por una reducción en la síntesis muscular de L-glutamina y por una mayor captación de ésta última por células hepáticas y del sistema inmune. Por el contrario, el entrenamiento óptimo funcional está ligado a un mejoramiento en el balance de L-glutamina, razonablemente a través de un aumento en la liberación de L-glutamina equilibrándose con la excreción después de sesiones de ejercicio suave o moderado (mild exercise). El impacto de diferentes tipos de ejercicio sobre la disponibilidad de L-glutamina y la inmunocompetencia han sido evaluados en humanos, aunque se presentan algunas incertidumbres que generan la necesidad de realizar más estudios clínicos [1].
En conclusión, el entrenamiento moderado juega
un rol positivo en el mantenimiento de la salud, al menos en parte por medio de
una mayor disponibilidad de L-glutamina, mientras que está demostrado que el
entrenamiento exhaustivo (over-training)
reduce considerablemente la concentración plasmática de L-glutamina permitiendo
posiblemente la inmunosupresión. En la siguiente tabla quiero enfatizar las
diferencias en ciertos marcadores clínicos en relación al tipo de entrenamiento,
claramente observamos la variación en la concentración de L-glutamina
dependiendo del tipo de ejercicio.
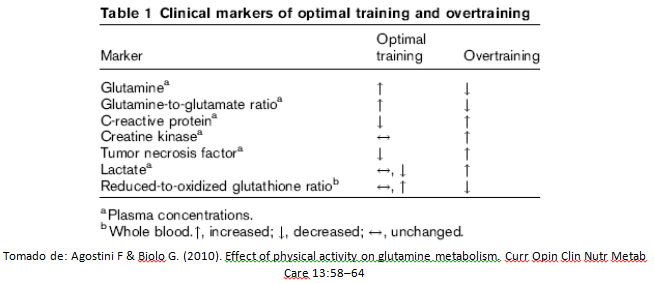
A manera de resumen, Agostini & Biolo [1] diseñaron el siguiente esquema en el cual se pueden observar las variables principales (actividad física e inactividad) que intervienen en las concentraciones plasmáticas y tisulares de L-glutamina.
3. Posibles Efectos de la suplementación con L-Glutamina
Actualmente existe discordia acerca de si la suplementación con L-glutamina presenta algunos de los efectos que se señalan a continuación debido a la falta de respaldo científico y experimental; sin embargo, menciono los efectos por los cuales es un suplemento dietario tan conocido, para posteriormente analizarlos metabólicamente.
-Mejoramiento del balance ácido/base.
-Incremento de procesos anabólicos musculares y por lo tanto aumento en la síntesis de proteína muscular.
-Aceleración de la recuperación muscular.
-Disminución en la aparición de lesiones y/o infecciones debido a la prevención de inmunosupresión después del ejercicio.
-Rápida restauración del balance hídrico.
-Aumento en la concentración de glucógeno muscular.
-Debemos tener claro que la concentración corporal de L-glutamina también incrementa tras la suplementación.
4. Bases Metabólicas que posiblemente justifican los efectos de la ingesta de L-Glutamina
A continuación intentaré evaluar de manera entendible los conceptos actuales que explican, al menos parcialmente, algunos de los efectos de la administración de L-glutamina descritos anteriormente.
4.1. Prevención de lesiones, recuperación muscular y atenuación de la inmunosupresión post-ejercicio
La glutaminasa es la enzima clave para la utilización de L-glutamina que permite la producción de sustratos energéticos (ej., α-cetoglutarato y piruvato) y aminoácidos (ej., glutamato, aspartato y alanina). En particular, la L-glutamina es utilizada por las células en división rápida como los enterocitos y las células inmunológicas, especialmente linfocitos o monocitos. La importancia de su rol en la activación y regulación del sistema inmune ha sido investigada desde varios modelos. Teniendo en cuenta que la glutaminasa es expresada en la membrana celular de los neutrófilos en humanos y que ésta es específicamente activada en células inmune con el objetivo de proveer sustratos requeridos para la proliferación, estudios in vitro han mostrado que cultivos de células inmunológicas utilizan mayoritariamente L-glutamina entre otros aminoácidos, al punto tal que la conversión de L-glutamina a glutamato, aspartato, alanina y piruvato representa el 85% del uso total de L-glutamina en el cultivo de células [1]. De ésta manera, el metabolismo de la L-glutamina provee los precursores e intermediaros necesarios para la proliferación de células inmunitarias y la síntesis de proteínas involucradas en dicho mecanismo.
Para comprensión de la siguiente explicación,
resumiré brevemente algunas de las proteínas involucradas en el proceso
inflamatorio que está relacionado concretamente con la recuperación muscular.
La activación del mecanismo inflamatorio tiene inicio con la (a) síntesis y
liberación de sustancias vasodilatadoras, como la prostaglandina E2
(PgE2) y las citoquinas pro-inflamatorias, como el factor de
necrosis tumoral (α-TNF) y la interleucina (IL) 1β, que por su acción inducen a
(b) la síntesis de interleucina (IL)-6, primer marcador de la reacción de fase
aguda, (c) estimula la formación de proteínas específicas, también de fase aguda,
como la proteína C reactiva (CRP), hecho que aumenta la (d) producción de
citoquinas anti-inflamatorias e inhibidores de citoquinas. Inicialmente
neutrófilos y, posteriormente, monocitos y linfocitos son activados, migrando a
la zona de la lesión (e) por medio del sistema sanguíneo, donde inicia (f) la
reparación de la lesión tisular con la síntesis de enzimas proteolíticas y
especies reactivas de oxígeno, especies reactivas de nitrógeno y radicales
libres. Por medio de la liberación de citoquinas y moléculas señalizadoras
intercelulares, el proceso inflamatorio regula y responde a la adaptación
celular. El equilibrio entre la síntesis de citoquinas pro y anti-inflamatorias
puede aumentar la protección de las células a nuevos factores de estrés.
Además, la intensidad del proceso inflamatorio está relacionada al grado de la
lesión tisular. De esta forma, la elevada cantidad de lesiones inducidas por el
ejercicio físico de carácter exhaustivo promueve una respuesta inflamatoria
intensa, aumentando principalmente la liberación de citoquinas
pro-inflamatorias, tales como α-TNF. Ésta citosina es sintetizada primariamente
por macrófagos y otros tipos de células, incluyendo las células musculares. Dos
receptores específicos de membrana, TNF-R1 y TNF-R2, median las respuestas
celulares de α-TNF. Aunque el músculo esquelético expresa ambos receptores,
experimentos indican que TNF-R1 está más relacionado con las respuestas
catabólicas inducidas por α-TNF, una vez que ésta citoquina regula la
activación de una subunidad citosólica de transcripción denominada factor
nuclear Kappa B (NF-kB). NF-kB está en el citoplasma de las células
musculares en forma inactiva, debido a que se encuentra ligado a un dímero de
acción inhibitoria, I-kBα. El α-TNF o
el estrés oxidativo celular estimulan la ubiquitinación (ligación con residuos
de otras proteínas) y la fosforilación de I-kBα
y, posteriormente, su degradación por el proteosoma 26S. En ausencia de I-kBα, NF-kB es activo y se transloca al núcleo de la célula. Una vez en el
núcleo, en pocos minutos NF-kB se
liga a una región promotora del ADN e inicia el proceso de transcripción de
genes para diversas citoquinas pro-inflamatorias y proteínas apoptóticas (que
regulan la muerte celular programada), lo que aumenta la actividad inflamatoria
y la producción de especies reactivas de oxígeno por neutrófilos y macrófagos [3].
De acuerdo con algunos autores, el elevado estado inflamatorio puede aumentar un
edema en el tejido muscular y la sensación de dolor muscular tardía (DOMS – delayed onset muscle soreness)
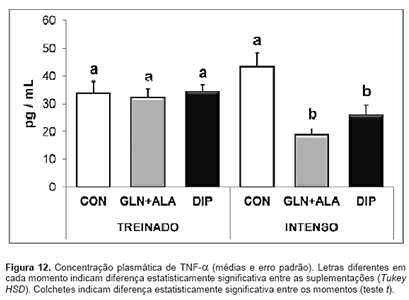
perjudicando así la reparación celular. Ahora bien, Cruzat (2008) [3] reportó
en un estudio con ratas suplementadas con L-glutamina y un dipéptido de
glutamina/alanina (DIP en la gráfica) sometidas a un protocolo de ejercicio
intenso una disminución significativa en los niveles de amonio, PgE2
y α-TNF en comparación con el grupo control. La siguiente gráfica expresa dicha
conclusión:
Adicionalmente, la inhibición de las vías de señalización intracelular tales como la de la proteína cinasa activada por mitógenos (MAPK) y NF-kB, también se han indicado como un mecanismo implicado en la protección contra la apoptosis desempeñado por las proteínas de choque térmico (HSPs – Heat Shock Proteins). Así, tanto la vía MAPK como la de NF-kB al ser inhibidas reducen la activación de las señales de traducción y la expresión de citoquinas pro-inflamatorias, tales como IL-1β y α-TNF [4]. La L-glutamina puede modular la activación de las HSPs (HSP 70, HSP 72, HSP 25, HSP 27) que están relacionadas con la respuesta anti-apoptótica celular. La activación de esas proteínas corresponde a una de las principales vías de señalización que contribuyen al aumento en la capacidad de la célula para sobrevivir a alteraciones en su homeostasis generados por exposición a agentes estresantes, como radiación ultravioleta (UV), calor, agentes infecciosos y especies reactivas de oxígeno. Evidencia experimental indica que un aumento en la disponibilidad de L-glutamina en las células puede aumentar la expresión de las HSPs, lo que otorga a la célula una mayor capacidad para resistir las lesiones [7]. Igualmente, el efecto de la L-glutamina en el incremento de la expresión de HSPs ocurre de manera dosis-dependiente, pues son necesarias mayores concentraciones de acuerdo con la intensidad del proceso, hecho que probablemente está relacionado con la necesidad de la célula para mantener su protección y, consecuentemente, sobrevivir a condiciones de estrés. El posible mecanismo que relaciona la L-glutamina con las HSPs involucra los homotrímeros del factor transcripcional de choque térmico, los cuales al ser activados por señales extracelulares se translocan al núcleo y se unen a lugares específicos de la región promotora de los genes de HSPs, denominados elementos de choque térmico [4].
4.2. Balance hídrico, síntesis de proteína y glucógeno muscular
Hormonas como la insulina y los factores de
crecimiento similares a la Insulina (IGFs) estimulan el transporte de L-glutamina
al medio intramuscular, mientras que los glucocorticoides (ej., cortisol)
estimulan la liberación de L-glutamina al medio extracelular. Considerando que
el gradiente transmembranal a través de la célula muscular debe ser elevado
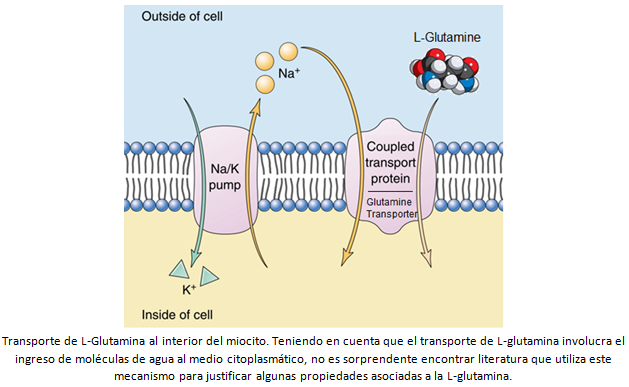
para la L-glutamina, su difusión libre a través de la membrana celular está
restricta. De esa forma, la L-glutamina necesita ser transportada de forma
activa al interior de las células, por medio de un sistema dependiente de sodio
que utiliza la energía del ATP para las modificaciones estructurales de la Na+/K+-ATPasa.
De entre los 20 aminoácidos, el transporte de L-glutamina a través de la
membrana celular es el más veloz [4]. La L-glutamina, al ser transportada al
citoplasma celular, promueve simultáneamente la absorción de agua y la
liberación de ión potasio (K+), hecho que aumenta el estado de
hidratación celular o hinchamiento celular (cell
swelling) [Ver figura abajo]. Aunque todavía es controvertido, el aumento
de volumen celular puede estimular la síntesis de proteínas, que se considera
una señal anabólica, además de generar también un incremento en la síntesis de
glucógeno muscular.
5. ¿Cómo suplementarse con Glutamina?
Dependiendo de los objetivos personales existen las siguientes pautas [8]:
5.1. Aumento de fuerza y masa muscular: Desde 500 mg hasta 10 g al día o también desde 10 hasta 100 mg / kilo de peso. Cuando es más de una vez al día; 30 minutos antes y 60 minutos después del entrenamiento, aunque algunas personas aseguran buenos resultados inmediatamente antes de dormir.
5.2. Esfuerzos del metabolismo aeróbico: desde 500 mg hasta 5 g al día o también desde 10 hasta 50 mg / kilo de peso. Generalmente 90 minutos después del entrenamiento.
5.3. Recuperación de Tejidos: desde 500 mg hasta 5 g al día o también desde 10 hasta 50 mg / kilo de peso. En cualquier momento, fuera de las comidas.
Existen algunos productos comerciales que combinan L-glutamina con otras sustancias, como por ejemplo:
L-Glutamina + Taurina: potencia su acción voluminizadora de la célula.
L-Glutamina + Monohidrato de Creatina: proporciona energía y recuperación muscular.
L-Glutamina + β-hidroxi-β-metilbutirato (HMB): busca el máximo de efecto anticatabólico.
6. ¿Es segura la suplementación con L-Glutamina?
Solamente porque una sustancia es un nutriente no puede asumirse que su uso es totalmente seguro, especialmente en dosis farmacológicas dadas a pacientes que no presentan deficiencia de éste metabolito. Sin embargo, se ha encontrado que la L-glutamina se absorbe de manera segura en el yeyuno. La ingestión aguda de L-glutamina en dosis de 0.1 and 0.3 g/kg de peso no han mostrado evidencia clínica de toxicidad. También, después de una dosis de 0.285 y 0.570 g/kg peso corporal/día de L-glutamina no tuvo efectos nocivos después de 5 días de suplementación en sujetos normales [6]. Ingestas crónicas de L-glutamina de 20 – 30 gramos parecen no tener un efecto dañino en la salud de humanos adultos, como lo reportó un estudio en el cual atletas consumieron 28 g de L-glutamina cada día durante 14 días. Además, se ha reportado que dosis máximas de 0.65 g/kg peso corporal de L-glutamina (en solución o suspensión) han sido toleradas por pacientes y no generaron cambios anormales en los niveles plasmáticos de amonio [5]. La dosis usada para provocar un efecto positivo sobre el balance del nitrógeno es considerablemente grande, 0.2 - 0.6 g/kg peso corporal por día [6].
La mayoría de los estudios de infusiones intravenosas de L-glutamina en voluntarios saludables no ha reportado problemas de salud. Sin embargo, postulados teóricos señalan una posible estimulación en el crecimiento tumoral tras la ingesta de L-glutamina. Estudios in vitro muestran un incremento significativo en la toxicidad tras la administración de L-glutamina en linfocitos periféricos de pacientes con Alzheimer o Síndrome de Down en comparación con el mismo tipo de células de sujetos saludables [2]. Por tal motivo, se requiere de mayor investigación en ésta área de suplementación y el tipo de pacientes involucrados.
En conclusión, la L-glutamina parece ser segura en sujetos saludables que se ejercitan constantemente, al punto tal que sus efectos parecen involucrar ciertos desordenes metabólicos, enfermedades y condiciones humanas como:
- Síndrome del Intestino Corto
- Pancreatitis Aguda y Enfermedad Inflamatoria del Intestino
- Administración en Cuidados Intensivos
- Trasplante de Médula Ósea
- Uso en pacientes que asisten a sesiones de Radiación y Quimioterapia
- Procedimientos Post-operatorios
- Atenuación de los Efectos de Medicamentos contra el SIDA / VIH
Referencias
[1] Agostini F & Biolo G. (2010). Effect of physical activity on glutamine metabolism. Curr Opin Clin Nutr Metab Care 13:58–64
[2] Buchman AL. (2001). Glutamine: commercially essential or conditionally essential? A critical appraisal of the human data. Am J Clin Nutr; 74:25–32.
[3] Cruzat VF. (2008). Efeito da suplementação com L-glutamina e L-alanil-L-glutamina sobre parâmetros de lesão muscular e de inflamação em ratos treinados e submetidos a exercício intenso de natação. [Dissertação Mestrado]. São Paulo: Faculdade de Ciências Farmacêuticas da USP. 141 p.
[4] Cruzat VF, Petry ER & Tirapegui J. (2009). Glutamina: Aspectos Bioquímicos, Metabólicos, Moleculares e Suplementação. Rev Bras Med Esporte – Vol. 15, No 5 – Set/Out
[5] Gleeson M. (2008). Dosing and Efficacy of Glutamine Supplementation in Human Exercise and Sport Training. J. Nutr. 138: 2045S–2049S
[6] Piattoly T. (2005). L-Glutamine Supplementation: Effects on Recovery from Exercise. [Master Dissertation]. Louisiana: The Departmente of Kinesiology at Louisiana State University.
[7] Sandres MM & Kon C. (1991). Glutamine is a powerfull effector of heat shock protein expression in drosophila Kc cells. Am J Cell Physiol; 146:180-90.
[8] Diccionario de la Suplementación - Felipe Isidro. Doctorando en Ciencias de la Actividad Física y el deporte. Especialista en Ejercicio Físico, Salud y Fitness en ANEF, Formación de Técnicos del Fitness (www.anefead.com). Master en Dirección y Gestión de Centros Educativos. www.felipeisidro.com
Diego A. Bonilla
