Las Endorfinas y El Ejercicio: Mecanismos Fisiológicos e Implicaciones Clínicas
Endorphins and Exercise: Physiological Mechanisms and Clinical Implications
Peter Thorén , John S. Floras , Pawl Hoffmann y Douglas R. Seals
Departamento de Fisiología, Universidad de Göteborg (Suecia).
Artículo publicado en el journal Revista de Entrenamiento Deportivo, Volumen 25, Número 2 del año 2013.
Publicado 19 de agosto de 2013
Resumen
Palabras clave: endorfinas, ejercicio, hipertensión, inmunidad, músculo
Abstract
Keywords: endorphins, exercise, hypertension, immunity, muscle
INTRODUCCION
La creciente popularidad del ejercicio regular puede atribuirse, en parte, a un mayor conocimiento público de sus efectos beneficiosos sobre el bienestar físico y emocional. En los últimos años, el ejercicio regular ha demostrado reducir la mortalidad en los trastornos cardiovasculares y respiratorios (106) y disminuir la presión sanguínea de pacientes con esencial hipertensión (103, 147). El ejercicio regular también parece mejorar el perfil de los lípidos de algunos individuos (143, 160) mejorar el humor (101), y disminuir la sensibilidad ante el dolor (69). Muchos de estos efectos positivos se han atribuido a la estimulación inducida por el ejercicio de la producción de opiáceos endógenos aunque los mecanismos que se encargan de esta activación de las vías opiáceas centrales apenas se comprenden. Nuestros objetivos en este artículo son 1) revisar la evidencia de nuestros laboratorios y de otros que indican que la estimulación de los nervios somáticos aferentes que ejercitan el músculo puede activar los sistemas opiáceos centrales, 2) analizar la potencial implicación de los opiáceos en la regulación de la presión sanguínea y la hipertensión, y 3) analizar como puede el ejercicio intenso (y la acupuntura), a través de las vías opiáceas, influir en la percepción del dolor, la inmunidad, la adicción, la depresión, y la anorexia. Es importante advertir que nuestro análisis de estos temas a veces es puramente especulativo. Sin embargo, se espera que muchas de nuestras ideas formarán la base para platear las hipótesis a partir de las cuales pueden realizarse estudios experimentales.
SISTEMAS OPIÁCEOS ENDÓGENOS
Los opiáceos han sido usados por el hombre duran-te miles de años. Sus efectos analgésicos, eufóricos, y adictivos han sido tema de intensa investigación clínica durante la mayor parte del s. XX. Nuestra comprensión del mecanismo de acción de los opiáceos en el tejido neural ha avanzado mucho con el desarrollo de técnicas vinculantes para identificar los receptores opiáceos (111, 135, 142). Los péptidos endógenos con actividad opiácea se denominaron inicialmente encefalinas, aunque más tarde se describieron varios péptidos. Por consiguiente, un término más apropia-do a usar es opiáceos endógenos, a diferencia de los opiáceos exógenos. Los opiáceos pueden subdividirse aproximada-mente en tres grupos, endorfinas, encefalinas y dinorfinas, procedentes de tres importantes moléculas precursoras. La familia de la endorfina incluye varias formas de beta-endorfina así como alfa- y gamma- endorfina. Las más importan-tes encefalinas son los pentapéptidos leucina-encefalina y metionina-encefalina. La familia de la dinorfina incluye la dinorfina A, la dinorfina B, y la neo-endorfina. Se han descrito las neuronas que contienen cada uno de estos péptidos (para revisión, ver 58). Estos opiáceos endógenos están ampliamente distribuidos en las áreas del sistema nervioso central implicadas en la regulación del flujo simpático, en los ganglios autónomos, y en los plexos de la tripa (5, 31, 146). Las encefalinas están presentes en las terminales nerviosas que rodean el núcleo del tracto solitario, el núcleo dorsal vagal, y el núcleo ambiguo, es decir, las áreas implica-das en el control circulatorio autónomo (78, 124.
De especial interés ha sido el sistema de la beta-endor-fina que contribuye a la regulación de la presión sanguínea, la percepción del dolor, y el control de la temperatura del cuerpo (8, 47, 65). Este sistema tiene cuerpos celulares en la eminencia mediana del hipotálamo e inerva gran parte del hipotálamo, el mesencéfa lo, y las partes rostrales del bulbo raquídeo implicadas en la regulación central del flujo autónomo (1, 5, 14, 29, 139). Una segunda beta-endorfina, independientemente regulada, que contiene el sistema se encuentra en la pituitaria anterior, en la que se sintetizan la beta-endorfina y la ACTH en las células corticotrópicas, como parte de una molécula precursora común, la proopiomelanocortina (POMC) (28, 89). Dado que la beta-endorfina y la ACTH son segregadas en concentraciones equimolares desde la adenohipófisis en respuesta al ejercicio y a otros estímulos estresantes, la mayoría de la beta-endorfina medida en la sangre periférica refleja la co-liberación con ACTH más que la actividad hipotalámica de la beta-endorfina del tallo cerebral (53). Los incrementos de la tensión específica en los niveles de beta-endorfina y ACTH del plasma a menudo no están asociados con los incrementos en las concentraciones de endorfina del cerebro (116). De hecho, dado que la barrera hematocerebral es relativamente impermeable a la circulación de los péptidos (9), no se esperaría que las concentraciones periféricas de beta-endorfina modificaran la actividad central de la beta-endorfina. Estas observaciones resaltan la necesidad de cautela al intentar valorar la actividad central de la beta-endorfina a partir de las concentraciones periféricas de la beta-endorfina del plasma.
Los receptores opiáceos también están presentes en las estructuras periféricas simpáticas y cardiovasculares (66, 67), y su efecto es inhibidor sobre la transmisión simpática periférica (67, 72, 80, 159). Sin embargo, estos efectos se observan cuando los péptidos opiáceos se usan en dosis farmacológicas. Además, su papel parece tener diferente importancia entre las especies, y en las ratas sin médula (en las que se excluyen todas las influencias del SNC) los agonistas opiáceos no afectan a la presión sanguínea (30, 39, 84).
En general, los opiáceos central y periféricamente administrados provocan bradicardia e hipotensión, aumentando el flujo parasimpático e inhibiendo el simpático (65). La administración de opiáceos sintéticos en la cisterna magna de los perros produce una caída en la presión sanguínea (83). Sin embargo, también hay estudios que indican una mayor presión sanguínea y actividad simpática después de la administración central de opiáceos (3, 38, 91, 113, 144, 148). Las respuestas del reflejo simpático a los estímulos presores y depresores son atenuadas con morfina o análogos opiáceos y potenciadas con naloxona, un antagonista opiáceo con gran afinidad para los mu-receptores (99, 112). Sin embargo, cuando se usan grandes dosis de naloxona, puede perder su especificidad para los receptores opiáceos o puede tener efectos agonistas. Además, la naloxona puede influir en las respuestas farmacológicas a algunas drogas no-opiáceas, incluyendo aquellas que interactúan con los sistemas dopaminérgicos y GABAérgicos (126).
La contribución de los sistemas opiáceos centrales a la regulación cardiovascular en animales o seres humanos conscientes intactos no siempre es evidente bajo las condiciones de reposo, aunque a veces puede detectarse una tensión real o percibida que interrumpe los mecanismos homeostáticos normales y desplaza la presión sanguínea fuera de su rango usual (118). La mayoría de los investigado-res no ha conseguido detectar ningún cambio en la presión sanguínea o el ritmo cardíaco en sujetos normales a los que se les administran dosis de hasta 20 mg i.v. de naloxona (71, 151, 157, 165). Sin embargo, las respuestas simpatoexcita-doras del reflejo a inclinarse, la hipotensión inducida por el nitroprusiato sódico, o la prueba presora en frío pueden atenuarse mediante un análogo de la encefalina, DJ\NME, o aumentarse con naloxona (16, 120). Además, la hipotensión nocturna, que parece estar influida por los opiáceos endógenos, puede suprimirse si los sujetos reciben elevadas dosis parenteral de naloxona (0.2 mg·kg-1) inmediatamente antes de dormir (118, 119). La disminución de la presión sanguínea con el sueño, expresada en unidades absolutas, también es mayor en los pacientes con hipertensión esencial que en los sujetos normales (42). Los resultados de varios estudios clínicos indican se necesitan grandes dosis de naloxona para bloquear los efectos cardiovasculares y endocrinos de los sistemas opiáceos endógenos; sin embargo, estos efectos sólo se observan después de un retraso de unas pocas horas. Una explicación para esta última observación es que los opiáceos endógenos facilitan sus efectos a través de un neurotransmisor intermediario que requiere de novo síntesis (118).
ACTIVACIÓN DE LOS SISTEMAS ENDORFÍNICOS CENTRALES A TRAVÉS DEL EJERCICIO
Nuestra principal hipótesis es que los opiáceos del sistema nervioso central (cerebro y médula espinal) son activados por el ejercicio prolongado. Sin embargo, los ajustes fisiológicos para el ejercicio son complejos, y cualquier implicación de los opiáceos centrales puede ser oscurecida por las acciones centrales y periféricas de otros neurotransmisores, hormonas, y subproductos metabólicos del ejercicio.
¿Cuál es entonces la evidencia en apoyo de esta hipótesis? En los humanos, muchos investigadores han examinado las concentraciones opiáceas en el plasma antes, durante, y después del ejercicio para analizar este postulado. La mayo-ría de los investigadores han mostrado un incremento en la concentración de beta-endorfina periférica de la sangre después del ejercicio (26, 34, 46, 48, 69, 86), aunque algunos no han logrado mostrar un incremento firme (82); para revisar, ver Allen (2). Sin embargo, como se mencionó anteriormente, la mayor parte de la beta-endorfina medida en el plasma refleja la coliberación hipofisaria con ACTH en respuesta a los estímulos estresantes más que a la activación de las específicas vías de la beta-endorfina del SNC.
Otra estrategia experimental normalmente usada ha sido determinar si los ajustes fisiológicos para el ejercicio son alterados después de la administración intravenosa de naloxona. Se ha indicado que la naloxona da lugar a las alteradas catecolainina, glucosa, hormona del crecimiento, y concentraciones de cortisol del plasma, durante o después del prolongado ejercicio submáximo (35, 52, 81, 100). Ade-más, se ha sugerido que la naloxona bloquea el incremento, inducido por el ejercicio, del umbral del dolor (55, 131). De hecho, la mayoría de la evidencia experimental hasta ahora indica que los ajustes circulatorios, metabólicos, endocri-nos, y termorreguladores al ejercicio submáximo y máximo no son influidos por el pretratamiento con rialoxona (17, 68, 93, 96, 127, 140). El fracaso de la naloxona a alterar firmemente las respuestas fisiológicas para el ejercicio puede deberse al hecho de que se han usado dosis inadecuadas (reducidas). Puede suponerse que se precisan mayores dosis de naloxona para oponerse a los efectos de los péptidos opiáceos endógenos que los análogos opiáceos administra-dos exógenamente, y se exigen mayores dosis más elevadas para oponerse a los efectos facilitados por los delta- y kappa-receptores opiáceos, mientras que el mu-receptor está eficazmente bloqueado por menores dosis (5, 25, 108, 109, 114). Sin embargo, otra interpretación de los resultados vistos con elevadas dosis de naloxona es que pueden representar los efectos no-opiáceos (126).
Los estudios invasivos en animales han proporcionado la evidencia más convincente para la activación inducida por el ejercicio de los sistemas opiáceos centrales. El prolongado ejercicio submáximo (13), aunque no el breve ejercicio extenuante (97), incrementa el contenido e beta-endorfina del cerebro e induce un incremento facilitado (posiblemente por la endorfina) del sistema opiáceo endógeno en el umbral del dolor (131) en las ratas. Los ratones, sometidos a 3 min de entrenamiento del nado, cada 2 h muestran un claro síndrome de retraimiento cuando se les administra naloxona (24). Recientemente, Hoffmann y otros (64) han observado un incremento significativo en la concentración de beta-endorfina en el fluido cerebroespinal (CSF) de ratas entrenadas para correr espontáneamente en comparación con el CSF de los controles sedentarios. Los niveles de beta-endorfina en el CSF se mantenían elevados 24 y 48 h después del final del ejercicio, aunque regresaban al nivel control 96 h después del ejercicio. Los resultados de Sforzo y otros (129) también apoyan la hipótesis de la participación de los opiáceos del SNC en el ejercicio; podrían demostrar una alterada ocupación del receptor opiáceo en discretas áreas del cerebro después de 2 h nadando en las ratas. Tomados juntos, los resultados de estos estudios proporcionan el apoyo experimental para la implicación opiácea del sistema nerviosa central en respuesta al prolongado ejercicio submáximo.
Si los niveles centrales de beta-endorfina aumentan durante el ejercicio, ¿cuál es el estímulo para esta liberación aumentada? Para analizar esta cuestión, Yao y otros (163, 164) simularon los efectos del ejercicio estimulando el nervio ciático de ratas conscientes con una serie de pulsos eléctricos de baja frecuencia. La estimulación activaba las aferentes somáticas del músculo de la pierna y evocaba poderosas contracciones rítmicas del miembro posterior. La estimulación del nervio ciático durante 30 mm tenía varios efectos. Primero, el umbral del dolor de estos animales aumentaba marcadamente después de que cesaba la estimulación del nervio. El incremento en el umbral del dolor podría ser bloqueado con naloxona y por tanto dependía de un mecanismo opioidérgico (163). Segundo, la estimulación del nervio ciático reducía la síntesis de la norepinefrina del cerebro; este efecto también era invertido por la naloxona (104). Los animales también mostraban la sostenida depresión conductual después del cese de la estimulación del nervio (163).
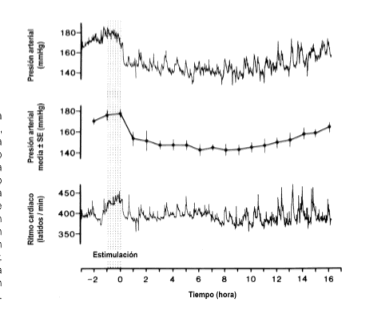
Figura 1. Cambios en la presión sanguínea arterial, la presión sanguínea arterial media, y el ritmo cardíaco, inducidos por la estimulación del músculo gastrocnemio de una rata espontáneamente hipertensa. La hipotensión persistía durante 15 h después de los 60 mm de estimulación muscular. [Reproducción autorizada de Hoffmann y Thorén (60)
Además, los experimentos de estimulación del nervio ciático dieron lugar a una observación interesante e inesperada. En las ratas con creciente secreción intestinal inducida por la coleratoxina, la estimulación del nervio inducía las disminuciones duraderas en la secreción intestinal mucho tiempo después de que se detuviera la estimulación. Este efecto era facilitado por los nervios eferentes hasta el intestino (20). En estos estudios, también se activaron las fibras aferentes A-delta (o Grupo III) en el nervio ciático si se incrementaba la intensidad del estímulo. Como se esperaría, la estimulación de estas aferentes evocaba el reflejo presorsomático (163), es decir, el incremento en el flujo simpático, la presión sanguínea, y el ritmo cardíaco que acompaña al ejercicio estático, y en menor grado al rítmico (98). Con las mayores intensidades del estímulo, Yao y otros (163) también observaron una sostenida reducción en la presión sanguínea después de que se detuviera la estimulación del nervio. Esta hipotensión no estaba acompañada por la esperada taquicardia y simpatoexcitación barorrefleja mediatizada; de hecho, el flujo neural simpático era reducido en comparación con las condiciones de control. Las reducciones en la presión sanguínea de 20 mmHg o más, que duraban durante varias horas, se vieron en ratas espontánea mente hipertensas (SER) aunque menos en las ratas normotensas y nada en las ratas hipertensas renales (59, 133, 163, 164). Las consecuen-cias conductuales y cardiovas culares de la estimulación del nervio podrían ser bloqueadas, no sólo por altas dosis de naloxona (10-15 mg·kg-1), sino por antagonistas de la serotonina centralmente activa. Por contra, la dexametasona, que bloquea la liberación de ACTH y beta-endorfina de la glándula pituitaria, no alteraba las respuestas posestimulación. Estas observaciones apoyan un papel para las endorfinas (opiáceos) del sistema nervioso central, a diferencia de las endorfinas que circulan periféricamente, facilitando las respuestas vistas después de la estimulación del nervio (163, 164).
Esta serie de experimentos ilustra cuatro puntos clave, que a su vez analizaremos: 1) los sostenidos cambios cardiovasculares y conductuales pueden ser elicitados por la estimulación prolongada del nervio ciático; 2) estas consecuencias (ej., una disminución en la presión sanguínea y la actividad del nervio simpático) contras-tan con los efectos directos de la estimulación del nervio; 3) los sistemas centrales de opiáceos y de serotonina participan en las sostenidas consecuencias cardiovasculares y conductuales de la estimulación del nervio; y 4) las secuelas neurales y cardiovasculares de la estimulación del nervio son más evidentes en las SHR, un modelo de hipertensión neurogénica en la rata, que en las ratas normotensas.
Recientemente, Hoffmann y Thorén (60) ha mostrado que respuestas circulatorias y conductuales, similares a las observadas con la estimulación del nervio ciático, podrían producirse mediante la directa estimulación eléctrica del músculo gastrocnemio. La estimulación muscular daba lugar a una bajada posestimuladora duradera en la presión sanguínea de las SHR (Fig. 1); esto podría ser suprimido mediante el pretratamiento de naloxona. La estimulación eléctrica del músculo también evocaba un incremento del 30% en el umbral del dolor, que duraba unas 3 h después del cese del estímulo (63).
¿Qué mecanismo podría explicar estos sostenidos efectos facilitados por los opiáceos de la estimulación del nervio o del músculo sobre la presión sanguínea, la conducta, el umbral del dolor, y el flujo neural simpático? Como se indicó antes, estas respuestas parecen ser facilitadas por la activación de las fibras aferentes A-delta o Grupo III procedentes del músculo. Histológicamente, las aferentes A-delta o Grupo III son un grupo notable de finas fibras de mielina situadas en los nervios del músculo esquelético, originalmente descritas como receptores de dolor-presión por Paintal (107). Las más recientes investigaciones indican que estas aferentes responden al estiramiento y contracción del músculo con descarga de baja frecuencia (74, 75, 79). Por esta razón, Kniffki y otros (79) llamaban a las terminaciones de estas aferentes, “ergorreceptores”. Las aferentes del Grupo III no responden a los pequeños movimientos del miembro y por tanto es improbable que tengan gran importancia en el control motor.
La contracción del músculo gastrocnemio a un nivel mayor o igual que el necesario para evocar el reflejo presor estimula a la mayoría de las aferentes del Grupo III (74). Por tanto podría concluirse de estas observaciones que la participación de varios grandes grupos musculares durante una actividad como el footing daría lugar al sustancial acceso al sistema nervioso central de estas aferentes del Grupo III y, si nuestra hipótesis es correcta, la activación de opiáceos centrales. Para extrapolar a partir de estos experimentos a la activación potencial de los opiáceos centrales con la actividad física en los seres humanos, la suposición de que la estimulación del nervio ciático o del músculo gastrocnemio puede usarse como un modelo para el ejercicio rítmico, requiere un apoyo adicional. Sin embargo, existen pruebas de que la estimulación eléctrica de las aferentes musculares y el ejercicio pueden inducir similares respuestas. Shyu y otros (131) mostraban que el ejercicio prolongado en las ratas puede inducir incrementos facilitados por los opiáceos en el umbral del dolor muy similares a los vistos con la estimulación del músculo y del nervio ciático. Los autores animaban a las SHR a desarrollar la conducta espontánea de la carrera, permitiendo el acceso a las ruedas de entrenamiento (132). La presión sanguínea podría medirse continuamente mediante un catéter arterial residente. Después de 6-7 semanas, las ratas corrían 5-7 km cada noche. Las respuestas de la presión sanguínea eran similares a las observadas durante los experimentos con la estimulación del nervio. Después de que dejaban de correr, las SHR exhibían una disminución transitoria de la presión sanguínea (y en algunos casos, una normalización de la presión sanguínea) durando hasta 2 h (Fig. 2). Cuando se comparaban con los controles sedentarios, las SHR que corrían de noche también demostraban un ritmo más lento de desarrollo de la hipertensión (61) y evidentes cambios conductuales con menos pruebas objetivas de nerviosismo y agresión (62). Compatible con los experimentos previos, la hipotensión posejercicio en las SHR podría bloquearse con elevadas dosis de naloxona.
Cuando se combinaban con los hallazgos previamente perfilados, estos estudios de las SHR conscientes apoyan nuestra suposición de que el ejercicio prolongado puede inducir efectos fisiológicos y conductuales que dependen de la activación de los sistemas opiáceos centrales. Además, a partir de estos resultados también postularíamos que estos efectos son facilitados por la activación continua de delga-das fibras de mielina Grupo III o A-delta, procedentes de los músculos esqueléticos contraídos.
¿Entonces cuál es el significado funcional de la activación ergorreceptora en el ejercicio? Especulamos que la activación ergorreceptora durante el ejercicio puede pro-yectar aparentemente influencias paradójicas sobre el sistema nervioso autónomo. Durante las breves contracciones musculares extenuantes, el impulso aferente ergorreceptor puede ejercer una no-opiácea influencia dependiente, excita dora, sobre los controladores autónomos que causan el retraimiento del tono vagal cardíaco y los incrementos específicos del tejido en el flujo neural simpático. Estos ajustes autónomos servirían para incrementar el ritmo cardiaco, el gasto cardíaco, la resistencia vascular regional, la presión sanguínea arterial, y, por tanto, ejercer la presión perfusora muscular y la distribución de O2. Este postulado es compatible con los recientes hallazgos de un acoplamiento firme entre las breves contracciones musculares eléctricamente inducidas y los estallidos de actividad renal del nervio simpático en los gatos anestesiados (150) . Tales contracciones musculares intermitentes activan a las aferentes musculares del Grupo III, aunque no las carentes de mielina del Grupo IV (75) . Por consiguiente, una consecuencia de la activación ergorreceptora puede permitir trabajar de acuerdo con las influencias volitivas centrales (es decir, el control central) para evocar los ajustes circulatorios y metabólicos que pre-paran al organismo para las demandas del ejercicio vigoro-so. Los hallazgos de que los niveles de endorfina del cerebro no se incrementan (97) y de que la naloxona no influye en el reflejo presor del ejercicio (152) apoyan la visión de que el sistema opiáceo endógeno no está implicado para facilitar los ajustes circulatorios para la breve activación muscular extenuante, aunque un estudio de Williams (158) muestra que la inyección intracisternal de naloxona antes de la clonidina impedía los efectos antipresores de la clonidina durante las contracciones musculares.
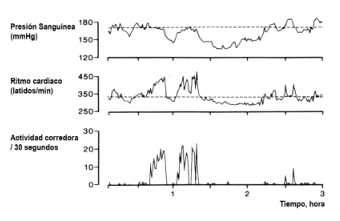
Figura 2. Presión arterial, ritmo cardíaco, y actividad corredora en una rata espontáneamente hipertensa durante tres horas de noche. Las líneas discontinuas representan la presión arterial media y el ritmo cardíaco medio, respectivamente, durante toda la noche. Observar la menor presión sanguínea después de la carrera. La hipotensión podría suprimirse si los animales fueran pretratados con naloxona (ver el texto). [Adaptado de Shyii y Thorén (134)].
Sin embargo, con el cese del ejercicio y sus entradas excitadoras asociadas, los efectos psicofisiológicos de la prolongada activación opiácea central pueden volverse manifiestos, explicando por tanto la depresión circulatoria y los cambios conductuales observados durante la recuperación. La importancia fisiológica de este mecanismo puede reducir las necesidades de energía del organismo (reducido estado catabólico) mientras que las reservas de energía se reabastecen (incrementado estado anabólico) para prepararse para el próximo período de elevada demanda metabólica. Esta idea es compatible con los conocidos efectos movilizadores del substrato de energía de la activación neural simpática y la liberación de la catecolamina suprarrenal durante el ejercicio (45). Esto además está apoyado por un reciente estudio de Farrell y otros (37), en el que mostraban que la activación opiácea inducida por el ejercicio estimula la secreción de insulina estimulada por la glucosa. Esto es importante en la restauración posejercicio de las reservas de energía. El incremento del umbral del dolor facilitado por el opiáceo central probablemente reduciría la incomodidad física aso-ciada con el prolongado ejercicio fatigoso.
LA REGULACIÓN DE LA PRESIÓN SANGUÍNEA Y EL CONTROL DE LA HIPERTENSIÓN ESENCIAL MEDIANTE EL EJERCICIO
Ahora analizaremos la evidencia de que la activación del sistema opiáceo endógeno mediante el ejercicio puede estar implicada en la regulación de la presión sanguínea, dado que ésta es una de las áreas mejor estudiadas. Muchos grupos han investigado la participación de los opiáceos endógenos en el control directo de la presión sanguínea (3, 38, 54, 85, 113, 123). Sin embargo, los resultados de estos experimentos son inconsistentes y varían según la zona de la inyección, la dosis, el tipo de opiáceo, y la especie de animal de laboratorio usada.
El ejercicio parece tener tres efectos claramente diferentes sobre la presión sanguínea. Una sesión intensa de ejercicio incrementará tanto la presión sanguínea arterial como el ritmo cardíaco. El segundo efecto, más evidente en los pacientes con hipertensión que en los sujetos normotensos (10), es una disminución de la presión sanguínea en el inmediato período posejercicio, comparada con los niveles preejercicio, que a menudo duran varias horas. De hecho, la presión sanguínea tiende a caer, incluso antes de que el sujeto abandone el ejercicio (10, 43). El tercer efecto es una reducción crónica de la presión sanguínea en reposo a menudo observada después de semanas o meses de regular ejercicio de resistencia (aeróbico) (70, 103). A diferencia del segundo efecto, esta sostenida reducción de la presión sanguínea puede verse en ausencia de ejercicio preceden-te. Creemos que este efecto crónico del ejercicio realizado regularmente es de gran interés y de importancia fisiológica y clínica.
Los efectos hipotensivos tanto del ejercicio agudo como del regular sobre la presión sanguínea sugieren un mecanismo por el que pueden manejarse algunas formas de hiper-tensión sin drogas (27, 32, 43, 49, 50, 70, 103, 1128, 147, 153, 155). En general (cf. 128), la mayoría de los investigadores han mostrado los efectos clínicamente importantes, aunque modestos (alrededor de 10 mmHg), del ejercicio regular sobre la presión sanguínea de los pacientes con hipertensión esencial. Todavía no está claro si el ejercicio puede reducir la presión sanguínea en la hipertensión experimental (Dahl sensible a la sal) (125, 130, 145).
Tanto una sola sesión prolongada como repetidas sesiones breves del submáximo ejercicio rítmico inducen marcadas disminuciones posejercicio en la presión sanguínea, que a menudo duran varias horas. Este fenómeno, principalmente observado en pacientes hipertensos, fue descrito originalmente por Gordon (49) y de nuevo por Fitzgerald (41) en un artículo “personal” y ha sido confirmado por otros investiga dores (10, 43, 70, 73, 155).
Aunque no se han aclarado los mecanismos, la obser-vación de que esta hipotensión posejercicio no está acom-pañada por la anticipada taquicardia barorrefleja (10, 155) sugiere que el control circulatorio reflejo ha sido alterado por el ejercicio. Este concepto es apoyado por unos estu-dios que demuestran que la habilidad para vasoconstreñir durante la ortostasis es deteriorada después del exhaustivo ejercicio isotónico incluso de breve duración (12). Estos hallazgos en los seres humanos con hipertensión son análogos a los previamente descritos en los estudios de las SHR que corren espontáneamente (Fig. 2) (134). Por esta razón, considerábamos si similares mecanismos eran responsables de la hipotensión posejercicio en las SER y en los seres humanos con hipertensión esencial. Sabiendo que las sostenidas consecuencias de la estimulación del nervio ciático incluían una disminución del flujo simpático así como una caída de la presión sanguínea (163), suponíamos que una única sesión de ejercicio, suficiente para reducir la presión sanguínea de los pacientes con hipertensión, también reducirían la actividad del nervio simpático (SNA). Por tanto reseñábamos la SEA postganglionar multifibra para el músculo esquelético en reposo, de los nervios peroneos de nueve hombres jóvenes con hipertensión límite antes y después de 45 min de ejercicio en la cinta andadora (43). También fueron estudiados cuatro sujetos antes y después del ejercicio “simulado” (es decir, la actividad deambulante normal). El ejercicio “simulado” no tenía efecto sobre la presión sanguínea en reposo o la SNA. Sin embargo, el ejercicio en la cinta andadora reducía la presión sanguínea sistólica en reposo, en siete sujetos, por término medio 13 mmHg. La actividad del nervio simpático, 60 mm después del ejercicio, se reducía en estos siete sujetos (Fig. 3) aunque no variaba, o aumentaba ligeramente, en dos sujetos sin hipotensión posejercicio. Por contra, cuando se infundía en cinco sujetos para generar una reducción de la presión sanguínea sistólica, similar a la vista después del ejercicio, el nitroprusiato incrementaba significativamente la actividad del nervio simpático. Estas observaciones demostraron que el ejercicio rítmico podría reducir la presión sanguínea en hombres con hipertensión límite y que esta hipotensión posejercicio se asociaba con una disminución, más que el incremento reflejo pronosticado, de la SNA. Por tanto concluíamos que la hipo-tensión posejercicio podría ser facilitada en parte por la inhibición de la actividad del nervio simpático.
Los resultados de los estudios de la estimulación prolongada del nervio ciático en las SHR nos permiten espe-cular que la caída de la presión sanguínea y la reducción de la actividad del nervio simpático, vistas en nuestros sujetos hipertensos, podrían ser bloqueadas con naloxona, y de hecho estamos actualmente implicados en los estudios para investigar específicamente esta hipótesis. La observación de que la respuesta depresora después del ejercicio es mayor en magnitud y duración en los seres humanos y las ratas hipertensos que en los normo tensos fomenta la fascinante posibilidad que alteraba la actividad opiácea central o el número receptor, o alteraba la actividad de los sistemas neurotransmisores que pueden ser modulados por las endorfinas, puede contribuir a la patogénesis de la “hipertensión neurogénica” tanto en las SHR (85) como en el hombre (94). Dado que la hipertensión puede ser temporalmente inhibida por el ejercicio rítmico prolongado tanto en los seres humanos como en las SHR, y tales alteraciones centrales en la actividad o función opiácea endógena parecerían reversibles - una observación con importantes implicaciones terapéuticas.
POTENCIALES PAPELES TERAPÉUTICOS PARA EL EJERCICIO Y LA ACTIVACIÓN DE LA ENDORFINA
Un potencial papel terapéutico para el ejercicio en el control de pacientes seleccionados con hipertensión esencial se presentó en la anterior sección. Nuestra hipótesis sugiere que el ejercicio también puede influir en la percepción del dolor y en la función inmunológica y ser beneficioso para el control del alcoholismo, la adicción, la depresión, y la anorexia nerviosa.
Percepción del dolor. Algunos de los efectos indicados del ejercicio sobre la percepción del dolor se han analizado antes. Los resultados de anteriores experimentos (63, 163, 164) indican que el umbral del dolor puede ser incrementado agudamente por la estimulación eléctrica tanto del nervio ciático como del músculo gastrocnemio y que estos efectos pueden ser bloqueados por la naloxona. La carrera espontánea también incrementa el umbral del quejido (dolor) en las SHR (131). Este incremento durará hasta 4 h después de que estos animales dejan de correr. La naloxona (1-2 mg·kg-1) invertía rápidamente el efecto analgésico de la carrera espontánea en estos experimentos. En estudios humanos, Haier y otros (55) y Janal y otros (69) mostraban un creciente umbral del dolor después del ejercicio prolongado. El efecto analgésico del ejercicio podría estar parcialmente influido por la naloxona. La estimulación transcutánea del nervio (TNS) de baja frecuencia y el cicloergómetro presentan efectos muy similares sobre la percepción del dolor dental. El umbral del dolor se eleva casi el 30% en comparación el control, y la elevación dura unos 60 mm (105). Estos últimos experimentos son fascinantes dado que sugerían que el sistema opiáceo endógeno puede estar implicado en los efectos analgésicos tanto de la acu-puntura como del footing.
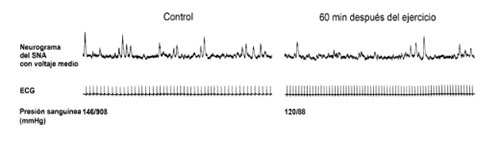
Figura 3. Efecto del ejercicio sobre la presión sanguínea y la actividad del nervio simpático. La actividad del nervio simpático muscular (SNA) y el electrocardiograma en un sujeto con hipertensión limite antes y 60 min después del ejercicio en la cinta andadora. La actividad del nervio simpático, registrada del nervio peroneo, y la presión sanguínea son menores después del ejercicio, mientras que el ritmo cardiaco aumenta.
¿Por qué sugieren que similares mecanismos pueden estar implicados en los efectos analgésicos mediadores de la acupuntura y el ejercicio prolongado? Los detallados estudios de la neurofisiología y la neuroquímica de la acupuntura indican que la aguja de la acupuntura estimula las aferentes somáticas del nervio muscular (probablemente las aferentes A-delta, Grupo III, analizadas anteriormente; y posiblemente también las fibras aferentes del Grupo IV, C carentes de mielina) (21, 56). Aproximadamente el 70% de los llamados puntos de acupuntura en el cuerpo son puntos motores (87), es decir, el punto en el que el nervio atraviesa la fascia y entra en el músculo. La anestesia local de la piel en el punto de acu-puntura no impedirá el efecto de la acupuntura, aunque la anestesia profunda del músculo lo bloquea totalmente (22). Por consiguiente, las respuestas a la acupuntura y al ejercicio prolongado podrían ser facilitadas por la excitación de las aferentes musculares de conducción lenta y la consiguiente activación de los sistemas opiáceos centrales.
Función inmunológica. Muchos corredores creen firmemente que el ejercicio los protege contra las infecciones comunes y que enfermarán si se interrumpe su pauta de ejercicio regular. Ignoramos la evidencia epidemiológica que apoye estas opiniones, aunque hay datos experimentales que indican que el ejercicio pueden influir en la función inmunológica (136).Bastante interesantemente, varios estudios recientes han demostrado que los opiáceos modulan (mejoran o suprimen) la función inmunológica; para revisión, vea Fischer y Falke (40). De especial interés es la mejora de la natural actividad de la célula supresora (MK) con muy reducidas dosis (fisiológicas) de beta-endorfina y encefalina (19, 33, 92). Sin embargo, debe recalcarse que no hay ninguna evidencia que vincule directamente al ejercicio con los opiáceos endógenos y la función inmunológica.
Adicción y alcoholismo. El alcohol puede influir en los sistemas neuro transmisores centrales implicados en la abstinencia de morfina (4), y el reciente trabajo sugiere que los sistemas opiáceos centrales también están implicados en la adicción al alcohol. La dependencia etílica en los ratones está asociada con las disminuciones en la concentración de beta-endorfina del hipotálamo y el mesencéfalo (156), y algunas fracciones de opiáceos del CSF disminuyen durante el inicial abandono del alcohol (15). Una aplicación clínica de esto ha sido el uso de la naloxona parenteral, que puede despertar bruscamente a los pacientes que están soñolientos debido a la intoxicación etílica (6, 88). Por consiguiente, el alcohol puede estimular la liberación de opiáceos de zonas del sistema nervioso central, y los síndromes de abstinencia pueden deberse a menores niveles de opiáceos centrales durante los períodos de abandono.
Un programa de ejercicio regular ¿puede beneficiar a los pacientes con adicción a la droga o al alcohol? La eficacia de la acupuntura en el control de pacientes con adicción al alcohol y a los opiáceos (18, 23, 44, 138, 141, 149, 154) fomenta la muy interesante e importante posibilidad teórica de que un vigoroso programa de ejercicio, junto con el tratamiento psiquiátrico y las intervenciones psicosociales, podría ayudar a la conversión del adicto de alguien dependiente de las fuentes exógenas de los opiáceos a un “endorfinista endógeno”.
Depresión y ansiedad. El ejercicio regular prolonga-do también puede inducir cambios de humor. Farrell y otros (36) encontraron una disminución de tensión psicológica en voluntarios sanos después de 40-80 mm de carrera a intensidades superiores al 40% del máximo consumo de oxígeno. Otras alternancias del humor indicadas después del ejercicio incluyen la alegría y la euforia, que podrían invertirse, en parte, mediante naloxona intravenosa (69).
El ejercicio parece ser casi tan eficaz como la terapia antidepresiva que se ocupa de tipos seleccionados de ansiedad y depresión (7, 51, 101, 102, 161). Aunque el mecanismo de estos cambios de humor podría ser a través del sistema opiáceo endóge- no, no todos los investigadores han sido capaces de bloquear estos cambios de humor inducidos por el ejercicio con la naloxona (90). Sin embargo, como analizábamos antes, la dosis usada en este estudio (0.8 mg) puede haber sido insuficiente para bloquear los sistemas opiáceos endógenos (25, 118).
Como se resumió antes, tanto la carrera voluntaria como la estimulación del nervio ciático pueden cambiar las pautas conductuales de las SHR (11, 62, 163). En una prueba de campo abierta, por ejemplo, Hoffmann y otros (62) encontraron que después del ejercicio las SHR sólo mostraban la mitad de la actividad locomotriz que sus controles sedentarias; es decir, los controles hipertensas sedentarias eran realmente “hiperactivas” en comparación con sus homólogas corredoras. Las ratas que hacían ejercicio también parecían ser menos agresivas que las controles. Se podría especular que tal conducta puede contribuir a la elevada presión sanguínea en las SHR sedentarias. Finalmente, estos animales mostraron una “reacción de abstinencia” con una considerable elevación en su conducta agresiva si, des-pués de 6 semanas de ejercicio diario, se les impidió correr bloqueando las ruedas de sus jaulas. Dado que la liberación central de opiáceos, desencadenada por la activación de las aferentes musculares, puede ser responsable de muchos de los cambios hemodinámicos y conductuales observados en las SHR que hacen ejercicio, los cambios de humor vistos en el hombre después del ejercicio pueden deberse a similares mecanismos. Por consiguiente, el ejercicio regular prolonga-do junto con el apoyo psicológico podría ser terapéutico en los pacientes seleccionados con leves enfermedades psicológicas o psiquiátricas y preferible, al menos como terapia inicial, a los enfoques farmacológicos para tales problemas.
Trastornos alimenticios. Ayunar pueden inducir cambios en los sistemas de la endorfina central que dan lugar a elevaciones en el umbral del dolor (95) y a disminuciones en la presión sanguínea de las SHR (162). De hecho, Kaye y otros (77) encontraron que la actividad opiácea del CSF aumentaba en los anoréxicos excesiva mente flacos, a diferencia de los pacientes que padecían anorexia nerviosa crónica pero que no estaban excesivamente delgados. La actividad opiácea del CSF volvía a los niveles normales en el primer grupo de pacientes después del recuperación del peso.
Sin embargo, la interpretación de los datos clínicos y experimentales no es sencilla. Se han mencionado disminuciones, no incrementos, en los niveles de beta-endorfina del plasma en los pacientes con bulimia (153), y en un estudio más reciente Kaye y otros (76) mencionaron hallazgos opuestos a los de su informe de 1982; a saber, una disminución en la concentración de beta-endorfinas del CSF y otros fragmentos de PONC en anoréxicos de peso insuficiente y un incremento en la concentración de CSF en estos péptidos después del aumento de peso.
Si estas últimas observaciones son correctas, el ejercicio regular podría contrarrestar los efectos de la anorexia o la bulimia restableciendo las endorfinas centrales a sus niveles normales. Bastante interesantemente, las cepas de ratas que normalmente no hacen ejercicio espontáneamente correrán hasta 8 km/d cuando están privados sólo del 10% de su ingesta normal de comida (121). Dado que el ejercicio puede reforzar la conducta anoréxica, sustituyendo la comida por ejercicio como mecanismo de activación opiácea central, serán necesarios estudios prospectivos controlados para determinar si el ejercicio regular será beneficioso o perjudicial para los pacientes con estos trastornos.
RESUMEN
Los hallazgos experimentales y clínicos analizados aquí nos llevan a proponer que el ejercicio rítmico prolongado puede activar los sistemas opiáceos centrales desencadenando la creciente descarga de las delgadas fibras nerviosas aferentes mecanosensitivas (Grupo III o A-delta) proceden-tes del músculo esquelético contraí- do. Hemos revisado la evidencia que apoya el concepto de que muchos de los efectos cardiovasculares, analgésicos, y conductuales de una única sesión de ejercicio rítmico prolongado o del ejercicio crónicamente realizado, son facilitados por este mecanismo. Creemos que se ha planteado alguna controversia en este área a partir de dos errores metodológicos: la suposición de que las concentraciones de beta-endorfina del plasma reflejarán los cambios en la actividad opiácea central y la suposición de que una reducida dosis de naloxona bloqueará estos sistemas opiáceos centrales.
También hemos revisado la evidencia en apoyo del concepto de que los mismos mecanismos pueden ser responsables de las respuestas centrales y periféricas al ejercicio rítmico prolongado y a la acupuntura. Una sugerencia esquemática de los mecanismos opioidérgicos comunes aparece en la Figura 4.
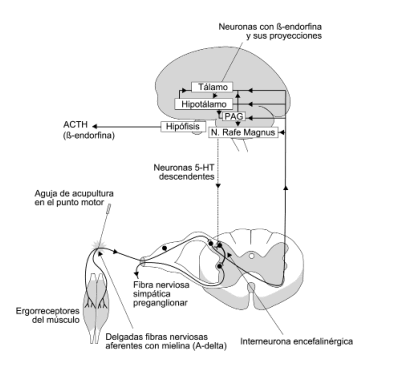
Figura 4. Esquema hipotético: cómo podría influir el ejercicio muscular y la acupuntura en las concentraciones opiáceas centrales (y periféricas) y ejercer sus efectos sobre la nocicepción y la presión sanguínea. El ejercicio activa “ergorreceptores” localizados en el músculo esquelético que reaccionan al estiramiento y a la contracción. Los impulsos se transmiten a la médula espinal a través de las delgadas fibras nerviosas de mielina (aferentes Grupo III o A-delta) y alcanzan el tálamo aunque también el núcleo del rafe magnus (NPN) y el núcleo gris periaqueductus (PAG) mediante vías espinales ascendentes. El tálamo, que está implicado en la percepción del dolor, tiene receptores opiáceos de varios tipos e incluye células nerviosas encefalinérgicas. El PAG y el NPM son parte del descendente sistema modulador del dolor, y el PAG ventral y los núcleos del rafe también están implicados en el control de la presión sanguínea del SNC. El PAG del mesencéfalo y el NRN del tallo cerebral son ricos en receptores opiáceos, y el PAG tiene células nerviosas dinorfinérgicas y encefalinérgicas. En el NEM, las neuronas inhibidoras serotonérgicas descendentes (5-HT) son activadas y las interneuronas encefalinérgicas espinales son estimuladas, y las fibras del nervio simpatico posiblemente preganglionares son influidas. Las señales ascendentes también continúan hasta el hipotálamo, dónde se liberan la beta-eridorfina, la encefalina, y la dinorfina. El hipotálamo, que está implicado en el control autónomo, que incluye la presión sanguínea, la conducta, la recompensa, y la modulación del dolor, contiene el N. Arcuatus, que es el principal emplazamiento de la célula nerviosa beta-endorfinérgica (extrapituitaria) en el SNC. El N. Arcuatus tiene proyecciones endorfinérgicas al tálamo, al PAG, y al tallo cerebral. La beta-endorfina liberada actúa probablemente como neuromoduladora o neurotransmisora. Además, el sistema hipofisario que contiene beta-endorfina es activado a medida que la beta-endorfina es coliberada con la ACTH desde la adenohipófisis en la circulación.
Referencias
1. AKIL, H., S. J. WATSON, E. YOUNG, M. E. LEWIS, H. KHACHATURIAN, and J. M. WALKER. (1984). Endogenous opioids: biology and function. Annu. Rev. Neurosci. 7:223-255
2. ALLEN, M. (1983). ALLEN, M. Activity generated endorphins: a review of their role in sports science. Can. J. Appl. Sport Sci. 8:115-133
3. APPEL, N. M., J. A. KIRITSY-ROY, and G. R. VAN LOON (1986). Mu -receptors at discrete hypothalamic and brainstem sites mediate opioid peptide-induced increases in central sympathetic outfl ow. Brain Res. 378:8-20
4. ASTON-JONES, G., S. L. FOOTE, and F. E. BLOOM (1982). Low doses of ethanol disrupt sensory responses of brain noradrenergic neurones. Nature 296:857-860
5. ATWEH, S. F. and M. J. KUHAR (1983). Distribution and physiological signifi cance of opioid receptors in the brain. Br. Med. Bull. 39:47-52
6. BADAWY, A. A.-B. and M. EVANS (1981). The mechanism of the antagonism by naloxone of acute alcohol intoxication. Br. J. Pharmacol. 74:514-516
7. BAHRKE, M. S. and W. P. MORGAN (1978). Anxiety reduction following exercise and meditation. Cognitive Ther. Res. 2:323-333
8. BASBAUM, A. I. and H. L. FIELDS (1984). BASBAUM, A. I. and H. L. FIELDS. Endogenous pain control systems: brain-stem spinal pathways and endorphin circuitry. Annu. Rev. Neurosci. 7:309-338
9. BENET, L. Z. and L. B. SHEINER (1985). Pharmacokinetics: the dynamics of drug absorbtion, distribution and elimination. In: Goodman and Gilman’s The Pharmacological Basis of Therapeutics, A. Goodman Gilman, L. S. Goodman, T. W. Rall, and F. Murad (Eds.). New York: MacMillan Publishing Company, pp. 3-34.
10. BENNETT, T., R. G. WILCOX, and I. A. MACDONALD (1984). Postexercise reduction of blood pressure in hypertensive men is not due to acute impairment of barorefl ex function. Clin. Sci. 67:97-103
11. BITTIKOFER-GRIFFIN, E. and D. ELY. (1987). Decrease in irritable aggression due to long-term voluntary aerobic exercise in spontaneously hypertensive rats (Abstract). Fed. Proc. 46:952
12. BJURSTEDT, H., G. ROSENHAMER, U. BALLDIN, and V. KATKOV (1983). Orthostatic reactions during recovery from exhaustive exercise of short duration. Acta Physiol. Scand. 119:25-31
13. BLAKE, M. J., E. A. STEIN, and A. VOMACHKA (1984). Effects of exercise training on brain opioid peptides and serum LM in female rats. Peptides 5:953-958
14. BLOOM, F. E (1983). The endorphins. A growing family of pharmaco- logically pertinent peptides. Annu. Rev. Pharmacol. Toxicol. 23:151-170
15. BORG, S., H. KVANDE, U. RYDBERG, L. TERENIUS, and A. WAHLSTROM (1982). Endorphin levels in human cerebrospinal fl uid during alcohol intoxication and withdrawal. Psychopharmacology 78:101-103
16. BOULOUX, P. M., A. GROSSMAN, S. AL-DAMLUJI, T. BAILEY, and M. BESSER (1985). Enhancement of the sympathoadrenal response to the cold-pressor test by naloxone in man. Clin. Sci. 69:365- 368
17. BRAMNERT, M. and B. HOKFELT (1985). Lack of effect of naloxone in a moderate dosage on the exercise-induced increase in blood pressure, heart rate, plasma catecholamines, plasma renin activity and plasma aldosterone in healthy males. Clin. Sci. 68:185-191
18. BULLOCK, M. L., P. D. CULLITON, and R. T. OLANDER (1989). Controlled trial of acupuncture for severe recidivist alcoholism. Lancet i:1435-1439
19. CARR, D. J. J. and G. R. KLIMPEL (1986). Enhancement of the generation of cytotoxic T cells by endogenous opiates. J. Neuroim-munol. 12:75-87
20. CASSUTO, J., P. LARSSON, T. YAO (1982). The effect of stimulating somatic afferents on cholera secretion in the rat small intestine. Acta Physiol. Scand. 116:443-446
21. CHANG, H.-T (1978). Neurophysiological basis of acupuncture analgesia. Sci. Sin. 21:829-846
22. CHANG, C.-Y., C.-T. CHANG, H.-L. CHU, and L.-F. YANG (1973). Peripheral afferent pathway for acupuncture analgesia. Sci. Sin. 16:210-217
23. CHOY, Y. M., W. W. TSO, K. P. FUNG, and K. C. LEUNG (1978). Suppression of narcotic withdrawals and plasma ACTH by auricular electroacupuncture. Biochem. Biophys. Res. Commun. 82:305-309
24. CHRISTIE, M. J. and G. B. CHESHER (1982). Physical dependence on physiologically released endogenius opiates. Life Sci. 30:1173- 1177
25. COHEN, M. R., R. M. COHEN, D. PICHAR, D. L. MURPHY, and W. E. BUNNEY (1982). Physiological effect of high dose naloxone administration to normal adults. Life Sci. 30:2025-2031
26. COLT, E. W. D., S. L. WARDLAW, and A. G. FRANTZ (1981). The effect of running on plasma beta-endorphin. Life Sci. 28:1637-1640
27. Cox, R. H., J. W. HUBBARD, J. E. LAWLER, B. J. SANDERS, and V. P. MITCHELL (1985). Exercise training attenuates stress-induced hypertension in the rat. Hypertension 7:747-751
28. CRINE, P., C. GIANOULAKIS, N. G. SEIDAH (1978). et al. Biosynthesis of beta-endorphin from beta-lipotropin and a larger molecular weight precursor in rat pars intermedia. Proc. Natl. Acad. Sci. U.S.A. 75:4719-4723
29. CUELLO, A. C (1983). Central distribution of opioid peptides. Br. Med. Bull. 39:11-16
30. EIMERL, J. and G. FEUERSTEIN (1986). The effect of μ, δ and κ opioid receptor agonists on heart rate and blood pressure of the pithed rat. Neuropeptides 8:351-358
31. ELDE, R., T. HOKFELT, O. JOHANSSON (1978). et al. Immunohistochemical localization of peptides in the nervous system. In: Centrally Acting Peptides, J. Hughes (Ed.). London: Macmillan, pp. 17-35.
32. FAGARD, R. (1985). Habitual physical activity, training, and blood pressure in normo- and hypertension. Int. J. Sports Med. 6:57-67
33. FAITH, R. E., H. J. LIANG, A. J. MURGO, and N. P. PLOTNIKOFF (1984). Neuroimmunomodulation with enkephalins: enhancement of human natural killer (NK) cell activity in vitro. Clin. Immunol. Immunopathol. 31:412-418
34. FARRELL, P. A., W. K. GATES, M. G. MAKSUD, and W. P. MORGAN (1982). Increases in plasma beta-endorphin/beta-lipotropin immunoreactivity after treadmill running in humans. J. Appl. Physiol. 52:1245-1249
35. FARRELL, P. A., A. B. GUSTAFSON, T. L. GARTHWAITE, R. K. KALKHOFF, A. W. COWLEY, JR., and W. P. MORGAN (1986). FARRELL, P. A., A. B. GUSTAFSON, T. L. GARTHWAITE, R. K. KALKHOFF, A. W. COWLEY, JR., and W. P. MORGAN. J. Appl. Physiol. 61:1051-1057
36. FARRELL, P. A., A. B. GUSTAFSON, W. P. MORGAN, and C. B. PERT (1987). Enkephalins, catecholamines, and psychological mood alterations: effects of prolonged exercise. Med. Sci. Sports Exerc. 19:347-353
37. FARRELL, P. A., B. SONNE, K. MIKINES, and H. GALBO (1988). Stimulatory role for endógenous opioid peptides on postexercise insulin secretion in rats. J. Appl. Physiol. 65:744-749
38. FEUERSTEIN, G., R. L. ZERBE, and A. I. FADEN. (1983). Opiate receptors and cardiovascular control in conscious SHR and WKY rats. Hypertension 5:663-671
39. FEUERSTEIN, G. and Z. ZUKOWSKA-GROJEC (1987). Effect of dermophin and morphine on the sympathetic and cardiovascular system of the pithed rat. Neuropeptides 9:139-150
40. FISCHER, E. G. and N. E. FALKE (1984). Beta-endorphin modulates immune functions. Psychot her. Psychosoin. 42:195-204
41. FITZGERALD, W. (1981). Labile hypertension and jogging: new diagnostic tool or spurious discovery. Br. Med. J. 282:542-544
42. FLORAS, J. S. and P. SLEIGHT (1982). Ambulatory monitoring of blood pressure. In: Scientifi c Foundations of Cardiology, P. Sleight, J. V. Jones (Eds.). London: Heineman, pp. 155-164.
43. FLORAS, J. S., C. A. SINKEY, P. E. AYLWARD, D. R. SEALS, P. N. THORÉN, and A. L. MARK (1989). Post-exercise hypotension and sympathoinhibition in borderline hypertensive men. Hypertension 14:28-35
44. GAAL, C. M. and C. FREEBAIRN (1979). Ear acupuncture relaxation therapy in alcoholics. Med. J. Aust. 2:179-180
45. GALBO, H. (1983). Hormonal and Metabolic Adaptation to Exercise. New York: Thieme-Stratton, Inc.
46. GAMBERT, S. R., T. L. GARTHWAITE, C. H. PONTZER (1981). Running elevates plasma beta-endorphin immunoreactivity and ACTH in untrained human subjects. Proc. Soc. Exp. Biol. Med. 168:1-4
47. GANTEN, D., T. UNGER, B. SCHLOKENS, W. RASCHER, G. SPECK, and G. STOCK. (1981). In: Role of Neuropeptides in Regulation of Blood Pressure. Disturbances in Neurogenic Control of the Circulation, F. Abboud, H. Fozzard, and D. Reis (Eds.). American Physiology Society, pp. 139-151.
48. GOLDFARB, A. H., B. D. HATFIELD, G. A. Sforzo, and M. G. FLYNN. (1987). Serum beta-endorphin levels during a graded exercise test to exhaustion. Med. Sci. Sports Exerc. 19:78-82
49. GORDON, G. A. (1907). Observations on the effect of prolonged and severe exertion on the blood pressure in healthy athletes. Edinburgh Med. J. 22:53-56
50. GREENLEAF, J. E., D. SCIARAFFA, E. SHVARTZ, L. C. KEIL, and P. J. BROCK. (1981). Exercise training hypotension: implications for plasma volume, renin, and vasopressin. J. Appl. Physiol.: Respirat. Environ. Exerc. Physiol. 51:298-305
51. GREIST, J. H., M. H. KLEIN, R. R. EISCHENS, J. FARIS, A. S. GURMAN, and W. P. MORGAN. (1979). Running as treatment for depression. Compr. Psychiatry 20:41-53
52. GROSSMAN, A., P. BOULOUX, P. PRICE (1984). The role of opioid peptides in the hormonal responses to acute exercise in man. Clin. Sci. 67:483-491
53. GUILLEMIN, R., T. VARGO, J. Rossier (1977). Beta-endorphin and adrenocorticotropin are secreted concomitantly by the pituitary gland. Science 197:1367-1369
54. HADDAD, G. G., H. J. JENG, and T. L. Lai. (1987). HADDAD, G. G., H. J. JENG, and T. L. Lai. Effect of endorphins on heart rate and blood pressure in adult dogs. Am. J. Physiol. 250:H796-H805
55. HAIER, R. J., K. Quaid, and J. S. C. MILLS. (1981). Naloxone alters pain perception after jogging. Psychiatry Res. 5:231-232
56. HAN, J. S. and L. TERENIUS (1982). Neurochemical basis of acupuncture analgesia. Annu. Rev. Pharmacol. Toxicol. 22:193-220
57. HE, L. (1987). Involvement of endogenous opioid peptides in acupuncture analgesia. Pain 31:99-121
58. HEDNER, T. and G. NORDBERG. (1989). Opioid receptors: types, distribution and pharmacological profi les. In: Spinal Narcotics, D. W. Coombs and N. Raval (Eds.). Boston: Martinus Nijhoff Publishing, pp. 11-20.
59. HOFFMANN, P. and P. THORÉN. (1986). Long-lasting cardiovascular depression induced by acupuncture-like stimulation of the sciatic nerve in unanaesthetized rats. Effects of arousal and type of hypertension. Acta Physiol. Scand. 127:119-126
60. HOFFMANN, P. and P. THORÉN. (1988). Electric muscle stimulation in the hind leg of the spontaneously hypertensive rat induces a long-lasting fall in blood pressure. Acta Physiol. Scand. 133:211- 219
61. HOFFMANN, P., P. FRIBERG, D. ELY, AND P. THORÉN. (1987). Effect of spontaneous running on blood pressure, heart rate and cardiac dimensions in developing and established spontaneous hypertension in rats. Acta Physiol. Scand. 129:535-542
62. HOFFMANN, P., P. THORÉN, and D. ELY. (1987). Effect of voluntary exercise on open-fi eld behavior and on aggression in the spontaneously hypertensive rat (SHR). Behav. Neural Biol. 47:346- 355
63. HOFFMANN, P., J. O. SKARPHEDINSSON, M. DELLE, and P. THORÉN (1990). Electric muscle stimulation of gastrocnemius muscle in the spontaneously hypertensive rat increases pain threshold. Role of different serotonergic receptors. Acta Physiol. Scand. 138:125-131
64. HOFFMANN, P., L. TERENIUS, and P. THORÉN. (1990). Cerebrospinal fl uid immunoreactive beta-endorphin concentration is increased by long-lasting voluntary exercise in the spontaneously hypertensive rat. Regulatory Peptides 28:233-239
65. HOLADAY, J. W. (1983). Cardiovascular effects of endogenous opiate systems. Annu. Rev. Pharmacol. Toxicol. 23:541-594
66. ILLES, P., D. RAMME, and K. STARKE. (1986). Presynaptic opioid O-receptors in the rabbit mesenteric artery. J. Physiol. 379:217-228
67. ILLES, P., R. BETTERMAN, and D. RAMME. (1987). Sympathoinhibitory opioid receptors in the cardiovascular system. In: Brain Peptides and Catecholamines in Cardiovascular Regulation, J. P. Buckley and C. M. Ferrario (Eds.). New York: Raven Press, pp. 169-184.
68. IMAI, N., C. K. STONE, P. D. WOOLF, and C.-S. LIANG. (1988). Effects of naloxone on systemic and regional hemodynamic responses to exercise in dogs. J. Appl. Physiol. 64:1493-1499
69. JANAL, M. N., E. W. D. COLT, W. C. CLARK, and M. GLUSMAN (1984). Pain sensitivity, mood and plasma endocrine levels in man following long-distance running: effects of naloxone. Pain 19:13-25
70. JENNINGS, G. L., L. NELSON, M. D. ESLER, P. LEONARD, and P. I. KORNER. (1984). Effects of changes in physical activity on blood pressure and sympathetic tone. J. Hypertens. 2 (suppl. 3):S 139- S141
71. JUDD, L. L., D. JANOWSKY, D. EGAL, and L. Y. HUEY. (1980). Naloxone- induced behavioural effects in normal and manic subjects. Arch. Gen. Psychiatry 37:583-586
72. KARRAS, P. J. and R. A. NORTH. (1981). Acute and chronic effects of opiates on single neurons of the myenteric plexus. J. Fha rmacol. Exp. Ther. 217:70-80
73. KAUFMAN, F. L., R. L. HUGHSON, and J. P. SCFIAMAN. (1987). Effect of exercise on recovery blood pressure in normotensive and hypertensive subjects. Med. Sci. Sports Exerc. 19:17-20
74. KAUFMAN, M. P., J. C. LONGHURST, J. RYBYCKI, J. H. WALLACH, and J. H. MITCHELL. (1983). Effects of static muscular contraction in impulse activity of groups III and IV afferents in cats. Appi. Physiol.: Respirat. Environ. Exerc. Physiol. 55:105-112
75. KAUFMAN, M. P., T. G. WALDROP, K. J. RYBYCKI, G. A. ORDWAY, and J. H. MITCHELL. (1984). Effects of static and rhythmic twitch contractions on the discharge of group III and IV muscle afferents. Cardiovasc. Res. 18:663-668
76. KAYF, W. H., W. H. BERRETTINI, H. E. GWIRTSMAN (1987). Reduced cerebrospinal fl uid levels of immunoreactive pro-opiomelanocortin related peptides (including beta-endorphin) in anorexia nervosa. Life Sci. 41:2147-2155
77. KAYE, W. H., D. PICKAR, D. NABER, and M. H. EBERT. (1982). Cere-brospinal fl uid opioid activity in anorexia nervosa. Am. J. Psychiatry 139:643-645
78. KHACHATURIAN, H., M. E. LEWIS, M. K.-H. SCHAFER, and S. J. WATSON (1985). Anatomy of the CNS opioid systems. Trends Neurosci. 8:111-119
79. KNIFFKI, K.-D., S. MENSE, and R. F. SCHMIDT (1981). Muscle receptors with fi ne afferent fi bers which may evoke circulatory refl exes. Circ. Res. 48 (Suppl. I):125-131
80. KONISHI, S., A. TSUNOO, and M. OTSUKA (1979). Enkephalins presynaptically inhibit cholinergic transmission in sympathetic ganglia. Nature 282:515-516
81. LAM, K. S. L., A. GROSSMAN, P. BOULOUX, P. L. DRURY, and G. M. BESSER. (1986). Effect of an opiate antagonist on the responses of circulating catecholamines and the renin-aldosterone system to acute sympathetic stimulation by hind-grip in man. Acta Endocrinol. 111:252-257
82. LANGENFELD, M. E., L. S. HART, and P. C. KAO. (1987). Plasma betaendorphin responses to one-hour bicycling and running at 50% VO2max. Med. Sci. Sports Exerc. 19:83-86
83. LAUBIE, M., H. SCHMITT, M. VINCENT, and G. REMOND. (1977). Central cardiovascular effects of morphinomimetic peptides in dogs. Fur. I Pharmacol. 16:67-71
84. LEUNG, C. M. K., C. W. OGLE, and S. DAI. (1986). LEUNG, C. M. K., C. W. OGLE, and S. DAI. Cardiovascular responses to sympathetic nerve stimulation in morphine-treated rats. Neuropharmacology 25:597-602
85. LEVIN, E. R., S. MILLS, and M. A. WEBER. (1986). Endogenous opioids and opiate antagonists modulate the blood pressure of the spontaneously hypertensive rat. Peptides 7:977-981
86. LI, W.-I. and C.-L. CI-IEN. (1987). LI, W.-I. and C.-L. CI-IEN. Running and shipping elevate plasma levels of beta-endorphin-like substance (B-end-Li) in thoroughbred horse. Life Sci. 40:1411-1421
87. LIU, Y. H., M. VARELA, and R. OSWALD. (1975). The correspondence between some motor points and acupuncture loci. Am. J. Chin. Med. 3:347-358
88. LYON, L. J. and K. J. ANTHONY. (1982). Reversal of alcoholic coma by naloxone. Ann. Intern. Med. 96:464-465
89. MAINS, R. E., B. A. EIPPER, and N. LING. (1977). Common precursor to corticotropins and endorphins. Proc. Natl. Acad. Sci. U.S.A. 74:3014-3018
90. MARKOFF, R. A., P. RYAN, and T. YOUNG. (1982). Endorphins and mood changes in long-distance running. Med. Sci. Sports Exerc. 14:11-15
91. MARSON, L., J. A. KIRITSY-ROY, and G. R. VAN LOON. (1989). Opioid peptide modulation of cardiovascular and sympathoad-renal responses to stress. Am. J. Physiol. 257:R901-R908
92. MATHEWS, P. M., C. J. FROELICH, W. L. SIBBITT, and A. D. BANKHURST. (1983). Enhancement of natural cytotoxity by beta-endorphin. J. Immunol. 130:1658-1662
93. MAYER, G., J. WESSEL, and J. KOBBERLING (1980). Failure of naloxone to alter exercise-induced growth hormone and prolactin release in normal men. Clin. Endocrinol. 13:413-416
94. MCCUBBIN, J. A., R. S. SURWIT, and R. B. WILLIAMS. (1985). Endogenous opiate peptides, stress reactivity, and risk for tension. Hypertension 7:808-811
95. MCGIVERN, R. F., C. BERKA, G. G. BERNTSON, M. WALKER, and C. A. SANDMAN. (1979). Effect of naloxone on analgesia induced by food deprivation. Life Sci. 25:885-888
96. MCMURRAY, R. G., D. S. SHEPS, and D. M. GUINAN. (1984). Effects of naloxone on maximal stress testing in females. J. Appl. Physiol. 56:436-440
97. METZGER, J. M. and E. A. STEIN. (1984). METZGER, J. M. and E. A. STEIN. β-endorphin and sprint training. Life Sci. 34:1541-1547
98. MITCHELL, J. H. and R. F. SCHMIDT. (1983). Cardiovascular refl ex control by afferent fi bers from skeletal muscle receptors. In: Handbook of Physiology. The Cardiovascular System, Vol III, Part II, J. T. Shepherd and F. M. Abboud (Eds.). Bethesda: American Physiological Society, pp. 623-658.
99. MONTRASTRUC, J. L., P. MONTRASTRUC, and F. MARALES- OLIVAS. (1981). Potentiation by naloxone of pressor refl exes. Br. J. Pharmacol. 74:105-109
100. MORETTI, C. A. FABBRI, L. GNESSI (1983). Naloxone inhibits exercise-induced release of PRL and GH in athletes. Clin. Endocrinol. 18:135-138
101. MORGAN, W. P. (1985). ffective benefi cence of vigorous physical activity. Med. Sci. Sports Exerc. 17:94-100
102. MORGAN, W. P., J. A. ROBERTS, F. R. BRAND, and A. D. FEINERMAN (1970). Psychological effect of chronic physical activity. Med. Sci. Sports 2:213-217
103. NELSON, L., M. D. ESLER, G. L. JENNINGS, and P. I. KORNER. (1986). Effect of changing levels of physical activity on blood-pressure and haemo-dynamics in essential hypertension. Lancet 2:473- 476
104. NISSBRANDT, H., T. YAO, P. THORÉN, and T. H. SVENSSON. (1982). Naloxone reversible eduction in brain monoamine synthesis following sciatic nerve stimulation. J. Neural Transm. 53:91-100
105. OLAUSSON, B., E. ERIKSSON, L. ELLMARKER, B. RYDENHAG, B.-C. SHYU, and S. A. ANDERSSON. (1986). Effects of naloxone on dental pain threshold following muscle exercise and low frequency transcutaneous nerve stimulation: a comparative study in man. Acta Physiol. Scand. 126:299-305
106. OLAUSSON, B., E. ERIKSSON, L. ELLMARKER, B. RYDENHAG, B.-C. SHYU, and S. A. ANDERSSON. (1986). Effects of naloxone on dental pain threshold following muscle exercise and low frequency transcutaneous nerve stimulation: a comparative study in man. Acta Physiol. Scand. 126:299-305
107. PAFFENBARGER, R. S., R. T. HYDE, A. L. WING, and C.-C. HSIEH. (1986). Physical activity, all-cause mortality, and longevity of college alumni. N. Engl. J. Med. 314:605-613
108. PAINTAL, A. S. (1960). Functional analysis of group III afferent fi bres of mammalian muscles. J. Physiol. 152:250-270
109. PASTERNAK, G. W. and S. H. SNYDER. (1975). Identifi cation of novel high affi nity opiate receptor binding in rat brain. Nature 253:563-565
110. PATERSON, S. J., L. E. ROBSON, and H. N. KOSTERLITZ. (1983). Classifi cation of opioid receptors. Br. Med. Bull. 39:31-36
111. PERT, A., R. DIONNE, L. NG, E. BRAGIN, T. W. MOODY, and C. B. PERT. (1981). Alterations in rat central nervous system endorphins following transauricular electroacupuncture. Brain Res. 224:83- 93
112. PERT, C. B. and S. H. SNYDER. (1973). Opiate receptor: demonstration in nervous tissue. Science 179:1011-1014
113. PETTY, M. and J. L. REID. (1981). The effect of opiates on arterial baroreceptor refl ex function in the rabbit. Naunyn Schmiedebergs Arch. Pharmacol. 319:206-211
114. PFEIFFER, A., G. FEUERSTEIN, R. L. ZERBE, A. I. FADEN, and I. J. KOPIN. (1983). Mu-receptors mediate opioid cardiovascular effects at anterior hypothalamic sites through sympatho-adrenomedullary and parasympathetic pathways. Endocrinology 113:929-938
115. PICKWORTH, W. B. and L. G. SHARPE. (1979). EEG-behavioral dissociation after morphine- and cyclazocine-like drugs in the dog: further evidence for two opiate receptors. Neuropharmacology 18:617-622
116. REID, J. L. and P. C. RUBIN. (1987). Peptides and central neural regulation of the circulation. Physiol. Rev. 67:725-749
117. ROSSIER, J., E. D. FRENCH, C. RIVIER, N. LING, R. GUILLEMIN, and F. E. BLOOM. (1977). Foot-shock induced stress increases beta- endorphin levels in blood but not brain. Nature 270:618-620
118. ROWELL, L. B. (1986). Human Circulation. Oxford: Oxford University Press
119. RUBIN, P. C. (1984). Opioid peptides in blood pressure regulation in man. Clin. Sci. 66:625-630
120. RUBIN, P. C., T. F. BLASCHKE, and C. GUILLEMINAULT. (1981). Effect of naloxone, a specifi c inhibitor on blood pressure fall during sleep. Circulation 63:117-121
121. RUBIN, P. C., K. MCLEAN, and J. L. REID. (1983). Endogenous opioids and barorefl ex control in humans. Hypertension 5:535-538
122. RUSSELL, J. C., W. F. EPLING, D. PIERCE, R. M. AMY, and D. P. BOER. (1987). Induction of voluntary prolonged running by rats. J. Appl. Physiol. 63:2549-2553
123. SALAR, G., I. JOB, S. MINGRINO, A. BASIO, and M. TRABUCCHI. (1981). Effect of transcutaneous electrotherapy on CSF beta-endorphin content in patients without pain problems. Pain 10:169-172
124. SANDER, G. E., R. F. LOWE, M. B. GIVEN, R. H. WOLF, and T. D. GILES. (1986). Haemodynamic responses to systemic methionineenkephalin in conscious dogs are mediated by opiate receptors perfused by the vertebral artery. Hypertension 4:S34-S36
125. SAR, M., W. E. STUMPF, R. J. MILLER, K.-J. CHANG, and P. CUATRECASAS. (1978). Immunohistochemical localization of enkephalin in brain and spinal cord. J. Comp. Neurol. 182:17-38
126. SAVAGE, M. V., G. F. MACKIE, and C. P. BOLTER. (1986). Effect of exercise on the development of salt-induced hypertension in Dahl-S rats. J. Hypertens. 4:289-293
127. SAWYNOK, J., C. PINSKY, and F. S. LABELLA. (1979). Minireview on the specifi city of naloxone as an opiate antagonist. Life Sci. 25:1621-1631
128. SCHWELLNUS, M. P. and N. F. GORDON. (1987). The role of endogenous opioids in thermoregulation during sub-maximal exercise. Med. Sci. Sports Exerc. 19:575-578
129. SEALS, D. and J. M. HAGBERG. (1984). The effect of exercise training on human hypertension: a review. Med. Sci. Sports Exerc. 16:207-215
130. SFORZO, G. A., T. F. SEEGER, C. P. PERT, A. PERT, and C. O. DOTSON. (1986). In vivo opioid receptor occupation in the rat brain following exercise. Med. Sci. Sports Exerc. 18:380-384
131. SHEPHERD, R. E., M. L. KUEHNE, J. KENMOK, J. L. DURSTINE, T. W. BALON, and J. P. RAPP. (1982). Attenuation of blood pressure increases in Dahl salt-sensitive rats by exercise. J. Appl. Physiol.: Respirat. Environ. Exerc. Physiol. 52:1608-1613
132. SHYU, B.-C., S. A. ANDERSSON, and P. THORÉN. (1982). Endorphin mediated increase in pain threshold induced by long-lasting exercise in rats. Life Sci. 30:833-840
133. SHYU, B.-C., S. A. ANDERSSON, and P. THORN. (1984). Spontaneous running in wheels. A microprocessor assisted method for measuring physiological parameters during exercise in rodents. Acta Physiol. Scand. 121:103-109,
134. SHYU, B.-C., S. A. ANDERSSON, and P. TH0RÉN. (1984). Circulatory depression following low frequency stimulation of the sciatic nerve in anaesthethized rats. Acta Physiol. Scand. 121:97-102
135. SHYU, B.-C. and P. THORÉN. (1986). Circulatory events following spontaneous muscle exercise in normotensive and hypertensive rats. Acta Physiol. Scand. 128:515-524
136. SIMON, E. J., J. M. HILLER, and I. EDELMAN. (1973). Stereospecifi c binding of the potent narcotic analgesic [3H] etorphine to rat brain homogenates. Proc. Natl. Acad. Sci. U.S.A. 70:1947-1949
137. SIMON, H. B. (1984). The immunology of exercise. A brief review. J.A.M.A. 252:2735-2738
138. SJÖLUND, B., L. TERENIUS, and M. ERIKSSON. (1977). Increased cerebrospinal fl uid levels of endorphins after electroacupuncture. Acta Physiol. Scand. 100:382-384
139. SMITH, M. O., R. SQUIRES, J. APONTE, N. RABINOWITZ, and S. W. REGINA-BONILLA-RODRIGUEZ. (1982). SMITH, M. O., R. SQUIRES, J. APONTE, N. RABINOWITZ, and S. W. REGINA-BONILLA-RODRIGUEZ. Acupuncture treatment of drug addiction and alcohol abuse. Am. J. Acupuncture 10:161 -163
140. SMYTH, D. G. (1983). Beta-endorphin and related peptides in pituitary, brain, pancreas, and antrum. Br. Med. Bull. 39:25-30
141. STAESSEN, J., R. FIOCcI-u, R. BOUILLON (1985). The nature of opioid involvement in the hemodynamic respiratory and humoral responses to exercise. Circulation 72:982-990
142. SYTINSKY, I. A. and L. V. GALEBSKAYA. (1979). Physiologo-biochemical bases of drug dependence treatment by electro-acupuncture. Addic. Behav. 4:97-120
143. TERENIUS, L. (1973). Stereospecifi c interaction between narcotic analgesics and a synaptic plasma membrane fraction of rat cerebral cortex. Acta Pharmacol. Toxicol. 32:317-320
144. THOMPSON, P. D., E. M. CULLINANE, S. P. SADY (1988). Modest changes in high-density lipoprotein concentration and metabolism with prolonged exercise training. Circulation 78:25-34
145. THORNHILL, J. A., L. GREGOR, and W. S. SAUNDERS (1989). Opiate and alphareceptor antagonists block the pressor responses of conscious rats given intravenous dynorphin. Peptides 10:171-177
146. TIPTON, C. M., J. M. OVERTON, E. B. PEPIN, J. G. EDWARDS, J. WEGNER, and E. M. YOUMANS. (1987). Infl uence of exercise training on resting blood pressures of Dahl rats. J. Appl. Physiol. 63:342- 346
147. UHL, G. R., R. R. GOODMAN, M. S. KUHAR, S. R. CHILDERS, and S. H. SYNDER. (1979). Immuno-histochemical mapping of enkephalin containing cell bodies, fi bres and nerve terminals in the brain stem of the rat. Brain Res. 167:77-91
148. URATA, H., Y. TANABE, A. KIYONAGA (1987). A tihypertensive and volume depleting effects of mild exercise on essential hypertension. Hypertension 9:245-252
149. VAN LOON, G. R., N. M. APPEL, and D. HO. (1981). Beta-endorphininduced increases in plasma epinephrine, norephinephrine and dopamine in rats: inhibition of adrenomedullary response by intracerebral somatostatin. Brain Res. 212:207-214
150. VEREBEY, K. and K. BLUM. (1979). Alcohol euphoria: possible mediation via endorphinergic mechanisms. J. Psychiatr. Drugs 11:305-311
151. VICTOR, R. G., D. M. Rorro, S. L. PRYOR, and M. P, KAUFMAN. (1989). Stimulation of renal sympathetic activity by static contraction: evidence for mechanoreceptor-induced refl exes from skeletal muscle. Circ. Res. 64:592-599
152. VOLAVKA, J., J. BAUMAN, J. PEVNICK, D. REKER, B. JAMES, and D. CHO. (1980). Short-term hormonal effects of naloxone in man. Psychoneuroendocrinology 5:225-234
153. WALDROP, T. G. and G. A. IWAMOTTO. (1984). Effects of naloxone on the cardiovascular responses to muscular contraction in decerebrate cats. Brain Res. 322:152-156
154. WALLER, D. A., R. S. KISER, B. W. HARDY, I. FUCHS, L. P. FEIGENBAUM, and R. UAUY. (1986). Eating behavior and plasma betaendorphin in bulimia. Am. J. Clin. Nutr. 44:20-23
155. WEN, H. L., W. K. K. Ho, N. LING, Z. D. MEHAL, and Y. H. NG. (1980). Immunoassayable beta-endorphin level in the plasma and CSF of heroin addicted and normal subjects before and after electroacupuncture. Am. J. Chin. Med. 8:154-159
156. WILCOX, R. G., T. BENNETT, A. M. BROWN, and I. A. MACDONALD. (1982). Is exercise good for high blood pressure?. Br. Med. J. 285:767-769
157. WILKINSON, C. W., J. C. CRABBE, L. D. KEITH, J. W. KENDALL, and D. M. DORSA. (1986). Infl uence of ethanol dependence on regionalbrain content of beta-endorphin in the mouse. Brain Res. 378:107-114
158. WILLER, J. D., F. BOUREAU, C. DAUTHIER, and M. BONORA. (1979). Study of naloxone in normal awake man: effects on heart rate and respiration. Neuropharmacology 18:469-472
159. WILLIAMS, C. E. (1985). Effect of clonidine and naloxone on the pressor response during contraction of cat hind-limb muscles. Cardiovasc. Res. 19:474-482
160. WILLIAMS, J. T. and R. A. NORTH. (1979). Effects of endorphins on single myenteric neurons. Brain Res. 165:57-65
161. WILLIAMS, P. T., P. D. WOOD, W. L. HASKELL, and K. VRANIZAN (1982). The effect of running mileage and duration on plasma lipoprotein levels. J.A.M.A. 247:2674-2679
162. WOOD, D. T. (1977). The relationship between state anxiety and acute physical activity. Am. Corr. Ther. J. 67-69
163. WRIGHT, O. L., J. P. MCMURTRY, and B. C. WEXLER. (1981). Food restriction reduces the blood pressure of the spontaneously hypertensive rat. Life Sci. 28:1253-1259
164. YAO, T., S. ANDERSSON, and P. THORÉN. (1982). Long-lasting cardiovascular depression induced by acupuncture-like stimulation of the sciatic nerve in unanaesthetized spontaneously hypertensive rats. Brain Res. 240:77-85
165. YAO, T., S. ANDERSSON, and P. THORÉN. (1982). Long-lasting cardiovascular depressor response following sciatic stimulation in SHR. Evidence for the involvement of central endorphin and serotonin systems. Brain Res. 244:295-303
166. ZILM, D. H. (1980). Naloxone response in non-dependent man: effect on six physiological variables. Neuropharmacology 19:591-595