1School of Kinesiology and Physical Education, University of Northern Colorado, Greeley, Colorado 80639; Department of Wellness and Movement Sciences, Western New Mexico University, Silver City, New Mexico 88062, Estados Unidos.
2School of Kinesiology and Physical Education, University of Northern Colorado, Greeley, Colorado 80639; Department of Wellness and Movement Sciences, Western New Mexico University, Silver City, New Mexico 88062; Department of Kinesiology, California State
Resumen
INTRODUCCION
La fisiología del ejercicio ha evolucionado desde los primeros análisis sobre los sistemas cardiorespiratorio y musculoesquelético, hasta la inclusión de múltiples sistemas fisiológicos y su impacto sobre el ejercicio. Una de las áreas que actualmente ha cobrado interés es el sistema inmunológico. La inmunología del ejercicio ha reflejado las mismas tendencias observadas en trabajos previos de fisiología del ejercicio; la actividad aeróbica ha sido estudiada más detalladamente que el ejercicio anaeróbico o al ejercicio de sobrecarga (4, 18, 21, 37). La respuesta inmune frente a la realización de ejercicios de fuerza en sujetos entrenados y no entrenados ha recibido poca atención (4, 18, 21, 37, 43).
En la actualidad, el acondicionamiento de la fuerza forma parte de algunas recomendaciones publicadas (Asociación Americana de Rehabilitación Cardiovascular y Pulmonar, Colegio Americano de Medicina del Deporte, Asociación Cardiológica Americana, Informes del Inspector General de Sanidad sobre la Actividad Física y la Salud) para conservar la salud y la aptitud física (15) y se está transformando en una de las formas más populares de ejercicio recreativo (6). Aunque las respuestas cardiovasculares, endocrinas, y musculares a los ejercicios aeróbicos son diferentes a las de los ejercicios de fuerza (1, 17, 20, 22, 23, 26, 27, 30, 31), durante este último tipo de ejercicio hay un aumento en el flujo de sangre y epinefrina (29, 31), lo que podría conducir a la demarginación de las células inmunes. Sin embargo, la claudicación intermitente (41) y/o las altísimas presiones arteriales medidas (31) durante las contracciones musculares podrían afectar la salida de las células desde las áreas de almacenamiento hacia el espacio vascular.
Los ejercicios de sobrecarga producen un aumento en la epinefrina (28), y en la sensibilidad de los leucocitos a la misma (36). Esto reduce la afinidad de la membrana celular de los leucocitos por las paredes de los vasos sanguíneos, potenciando así esta salida hacia la circulación. Con el aumento en el flujo sanguíneo y en el bombeo muscular de los vasos linfáticos, la linfa vuelve por la sangre a través del conducto torácico a una mayor velocidad (40). Esto produce que más linfocitos (LY) pasen a la sangre (25). Adicionalmente, el ejercicio excéntrico provoca la infiltración del área local con neutrófilos (NE) para eliminar los desechos celulares e iniciar la recuperación (5), y esto produce un aumento transitorio en la cantidad de NE en circulación (38).
El propósito de este estudio fue determinar los efectos de una única serie de ejercicio de sobrecarga sobre la cantidad de células inmunes en hombres moderadamente activos. Se planteó la hipótesis que sostiene que debido al aumento del flujo sanguíneo y de epinefrina que se producen durante el ejercicio de sobrecarga (29, 31), se produciría una leucocitosis generalizada. Los LY, monocitos (MO), y NE contribuirían con esto, mientras que los eosinófilos (EO) y basófilos (BA) no lo harían, dado que los EO se almacenan preferentemente en el tejido conectivo laxo más profundo del intestino, piel, y pulmones (9) y a la baja cantidad de BA encontrados en la circulación (33). Adicionalmente, todos los recuentos celulares que habían aumentado empezarían a retornar a los valores iniciales durante 30 minutos de recuperación.
Enfoque Experimental del Problema
La cantidad de células inmunitarias se evaluó en 8 sujetos varones desentrenados, antes y después de realizar rutina de ejercicios de fuerza. La rutina que fue seleccionada se recomienda a menudo para deportistas que comienzan con el entrenamiento de fuerza y consiste en 3 series de 10 repeticiones de 8 ejercicios que implican a grupos musculares grandes.
Se usaron máquinas seleccionadas para reducir los efectos del aprendizaje técnico y motor sobre el rendimiento. Las muestras de sangre para realizar el recuento celular y la determinación del volumen plasmático fueron tomadas antes y después de realizar los ejercicios. Para los datos obtenidos antes de realizar los ejercicios (pre-ejercicio) empleados como línea de base y para las determinaciones obtenidas en el grupo control que no realizó ejercicio, se utilizó un diseño de mediciones repetidas.
Sujetos
Dieciséis voluntarios de sexo masculino (media±DS; edad 30±7 años, talla 180,1±7,0 cm, masa 83,97±10,33 kg) fueron sometidos previamente a un chequeo médico y firmaron un consentimiento informado siguiendo las normas establecidas por el Comité de Revisión de la Universidad de Colorado del Norte. Se seleccionaron sujetos inactivos de la comunidad universitaria a lo largo de un período de 3 años.
Diseño del Estudio
Los sujetos fueron asignados al azar a cada uno de los grupos. Ocho sujetos al grupo control y ocho al grupo tratado. El tratamiento consistió en una rutina de entrenamiento de fuerza equilibrada para todo el cuerpo, formada por 8 ejercicios de los principales grupos musculares utilizando máquinas de fuerza seleccionadas (Body Masters Sports Industries, Rayne, LA). Se realizaron crunchs abdominales, press en banco, dorsales en polea, flexiones y extensiones de piernas, press de piernas, remo sentado, y press de hombros. La repetición máxima (1RM) para cada uno de los 8 ejercicios fue determinada (12) durante 2-3 sesiones que tuvieron lugar como mínimo 1 semana antes de la recolección de los datos. La ecuación de regresión utilizada fue validada por numerosos estudios (7, 47). Los sujetos pertenecientes al grupo control no participaron en ninguno de los protocolos de ejercicio de fuerza.
Los sujetos concurrieron a la sala y descansaron 30 minutos antes de comenzar con el protocolo. Se tomó la primera muestra de sangre (pre) insertando un catéter de Teflón (Quick-Cath, Baxter Healthcare Corporation, Deerfield, IL). Luego, el grupo del tratamiento completó 3 series de 8-10 repeticiones al 75% de 1RM. Se empleó un circuito de rutina con una relación trabajo/reposo de 1/2. Luego inmediatamente se tomaron muestras de sangre venosa en los siguientes tiempos: (0 minutos, P0), 15 minutos (P15), y 30 minutos (P30) post-ejercicio (Tabla 1). Los sujetos del grupo control permanecieron sentados en silencio en la sala de entrenamiento y se les tomaban las muestras de sangre en los mismos tiempos que al grupo que realizaba el ejercicio.
Tabla 1. Respuesta inmune frente a la realización de ejercicios de fuerza. Especificaciones relacionadas al tratamiento y a la recolección de los datos. * PO= 0 minutos; P15= luego de 15 minutos de recuperación; P30= luego de 30 minutos de recuperación; 1RM= Una repetición máxima.
Hematología
Se utilizó una cámara de recuento celular Coulter Counter, calibrada según las especificaciones técnicas de fabricante (Coulter Electronics, Hialeah, FL) para determinar el número de leucocitos y para la determinación del número de linfocitos (LY) se utilizó un citómetro de flujo. La cámara de recuento Coulter Counter también aportó datos correspondientes a la hemoglobina y al hematocrito, que fueron utilizados para determinar los cambios en el volumen de plasma (10). Los cambios en el número de células fueron corregidos según los cambios en el volumen de plasma (35).
Análisis de las Células Inmunes
Tres mililitros de sangre fueron analizados con una cámara de recuento Coulter Counter para determinar el número de LY por mililitro. Las muestras fueron luego preparadas para ser analizadas mediante citometría de flujo.
La sangre fue transferida a tubos de análisis de plástico de 50 mL. El volumen fue duplicado mediante el agregado de una cantidad igual de buffer fosfato salino (PBS) (Sigma Chemical Company, St. Louis, MO), a continuación la muestra diluida fue tratada con Ficol (centrifugación según gradiente de densidad) colocando 3 mL de medio de separación de linfocitos (Organon Teknika, West Chester, PA).
Posteriormente los tubos fueron centrifugados a 2000 rpm durante 30 minutos a 20° C, para crear 4 capas distintas: la capa superior clara estaba compuesta por plasma, la capa amarillenta turbia contenía los LY, la tercera capa era la solución de Ficol, y la cuarta capa, el precipitado, contenía eritrocitos y granulocitos. La capa amarillenta turbia fue extraída con una pipeta y transferida a un nuevo tubo de ensayo plástico de 50-mL, diluida a 50 mL con PBS para diluir el efecto del Ficol, y centrifugada a 1500 rpm durante 10 minutos a 5° C. En el precipitado se encontraban los LY. El sobrenadante fue removido y el precipitado fue agitado suavemente hasta que estuviera correctamente resuspendido. Se colocó un mililitro de una solución que contenía PBS (1%), albúmina sérica bovina (0,02%) y azida sódica (PBS-BSA-azida) para resuspender el precipitado e inhibir el desprendimiento de la membrana celular y de los marcadores ligados a la membrana. Doscientos microlitros de cada muestra fueron colocados con una micropipeta en los pocillos de la placa de micropocillos; se utilizaron 2 pocillos para cada muestra. Éstos fueron centrifugados a 2000 rpm durante 5 minutos a 5° C. Las placas de micropocillos fueron suavemente sacudidas para quitar el sobrenadante, el precipitado fue disgregado y resuspendido. A continuación se colocaron en cada pocillo 10 µl de anticuerpo monoclonal anti Leu-7 humana obtenido en ratón y las placas fueron incubadas durante 10 minutos a 5° C. Las células fueron correctamente lavadas agregando 100 µL de la solución PBS-BSA-azida fría a cada uno de los pocillos y luego las placas fueron centrigugadas a 2000 rpm durante 2 minutos a 5° C. Posteriormente el sobrenadante fue descartado girando suavemente las placas con micropocillos, el precipitado fue disgregado, resuspendido. Se agregaron 200 µL de solución de PBS-BSA-azide fría a cada pocillo y nuevamente se centrifugó a 2000 rpm durante 2 minutos a 5° C. El sobrenadante fue descartado girando suavemente las placas con micropocillos, el precipitado fue disgregado y resuspendido y se le agregaron 3 µL de anticuerpo anti-ratón obtenido en cabra marcado con fluoro-isotiocianato (FITC-GAM) a cada pocillo y las placas fueron incubadas durante 10 minutos a 5° C. Las células fueron lavadas dos veces del mismo modo que se describió anteriormente. Entonces se agregaron 200 µL de PBS-BSA-azida a cada pocillo, los pocillos fueron agitados, y transferidos a tubos de aspiración. Se agregaron 100 microlitros de PBS-BSA-azida a cada pocillo para llevar el volumen a 300 µL.
La determinación del número de células natural killers (NK), CD4+, y CD8+ se realizó a través de citometría de flujo (Coulter Epics Dual Laser Cell Sorter, Coulter Electronics, Hialeah, FL). Se usaron microesferas de control de tipo inmune (Immuno-check beads) para alinear los láseres y para calibrar antes del análisis de cada serie de muestras. Luego de que cada muestra era suavemente mezclada y resuspendida, era analizada en el citómetro de flujo.
Se generaron histogramas y se determinaron las áreas bajo la curva. Los números celulares fueron calculados utilizando el número de LY contados en una muestra en el contador de células Counter Coulter y el porcentaje de eventos fluorescentes bajo la curva en el histograma.
Análisis Estadísticos
El análisis estadístico de los datos fue realizado mediante un análisis de la varianza (ANOVA) de mediciones repetidas (SPSS 7.5 para Windows; SPSS, Inc., 1996, Chicago, IL) con una significancia estadística fijada en p≤0,050. Las comparaciones múltiples fueron realizadas utilizando el método de Dunn para identificar cuales datos eran los responsables de la variabilidad (16). El análisis de potencia del diseño indicó que un tamaño muestral de n=15-22 aportaba una potencia estadística alta de 0,8 a 0,95 respectivamente, con un valor de delta de 0,8 (44).
RESULTADOS
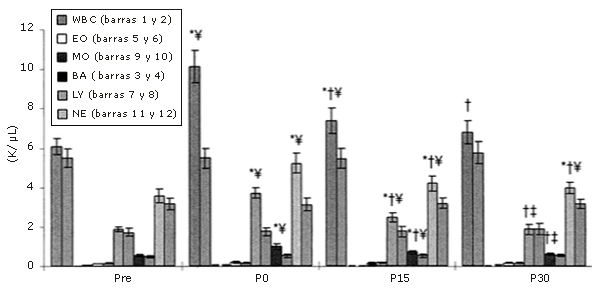
Las subpoblaciones de MO, NE, y LY aumentaron en respuesta a una rutina de ejercicios de sobrecarga común, pero este aumento no se observó en las supoblaciones de BA y EO (Figura 1). Los recuentos celulares de todas las subpoblaciones que habían aumentado disminuyeron luego de 15 minutos y continuaron disminuyendo a los 30 minutos de la recuperación. De las poblaciones que presentaron un aumento inducido por los ejercicios de sobrecarga, sólo los NE no retornaron a los niveles pre-ejercicio después de 30 minutos de recuperación (Figura 2).
Figura 1. Respuestas de los leucocitos a una serie única de ejercicios de sobrecarga (los datos se expresan en forma de valores absolutos). Las barras sólidas corresponden al grupo que realizó ejercicio, mientras que las barras rayadas pertenecen al grupo control. * = Presenta diferencias con respecto al valor Pre; † = Presenta diferencias con respecto al valor correspondiente al minuto 0 (P0); ‡ = Presenta diferencias con respecto al valor encontrado a los 15 minutos post-ejercicio (P15); ¥ = Presenta diferencias con respecto al control.
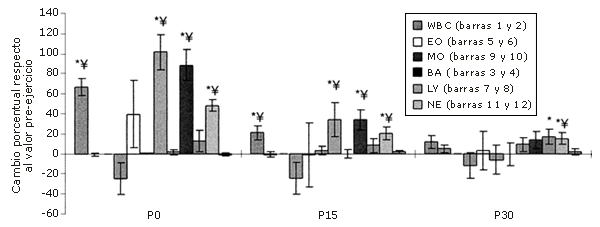
Figura 2. Respuestas de los leucocitos a una serie única de ejercicios de sobrecarga (cambio relativo a los valores pre-ejercicio [Pre]). Las barras sólidas corresponden al grupo que realizó el ejercicio, mientras que las barras rayadas pertenecen al grupo control. *=Presenta diferencias con respecto al valor Pre; †=Presenta diferencias con respecto al valor correspondiente al minuto 0 (P0); ‡=Presenta diferencias con respecto al valor encontrado a los 15 minutos post-ejercicio (P15); ¥=Presenta diferencias con respecto al control.
La leucocitosis inducida por los ejercicios de sobrecarga se debió principalmente a un aumento en el número de LY circulantes, seguidos por los MO.
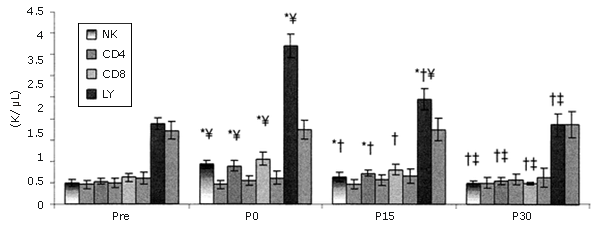
Los LY se recuperaron más rápidamente. Entre los LY, las células NK fueron las que más aumentaron y los linfocitos CD8+ fueron los que se recuperaron más rápidamente (Figura 3). Las células NK no sólo aumentaron más que las otras subpoblaciones de LY medidas, si no que aumentaron más que cualquier otra subpoblación de leucocitos (Figura 4).
Figura 3. Respuestas de las subpoblaciones de linfocitos seleccionadas a una serie única de ejercicios de fuerza (los valores se expresan en forma de valores absolutos). Las barras sólidas corresponden al grupo que realizó el ejercicio, mientras que las barras rayadas pertenecen al grupo control. * = Presenta diferencias con respecto al valor Pre; † = Presenta diferencias con respecto al valor correspondiente al minuto 0 (P0); ‡ = Presenta diferencias con respecto al valor encontrado a los 15 minutos post-ejercicio (P15); ¥ = Presenta diferencias con respecto al control.
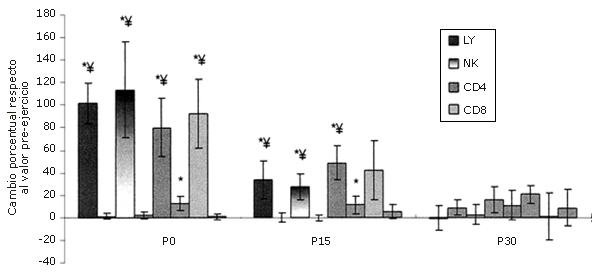
Figura 4. Respuestas de las subpoblaciones de linfocitos seleccionadas a una serie única de ejercicios de sobrecarga [los valores se expresan en forma de cambio relativo respecto al valor de la línea de base (Pre)]. Las barras sólidas corresponden al grupo que realizó el ejercicio, mientras que las barras rayadas pertenecen al grupo control. *=Presenta diferencias respecto al valor Pre; †=Presenta diferencias respecto al valor correspondiente al minuto 0 (P0); ‡ = Presenta diferencias respecto al valor encontrado a los 15 minutos post-ejercicio (P15); ¥ = Presenta diferencias respecto al control.
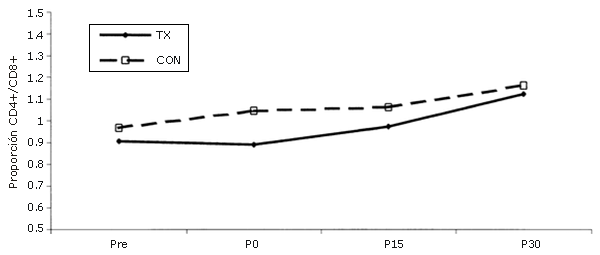
No se observaron cambios en la proporción CD4+/CD8+ (Figura 5).
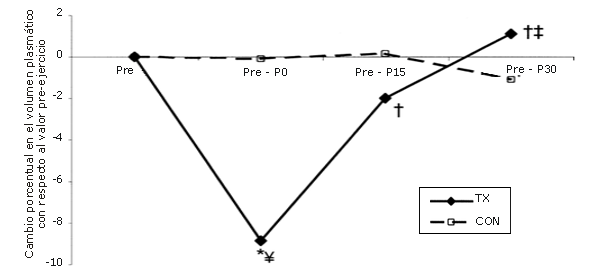
Como resultado de una serie única de ejercicios de fuerza el volumen plasmático disminuyó en un 8,9±2,1%. El mismo, a los 15 min (P15), aumentó hacia los niveles pre-ejercicio y continuó aumentando, a los 30 minutos (P30), aunque nunca superó el valor pre-ejercicio (Figura 6).
Figura 5. Cambios en la proporción CD4+/CD8+ luego de la realización de una única serie de ejercicios de sobrecarga. La línea continua corresponde al grupo que realizó el ejercicio (TX), mientras que las líneas discontinuas corresponden al grupo control (CON). *= Presenta diferencias respecto al valor Pre; †=Presenta diferencias respecto al valor correspondiente al minuto 0 (P0); ‡=Presenta diferencias respecto al valor encontrado a los 15 minutos post-ejercicio (P15); ¥ = Presenta diferencias respecto al control.
Figura 6. Cambio en el volumen de plasmático [relativo al valor observado en la línea de base (pre-ejercicio)] como resultado de la realización de una única serie de ejercicios de sobrecarga. La línea continua corresponde al grupo que realizó ejercicio (TX), mientras que la línea discontinua corresponde al grupo control (CON). *=Presenta diferencias respecto al valor Pre; †=Presenta diferencias respecto al valor correspondiente al minuto 0 (P0); ‡=Presenta diferencias respecto al valor encontrado a los 15 minutos post-ejercicio (P15); ¥=Presenta diferencias respecto al control.
DISCUSION
El propósito de este estudio fue determinar los efectos de una sola serie de ejercicio de fuerza en el número de células inmunes de hombres que realizaban actividad moderada. Se planteó la hipótesis sostiene que los recuentos celulares aumentarían con el ejercicio y empezarían a retornar a los valores de la línea de base durante los 30 minutos de recuperación.
El acondicionamiento de fuerza es la cuarta forma más popular de ejercicio recreativo (6) y forma parte de las recomendaciones publicadas para mantener la salud y la aptitud física (15). Si bien muchas de las respuestas fisiológicas frente a los ejercicios aeróbicos y de resistencia son diferentes (1, 17, 20, 22, 23, 26, 27, 30, 31), es poco lo que se conoce acerca de cómo se comparan las respuestas de las células inmunes.
Inmediatamente después del ejercicio de fuerza se observó un aumento inducido por la hipovolemia en el número de todas las subpoblaciones de leucocitos y de LY medidas en este estudio, excepto en las de BA y EO. Durante la recuperación, a medida que el volumen plasmático retornaba hacia los valores pre-ejercicio, su número fue disminuyendo. De cualquier manera, los datos fueron corregidos para los cambios en el volumen plasmático. Si la alteración en el volumen plasmático fuera el único factor que afectara los leucocitos, el número de leucocitos obtenidos con el volumen plasmático corregido no habría cambiado. Es por ello que los cambios en el volumen plasmático no explican toda la variabilidad de las diferentes poblaciones de leucocitos.
La leucocitosis inducida por el ejercicio ha sido observada durante la realización de ejercicio aeróbico (45). El aumento en el número de leucocitos circulantes dentro de 15 minutos del comienzo de la actividad aeróbica, es demasiado rápido para que se produzca la división celular (25, 32). Es por ello que las células deben salir afuera de los tejidos hacia el sistema circulatorio. Hay controversia con respecto a cuales son los tejidos que sirven como fuente de leucocitos. El sistema linfático, el bazo, el hígado, los pulmones, las reservas marginales, y la médula ósea han sido todos considerados como probables fuentes de células durante el ejercicio aeróbico y en la bibliografía correspondiente al sistema inmune.
El ejercicio de fuerza provoca un aumento en la presión arterial y en la frecuencia cardíaca (31, 39).
La mayor velocidad de flujo de la sangre y la transición desde flujo laminar a flujo turbulento hace que las células que se mantenían unidas a lo largo de las paredes de los vasos sanguíneos sean liberadas hacia la circulación (demarginación) (32). La epinefrina, al igual que la sensibilidad de los leucocitos a la misma (36), aumentan con el ejercicio de fuerza (28). Esto reduce la afinidad de la membrana celular de los leucocitos con las paredes de los vasos, potenciando así, la salida de los mismos hacia la circulación. Ante el aumento del flujo sanguíneo y el bombeo muscular de los vasos linfáticos, la linfa regresa a la sangre a través del conducto torácico a mayor velocidad (40). Esto hace que más LY se vuelquen al torrente sanguíneo (25).
Los aumentos del 80-113% que se han observado en las subpoblaciones de LY pueden ser indicadores de vaciamiento linfático debido a que estas poblaciones celulares se encuentran en los espacios intersticiales y en grandes concentraciones en la linfa y nódulos linfáticos (24, 40).
Los neutrófilos parecen comportarse de la misma manera frente a los ejercicios de fuerza y aeróbicos.
Los neutrófilos aumentan durante el ejercicio aeróbico (25, 33, 42, 46) y de sobrecarga (34); este estudio verifica una repuesta similar frente a los ejercicios de fuerza. Durante la realización de ejercicios que tienen una duración superior a los 30 minutos, los NE se transforman en colaboradores importantes en la ocurrencia de la leucocitosis (33,45). Con el ejercicio excéntrico y el daño del tejido local asociado al mismo, los NE infiltran el área lesionada para fagocitar los restos celulares (5).
Robertson et al. (38) demostraron que el aumento en el número de NE circulantes es transitorio, y que la recuperación a niveles normales se alcanza dentro de los 45 minutos. En el presente estudio, a los 30 minutos de recuperación, la normalización todavía no se había alcanzado.
Los estudios sobre los efectos del ejercicio aeróbico sobre los MO y los macrófagos no han arrojado conclusiones claras. En resultados contradictorios se ha observado que la función había disminuido o no había sufrido cambios y que el número no se había alterado, había aumentado, o disminuido (2, 3, 25, 33, 46). Se ha sugerido que los macrófagos aumentan a las 2 horas posteriores al ejercicio (45) y que los estudios podrían no haber medido la respuesta en ese momento tan tardío, por lo que en dichos estudios se habría perdido el incremento en el número de macrófagos.
Evans y Cannon (13) sugieren que los NE y MO no regresan a los sitios de almacenamiento vasculares después que el ejercicio ha finalizado. Ellos sugieren que las células encargadas de la fagocitosis, especialmente los NE, ingresan a los músculos dañados por el ejercicio como parte de la respuesta de la fase aguda. La respuesta de la fase aguda puede ser desencadenada por una elevada presión intramuscular, como la que se produce durante el ejercicio de fuerza, causando una interrupción del flujo sanguíneo local. La isquemia subsecuente puede provocar daño celular (13). Se ha observado previamente que las contracciones máximas, incluidas en nuestro protocolo de estudio, especialmente aquéllas que tienen un componente excéntrico, rompen las proteínas estructurales y contráctiles dentro de las fibras musculares (13, 14).
El cuerpo percibe estos dos traumatismos como lesiones que desencadenan la respuesta de fase aguda. El daño inducido por el ejercicio en los elementos contráctiles y conjuntivos del músculo provoca la activación inmediata de la cascada del complemento (13). Esto activa rápidamente y provoca la demarginación de los NE (13, 14). Dentro de la primera hora después del ejercicio se produce un aumento rápido subsecuente en la infiltración intramuscular de NE (13, 14).
La cantidad de NE observados en P30 podría estar indicando que las células fagociticas están emigrando hacia los músculos lesionados. Los NE utilizan el sistema circulatorio para trasladarse desde los tejidos de almacenamiento (bazo y tejido conjuntivo) hacia los sitios donde son necesarios (9). Debido a que el protocolo de ejercicio de fuerza involucró a todos los grupos musculoesqueléticos mayores, se esperaría que la migración sea sistémica. El elevado recuento de NE periféricos que se observó coincide con los resultados obtenidos en investigaciones previas.
Los Monocitos son atraídos hacia el sitio de la lesión.
Sin embargo, ésta es una respuesta de una duración mucho mayor que la de los NE (13). Los NE activados son células con una vida media relativamente corta y duran 2 o 3 días (9). Las células de mayor vida media como los MO o macrófagos realizan la debridación y la reparación de los tejidos (9). La acumulación máxima de MO se produce a los 7 días post-ejercicio. Donde, tanto NE como macrófagos, son los responsables de la eliminación de los desechos celulares, los macrófagos infiltran los tejidos dañados, intervienen en la mayoría de los mecanismos inflamatorios y comienzan la reconstrucción (5, 9). Sin la infiltración de macrófagos, los tejidos no se curan; no se produce hipertrofia y se produce un pequeño aumento en la fuerza (13).
Los eosinófilos pueden presentar falta de respuesta al ejercicio de fuerza, contrariamente a lo que se observa en otras poblaciones celulares, debido a su ciclo de vida. Los eosinófilos se producen y maduran en la médula ósea. Su vida media en sangre es aproximadamente 8 horas, lo que significa un paso bastante rápido (9). Son conservados como reserva durante un tiempo indeterminado hasta que son necesarios (9), momento en el que migran a través de la sangre al sitio de necesidad. Migran hacia el tejido conjuntivo para actuar como células fagocitarias de parásitos sensibles a la inmunoglobulina E (24). El resultado es que los EO se distribuyen principalmente en el tejido conjuntivo laxo mas profundo del intestino, piel, y pulmones (9).
Teniendo en cuenta los sitios de almacenamiento de los EO, no es sorprendente que su número no presente cambios significativos. Si el aumento en el flujo sanguíneo, en la turbulencia, y en la hipovolemia fueran las principales causas de los incrementos inducidos por el ejercicio, entonces se evidenciaría un mayor aumento en las células almacenadas en aquellos tejidos en los que se haya incrementado el flujo de sangre durante el ejercicio.
Los eosinófilos serían extraídos de la médula ósea y de los pulmones. Sin embargo, durante la actividad física se reduce el flujo de sangre hacia la piel y hacia el tracto gastrointestinal, y más aún cuando los niveles de epinefrina se elevan, tal como sucede durante los ejercicios de fuerza. Por lo tanto no hay ningún mecanismo que fuerce a que los EO salgan de sus sitios de almacenamiento principales.
Verde (46) sugiere que los BA no son afectados por el ejercicio, lo que coincide con lo observado en este estudio. La falta de efecto puede ser explicada por la baja cantidad de BA encontrados en la circulación (33) y la falta de sensibilidad de esta población celular.
El número total de LY presentó las mismas tendencias que los leucocitos. Esta tendencia ha sido observada en estudios realizados con ejercicios aeróbicos (19, 33, 45, 46) y ejercicios de fuerza (34).
La mayor parte de la variación en el número de LY totales asociados con el ejercicio aeróbico se puede explicar por el incremento en el número de células NK (25, 45, 46). También se observan aumentos en la cantidad de NK durante las contracciones excéntricas que producen un daño localizado en el tejido (5). Dohi et al. observaron un aumento de 152-200% en la cantidad de células NK circulantes como resultado de 6 series de 10 RM en sentadilla en mujeres (11). Esta tendencia fue observada, aunque en menor grado (113%), y se esperaba que así fuera, porque los ejercicios de fuerza tenían un gran componente excéntrico. Es difícil determinar si la diferencia en el número de células NK observado en este estudio y el observado en el estudio con mujeres (11) es significativa, debido a que no se realizó ningún análisis estadístico y a que los protocolos de ejercicio de sobrecarga eran diferentes. Las células asesinas naturales (NK) presentaron un mayor aumento que los CD4+ y CD8+ (80 y 92%, respectivamente).
La proporción CD4+/CD8+ permaneció constante.
Esto es lo opuesto a lo informado en resultados correspondientes a ejercicios aeróbicos (25, 33, 45, 46). El hecho de que la proporción no haya variado indica que las alteraciones en la cantidad de células CD4+ y CD8+ eran proporcionales entre sí a lo largo de todas las fases del estudio y también sugieren que la inmunomodulación celular no ha sido alterada (8, 25). Esto no se observa durante el ejercicio aeróbico.
Cuando los subconjuntos de células T se diferencian después del ejercicio aeróbico, el aumento en la cantidad de células T totales se debe a un mayor incremento en las células CD8+ (33). Una disminución en la proporción CD4+/CD8+ es indicativa de inmunosupresión (8, 25); este efecto no observó durante los ejercicios de fuerza.
Al parecer, las respuestas de las poblaciones de células inmunes a los ejercicios de fuerza fueron similares a las observadas durante la actividad aeróbica, con algunas pocas variaciones (36).
Aplicaciones Prácticas
Todos los resultados inmunológicos están sujetos a cierta especulación a causa de variaciones diurnas en el número y funcionamiento celular, alteraciones en los niveles hormonales, ingesta de alimentos, estrés emocional, y estímulos antigénicos. Sin embargo, parecería que las pequeñas alteraciones pasajeras en la cantidad de células inmunes indican que el ejercicio de sobrecarga tiene un impacto pequeño sobre el sistema inmunológico. Así, aquéllos que realicen una serie aguda de ejercicios de fuerza no parecen presentar ni un aumento de la respuesta inmune ni inmunosupresión.
Los incrementos en los niveles de epinefrina, en la presión arterial, frecuencia cardíaca, velocidad de la sangre, volumen plasmático, y en el retorno de la linfa al espacio vascular pueden contribuir a la leucocitosis inducida por ejercicios de sobrecarga.
Así, la causa del aumento en el número de leucocitos circulantes inducido por los ejercicios sobrecarga no es un evento simple asociado a un solo factor si no que más bien es una compleja interacción de una variedad de estímulos y respuestas.
Los resultados de este estudio sugieren que los individuos pueden enfrentar nuevos ejercicios de fuerza sin preocuparse demasiado sobre el compromiso de la función inmune y el incremento de la probabilidad de sufrir episodios infecciosos.
Agradecimientos
Los autores desean agradecer a los sujetos por su participación, The Conditioning Spa, Greeley, CO, The Fort Collins Pulse, Fort Collins, CO, y al Dr. Ian Orme. A la Universidad Estatal de Colorado por el uso de sus instalaciones. El Dr. De Sales Lawless de la Universidad de Rockefeller aportó su valiosa ayuda para los análisis inmunológicos.
REFERENCIAS
1. Allen E. T., R. J. Byrd and D. P. Smith (1976). Hemodynamic consequences of circuit weight training. Res. Q. 47:299307
2. Asselin P., C. Benquet, K. Krzystyniak, P. Brousseau, R. Savard, and M. Fournier (1996). In vivo indomethacin reverse exercise-induced immunosuppression in rats. Int. J. Immunopharmacol. 18:491497
3. Bagby G. J., L.D. Crouch, and R. E. Shepherd (1996). Exercise and cytokines: Spontaneous and elicited responses. In: Exercise and Immune Function. L. Hoffman-Goetz, ed. Boca Raton, FL: CRC Press, 5577
4. Boros R. L., A. Koch, and D. C. Nieman (1997). Compendium of the Exercise Immunology Literature, 19951997 (June). Paderborn: International Society of Exercise Immunology, p. 94
5. Cannon J. G., R. A. Fielding, M. A. Fiatarone, S. F. Orencole, C. A. Dinarello, and W. J. Evans (1989). Increased interleukin 1-beta in human skeletal muscle after exercise. Am. J. Physiol. 257:R451R455
6. Centers for Disease Control and Prevention (1996). Physical Activity and Health: A report of the Surgeon General. Centers for Disease Control and Prevention, President's Council on Physical Fitness and Sport
7. Chapman P. P., J. R. Whitehead, and R. H. Binkert (1998). The 225-lb reps-to-fatigue test as a submaximal estimate of 1-RM bench press performance in college football players. J. Strength Cond. Res. 12:258261
8. Cohen J. J., H. N. Claman, and R. C. Duke (1992). Immunology Course Book. Denver: University of Colorado Health Sciences Center, p. 155
9. Cormak D. H. Blood cells (1987). In: Hams Histology. (9th ed.). Saint Louis: J. B. Lippincott Company, 188213
10. Dill D. B., and D. L. Costill (1974). Calculation of percentage changes in volumes of blood, plasma, and red cells in dehydration. J. Appl. Physiol. 37:247248
11. Dohi K., A. M. Mastro, M. P. Miles, J. A. Bush, D. S. Grove, S. K. Leach, J. S. Volek, B. C. Nindl, J. O. Marx, L. A. Gotshalk, M. Putukian, W. J. Sebastianelli, and W. J. Kraemer (2001). Lymphocyte proliferation in response to acute heavy resistance exercise in women: Influence of muscle strength and total work. Eur. J. Appl. Physiol. 85:367373
12. Epley B (1988). Boyd Epley Workout: Logbook for Football. Lincoln, NE: Body Enterprises, Inc., p. 46
13. Evans W. J., and J. G. Cannon (1991). The metabolic effects of exercise-induced muscle damage. In: Exercise Sport Science Review. J. O. Holloszy, ed. Baltimore: Williams and Wilkins, 99125
14. Fielding R. A., T. J. Manfredi, W. Ding, M. A. Fiatarone, W. J. Evans, and J. G. Gannon (1993). Acute phase response in exercise: III. Neutrophil and IL-1β accumulation in skeletal muscle. Am. J. Physiol. 265:R166R172
15. Franklin B. A (1998). Pumping iron: rationale, benefits, safety, and prescription. ACSM Health Fit. J. 2:1215
16. Glass G. V., and K. D. Hopkins (1984). Statistical Methods in Education and Psychology. Needham Heights, MA: Allyn and Bacon, p. 578
17. Gollnick P. D., R. B. Armstrong, C. W. Saubert IV, K. Piehl, and B. Saltin (1972). Enzyme activity and fiber composition in skeletal muscle of untrained and trained men. Appl. Physiol. 33:312319
18. Hardesty A. J., J. E. Greenleaf, S. R. Simonson, A. Hu, and C. G. R. Jackson (1993). Exercise, exercise training, and the immune system: A compendium of research (19021991). Moffett Field: NASA Ames Research Center, p. 164
19. Hedfors E., G. Holm, and B. Ohnell (1976). Variations of blood lymphocytes during work studied by cell surface markers, DNA synthesis and cytotoxicity. Clin. Exp. Immunol. 24:328335
20. Hickson R. C., M. A. Rosenkoetter, and M. M. Brown (1980). Strength training effects on aerobic power and short-term endurance. Med. Sci. Sports Exerc. 12:336339
21. Hjertman J. M. E., and D. C. Nieman (1999). Compendium of the Exercise Immunology Literature 1997 (June) − 1999 (April). Paderborn: International Society of Exercise and Immunology, p. 99
22. Horne L., G. Bell, B. Fisher, S. Warren, and A. Janowska-Wieczorek (1997). Interaction between cortisol and tumor necrosis factor with concurrent resistance and endurance training. Clin. J. Sport Med. 7:247251
23. Hurley B. F., D. R. Seals, A. A. Ehsani, L. J. Cartier, G. P. Dalsky, J. M. Hagberg, and J. O. Holloszy (1984). Effects of high-intensity strength training on cardiovascular function. Med. Sci. Sports Exerc. 16:483488
24. Janeway C. A. Jr, and P. Travers (1996). Immunobiology: The Immune System in Health and Disease. New York: Garland Publishing Inc
25. Keast D., and A. R. Morton (1992). Long-term exercise and immune functions. In: Exercise and Disease. R. R. Watson and M. Eisinger, eds. Boca Raton, FL: CRC Press, 89120
26. Keul J., G. Haralambie, M. Bruder, and H.-J (1978). Gottstein. The effect of weight lifting exercise on heart rate and metabolism in experienced weight lifters. Med. Sci. Sports. 10:1315
27. Kraemer W. J (1994). Neuroendocrine responses to resistance exercise. In: Essentials of Strength Training and Conditioning. T. R. Baechle, ed. Champaign, IL: Human Kinetics, 86107
28. Kraemer W. J., L. Marchitelli, S. E. Gordon, E. Harman, J. E. Dziados, T. Mello, P. Frykman, D. McCurry, and S. J. Fleck (1990). Hormonal and growth factor responses to heavy resistance exercise protocols. J. Appl. Physiol. 69:14421450
29. Kraemer W. J., B. J. Noble, M. J. Clark, and B. W. Culver (1987). Physiologic responses to heavy-resistance exercises with very short rest periods. Int. J. Sports Med. 8:247252
30. MacDougall J. D., D. G. Sale, J. R. Moroz, G. C. B. Elder, J. R. Sutton, and H. Howald (1979). Mitochondrial volume density in human skeletal muscle following heavy resistance training. Med. Sci. Sports. 11:164166
31. MacDougall J. D., D. Tuxen, D. G. Sale, J. R. Moroz, and J. R. Sutton (1985). Arterial blood pressure response to heavy resistance exercise. J. Appl. Physiol. 58:785790
32. Mackinnon L. T., and T. B. Tomasi (1988). Immunology of exercise. In: Sports Medicine; Fitness Training Injuries. O. Apenzeller, ed. Baltimore: Urban and Schwarzenberg, 273289
33. McCarthy D. A., and M. M. Dale (1988). The leucocytosis of exercise: A review and model. Sports Med. 6:333363
34. Miles M. P., S. K. Leach, W. J. Kraemer, K. Dohi, J. A. Bush, and A. M. Mastro (1998). Leukocyte adhesion molecule expression during intense resistance exercise. J. Appl. Physiol. 84:16041609
35. Muldoon M. F., E. A. Bachen, S. B. Manuck, S. R. Waldstein, P. L. Bricker, and J. A. Bennett (1992). Acute cholesterol responses to mental stress and change in posture. Arch. Intern. Med. 152:775780
36. Nieman D. C., D. A. Henson, C. S. Sampson, J. L. Hering, J. Suttles, M. Conley, M. H. Stone, D. E. Butterworth, and J. M. Davis (1995). The acute immune response to exhaustive resistance exercise. Int. J. Sports Med. 16:322328
37. Rainwater M. K., D. C. Nieman, and S. A. Thomas (1995). Compendium of the Exercise Immunology Literature, 19911995 (June). Paderborn: International Society of Exercise and Immunology, p. 118
38. Robertson A. J., C. R. B. Ramesar, R. C. Potts, J. H. Gibbs, M. C. K. Browning, R. A. Brown, P. C. Hayes, and J. Swanson Beck (1981). The effect of strenuous physical exercise on circulating blood lymphocytes and serum cortisol levels. J. Clin. Lab. Immunol. 5:5357
39. Sale D. G., D. E. Moroz, R. S. McKelvie, J. D. MacDougall, and N. McCartney (1994). Effect of training on the blood pressure response to weight lifting. Can. J. Appl. Physiol. 19:6074
40. Scmid-Schoenbein G., and J. Ross Jr (1990). Structure-function relations in the peripheral circulation. In: Best and Taylor's Physiological Basis of Medical Practice. (12th ed.). J. Ross, Jr., ed. Baltimore: Williams and Wilkins, 118137
41. Sejersted O. M., A. R. Hargens, K. R. Kardel, P. Blom, O. Jensen, and L. Hermansen (1984). Intramuscular fluid pressure during isometric contraction of human skeletal muscle. J. Appl. Physiol. 56:287295
42. Simon, H. B (1988). Exercise, infection, and immunity. In: Exercise in the Practice of Medicine. (2nd ed.). G.F. Fletcher, ed. Mount Kisco, NY: Futura Publishing Co., Inc., 337359
43. Simonson S. R (2001). The immune response to resistance exercise. J. Strength Cond. Res. 15:378384
44. Thomas J. R., and J. K. Nelson (1996). Research Methods in Physical Activity. Champaign, IL: Human Kinetics
45. Tvede N., B. K. Pedersen, F. R. Hansen, T. Bendix, L. D. Christensen, H. Galbo, and J. Halkjaer- Kristensen (1989). Effect of physical exercise on blood mononuclear cell subpopulations and in vitro proliferative responses. Scand. J. Immunol. 29:383389
46. Verde T. J (1992). Short-term exercise and immune function. In: Exercise and Disease. R.R. Watson and M. Eisinger, eds. Boca Raton, FL: CRC Press, 7188
47. Ware J. S., C. T. Clemens, J. L. Mayhew, and T. J. Johnston (1995). Muscular endurance repetitions to predict bench press and squat strength in college football players. J. Strength Cond. Res. 9:99103
Mejora de las propiedades nutricionales y de textura del jerky reestructurado con polvo de sangre de pato para aplicaciones en kits de comida
Resumen del Estudio sobre el Uso de Polvo de Sangre de Pato en Jerky Reestructurado En un contexto...
El ejercicio aeróbico a lo largo de la vida protege contra la inflamaging y el cáncer
Ejercicio Aeróbico y su Impacto en el Envejecimiento y el Riesgo de Cáncer La investigación...
La combinación de nandrolona y entrenamiento de resistencia indujo remodelación cardíaca y estrés oxidativo a pesar de la contractilidad mejorada de los cardiomiocitos
Este artículo investiga cómo la combinación de entrenamiento de resistencia (RT) y el uso de...
El efecto del ciclismo en la función cognitiva y el bienestar en adultos mayores
El impacto del ciclismo al aire libre en la función cognitiva y bienestar de los adultos mayores...
Predicción de las salidas de potencia mecánica anaeróbica del Wingate a partir de una prueba de esfuerzo cardiopulmonar incremental máxima utilizando un enfoque de aprendizaje automático
El Wingate Anaerobic Test (WAnT) se ha establecido como un método efectivo para medir la potencia...