Los Factores de Crecimiento Muscular y los Ejercicios de Fuerza
Artículo publicado en el journal PubliCE, Volumen 0 del año 2005.
Publicado 5 de diciembre de 2005
Resumen
Palabras clave: entrenamiento de la fuerza, crecimiento, desarrollo, maduración, sistema endócrino
CARACTERISTICAS GENERALES DE LAS HORMONAS Y SU FUNCION
El entrenamiento de la fuerza y de la potencia, representa un gran estímulo al sistema músculo-esquelético. Este tipo de estrés físico activa una amplia variedad de mecanismos fisiológicos implicados con la activación del músculo (Figura 1). Uno de los sistemas fisiológicos que ha sido demostrado de ser sensible al ejercicio agudo con pesas, es el sistema endócrino (17). Las respuestas y las adaptaciones se vinculan al estímulo del ejercicio de fuerza (por ejemplo, elección del ejercicio, orden de ejecución, carga utilizada, intensidad, tiempo de pausa, etc.). La magnitud de esa respuesta hormonal estará relacionada a la configuración específica de los protocolos de ejercicio elegido, por ejemplo, pausas cortas (17).
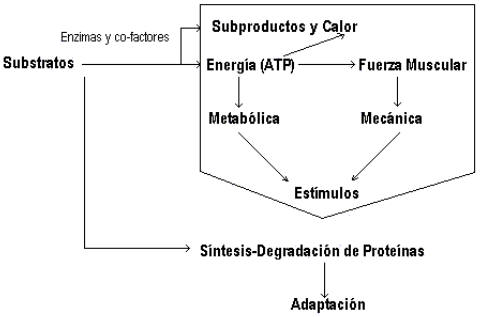
Figura 1. Esquema teórico del estrés metabólico y mecánico sobre el músculo
esquelético durante y después de la actividad física. (Coyle E., 2000).
La Figura 2 muestra una secuencia esquemática de los "eventos" que abarcarían los mecanismos neuroendócrinos en ejercicios de pesas (17).
Brevemente (5), se puede decir que las hormonas se clasifican como esteroides y no esteroides, según su composición química. Las hormonas esteroides son liposolubles, y la mayoría se forman a partir del colesterol. Las hormonas no esteroides (peptídicas) son proteínas, péptidos o aminoácidos.
Las hormonas esteroides pasan a través de las membranas celulares y se unen a receptores dentro de la célula. Usan un mecanismo llamado "activación directa" de genes para producir la síntesis de proteínas (a través del ARNm "mensajero") dentro del citoplasma (procesos de reparación y crecimiento de tejidos, por ejemplo). Las hormonas no esteroides no pueden entrar fácilmente en las células, por lo que se unen a receptores específicos ubicados en las membranas celulares. Esto forma el complejo hormona-receptor que activa a un segundo mensajero dentro de la célula, que al formar AMPc, activa numerosos procesos celulares (activación de enzimas, cambios de permeabilidad de membranas, síntesis de proteínas, estimulación de secreciones celulares, etc.).
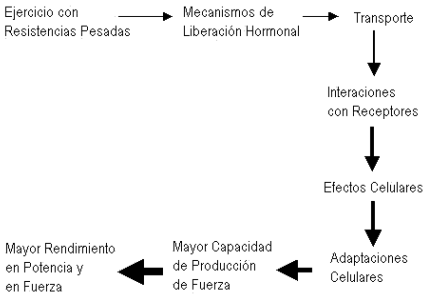
Figura 2. Gráfico esquemático de los eventos que implican al sistema
neuroendócrino desde el estímulo del ejercicio con resistencias pesadas hasta el
mayor rendimiento de fuerza. (Kraemer, 1992).
Según su función, se encuentran las hormonas "Anabolizantes", tales como la hormona de crecimiento (GH, Growth Hormone), hormonas tiroideas, testosterona, insulina, y el sistema IGF-I (Insulin-Like Growth Factor I, factor I de crecimiento como la insulina)
En la Tabla 1, se resumen las acciones principales de estas hormonas y factores de crecimiento sobre el músculo esquelético, entre otros tejidos (1, 3, 5, 14, 16, 17).
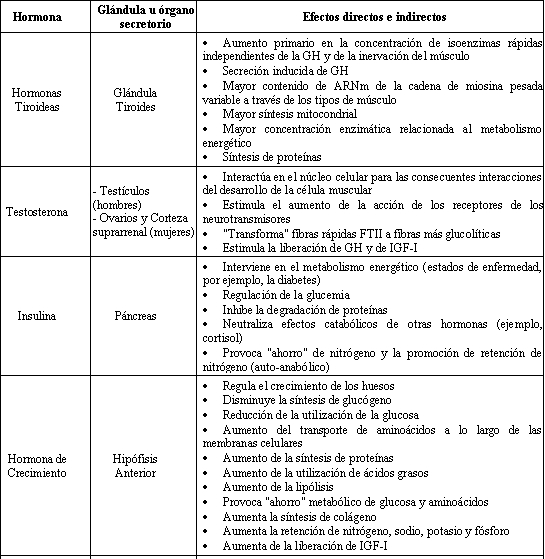

Tabla 1. Hormonas"Anabolizantes".
FACTORES DE CRECIMIENTO: INTERACCION DE HORMONAS
La GH tiene muchos roles biológicos en el metabolismo y el crecimiento que promueven acciones en los tejidos. Muchas de estas acciones biológicas son mediadas por una variedad de mecanismos vía IGF, también llamadas antes como Somatomedinas. Pero, parece ser que la hipertrofia inducida por ejercicio es absolutamente diferente de la hipertrofia estimulada por la GH. Por ejemplo, las características de la producción de fuerza de la fibra muscular son superiores subsecuentes a los aumentos de su tamaño inducido por el ejercicio, comparado al músculo "tratado" (medicado) con GH (16).
Además, una mayor evidencia indica que la modulación del turnover (recambio) de proteínas en el músculo está regulada por un número de factores de crecimiento de tejidos expresados localmente (4,10). La IGF-I estimula la proliferación y diferenciación de mioblastos in vitro, como también la síntesis de proteínas y, como tal, es por eso que ha recibido gran atención en los estudios de hipertrofia muscular (4).
En suma, la mejorada estimulación de la secreción de la GH por parte de la testosterona, aumenta la producción de IGF, vía mecanismo mediados por la GH y puede, también, ayudar a producir varias propiedades anabólicas típicamente atribuidas a la testosterona (actualmente no es tan así) en el cuerpo entero (16).
Estas interrelaciones con otras hormonas demuestran la naturaleza altamente interdependiente del sistema neuroendócrino en la influencia de la expresión de una característica del rendimiento tal como lo es la fuerza y/o la potencia de los músculos utilizados. Así, cómo la testosterona influencia tales cambios en la función y en la estructura muscular, puede ser en gran parte debido a la interacción de la testosterona con muchos tejidos (por ejemplo, tejido nervioso) y otras hormonas en el cuerpo (por ejemplo, hormona de crecimiento).
En la Figura 3 se observan los mecanismos de acción de la testosterona. También, con el avance de la edad (envejecimiento), las concentraciones plasmáticas de hormonas anabólicas circulantes y los factores de crecimiento disminuyen (andropausa-somatopausa) (18).
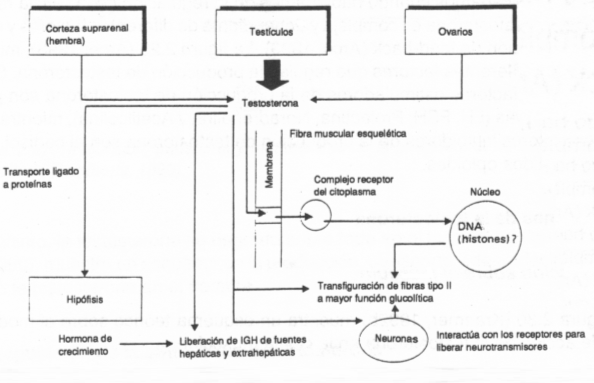
Figura 3. Mecanismos de acción de la testosterona en el músculo (Kraemer,
1992)
EL SISTEMA IGF-I
La IGF-I, originalmente llamada somatomedina C, es un factor de crecimiento relacionado estructuralmente a la insulina. La IGF-I es la principal proteína implicada en la respuesta de las células a la GH; esto es, la IGF-I es producida en respuesta a la GH y entonces induce las actividades celulares subsecuentes, particularmente sobre el crecimiento del hueso. Sin embargo, estudios recientes (1,14), han demostrado que la IGF-I tiene actividades autócrinas (estimulación directa de la síntesis de proteínas miofibrilares) y parácrinas (proliferación, diferenciación y fusión de células "satélite"), en adición a las actividades endócrinas inicialmente observadas sobre el hueso (4,14).
El receptor IGF-I, receptor como el de la propia insulina, tiene la actividad intrínseca de la tirosina kinasa. Debido a sus similitudes estructurales, la IGF-I puede unirse al receptor de la insulina, pero con una afinidad mucho menor que la de la propia insulina (14) (Ver Figuras 4 y 5).
Los factores de crecimiento con la insulina tienen efectos importantes sobre múltiples órganos, incluyendo el hueso. La IGF-I en plasma es sintetizada principalmente por el hígado y los niveles plasmáticos tienen su pico máximo durante la pubertad (23).
La hipótesis de las Somatomedinas (10), establecía que las acciones de la GH eran mediadas por un segundo agente liberado hacia la sangre por un "objetivo" (target) de la acción de la GH. La GH se sabe que especifica la liberación de las IGFs (particularmente la IGF-I) hacia la sangre desde el hígado, convirtiéndolo a éste en una glándula endócrina. En suma, el hígado y otros tejidos liberan proteínas unidas a la IGF (las IGFBPs) que pueden prolongar, mejorar o inhibir las acciones de las IGFs. Estas acciones de las IGF son moduladas por esta familia de proteínas, llamadas IGFBP-1, IGFBP-2, IGFBP-3, IGFBP-4, IGFBP-5, y IGFBP-6. La función de las IGFBPs no sólo es ser proteínas de transporte (carriers), para las IGFs en la circulación, protegiéndose de la degradación y transportándolas hacia tejidos específicos, sino también como moduladores de la acción de la IGF (10).
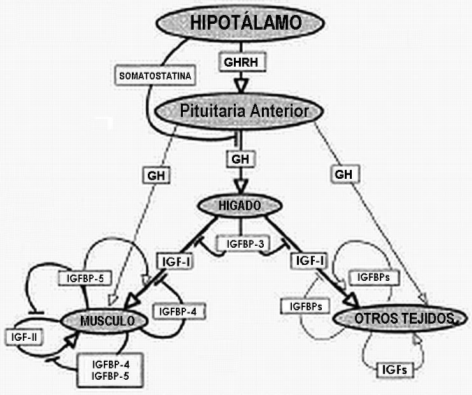
Figura 4. Relaciones dentro del sistema GH/IGF. Las flechas indican los
efectos estimulatorios, y las líneas paralelas indican las inhibiciones. Las
líneas oscuras muestran las relaciones bien establecidas, mientras las líneas
más claras indican efectos que sólo ocurren en situaciones limitadas o (como los
efectos directos de la GH en el músculo esquelético) que no han sido
inequívocamente o de forma consistente demostradas en cultivos de células así
como en animales intactos.
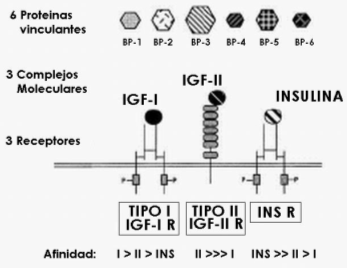
Figura 5. Complejidad de la familia de IGF. Como se muestra aquí, la familia
de IGF incluye tres hormonas, tres receptores, y seis proteínas vinculantes,
todos productos de distintos genes. Muchos pero no todos los miembros de la
familia pueden actuar recíprocamente entre sí.
EL SISTEMA IGF-I Y LA ADAPTACION MUSCULAR
Control local de la adaptación del músculo esquelético. Un número de estudios ha demostrado que las adaptaciones tal como la hipertrofia muscular, puede ocurrir aún cuando el medio (entorno) somático podría considerarse "no anabólico" (1). En este modelo, este proceso de hipertrofia "compensatoria" incluye su claro aumento en la expresión del ARNm del IGF-I en los músculos sometidos a sobrecarga (1, 4).
Regeneración del músculo. Para conocer la importancia de la regulación intrínseca vía activación autócrina/parácrina, es necesario considerar algunos procesos celulares, tales como la regeneración de la fibra muscular (miofibras), que parece ser modulada por la IGF-I. Cuando hay daño (injuria) muscular, las células satélite, que son pequeñas células mononucleadas del músculo, son "movilizadas" para comenzar el proceso de regeneración (1,10). Luego de esta activación de las células satélite se observa una respuesta proliferativa en la cual algunas de esas células activadas se someten a un ciclo mitótico (división de células). A continuación de esto, estas células activadas se "diferencian" en células como mioblastos. Así, estos mioblastos pueden fusionarse con otros para formar nuevas miofibras o incorporarse en las miofibras "sobrevivientes" del daño muscular. De allí, que hay evidencia de que la IGF-I producida localmente de modo autócrina/parácrina, puede ser importante en este proceso de regeneración (Ver Figura 6).
Hay que destacar que este proceso "proliferativo" puede ser eliminado vía irradiación (utilizada para el tratamiento de ciertos tumores cancerígenos), y por lo tanto, inhibir el proceso de regeneración (1).
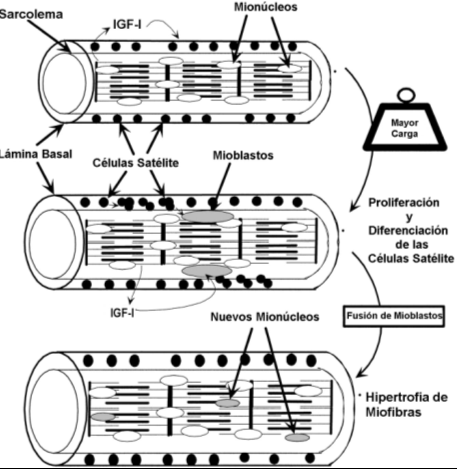
Figura 6. IGF-I y “miogénesis” durante la hipertrofia compensatoria. Grandes
cargas conllevan a la proliferación, diferenciación, y fusión de las células
"satélite". La IGF-I se ha demostrado que estimula estos procesos miogénicos en
los músculos esqueléticos. Se ha postulado que la IGF-I y/o la isoforma IGF-I
factor de crecimiento mecánico sensible a la sobrecarga (mechano growth factor,
MGF), es producida y liberada por las miofibras en respuesta a una carga mayor o
estiramiento. La mayor concentración local de IGF-I (MGF) estimularía entonces
los procesos miogénicos necesarios para dirigir la respuesta de la hipertrofia.
Adaptación muscular a una mayor sobrecarga. Un número de modelos de actividad in vivo, tales como alta sobrecarga, estiramiento y contracción (activación) excéntrica muscular, son conocidos por resultar en una mayor expresión del ARNm del IGF-I y/o mayor IGF-I en células musculares (4,10). Además, manipulaciones experimentales de niveles musculares de IGF-I han sido demostradas de inducir hipertrofia muscular tanto in vitro como in vivo.
Acciones autócrinas/parácrinas del Sistema IGF-I. Uno de los desarrollos más interesantes recientemente en la historia de la IGF-I ha sido la identificación de una isoforma de la IGF-I que se expresa en respuesta a cambios en el estado de sobrecarga de los músculos esqueléticos. Esta isoforma, factor de crecimiento mecánico (MGF, mechanogrowth factor), ha sido demostrada de ser marcadamente estimulada en respuesta tanto a un estiramiento como a una sobrecarga mayor (tensión) (1,4). Recordemos que el músculo esquelético produce, cuando se somete a una sobrecarga, un tipo de IGF-I para tejidos en general y otra isoforma, la MGF, señalando que ambas isoformas poseen diferentes cursos de tiempo y distintos roles (1).
La eficacia de la IGF-I muscular es dependiente no sólo de su expresión sino también de su disponibilidad, la cual es regulada por las proteínas vinculadas a la IGF (IGFBP-1 a -6) y por la abundancia del receptor IGF-I. Por ejemplo, en el músculo, la IGFBP-4 tiene una alta afinidad para la IGF-I y así inhibe sus efectos miogénicos, mientras la IGFBP-5 puede facilitar (10) o inhibir la diferenciación estimulada por la IGF-I bajo ciertas condiciones (4). Además, la IGFBP-1 ha sido demostrada de inhibir la síntesis de proteínas estimulada por la IGF-I (1).
El componente "miogénico" de adaptación muscular. En la respuesta de hipertrofia, parece haber un componente miogénico (la IGF-I) en el que los mioblastos derivados de las células satélite se fusionan con miofibras existentes tanto dañadas como aún con miofibras viables (sobrevivientes) después de una lesión (Ver Figura 3).
Sobrecarga mecánica e IGF-I muscular. El modelo de Adams (1) propone que esta isoforma de la IGF-I sensible a la sobrecarga en el músculo trabaja por acción parácrina o autócrina para inducir la proliferación y diferenciación de las células satélite, seguida de una fusión de mioblastos diferenciados para "hipertrofiar" a las fibras musculares (miofibras). Sin embargo, el vínculo directo entre la carga mecánica de alta intensidad y la modulación de la IGF-I muscular requiere de más investigación (4).
En un estudio (4), en base a datos de la creatinquinasa (CK) y de registros del dolor muscular después de la carga excéntrica muscular, se indicó que la disrupción miofibrilar y/o el daño del sarcolema, pueden jugar un rol en la activación del sistema IGF-I muscular. Sin embargo, se debe aclarar que el daño muscular inducido por el ejercicio excéntrico no resulta siempre en hipertrofia muscular necesariamente, como por ejemplo, la carrera en descenso, que es un ejercicio de resistencia, y como tal, no es un estímulo hipertrófico potente (4). En el mismo estudio, se indica que la acción de la IGF-I en el músculo es secundaria a la activación andrógena, ya que la testosterona total sérica (plasmática) no fue mayor, sino que cayó después de la sobrecarga excéntrica y concéntrica, admitiendo que la respuesta de la testosterona al ejercicio con pesas es altamente variable.
HIPERTROFIA E IGF-I
Como se mencionó anteriormente, la IGF-I tiene un gen complejo que está regulado por múltiples promotores y es capaz de producir al menos 4 diferente proteínas precursoras (isoformas) de IGF-I. Las 2 isoformas que tienen más relevancia para la hipertrofia son: la IGF-IEa (llamada IGF-I muscular), la cual es similar a la IGF-I producida por el hígado, y la IGF-IEb (llamada MGF, factor de crecimiento mecánico), la cual solamente es producida por el músculo dañado o sobrecargado (como se dijo anteriormente) (1,4,10,13,21). Estas isoformas de IGF-I son un componente integral de la hipertrofia del músculo esquelético. Sin embargo, parece ser que la MGF inicia la proliferación de las células satélite, mientras que la IGF-Ea promueve la diferenciación en los miotubos (13).
La expresión ARNm de IGF-I del músculo esquelético y la expresión de proteínas aumentan durante las primeras fases de la sobrecarga mecánica, indicando que el hígado no es la única fuente de IGF-I (4, 13, 21).
Entonces, la hipertrofia del músculo esquelético es regulada al menos por 3 procesos moleculares: mayor actividad de células satélite, transcripción genética y codificación proteica, con cada uno de estos procesos contribuyendo diferentemente a la hipertrofia muscular. Es interesante observar que, la IGF-I puede influenciar a la actividad de todos esos mecanismos. Por ejemplo, la IGF-I aumenta la proliferación de células satélite, la expresión ARNm de la -actina del músculo, y la síntesis proteica (21). Por lo tanto, en base a los mecanismos moleculares y celulares, es muy probable que la IGF-I contribuya significativamente a la hipertrofia.
LOS FACTORES DE CRECIMIENTO (GH, SISTEMA IGF-I) Y LOS EJERCICIOS DE FUERZA
Diferentes estudios reportan que los niveles circulantes de GH, aumentan en individuos después de ejercitarse (10, 20).
Como es sabido, los aumentos de la GH son acompañados por aumentos similares (o mayores) en las IGF-Is circulantes, las cuales pueden ser las estimuladoras proximales del crecimiento muscular (10). En un estudio (20) de 25 semanas de entrenamiento, se demostró que la IGF-I circulante aumentó un 20% después de 13 semanas de entrenamiento con pesas (grupos que entrenaron con 1 o 3 series por ejercicio), pero luego no aumentó desde la semana 13 a la 25. A la par de este aumento, también aumentaba la fuerza muscular, siendo mayor en el grupo de 3 series. Está bien establecido que la GH circulante se eleva durante aproximadamente 60 minutos después de un turno de entrenamiento con pesas. La IGF-I, no se incrementó en las primeras 2 horas después del entrenamiento con pesas. Sin embargo, tal aumento puede ocurrir más tarde, porque la GH "inyectada" causa una elevación en la IGF-I con un retraso de algo de 16 horas. Hasta hoy, no está tan claro si la secreción de GH esperada durante el ejercicio podría ser de suficiente magnitud como para causar una elevación de largo término de la IGF-I.
Por otra parte, Nindl y colaboradores (19), indicó que luego de un protocolo de ejercicio agudo de fuerza con cargas pesadas (5 series de 5-10 MR para 10 ejercicios con 9 segundos de pausa entre ejercicios, tiempo total de trabajo: 125 minutos), el impacto que esta actividad ejerció sobre el sistema de IGF-I circulante no está en la alteración de la cantidad de IGF-I, sino más bien de la manera en la cual la IGF-I es "dividida" (redistribuida) entre su familia de proteínas circulantes. Por lo tanto, el ejercicio agudo con pesas, puede conllevar a alteraciones en el sistema IGF-I (pensado de ocurrir en un medio localizado, es decir, netamente muscular) que pueden ser detectado en la circulación sistémica (medio no localizado sino general). Aunque en otro estudio, Häkkinen y colaboradores (11), luego de un protocolo de entrenamiento de la fuerza durante 21 semanas en mujeres mayores de edad, observó una falta de cambios en la IGF-I plasmática, lo que podría indicar que la IGF-I en la circulación no puede ser un buen "marcador" de la actividad implícita del sistema GH-IGF-I (11,18), ya que sí se observaron aumentos en el área transversal muscular del cuádriceps. Fiatarone Singh y colaboradores (8), encontraron que el entrenamiento de la fuerza en sujetos mayores de edad, conlleva a un sustancial aumento en el tejido muscular en presencia de IGF-I.
En algunos estudios, la cantidad de GH secretada durante el ejercicio con pesas fue pequeña comparado con la secreción de la GH durante la noche. En otros, la cantidad secretada durante el ejercicio con pesas es sustancial comparada con la secreción nocturna.
También, la GH no aumenta el crecimiento y la fuerza muscular, cuando es "administrada" a hombres jóvenes o adultos (1). Así, el uso de GH como tratamiento para "mejorar el rendimiento" puede ser poco efectivo, como también peligroso y hasta ilegal (1). Aunque si bien la administración exógena de GH y de IGF-I estimula el crecimiento muscular, en humanos adultos ha sido controversial; es más, ha sido demostrado que las combinaciones de la aplicación de GH y estímulos de ejercicio provocan efectos interactivos positivos en potenciar hipertrofia muscular en humanos (22). En relación a este punto, Armani y colaboradores (2) estudiaron a una atleta italiana acusada de dóping (y ganadora de una medalla de oro en los Juegos Olímpicos de Sydney) después de que le encontraron altos niveles de GH en plasma antes de los juegos. Ella fue estudiada primeramente bajo condiciones de estrés y luego en condiciones sin estrés. En el primer caso, la GH estuvo por arriba del rango normal en todas las muestra de sangre, mientras que la IGF-I estuvo normal. En el segundo caso, la GH retornó progresivamente a niveles normales aceptables, y la IGF-I estuvo otra vez normal. Se concluyó que el rango normal para la GH en los atletas debe ser reconsiderado para los propósitos de dóping, ya que los atletas están sometidos al estrés y, así, a amplias variaciones en los niveles de GH.
Por lo tanto, se puede observar que mientras el impacto del ejercicio sobre la IGF-I circulante es equívoco, los datos que vinculan al ejercicio y la acción de la IGF-I producida localmente (células musculares) se mantienen convincentes (10, 11, 18, 19).
En el estudio de Kraemer (18), donde se estudiaron hombres jóvenes (30 años) y mayores (62 años), se demostró que tan sólo 10 semanas de entrenamiento con resistencias pesadas (series de 3-5 MR a 12-15 MR 3 veces por semana) no fueron efectivas en alterar las concentraciones de IGF-I, a pesar de la diferencia relacionada con la edad (los jóvenes siempre tuvieron niveles más altos de IGF-I que los adultos). Sólo se advirtió un aumento significativo de la IGFBP-3 en el grupo de jóvenes, pero fue también alto tanto pre- como post-entrenamiento. La IGF-I y la IGFBP-3 son liberadas desde el hígado. En otros estudios, con el entrenamiento de resistencia aeróbica, la respuesta de la IGFBP-3 se mostró independiente de la respuesta de la IGF-I y potencialmente tiene su propia actividad biológica a nivel celular. Como se dijo antes, la IGF-I puede operar en una forma autócrina/parácrina en el músculo, o la mayor secreción desde el hígado puede ser fácilmente "secuestrada" por aquél tejido en un esfuerzo por mantener un equilibrio homeostático de la IGF-I en la circulación sistémica. La IGF-I ejerce una inhibición negativa sobre la secreción de la GH a nivel del hipotálamo y de la glándula pituitaria. La utilización ("secuestro") por parte del tejido muscular de la IGF-I podría servir para aumentar sus acciones mitogénicas y, al mismo tiempo, proteger al sistema de una caída en la liberación de la GH hipotalámica y pituitaria. En ese mismo estudio, quedó demostrado que tan sólo 10 semanas de entrenamiento fueron efectivas en producir mayor fuerza y tamaño muscular, demostrando una "plasticidad" por parte del sistema endócrino para cambios adaptativos tanto en jóvenes como en adultos, cuando históricamente se le atribuía solamente a fenómenos nerviosos.
En un estudio de Takarada y colaboradores (22), se demostró que en hombre jóvenes el entrenamiento con pesas (5series al 20% de 1 MR en el ejercicio de extensión de piernas en camilla, combinado con una oclusión vascular, o sea, una intensidad extremadamente baja), causó una mejor actividad eléctrica muscular y mejores respuestas hormonales. Notablemente, el aumento en la concentración plasmática de GH fue mucho mayor en magnitud que la reportada después de un ejercicio típico (alta intensidad y cortas pausas) ampliamente utilizado para ganar tamaño muscular. Incluso, tal efecto no se asoció con algún daño serio del tejido muscular, aunque sí ocurrieron ligeros micro-daños en las paredes vasculares y/o tejido muscular (aumento plasmático de la interleukina 6, IL-6). Por lo tanto, este estudio concluyó que las condiciones intramusculares de hipoxia y de acumulación de metabolitos deben ser satisfechas durante el ejercicio con resistencias para alcanzar la hipertrofia muscular.
Otro dato a tener en cuenta respecto a los niveles de IGF-I circulante es su relación con la restricción calórica, ya que en estudios de entrenamiento físico donde el gasto calórico excedía el consumo energético, la IGF-I circulante caía (7,15). Es por eso, que el entrenamiento con pesas combinado con una suplementación de hidratos de carbono y/o aminoácidos estimulan un aumento en la IGF-I (15).
CONCLUISIONES
Como resumen final, se presentan varias notas concluyentes:
- La testosterona no es la principal hormona que induce hipertrofia muscular, sino que responde a otros factores y mecanismos más intrínsecos, siendo en hombres una potente hormona que mejora la función neural.
- La respuesta de la testosterona al ejercicio de fuerza es altamente variable entre los individuos.
- Los factores de crecimiento, en especial, el sistema IGF-I, son los responsables del crecimiento muscular provocado por daño muscular inducido por ejercicio.
- El aumento de IGF-I plasmático con administración exógena de GH o IGF-I (utilizado para problemas de crecimiento en adolescentes y en adultos con deficiencia de GH) no estimulan la hipertrofia de las miofibras en ausencia de carga mecánica sobre el músculo.
- Sin embargo, la inducción de IGF-I exógena directamente en el músculo esquelético aumenta la masa muscular, indicando que existe algún estímulo que causa un aumento en la disponibilidad de IGF-I muscular que conlleva al crecimiento muscular.
- La actividad muscular de la IGF-I es independiente de los cambios en la IGF-I plasmática, lo que hace que éste último no sea considerado un buen marcador de la actividad intrínseca (local) del sistema GH/IGF-I.
- La respuesta hipertrófica es específica de los músculos sobrecargados, la activación del sistema hormonal IGF-I requiere de la modulación (mediado por la carga) de la eficacia de hormonas en los músculos ejercitados.
- Las respuestas musculares del sistema IGF-I parecen ser más sensibles a la acción excéntrica, debido al daño muscular y su regeneración.
- La isoforma MGF de la IGF-I es estimulada marcadamente en respuesta a un estiramiento y/o sobrecarga grande sobre el músculo.
- El punto óptimo de tiempo para una elevación aguda post-ejercicio (de fuerza) en el contenido muscular de IGF-I es desconocido.
- La IGF-I actúa de manera autócrina (estimulación directa de la síntesis de proteínas miofibrilares) y parácrina (proliferación, diferenciación y fusión de células satélite)
- La IGF-I a nivel muscular compite con la insulina, ya que estructuralmente, se puede unir al receptor de la insulina en el músculo.
- Existe una relación entre la restricción calórica y/o excesivo gasto calórico (por ejercicio) y los niveles de IGF-I circulantes, disminuyendo éstos últimos cuando aumentan aquéllos.
- La suplementación de hidratos de carbono y aminoácidos, combinados con entrenamiento con pesas, aumentan los niveles circulantes de IGF-I.
- De acuerdo a estudios, la respuesta de la IGF-I al entrenamiento con pesas, es más importante por su calidad que por su cantidad o magnitud de esta respuesta, ya que la IGF-I circulante no varía tan significativamente luego del ejercicio con pesas, aunque su composición (sus proteínas) sí varía.
- Los jóvenes tienen mayores concentraciones de IGF-I (en especial la IGFBP-3), teniendo su pico máximo en la adolescencia, que los adultos.
- Se necesitan estudios más prolongados en el tiempo para observar cómo las concentraciones hormonales, en especial, los factores de crecimiento, provocan cambios en el tamaño muscular, fuerza muscular y capacidades funcionales, tanto en sujetos jóvenes como adultos.
- Las condiciones intramusculares de hipoxia y de acumulación de metabolitos durante el trabajo muscular (ejercicios de fuerza), deben ser satisfechas ara alcanzar la hipertrofia muscular.
Como observamos, el fenómeno de los Factores de Crecimiento (Sistema GH-IGF-I) relacionado con el ejercicio de fuerza es bastante complejo e interesante a la vez.
Uno de los puntos llamativos fue observar qué ocurre realmente en el músculo esquelético cuando es sometido a una sobrecarga de fuerza. La gran importancia del rol del sistema IGF-I en la llamada “hipertrofia compensatoria” en respuesta al daño muscular provocado por el ejercicio de fuerza. También, importante es el significado de este fenómeno de carácter localizado, como bien se explico anteriormente. Esto tiene un gran valor práctico, a la vez que surge una pregunta: ¿sólo los ejercicios que involucran grandes masas musculares son efectivos en la promoción de la hipertrofia muscular, como tan popularmente se pregona? A la luz de lo expuesto en este trabajo de revisión, la respuesta sería que no son los únicos. Y lo más importante, es que el ejercicio muscular localizado (en determinadas condiciones, antes comentadas), puede ser realizado por sujetos que están limitados a la ejecución de ejercicio que involucren a todo el cuerpo o grandes masas musculares, tal es el caso de los adultos mayores de edad o personas con discapacidades en distintas regiones del cuerpo. Un ejemplo de esto, serían los esfuerzos por combatir la sarcopenia en poblaciones adultas sedentarias. Aquí, el ejercicio con resistencias (de fuerza), aún en forma localizada, juega un rol preventivo (prevención primaria y secundaria) en esta enfermedad producto del envejecimiento y el sedentarismo.
Para finalizar, y como propuesta de estudio, se necesitaría más información y trabajos de investigación acerca de los factores de crecimiento (sistema IGF-I) a través de largos períodos de entrenamiento y sus consecuencias sobre la hipertrofia muscular inducida por ejercicios de fuerza, sus respuestas y la carga de trabajo óptima para obtener los mejores beneficios de esas respuestas del sistema IGF-I, y también, sus adaptaciones crónicas al entrenamiento en distintas poblaciones.
Referencias
1. Adams G.R (2002). Exercise effects on muscle insulin signaling and actions, Invited Review: autocrine/paracrine IGF-I and skeletal muscle adaptation. J Appl Physiol 93:1159-1167
2. Armani D (2002). Growth hormone and insulin-like growth factor I in a Sydney Olympic Gold medallist: case report. Br J Sports Med 36 (148-149)
3. Bamman M.M (2001). Mechanical load increases muscle IGF-I and androgen receptor mRNA concentrations in humans. Am J Physiol Endocrinol Metab 280:E380-E390
4. Costill D.L (1998). Fisiología del esfuerzo y del deporte. Ed. Paidotribo, Barcelona
5. Coyle E.F (2000). Physical activity as a metabolic stressor. Am J Clin Nutr 72, (Suppl.) 512s-20s
6. Eliakim A (1996). Physical fitness, endurance training and the growth hormone-insulin-like growth factor I system in adolescent females. J Clin Endocrinol Metab 81 (11): 3986-3991
7. Fiatarone Singh M.A (1999). Insulin-like growth factor I in skeletal muscle after weight-lifting exercise in frail elders. Am J Physiol Endocrinol Metab 277 (40): E135-E143
8. Fleck S.J (1996). Influence of resistance exercise volume on serum growth hormone and cortisol concentrations in women. J Strength Cond Res, Vol. 10 (4)
9. Florini J.R (1996). Growth hormone and the insulin-like growth factor system in myogenesis. Endocrine Reviews, Vol. 17 Nº 5, 481-517
10. Harridge S.D.R (2003). Expression on IGF-I splice variants in young and old human skeletal muscle after high resistance exercise. J Physiol, 547.1, pp. 247-254
11. King M.W (2003). No Disponible. Medical Biochemestry Page, IU School of Medicine. (http://web.indstate.edu/thcme/mwking/) web site.
12. Kraemer W.J (1998). Hormonal responses to consecutive days of heavy-resistance exercise with or without nutritional supplementation. J Appl Physiol 85 (4): 1544-1555
13. Kraemer W.J (1999). Cap. 4:Hormonal mechanisms related to the expression of muscular strength, Strength and Power in Sports. Edited by Komi P.V., Blackwell Science, London, UK
14. Kraemer W.J (1999). Cap. 11:Endocrine responses and adaptations to strength training, Strength and Power in Sports. Edited by Komi P.V., Blackwell Science, London, UK
15. Kraemer W.J Effects of heavy-resistance training on hormonal response patterns in younger vs older men (1999). J Appl Physiol 87 (3): 982-992
16. Nindl B.C (2001). Overnight responses of the circulating igf-I and androgen receptor mRNA concentrations in humans. Am J Physiol Endocrinol Metab 280:E383-E390
17. Pollock M.L (2001). Effects of resistance training on insulin-like growth factor I and IGF binding proteins. Med Sci Sorts Exercise, Vol. 33 (4)
18. Spangenburg E.E (2003). IGF-I isoforms and ageing skeletal muscle: an unresponsive hypertrophy agent. J Physiol, 547, p. 2, Perspectives
19. Takarada Y (2000). Rapid increase in plasma growth hormone after low-intensity resistance exercise with vascular occlusion. J Appl Physiol 88: 61-65
20. Thorsen K (1999). The relation between bone mineral density, insulin-like growth factor I, lioprotein (a), body composition, and muscle strength in adolescent males. J Clin Endocrinol Metab, Vol. 84 (9); 3025-3029