MAPKs y Factores Reguladores Miogénicos
Publicado 29 de mayo de 2014, 3:51
1. Vía de Señalización de las MAPK
Esta vía metabólica tiene su origen en la superfamilia de las proteínas Ras (ras; rat sarcoma). La proteína Ras es una GTPasa monomérica de 21 KDa que sobrelleva la activación e inactivación del ciclo de las proteínas G, funcionando así como un interruptor en la trasmisión de señales [1]. Así, la forma GTP ligada representa el estado activo mientras la forma GDP ligada es el estado inactivo de la proteína. La conversión del complejo inactivo RasGDP al complejo activo RasGTP se lleva a cabo mediante factores de intercambio de nucleótidos de guanina (GEFs, guanine nucleotide exchange factors). La proteína Ras activa desarrolla todas sus funciones en cercanías a la membrana celular y tiene una función clave en la traducción de señales extracelulares, particularmente promoviendo el crecimiento, proliferación y diferenciación. La traducción de la señal empieza en la activación de receptores tirosina cinasa y otros receptores transmembranales que transmiten la señal por medio de los GEFs a la Ras activándola. Una vez activa, Ras procesa la señal a nivel de transcripción por medio de la cascada de las MAPK y desde aquí activa genes clave de los cuales muchos promueven la proliferación y posterior diferenciación celular. Otra vía importante que promueve señales antiapoptóticas y proliferativas puede ser desarrollada desde Ras por medio de la cascada PI3K/Akt [1].
La primera proteína identificada que es activada
por Ras es Raf cinasa, una proteína cinasa específica de Ser/Thr. La forma
RasGTP interactúa alostéricamente con Raf cinasa y de esta manera media su
activación permitiendo que esta estimule el resto de la cascada de las MAPK,
siendo Raf el primer miembro de esta vía de señalización y clasificada entre el
grupo de las MAP3Ks/MAPKKKs/MEKKs, las cuales son el punto de inicio de la
cascada de las MAPK. Posteriormente, Raf cinasa fosforila y activa corriente
abajo a las proteínas MAPKK/MEK en dos residuos de serina separados por tres aminoácidos,
las cuales a su vez fosforilan a las MAPK/ERK en residuos de tirosina y
treonina permitiendo su activación (así el término MAPK es frecuentemente usado
para la cinasa terminal de la cascada de las MAPK, refiriéndose así a
diferentes proteínas cinasa terminales). En la mayoría de los casos este
proceso está ligado a la translocación de la proteína cinasa terminal al
interior del núcleo, localizando sustratos que generalmente son factores de
transcripción para activarlos [1] (Figura 1).
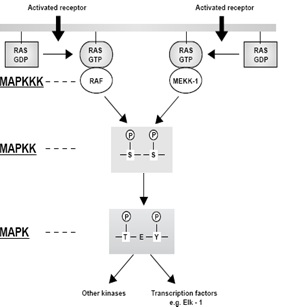
Figura 1. Componentes y activación de la cascada de las MAPK/ERK. Las señales extracelulares son registradas por medio de receptores tirosina cinasa y transitadas a la proteína Ras. RasGTP activa proteínas cinasas pertenecientes al grupo de las MAPKKK (Raf cinasas y MEKKs). Las MAPKKK fosforilan corriente abajo en dos residuos de serina al grupo de proteínas MAPKKs. Las MAPKKs fosforilan en residuos de tirosina y treonina las MAPK/ERK. Tomado de: Krauss, Gerhard. Biochemistry of Signal Transduction and Regulation. Third, Completely Revised Edition. Germany. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim (2003).
Actualmente, han sido verificadas tres MAPK principales en humanos: La clase menos caracterizada de las vías activadas por estrés es la cascada de ERK5 con su proteína ERK5 como cinasa terminal; la vía de la cinasa NH2-terminal c-Jun/proteína cinasa activada por estrés (JNK/SAPK, c-Jun NH2-terminal kinase/stress-activated protein kinase), la cual está ligada a una variedad de receptores celulares los cuales son sensibles al estrés y a la inflamación, incluyendo receptores de muerte celular (FAS), receptores inflamatorios de citoquinas (TNFα, factor de necrosis tumoral y TGFβ, factor de crecimiento tumoral) y receptores de antígenos. La cinasa terminal de esta vía es JNK/SAPK y tiene como sustrato el factor de transcripción c-Jun aunque también se ha evidenciado una activación del factor de transcripción de p53, con función supresora tumoral y reguladora de la diferenciación; y la vía de p38 que tiene a la proteína p38 como cinasa terminal característica. Esta clase de MAPK está involucrada en la diferenciación celular y la apoptosis, además responde a estímulos de estrés, irradiación UV, choque térmico, choque osmótico y factores de crecimiento. La p38 activa ha sido caracterizada por fosforilar factores de transcripción como ATF2 y el factor realzador del miocito (MEF-2, myocyte enhancer factor 2) [1].
2. Factores
Reguladores Miogénicos
La diferenciación del músculo esquelético sigue un programa específicamente regulado por la expresión de genes (Figura 2). Varias proteínas son esenciales para la diferenciación incluyendo los factores de transcripción miogénicos básicos helix-loop-helix (bHLH) MyoD, Miogenina, Myf5 y MRF4/Myf6/Herculin (conocidos popularmente como factores reguladores miogénicos, MRFs) y otros factores transcripcionales como el MEF-2, sustrato directo de p38. La familia de factores de transcripción MEF-2 tiene un papel clave en la diferenciación muscular y en la activación de genes asociados a la regeneración muscular como la cofilina (una proteína reguladora de la actina) y la vimentina. Son cuatro las isoformas de MEF-2 (A-D) que han sido identificadas y todas (excepto MEF-2B) son expresadas en el músculo esquelético. En miotubos diferenciados, MEF-2 está localizado en el núcleo en donde se une a secuencias específicas de ADN, incluyendo las de los MRFs, activando su transcripción. Estos factores actúan en múltiples puntos del lineamiento miogénico para establecer la identidad de mioblastos y el control terminal de la diferenciación [2].
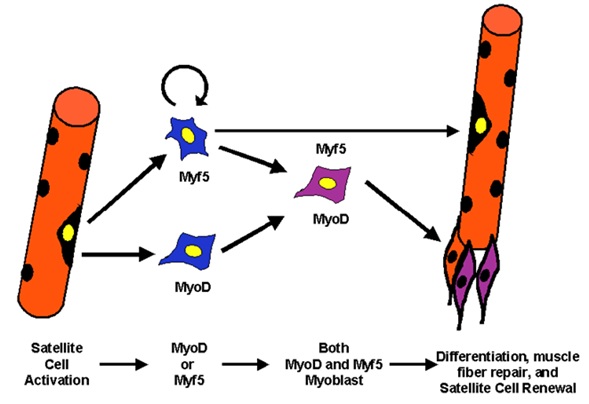
Figura 2. Esquema general de los procesos celulares que implican a los Fatores Reguladores Miogénicos (MRFs).
Los MRFs son necesarios para la determinación, terminación de la diferenciación y mantenimiento del músculo esquelético. Durante el desarrollo, la iniciación de la expresión de MyoD y Myf5 define el origen de las células miogénicas progenitoras que son responsables de formar los distintos grupos musculares en el organismo adulto. La clonación original del MyoD y su función en la diferenciación del músculo esquelético marcó una nueva era de investigación en la miogénesis, conllevando a la clonación de los otros tres MRFs. La sobreexpresión de estos factores convierte células no musculares en una línea miogénica, además la habilidad de cada factor de iniciar la expresión de uno o más de los otros tres MRFs sugiere que estos forman un loop regulador cruzado. Experimentos enfocados en la activación de genes por los MRFs sugieren que MyoD y Myf5 actúan en la determinación del linaje del mioblasto mientras Miogenina y MRF4 son importantes para la diferenciación y mantenimiento del estado final de este proceso [3], además se ha evidenciado que estos MRFs se unen a las regiones promotoras y enhancers corriente abajo de algunos genes específicos musculares como el MHC, α-actina, TpI y CK [4].
3. ¡Creatina como súper suplemento!
Requiere especial atención el efecto que tiene la suplementación con Cr sobre los factores de transcripción miogénicos, el destino de activación final de las cascadas de señalización que activan el proceso de hipertrofia muscular y que influyen directamente sobre el proceso de diferenciación celular.
Haciendo un énfasis en la expresión de MEF-2 tras la suplementación con Cr y el ejercicio de resistencia, en el trabajo de Deldicque y col. [5] en (2008) se evidenció un aumento del doble en el nivel de expresión del MEF-2 en el núcleo con respecto al estado inicial y también una tendencia de mayor incremento en éste nivel con respecto al placebo, aunque sin diferencia significativa, durante el postejercicio. Anteriormente, Ju y colaboradores (2005) [6] habían reportado un incremento significativo en las isoformas musculares de MEF-2 en ratas alimentadas con Cr (2% dieta) con respecto a los grupos control.
Hespel y col. (2001) [7] concluyeron que la suplementación con Cr estimula la hipertrofia muscular durante entrenamiento fuerte de rehabilitación mediante un cambio inducido sobre el contenido de MRF4 muscular. Consecutivamente, Willoughby & Rosene (2003) [4] examinaron el efecto de 12 semanas de suplementación con Cr y ejercicio pesado de resistencia (3 veces a la semana 3 sets de 6-8 repeticiones al 85-90% de la repetición máxima de press de pierna, extensión de rodilla y curl de pierna) sobre la expresión de CK, MyoD, Miogenina, MRF4 y Myf5 mediante un estudio de doble ciego que se llevó a cabo con 22 hombres, asignados aleatoriamente a los grupos control, placebo (maltodextrina) y Cr (6 g de Cr dia-1 durante toda la investigación). Biopsias musculares fueron tomadas del vasto lateral antes y después del entrenamiento para ser analizadas por Western Blot y RT-PCR. Después del entrenamiento, la expresión de CK, Miogenina y MRF4, incrementó significativamente en el grupo Cr con respecto al placebo y al control. En el caso de la proteína y ARNm del MyoD, los grupos Cr y placebo presentaron mayores diferencias en relación al control (P<0.05) pero sin diferencias entre ellos mismos. No fueron encontradas diferencias significativas en la proteína ni el ARNm del Myf5. En conclusión, los autores señalaron que la suplementación con Cr cuando es combinada con entrenamiento en ejercicios de resistencia, incrementa la expresión del ARNm y proteína de Miogenina y MRF4 estimulando un incremento en la expresión y tamaño de MHC [4]. De acuerdo con esto, Willoughby & Rosene (2001) [8] demostraron que la suplementación con Cr incrementa significativamente el contenido de proteína y ARNm de los tipos I y II de MHC, además del contenido de proteína miofibrilar, después de 12 semanas de entrenamiento de resistencia en el ser humano.
La expresión de los ARNm para los diferentes tipos de MHC y para la CK ha sido caracterizada por estar regulada a nivel pretraduccional por los MRFs, de tal manera que la suplementación con Cr y el ejercicio de resistencia incrementan la expresión de estos factores de transcripción y tienen un efecto notable sobre la expresión de las diferentes isoformas de MHC, ya que se ha demostrado que el ARNm de los tipos I y IIA de MHC se correlacionan con la expresión de Miogenina mientras que el ARNm de la MHC tipo IIX ha sido correlacionado con el MyoD [4]. A pesar del incremento en la expresión de CK muscular, Machado y colegas (2009) [9] demostraron que la suplementación con Cr durante ejercicio de resistencia no tiene efecto alguno sobre la actividad de CK sérica, la cual se usa como un marcador fisiológico de ciertos desordenes de miocardio y de tipo muscular.
Los aspectos teóricos analizados anteriormente demuestran claramente el poderoso potencial ergogénico de la suplementación con Cr, es por eso que personalmente considero la Cr (en su forma de Monohidrato de Cr) como el suplemento dietario más poderoso y eficiente para mejorar significativamente el rendimiento deportivo, sin tener en cuenta los múltiples efectos adicionales que tiene la administración de Cr sobre las salud humana [10].
Referencias
[1] Krauss G. (2003). Biochemistry of Signal Transduction and Regulation. Third, Completely Revised Edition. Germany. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
[2] Al-Khalili L, Krämer D, Wretenberg P & Krook A. (2004). Human Skeletal Muscle Cell Differentiation is Associated with Changes in Myogenic Markers and Enhanced Insulin-Mediated MAPK and PKB Phosphorylation. Acta Physiol Scand, 180, 395–403
[3] Perry RL & Rudnicki MA. (2000). Molecular Mechanisms Regulating Myogenic Determination and Differentiation. Frontiers in Bioscience 5, d750-767
[4] Willoughby DS & Rosene JM. (2003). Effects of Oral Creatine and Resistance Training on Myogenic Regulatory Factor Expression. Med. Sci. Sports Exerc., Vol. 35, No. 6, pp. 923-929
[5] Deldicque L, Louis M, Theisen D, Nielens H, Dehoux M, Thissen JP, Rennie MJ & Francaux M. (2005). Increased IGF mRNA in Human Skeletal Muscle after Creatine Supplementation. Med Sci Sports Exerc 37 (5); 731-736
[6] Ju JS, Smith JL, Oppelt PJ & Fisher JS. (2005). Creatine Feeding Increases GLUT4 Expression in Rat Skeletal Muscle. Am J Physiol Endocrinol Metab 288: E347–E352
[7] Hespel P, Op‘t Eijnde B, Leemputte MV, Ursø B, Greenhaff PL, Labarque V, Dymarkowski S, Hecke PV & Richter EA. (2001). Oral Creatine Supplementation Facilitates The Rehabilitation of Disuse Atrophy and Alters The Expression of Muscle Myogenic Factors In Humans. Journal of Physiology, 536.2, 12464, pp.625–633
[8] Willoughby DS & Rosene J. (2001). Effects of Oral Creatine and Resistance Training on Myosin Heavy Chain Expression. Med Sci Sports Exerc;33:1674
[9] Machado M, Pereira R, Sampaio-Jorge F, Knifis F & Hackney A. (2009). Creatine Supplementation: Effects on Blood Creatine Kinase Activity Responses to Resistance Exercise and Creatine Kinase Activity Measurement. Brazilian Journal of Pharmaceutical Sciences 45 (4), 751-757
[10] Bonilla DA. (2013). Principios Metabólicos de los Efectos de la Suplementación con Creatina sobre el Rendimiento Deportivo. PubliCE Standard. http://g-se.com/es/org/db-sport-supplementation/articulos/principios-metabolicos-de-los-efectos-de-la-suplementacion-con-creatina-sobre-el-rendimiento-deportivo-1601
