1Faculty of Kinesiology and Physical Education, University of Toronto, Toronto ON, M5S 2W6, Canada.
2Exercise and Nutrition Research Group, Department of Exercise Sciences, Australian Catholic University, Fitzroy,Victoria, Australia.
3Exercise and Nutrition Research Group, Department of Exercise Sciences, Australian Catholic University, Fitzroy, Victoria, Australia; Research Institute for Sport and Exercise Sciences, Liverpool John Moores University, Liverpool, UK.
Resumen
INTRODUCCION
La recuperación apropiada frente al estrés producido por el ejercicio es un componente esencial de cualquier programa periodizado que tenga como fin maximizar las adaptaciones fisiológicas inducidas por el entrenamiento y mejorar el rendimiento deportivo. Las sesiones prolongadas y continuas de entrenamiento de resistencia plantean demandas metabólicas significativas entre las que se incluyen el agotamiento de las reservas endógenas de combustible (ej., glucógeno hepático y muscular). pérdida de fluidos y electrólitos del cuerpo, alteraciones hormonales y daño/alteraciones en las proteínas musculares y en las proteínas del cuerpo. Por lo tanto las estrategias de recuperación para atletas competitivos que realizan entrenamiento de resistencia generalmente están centradas en 3 enfoques relacionados entre si: recuperación de combustibles, rehidratación y reparación. Dadas las grandes demandas energéticas del entrenamiento de resistencia diario (Stepto et al. 2002). muchos atletas reconocen la importancia de llenar las reservas de combustibles a través de la ingesta de carbohidratos post-ejercicio siguiendo los protocolos establecidos (Burke et al. 2004). Por otra parte, se sabe cual es el rol que tienen la hidratación y la rehidratación en la optimización de los resultados del entrenamiento y en el rendimiento (Murray 2007; Sawka et al. 2007). De igual manera, muchos atletas de resistencia competitivos conocen la necesidad de recuperar los combustibles y de rehidratarse después de entrenar. Sin embargo, un aspecto del proceso de recuperación que frecuentemente no se tiene en cuenta es el papel de las proteínas dietéticas que aportan los "ladrillos" (es decir, aminoácidos) para reparar y regenerar las proteínas dañadas, y sintetizar una variedad de nuevas proteínas (entre las que se incluyen las proteínas miofibrilares contráctiles, las proteínas mitocondriales productoras de energía y los complejos enzimáticos asociados). Esta reparación y remodelación de proteínas musculares es la que aporta la base muchas de las adaptaciones inducidas por el entrenamiento que regulan los aumentos en la calidad del músculo (es decir, densidad mitocondrial y (o) área transversal) y que finalmente permitirá un mejor rendimiento
La importancia del adecuado contenido de proteínas dietéticas para mejorar la recuperación frente a ejercicios de sobrecarga se conoce con detalle y es un principio fundamental de nutrición para el crecimiento del músculo (Churchward-Venne et al. 2012). Los factores que influyen en el nivel y la magnitud de la remodelación muscular que producen los ejercicios de fuerza incluyen la cantidad, tipo y momento en que se produce la ingesta de proteínas (Burd et al. 2009). Sin embargo, sólo recientemente se ha reconocido que los resultados de estudios realizados con atletas entrenados en fuerza pueden tener importancia para atletas que están entrenando y compitiendo en eventos de resistencia. Por lo tanto el propósito general de esta revisión fue resumir la información reciente sobre la importancia de las proteínas de la dieta para el atleta de resistencia, centrándonos en el papel de las proteínas para facilitar una recuperación y una adaptación óptimas al entrenamiento de resistencia de alta carga. Si bien proporcionaremos una apreciación global breve sobre los requisitos de proteínas que tiene un atleta de resistencia, nuestro enfoque principal será discutir los resultados de las investigaciones recientes que han acrecentado nuestros conocimientos sobre los aspectos específicos de una mayor disponibilidad de proteínas que facilite la remodelación muscular promoviendo la síntesis de proteínas musculares. Debido a la escasez de evidencia sobre el impacto que tiene la ingesta de proteínas en la remodelación muscular post-ejercicio (es decir, aumento en la producción de proteínas musculares) después del entrenamiento de resistencia, se destacarán los estudios que hayan utilizado entrenamiento de la fuerza y se pondrán en el contexto del atleta de resistencia.
Los aminoácidos como combustible
Los combustibles basados en carbohidratos (CHO) (glucógeno hepático y muscular, glucosa sanguínea, lactato sanguíneo, muscular y hepático) son la fuente de energía principal para la contracción muscular durante eventos de resistencia continuos de 2 h de duración (Hawley y Hopkins 1995). En eventos de resistencia que tienen una duración de 2-10 h (i.e. triatlón Ironman) hay todavía una fuerte dependencia de los carbohidratos para el metabolismo oxidativo, pero los combustibles basados en las grasas (triglicéridos adiposos e intramusculares así como los ácidos grasos libres transportados por la sangre) juegan un papel cada vez mas importante en la provisión de energía (Jeukendrup 2011). Dado que las reservas endógenas de CHO son limitadas, las estrategias nutricionales para retardar su tasa de oxidación durante el ejercicio y/o para aumentar su disponibilidad antes y/o durante el ejercicio han recibido un importante abordaje científico (Burke et al. 2011). Sin embargo, la oxidación de aminoácidos (del conjunto de aminoácidos libres en sangre y en hígado, así como también de las reservas de proteínas que están en equilibrio) puede aportar hasta un 10% de la energía total durante el ejercicio de resistencia (Tarnopolsky 2004). Esta mayor oxidación se incrementa hasta una magnitud significativa por medio de la descomposición de las proteínas musculares en sus aminoácidos constitutivos (Howarth et al. 2010). que luego son liberados del músculo para la gluconeogénesis hepática y/o para sufrir desaminación y oxidados dentro de las mitocondrias musculares como una fuente directa de combustible (este es el principal destino de los aminoácidos de cadena ramificada y sobre todo de la leucina) (Tarnopolsky 2004).
La oxidación de aminoácidos endógenos puede incrementarse por diferentes factores tales como la intensidad y (o) la duración del ejercicio (Haralambie y Berg 1976; Lamont et al. 2001). la baja disponibilidad de glucógeno muscular (Howarth et al. 2010; Lemon y Mullin 1980). una dieta habitualmente rica en proteínas (es decir, aprox. 1,8 g/(kg/día) (Bowtell et al. 1998) y el sexo (Phillips et al. 1993). El entrenamiento de resistencia disminuye la actividad máxima de la deshidrogenasa de cetoácidos de cadena ramificada (la enzima que controla la velocidad de la oxidación de aminoácido de cadena ramificada) durante el ejercicio al tiempo que disminuye la estimulación de la oxidación de leucina inducida por el ejercicio (McKenzie et al. 2000). lo que sugiere que el músculo de los individuos entrenados en resistencia tiene un metabolismo refinado que puede reducir su dependencia de los aminoácidos como fuente alternativa de combustible. Si bien la práctica común de consumir CHO durante el ejercicio de resistencia atenúa la oxidación de aminoácidos, las tasas en el cuerpo entero se mantienen significativamente elevadas durante el descanso (Bowtell et al. 2000). De hecho, la leucina, un aminoácido con un importante rol regulador en el metabolismo de las proteínas (discutiremos esto a continuación). puede ser oxidado a una tasa de 8 mg/(kg h) en atletas de resistencia que realizan ejercicio continuo de intensidad moderada (aprox. 60% de potencia aeróbica máxima (VO2max)) (Bowtell et al. 1998). lo que produce una pérdida estimada de leucina en todo el cuerpo de aprox. 1,2 g durante 2 h. Asumiendo que la proteína muscular contiene 9% de leucina (Burd et al. 2013). esto podría significar que durante este tipo de ejercicio se cataboliza un equivalente de 13 g de proteína. Paradójicamente a pesar del aumento inducido por el ejercicio en la oxidación de leucina, esta demanda extra de proteínas ejerce un efecto pequeño en el balance neto de leucina durante 24-h en las pruebas metabólicas agudas (Forslund et al. 1999). Estos datos sugieren que durante el transcurso de un día se produce un acomodamiento metabólico para ahorrar pérdidas netas de leucina, quizás a través de una menor oxidación de leucina post-ejercicio (Devlin et al. 1990). Sin embargo, para el atleta que entrena diariamente (o en varias ocasiones en un solo día) y/o para quienes estén enfocados en una estrategia de recuperación óptima que busque alcanzar el balance neto de leucina (proteína) o superarlo, este potencial acomodamiento en el metabolismo de proteínas puede no ser ideal para mantener las metas de entrenamiento a largo plazo. Dado que los aminoácidos oxidados (y sobre todo el aminoácido esencial leucina) se pierden y no contribuyen con la mayor síntesis de proteínas musculares que se observa durante la recuperación, deben ser remplazados ostensiblemente a través de las fuentes dietéticas.
NECESIDADES DE PROTEÍNAS DE LOS ATLETAS DE RESISTENCIA
Balance energético
En la población general, las necesidades actuales de proteínas para mantener el balance de nitrógeno han sido establecido en 0,8 g/(kg/día). Sin embargo, las personas activas, particularmente los atletas que realizan entrenamiento de la resistencia de alta carga y entrenamiento de la fuerza, tienen una mayor necesidad de proteínas que sus colegas sedentarios. Por lo tanto, estos individuos necesitan ingerir una mayor cantidad de proteínas con la dieta para cumplir con el balance de nitrógeno (Phillips et al. 1993; Tarnopolsky et al. 1988). De hecho, se ha sugerido que la necesidad de proteínas de tales atletas puede ser 40%-100% mayor que la ingesta dietética recomendada (Tarnopolsky 2004). Se cree que este mayor requerimiento proteico refleja la mayor oxidación de aminoácidos que se produce durante el ejercicio en estos atletas (Tarnopolsky 2004). Sin embargo, se ha cuestionado la importancia de mantener el balance de nitrógeno en atletas, dado que tiene poca vinculación directa con cualquier medida de rendimiento o incluso con la masa muscular magra per se (Phillips 2006; Phillips et al. 2007; Tipton y Witard 2007). Es más, la mayoría de los atletas entrenados en resistencia probablemente cumplen con los requerimientos de energía diarios totales y por consiguiente probablemente ingieren cantidades de proteínas más altas que los niveles recomendados mínimos (Tarnopolsky 2004). Como discutiremos luego, es probable que el tipo de proteína y el momento de la ingesta tengan un rol más importante para maximizar la recuperación y la adaptación al entrenamiento de resistencia que meramente alcanzar o superar las recomendaciones actuales de consumo diario de proteínas (Tarnopolsky 2004)).
Balance energético negativo
Durante períodos de entrenamiento intenso y (o) pérdida de peso voluntaria (es decir, restricción energética para todo el cuerpo). los atletas de resistencia se enfrentan con un período de baja disponibilidad de energía (Loucks 2007). La desconexión entre la ingesta de energía y el gasto de energía puede provocar una reducción en la masa corporal total, especialmente de la masa magra corporal (es decir, músculo). Las implicaciones de la pérdida de tejido magro durante el entrenamiento y los resultados de rendimiento son obvias. Además si esta menor ingesta de energía no permite recuperar las reservas musculares (y hepáticas) de glucógeno antes de las sesiones de entrenamiento subsiguientes, es probable que se produzca un mayor catabolismo muscular y una mayor oxidación de aminoácidos durante el ejercicio subsiguiente (Howarth et al. 2010). lo que finalmente provocará la necesidad de una mayor de ingesta dietética de los aminoácidos oxidados (por ejemplo, leucina) para completar las reservas de aminoácidos. Los estudios realizados con poblaciones de sujetos no deportistas (Josse et al. 2011; Pasiakos et al. 2013) y con diferentes modalidades de entrenamiento (i.e., ejercicio de la fuerza) (Mettler et al. 2010) demuestran que el aporte de proteínas en la dieta por encima de los niveles recomendados atenúa la pérdida de masa magra corporal durante los períodos de disponibilidad de energía reducida; esta estrategia tendría un apoyo preliminar en atletas que participan en deportes de resistencia (Haakonssen et al. 2013). Si bien no se han investigado sistemáticamente las necesidades de proteínas de los atletas de resistencia durante los períodos de balance energético deliberadamente negativo, es probable que estos individuos se beneficien de una mayor disponibilidad de proteínas dietarias (Tipton y Witard 2007). de manera similar a lo que ocurre con los atletas entrenados en fuerza (Helms et al. 2013). Sin embargo, la ingesta adicional de proteínas con la dieta no debe producirse a expensas de alcanzar la ingesta adecuada de CHO que son esenciales si un atleta desea mantener la calidad del entrenamiento (i.e. intensidad) y de rendimiento (Jarvis et al. 2002; Macdermid y Stannard 2006).
Remodelación del músculo esquelético inducida por el ejercicio.
El músculo esquelético es un tejido muy plástico que sufre remodelación constante a través de procesos continuos y simultáneos de síntesis de proteínas musculares (MPS) y degradación de las mismas. El equilibrio neto entre estos 2 procesos ("producción") finalmente determinará si el tejido del músculo esquelético aumentará (hipertrofia) o disminuirá (atrofia) el contenido total de proteínas (Rennie et al. 2004; Burd et al. 2009). En el caso de los atletas que entrenan para deportes de resistencia, la remodelación del músculo es esencial para romper las proteínas viejas y (o) dañadas y para resintetizar nuevas proteínas funcionales. Que este proceso energéticamente costoso signifique una expansión neta de un conjunto de proteínas específicas puede ser algo irrelevante (por ejemplo, proteínas miofibrilares) o puede ser un resultado buscado del entrenamiento (por ejemplo, una mayor biogénesis mitocondrial). No obstante, la preminencia de la estimulación de la síntesis de proteínas musculares es que los cambios cualitativos en la síntesis de las fracciones de proteínas musculares (por ejemplo, las proteínas miofibrilares generadoras de fuerza vs. proteínas mitocondriales productoras de energía) aportan una visión de la respuesta adaptativa final al entrenamiento (por ejemplo, músculos más grandes vs. músculos más resistentes a la fatiga) (Wilkinson et al. 2008).
Numerosos estudios han informado aumentos en la síntesis de proteínas de los músculos mixtos luego de una sola serie de ejercicio (Harber et al. 2010; Mascher et al. 2011) y luego de entrenamiento de resistencia a corto plazo (i.e., 4 semanas) (Pikosky et al. 2006) y de entrenamiento crónico (es decir, 4 meses) (Short et al. 2004). Tales aumentos en la síntesis de proteínas de los músculos mixtos reflejan una mayor remodelación de proteínas del músculo que puede incluir proteínas/enzimas relacionadas a las mitocondrias, proteínas anigiogénicas (ej., células endoteliales y células del músculo liso dentro de los capilares). y proteínas miofibrilares. El/Los mecanismo(s) celulares que regulan los aumentos observados en la síntesis de proteínas musculares luego de entrenamiento de resistencia han comenzado a ser explorados recientemente. Al respecto, el blanco corriente abajo del complejo rapamicina 1 (mTORC1) de la cascada de señalización intracelular, es una importante vía estimulada por la contracción y por los nutrientes que regula el inicio de la traducción y la posterior síntesis de proteínas en el músculo esquelético (Drummond et al. 2009; Dickinson et al. 2011). El ejercicio de resistencia ya sea en forma de ejercicio prolongado de carga constante, o de esprints repetidos de alta intensidad estimula la señalización mTORC1 independientemente del consumo de proteínas (Benziane et al. 2008; Coffey et al. 2011; Mascher et al. 2007). De hecho, nosotros observamos previamente una evolución similar de la señalización mediada por mTOR durante el período de recuperación temprano (60-min) entre ejercicios de fuerza y ejercicios de resistencia (Camera et al. 2010). Independientemente, la activación y la posterior estimulación de aspectos de la maquinaria de señalización celular que regula la síntesis de proteínas después de los ejercicios de resistencia son un requisito previo necesario para el aumento en la traducción de los genes y la posterior expresión de proteínas, lo que finalmente producirá el fenotipo inducido por el ejercicio asociado con este tipo de entrenamiento. Sin embargo, es necesario realizar trabajos adicionales para poder establecer la "firma" molecular apropiada que puede traducirse en tasas alteradas de síntesis de proteínas musculares, debido a que existen algunos informes de una disociación entre estos marcadores "instantáneos" agudos de actividad quinasa y la cinética de la posterior remodelación proteica (Greenhaff et al. 2008; Wilkinson et al. 2008).
Las proteínas de la dieta para mejorar las tasas de síntesis de proteínas musculares
La ingesta de aminoácidos dietéticos aumenta la síntesis de proteínas musculares durante la recuperación de los ejercicios de fuerza (Burd et al. 2009). Este mayor incremento inducido por el ejercicio en la síntesis de proteínas que puede persistir por hasta 72 h (Cuthbertson et al. 2006; Miller et al. 2005). facilita el proceso de remodelación del músculo esquelético que puede finalmente aumentar las ganancias inducidas por el entrenamiento en la masa corporal magra (Cermak et al. 2012). Además, trabajos recientes han demostrado que la ingesta de proteínas también puede aumentar las tasas de síntesis de proteínas musculares después de ejercicios de resistencia prolongados de alta carga (Breen et al. 2011; Howarth et al. 2009; Levenhagen et al. 2002; Lunn et al. 2012) (ver Tabla 1). Por consiguiente, independientemente de la modalidad de ejercicio, las pautas nutricionales generales para mejorar la recuperación del ejercicio, recomiendan la ingesta de proteínas para maximizar las tasas de síntesis de proteínas musculares post ejercicio (Phillips y van Loon 2011). En relación a esto, investigaciones recientes han aportado información específica relacionada a las estrategias nutricionales más eficaces para mejorar la remodelación de proteínas musculares después del ejercicio y han determinado que la cantidad, tipo y momento de ingesta de las proteínas pueden afectar el nivel y la magnitud de la remodelación del músculo esquelético post ejercicio (Figura 1); este tema de la ingesta periodizada de proteínas será abordado posteriormente. Debido a la escasez de estudios que hayan evaluado directamente los factores relacionados con la ingesta de proteínas dietéticas después de los ejercicios de resistencia, nuestra discusión se centrará en los resultados de la bibliografía sobre el entrenamiento de la fuerza y, en los casos en que sea apropiado, los contrastaremos con las demandas de los atletas de resistencia
Cantidad de proteínas
Una de las consideraciones nutricionales más importantes que facilitan el aumento en las tasas de síntesis de proteínas musculares es la cantidad de proteína que se consume. Las tasas de síntesis de proteínas de músculos mixtos y proteínas de miofibrilares aumentan luego de los ejercicios de fuerza con pequeñas cantidades de proteínas (5-10 g) (Moore et al. 2009;Tang et al. 2007). pero se incrementan aún mas después de una mayor ingesta de alimentos con proteínas (20 g) (Moore et al. 2009; Witard et al. 2014). Las tasas de síntesis de proteínas musculares (MPS) alcanzan una meseta con la ingesta de alrededor de 20 g de proteínas y cantidades adicionales (hasta 40 g) no estimulan adicionalmente la síntesis de proteínas, al menos no estadísticamente (Moore et al. 2009; Witard et al. 2014). Por el contrario, en estas elevadas ingestas de proteínas se observa una mayor oxidación de aminoácidos y una mayor producción de urea (Moore et al. 2009; Witard et al. 2014). Aunque estos datos parecen robustos para atletas que tienen un equilibrio de energía, contamos con datos preliminares que sugieren que las necesidades de proteínas para producir síntesis de proteína musculares máximas podrían ser más altas (es decir, >20 g) para atletas que poseen un déficit de energía (Areta et al. 2014). Según nuestros conocimientos, ningún estudio ha determinado sistemáticamente las características de la dosis-respuesta de la ingesta de proteínas luego de ejercicios de resistencia. Sin embargo, la síntesis de proteínas del músculo puede incrementarse después de ejercicios de resistencia con una cantidad de proteínas tan pequeña como de 10 g (Levenhagen et al. 2002). con la ingesta repetida de pequeñas cantidades (10 g) de proteínas inmediatamente y 30 min después de una sola serie de ejercicio de resistencia lo que aumenta las tasas de síntesis de proteínas miofibrilares generadoras de fuerza (Breen et al. 2011). Es importante destacar que la ingesta de proteínas tiene un efecto pequeño en la capacidad de aumentar la tasa de síntesis de proteína mitocondriales post-ejercicio (Tabla 1). lo que contrasta con la capacidad del aporte exógeno de aminoácidos de estimular la maquinaria de la síntesis de proteínas en reposo (Bohe et al. 2003). Quizás la importancia del aporte de energía que sostiene la función y la supervivencia celular, y la dependencia de un suministro constante de ATP determinan que se priorice la síntesis de proteínas mitocondriales en el período post ejercicio con niveles bajos de aminoácidos suficientes para sostener la remodelación de esta vital organela (Moore y Stellingwerff 2012). No obstante, debido a que se han informado tasas máximas de síntesis de proteína musculares después de la ingesta de 20-25 g de proteína durante reposo y después de ejercicios de fuerza (Cuthbertson et al. 2005; Moore et al. 2009). parece prudente recomendar que también deberían consumirse cantidades similares después de ejercicios de resistencia para facilitar el remodelación muscular post ejercicio.
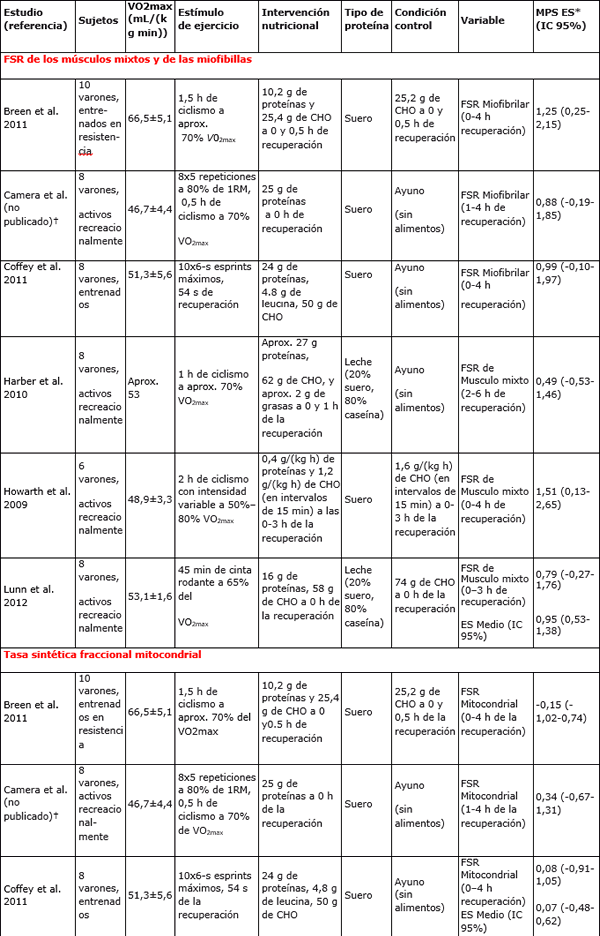
Tabla 1. Estudios que investigaron los efectos de la ingesta de proteína sobre la síntesis de proteínas musculares después de ejercicios de resistencia o de ejercicios de esprints de alta intensidad.
Nota: 1RM=Una repetición máxima; IC= Intervalo de confianza; CHO= Carbohidratos; FSR= Tasa sintética fraccional; VO2max = Capacidad aeróbica máxima.
* MPS ES: tamaño del efecto de la síntesis de proteínas musculares de la ingesta de proteínas en relación a la condición Control
†D.M Cámara, D.W.D. West, S.M. Phillips, T. Rerecich, T. Stellingwerff, J.A. Hawley, y V.G. Coffey. Trabajo no publicado.
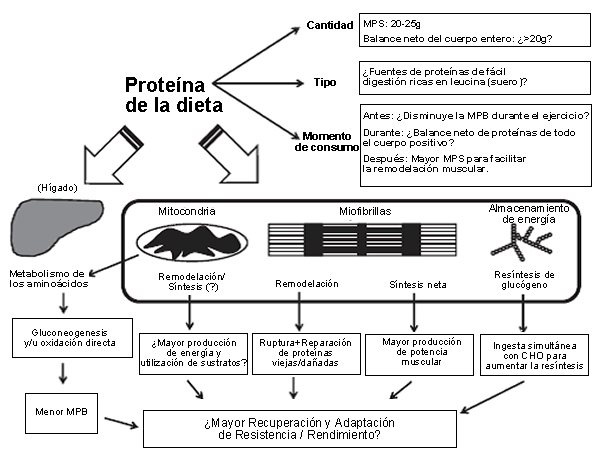
Figura 1. Apreciación global de los efectos potenciales de la ingesta de proteína para favorecer la recuperación frente a ejercicios de resistencia como un medio para mejorar la capacidad y el rendimiento de resistencia. Los mecanismos potenciales incluyen (i) oxidación de aminoácidos para que sean utilizados en la gluconeogenesis hepática y/o en la desaminación, o como fuente de combustible por parte de las mitocondrias del músculo esquelético; (ii) aumentos en la síntesis de proteínas mitocondriales para aumentar el metabolismo y la utilización de sustratos; (iii) promoción de remodelación miofibrilar para mantener la calidad y el funcionamiento de las proteínas musculares eliminando las proteínas viejas o dañadas; (iv) estimulación de la síntesis de proteínas miofibrilares neta para permitir un mayor rendimiento de fuerza/potencia muscular; y (v) promoción de resíntesis de glucógeno cuando son ingeridas junto con los carbohidratos (CHO). La capacidad de la ingesta de proteína para modular tales señales adaptativas puede ser influenciada por factores periféricos tales como momento de consumo, la cantidad y el tipo de ingesta de proteínas. MPB= degradación de proteínas musculares; MPS= síntesis de proteínas del musculo; ?=especulativo/debería ser investigado con mas detalle.
Actualmente no se sabe con certeza si el ejercicio de duración más larga (es decir, mayor a 2 h) incrementa aún mas las necesidades agudas de proteínas a nivel del cuerpo entero. Sin embargo, dado que durante el ejercicio de resistencia prolongado se produce una oxidación significativa de aminoácidos (sobre todo leucina). esto sería probable. Además, las series de ejercicios de resistencia de alta intensidad provocan una redistribución del gasto cardíaco y un desvío de sangre del sistema digestivo lo que provoca un pequeño daño en el intestino mediado por la hipoxia (van Wijck et al. 2011). Tales efectos probablemente se verán exacerbados con las series de ejercicios de mayor duración, particularmente las que se realizan en ambientes cálidos/húmedos o con baja concentración de oxígeno. Finalmente, no se conoce cual sería el efecto neto de cualquier lesión intestinal inducida por el ejercicio ni tampoco el efecto que podría tener el aumento en el catabolismo de proteínas y en la oxidación de aminoácidos sobre los requisitos de proteínas agudos para la recuperación de las proteínas del cuerpo entero. Por ejemplo, en el estudio de Levenhagen et al (2002). 10 g de proteína dietética fueron suficientes para mejorar la síntesis de proteínas musculares e inducir un balance neto positivo de proteínas musculares después de sólo 60 min de ejercicio de intensidad moderada, pero no lograron inducir un balance positivo de proteínas en el cuerpo entero. Esto es similar a lo observado por Lunn et al. (2012) quiénes demostraron que la ingesta de 500 mL de leche chocolatada (aprox.16 g de proteína) aumentó la síntesis de proteínas en el músculo mixto a pesar de que el balance de proteínas de todo el cuerpo fue negativo. En conjunto, estos resultados sugieren que los aminoácidos dietéticos se utilizan preferencialmente para apoyar mayores tasas de MPS en el período inmediato post-ejercicio, y que la remodelación de proteínas en todo el cuerpo (incluso del intestino) se produce como un proceso secundario. Por consiguiente, en la actualidad se desconoce si para recuperar rápida y completamente el balance de proteínas del cuerpo entero después de realizar ejercicios de resistencia se necesitará una cantidad ligeramente mayor de proteínas, o si tal vez será necesario un número mayor de ingestas repetidas de alimentos.
MOMENTO EN QUE DEBEN INGERIRSE LAS PROTEÍNAS.
Antes y durante el ejercicio
Se ha demostrado que la ingesta de proteínas y de aminoácido antes de una serie de esprints repetidos permite mayores tasas de síntesis de proteínas miofibrilares post ejercicio (Coffey et al. 2011). algo que generalmente coincide con los resultados de estudios que utilizaron un estímulo de ejercicios de fuerza (Tipton et al. 2007). Estos resultados sugieren que la recuperación a partir de un ejercicio de resistencia de alta intensidad relativamente corto puede ser mejorada mediante la ingesta de proteínas antes del ejercicio. Sin embargo, el ejercicio de resistencia prolongado estimula una mayor oxidación de aminoácidos (sobre todo de los aminoácidos de cadena ramificada) como fuente de combustible alternativa y puede deprimir las tasas normales de síntesis de proteínas como una manera de priorizar las reservas de energía muscular frente a la falta de energía, en vez destinarlas a la síntesis de proteínas que es un proceso con un elevado costo energético (Rose y Richter 2009). Por lo tanto, el período de ejercicio representa un ambiente catabólico neto, que puede producir la destrucción de proteínas del músculo esquelético y una salida neta de nitrógeno aminado del músculo (Howarthet. 2010; van Hall et al. 1999). Los atletas de resistencia que realizan series de entrenamiento prolongadas (es decir >1 h) o aquellos atletas que entrenan varias veces al día (no siempre con las reservas de glucógeno completas) podrían estar sometiendo a sus músculos a períodos prolongados de catabolismo neto, y en la actualidad no se sabe cuales serían las consecuencias sobre la mejora óptima de la síntesis de proteínas musculares y sobre el balance de las proteínas de todo el cuerpo y musculares durante el período de recuperación post-ejercicio.
Koopman y colegas (2004) fueron los primeros en demostrar que la ingesta conjunta de proteínas y CHO durante ejercicios de resistencia prolongados en atletas entrenados provocaba una mayor oxidación de proteínas del cuerpo entero que la que producían los CHO solos. En ese momento se sugirió que la mayor oxidación reflejaba un mayor uso de los aminoácidos de la dieta en comparación con los aminoácidos del cuerpo como fuente de combustible, lo que finalmente producía un balance de proteínas de cuerpo entero neto mas positivo durante el ejercicio (Koopman et al. 2004). Con respecto a los efectos locales dentro del músculo, la ingesta simultánea de proteínas y CHO atenuaría el típico aumento inducido por el ejercicio en la degradación de proteínas lo que se refleja en una disminución en la liberación de aminoácidos del músculo y en un posterior balance de proteínas musculares neto menos negativo durante el ejercicio (Hulston et al. 2011). En conjunto, estos datos sugieren que los atletas que realizan entrenamiento extenuante prolongado podrían beneficiarse de la ingesta conjunta de proteínas en su plan de nutrición diario para limitar el ambiente catabólico de ejercicio, lo que finalmente los colocaría en una mejor posición nutricional durante el período de recuperación post-ejercicio. Por otra parte, la ingesta de proteínas durante el ejercicio puede tener un valor ergogénico limitado (Betts y Williams 2010; Saunders 2007). Por consiguiente, se necesitan investigaciones adicionales para poder establecer la ventaja potencial que tendría un catabolismo atenuado de proteínas endógenas (ya sea de las reservas musculares o de todo el cuerpo) para mantener las metas de entrenamiento a largo plazo que dependen de la remodelación del tejido del músculo esquelético.
Recuperación inmediata (<3 h) post-ejercicio
En concordancia con los informado en la literatura sobre ejercicios de fuerza (Burd et al. 2009). la ingesta de proteínas dietéticas después de los ejercicios de resistencia aumenta la síntesis de proteína muscular post-ejercicio, posiblemente como una forma de facilitar la remodelación del músculo y permitir el proceso de recuperación (Breen et al. 2011; Howarth et al. 2009; Levenhagen et al. 2002; Lunn et al. 2012). Esto se puede evidenciar a través de los tamaños de efecto moderados a grandes en la síntesis de proteínas mixtas y miofibrilares (pero no mitocondriales) después de la ingesta de proteínas en comparación con la ingesta de CHO solos (Tabla 1). En contraste con la relativamente prolongada (es decir, ≥24 h) sensibilidad del músculo esquelético a los aminoácidos dietéticos inducida por una serie de ejercicio de fuerza (Burd et al. 2011). el período de recuperación post ejercicio inmediato puede ser relativamente importante para aumentar la síntesis de proteínas del músculo y el balance neto de proteínas después de ejercicios de resistencia en comparación con ejercicios de fuerza. Por ejemplo, retrasar 3 horas la ingesta de 10 g de proteína de leche atenúa notablemente los efectos anabólicos de la proteína dietética y no aumenta la síntesis de proteínas del músculo mixto post-ejercicio (Levenhagen et al. 2001). Es más, la ingesta de proteínas después del entrenamiento puede ser especialmente importante para atletas que consumen crónicamente dietas ricas en proteínas (es decir, >1,8 g/(kg·día)). porque se ha observado que las tasas de síntesis de proteínas de los músculos mixtos post-ejercicio en estado de ayuno están suprimidas en relación a las dietas con un contenido mas bajo de proteínas (Bolster et al. 2005). Esta menor respuesta de síntesis de proteínas después del ejercicio en el estado de ayuno, puede ser secundaria a una estimulación de la capacidad de oxidación de aminoácidos que posteriormente puede producir una menor disponibilidad intracelular de aminoácidos disponibles para la reparación y remodelación de tejido muscular, en ausencia de una fuente dietética exógena (Bolster et al. 2005; Gaine et al. 2007). Por consiguiente, si bien se necesitan estudios adicionales para evaluar la importancia del momento en el que se consumen las proteínas después del ejercicio de resistencia, sobre la base de la evidencia actual de una atenuación de la síntesis de proteínas cuando la alimentación se retrasa varias horas (Levenhagen et al. 2001). es necesario recomendar la ingesta de proteínas dietéticas en los primeros 30-60 min después del ejercicio de resistencia para maximizar las tasas de síntesis de proteínas del músculo esquelético y favorecer la recuperación.
Recuperación prolongada (>3 h) post-ejercicio
Además del período de recuperación inmediato post-ejercicio (es decir, <3 h). recientemente nosotros determinamos cómo el hecho de alimentarse durante un período de recuperación prolongado (12 h) post-ejercicio puede apoyar aún mas la remodelación del músculo. Después de una sola serie de ejercicios de fuerza, realizada por la mañana, observamos que la tasa de síntesis de proteínas miofibrilares y el balance neto de proteínas de todo el cuerpo eran mayores durante 12 h de un día cuando los atletas consumían 20g de proteínas cada 4 h en comparación con cantidades isoenergéticas proporcionadas como 2 x 40 g cada 6 h (típico de un abordaje con 3 comidas ) o varias porciones pequeñas de 8 x 10 g cada 1,5 h (típico de un patrón de alimentación de "picoteo") (Areta et al. 2013; Moore et al. 2012). Estos datos demuestran claramente que los importante para la remodelación del músculo crónica, no sólo es la cantidad de proteínas que un atleta consume si no que también el patrón de ingesta de estas proteínas. Dada la importancia de la proteína dietética para aumentar la síntesis de proteínas del músculo después del ejercicio de resistencia (Tabla 1). es probable que los atletas que entrenan y compiten en estas actividades también se beneficien de una ingesta diaria equilibrada de proteínas (es decir, porciones de alimentos repetidas de aprox. 20 g de proteínas cada 3-4 h) para maximizar su recuperación post-ejercicio. De hecho, dado que los pequeños bocadillos con 10g de proteínas tendrían poco efecto para mejorar las tasas de síntesis de proteínas del músculo y el balance neto de proteínas 3 h después de ejercicios de resistencia (Levenhagen et al. 2001). la ingesta equilibrada de proteínas necesarias (es decir, varios bocadillos de 20 g) puede ser aun más importante para sostener tasas máximas de remodelación de proteínas musculares en atletas de resistencia. Este patrón de aporte de alimentos para mantener tasas diarias de remodelación de proteínas musculares, probablemente también sería beneficioso para aquellos atletas que tienen un balance de energía negativo y para aquellos atletas que desean conservar la masa magra mientras pierden masa grasa, tal como se ha sugerido con otros atletas durante los períodos de pérdida de peso (Iwao et al. 1996).
Tipo de proteínas
Las proteínas dietéticas difieren en su composición de aminoácidos y en las tasas de digestión y absorción (es decir, la velocidad en que aparecen en la sangre los aminoácidos que las constituyen) (Boirie et al. 1997; Pennings et al. 2011, 2012). y además se ha informado que ambos aspectos tienen efectos mensurables en la capacidad de reforzar la síntesis de proteínas musculares post-ejercicio (Burd et al. 2009). Desde el punto de vista de calidad nutricional de la proteína, caracterizado por el criterio de referencia actual del Puntaje de Aminoácidos Corregido por Digestibilidad Proteica (PDCAAS; para una mayor explicación sobre la definición y las limitaciones de este índice, ver Schaafsma 2000). las proteínas que normalmente se recomiendan para atletas como las proteínas del suero de leche y la caseína y las proteínas derivadas de la soja, son todas consideradas proteínas de “alta calidad" (es decir, PDCAAS >1). Sin embargo, dado que la síntesis de proteína muscular está regulada principalmente por el contenido de EAA de una proteína (Tipton et al. 1999a, 1999b). es evidente que las sutilezas de las características de las proteínas de la dieta pueden producir diferencias en su capacidad de mantener tasas máximas de MPS después del ejercicio y de permitir las adaptaciones al entrenamiento posteriores (Phillips et al. 2009). Por ejemplo, en comparación con las fuentes de proteínas derivadas de la caseína y de la soja, las proteínas derivadas del suero tienen características anabólicas particulares que provocan una mayor estimulación de la síntesis de proteínas musculares inducida por el alimento: esta premisa es cierta cuando se ingieren tanto en reposo como después del ejercicio de fuerza (Tang et al. 2009). aunque también se ha observado que las mezclas de éstas fuentes proteicas pueden apoyar la síntesis de proteínas musculares post-ejercicio (Reidy et al. 2013). Por otra parte, un cuerpo creciente de evidencia postula que el aminoácido esencial leucina sería un mediador probable de esta mayor respuesta anabólica que se produce con las proteínas del suero debido a su capacidad de "encender” la maquinaria de señalización celular que controla la síntesis de proteínas y sirve como sustrato para la síntesis de proteínas (Drummond et al. 2008; Phillips y van Loon 2011). Mas aún, independientemente de su perfil de aminoácidos, la velocidad en que una proteína se digiere y su capacidad de inducir aminoacidemia y leucinemia rápidas podrían modular la magnitud de la remodelación muscular, tal como se puede evidenciar por el mayor estímulo de síntesis de proteínas miofibrilares después de ejercicios de fuerza con la ingesta de 25g de proteínas de suero en forma de un solo bolo, en comparación con una cantidad equivalente de proteínas de suero ingeridas en forma de varias porciones pequeñas repetidas (West et al.. 2011). Estos mayores efectos estimuladores de la aminoacidemia rápida deben ser considerados en el caso de atletas que desean aumentar rápidamente la síntesis de proteínas musculares después de una serie de ejercicios, ya que los alimentos completos con fuentes proteicas en forma líquida se digieren más rápidamente que las formas sólidas (Burke et al. 2012). Por consiguiente, aunque en la actualidad carecemos de estudios que comparen directamente las diferentes fuentes de proteínas durante la recuperación de ejercicios de resistencia, los atletas que deseen mejorar la síntesis de proteínas musculares durante el proceso de recuperación temprano podrán alcanzar su meta rápidamente ingiriendo fuentes de proteínas de fácil digestión y con gran contenido de leucina tales como el suero (Breen et al. 2011).
Entrenamiento Concurrente
No es raro que los atletas que entrenan para deportes de resistencia realicen entrenamiento de la fuerza para aumentar específicamente la fuerza, la potencia y la resistencia a la fatiga de los músculos (Aagaard y Andersen 2010). A la inversa, los atletas de la mayoría de los deportes de equipo a menudo tienen demandas fisiológicas que requieren una combinación de fuerza, elevada proporción de masa magra y una mayor capacidad de resistencia y (o) capacidad sprint/potencia para tener éxito en sus disciplinas (Bishop et al. 2011). Así, muchos atletas de una variedad de deportes realizan entrenamiento concurrente, en el cual realizan entrenamiento de la fuerza y entrenamiento de la resistencia en una sola sesión o en sesiones separadas en el mismo día.
Estudios preliminares clásicos que investigaron las respuestas de adaptación al entrenamiento concurrente demostraron claramente una "interferencia" en las adaptaciones al entrenamiento cuando se combinaron entrenamiento para la fuerza y entrenamiento para la resistencia en comparación a cuando estos entrenamientos se realizaban por separado (Dudley y Djamil 1985; Hickson 1980). Los potenciales mecanismos moleculares que explican esta atenuación en las adaptaciones anabólicas/fuerza con el entrenamiento concurrente, se han centrado en las alteraciones en la disponibilidad de glucógeno muscular y (o) en la activación del sensor de energía celular AMP quinasa (AMPK) (Hawley 2009). Sin embargo, nosotros hemos observado un efecto pequeño del AMPK sobre la señalización celular anabólica y sobre las tasas de síntesis de proteínas miofibrilares tanto en estado de ayuno (ingesta de placebo) como en estado alimentado (2 bebidas a las 0 y 2 h de recuperación que contenían 20 g de suero y 40 g de CHO cada uno) cuando los sujetos entrenados comenzaban una sola serie de ejercicios de fuerza extenuantes (8 × 5 repeticiones a 80% 1 RM) con bajo contenido de glucógeno muscular (50% del nivel de descanso en estado alimentados) (Camera et al. 2012). Todavía no se ha podido establecer en el musculo humano in vivo una relación causal para una menor disponibilidad de glucógeno o una atenuación mediada por AMPK de la señalización mTORC1 en un esquema de entrenamiento concurrente.
Hasta la fecha pocas investigaciones han examinado el efecto de la ingesta de proteínas en el contexto del entrenamiento concurrente. Recientemente observamos que luego de ejercicios simultáneos para la fuerza y la resistencia, la tasa de síntesis de proteínas miofibrilares pero no la de proteínas de mitocondriales aumentaba cuando se ingerían 25g de proteína de suero (comparada con un placebo no energético) (Camera et al., Tabla 1). Así, la ingesta de proteínas puede reducir el efecto de la interferencia potencial del ejercicio de resistencia en la hipertrofia del músculo esquelético con el entrenamiento concurrente crónico. Aunque existe muy poca información con respecto a los efectos de la ingesta de proteínas para aumentar las adaptaciones inducidas por el entrenamiento de la resistencia (ej., síntesis de proteínas mitocondriales contra síntesis de proteínas miofibrilares) después del entrenamiento concurrente, se ha observado que las proteínas del suero pueden mantener las tasas de síntesis de proteínas mitocondriales luego del entrenamiento concurrente (Donges et al. 2012). Sin embargo, dado que en dicho estudio no se consideró un placebo libre de proteínas (Donges et al. 2012). no se puede saber con certeza si las tasas de síntesis de proteínas mitocondriales aumentaron efectivamente por la ingesta de proteínas, o si simplemente aumentaron por el propio estímulo de ejercicio, algo similar a lo observado en informes previos después de la realización de ejercicios de resistencia (Breen et al. 2011; Coffey et al. 2011; Wilkinson et al. 2008). Por lo tanto la ingesta de proteínas representa una manera práctica para aumentar las adaptaciones anabólicas con el ejercicio concurrente. Ciertamente el aumento en la disponibilidad de proteínas en estas situaciones no provocará una disminución en las respuestas de adaptación, aunque claramente ésta es un área fecunda para las futuras investigaciones. Sobre la base de la capacidad de la ingesta de proteínas post-ejercicio de apoyar mayores tasas de síntesis de proteínas musculares, después de una variedad de ejercicios y en ausencia de cualquier evidencia creíble en contra, parece prudente recomendar que los atletas que realizan entrenamientos concurrentes sigan recomendaciones sobre la ingesta de proteínas similares a las de los atletas que entrenan solamente para deportes de fuerza y potencia.
BENEFICIOS DE LA INGESTA DE PROTEÍNAS QUE VAN MÁS ALLÁ DE LA SÍNTESIS DE PROTEÍNAS DE MUSCULARES
Síntesis de Glucógeno
Tal como mencionamos previamente, los CHO son un combustible importante para el metabolismo oxidativo tanto durante sesiones de entrenamiento con esprints repetidos como durante entrenamientos prolongados de menor intensidad. En estas situaciones, y en ausencia de una ingesta de CHO exógena, el glucógeno muscular y hepático son las fuentes principales de combustible para permitir la oxidación de CHO. Aún cuando sean ingeridos en una elevada proporción (>1 g/min). durante los ejercicios de resistencia submáximos, la oxidación de glucosa sanguínea no puede ser la única fuente de CHO para los músculos activos (Coyle et al. 1986). Debido a que las reservas endógenas de CHO están limitadas a 400-600g de glucógeno (dependiendo de la masa corporal y del estado nutricional de los atletas). la recuperación del glucógeno muscular y hepático es una consideración importante para los atletas de resistencia. Luego de ejercicios de resistencia prolongados, el glucógeno muscular generalmente se recupera hasta los niveles pre-ejercicio en un lapso de 24 h (Burke et al. 1995; Costill et al. 1981) siempre y cuando se ingiera una cantidad adecuada de carbohidratos luego de los ejercicios (es decir, aprox. 1,2 g/(kg día)) (Burke et al. 2011). Sin embargo, para atletas que no tienen un acceso adecuado a CHO y/o que tiene una ventana pequeña de oportunidad para recuperar los combustibles (es decir, múltiple sesiones de entrenamiento y/o competencias en un mismo día, se han explorado estrategias alternativas de alimentación para aumentar las tasas de resíntesis de glucógeno. Una metodología ha sido aumentar las estrategias habituales de recuperación de CHO con cantidades pequeñas de proteínas como un medio para promover tasas rápidas de resíntesis de glucógeno muscular y mantener el rendimiento físico subsiguiente (Beelen et al. 2010).
Se ha sugerido que el incremento en la respuesta de la insulina que se observa con la ingesta simultánea de proteínas y CHO puede aumentar el consumo de glucosa en el músculo a través de la estimulación de transportadores de glucosa, lo que finalmente se traduciría en una mayor tasa de resíntesis de glucógeno muscular (van Loon et al. 2000a, 2000b). De hecho, se ha observado que el consumo de glucosa en las piernas es 3,5 veces superior luego de la ingesta conjunta de proteínas y carbohidratos en comparación a la ingesta de CHO solos (Levenhagen et al. 2002). Sin embargo, los estudios que han demostrado que la ingesta simultánea de proteínas con carbohidratos aumenta la síntesis de glucógeno muscular durante la recuperación han utilizado estrategias de alimentación con ingestas de carbohidratos que son sub optimas (<0.8 g/(kg h)) para las tasas máximas de síntesis de glucógeno (van Loon et al. 2000a; Zawadzki et al. 1992). De hecho, la ingesta simultánea de proteínas y CHO no parece aumentar la tasa de síntesis de glucógeno muscular post-ejercicio cuando se consumen cantidades adecuadas de carbohidratos (1,2 g/(kg h)) (Burke et al. 2011; Jentjens et al. 2001). Por consiguiente, los atletas que buscan maximizar el almacenamiento de combustibles (es decir, resíntesis de glucógeno muscular y hepático) deben enfocarse en lograr una ingesta adecuada de CHO. No obstante, la ingesta conjunta de proteínas y CHO para recuperar las reservas de glucógeno muscular puede tener importancia práctica en situaciones en las que los CHO no puedan ser consumidos en un nivel óptimo (por ejemplo, dolor gastrointestinal, acceso inadecuado a CHO, etc.). Adicionalmente, los atletas que realizan múltiples sesiones de entrenamiento en un día con tiempos de recuperación limitados (por ejemplo, <4 h) podrían obtener beneficios de la ingesta simultánea de proteínas y CHO como un medio para optimizar las concentraciones de glucógeno muscular así como para aportar los aminoácidos necesarios para la reparación de las proteínas del músculo.
Función inmune
Se ha informado que los períodos de entrenamiento intenso pueden predisponer a los atletas a sufrir un riesgo mayor de desarrollar infecciones del tracto respiratorio superior (Gleeson 2007) que pueden afectar la calidad del entrenamiento y pueden alterar la capacidad para recuperarse de las enfermedades. Esta mayor susceptibilidad frente a las infecciones oportunistas puede relacionarse en parte con una menor actividad inmune caracterizada por una menor circulación de linfocitos T-CD8+ que reconocen los antígenos virales (Gleeson 2007; Witard et al. 2012). Por otra parte, se ha observado que una dieta con elevado contenido (3 g/(kg día)). pero no con un contenido moderado (1,5 g/(kg día)). de proteínas restaura la concentración circulante de estas importantes células inmunes hasta niveles que son comparables a los niveles observados con cargas de entrenamiento normales. Además, la ingesta de proteína mas elevada está asociada con una reducción en la incidencia de infecciones del tracto respiratorio superior informada por los atletas cuando realizan entrenamiento con cargas de alta intensidad (Witard et al. 2012, 2013). En estos estudios (Witard et al. 2012, 2013) el nivel de ingesta de CHO fue menor que el recomendado para períodos de entrenamiento de alta intensidad (es decir, aprox. 6 contra >8 g/(kg día). respectivamente) (Burke et al. 2011). lo que sugiere que en ausencia de una ingesta óptima de CHO, la ingesta de proteínas puede mejorar los marcadores de la respuesta inmune (Nieman 1998) y ayudar a mitigar el riesgo de desarrollar infecciones respiratorias del tracto superior en atletas. Es necesario que se realicen trabajos en el futuro para confirmar estos resultados positivos iniciales y determinar su importancia clínica para mantener la salud del atleta.
Perspectivas futuras
Hay una estrecha vinculación entre la suplementación de proteínas a través de la dieta y el crecimiento muscular. Esto surge como producto de una cultura del entrenamiento de la fuerza que promueve el uso de suplementos de proteínas y de investigaciones que inequívocamente apoyan la mayor disponibilidad de proteínas para aumentar la síntesis y remodelación de las proteínas musculares post-ejercicio (Burd et al. 2009). Además, un reciente meta-análisis demostró que la suplementación con proteínas dietéticas está asociada con mayores ganancias inducidas por el entrenamiento en el crecimiento de la masa magra y en el aumento de la fuerza (Cermak et al. 2012).
Por otra parte, nuestros conocimientos actuales sobre el resultado funcional de aumentar la síntesis de proteínas musculares durante la recuperación de ejercicios de resistencia son escasos: solo recientemente se ha cuestionado científicamente el papel que tienen las proteínas dietéticas en el apoyo de una mayor remodelación del músculo esquelético. Por consiguiente, es necesario responder preguntas fundamentales de cómo la ingesta óptima de proteínas (es decir, cantidad, tipo, momento de consumo) durante y después de los ejercicios de resistencia puede mejorar la recuperación muscular y la posterior adaptación al entrenamiento. Por ejemplo, aunque las proteínas pueden aumentar la síntesis de proteínas musculares después de los ejercicios de resistencia, sobre todo de las proteínas miofibrilares generadoras de fuerza (Tabla 1). no está claro si esta mayor síntesis de proteínas puede traducirse en una mayor masa y/o potencia muscular durante un período de semanas a meses; tales adaptaciones podrían ser consideradas como beneficiosas para atletas de resistencia que realizan deportes sin traslado de peso como el ciclismo, en los cuales el éxito generalmente está relacionado con la capacidad de mantener elevadas producciones de potencia (Hawley y Noakes 1992). En contraste, a pesar de la ausencia de estimulación de la síntesis de proteínas mitocondriales con una ingesta fisiológica de proteínas (i.e., 20 g). varios estudios crónicos (es decir, 4-6 semanas) han observado una mayor capacidad aeróbica después del entrenamiento con la ingesta de proteínas post-ejercicio en sujetos jóvenes (Ferguson-Stegall et al. 2011) y en adultos mayores (Robinson el al del et. 2011). Es necesario confirmar estos resultados en atletas de resistencia altamente entrenados para poder establecer los mecanismos potenciales que se ponen en juego para estas adaptaciones a los ejercicios mediadas por los nutrientes. Finalmente, aunque la ingesta moderada de proteínas (es decir, 20 g) tendría un efecto pequeño en el aumento de la síntesis de proteínas mitocondriales post ejercicio (Breen et al. 2011). se ha observado que la suplementación con aminoácidos de cadena ramificada (i.e. equivalente a aprox.10 g/día) aumenta la biogénesis mitocondrial y la capacidad aeróbica en ratones (D’Antona et al. 2010). Es necesario establecer si en seres humanos se pueden obtener resultados similares. La evidencia preliminar sugiere que el consumo de alimentos con elevado contenido de proteínas (i.e., aprox. 64g durante 3 h, un nivel que supera los requerimientos para aumentar la síntesis de proteínas musculares) durante la recuperación frente a ejercicios de resistencia de alta intensidad, puede favorecer la expresión génica de un perfil que estimule las vías metabólicas energéticas de la célula (Rowlands et al. 2011). Por consiguiente, se necesitan estudios futuros que puedan establecer el efecto de maximizar la síntesis de proteínas musculares y los efectos subsiguientes sobre los perfiles con expresión génica alterada a través de una ingesta óptima de proteínas, y los cambios que se producirían en la masa muscular, calidad muscular, y (o) rendimiento deportivo con períodos prolongados de suplementación (i.e. entrenamiento). Adicionalmente, es necesario evaluar sistemáticamente la importancia de la adecuada suplementación con proteínas durante los períodos de déficit de energía (en comparación con el balance energético) dados los potenciales beneficios ergogénicos (por ejemplo, menor dolor muscular, mayor rendimiento físico) que se pueden obtener con el aporte periodizado de proteínas durante este estado nutricional comprometido (Pasiakos et al. 2014).
CONCLUSIÓN
La idea que la mayoría de los atletas tiene, es que las proteínas de la dieta son para construir músculo (es decir, hipertrofia). Aunque una gran cantidad de investigaciones apoyan esta visión “centrada en la hipertrofia”, las investigaciones recientes destacan el papel fundamental que tienen las proteínas de la dieta en la recuperación frente a los ejercicios de resistencia. En esta población, se ha observado que además de los elevados requisitos de proteínas, la ingesta periodizada de proteínas aumenta la remodelación muscular y las proteínas de todo el cuerpo con el entrenamiento de resistencia. Esta remodelación de las proteínas que está principalmente determinada por cambios en la síntesis de proteínas musculares, es un aspecto importante del proceso de recuperación aguda después del ejercicio y finalmente permite las adaptaciones (por ejemplo, mayor potencia muscular, mayor capacidad aeróbica) que se logran con el entrenamiento de resistencia. Si bien es necesario que se realicen investigaciones futuras para poder establecer cuales serían las estrategias de ingesta de proteínas más eficaces para mantener y promover las adaptaciones al entrenamiento de resistencia, el hecho que las proteínas de la dieta aporten los ladrillos necesarios para la síntesis de proteínas musculares, hace que este macronutriente sea un componente vital, aunque algo subestimado, del andamiaje nutricional de un atleta de resistencia.
REFERENCIAS
1. Aagaard, P., and Andersen, J.L. (2010). Effects of strength training on endurance capacity in top-level endurance athletes. Scand. J. Med. Sci. Sports, 20(Suppl.): 239-247. doi:10.1111/j.l600-0838.2010.01197.x. PMID:20840561.
2. Areta, J.L., Burke, L.M., Camera, D.M., West, D.W., Crawshay, S., Moore, D.R., et al. (2014). Reduced resting skeletal muscle protein synthesis is rescued by resistance exercise and protein ingestions following short-term energy deficit. Am. J. Physiol. Endocrinol. Metab. 306(8): E989-E997. doi:10.1152/ajpendo. 00590.2013. PMID:24595305.
3. Areta, J.L., Burke, L.M., Ross, M.L., Camera, D.M., West, D.W., Broad, E.M., et al. (2013). Timing and distribution of protein ingestión during prolonged recovery from resistance exercise alters myofibrillar protein synthesis. J. Physiol. 591(9): 2319-2331. doi:10.1113/jphysiol.2012.244897. PMID:23459753.
4. Beelen, M., Burke, L.M., Gibala, M.J., and van Loon, L.J. (2010). Nutritional strategies to promote postexercise recovery. Int. J. Sport Nutr. Exerc. Metab. 20(6): 515-532. PMID:21116024.
5. Benziane, B., Burton, T.J., Scanlan, B., Galuska, D., Canny, B.J., Chibalin, A.V., et al. (2008). Divergent cell signaling after short-term intensified endurance training in human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 295(6): E1427-E1438. doi:10.1152/ajpendo.90428.2008. PMID:18827172.
6. Betts, JA., and Williams, C. (2010). Short-term recovery from prolonged exercise: exploring the potential for protein ingestion to accentuate the benefits of carbohydrate supplements. Sports Med.40(11): 941–959. doi:10.2165/11536900-000000000-00000. PMID:20942510.
7. Bishop, D., Girard, O., and Mendez-Villanueva, A. (2011). Repeated-sprint ability – part II: recommendations for training. Sports Med. 41(9): 741–756. doi:10.2165/ 11590560-000000000-00000. PMID:21846163.
8. Bohe, J., Low, A., Wolfe, R.R., and Rennie, M.J. (2003). Human muscle protein synthesis is modulated by extracellular, not intramuscular amino acid avail-ability: a dose-response study. J. Physiol. 552(1): 315–324. doi:10.1113/jphysiol. 2003.050674. PMID:12909668.
9. Boirie, Y., Dangin, M., Gachon, P., Vasson, M.P., Maubois, J.L., and Beaufrere, B. (1997). Slow and fast dietary proteins differently modulate postprandial pro-tein accretion. Proc. Natl. Acad. Sci. U.S.A. 94(26): 14930–14935. doi:10.1073/ pnas.94.26.14930. PMID:9405716.
10. Bolster, D.R., Pikosky, M.A., Gaine, P.C., Martin, W., Wolfe, R.R., Tipton, K.D., et al. (2005). Dietary protein intake impacts human skeletal muscle protein fractional synthetic rates after endurance exercise. Am. J. Physiol. Endocri-nol. Metab. 289(4): E678–E683. doi:10.1152/ajpendo.00060.2005. PMID:15914508.
11. Bowtell, J.L., Leese, G.P., Smith, K., Watt, P.W., Nevill, A., Rooyackers, O., et al. (1998). Modulation of whole body protein metabolism, during and after exercise, by variation of dietary protein. J. Appl. Physiol. 85(5): 1744–1752. PMID: 9804577.
12. Bowtell, J.L., Leese, G.P., Smith, K., Watt, P.W., Nevill, A., Rooyackers, O., et al. (2000). Effect of oral glucose on leucine turnover in human subjects at rest and during exercise at two levels of dietary protein. J. Physiol. 525(1): 271–281. doi:10.1111/j.1469-7793.2000.00271.x. PMID:10811743.
13. Breen, L., Philp, A., Witard, O.C., Jackman, S.R., Selby, A., Smith, K., et al. (2011). The influence of carbohydrate-protein co-ingestion following endurance exercise on myofibrillar and mitochondrial protein synthesis. J. Physiol. 589(16): 4011–4025. doi:10.1113/jphysiol.2011.211888. PMID:21746787.
14. Burd, N.A., Tang, J.E., Moore, D.R., and Phillips, S.M. (2009). Exercise training and protein metabolism: influences of contraction, protein intake, and sex-based differences. J. Appl. Physiol. 106(5): 1692–1701. doi:10.1152/japplphysiol.91351. 2008. PMID:19036897.
15. Burd, N.A., West, D.W., Moore, D.R., Atherton, P.J., Staples, A.W., Prior, T., et al. (2011). Enhanced amino acid sensitivity of myofibrillar protein synthesis per-sists for up to 24 h after resistance exercise in young men. J. Nutr. 141(4): 568–573. doi:10.3945/jn.110.135038. PMID:21289204.
16. Burd, N.A., Hamer, H.M., Pennings, B., Pellikaan, W.F., Senden, J.M., Gijsen, A.P., and van Loon, L.J. (2013). Substantial differences between organ and muscle specific tracer incorporation rates in a lactating dairy cow. PLoS One, 8(6): e68109. doi:10.1371/journal.pone.0068109. PMID:23826365.
17. Burke, L.M., Collier, G.R., Beasley, S.K., Davis, P.G., Fricker, P.A., Heeley, P., et al. (1995). Effect of coingestion of fat and protein with carbohydrate feedings on muscle glycogen storage. J. Appl. Physiol. (1985). 78(6): 2187–2192. PMID: 7665416.
18. Burke, L.M., Kiens, B., and Ivy, J.L. (2004). Carbohydrates and fat for training and recovery. J. Sports Sci. 22(1): 15–30. doi:10.1080/0264041031000140527. PMID: 14971430.
19. Burke, L.M., Hawley, J.A., Wong, S.H., and Jeukendrup, A.E. (2011). Carbohydrates for training and competition. J. Sports Sci. 29(Suppl. 1): S17–S27. doi:10.1080/ 02640414.2011.585473. PMID:21660838.
20. Burke, L.M., Winter, J.A., Cameron-Smith, D., Enslen, M., Farnfield, M., and Decombaz, J. (2012). Effect of intake of different dietary protein sources on plasma amino Acid profiles at rest and after exercise. Int. J. Sport Nutr. Exerc. Metab. 22(6): 452–462. PMID:23212318.
21. Camera, D.M., Edge, J., Short, M.J., Hawley, J.A., and Coffey, V.G. (2010). Early time-course of Akt phosphorylation following endurance and resist-ance exercise. Med. Sci. Sports Exerc. 52(10): 1843–1852. doi:10.1249/MSS. 0b013e3181d964e4. PMID:20195183.
22. Camera, D.M., West, D.W., Burd, N.A., Phillips, S.M., Garnham, A.P., Hawley, J.A., and Coffey, V.G. (2012). Low muscle glycogen concentration does not suppress the anabolic response to resistance exercise. J. Appl. Physiol. (1985). 113(2): 206–214. doi:10.1152/japplphysiol.00395.2012. PMID:22628371.
23. Cermak, N.M., Res, P.T., de Groot, L.C., Saris, W.H., and van Loon, L.J. (2012). Protein supplementation augments the adaptive response of skeletal muscle to resistance-type exercise training: a meta-analysis. Am. J. Clin. Nutr. 96(6): 1454–1464. doi:10.3945/ajcn.112.037556. PMID:23134885.
24. Churchward-Venne, T.A., Burd, N.A., and Phillips, S.M. (2012). Nutritional regulation of muscle protein synthesis with resistance exercise: strategies to enhance anabolism. Nutr. Metab. (Lond.). 9(1): 40. doi:10.1186/1743-7075-9-40. PMID:22594765.
25. Coffey, V.G., Moore, D.R., Burd, N.A., Rerecich, T., Stellingwerff, T., Garnham, A.P., et al. (2011). Nutrient provision increases signalling and protein synthesis in human skeletal muscle after repeated sprints. Eur. J. Appl. Physiol. 111(7): 1473–1483. doi:10.1007/s00421-010-1768-0. PMID:21165642.
26. Costill, D.L., Sherman, W.M., Fink, W.J., Maresh, C., Witten, M., and Miller, J.M. (1981). The role of dietary carbohydrates in muscle glycogen resynthesis after strenuous running. Am. J. Clin. Nutr. 34(9): 1831–1836. PMID:7282610.
27. Coyle, E.F., Coggan, A.R., Hemmert, M.K., and Ivy, J.L. (1986). Muscle glycogen utilization during prolonged strenuous exercise when fed carbohydrate. J. Appl. Physiol. (1985). 61(1): 165–172. PMID:3525502.
28. Cuthbertson, D., Smith, K., Babraj, J., Leese, G., Waddell, T., Atherton, P., et al. (2005). Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB J. 19(3): 422–424. doi:10.1096/fj.04-2640fje. PMID: 15596483.
29. Cuthbertson, D.J., Babraj, J., Smith, K., Wilkes, E., Fedele, M.J., Esser, K., and Rennie, M. (2006). Anabolic signaling and protein synthesis in human skeletal muscle after dynamic shortening or lengthening exercise. Am. J. Physiol. Endocrinol. Metab. 290(4): E731–E738. doi:10.1152/ajpendo.00415.2005. PMID: 16263770.
30. D’Antona, G., Ragni, M., Cardile, A., Tedesco, L., Dossena, M., Bruttini, F., et al. (2010). Branched-chain amino acid supplementation promotes survival and supports cardiac and skeletal muscle mitochondrial biogenesis in middle-aged mice. Cell Metab. 12(4): 362–372. doi:10.1016/j.cmet.2010.08.016. PMID: 20889128.
31. Devlin, J.T., Brodsky, I., Scrimgeour, A., Fuller, S., and Bier, D.M. (1990). Amino acid metabolism after intense exercise. Am. J. Physiol. 258(2): E249–E255. PMID:2106267.
32. Dickinson, J.M., Fry, C.S., Drummond, M.J., Gundermann, D.M., Walker, D.K., Glynn, E.L., et al. (2011). Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids. J. Nutr. 14(5): 856–862. doi:10.3945/jn.111.139485. PMID: 21430254.
33. Donges, C.E., Burd, N.A., Duffield, R., Smith, G.C., West, D.W., Short, M.J., et al. (2012). Concurrent resistance and aerobic exercise stimulates both myofibrillar and mitochondrial protein synthesis in sedentary middle-aged men. J. Appl. Physiol. (1985). 112(12): 1992–2001. doi:10.1152/japplphysiol.00166. 2012. PMID:8175494.
34. Drummond, M.J., Fry, C.S., Glynn, E.L., Drever, H.C., Dhanani, S., Timmerman, K.L., et al. (2009). Rapamycin administration in humans blocks the contraction-induced increase in skeletal muscle protein synthesis. J. Physiol. 587(Pt.7): 1535–1546. doi:10.1113/jphysiol.2008. PMID:19188252.
35. Drummond, M.J., and Rasmussen, B.B. (2008). Leucine-enriched nutrients and the regulation of mammalian target of rapamycin signalling and human skeletal muscle protein synthesis. Curr. Opin. Nutr. Metab. Care. 11(3): 222–226. doi: 10.1097/MCO.0b013e3282fa17fb. PMID:18403916.
36. Dudley, G.A., and Djamil, R. (1985). Incompatibility of endurance- and strength-training modes of exercise. J. Appl. Physiol. (1985). 59(5): 1446–1451. PMID: 4066574.
37. Ferguson-Stegall, L., McCleave, E., Ding, Z., Doerner Iii, P.G., Liu, Y., Wang, B., et al. (2011). Aerobic exercise training adaptations are increased by postexercise carbohydrate-protein supplementation. J. Nutr. Metab. 2011: 623182. doi:10.1155/2011/623182. PMID:21773022.
38. Forslund, A.H., El-Khoury, A.E., Olsson, R.M., Sjodin, A.M., Hambraeus, L., and Young, V.R. (1999). Effect of protein intake and physical activity on 24-h pat-tern and rate of macronutrient utilization. Am. J. Physiol. 276(5): E964–E976. PMID:10329992.
39. Gaine, P.C., Pikosky, M.A., Bolster, D.R., Martin, W.F., Maresh, C.M., and Rodriguez, N.R. (2007). Postexercise whole-body protein turnover response to three levels of protein intake. Med. Sci. Sports Exerc. 39(3): 480–486. doi:10. 1249/mss.0b013e31802d0be4. PMID:17473774.
40. Gleeson, M. (2007). Immune function in sport and exercise. J. Appl. Physiol. (1985). 103(2): 693–699. doi:10.1152/japplphysiol.00008.2007. PMID:17303714.
41. Greenhaff, P.L., Karagounis, L.G., Peirce, N., Simpson, E.J., Hazell, M., Layfield, R., et al. (2008). Disassociation between the effects of amino acids and insulin on signaling, ubiquitin ligases, and protein turnover in human muscle. Am. J. Physiol. Endocrinol. Metab. 295(3): E595–E604. doi:10.1152/ajpendo.90411. 2008. PMID:18577697.
42. Haakonssen, E.C., Martin, D.T., Burke, L.M., and Jenkins, D.G. (2013). Increased lean mass with reduced fat mass in an elite female cyclist returning to com-petition: case study. Int. J. Sports Physiol. Perform. 8(6): 699–701. PMID: 23538431.
43. Haralambie, G., and Berg, A. (1976). Serum urea and amino nitrogen changes with exercise duration. Eur. J. Appl. Physiol. Occup. Physiol. 36(1): 39–48. doi:10. 1007/BF00421632. PMID:1001315.
44. Harber, M.P., Konopka, A.R., Jemiolo, B., Trappe, S.W., Trappe, T.A., and Reidy, P.T. (2010). Muscle protein synthesis and gene expression during recovery from aerobic exercise in the fasted and fed states. Am. J. Physiol. Regul. Integr. Comp. Physiol. 299(5): R1254–R1262. doi:10.1152/ajpregu.00348.2010. PMID:20720176.
45. Hawley, J.A. (2009). Molecular responses to strength and endurance training: are they incompatible? Appl. Physiol. Nutr. Metab. 34(3): 355–361. doi:10.1139/ H09-023. PMID:19448698.
46. Hawley, J.A., and Hopkins, W.G. (1995). Aerobic glycolytic and aerobic lipolytic power systems. A new paradigm with implications for endurance and ultraendurance events. Sports Med. 19(4): 240–250. doi:10.2165/00007256-199519040-00002. PMID:7604197.
47. Hawley, J.A., and Noakes, T.D. (1992). Peak power output predicts maximal oxygen uptake and performance time in trained cyclists. Eur. J. Appl. Physiol. Occup. Physiol. 65(1): 79–83. doi:10.1007/BF01466278. PMID:1505544.
48. Helms, E.R., Zinn, C., Rowlands, D.S., and Brown, S.R. (2013). A systematic review of dietary protein during caloric restriction in resistance trained lean athletes: a case for higher intakes. Int. J. Sport Nutr. Exerc. Metab. [Epub ahead of print.] PMID:24092765.
49. Hickson, R.C. (1980). Interference of strength development by simultaneously training for strength and endurance. Eur. J. Appl. Physiol. Occup. Physiol. 45(2–3): 255–263. doi:10.1007/BF00421333. PMID:7193134.
50. Howarth, K.R., Moreau, N.A., Phillips, S.M., and Gibala, M.J. (2009). Coingestion of protein with carbohydrate during recovery from endurance exercise stimulates skeletal muscle protein synthesis in humans. J. Appl. Physiol. 106(4): 1394–1402. doi:10.1152/japplphysiol.90333.2008. PMID:19036894.
51. Howarth, K.R., Phillips, S.M., Macdonald, M.J., Richards, D., Moreau, N.A., and Gibala, M.J. (2010). Effect of glycogen availability on human skeletal muscle protein turnover during exercise and recovery. J. Appl. Physiol. 109(2): 431– 438. doi:10.1152/japplphysiol.00108.2009. PMID:20489032.
52. Hulston, C.J., Wolsk, E., Grondahl, T.S., Yfanti, C., and van Hall, G. (2011). Protein intake does not increase vastus lateralis muscle protein synthesis during cycling. Med. Sci. Sports Exerc. 43(9): 1635–1642. doi:10.1249/MSS. 0b013e31821661ab. PMID:21364482.
53. Iwao, S., Mori, K., and Sato, Y. (1996). Effects of meal frequency on body compo-sition during weight control in boxers. Scand. J. Med. Sci. Sports, 6(5): 265– 272. doi:10.1111/j.1600-0838.1996.tb00469.x. PMID:8960647.
54. Jarvis, M., McNaughton, L., Seddon, A., and Thompson, D. (2002). The acute 1-week effects of the Zone diet on body composition, blood lipid levels, and performance in recreational endurance athletes. J. Strength Cond. Res. 16(1): 50–57. doi:10.1519/00124278-200202000-00009. PMID:11834107.
55. Jentjens, R.L., van Loon, L.J., Mann, C.H., Wagenmakers, A.J., and Jeukendrup, A.E. (2001). Addition of protein and amino acids to carbohydrates does not enhance postexercise muscle glycogen synthesis. J. Appl. Physiol. (1985). 91(2): 839–846. PMID:11457801.
56. Jeukendrup, A.E. (2011). Nutrition for endurance sports: marathon, triathlon, and road cycling. J. Sports Sci. 29(Suppl. 1): S91–S99. doi:10.1080/02640414.2011. 610348. PMID:21916794.
57. Josse, A.R., Atkinson, S.A., Tarnopolsky, M.A., and Phillips, S.M. (2011). Increased consumption of dairy foods and protein during diet- and exercise-induced weight loss promotes fat mass loss and lean mass gain in overweight and obese premenopausal women. J. Nutr. 141(9): 1626–1634. doi:10.3945/jn.111. 141028. PMID:21775530.
58. Koopman, R., Pannemans, D.L., Jeukendrup, A.E., Gijsen, A.P., Senden, J.M., Halliday, D., et al. (2004). Combined ingestion of protein and carbohydrate improves protein balance during ultra-endurance exercise. Am. J. Physiol. Endocrinol. Metab. 287(4): E712–E720. doi:10.1152/ajpendo.00543.2003. PMID: 15165999.
59. Lamont, L.S., McCullough, A.J., and Kalhan, S.C. (2001). Relationship between leucine oxidation and oxygen consumption during steady-state exercise. Med. Sci. Sports Exerc. 33(2): 237–241. doi:10.1097/00005768-200102000-00011. PMID:11224812.
60. Lemon, P.W., and Mullin, J.P. (1980). Effect of initial muscle glycogen levels on protein catabolism during exercise. J. Appl. Physiol. 48(4): 624–629. PMID: 7380688.
61. Levenhagen, D.K., Gresham, J.D., Carlson, M.G., Maron, D.J., Borel, M.J., and Flakoll, P.J. (2001). Postexercise nutrient intake timing in humans is critical to recovery of leg glucose and protein homeostasis. Am. J. Physiol. Endocrinol. Metab. 280(6): E982–E993. PMID:11350780.
62. Levenhagen, D.K., Carr, C., Carlson, M.G., Maron, D.J., Borel, M.J., and Flakoll, P.J. (2002). Postexercise protein intake enhances whole-body and leg protein accretion in humans. Med. Sci. Sports Exerc. 34(5): 828–837. doi:10.1097/ 00005768-200205000-00016. PMID:11984302.
63. Loucks, A.B. (2007). Low energy availability in the marathon and other endurance sports. Sports Med. 37(4–5): 348–352. doi:10.2165/00007256-200737040-00019. PMID:17465605.
64. Lunn, W.R., Pasiakos, S.M., Colletto, M.R., Karfonta, K.E., Carbone, J.W., Anderson, J.M., and Rodriguez, N.R. (2012). Chocolate milk and endurance exercise recovery: protein balance, glycogen, and performance. Med. Sci. Sports Exerc. 44(4): 682–691. doi:10.1249/MSS.0b013e3182364162. PMID: 21904247.
65. Macdermid, P.W., and Stannard, S.R. (2006). A whey-supplemented, high-protein diet versus a high-carbohydrate diet: effects on endurance cycling performance. Int. J. Sport Nutr. Exerc. Metab. 16(1): 65–77. PMID:16676704.
66. Mascher, H., Andersson, H., Nilsson, P.A., Ekblom, B., and Blomstrand, E. (2007). Changes in signalling pathways regulating protein synthesis in human mus-cle in the recovery period after endurance exercise. Acta Physiol. (Oxf.). 191(1): 67–75. doi:10.1111/j.1748-1716.2007.01712.x. PMID:17488244.
67. Mascher, H., Ekblom, B., Rooyackers, O., and Blomstrand, E. (2011). Enhanced rates of muscle protein synthesis and elevated mTOR signalling following endurance exercise in human subjects. Acta Physiol. (Oxf.). 202(2): 175–184. doi:10.1111/j.1748-1716.2011.02274.x. PMID:21385328.
68. McKenzie, S., Phillips, S.M., Carter, S.L., Lowther, S., Gibala, M.J., and Tarnopolsky, M.A. (2000). Endurance exercise training attenuates leucine oxidation and BCOAD activation during exercise in humans. Am. J. Physiol. Endocrinol. Metab. 278(4): E580–E587. PMID:10751189.
69. Mettler, S., Mitchell, N., and Tipton, K.D. (2010). Increased protein intake reduces lean body mass loss during weight loss in athletes. Med. Sci. Sports Exerc. 42(2): 326–337. doi:10.1249/MSS.0b013e3181b2ef8e. PMID:19927027.
70. Miller, B.F., Olesen, J.L., Hansen, M., Dossing, S., Crameri, R.M., Welling, R.J., et al. (2005). Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. J. Physiol. 567(3): 1021– 1033. doi:10.1113/jphysiol.2005.093690. PMID:16002437.
71. Moore, D.R., and Stellingwerff, T. (2012). Protein ingestion after endurance exercise: the ‘evolving’ needs of the mitochondria? J. Physiol. 590(8): 1785–1786. doi:10.1113/jphysiol.2011.224188. PMID:22532648.
72. Moore, D.R., Robinson, M.J., Fry, J.L., Tang, J.E., Glover, E.I., Wilkinson, S.B., et al. (2009). Ingested protein dose response of muscle and albumin protein synthe-sis after resistance exercise in young men. Am. J. Clin. Nutr. 89(1): 161–168. doi:10.3945/ajcn.2008.26401. PMID:19056590.
73. Moore, D.R., Areta, J., Coffey, V.G., Stellingwerff, T., Phillips, S.M., Burke, L.M., et al. (2012). Daytime pattern of post-exercise protein intake affects whole-body protein turnover in resistance-trained males. Nutr. Metab. (Lond.). 9(1): 91. doi:10.1186/1743-7075-9-91. PMID:23067428.
74. Murray, B. (2007). Hydration and physical performance. J. Am. Coll. Nutr. 26(5 Suppl.): 542S–548S. doi:10.1080/07315724.2007.10719656. PMID:17921463.
75. Nieman, D.C. (1998). Influence of carbohydrate on the immune response to intensive, prolonged exercise. Exerc. Immunol. Rev. 464–476. PMID:9644095.
76. Pasiakos, S.M., Cao, J.J., Margolis, L.M., Sauter, E.R., Whigham, L.D., McClung, J.P., et al. (2013). Effects of high-protein diets on fat-free mass and muscle protein synthesis following weight loss: a randomized controlled trial. FASEB J. 27(9): 3837–3847. doi:10.1096/fj.13-230227. PMID:23739654.
77. Pasiakos, S.M., Lieberman, H.R., and McLellan, T.M. (2014). Effects of protein supplements on muscle damage, soreness and recovery of muscle function and physical performance: a systematic review. Sports Med. doi:10.1007/ s40279-013-0137-7. PMID:24435468.
78. Pennings, B., Boirie, Y., Senden, J.M., Gijsen, A.P., Kuipers, H., and van Loon, L.J. (2011). Whey protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men. Am. J. Clin. Nutr. 93(5): 997–1005. doi:10.3945/ajcn.110.008102. PMID:21367943.
79. Pennings, B., Groen, B., de Lange, A., Gijsen, A.P., Zorenc, A.H., Senden, J.M., and van Loon, L.J. (2012). Amino acid absorption and subsequent muscle protein accretion following graded intakes of whey protein in elderly men. Am. J. Physiol. Endocrinol. Metab. 302(8): E992–E999. doi:10.1152/ajpendo.00517. 2011. PMID:22338070.
80. Phillips, S.M. (2006). Dietary protein for athletes: from requirements to metabolic advantage. Appl. Physiol. Nutr. Metab. 31(6): 647–654. doi:10.1139/h06-035. PMID:17213878.
81. Phillips, S.M., and van Loon, L.J. (2011). Dietary protein for athletes: From requirements to optimum adaptation. J. Sports Sci. 29(Suppl. 1): S29–S38. doi:10. 1080/02640414.2011.619204. PMID:22150425.
82. Phillips, S.M., Atkinson, S.A., Tarnopolsky, M.A., and MacDougall, J.D. (1993). Gender differences in leucine kinetics and nitrogen balance in endurance athletes. J. Appl. Physiol. 75(5): 2134–2141. PMID:8307870.
83. Phillips, S.M., Moore, D.R., and Tang, J.E. (2007). A critical examination of dietary protein requirements, benefits, and excesses in athletes. Int. J. Sport Nutr. Exerc. Metab. 17: S58–S76. PMID:18577776.
84. Phillips, S.M., Tang, J.E., and Moore, D.R. (2009). The role of milk- and soy-based protein in support of muscle protein synthesis and muscle protein accretion in young and elderly persons. J. Am. Coll. Nutr. 28(4): 343–354. doi:10.1080/ 07315724.2009.10718096. PMID:20368372.
85. Pikosky, M.A., Gaine, P.C., Martin, W.F., Grabarz, K.C., Ferrando, A.A., Wolfe, R.R., and Rodriguez, N.R. (2006). Aerobic exercise training increases skeletal muscle protein turnover in healthy adults at rest. J. Nutr. 136(2): 379–383. PMID:16424115.
86. Reidy, P.T., Walker, D.K., Dickinson, J.M., Gundermann, D.M., Drummond, M.J., Timmerman, K.L., et al. (2013). Protein blend ingestion following resistance exercise promotes human muscle protein synthesis. J. Nutr. 143(4): 410–416. doi:10.3945/jn.112.168021. PMID:23343671.
87. Rennie, M.J., Wackerhage, H., Spangenburg, E.E., and Booth, F.W. (2004). Control of the size of the human muscle mass. Annu. Rev. Physiol. 66: 799–828.
88. Robinson, M.M., Turner, S.M., Hellerstein, M.K., Hamilton, K.L., and Miller, B.F. (2011). Long-term synthesis rates of skeletal muscle DNA and protein are higher during aerobic training in older humans than in sedentary young subjects but are not altered by protein supplementation. FASEB J. 25(9): 3240–3249. doi:10.1096/fj.11-186437. PMID:21613572.
89. Rose, A.J., and Richter, E.A. (2009). Regulatory mechanisms of skeletal muscle protein turnover during exercise. J. Appl. Physiol. 106(5): 1702–1711. doi:10. 1152/japplphysiol.91375.2008. PMID:19074568.
90. Rowlands, D.S., Thomson, J.S., Timmons, B.W., Raymond, F., Fuerholz, A., Mansourian, R., et al. (2011). Transcriptome and translational signaling following endurance exercise in trained skeletal muscle: impact of dietary protein. Physiol. Genomics, 43(17): 1004–1020. doi:10.1152/physiolgenomics.00073. 2011. PMID:21730029.
91. Saunders, M.J. (2007). Coingestion of carbohydrate-protein during endurance exercise: influence on performance and recovery. Int. J. Sport Nutr. Exerc. Metab. 17(Suppl.): S87–S103. PMID:18577778.
92. Sawka, M.N., Burke, L.M., Eichner, E.R., Maughan, R.J., Montain, S.J., and Stachenfeld, N.S. (2007). American College of Sports Medicine position stand. Exercise and fluid replacement. Med. Sci. Sports Exerc. 39(2): 377–390. doi: 10.1249/mss.0b013e31802ca597. PMID:17277604.
93. Schaafsma, G. (2000). The protein digestibility-corrected amino acid score. J. Nutr. 130(7): 1865S–1867S. PMID:10867064.
94. Short, K.R., Vittone, J.L., Bigelow, M.L., Proctor, D.N., and Nair, K.S. (2004). Age and aerobic exercise training effects on whole body and muscle protein metabolism. Am. J. Physiol. Endocrinol. Metab. 286(1): E92–E101. doi:10.1152/ajpendo. 00366.2003. PMID:14506079.
95. Stepto, N.K., Carey, A.L., Staudacher, H.M., Cummings, N.K., Burke, L.M., and Hawley, J.A. (2002). Effect of short-term fat adaptation on high-intensity train-ing. Med. Sci. Sports Exerc. 34(3): 449–455. doi:10.1097/00005768-200203000-00011. PMID:11880809.
96. Tang, J.E., Manolakos, J.J., Kujbida, G.W., Lysecki, P.J., Moore, D.R., and Phillips, S.M. (2007). Minimal whey protein with carbohydrate stimulates muscle protein synthesis following resistance exercise in trained young men. Appl. Physiol. Nutr. Metab. 32(6): 1132–1138. doi:10.1139/H07-076. PMID: 18059587.
97. Tang, J.E., Moore, D.R., Kujbida, G.W., Tarnopolsky, M.A., and Phillips, S.M. (2009). Ingestion of whey hydrolysate, casein, or soy protein isolate: effects on mixed muscle protein synthesis at rest and following resistance exercise in young men. J. Appl. Physiol. 107(3): 987–992. doi:10.1152/japplphysiol.00076.2009. PMID:19589961.
98. Tarnopolsky, M. (2004). Protein requirements for endurance athletes. Nutrition, 20(7–8): 662–668. doi:10.1016/j.nut.2004.04.008. PMID:15212749.
99. Tarnopolsky, M.A., MacDougall, J.D., and Atkinson, S.A. (1988). Influence of pro-tein intake and training status on nitrogen balance and lean body mass. J. Appl. Physiol. 64(1): 187–193. PMID:3356636.
100. Tipton, K.D., and Witard, O.C. (2007). Protein requirements and recommenda-tions for athletes: relevance of ivory tower arguments for practical recom-mendations. Clin. Sports Med. 26(1): 17–36. doi:10.1016/j.csm.2006.11.003. PMID:17241913.
101. Tipton, K.D., Ferrando, A.A., Phillips, S.M., Doyle, D., Jr., and Wolfe, R.R. (1999a). Postexercise net protein synthesis in human muscle from orally adminis-tered amino acids. Am. J. Physiol. 276(4): E628–E634. PMID:10198297.
102. Tipton, K.D., Gurkin, B.E., Matin, S., and Wolfe, R.R. (1999b). Nonessential jamino acids are not necessary to stimulate net muscle protein synthesis in healthy volunteers. J. Nutr. Biochem. 10(2): 89–95. doi:10.1016/S0955-2863(98)00087-4. PMID:15539275.
103. Tipton, K.D., Elliott, T.A., Cree, M.G., Aarsland, A.A., Sanford, A.P., and Wolfe, R.R. (2007). Stimulation of net muscle protein synthesis by whey pro-tein ingestion before and after exercise. Am. J. Physiol. Endocrinol. Metab. 292(1): E71–E76. doi:10.1152/ajpendo.00166.2006. PMID:16896166.
104. van Hall, G., Saltin, B., and Wagenmakers, A.J. (1999). Muscle protein degradation and amino acid metabolism during prolonged knee-extensor exercise in humans. Clin. Sci. (Lond.). 97(5): 557–567. doi:10.1042/CS19980422. PMID: 10545306.
105. van Loon, L.J., Saris, W.H., Kruijshoop, M., and Wagenmakers, A.J. (2000a). Maxi-mizing postexercise muscle glycogen synthesis: carbohydrate supplementa-tion and the application of amino acid or protein hydrolysate mixtures. Am. J. Clin. Nutr. 72(1): 106–111. PMID:10871568.
106. van Loon, L.J., Saris, W.H., Verhagen, H., and Wagenmakers, A.J. (2000b). Plasma insulin responses after ingestion of different amino acid or protein mixtures with carbohydrate. Am. J. Clin. Nutr. 72(1): 96–105. PMID:10871567.
107. van Wijck, K., Lenaerts, K., van Loon, L.J., Peters, W.H., Buurman, W.A., and Dejong, C.H. (2011). Exercise-induced splanchnic hypoperfusion results in gut dysfunction in healthy men. PLoS One, 6(7): e22366. doi:10.1371/journal. pone.0022366. PMID:21811592.
108. West, D.W., Burd, N.A., Coffey, V.G., Baker, S.K., Burke, L.M., Hawley, J.A., et al. (2011). Rapid aminoacidemia enhances myofibrillar protein synthesis and an-abolic intramuscular signaling responses after resistance exercise. Am. J. Clin. Nutr. 94(3): 795–803. doi:10.3945/ajcn.111.013722. PMID:21795443.
109. Wilkinson, S.B., Phillips, S.M., Atherton, P.J., Patel, R., Yarasheski, K.E., Tarnopolsky, M.A., and Rennie, M.J. (2008). Differential effects of resistance and endurance exercise in the fed state on signalling molecule phos-phorylation and protein synthesis in human muscle. J.Physiol. 586(15): 3701– 3717. doi:10.1113/jphysiol.2008.153916. PMID:18556367.
110. Witard, O.C., Turner, J.E., Jackman, S.R., Tipton, K.D., Jeukendrup, A.E., Kies, A.K., and Bosch, J.A. (2012). High-intensity training reduces CD8+ T-cell redistribution in response to exercise. Med. Sci. Sports Exerc. 44(9): 1689– 1697. doi:10.1249/MSS.0b013e318257d2db. PMID:22525761.
111. Witard, O.C., Jackman, S.R., Breen, L., Smith, K., Selby, A., and Tipton, K.D. (2014). Myofibrillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise. Am. J. Clin. Nutr. 99(1): 86–95. doi:10.3945/ajcn.112.055517. PMID:24257722.
112. Witard, O.C., Turner, J.E., Jackman, S.R., Kies, A.K., Jeukendrup, A.E., Bosch, J.A., and Tipton, K.D. (2013). High dietary protein restores overreaching induced impairments in leukocyte trafficking and reduces the incidence of upper respiratory tract infection in elite cyclists. Brain Behav. Immun. In press. doi:10.1016/j.bbi.2013.10.002. 24120932.
113. Zawadzki, K.M., Yaspelkis, B.B., III, and Ivy, J.L. (1992). Carbohydrate-protein com-plex increases the rate of muscle glycogen storage after exercise. J. Appl. Physiol. (1985). 72(5): 1854–1859. PMID:1601794.

Monitoreo de la postura del entrenamiento de baloncesto basado en un dispositivo portátil inteligente
Resumen El contenido relevante del trabajo deportivo de China señaló claramente que es necesario...
Prevalencia de mujeres físicamente activas en riesgo para la tríada femenina deportista en España
Resumen Antecedentes: La tríada de la atleta femenina (Tríada) se refiere a la interrelación entre...

Variación de la recuperación neuromuscular según el tipo de serie en el entrenamiento de fuerza
¿Cuánto tarda realmente en recuperarse un atleta después de una serie al fallo? Un estudio...

Nutrición para atletas tácticos: conocimientos, aplicaciones y lagunas en la investigación
Resumen Los atletas tácticos, incluido el personal militar, los bomberos y el personal de rescate,...

Seguridad de la suplementación con creatina a largo plazo en jugadoras de fútbol: un estudio del mundo real durante la temporada
Resumen Aunque la suplementación con creatina está bien establecida para mejorar el rendimiento...