Metabolismo de las Proteínas en el Músculo Esquelético y Entrenamiento de Sobrecarga
Department of Surgery, The University of Texas Medical Branch and Metabolism Unit, Shriners Burns Hospital, Galveston, TX, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2006.
Publicado 28 de enero de 2010
Resumen
Palabras clave: isótopos estables, metodología con trazadores, sujetos humanos, aminoácidos, entrenamiento de sobrecarga
INTRODUCCION
Los efectos anabólicos potenciales del entrenamiento de sobrecarga han sido reconocidos por muchas décadas, pero las bases metabólicas para la respuesta anabólica es desconocida. Además, el rol de la ingesta de nutrientes, particularmente aminoácidos, en la modulación de la respuesta al ejercicio ha sido considerablemente inexplorada. Finalmente, mientras está generalmente reconocido que el anabolismo muscular no persiste indefinidamente en respuesta al entrenamiento, los mecanismos responsable del plateau de la respuesta, son inciertos.
Consecuentemente, hemos realizado una serie de experimentos a través de los últimos años para establecer estos aspectos. Fue usada la metodología de trazadores isotópicos estables para cuantificar la respuesta en sujetos humanos.
METODOLOGIA PARA MEDIR EL METABOLISMO PROTEICO
El enfoque tradicional para cuantificar la tasa de síntesis de proteínas musculares es administrar, ya sea un bolo o una infusión constante de aminoácidos marcados con un isótopo radiactivo (14C o 3H) y determinar el grado de incorporación hacia las proteínas musculares a través del tiempo. Cuando esta tasa es dividida por el enriquecimiento del precursor, se calcula la tasa sintética fraccional (FSR). La FSR es la fracción de la reserva o pool de proteínas que es sintetizada por unidad de tiempo.
Cuando la FSR es multiplicada por la cantidad total de proteínas musculares, se calcula la tasa sintética absoluta. Teniendo en cuenta que la reserva muscular es grande en relación a la tasa de síntesis, las diferencias en la FSR generalmente se traducen a las diferencias correspondientes en la tasa sintética absoluta.
Adaptamos la técnica FSR usando trazadores radioactivos a la metodología de isótopos estables y determinamos la respuesta al ejercicio en sujetos humanos (1). Mientras que este enfoque ha sido ampliamente utilizado desde ese momento, el mismo es limitado como una herramienta para entender la respuesta al ejercicio, debido a que el cambio neto en la cantidad de proteínas musculares no es solo determinado por la tasa de síntesis, sino a través del balance entre las tasas de síntesis y ruptura. Por ejemplo, en nuestro estudio original de sujetos caminando en una cinta rodante, la FRS muscular se incrementó en ~40%, pero otros indicadores sugieren que esto no corresponde con cambios en el balance neto de proteínas (1). Consecuentemente, desarrollamos un nuevo enfoque que permite la medición simultánea de tanto la síntesis como la ruptura de proteínas musculares y de este modo una medición del balance neto de proteínas musculares (2). Este modelo está basado en el enriquecimiento y concentraciones isotópicas arteriovenosas y el enriquecimiento intramuscular de aminoácidos trazadores (2). También desarrollamos una técnica para medir la tasa de ruptura fraccional de proteínas musculares de un modo que podría ser usado junto con la FSR para determinar el balance neto de proteínas musculares (3, 4). Así, hay dos enfoques separados para medir la respuesta de la cinética de proteínas musculares (síntesis, ruptura, y balance neto) al ejercicio. Teniendo en cuenta que muchas de las suposiciones de los dos métodos difieren entre si (5), la coincidencia entre ellos apoya los resultados.
RESPUESTA DEL MUSCULO ESQUELETICO AL EJERCICIO DE SOBRECARGA
El ejercicio de sobrecarga estimula la FSR muscular (6). Es importante destacar que efecto no solo es evidente 3 h después de la finalización del ejercicio, sino que persiste a las 24 y 48 h después del ejercicio.
El efecto de la FSR estimulada sobre el balance neto de proteínas musculares es atenuado por un incremento simultáneo en la ruptura de las mismas.
En la condición de reposo y ayuno, el balance neto de proteínas musculares es negativo, lo cual refleja el hecho de que la ruptura excede la tasa de síntesis de proteínas musculares. Luego del ejercicio en el estado de ayunas, el balance neto de proteínas musculares mejora, pero la tasa de ruptura todavía excede la de síntesis (Figura 1). Diferentes estudios (e.g., 7, 8) han confirmado que el entrenamiento sobrecarga solo, no elimina completamente la ruptura neta de proteínas musculares en el estado de ayuno.
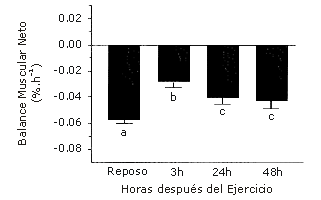
Figura 1. El Balance neto de proteínas musculares permanece siendo negativo luego del entrenamiento de sobrecarga. La figura muestra el balance neto de proteínas (FSR – FBR) en reposo y luego de la sesión de ejercicio. Los valores medios con letras diferentes son estadísticamente significativos (p<0,05). Los datos son presentados como valores medios±error estándar de la media (n=8). 3 h, 24 h y 48 h, indica tiempo post-ejercicio. FBR, tasa de ruptura fraccional; FSR, tasa sintética fraccional. Reproducido de Phillips et al. (6), con permiso.
INFLUENCIA DE LOS AMINOACIDOS SOBRE EL BALANCE NETO DE PROTEINAS MUSCULARES
La elevación de los aminoácidos plasmáticos, ya sea por infusión (e.g., 9) o ingestión (e.g., 10), estimula la síntesis de proteínas musculares. El grado de estimulación es dependiente de la dosis, el perfil de aminoácidos suministrados, el patrón de ingesta (bolo vs. ingesta constante), la edad del sujeto, y el perfil hormonal (11). La realización de entrenamiento de sobrecarga sensibiliza al músculo a los efectos anabólicos de los aminoácidos. Hay un efecto interactivo entre el entrenamiento de sobrecarga y los aminoácidos, lo cual significa que la respuesta anabólica neta a los aminoácidos después del ejercicio es mayor que la suma del efecto de los aminoácidos y del ejercicio (Figura 2). Es probable que el ejercicio sirva para activar el potencial para el incremento de la síntesis, pero sin el incremento de la disponibilidad de precursor hay una limitación en el grado al cual se incrementa verdaderamente la síntesis. Cuando están disponibles los aminoácidos en cantidades excesivas luego del ejercicio, el incremento potencial para la síntesis inducida por el ejercicio es manifestado en un mayor incremento en la verdadera producción de proteínas musculares nuevas que cuando los aminoácidos son suministrados en un estado de reposo.
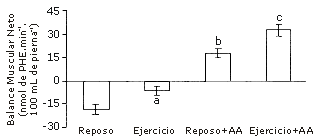
Figura 2. Influencia de los aminoácidos sobre el balance neto de proteínas musculares. Escala ordinaria: balance muscular neto, en nmol de penilalanina (PHE).min-1.100 mL de pierna-1. Los datos son presentados como valores medios±error estándar de la media. Adaptado de Biolo et al. (2) y (7).
Estos resultados muestran que los nutrientes son necesarios para aumentar el anabolismo muscular neto en respuesta al entrenamiento de sobrecarga, y que el mismo amplifica la respuesta del músculo esquelético para exceder la disponibilidad de aminoácidos.
¿SON NECESARIOS LOS AMINOACIDOS NO ESENCIALES PARA ESTIMULAR LA SINTESIS DE PROTEINAS MUSCULARES?
A voluntarios normales se les proporcionaron cuarenta gramos de aminoácidos, la cantidad aportada por la proteína de la carne. La respuesta de la cinética de las proteínas fue comparada con la de esta misma mezcla de aminoácidos a la que le faltaban los aminoácidos no esenciales (NEAAs) [i.e., 22 g de NEAAs + 18 g de aminoácidos esenciales (EAAs) vs. 18 g de EAAs] (12). El efecto anabólico neto de los EAAs no fue afectado por la inclusión de los NEAAs (Figura 3). Concluimos en que como un suplemento dietario, solo los EAAs son necesarios para estimular la síntesis de proteínas musculares. Sin embargo, actualmente no se sabe si la síntesis endógena de NEAAs podría equiparar a los requerimientos si solo se ingieren EAAs en la dieta.
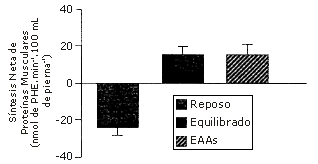
Figura 3. Respuesta del balance de proteínas musculares a la ingestión de 40 g de una mezcla equilibrada de aminoácidos [18 g de aminoácidos esenciales (EAAs) + 22 g de aminoácidos no esenciales (NEAA)] o 18 g de EAAs solos. Los datos son presentados como valores medios±error estándar de la media. Adaptado de Volpi et al. (12).
INTERACCION ENTRE LOS CARBOHIDRATOS Y AMINOACIDOS
Los carbohidratos solos presentan un efecto estimulador sobre el balance neto de proteínas musculares luego del ejercicio, pero el efecto es mínimo en comparación con la estimulación producida por los aminoácidos: la ingestión de solo 3 g de EAAs luego del ejercicio estimula el balance neto de proteínas tanto como 35 g de carbohidratos (CHO) (13). Además, si la dosis de EEAs se incrementa a 6 g, la respuesta es del doble que la de una mezcla de 3 g de EAAs + 3 g de NEAAs. Al mismo tiempo, la adición de 35 g de CHO a los 6 g de la mezcla de EAAs y NEAAs tiene un efecto mínimo, y la respuesta a la mezcla de 6 g de EAAs y 35 g de CHO fue en realidad menor que el efecto anabólico de 6 g de EAA solos (Figura 4). La falta de un efecto interactivo entre los EAA y los CHO puede ser el resultado de la estimulación de la captación esplácnica de aminoácidos mediada por la insulina.
De cualquier modo, estos datos indican que el efecto de los aminoácidos sobre el anabolismo muscular neto no es simplemente un efecto calórico.
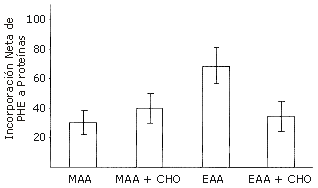
Figura 4. Respuesta a 6 g de EAA±35 g de carbohidratos (CHO) luego del ejercicio. El área bajo la curva representa la captación neta (mg.pierna-1) de fenilalanina a través de 1 h después de la ingestión de 6 g de diferentes bebidas con aminoácidos por sujetos humanos sanos. MAA, 6 g de una mezcla de aminoácidos (3 g de aminoácidos esenciales + 3 g de aminoácidos no esenciales); MAA + CHO, 6 g de una mezcla de aminoácidos + 35 g de carbohidratos; EAA, 6 g de aminoácidos esenciales; EAA + CHO, 6 g de aminoácidos esenciales + 35 g de carbohidratos. Los datos están representados como valores medios±error estándar de la media. Datos adaptados de Miller et al. (13) y Borsheim et al. (15).
METABOLISMO DE PROTEINAS MUSCULARES EN RESPUESTA AL ENTRENAMIENTO DE SOBRECARGA CRONICO
La respuesta a una sesión única de ejercicio es de limitado interés práctico, ya que los efectos beneficiosos duraderos del ejercicio requieren un período de entrenamiento. De este modo, estudiamos la respuesta de la cinética de las proteínas musculares antes y después de 16 semanas de un programa de entrenamiento de sobrecarga para determinar si hay una respuesta adaptativa a una sola sesión de ejercicio o a los efectos interactivos de los aminoácidos y el ejercicio. Encontramos que el balance neto de proteínas musculares en reposo o post-ejercicio no fue afectado por el entrenamiento.
En otras palabras, el grado de balance proteico negativo fue el mismo antes y después del entrenamiento. Además, la respuesta anabólica a los aminoácidos después del entrenamiento fue atenuada (14). De este modo, el plateau del anabolismo muscular neto durante el entrenamiento de sobrecarga puede resultar de la adaptación a los efectos anabólicos de los aminoácidos ingeridos. Una implicancia de esta observación es que durante el entrenamiento crónico sería requerida una mayor ingesta de proteínas/aminoácidos para provocar un efecto anabólico que lo que es sugerido por los hallazgos a partir de una sola sesión de ejercicio.
TIMING EN LA INGESTA DE NUTRIENTES EN RELIACION AL ENTRENAMIENTO DE SOBRECARGA
Se esperaría que la ingesta de aminoácidos antes del ejercicio sería beneficiosa, debido a que la captación de aminoácidos por parte del músculo es proporcional al transporte, y la proporción de flujo sanguíneo a los músculos se incrementa durante el ejercicio. Un incremento en la captación neta de EAAs se traduce en un incremento de la síntesis de proteínas musculares. Nosotros encontramos esto, debido a que una mezcla de 6 g de EAA + 35 g de glucosa administrados inmediatamente antes del ejercicio resultó en una mayor estimulación del balance neto de proteínas musculares que cuando fue proporcionada ya sea inmediatamente después o 1 hora después del ejercicio (15). De manera interesante, no solo fue mayor la captación neta de aminoácidos durante el período de ejercicio (cuando solo el grupo al que se le proporcionó aminoácidos antes del ejercicio había recibido algo), sino que la respuesta fue también mayor en la primera hora después del ejercicio de lo que fue la respuesta de la primera hora de los sujetos a los que se les proporcionó el suplemento inmediatamente después del ejercicio.
RESPUESTA CUANTITATIVA A LA INGESTION DE EAA DESPUES DEL EJERCICIO
La cinética de los trazadores permite una cuantificación de la respuesta del balance muscular neto después de la ingestión de aminoácidos, la cual puede ser extrapolada a la ganancia neta de tejido muscular. Por ejemplo, cuando fueron proporcionados 12 g de EAA después del ejercicio, hubo una ganancia neta de ~7,2 g de proteínas musculares (15). Esto representó ~ 3,6 g de EAAs (~30% de lo ingerido) y 3,6 g de NEAAs. Esto correspondió a una ganancia neta de ~26 g de tejido muscular. Dos puntos surgen de este cálculo. 1) La respuesta a una sola dosis de EAAs es pequeña en relación a la masa muscular total. Además, en cualquier respuesta estudiada, el efecto puede incluso ser menor debido a que ocurre la adaptación a la dosis. Por ejemplo, en el caso de la respuesta a 15 g de EAA, 2 meses o más de tratamiento diario serían necesarios para detectar en forma confiable una diferencia, y quizás un período mayor si el tratamiento no fuera diario. 2) Cuando solo fueron proporcionados EAAs, los NEAAs fueron utilizados en vez de ser degradados y el N incorporado a la urea. A pesar de la ingestión de los 12 g extra de EAA, donde solo 30% de los cuales fueron usados para la síntesis de proteínas musculares, la producción de urea no se incrementó, debido a la disminución de la disponibilidad de NEAA. Por ejemplo, la concentración de alanina cayó hasta ~ 50 % como resultado de la ingestión de EAA, reflejando en parte la utilización acelerada de alanina (y otros NEAAs) para la incorporación a proteínas.
CONCLUSION
La respuesta anabólica de las proteínas musculares al ejercicio resulta de los cambios metabólicos inducidos por la contracción muscular y la disponibilidad de aminoácidos. Además, es importante el timing de nutrientes ingeridos en relación al ejercicio. La efectividad de la ingesta de nutrientes es amplificada por una ingestión antes del ejercicio. Finalmente, es alcanzado un plateau en la respuesta anabólica al entrenamiento de sobrecarga que puede deberse, en parte, a la disminución del efecto de interacción entre los aminoácidos y el ejercicio.
Referencias
1. Carraro F., Stuart C. A., Hartl W. H., Rosenblatt J., Wolfe R. R (1990). Effect of exercise and recovery on muscle protein synthesis in human subjects. Am J Physiol. 259:E470-6
2. Biolo G., Reming R. Y. D., Maggi S. P., Wolfe R. R (1995). Transmembrane transport and intracellular kinetics of amino acids in human skeletal muscle. Am J Physiol. 268: E75-84
3. Zhang X. J., Chinkes D. L., Sakurai Y., Wolfe R. R (1996). An isotopic method for measurement of muscle protein fractional breakdown rate in vivo. Am J Physiol. 270: E159-67
4. Zhang X. J., Chinkes D. L., Wolfe R. R (2002). Measurement of muscle protein fractional synthesis and breakdown rates from a pulse tracer injection. Am J Physiol Endocrinol Metab. 283: E753-64
5. Wolfe R. R., Chinkes D. L (2004). Isotope tracers in metabolic research: principles and practice of kinetic analysis. New York: John Wiley & Sons
6. Phillips S. M., Tipton K. D., Aarsland A., Wolf S. E., Wolfe R. R (1997). Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am J Physiol. 273: E99-107
7. Biolo G., Maggi S. P., Williams B. D., Tipton K. D., Wolfe R. R (1995). Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am J Physiol. 268: E514-20
8. Tipton K. D., Ferrando A. A., Phillips S. M., Doyle D. Jr., Wolfe R. R (1999). Post exercise net protein synthesis in human muscle from orally administered amino acids. Am J Physiol. 276: E628-34
9. Bohe J., Low Aili F., Wolfe R. R., Rennie M. J (2001). Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol. 532: 575-9
10. Volpi E., Mittendorfer B., Rasumussen B. B., Wolfe R. R (2000). The response of muscle protein anabolism to combined hyperaminoacidemia and glucose- induced hyperinsulinemia is impaired in the elderly. J Clin Endocrinol Metab. 85: 4481-90
11. Wolfe R. R (2002). Regulation of muscle protein by amino acids. J Nutr. 132: 3219S-24S
12. Volpi E., Kobayashi H., Sheffield- Moore M., Mittendorfer B., Wolfe R. R (2003). Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am J Clin Nutr. 78: 250-8
13. Miller S. L., Tipton K. D., Chinkes D. L. Wolf S. E., Wolfe R. R (2003). Independent and combined effects of amino acids and glucose on muscle protein following resistance exercise. Med Sci Sports Exerc. 35: 449-55
14. Tipton K. D., Cocke T. L., Wolf S. E., Wolfe R. R (2006). Response of muscle protein metabolism to resistance training and acute resistance exercise during hyperaminoacidemia. Am J Physiol. in press
15. Borsheim E., Tipton K. D., Wolf S. E., Wolfe R. R (2002). Essential amino acids and muscle protein recovery from resistance exercise. Am J Physiol Endocrinol Metab. 283: E648-57