Mioglobina
Publicado 18 de abril de 2014, 19:45
La mioglobina es un complejo formado por una parte proteica, la globina, y un grupo prostético, el hemo; situado en la fibra muscular cardíaca y esquelética. Cuando un componente de bajo peso molecular se une a una proteína, normalmente se llama a éste cofactor. Si el factor está asociado de forma permanente a la proteína se denomina grupo prostético (Müller, 2008).
 La parte proteica de la mioglobina consta de una única cadena
polipeptídica de 153 aminoácidos que se pliega formando ocho hélices de tipo
alfa (nombradas de la A a la H). Al plegarse, los residuos de los aminoácidos
que forman la proteína pueden interactuar de tal manera que aquellos con cadena
lateral apolar se disponen hacia el interior interaccionando mediante uniones
hidrofóbicas (Cardellà, 2007). En la figura 1 se puede observar la estructura
tridimensional de la mioglobina.
La parte proteica de la mioglobina consta de una única cadena
polipeptídica de 153 aminoácidos que se pliega formando ocho hélices de tipo
alfa (nombradas de la A a la H). Al plegarse, los residuos de los aminoácidos
que forman la proteína pueden interactuar de tal manera que aquellos con cadena
lateral apolar se disponen hacia el interior interaccionando mediante uniones
hidrofóbicas (Cardellà, 2007). En la figura 1 se puede observar la estructura
tridimensional de la mioglobina.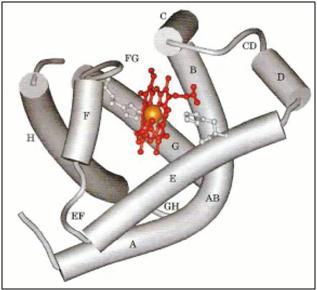
Figura 1: estructura tridimensional de la mioglobina (extraído de Principios de bioquímica Lehninger, 2005)
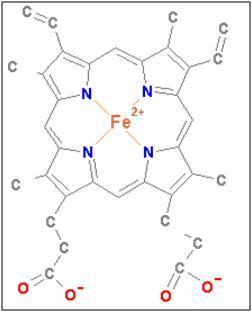
Como se puede observar, el grupo hemo queda fijado en ese bolsillo hidrofóbico por enlaces no covalentes (Müller, 2008). Este grupo hemo es un sistema aromático de anillos formados por una molécula orgánica compleja nombrada protoporfirina IX, al que se la une un ión hierro divalente (Fe2+) central.
Es bastante común en fisiología del ejercicio el clasificar las fibras musculares según su pigmentación en fibras blancas (o rápidas) y fibras rojas (o lentas). Lo que hace posible la distinción a través de su coloración es el extenso sistema de dobles enlaces conjugados de la protoporfirina IX del grupo hemo como se puede observar en la figura 2. Las fibras lentas, al tener mayores concentraciones de mioglobina, presentan a su vez mayor cantidad de grupos hemo y por lo tanto mayor coloración que sus pares rápidas.
El ión hierro tiene seis posibilidades de unión (llamados también posiciones de coordinación), cuatro de ellas están ocupadas por nitrógeno de la protoporfirina IX, la quinta posición está ocupada por un residuo de histidina (denominada proximal) de la hélice F y la sexta posición es la que se encarga de ligar de forma reversible el oxígeno (O2). Finalmente, éste oxígeno es ligado con otro residuo de histidina (distal) de la hélice E a través de puentes de hidrógeno dando estabilidad a todo el complejo.
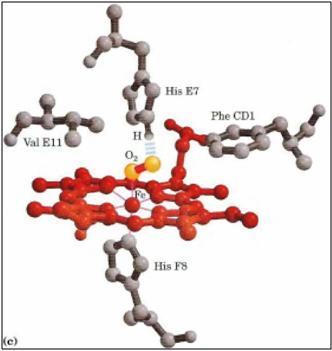
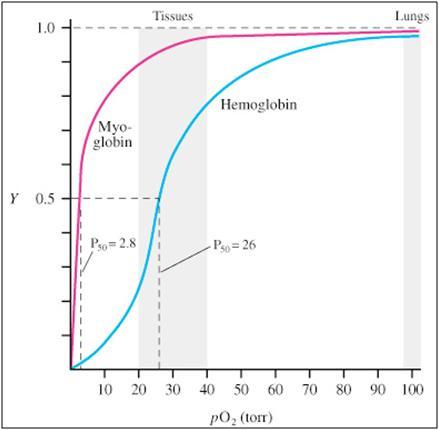
 Figura 4: curva de disociación de oxígeno en la mioglobina y la
hemoglobina (extraído de Relat, 2010). En el eje de las “x” esta
ubicada la presión de O2, y en el de las “y” el porcentaje de los centros de
unión ocupados por el oxígeno en ambas moléculas. Dicha gráfica muestra como la
hemoglobina es más sensible a pequeñas diferencias en la concentración de
oxígeno entre los pulmones y los tejidos permitiendo unir oxigeno donde las
presiones de oxigeno son altas (pulmones) y soltarlo donde son bajas (tejidos).
La mioglobina en cambio se resiste a dejar escapar el oxígeno hasta presiones
muy bajas.
Figura 4: curva de disociación de oxígeno en la mioglobina y la
hemoglobina (extraído de Relat, 2010). En el eje de las “x” esta
ubicada la presión de O2, y en el de las “y” el porcentaje de los centros de
unión ocupados por el oxígeno en ambas moléculas. Dicha gráfica muestra como la
hemoglobina es más sensible a pequeñas diferencias en la concentración de
oxígeno entre los pulmones y los tejidos permitiendo unir oxigeno donde las
presiones de oxigeno son altas (pulmones) y soltarlo donde son bajas (tejidos).
La mioglobina en cambio se resiste a dejar escapar el oxígeno hasta presiones
muy bajas.Durante el reposo y la realización de ejercicio físico moderado, la mioglobina mantiene una elevada saturación de oxígeno (López, 2006).
Así entonces, teniendo en cuenta la gran afinidad de la mioglobina por el oxígeno, que su volumen almacenado en la musculatura no supera los 500ml yque tampoco se manifiestangrandes modificaciones en su contenido inducidas por el entrenamiento aeróbico;se intuye que sus funciones de administración de oxigeno a la musculatura en la actividad física son secundarias. Parece más oportuno pensar, que la mioglobina podría actuar suministrando O2 en las etapas iniciales del ejercicio, cuando todavía no ha sido posible adecuar el flujo local de oxígeno a las demandas metabólicas (Barbany, 2002).
Capacitaciones Relacionadas
Curso de Fisiología del Ejercicio Aplicada
Capacitaciones de Nuestra Institución
Curso de Preparación Física Integral en Natación
Curso de Preparación Física Integral en Ciclismo
Webinar de Lineamientos para la Utilización de Bebidas Deportivas en los Deportes de Resistencia
Webinar de Descripción y Análisis de la Técnica de Crol
Taller de Entrenamiento para el Trail Running: Introducción y Conceptos Esenciales
Referencias
Barbany, J.R., (2002), “Respiración y ejercicio físico ” en, Barbany, J.R. Fisiología del ejercicio físico y del entrenamiento. Editorial Paidotribo. Barcelona
Cardellà, L (2007), Bioquímica humana. Editorial Ciencias médicas. La Habana
López, J., (2006), “Difusión y transporte de gases en el ejercicio físico ” en López, J. Fisiología del ejercicio. Editorial Panamericana. 3ª edición. Madrid
Müller, W (2008), Bioquímica. Fundamentos para medicina y ciencias de la vida. Editorial Reverté. Barcelona
Nelson, D. y Cox, M. (2005), Principios de bioquímica Lehninger. 4ª edición. Editorial Omega
Relat, J. (2010). Estructura y función de las proteínas. Apuntes de la asignatura Bioquímica del grado en Nutrición Humana y Dietética. Universidad de Barcelona.