mTOR
Publicado 20 de febrero de 2014, 23:20
mTOR es una
proteína cinasa de 289 kDa, específica de Ser/Thr perteneciente a la clase de
proteínas PI3K, caracterizada por ser un regulador clave en el control de la
traducción y nombrada acorde a su específica unión al complejo entre rapamicina
y la proteína ligante FK504. mTOR presenta diversos dominios reguladores
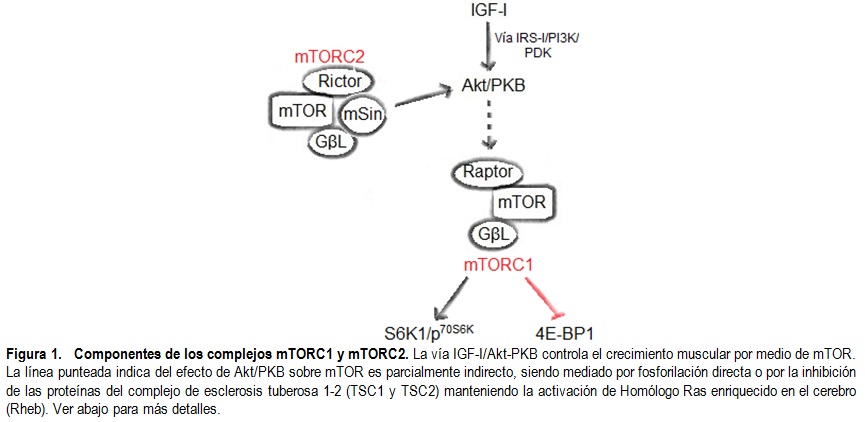
que se encuentran al interior de un complejo que puede ser de dos tipos; mTORC1
y mTORC2 (Figura 1). El complejo mTORC1 está conformado, además de mTOR, por
la proteína semejante a la subunidad beta de la proteína G (GβL, G-protein beta subunit-like protein) y
la proteína reguladora asociada al mTOR (raptor, regulatory associated protein of mTOR). Este complejo es sensible a
la rapamicina (la cual lo inactiva) y ejerce un importante rol de regulación
durante el proceso de hipertrofia de las células del músculo esquelético [1].
Principalmente, dos proteínas corriente abajo de la activación de mTOR
participan en la regulación de la iniciación de la traducción y elongación por
mTOR: S6K1 (conocida comúnmente como p70s6k) y la proteína ligada al
factor eucariótico de iniciación 4E (4E-BP1, eukaryotic initiation factor 4E binding protein). S6K1/p70s6k
en su estado activo fosforila por lo menos nueve sustratos diferentes entre los
que se destacan la activación de la proteína ribosomal S6 (rpS6), encargada de
incrementar el tamaño y la proliferación celular y la inhibición de la cinasa
del factor eucariótico de elongación 2 (eEF2K, eukaryotic elongation factor 2 kinase), manteniendo activo el
factor eucariótico de elongación 2 (eEF2) encargado de la transición del ARN
transferente desde el sitio peptidil (P site) al sitio de salida (E site)
durante la traducción. Por otro lado, el mTOR al fosforilar e inhibir 4E-BP1
impide que ésta última se una al factor eucariótico de iniciación 4E (eIF4E)
promoviendo así el acoplamiento entre el eIF4E y el eIF4G incrementando la
formación del complejo de iniciación de la traducción [4]. El complejo mTORC2
está compuesto, además de mTOR y de GβL, por mSin y por el acompañante
insensible a la rapamicina del mTOR (rictor, rapamycin-insensitive companion of mTOR). Hay muy poco
conocimiento acerca de la regulación de este complejo aunque se sabe que es
requerido para la fosforilación y activación en el residuo de SER 473 de
Akt/PKB, punto de máxima activación, por medio de la cual puede estar
involucrado en la regulación de la iniciación y elongación de la traducción
[2].
De manera resumida, es
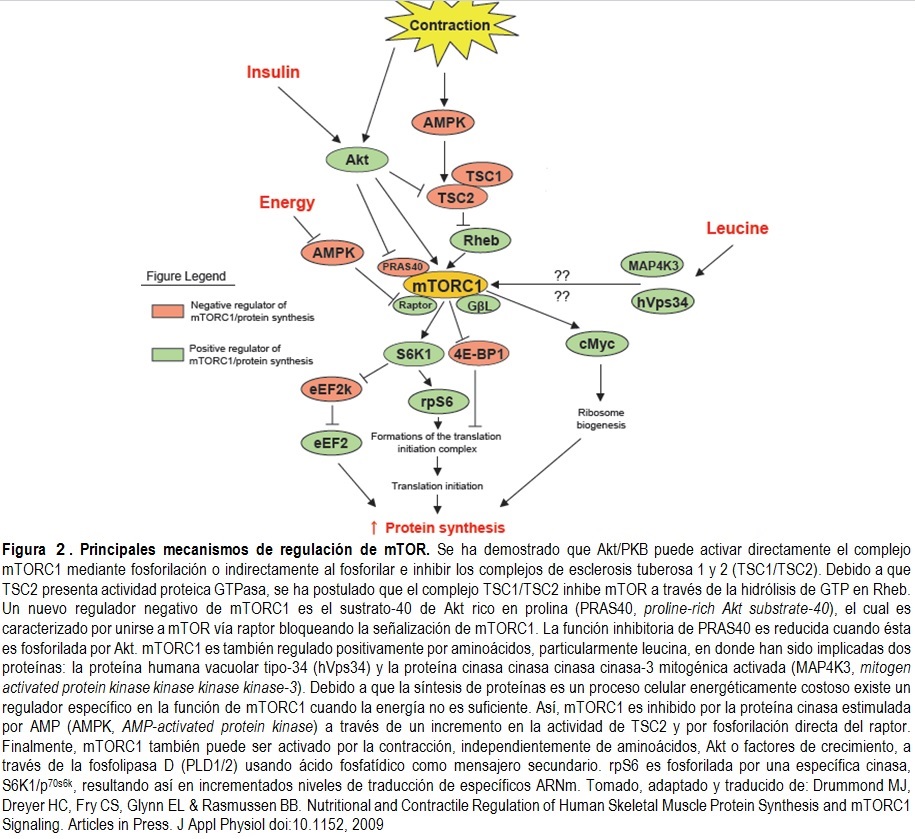
bien sabido que el complejo mTORC1 es regulado al menos por tres factores
conocidos: estimulación por la entrada de glucosa vía insulina/Akt y
disminución de la activación de la AMPK; aminoácidos, principalmente leucina,
vía hVps34, MAP4K3 y las Rag GTPasas; y factores de crecimiento por medio de
Akt/PKB y el complejo de TSC1/2 (Figura 2).
Por lo tanto, varias vías que incluyen la cascada de la proteína cinasa mitogénica activada (MAPK, mitogen activated protein kinase), también conocida como cinasa regulada extracelularmente (ERK, extracellular regulated kinase) y Akt/PKB pueden contribuir a la activación de S6K1/p70s6k a través de mTOR [3].
Referencias
[1] Drummond MJ, Dreyer HC, Fry CS, Glynn EL & Rasmussen BB. (2009). Nutritional and Contractile Regulation of Human Skeletal Muscle Protein Synthesis and mTORC1 Signaling. Articles in Press. J Appl Physiol doi:10.1152
[2] Schiaffino & Mammucari. (2011). Regulation of Skeletal Muscle Growth by the IGF1-Akt/PKB Pathway: Insights from Genetic Models. Skeletal Muscle 1:4
[3] Krauss G. (2003). Biochemistry of Signal Transduction and Regulation. Third, Completely Revised Edition. Germany. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
[4] Bonilla DA. (2013). Principios Metabólicos de los Efectos de la Suplementación con Creatina sobre el Rendimiento Deportivo. PubliCE Standard · 2013