Muscularidad y Densidad de la Masa Libre de Grasa en Atletas
Ellen M Evans1, Barry M Prior1, Christopher M Modlesky1, Mark A Sloniger1, Michael J Saunders1, Richard D Lewis1 y Kirk J Cureton1
Departments of Exercise Science and Foods and Nutrition, University of Georgia, Atenas, Georgia 30602-6554.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2001.
Publicado 9 de agosto de 2006
Resumen
Palabras clave: composición corporal, agua corporal, contenido mineral óseo, densitometría, absorciometría dual de r
INTRODUCCIÓN
Las estimaciones de la composición corporal son utilizadas para valorar el nivel nutricional, el riesgo de enfermedades y la aptitud física y para separar la masa corporal (BM) en componentes metabólicamente activos e inactivos (11). En atletas, las mediciones de la composición corporal son ampliamente utilizadas para prescribir pesos corporales deseables, para optimizar el rendimiento competitivo y para valorar los efectos del entrenamiento (34). Los métodos indirectos tradicionales para evaluar la composición corporal en humanos, tales como la densitometría, la hidrometría y la espectrometría 40K, están basadas en un modelo de dos componentes en los cuales se asumen que la composición corporal consiste de masa grasa y masa libre de grasa o masa magra (35). La densitometría, considerada ampliamente como el método indirecto de mayor precisión (13), asume que el cuerpo consiste de un componente graso con una densidad de 0.9007 g/cm3 y de un componente libre de grasa con una densidad (DFFM) de 1.1 g/cm3. Se asume que la masa libre de grasa (FFM) está compuesta de un 73.8% de agua con una densidad de 0.9937 g/cm3, 6.8% de contenido mineral con una densidad de 3.038 g/cm3, y 19.4% de proteínas con una densidad de 1.34 g/cm3 (5). La variabilidad en la DFFM es el principal factor limitante de la precisión de las estimaciones de la composición corporal a partir de la densidad corporal (35), pero el alcance de la variabilidad en grupos no característicos, tal como los atletas, no está establecido.
Se ha sugerido que la densidad y la composición de la FFM de los atletas con una muscularidad y con masa ósea inusual pueden diferir de los valores asumidos; por lo tanto las estimaciones de la composición corporal a partir de la densitometría, utilizando un modelo de dos componentes, puede ser imprecisa (20, 44). Sin embargo, el efecto del desarrollo musculoesquelético sobre las estimaciones de la composición corporal a partir de la densidad corporal es difícil de predecir. El incremento en la muscularidad debería provocar la reducción de la DFFM, y esto se debe a que la densidad del músculo libre de grasa es de ~ 1.066 g/cm3 (1), mientras que el incremento en el desarrollo esquelético debería provocar el incremento en la DFFM, ya que la densidad del mineral óseo es de ~3.317 g/cm3 (5). Si el tejido muscular y óseo varían en proporción, el efecto sobre la DFFM puede ser dominado por el tejido óseo debido a su mayor densidad (23, 47). Sin embargo, el tejido óseo y el tejido muscular no varían proporcionadamente. Modlesky et al. (26) hallaron que la DFFM en levantadores de pesas con un gran desarrollo muscular era de 1.089±0.005 g/cm3. El menor valor de DFFM que el asumido, se debió a un mayor contenido de agua y a un mayor contenido mineral en la FFM, aparentemente debido a que el músculo, con mayor contenido de agua, estaba desproporcionadamente incrementado respecto del tejido óseo. Withers et al. (46) reportaron resultados similares en físicoculturistas. Se desconoce si el efecto del desarrollo musculoesquelético sobre la DFFM observado en estos estudios puede generalizarse a otros grupos de atletas. Hasta hace poco, las estimaciones de la DFFM in vivo estaban limitadas a la capacidad para medir con precisión la FFM. Los avances tecnológicos han derivado en el desarrollo de métodos para estimar la composición corporal utilizando un modelo de cuatro componentes (grasa, agua, mineral, proteínas) en base a mediciones de la densidad corporal, contenido de agua y de mineral óseo (2, 22). Las estimaciones de la grasa y de la FFM en base al modelo de cuatro componentes son más precisas que las realizadas a partir de la densidad corporal, debido a que se hacen pocas presunciones respecto de la composición de la FFM, dando cuenta de las variaciones en el contenido de agua y en el contenido mineral corporal, los cuales se encuentran entre los componentes más variables de la FFM (3, 22). Los estudios con pequeños grupos de atletas han hallado diferencias sistemáticas entre las estimaciones del porcentaje de grasa realizadas con el modelo de cuatro componentes y las estimaciones realizadas a partir de la densidad corporal (26, 46), indicando que la DFFM difiere del valor 1.1 g/cm3, mientras que otros estudios no han encontrado diferencias (2, 31, 45).
El propósito principal de este estudio fue utilizar las estimaciones de la composición corporal a partir del modelo de cuatro componentes para determinar si la muscularidad o el desarrollo musculoesquelético afecta la DFFM y, por lo tanto, la precisión de las estimaciones de la composición corporal a partir de la densidad corporal utilizando la ecuación de Siri en un grupo heterogéneo de atletas y no atletas. En base a los resultados del estudio de Modlesky et al. (26), hemos planteado la hipótesis acerca de que la muscularidad y el desarrollo musculoesquelético estarían inversamente relacionados con la DFFM. Nuestra hipótesis fue que en individuos con alta y baja muscularidad o desarrollo musculoesquelético, las estimaciones del porcentaje de grasa a partir de la densidad corporal sobreestimarían y subestimarían, respectivamente, el porcentaje de grasa en base al modelo de cuatro componentes.
METODOS
Sujetos
Ciento setenta y dos hombres y mujeres jóvenes, los cuales estaban conformados por 111 atletas de nivel universitario y 61 sujetos no atletas, participaron en este estudio. Los atletas universitarios fueron reclutados en los equipos de fútbol americano (41 hombres), básquetbol (7 hombres y 1 mujer), voleibol (5 mujeres), gimnasia (11 mujeres), natación (10 hombres y 14 mujeres), y atletismo de pista y campo (9 hombres y 13 mujeres), de la Universidad de Georgia. Veintinueve de los hombres y 10 de las mujeres eran de raza negra; los otros eran de raza blanca. Los hombres y las mujeres no atletas quienes realizaban actividades recreativas, pero que no realizaban >20 min de ejercicio tres veces por semanas, fueron reclutados como grupo de referencia en la población estudiantil universitaria. Diez de los hombres y 11 de las mujeres no atletas eran de raza negra; mientras que el resto eran de raza blanca. El estudio fue aprobado por el Comité de Revisión Institucional de la Universidad, y se obtuvo el consentimiento escrito de los sujetos antes de llevar a cabo cualquier evaluación. Las características físicas de los sujetos se resumen en la Tabla 1.
Protocolo
Las características físicas, las mediciones antropométricas, la densidad corporal, el agua corporal total y el mineral óseo corporal total, fueron medidos durante una única sesión de evaluación que duró ~3.5 horas. Los sujetos fueron instruidos para no realizar actividad física vigorosa en las 24 horas previas a la sesión de evaluación. Los sujetos se reportaron al laboratorio luego de 8-12 horas de no consumir alimentos o bebidas, excepto agua, y se les pidió que arribaran bien hidratados. El nivel de hidratación fue normal, lo cual estuvo indicado por el peso específico de la orina (1.020±0.009 g/ml). Todos los individuos estuvieron dentro de los 2 DE a partir de la media. Los sujetos no consumieron alimentos o agua durante la sesión.
Densitometría
La densidad corporal fue medida utilizando la técnica de pesaje subacuático y el principio de Arquímedes para determinar el volumen corporal. La BM fue medida utilizando una balanza electrónica con una apreciación de 0.05 kg. La BM subacuática fue medida utilizando una balanza para autopsias (Chatillon, Greensboro, NC) con una apreciación de 0.025 kg. El volumen pulmonar residual fue medido en el mismo momento del pesaje subacuático utilizando una modificación de la técnica de reinspiración de oxígeno y disolución de nitrógeno propuesta por Goldman y Burskirk (14). Se asumió que el volumen gaseoso dentro del tracto gastrointestinal era de 0.1 litros. El DE intra-sujeto de las mediciones de la densidad corporal repetidas en 2 días separados por ~1 semana fue de 0.0016 g/cm3 (26).
Agua Corporal
El agua corporal total fue determinada por la disolución de deuterio (D2O). Luego de recolectar muestras de sangre basales, los sujetos ingirieron una cantidad conocida de D2O [0.31±0.01 (DE) g/kg BM] en 100 ml de agua destilada diluida con 100 ml adicionales de agua destilada para asegurar la completa ingesta del marcador. Luego de un período de equilibración de 3 horas durante el cual se recolectó toda la orina de los sujetos, se recolectaron otras muestras de sangre. Las muestras de sangre fueron centrifugadas a 3000 rpm durante 20 min, y el plasma fue conservado a -80ºC. Las muestras del plasma sanguíneo fueron purificadas por difusión (10); volúmenes iguales (3 ml) de plasma y agua destilada fueron incubados a 37ºC en un Plato Conway de difusión sellado (Bel-Air Products, Pequannock, NJ) durante 48 horas.
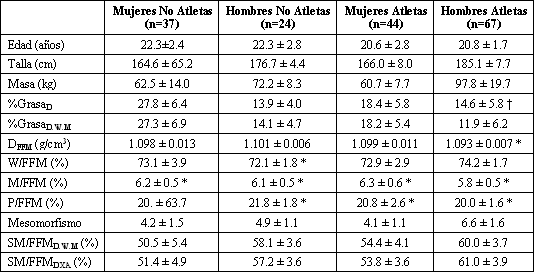
Tabla 1. Características de los sujetos, composición corporal y
desarrollo musculoesquelético por sexo y nivel de entrenamiento. Los datos son
presentados como valores medios±DE; n, número de sujetos. DFFM,
densidad de la masa libre de grasa; W, agua corporal total; M, contenido mineral
corporal total; P, contenido proteico corporal total; SM, masa muscular corporal
total medida mediante absorciometría dual de rayos X (DXA); FFM, masa libre de
grasa estimada con el modelo de cuatro componentes. *Significativamente
diferente de los valores obtenidos con el análisis cadavérico (5): DFFM=1.100
g/cm3, W/FFM=73.8%; M/FFM=6.8%, P/FFM=19.4% (p<0.05). †
Significativamente diferente del % GrasaD,W,M (p<0.05).
En nuestro laboratorio, la recuperación de cantidades conocidas de D2O a partir de soluciones plasmáticas utilizando este método promedió el 9% (rango 95-102%) (26). En 12 de los sujetos, no pudieron obtenerse las muestras sanguíneas y en cambio se purificaron las muestras de orina. La muestra purificada fue analizada utilizando un espectrofotómetro infrarrojo (Miran 1FF, Foxboro, Foxboro, MA) con una celda sellada CaF a una longitud de onda fija de 4.0 μm en interfase con una computadora. Las lecturas del analizador fueron registradas a 10 Hz durante 1 min utilizando un programa de adquisición de datos Labtech Notebook (version 8.0, Cambridge, MA) luego de que la muestra se equilibró durante 5 min. La concentración plasmática de D2O fue determinada a partir de una curva estándar. El agua corporal total fue corregida por la pérdida de D2O en la orina y se redujo un 4% para contabilizar el intercambio de hidrógeno con las proteínas y los carbohidratos durante el período de equilibración de 3 h (33). El DE intra-sujeto para las mediciones repetidas del agua corporal total realizadas en 2 días separados por ~1 semana en cinco sujetos fue de 0.75 litros (26).
Contenido Mineral Corporal
El contenido mineral óseo corporal total fue medido utilizando absorciometría dual de rayos X (DXA; Hologic QDR- 1000W, Waltham, MA, análisis de Todo el Cuerpo Mejorado, versión de software 5.71). Antes de cada sesión de evaluación se realizó el control de calidad del instrumento realizando barridos de una imitación de una vértebra lumbar hecha de hidroxiapatita de calcio embebida de Lucita. El coeficiente de variación de los 164 barridos fue de 0.27%. El DE intra-sujeto para mediciones repetidas del contenido mineral óseo (BMC) realizadas en 2 días separados por ~1 semana en cinco sujetos fue de 7.2 g (26).
El Dispositivo de DXA Hologic fue calibrado para valorar la masa del mineral óseo con las propiedades de atenuación de los rayos X de la hidroxiapatita. El mineral óseo difiere ligeramente de la hidroxiapatita y contiene agua extra proveniente de la cristalización y bicarbonato (5). Ho et al. (16) hallaron que el contenido mineral en las vértebras lumbares valorado con el QDR-1000W Hologic correlacionó más estrechamente con el peso en ceniza que con el peso de hueso seco. Nosotros asumimos que el mineral medido por la DXA se aproxima al hueso en ceniza, que es el mineral óseo total menos los componentes volátiles perdidos en el proceso de cremación, tales como el agua de cristalización y el dióxido de carbono proveniente de los carbonatos (5). El peso de las cenizas fue multiplicado por 1.2741 para estimar el contenido mineral corporal. La constante 1.2741 asume que el 4% del mineral óseo se pierde durante el proceso de cremación (25) y que la masa mineral no ósea representa el 23% de las cenizas minerales óseas (5). Treinta y un sujetos tenían una talla que estaba fuera de la región de barrido del densitómetro óseo. En estos sujetos, el mineral óseo se estimó a partir de la suma del mineral óseo en dos barridos separados (cuerpo superior y cuerpo inferior, realizando la división en la zona del cuello) utilizando una ecuación de regresión obtenida en un estudio de validación, en el cual el BMC obtenido con un único barrido en 20 sujetos de ~183 cm, fue estimado a partir de los valores de BMC en base a la suma de dos barridos (y=1.003.x - 46, r2=0.99, Error estándar de estimación=30 g) (29). Esta ecuación de regresión fue utilizada debido a que produjo una pequeña diferencia sistemática (~46 g) entre la BMC medida en un único barrido y la BMC determinada con dos barridos.
Muscularidad
La masa muscular corporal total fue estimada a partir de la ecuación de regresión propuesta por Wang et al. (43), quienes predijeron la masa muscular corporal total valorada mediante barridos de tomografía computada en serie (CT) a partir de tejido blando apendicular valorado mediante DXA. El porcentaje de FFM comprendido en los músculos esqueléticos (SM/FFM) fue considerado como un índice de muscularidad. La FFM fue estimada utilizando un modelo de cuatro componentes (FFMD, W, M, donde D es densidad, W es agua y M es mineral óseo), y mediante la utilización de DXA (FFMDXA) de manera que el índice fue completamente independiente de la composición corporal estimada utilizando el modelo de cuatro componentes.
Desarrollo Musculoesquelético
El desarrollo musculoesquelético fue caracterizado utilizando el índice de mesomorfia propuesto en el somatotipo antropométrico de Heath-Carter (8). Este índice refleja el desarrollo relativo de los músculos esqueléticos y del tejido óseo por unidad de talla y se determina a partir de la medición de la circunferencia del brazo (AC) y de la pantorrilla (CC) corregidos por el grosor de los pliegues cutáneos, por el diámetro biepicondilar del húmero (HW) y por el diámetro bicondilar del fémur (FW), y por el peso (HT) con la siguiente ecuación: Mesomorfismo=0.858.HW + 0.601.FW + 0.188.AC + 0.161.CC – 0.131.HT + 4.5 (8). Los valores obtenidos con esta ecuación varían entre ~ 0.5 y 9.
Cálculos para la Determinación de la Composición Corporal
El porcentaje de grasa corporal fue estimado a partir de la densidad corporal (%GrasaD) en base a un modelo de dos componentes y utilizando la ecuación de Siri (35)
%GrasaD=[(4.95/Db) - 4.50].100
Donde Db es la densidad corporal.
El porcentaje de grasa corporal también fue estimado a partir de la densidad corporal, el agua corporal y el contenido mineral corporal (%GrasaD, W, M) en base al modelo de cuatro componentes y utilizando la siguiente ecuación desarrollada por Lohman (21):
%GrasaD,W,M=[(2.747/Db) - (0.714.W) + (1.146.M) - 2.0503].100
Donde W es el agua corporal total relativa a la BM y M es el contenido mineral corporal relativo a la BM.
La DFFM fue estimada a partir de los contenidos de agua (W), mineral (M) y proteína (P) de la FFM (estimada a partir del modelo de 4 componentes) y sus respectivas densidades, utilizando la siguiente ecuación:
DFFM =1/[(W/DW) + (M/DM) + (P/DP)]
Análisis Estadísticos
Los análisis estadísticos fueron llevados a cabo utilizando el programa SPSS para Windows (version 6.1.3, SPSS, Chicago, IL). Los valores medios y los DE para las variables dependientes de interés fueron calculados para los hombres y las mujeres atletas y no atletas y para los atletas de los deportes seleccionados. La significancia de las diferencias medias entre %GrasaD y %GrasaD,W,M dentro de los grupos a partir de cero y las diferencias en la DFFM, W/FFM, M/FFM y P/FFM a partir de los valores asumidos en base a los análisis cadavéricos (5) fueron determinadas utilizando la prueba t para una medida. Debido a que Visser et al. (40) demostraron que el sexo y la raza tienen un efecto mínimo sobre la DFFM, la fuerza de las correlaciones entre las mediciones del desarrollo musculoesquelético y los componentes de la FFM con la DFFM se valoraron utilizando la correlación de Pearson de todo el grupo. Se estableció un nivel de significancia de 0.05 para todas las evaluaciones. Los valores significativos fueron corregidos mediante comparaciones múltiples utilizando el método de Bonferroni.
RESULTADOS
Las diferencias individuales entre el %GrasaD y el %GrasaD,W,M estuvieron en el rango del - 8.5 al 8.1% de la BM. En la muestra total el %GrasaD fue significativamente mayor que el %GrasaD,W,M en 1.2±3.4 % de la BM. El %GrasaD fue significativamente mayor que el %GrasaD,W,M en los hombres atletas en un 2.7±2.5%, pero el %GrasaD y el %GrasaD,W,M no fueron significativamente diferentes en los hombres no atletas o en las mujeres atletas y no atletas (Tabla 1). En aquellos atletas cuyo número era suficiente como para realizar análisis significativos según el deporte, se hallaron diferencias substanciales y significativas entre el %GrasaD y el %GrasaD,W,M. En los jugadores de fútbol americano el %GrasaD fue significativamente mayor que el %GrasaD,W,M en un 5.0±2.0 % de la BM y en los hombres y mujeres nadadores la diferencia fue de 3.4±1.8% de la BM. En los gimnastas el %GrasaD,W,M fue significativamente diferente del %GrasaD en un 4.4 ± 2.0% de la BM (Tabla 2).
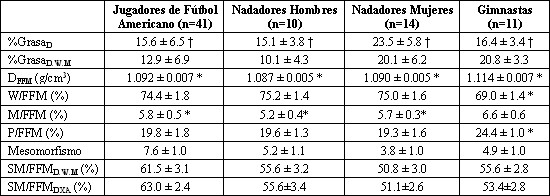
Tabla 2. Composición corporal y desarrollo musculoesquelético en atletas
seleccionados. Los datos son presentados como valores medios±DE; n, número de
sujetos. *Significativamente diferente de los valores obtenidos con el análisis
cadavérico (5): DFFM=1.100 g/cm3, W/FFM=73.8%; M/FFM=6.8%,
P/FFM=19.4% (p<0.05). † Significativamente diferente del %GrasaD,W,M
(p<0.05).
La diferencia entre el %GrasaD,W,M y el %GrasaD pudo explicarse casi completamente por la variabilidad en la DFFM. La correlación entre la DFFM y la diferencia entre %GrasaD,W,M y el %GrasaD en la muestra total fue de 0.99 (Figura 1). En la muestra total, la DFFM estuvo entre 1.075 y 1.127 g/cm3. La media de DFFM fue significativamente menor que el valor asumido de 1.1 g/cm3 en la muestra total (Tabla 1). En los jugadores de fútbol americano y en los nadadores hombres y mujeres la DFFM fue significativamente menor que el valor asumido de 1.1 g/cm3, pero en las mujeres gimnastas, la DFFM fue significativamente mayor al valor asumido de 1.1 g/cm3 (Tabla 2).
La variabilidad en la DFFM correlacionó fuertemente con la variabilidad en la W/FFM (r=-0.96), en la P/FFM (r=0.89) y correlacionó moderadamente con la variabilidad en la M/FFM (r=0.65, Figura 2). La W/FFM estuvo entre 65.1 y 79.4 % (73.4±2.7 %), la P/FFM estuvo entre 13.9 y 29.0% (20.6±2.5 %) y la M/FFM estuvo entre 4.5 y 7.6 % (6.0±0.6 %). En la muestra total, la W/FFM no fue significativamente diferente del 73.8% asumido; la M/FFM fue significativamente menor al valor asumido del 6.8% y la P/FFM fue significativamente mayor que el valor asumido de 19.4%.
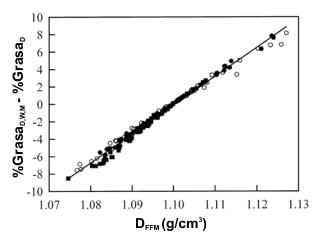
Figura 1. Relación entre la diferencia en el porcentaje de grasa corporal
estimado a partir de la densidad corporal, el agua corporal y el contenido
mineral óseo (%GrasaD,W,M) y el porcentaje de grasa estimado a partir
de la densidad corporal (%GrasaD) y la densidad de la masa libre de
grasa (DFFM). ○, mujeres no atletas; □, hombres no atletas; ●,
mujeres atletas; ■, hombres atletas. Ecuación de regresión: y=331.4.x - 364.7,
r=0.99, Error estándar de estimación=0.4% de la masa corporal.
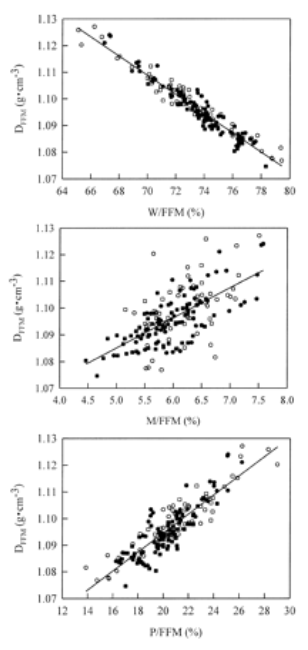
Figura 2. Arriba: correlación entre la DFFM y el contenido de
agua de la masa libre de grasa (W/FFM) expresado como un porcentaje de la masa
libre de grasa (FFM). Ecuación de regresión: y=-0.004x + 1.4, r=-0.96, Error
estándar de estimación=0.003 g/cm3. Medio: contenido mineral corporal
total expresado como un porcentaje de la FFM (M/FFM). Ecuación de regresión:
y=0.01.x + 1.0, r=0.65, Error estándar de estimación=0.008 g/cm3.
Abajo: contenido proteico corporal total expresado como un porcentaje de la FFM
(P/FFM). Ecuación de regresión: y=0.004.x + 1.0, r=0.89, Error estándar de
estimación=0.005 g/cm3. Ver pie de la Figura 1 para la explicación de
los símbolos.
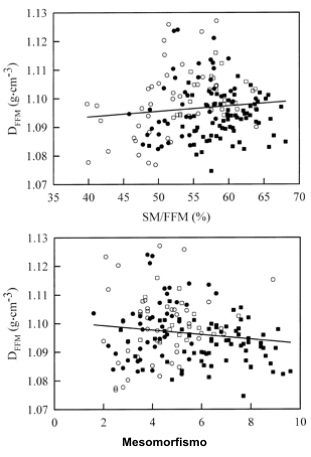
Figura 3. Arriba: Correlación entre la DFFM y la masa muscular
expresada como un porcentaje de la FFM (SM/FFMD,W,M). Ecuación de regresión:
y=0.0002.x + 1.086, r=0.11, Error estándar de estimación=0.01 g/cm3.
Abajo: índice de mesomorfia calculado a partir del somatotipo antropométrico de
Heath-Carter. Ecuación de regresión: y=- 0.0008.x + 1.1, r=-0.14, Error estándar
de estimación=0.01 g/cm3. Ver pie de la Figura 1 para la explicación
de los símbolos.
Los aspectos importantes de este estudio fueron la utilización de un modelo de composición corporal de cuatro componentes para valorar con precisión la FFM y su densidad y composición, y la utilización de DXA para obtener una medición de la masa muscular corporal total más directa en relación a los métodos disponibles en el pasado. Las hipótesis previas o estudios previos acerca del efecto de la muscularidad sobre la densidad y la composición de la FFM se han basado en las diferentes teorías (23), han asumido diferencias entre los grupos de atletas y no atletas (47), o se han basado en el índice de mesomorfia obtenido mediante el somatotipo antropométrico de Heath-Carter, el cual refleja tanto el desarrollo óseo como muscular (26).
En base a los datos del estudio de Modlesky et al. (26), hemos planteado la hipótesis acerca de que la muscularidad y el índice de mesomorfia estarían inversamente correlacionados con la DFFM. El principal hallazgo del presente estudio fue que, en esta gran y heterogénea muestra, las muscularidad y la mesomorfia no tuvieron correlación con la DFFM. Estos datos contrastan con los resultados de estudios previos que han hallado una asociación entre la muscularidad o el desarrollo musculoesquelético con la DFFM. Womersley et al. (47), utilizando valores de FFM derivados con espectrometría 40K, estimaron que la DFFM era menor en hombres y mujeres “musculados” que en hombres y mujeres sedentarios. En contraste, Vickery et al. (37) utilizando valores de FFM derivados de la densidad corporal estimada a partir de la medición de pliegues cutáneos, hallaron que los hombres de raza negra, que tenían un mayor índice de mesomorfia, también tenían una mayor DFFM estimada que los hombres de raza blanca. Ambos estudios calcularon la DFFM a partir de estimaciones de la FFM potencialmente imprecisas (i.e., modelo de dos componentes), lo cual pudo haber comprometido la validez de las estimaciones de la DFFM. Modlesky et al., sin embargo, calcularon la DFFM en base a estimaciones de la composición corporal utilizando el modelo de cuatro componentes y hallaron una correlación negativa, moderada y significativa (r=-0.64) entre la mesomorfia y la DFFM en una muestra de hombres blancos levantadores de pesas y de no atletas, con desarrollos musculares marcadamente diferentes. El mayor mesomorfismo en los levantadores de pesas estuvo asociado a una mayor valor del índice W/FFM y a una menor valor de los índices M/FFM y P/FFM en comparación con los sujetos controles. Sin embargo, su correlación pudo haber resultado de combinar dos grupos muy disimilares. Withers et al. (46) también reportaron una baja DFFM (1.094±0.003 g/cm3) en físicoculturistas con una muy alta mesomorfia (8.6±0.7). En el presente estudio, obtuvimos valores de mesomorfia que se encontraron en rango amplio y continuo. Asimismo, los hallazgos que hemos obtenido utilizando el índice de mesomorfismo fueron corroborados con una medición más directa y contemporánea de la masa muscular, lo cual refleja la variación solo en la muscularidad y no la variación en la combinación de desarrollo muscular y óseo. La falta de relación entre la muscularidad, el mesomorfismo y la DFFM probablemente se debió a la utilización de una muestra grande y heterogénea y puede reflejar las diferentes contribuciones relativas del tejido muscular y óseo a la DFFM en los subgrupos.
Se ha planteado la hipótesis durante mucho tiempo que ciertos atletas pueden tener una composición no característica de la FFM. Los físicos extremos y poco característicos requeridos para lograr el éxito en numerosos deportes y el intenso entrenamiento que con frecuencia acompaña la participación en el deporte, pueden alterar la composición de la FFM. Consecuentemente, los métodos para estimar la composición corporal que asumen proporciones constantes de FFM pueden ser imprecisos e inapropiados cuando se los aplica a ciertos atletas (20, 34). La densidad y la composición de la FFM de los atletas en relación a los valores asumidos han sido desconocidas por mucho tiempo. Se ha sugerido que los atletas que participan en entrenamientos de alta intensidad y en entrenamientos explosivos pueden tener una mayor M/FFM y DFFM que los no atletas (6, 2), mientras que algunos estudios sugieren que los atletas pueden tener mayores valores de W/FFM y DFFM que los no atletas (20, 26, 47). Nuestros datos respaldan ambas sugerencias hasta cierto punto, y sugieren que los atletas pueden tener una densidad y una composición de la FFM no característica y que depende del deporte practicado. En el presente estudio, los hombres atletas tuvieron una menor DFFM, causada por una menor M/FFM y una mayor W/FFM, que la asumida en base a los datos cadavéricos (5). Además, su DFFM fue significativamente menor que la observada en hombres no atletas. El valor de DFFM obtenido para las mujeres atletas como grupo y para los hombres y las mujeres no atletas no fue significativamente diferente del valor asumido de 1.1 g/cm3, aunque la composición de la FFM en cada uno de estos grupos difirió en cierta proporción de lo asumido. Sin embargo, las mujeres gimnastas tuvieron una DFFM significativamente mayor al valor asumido de 1.1 g/cm3, mientras que las mujeres nadadoras tuvieron una DFFM significativamente menor al valor de 1.1 g/cm3. Globalmente, estos hallazgos indican que la DFFM de los atletas puede ser mayor o menor que los valores asumidos y que la generalización entre los atletas en diferentes deportes no es posible.
Una densidad y una composición de la FFM no característica en los atletas podría reflejar una predisposición genética o podría reflejar los efectos del entrenamiento. Varios estudios han sugerido que la carga intensa y rítmica del sistema musculoesquelético, por medio del levantamiento de pesas u otro tipo de ejercicio vigoroso, provoca el incremento de la mineralización ósea (15, 36). En contraste, la descarga prolongada del sistema musculoesquelético, especialmente de las extremidades, puede causar la desmineralización (17). Se piensa, que dicha carga y descarga afecta la M/FFM y, consecuentemente, la DFFM. En el presente estudio, las mujeres gimnastas, cuyo entrenamiento implica la carga intensa del sistema esquelético corporal total, tuvieron mayores valores de DFFM y M/FFM y una menor W/FFM que los nadadores hombres y mujeres, cuyo entrenamiento implica la descarga relativa del sistema musculoesquelético y puede proveer un mayor estímulo para el incremento del agua corporal total (9). Los datos del presente estudio respaldan los datos obtenidos por Robinson et al. (32), quienes hallaron que las mujeres gimnastas de nivel universitario tenían una mayor densidad mineral ósea que las mujeres nadadoras de nivel universitario. Estos hallazgos respaldan indirectamente la idea de que el tipo de entrenamiento deportivo puede tener cierto efecto sobre la densidad y la composición de la FFM.
La alta DFFM de las mujeres gimnastas, causada por una W/FFM más baja y una P/FFM mas alta que las asumidas y una M/FFM mayor que la de los otros grupos de atletas y no atletas, fue particularmente interesante, ya que fue diferente del patrón observado en los otros grupos de atletas. Su bajo valor de W/FFM no estuvo relacionado a una baja SM/FFM, la cual, aunque más baja que en los hombres atletas y no atletas, fue similar a la observada en las otras mujeres atletas y mayor a la observada en las mujeres no atletas. Su bajo valor de W/FFM podría haber reflejado un estado de hipohidratación; sin embargo, esto parece improbable ya que el peso específico de la orina (1.023±0.006 g/ml) no difirió marcadamente de los valores observados en los otros sujetos (1.020±0.009 g/ml), y no hubo ninguna indicación de que no se adhirieran a las instrucciones diseñadas para asegurar la hidratación normal. La relativamente alta M/FFM reflejó un BMC relativamente alto, probablemente resultante del tipo de entrenamiento que realizan estas atletas y que fue discutido previamente. La razón de una alta P/FFM no es clara, aunque indudablemente refleja en parte la relativamente baja W/FFM y la relativamente alta M/FFM, ya que la suma de las fracciones componentes es igual a 1.0.
En base a que los jugadores de fútbol americano realizan entrenamientos de la fuerza de alta intensidad, nosotros esperamos que tuvieran una composición de la FFM similar a la de los levantadores de pesas del estudio de Modlesky et al. (2), i.e., una relativamente baja M/FFM y una ligeramente alta W/FFM, y esto fue hallado. La composición de la FFM de los jugadores de fútbol americano puede reflejar el mayor estímulo provocado por su entrenamiento de sobrecarga para el incremento del agua corporal (7), lo cual puede estar asociado con la hipertrofia muscular (2) o con el incremento en el contenido de agua en el músculo debido al incremento en el glucógeno muscular (30) lo cual tiende a incrementar la W/FFM y a reducir la M/FFM y la P/FFM. Los jugadores de fútbol americano tuvieron el mayor valor de SM/FFM y el mayor índice de mesomorfia respecto de cualquiera de los grupos de atletas. La gran masa muscular y la baja DFFM en los jugadores de fútbol americano pueden sugerir que, en este grupo, estas dos variables estén inversamente relacionadas. Es posible que la masa muscular deba incrementarse marcadamente antes de que tenga un efecto sistemático sorbe la W/FFM y sobre la DFFM. Sin embargo, la hipertrofia del músculo esquelético, si es que tiene un efecto, no es la única causa de una alta W/FFM y una baja DFFM en atletas. Los hombres y mujeres nadadores tuvieron mayores valores medios de W/FFM y menores valores medios de DFFM que los jugadores de fútbol americano, pero menores valores de SM/FMM y de mesomorfia. Aunque los gimnastas tuvieron valores de SM/FFM y de mesomorfia intermedios en comparación con los otros grupos de atletas y los no atletas, su W/FFM fue marcadamente menor y la DFFM marcadamente mayor que la de los otros grupos. Por lo tanto nuestros resultados son consistentes con la hipótesis de que diferentes tipos de entrenamientos pueden tener diferentes efectos sobre la densidad y la composición de la FMM pero indican que estos efectos son complejos y no simplemente reflejan las diferencias en la muscularidad o en el desarrollo musculoesquelético.
La variabilidad en la DFFM en la muestra total (DE=0.010 g/cm3) fue igual a la estimada para la población general por Siri (35). La variación estimada por Siri en la DFFM se basó en la variación estimada de la W/FFM y en la relación entre el contenido mineral y el contenido proteico. En el presente estudio, la variación en la W/FFM en todos los sujetos (DE=2.7% de la FFM) fue mayor que la estimada por Siri (±2%) para poblaciones generales, mientras que la varianza en la relación contenido mineral/contenido proteico (±0.04) fue menor que la estimada por Siri (±0.010). Para nuestra sorpresa el DE de la DFFM en nuestra muestra no fue mayor que el estimado por Siri, dadas las características poco comunes de los atletas incluidos. Sin embargo, aunque en el grupo de atletas se observaron desviaciones sistemáticas en los valores medios de la DFFM a partir del valor de 1.1 g/cm3, los valores individuales de la DFFM en los atletas estuvieron dentro del rango observado para los no atletas. El DE de la DFFM en los hombres y mujeres atletas (DE=0.007 y 0.011 g/cm3) no fue mayor que la observada en los hombres y mujeres no atletas (DE=0.006 y 0.013 g/cm3; Tabla 2). Lohman (19) sugirió que en un grupo homogéneo la variabilidad de la DFFM debería ser menor (DE ~ 0.006 g/cm3) que la estimada por Siri para poblaciones generales. Asimismo, si hubiera diferencias sistemáticas en la DFFM entre los subgrupos de una población general, se podrían obtener estimaciones más precisas de la composición corporal mediante la utilización de densitometría y la ecuación de Siri modificada, siempre que se conozca la media de DFFM. Nuestros hallazgos con los atletas de diferentes deportes respaldan esta sugerencia. En los atletas, cuyo número era suficiente como para permitir un análisis significativo (Tabla 2), el DE de la DFFM para los atletas de un deporte determinado estuvo en el rango de 0.005 a 0.007 g/cm3, y se observó una desviación significativa del valor medio de DFFM a partir de los valores asumidos y de los grupos de referencia. Las diferencias entre el %GrasaD y el %GrasaD,W,M de 2.5-5.0% en estos atletas indican que la desviación de la DFFM del valor asumido de 1.1 g/cm3 en la ecuación de Siri resulta en errores substanciales durante la estimación del porcentaje de grasa mediante densitometría. En teoría, la utilización de una modificación de la ecuación de Siri en base a valores de DFFM específicos para los atletas de estos deportes podría eliminar esta fuente de error. Sin embargo, se necesitan más investigaciones con atletas de deportes específicos para confirmar nuestros datos y para establecer si la utilización de valores de DFFM para deportes específicos justifica la derivación de una modificación a la ecuación de Siri.
La variabilidad de la DFFM estuvo más fuertemente relacionada a la varianza en la W/FFM que a la varianza en la M/FFM. Considerada independientemente, el agua explicó el 93% y el contenido mineral explicó el 42% de la varianza en la DFFM. Este hallazgo es similar al obtenido por otros investigadores (4, 26, 40) y respalda la hipótesis de que, de los diferentes componentes químicos de la FFM, la variabilidad en el contenido de agua tiene el mayor efecto sobre la DFFM (3, 19). Otros investigadores han argumentado es el contenido mineral, por su mayor densidad (3.038 g/cm3 a 36°C) en comparación con el agua (0.9937 g/cm3), tiene un mayor impacto sobre la DFFM que el agua (23, 24, 41). En base a los análisis de regresión de los datos del presente estudio, el 1% de cambio en el M/FFM (desde 5 al 6% de la FFM) estuvo asociado a un cambio tres veces mayor en la DFFM en comparación con el cambio del 1% en la W/FMM (desde el 72 al 73% de la FMM). Sin embargo, la variabilidad en la W/FFM en la muestra total fue de 4.5 veces la variabilidad de la M/FMM (DE=2.7 vs. 0.6%). Además, el agua ocupa una proporción ~11 veces mayor a la que ocupa el mineral respecto de la FFM. Los valores absolutos para la estimación de la densidad y la composición de la FFM son afectados por el método utilizado para obtener los datos del contenido mineral óseo. Tothill et al. (37) demostraron que los densitómetros óseos de diferentes fabricantes y con diferentes versiones de programas de los mismos fabricantes, resultan en diferentes estimaciones del contenido mineral óseo. El densitómetro Lunar DPX-L (versión del programa 1.3Z) ha mostrado medir una densidad mineral ósea en promedio 11% mayor que el densitómetro y la versión del programa utilizados en el presente estudio (Hologic QDR-1000W, Enhanced Whole Body Analysis software version 5.71) (28). Si las estimaciones del contenido mineral óseo fueron un 11% mayores en este estudio, entonces la M/FFM y la W/FMM se incrementarían, la P/FFM se reduciría, y la DFFM se incrementaría desde 1.097 a 1.099 g/cm3 (27). Aunque el error potencial en la medición del contenido mineral óseo podría afectar los valores absolutos de la densidad y la composición de la FFM, no afectaría las diferencias relativas entre los grupos o las relaciones con la muscularidad y el mesomorfismo. Se necesitan investigaciones adicionales sobre la validez de las estimaciones del contenido mineral óseo y de la composición corporal a partir de diferentes densitómetros óseos para resolver esta cuestión.
La variación biológica día a día y los errores técnicos en cada una de las mediciones utilizadas para estimar la DFFM, el %GrasaD y el %GrasaD,W,M también contribuyen a las diferencias día a día en las estimaciones de la composición corporal. De particular preocupación en los estudios de validación en los cuales se ha utilizado el modelo de cuatro componentes como criterio, ha sido que la probable propagación de errores asociados con las tres mediciones utilizadas en el cálculo de la DFFM y el %GrasaD,W,M pueda ir en contra de las ventajas de medir más fuentes de variabilidad de la DFFM. Nosotros (26) y otros investigadores (12), sin embargo, hemos reportado que los errores asociados con estas mediciones son bastante pequeños, con desviaciones estándar intra-sujeto para las mediciones repetidas de la DFFM, y el %GrasaD,W,M de ~0.002 g/cm3 y 1% de la BM, respectivamente.
Nosotros valoramos la masa muscular corporal total a partir del tejido blando apendicular determinado mediante DXA (43). Esta aproximación asume que el tejido blando magro determinado con DXA es músculo esquelético y que el músculo esquelético apendicular representa una porción constante (79%) de la masa muscular corporal total. Los estudios de validación han mostrado que el tejido blando determinado mediante DXA tiene una alta correlación, aunque sobreestima, la masa muscular apendicular medida por medio de barridos de CT en hombres y mujeres, principalmente debido a que la medición con DXA incluye la piel, el tejido conectivo y los componentes no grasos del tejido adiposo que no son incluidos en el volumen de músculo esquelético y en la masa determinada mediante el barrido con CT (18, 39, 42, 43). Aunque se han desarrollado aproximaciones más sofisticadas para cuantificar estos componentes no musculares (42), nosotros elegimos utilizar la ecuación de regresión propuesta por Wang et al. (43), la cual predice la masa muscular corporal total determinada por medio de barridos de CT a partir del tejido blando magro apendicular determinado mediante DXA. Esta predicción corrige la sobreestimación y provee una estimación precisa de la masa muscular esquelética en una muestra limitada de hombres blancos no atletas (r=0.95, Error estándar de estimación=2.1 kg). La principal limitación es que la validez con atletas, mujeres y otros grupos étnicos, no ha sido establecida. Es posible que los componentes no musculares del tejido blando magro determinado mediante DXA y que la relación de músculo apendicular/músculo esquelético corporal total puedan ser algo diferentes a los de la muestra de Wong et al.
Por lo tanto, concluimos que, en una muestra heterogénea de hombres y mujeres jóvenes atletas y no atletas, la DFFM y la precisión de las estimaciones de la composición corporal a partir de la densidad corporal utilizando la ecuación de Siri no se relacionan con la muscularidad o con el desarrollo musculoesquelético. Los atletas de diferentes deportes pueden mostrar desviaciones sistemáticas en la DFFM con respecto del valor asumido de 1.1 g/cm3 en la ecuación de Siri, lo que resulta en un error medio grupal en la estimación del %GrasaD de 2-5% de la masa corporal, pero la causa de estas desviaciones es compleja y no es simplemente el reflejo de diferencias en la muscularidad o en el desarrollo musculoesquelético.
Dirección para el pedido de reimpresiones y otra correspondencia
B. M. Prior, Dept. of Veterinary Biomedical Sciences, E102 Vet Med Bldg., University of Missouri-Columbia, Columbia, MO 65211 (correo electrónico: priorb@missouri.edu).
Referencias
1. Allen TH, Krzywicki HJ, and Roberts JE (1959). Density, fat, water, and solids in freshly isolated tissues. J Appl Physiol 14: 10051008
2. Arngrımsson SA, Evans EM, Saunders MJ, Ogburn CLI, Lewis RD, and Cureton KJ (2000). Validation of body composition estimates in male and female distance runners using estimates from a four-component model. Am J Hum Biol 12: 301314
3. Bakker HK and Struikenkamp RS (1977). Biologic variability and lean body mass estimates. Hum Biol 49: 187202
4. Baumgartner RN, Heymsfield SB, Lichtman S, Wang J, and Pierson RN Jr (1991). Body composition in elderly people: effect of criterion estimates on predictive equations. Am J Clin Nutr 53: 13451353
5. Brozek J, Grande F, Anderson JT, and Keys A (1963). Densitometric analysis of body composition: revision of some quantitative assumptions. Ann NY Acad Sci 110: 113140
6. Bunt JC, Going SB, Lohman TG, Heinrich CH, Perry CD, and Pamenter RW (1990). Variation in bone mineral content and estimated body fat in young adult females. Med Sci Sports Exerc 22: 564569
7. Campbell WC, Crim MC, Young VR, and Evans WJ (1994). Increased energy requirements and changes in body composition with resistance training in older adults. Am J Clin Nutr 60:167175
8. Carter JEL and Heath BH (1990). SomatotypingDevelopment and Applications. Cambridge, UK: Cambridge University Press, p. 374
9. Convertino VA (1991). Blood volume: its adaptation to endurance training. Med Sci Sports Exerc 23: 13381348
10. DeLuca JP and Friedl KE (1992). Validation of a simplified method of total body water measurement using deuterium oxide and diffusion dish purification (Abstract). Med Sci Sports Exerc 24, Suppl: S8
11. Forbes GB (1987). Human Body Composition: Growth, Aging, Nutrition, and Activity. London: Springer-Verlag, p. 153195
12. Friedl KE, DeLuca JP, Marchitelli LJ, and Vogel JA (1992). Reliability of body-fat estimations from a four-component model by using density, body water, and bone mineral measurements. Am J Clin Nutr 55: 764770
13. Going SB (1996). Densitometry. In: Human Body Composition, edited by Roche AF, Heymsfield SB, and Lohman TG. Champaign, IL: Human Kinetics, p. 324
14. Goldman RF and Buskirk ER (1959). Body volume measurement by underwater weighing: description of a method. In: Techniques for Measuring Body Composition, edited by Brozek J. Washington, DC: Natl. Acad. Sci., p. 7889
15. Heinonen A, Oja P, Kannus P, Sievanen H, Manttari A, and Vuori I (1993). Bone mineral density of female athletes in different sports. Bone Miner 23: 114
16. Ho CP, Kim RW, Schaffler MB, and Satoris DJ (1990). Accuracy of dual-energy radiographic absorptiometry of the lumbar spine: cadaver study. Radiology 176: 171173
17. Krolner B and Toft B (1983). Vertebral bone loss: an unheeded side effect of therapeutic bed rest. Clin Sci (Colch) 64: 537540
18. Levine JA, Abboud L, Barry M, Reed JE, Sheedy PF, and Jensen MD (2000). Measuring leg muscle and fat mass in humans: comparison of CT and dual-energy X-ray absorptiometry. J Appl Physiol 88: 452456
19. Lohman TG (1981). Skinfolds and body density and their relation to body fatness: a review. Hum Biol 53: 181225
20. Lohman TG (1984). Research progress in validation of laboratory methods of assessing body composition. Med Sci Sports Exerc 16: 596603
21. Lohman TG (1986). Applicability of body composition techniques and constants for children and youths. In: Exercise and Sport Sciences Reviews, edited by Pandolf K. New York: Macmillan, p. 325357
22. Lohman TG (1992). Advances in Body Composition Assessment. Champaign, IL: Human Kinetics, p. 1150
23. Martin AD and Drinkwater DT (1991). Variability in the measures of body fat: assumptions or technique. Sports Med 11: 277288
24. Mazess RB, Peppler WW, and Gibbons M (1984). Total body composition by dual-photon (153Gd) absorptiometry. Am J Clin Nutr 40: 834839
25. Mendez J, Keys A, Anderson JT, and Grande F (1960). Density of fat and bone mineral of the mammalian body. Metabolism 9: 472477
26. Modlesky CM, Cureton KJ, Lewis RD, Prior BM, Sloniger MA, and Rowe DA (1996). Density of the fat-free mass and estimates of body composition in male weight trainers. J Appl Physiol 80: 20852096
27. Modlesky CM, Evans EM, Millard-Strafford ML, Collins MA, Lewis RD, and Cureton KJ (1999). Impact of bone mineral estimates on percent fat estimates from a four-component model. Med Sci Sports Exerc 31: 18611868
28. Modlesky CM, Lewis RD, Yetman KA, Rose B, Rosskopf LB, Snow TK, and Sparling PB (1996). Comparison of body composition and bone mineral measurements from two DXA instruments in young men. Am J Clin Nutr 64: 669676
29. Modlesky CM, Prior BM, Lewis RD, and Cureton KJ (1997). Measurement of body composition in tall individuals using dualenergy X-ray absorptiometry (Abstract). Med Sci Sports Exerc 29 Suppl: S37
30. Olsson K-E, and Saltin B (1970). Variation in total body water with muscle glycogen changes in man. Acta Physiol Scand 80: 1118
31. Penn I, Wang Z, Buhl KM, Allison DB, Burastero SE, and Heymsfield SB (1994). Body composition and two-compartment model assumptions in male long distance runners. Med Sci Sports Exerc 26: 392397
32. Robinson TL, Snow-Harter C, Taaffe DR, Gilllis D, Shaw J, and Marcus R (1995). Gymnasts exhibit higher bone mass than unners despite similar prevalence of amenorrhea and oligomenorrhea. Bone Miner Res 10: 2635
33. Schoeller DA (1996). Hydrometry. In: Human Body Composition, edited y Roche AF, Heymsfield SB, and Lohman TG. Champaign, L: Human Kinetics, p. 2544
34. Sinning WE (1996). Body composition in athletes. In: Human Body omposition, edited by Roche AF, Heymsfield SB, and Lohman G. Champaign, IL: Human Kinetics, p. 257274
35. Siri WE (1961). Body composition from fluid spaces and density: análisis f methods. In: Techniques for Measuring Body Composition, dited by Brozek J and Henschel A. Washington, DC: Natl. cad. Sci., p. 223244
36. Snow-Harter C, Bouxsein ML, Lewis BT, Carter DR, and arcus R (1992). Effects of resistance and ndurance exercise on bone ineral status of young women: a randomized exercise intervention rial. J Bone Miner Res 7: 761769
37. Tothill P, Avenell A, and Reid DM (1994). Precision and accuracy of easurements of whole-body bone mineral: comparisons between ologic, Lunar and Norland dual-energy X-ray absorptiometers. R J Radiol 67: 12101217
38. Vickery SR, Cureton KJ, and Collins MA (1988). Prediction of body ensity from skinfolds in black and white young men. Hum Biol 0: 135149
39. Visser M, Fuerst T, Lang T, Salamone L, and Harris TB (1999). Alidity of fan-beam dual-energy X-ray absorptiometry for measuring at-free mass and leg muscle mass. J Appl Physiol 87: 5131520
40. Visser M, Gallagher D, Deurenberg P, Wang J, Pierson N, and Heymsfield SB (1997). Density of fat-free body mass: relationship with race, age, and level of body fatness. Am J Physiol ndocrinol Metab 272: E781E787
41. Wang J, Heymsfield SB, Aulet M, Thornton JC, and Pierson N (1989). Body fat from body density: underwater weighing vs. ual-photon absorptiometry. Am J Physiol Endocrinol Metab 56: E829E834
42. Wang W, Wang Z, Faith MS, Kotler D, Shih R, and Heymsfield B (1999). Regional skeletal muscle measurement: evaluation of ew dual-energy X-ray absorptiometry. J Appl Physiol 87: 1163 171
43. Wang ZM, Visser M, Ma R, Baumgartner RN, Kotler D, allagher D, and Heymsfield SB (1996). Skeletal muscle mass: evaluation f neutron activation and dual-energy X-ray absorptiometry ethods. J Appl Physiol 80: 824831
44. Wilmore JH (1983). Body composition in sport and exercise: directions or future research. Med Sci ports Exerc 15: 2131
45. Withers RT, LaForgia J, Pillans RK, Shipp NJ, Chatterton E, Schultz CG, and Leaney F (1998). Comparisons of two-, three, and four-compartment models of body composition analysis in men and women. J Appl Physiol 85: 238245
46. Withers RT, Noell CJ, Whittingham NO, Chatterton BE, Schultz CG, and Keeves JP (1997). Body composition changes in elite male bodybuilders during preparation for competition. Aust J Sci Med Sport 29: 1116
47. Womersley J, Durnin JVGA, Boddy K, and Mahaffy M (1976). Influence of muscular development, obesity, and age on the fat-free mass of adults. J Appl Physiol 41: 223229