Patrones de Desaturación Ergoespirométricos en Futbolistas de 2ª División B
Raúl P Garrido Chamorro1, Marta González Lorenzo2, José Sirvent Belando3 y Manuel García Vercher1
1Servicio de Apoyo al Deportista del Centro de Tecnificación de Alicante.
2Hospital General de Alicante. Área de Urgencias de Traumatología.
3Departamento de Química, Analítica, Nutrición y Bromatología de la Universidad de Alicante.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2005.
Publicado 19 de septiembre de 2005
Resumen
Palabras clave: patrones, desaturación, deportistas, sexo
INTRODUCCION
Cuando realizamos una ergoespirometría, nos centramos en valorar el volumen de oxígeno que un deportista introduce en sus pulmones por unidad de tiempo (VO2ml/min). Pero ésta no es la cantidad que el músculo de nuestro deportista puede utilizar durante el ejercicio (1). Debido a que las diferencias entre difusión y perfusión limitan la cantidad de oxígeno (O2) que llevan sus hematíes (2). Para valorar la cantidad de O2 que transporta la sangre usamos la saturación de oxígeno. La oximetría de pulso (medición no invasiva de la saturación arterial) es actualmente un importante método de la monitorización no invasiva de la saturación arterial porque ofrece una lectura confiable y constante de la saturación de la hemoglobina arterial (21).
El interés por la medida de la oxigenación de los pacientes es muy antiguo. En 1930 se empieza ya a investigar sobre la Saturación de oxígeno (SO2) mediante la absorción de luz. En la II Guerra Mundial se renueva el interés, ante los graves accidentes por hipoxia de los pilotos de aviación (38). En 1950, Clark diseña su electrodo de PO2 construido con un ánodo de plata-cloruro de plata, y un cátodo de plata, con un voltaje de polarización entre ambos de -0,6 Voltios. En 1960, con la idea original de Millikan (39), se diseña el primer oxímetro, comercializándose en 1970 un equipo con un sensor o pieza de oreja, que funcionaba con ocho longitudes de onda, apareciendo también en 1970, un catéter de fibra óptica para medir in vivo la saturación en la arteria pulmonar. En 1972, la Universidad de Washington diseña un equipo para medir la saturación de oxígeno en la arteria umbilical, comercializándose una de las marcas pioneras, en 1977. A partir de 1981, el mercado se inunda de pulsioxímetros, existiendo (40) en 1992, más de 35 firmas que los comercializan, pasando la pulsioximetría a ser el quinto signo vital. La pulsioximetría (38) diseñada al mismo tiempo (1972), que los equipos de PO2 transcutánea ha tardado en desarrollarse y comercializarse 10 años, pero ha inundado las UVI móviles, las salas de urgencia, reanimación y cuidados intensivos. Para finalmente empezar a formar parte del material de evaluación deportiva en los ultimos años. Los pulsioxímetros, mal calificados de saturímetros, y mejor tipificados como centinelas de la rodilla o pendiente de la curva de asociación-disociación del O2 con la Hb, representan un medio incruento de seguir la tendencia de la Saturación de oxígeno.
Vamos a comenzar recordando unos aspectos fisiológicos que pueden ser importantes para la compresión de nuestro artículo.
Regulación de la Respiración (47)
El mantenimiento del equilibro homeostático (48) en cuanto al PO2, al PCO2 y al pH en la sangre requiere un alto grado de precisión. Con una importante coordinación entre los aparato circulatorio y respiratorio. La mayoría de esta coordinación (48) se produce de manera involuntaria. Los músculos respiratorios (48) están bajo el control directo de las neuronas motoras, que a su vez están reguladas por el centro respiratorio. A nivel del sistema nervioso central existe un grupo de neuronas determinadas que forman el llamado: Centro respiratorio Bulbar (Bulbo raquídeo y protuberancia). Estos centros establecen el ritmo y la profundidad de la respiración. La profundidad y el ritmos respiratorio, varían a lo largo de la prueba de esfuerzo, dicho ritmo y dicha profundidad deben de ser adecuados al esfuerzo que el deportista esta realizando si dichos parámetros no son adecuados no conseguiremos una rendimiento respiratorio optimo, y por tanto observaremos cubetas de desaturación a lo largo de la prueba de esfuerzo.
Además este centro va a tener 5 grupos de centros neuronales:
- Zona inspiratoria: Que controlará el ritmo inspiratorio normal (frecuencia) de 12 respiraciones/minuto. La expiración ocurrirá de forma pasiva. Esta solo será así si se estimula la zona inspiratoria.
- Zona expiatoria: Este centro en condiciones de reposo va a estar inactivo y solo se requerirá cuando sea una expiración activa.
- Zona neumotóxica: Esta zona limitaría la profundidad de la expiración y aumentaría la frecuencia ventilatoria (respiraciones frecuentes y poco profundas). Este centro es lo que se llama centro del jadeo.
- Zona apneusica: Su estimulación produce inspiraciones muy profundas.
- Zona quimiosensible: Esta zona va ser sensible a cambios de determinados parámetros químicos, como por ejemplo las concentraciones de CO2 o de los hidrogeniones, etc... Cuando esto niveles aumentan, se envían señales al centro inspiratorio ordenándoles incrementar la eliminación de dióxido de carbono y de hidrogeniones.
No obstante estro centro no actúan solos en el control de la respiración. Su regularon también está determinada por el cambiante ambiente químico de cuerpo (48).
Factores que influyen en la regulación de la respiración (47)
Factores químicos
La concentración o presión parcial del CO2 y O2 en la sangre, además del PH o concentración de hidrogeniones. La concentración de hidrogeniones y el CO2 va a activar la zona quimiosensible bulbar, de tal manera que cuando hay un aumento de la presión de CO2 en sangre, se produce una activación ventilatoria, por lo que se consigue eliminar el CO2, el cual se difunde a través de la membrana alveolar. Si por el contrario sucede que hay una disminución de la presión parcial de CO2, sucede todo lo contrario. Si disminuye el PH de la sangre hay un aumento de la concentración de hidrogeniones y por lo tanto habrá un aumento de la concentración de CO2, por lo que se activará la respiración.
CO2 + H2O Ā ↔ CO3H2 ↔ CO3H- + H+
También la disminución del PH es un estímulo directo sobre la zona quimiosensible bulbar que activará la respiración. El CO2 y el PH llevan a cabo el control químico central. Existe un control químico periférico que se activa cuando hay modificaciones en la concentración del O2 en sangre y estos cambios se detectan a nivel de unos receptores quimiosensibles periféricos localizados en el callado aórtico y el seno carótideo. Cuando baja la presión de O2, se produce una activación ventilatoria, mediante la activación del Centro respiratorio Bulbar. Existe una particularidad con el CO2, ya que la zona quimiosensible bulbar es capaz de acostumbrarse a convivir con presiones de CO2 altas o bajas, mientras que estas sean continuas. Esta zona detecta los cambios agudos. Los quimioreceptores no se acostumbran a presiones bajas de O2. Si esto ocurriera, estaríamos pues ante una presión crónica. Existe pues una relación entre la actividad muscular y la activación ventilatoria y esta relación se piensa que tiene que ser de tipo nervioso y se ha especulado que sea mediante dos vías: Que junto con la orden motora que salga de forma voluntaria o involuntaria de la zona que controla la actividad motora se active también el centro respiratorio bulbar.
Del propio sistema músculo tendinoso. La sola activación de un miembro puede estimular el centro nervioso bulbar por alguna vía nerviosa. Parece ser que hay unas vías nerviosas que informan al centro respiratorio bulbar de la actividad muscular. Receptores sensibles localizados a cualquier nivel del aparato esquelético-muscular informando y activando al centro respiratorio bulbar. A partir del movimiento voluntario del sistema músculo-esquelético y a través de la corteza motora cerebral se estimularía el centro respiratorio bulbar.
Si la disminución de la respiración es de forma voluntaria, como consecuencia del aumento de CO2 y de la disminución de O2 se produciría un reflejo de activación de la respiración. Mecanismo reflejo. El control químico central y periférico es involuntario.
La membrana respiratoria
Es el espacio que existe entre la sangre y el aire alveolar, en definitiva es el territorio que deben de atravesar el O2 y CO2. Consideramos (47) difusión pulmonar al intercambio de gases en los pulmones, este tiene dos finalidades importantes 1) reemplazar el aporte de oxigeno de la sangre que se ha agotado al nivel de los tejidos donde se utiliza para la producción de energía oxidativa. 2) elimina el dióxido de carbono de la sangre que regresa. ¿Que estratos deben de atravesar los gases?. Contando desde el lado alveolar, en primer lugar nos encontraremos con:
Una capa de líquido y sufactante → Epitelio alveolar → Membrana basal epitelial → Espacio intersticial → Membrana basal capilar → Endotelio capilar
La membrana respiratoria tiene un espesor de 0'6 micras u y una superficie total de 160m2. Difusión de gases a través de la membrana respiratoria. Como hemos dicho anteriormente la membrana respiratoria es el tejido por el que los gases van pasar desde el alvéolo al capilar mediante la difusión.
Factores de los que depende la difusión
El grosor o espesor de la membrana: Pueden existir situaciones patológicas que engrosen anormalmente la membrana como por ejemplo una fibrosis, un edema pulmonar, que dificulten la difusión gaseosa a través de la membrana respiratoria. La superficie de la membrana (160m2). Cuando se reduce la difusión por la reducción de la membrana (extirpación de una parte del pulmón o de todo e mismo) puede afectar de manera importante a la difusión. También cuando se produce una vaso dilatación una vaso constricción pulmonar se produce una disminución o aumento de la membrana respiratoria. El coeficiente de difusión de gas depende de la solubilidad del gas directamente y es inversamente proporcional al peso molecular del gas. El Coeficiente de difusión del CO2 es 20 veces mayor que el del O2, lo cual explica que el CO2 es más soluble que el O2. El Gradiente de presión a un lado y a otro de la membrana: A mayor gradiente (diferencia de presiones / concentraciones) mayor difusión y viceversa.
El Coeficiente ventilación / perfusión Va/Q (47)
En condiciones normales existe un adecuado equilibrio entre el aire que lega a una zona de alvéolos pulmonares y la cantidad de sangre que llega a ese territorio pulmonar. Ahora bien, no todas las zonas del pulmón están igualmente ventiladas (en condiciones normales el aire no se renueva uniformemente), además de la misma manera a zonas habrán zonas no estén igualmente perfundidas, por lo que habrá de haber un equilibrio entre estas zonas mal perfundidas y poco ventiladas. Si se ventilaran zonas poco perfundidas, el rendimiento en el intercambio de sangre no va ser el adecuado, es decir no se van a oxigenar adecuadamente esta sangre que se encuentra en zonas mal perfundidas. Aumenta lo que se denomina espacio muerto (No hay intercambio gaseoso). Si Q → 0 Va/Q → infinito (aumenta el espacio muerto). Si no se ventilan zonas bien perfundidas Va → 0 Va/Q → 0 y en estas condiciones la sangre que pasa por los pulmones se arterializará (habrá una mezcla de sangre arterial con sangre venosa), por lo que aumentará la concentración de CO2 y disminuirá la de O2.
Presiones de O2 en los pulmones, sangre y tejidos
En condiciones normales la presión del N2 no tiene influencias, salvo en condiciones específicas como para los practicantes de buceo, en los que un aumento elevado de N2 tiene gravísimas consecuencias. Como sabemos los gases difunden del lado de mayor presión al de menos. Podríamos preguntarnos ¿que pasa con el intercambio gaseoso y como llega la sangre venosa a la zona alveolar?. La presión del O2 a nivel alveolar es de 104mm. Hg. La presión del O2 a nivel del capilar pulmonar es de 40mm. Hg. Como consecuencia de la diferencia de presiones existe un intercambio gaseoso de O2 entre el alvéolo y el capilar, de forma que cuando ha realizado 1/3 de su recorrido las presiones se han igualado. Este equilibrio se logra forma muy rápida y una vez la Pr.O2 capilar (104mm. Hg) Pr. O2 alveolar (104mm. Hg), la sangre que abandona el pulmón sale con una concentración de 104mm. Hg. Esta sangre recibe en su viaje de retorno al corazón, a la sangre de territorio bronquial (la que irriga a los pulmones), la cual no ha tenido intercambio, por lo cual aparece en la aorta una Presión menor (97mm. Hg), y en estas condiciones llega al tejido capilar que va a irrigar. La Presión que existe en el espacio intersticial (entre el capilar (sangre) y la célula) es de 40mm. Hg, por lo cual la sangre pasará por difusión al espacio intersticial. Una vez aquí habrá un intercambio gaseoso con el LIC. (líquido intracelular) que posee una presión de O2 de 25mm. Hg y por otro lado a través del espacio intersticial llegará a los capilares pulmonares con lo cual se reanudará el ciclo. Con presiones tan bajas como 3mm. Hg, son suficientes para mantener el mecanismo aeróbico (reacciones oxidativas) de la (ciclo de Krebbs), por lo que si en condiciones normales el LIC. se encuentra a 25mm. Hg, existe un gran margen de seguridad.
El oxígeno se transporta en la sangre disuelto físicamente en el plasma, fracción menor cuantificada por la gasometría como PO2, y esencial y fundamentalmente, combinado con la hemoglobina en una proporción dependiente de la concentración total de Hb (ctHb), de una constante (1,34 a 1,39), y de la saturación de oxígeno (SO2). Al ser mayor la proporción del oxígeno que se transporta combinado a la hemoglobina, así como porque hay hemoglobinas que no son eficaces transportadoras de oxígeno.
El transporte de oxígeno en la sangre arterial, depende del gasto cardiaco y del contenido arterial de oxígeno:
CaO2= {(Hb x 1,34 x SO2) + (PaO2 x 0,0031)}
Con los valores consiguientes en sangre venosa para estimar el Contenido venoso de oxígeno (CvO2). En la Saturación de oxígeno en sangre venosa mixta (SvO2) influyen una serie de factores relacionados con el consumo de oxígeno (VO2), el gasto cardiaco (Qt), y la extracción de oxígeno. Aquellas situaciones en que la SvO2 disminuya o aumente, van a influir en el producto final, el aporte tisular (DO2) y la extracción tisular de oxígeno (EO2), sin olvidar que al aumentar la PvO2 disminuye la protectora vasoconstricción hipóxica, lo que aumentaría el shunt. Por su trascendencia, se recuerda a continuación la definición de algunos índices informativos del aporte y extracción de oxígeno usados en la práctica diaria:
1. Aporte o Delivery de O2
DO2= Gasto cardiaco(en L) x (CaO2) en ml/100 x 10
El valor normal es 950-1150ml/min, ó 500-600ml/min/m2 , siendo 10 el factor que convierte el CaO2 de ml/100 en ml/1000.
2. Contenido o diferencia arterio-venosa de O2
C(a-v)O2= CaO2 - CvO2
Valor normal 4-6ml% ó Vol %.
3. Extracción de oxígeno
(EO2)= 100 x VO2/DO2=100 x C(a-v)O2/CaO2.
Valor normal 0.23-0,32%
Px = PO2 uncompensated=PO2 (uv)
Esta sigla corresponde a la Presión de oxígeno venosa mixta (PvO2) no compensada, es decir, la PO2 hipotética requerida para que se extraigan 2,3mmol/L (5,1 volúmenes%) de oxígeno. Se calcula, cuando no se dispone de una muestra de sangre venosa mixta de arteria pulmonar, restando del CaO2, la diferencia arterio-venosa normal de 5,1 vol%.
Cx: Concentración de O2 extraible
Es decir la concentración o cantidad de oxígeno que puede extraerse en condiciones de pH, PCO2, y temperatura normales constantes, a PO2 de 38mmHg. El valor normal es de 5,1 vol%, y se calcula restando del CaO2, la Concentración de oxígeno a PO2 38mmHg, a la misma PCO2 y pH actuales del paciente.
4. Factor de compensación cardiaco del oxígeno
Qx= CQ= 2,3/CX
El factor que debe aumentar el gasto cardiaco para mantener una PvO2 normal, en presencia de un consumo de oxígeno constante. El valor normal sería 1, cuando Cx=2,3mmol/L= 5,1 Vol%.
Los tres índices o cálculos anteriores funcionan bien siempre que la SO2 sea menor del 97%, sirviendo para diferenciar las posibles compensaciones en la oxigenación de deportistas hipoxémicos.
4.a. P50
Define la posición de la curva de asociación-disociación de la Hb, y es la PO2 que corresponde a una SO2 del 50%, y que normalmente es de 26,84. La relación es inversa entre el valor de P50 y la afinidad de la Hb por el oxígeno: a mayor valor de P50, menor afinidad, más facilidad de disociación o descarga de oxígeno, lo que ocurre en acidosis, hipercapnia o hipertermia. Esta P50 puede calcularse con varias fórmulas, a partir de: PO2, PO2 de una muestra con SO2 medida o calculada, el pH y el EB, ó en forma simplificada:
P50= 26,8 x PaO2 observada / PaO2 standard
4.b. P50(st)
Se usa cuando la P50, en lugar de en condiciones actuales o reales, se mide en condiciones standard de pH, PCO2, y temperatura, y con COHb y MetaHb de cero.
4.c. Porcentaje de Shunt(Qs/Qt)
Se hace calculando previamente el Contenido arterial, venoso mixto, y capilar teórico de la sangre, expresándose en tanto por cien. Estas determinaciones requieren la obtención de una muestra de sangre arterial y otra venosa mixta, y la mejor sangre mezclada, o mixta, es la obtenida de la Arteria Pulmonar, sangre que debe ser retirada lentamente para no contaminarla con sangre arterializada (1ml en 15seg de retirada).
Si no se dispone de un catéter para muestra de arteria venosa mixta, puede calcularse el shunt estimado, a partir del gradiente Alvéoloarterial de oxígeno, P(A-a)O2, y asumiendo un C(a-v)O2 de 5,1 vol%.
4.d. Determinación del 2-3 difosfoglicerato de los hematies
Puede medirse directamente por métodos enzimáticos (normal 4,1-5,6mmol/L, con valores más altos en el sexo femenino), o bien calcularse su nivel, que puede estar bajo en hipofosfatemias, y alto cuando hay mucha deoxiHb. El cálculo se hace a partir de la desviación de la P50std del valor normal de 26,8mmHg, asumiendo que esta desviación no se deba a variaciones del pH, de la PCO2, COHb o MetaHb.
Mediante esta técnica valoramos la cantidad de oxígeno realmente útil para nuestro deportista dicha cantidad sera la calculda mediante la ergoespirometia ponderado por la saturación arterial siguiendo la formula:
O2 sanguineo: (VO2 calculado * Sat O2 )/ 100
La saturación de oxígeno nos informa del porcentaje de oxígeno que llega a la sangre, del total inspirado (2). De esta manera, podemos valorar la eficiencia de nuestro deportista con respecto a la utilización del oxígeno (1). La oximetría percutánea pulsátil generalmente correlaciona muy bien con la oximetría que se mide en la sangre arterial obtenida mediante gasometría, con un error de 1-2 por ciento. Ambas formas de medición no presentan diferencias significativas en cuanto al valor de la saturación de oxigeno, por lo que consideramos a la medición de la saturación de la hemoglobina arterial por oximetría de pulso un buen sistema de medición de la saturación arterial, con resultados tan confiables como los realizados por la gasometría convencional(21). Este es un buen método para seguir la saturación de oxígeno durante una prueba de esfuerzo, sin la necesidad de realizar gasometrías durante la prueba a nuestros deportistas. Las desventajas que la gasometría arterial presenta con respecto a la saturación son:
- Es un método invasivo ya que exige la extracción de sangre arterial del deportistas.
- Dicha determinación es técnicamente difícil en un sujeto en movimiento.
- La Gasometría arterial es una técnica doloroso e incomoda.
- la imposibilidad de monitorización continua del deportista.
Dichos inconvenientes impiden la realización de una gasometría arterial durante la prueba de esfuerzo. A pesar de que la regla de oro para la determinación de la saturación arterial de oxigeno lo sigue constituyendo la gasometría (21).
Una de las preguntas que los médicos deportivos nos hacemos, es cuánto oxígeno hay realmente en la sangre de mi deportista.
Para valorar adecuadamente el volumen de oxígeno, hay que tener en cuenta varios parámetros (2):
- El gradiente de presión alveolo-arterial de oxígeno (PAO2).
- La presión arterial de oxígeno (PaO2).
- La saturación de oxígeno (SaO2).
El parámetro que menos importancia tiene en medicina deportiva es la PaO2, aunque no es un parámetro despreciable en nuestras valoraciones. Ya que un valor normal de esta variable implica una correcta difusión del oxígeno que captan nuestras pulmones en la sangre. Si encontramos un valor alto de este parámetro, nos estará indicando una mala difusión de oxígeno a nivel alveolar. Podíamos definir a la presión arterial de oxígeno como la presión de las moléculas libres disueltas en la sangre, que no se encuentran combinadas con la hemoglobina (1). (Esta es la razón que limita la utilidad de este parámetro).
Debemos en este punto recordar algunos parámetros de fisiología pulmonar. La circulación pulmonar tiene unas características especiales, que se adapta a las funciones de intercambio gaseoso que tiene encomendadas. Se puede resumir como un "Sistema de perfusión de baja presión". Ello conlleva una distribución irregular de la perfusión sanguínea a lo largo del pulmón, al ser influenciada su distribución por la fuerza de gravedad. Prefundiéndose con mayor cantidad de sangre los lóbulos pulmonares inferiores, mientras que los lóbulos superiores reciben menor caudal sanguíneo. Además no toda la sangre que perfunde al pulmón va a tener un intercambio alveolar (alveolo numero 3 en la Figura). Hay un 10% de sangre que no realiza esta función; llegando al lado venoso sin haber sufrido cambios en su composición "Shunt Derecha-Izquierda". Es decir hay alvéolos no perfundidos (llega oxigeno pero no entra en contacto con la sangre), alveolo numero 2 en la Figura, y alvéolos prefundidos pero no ventilados (llega sangre pero no llega oxigeno) alveolo numero 1 en la figura. A esta relación entre el oxigeno y la sangre se denomina Relación Ventilación-Perfusión.
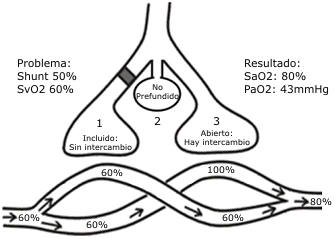
Figura 1.
Se define como corto circuito o shunt arterio venoso a la transferencia de sangre desde la circulación derecha a la circulación izquierda sin pasar por las unidades de intercambio gaseoso. Este fenómeno ocurre cuando los alvéolos no son ventilados porque existe una obstrucción distal a ellos, se encuentran llenos de líquido u obliterados o porque existe una comunicación vascular directa entre el sistema venoso y arterial. En estas situaciones la sangre que no ha pasado por áreas ventiladas entra nuevamente a la circulación sistémica o la sangre venosa se mezcla a nivel extrapulmonar con la sangre arterial. En los pulmones normales se presenta el corto circuito en cierta medida ya que parte de la sangre arterial bronquial que ha irrigado la pared de las grandes vías termina en las venas pulmonares y una pequeña cantidad de sangre drena del miocardio del ventrículo izquierdo directamente hacia la cavidad del ventrículo. Estas dos situaciones reducen la PaO2 sistémica. En la figura anterior se puede ver ilustrado un ejemplo de corto circuito a través de dos vías en el pulmón. Parte de la sangre pasa a través de alvéolos que no son ventilados (corto circuito) en la región de la izquierda, mientras que en la parte derecha si pasa a través de alvéolos que son ventilados. En el primer caso la sangre venosa mixta que se encuentra saturada en un 60%, sale del capilar pulmonar con la misma saturación, mientras que en el segundo caso si se satura en un 100%. Si tenemos en cuenta que el resultado final va a ser la mezcla de la sangre oxigenada con la sangre que pasa por el corto circuito tendremos una saturación de aproximadamente el 80% al final de su paso por el pulmón. Esto indica que un paciente con estas condiciones presentará una hipoxemia severa.
La eficacia del intercambio gaseoso depende de la interrelación entre la ventilación y la perfusión. La situación ideal seria aquella en la que la ventilación alveolar fuese la suficiente para intercambiar todos los gases de la sangre que perfunden a los alveolos. Entonces diríamos que el intercambio gaseoso seria total, o en otras palabras, que habría un perfecto equilibrio entre la ventilación y la perfusión alveolar. Expresándolo en forma de cociente, diríamos:
VA/QP = 1
Según en las zonas pulmonares:
- Z. Apical: predomina la ventilación VA/Q > 1. Espacio muerto fisiológico.
- Z. Media: VA/Q= 1.
- Z. Basal: predomina la perfusión VA/Q < 1.
Además debemos de considerar el denominado Shunt intrapulmonar: Las concentraciones de O2 y CO2 en la sangre que sale del pulmón traduce el equilibrio o no de esta relación VA/QP. Cuando predomina el espacio muerto fisiológico aumentará la PaCO2; cuando aumenta el shunt pulmonar descenderá la PaO2.
Otro concepto a valorar en la fisiopatología pulmonar es el espacio muerto. Se define como espacio muerto las vías aéreas o los alvéolos que son ventilados pero no perfundidos. Un ejemplo típico de este fenómeno ocurre en las vías aéreas de conducción, que deben movilizar el aire durante un ciclo respiratorio pero que no intercambian oxígeno y dióxido de carbono en el capilar pulmonar. La ventilación del espacio muerto es la porción de la ventilación minuto que no participa en el intercambio de gases. Supongamos que se presenta un aumento en el espacio muerto de un paciente. Si el paciente aumenta su ventilación total para compensar este aumento en el espacio muerto, no se presentará ninguna alteración. Sin embargo si el paciente permanece con una ventilación constante y es incapaz de aumentarla, se disminuirá la ventilación alveolar y si se presentará un aumento en la PaCO2.
El espacio muerto tiene dos componentes:
- Espacio muerto anatómico: Es el volumen de las vías aéreas de conducción. Su valor normal es alrededor de 150ml.
- Espacio muerto fisiológico: Es una medida funcional del volumen de los pulmones que no intercambia CO2. En sujetos normales este valor es similar al espacio muerto anatómico.
El espacio muerto representa ventilación perdida y en pacientes con enfermedades ventilatorias obstructivas y restrictivas esto puede representar un serio problema debido a su incapacidad de incrementar su ventilación minuto. La siguiente ilustración esquematiza de una manera muy sencilla el espacio muerto:
El ultimo factor importante en la fisiología respiratoria en el ejercicio en la adecuación de la frecuencia respiratoria, la frecuencia y la profundidad de la respiración debe de ser adecuada a las exigencias del esfuerzo que se esta realizando, una descoordinación entre la demando de oxigeno y la frecuencia y profundidad respiratoria puede producir cubetas de desaturación a lo largo de la prueba de esfuerzo y determinar una desaturación en los estadios finales de la misma.
La SaO2 y la PaO2 están relacionadas por la curva de disociación del oxígeno y bajo ciertas condiciones de intercambio gaseoso se desplaza la curva de disociación del oxígeno. Esta curva es exponencial y la mostramos en el gráfico 1. Este gráfico nos muestra como la cantidad de oxígeno en sangre aumenta al aumentar la saturación. Pero dado el carácter exponencial de la curva, a saturaciones bajas aumenta rápidamente el oxígeno arterial. Pero con pequeñas modificaciones en la parte alta de la curva se producen grandes caídas en la concentración de oxígeno. Por lo que desaturaciones de un 10% (bajar de 100% a 90%), supone pasar de tener un oxígeno arterial de 100mmHg a 60mmHg (es decir una caída del 40%). Por tanto, pequeños cambios en la saturación de oxígeno, llevan aparejados grandes variaciones en la perfusión de oxígeno a nivel celular.
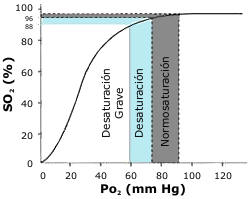
Figura 2. Curva de Disociación del oxígeno y la saturación.
La forma de la curva es sigmoidea y en la porción casi vertical de ella pequeños cambios de PaO2 causan importantes cambios de la SaO2 y por lo tanto en el contenido de oxígeno. La entrega de oxígeno a los tejidos se produce a estas presiones bajas de oxígeno cuando la Hb libera con más facilidad el oxígeno; por el contrario, en la parte plana de la curva, aumentos de la PaO2 por arriba de 60mm Hg incrementan poco la saturación de oxígeno y, por ende, el contenido de oxígeno.
La otra porción del oxígeno, bastante menor, es el disuelto en el plasma, tiene importancia por tres hechos: es la que determina el grado de saturación de la hemoglobina, es la que difunde hacia los tejidos y es la que miden los instrumentos más usados en clínica.
Hay circunstancias en las que la curva se desvía hacia la derecha o hacia la izquierda. Se desplaza hacia la derecha cuando diminuye el pH, aumenta la PaCO2, aumenta la temperatura, aumenta la concentración intraeritrocitaria de 2,3 difosfoglicerato, y el ejercicio intenso (disminuye el pH y aumenta la temperatura); lo que significa que la afinidad de la hemoglobina para el oxígeno disminuye. La curva se desplaza hacia la izquierda en las circunstancias contrarias (2).
Factores que modifican la curva de disociación O2 / Hb. (Hb.= Hemoglobina.) (47)
El PH. La curva se desplaza hacia la derecha cuando se da un acidosis en la sangre, es decir un aumento de hidrogeniones (ión hidrógeno) y hacia la izquierda cuando hay alcalosis. El aumento de la presión de CO2 desplazará la curva hacia la derecha. Un aumento de la temperatura desplazará la curva hacia la derecha. Un aumento de las concentraciones de un metabolito llamado 2'3 Difosfoglicerato (que deriva de las vías metabólicas glucolíticas) desplazaría la curva hacia la derecha. Se le atribuye un efecto regulador de la concentración de O2. Este metabolito aumenta cuando lo hace la actividad metabólica. Lo que ocurre es que para la misma presión de O2 hay un menor porcentaje de saturación. Como consecuencia de esto se produce un aumento de la disponibilidad de O2 a nivel tisular porque se libera antes el O2. Si se produce un aumento del CO2, hay un aumento de la concentración de hidrogeniones o acidosis, por lo que disminuye el PH. La disminución del PH, el aumento de la concentración de 2.3 Difosfogllicerato y el aumento de la temperatura desvían la curva hacia a la derecha. La disminución de la tª produce un desplazamiento hacia la izquierda.
Durante el ejercicio, los músculos producen más cantidad de CO2, por lo que habrá un aumento de la acidosis. Al entrar en juego la vía glucolítica, cuando se acaba el ATP hay un aumento del metabolito 2.3.... y la actividad muscular genera un aumento de la tª, por lo que todos estos factores hacen que la curva se desplace hacia la derecha.
El Efecto Böhr (47)
Consiste en las influencias de las presiones parciales del CO2. A nivel del tejido y como consecuencia de la actividad muscular hay un aumento de la producción de CO2, que como hemos dicho anteriormente desplazará la curva hacia la derecha, por lo que la hemoglobina liberará más O2. Esta sangre venosa poseerá un bajo porcentaje de saturación de O2 a nivel de la hemoglobina, Cuando esta sangre venosa llega a los pulmones, el CO2 pasa con una enorme facilidad al espacio alveolar y la presión de CO2 volverá a ser normal, por lo que la curva de saturación volverá a ser normal y así la hemoglobina alcanzará el 100% de saturación, de esta manera se asegura la liberación total en los tejidos y la captación total en los pulmones. Los otros factores no tienen la facilidad de la reversibilidad ya que el 2'3 ...y la ta pueden afectar de forma permanente la desviación de a curva hacia la derecha y alteran la máxima capacidad de captación de O2 por la hemoglobina.
Aproximadamente el 99% del oxígeno transportado por la sangre está unido a la hemoglobina y sólo un 1% se encuentra en el plasma. Por lo tanto, la cantidad de moléculas de oxígeno, o contenido de oxígeno de la sangre, depende de la concentración de hemoglobina y de la PaO2, ya que, a medida que sube ésta, aumenta el contenido.
Cada molécula de hemoglobina tiene cuatro enlaces disponibles para combinarse con el oxígeno, el porcentaje de estos enlaces disponibles y los que verdaderamente se encuentran combinados con moléculas de oxígeno, es lo que se denomina saturación de oxihemoglobina (SaO2 cuando es medida en sangre arterial), lo que realmente medimos con los saturímetros se denomina SpO2 porque se mide en la periferia del cuerpo humano, por ej: el dedo o el lóbulo de la oreja (nosotros lo realizamos en el 4º dedo de la mano izquierda) (1,2).
Para conocer la cantidad de oxígeno total en sangre, no basta con conocer la PaO2 ni la SaO2, es necesario conocer el contenido de hemoglobina en sangre. Con este nuevo parámetro y con la ecuación del contenido de oxígeno, que no será detallada en este artículo, se puede calcular el mismo, teniendo entonces una mejor información para el diagnóstico. De todas maneras la medición de la SaO2 es muy útil para evaluar la oxigenación arterial de pacientes en los servicios médico-deportivos. Los valores típicos de SaO2 se encuentran entre 95% y 97%, con un rango de variación del 2%. Valores por debajo del 90% (en reposo) se asocian con situaciones patológicas e insuficiencia respiratoria.
La pulsioximetría mide la saturación de oxígeno en la sangre, pero no mide la presión de oxígeno (PaO2), la presión de dióxido de carbono (PaCO2) o el pH. Por tanto, no sustituye a la gasometría en la valoración completa de los enfermos respiratorios. Sin embargo supera a la gasometría en rapidez y en la monitorización de estos enfermos. Los aparatos disponibles en la actualidad son muy fiables, para valores entre el 80 y el 100%, pero su fiabilidad disminuye por debajo de estas cifras. En la Tabla 1: mostramos las equivalencias entre la Saturación de oxígeno y la PaO2 en la gasometría arterial.
Existe un valor crítico: PaO2 de 60mmHg que se corresponde con una saturación del 90%, por debajo de la cual, pequeñas disminuciones de la PaO2 ocasionan desaturaciones importantes. Por el contrario, por encima del 95%, grandes aumentos de la PaO2 no suponen incrementos significativos de la saturación de oxígeno.
El punto crítico que debe dar la señal de alarma es el de saturaciones inferiores al 95% (inferiores al 90 ó 92% (en reposo) cuando existe patología pulmonar crónica previa) estos pacientes deben recibir tratamiento inmediato. Sin embargo, en la práctica médico-deportiva observamos como deportistas de alto nivel y sin patología cardio-pulmonar manejan Saturaciones inferiores al 88%, sin clínica respiratoria aparente(1).
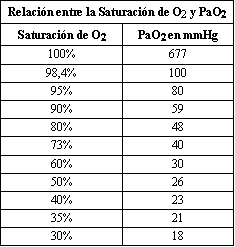
Tabla 1.
La oximetría del pulso o pulsioximetría es la medición, no invasiva, del oxígeno transportado por la hemoglobina en el interior de los vasos sanguíneos.
La oximetría valora la saturación de oxígeno, expresando la cantidad de oxígeno que se combina en sentido químico, con la hemoglobina para formar oxihemoglobina, que es la molécula encargada de transportar el oxígeno hacia los tejidos.
Al medir la saturación de oxígeno estamos midiendo la cantidad de oxígeno que se encuentra combinado con la hemoglobina, es por eso que esta medida es una medida relativa y no absoluta, ya que no indica la cantidad de oxígeno en sangre que llega a los tejidos, sino la relación existente entre la cantidad de hemoglobina presente y la cantidad de hemoglobina combinada con oxígeno (oxihemoglobina).
La oximetría de pulso proporciona valores estimados de la saturación de la oxihemoglobina arterial utilizando luz de longitudes de onda seleccionadas para determinar no invasivamente la saturación de oxihemoglobina (22,23,24,25). La oximetría de pulso se fundamenta en la espectrofotometría clásica que permite calcular la concentración de una sustancia en solución a partir de su absorción óptica a una longitud de onda determinada; con la llamada ley de Beer. La sustancia que se está analizando se ilumina y se mide cuanta absorbe; de tal medida se calcula la concentración. Dicha técnica analítica también establece que para analizar dos sustancias en solución se necesitan dos longitudes de onda (21). Se basa en que el color de la sangre varía dependiendo de lo saturada de oxígeno que se encuentre, debido a las propiedades ópticas del grupo hemo de la molécula de hemoglobina. La oximetría de pulso se fundamenta en la espectrofotometría clásica que permite calcular la concentración de una sustancia en solución a partir de su absorción óptica a una longitud de onda determinada; con la llamada ley de Beer. La sustancia que se está analizando se ilumina y se mide cuanta absorbe; de tal medida se calcula la concentración. Dicha técnica analítica también establece que para analizar dos sustancias en solución se necesitan dos longitudes de onda (21).Cuando la molécula de hemoglobina libera oxígeno, pierde su color rosado, adquiriendo un tono más azulado y deja pasar menos luz roja. Así pues, el pulsioxímetro determina la saturación de oxígeno midiendo espectrofotométricamente el "grado" de azules de la sangre arterial y expresa esta "azulez" en términos de saturación. Dado que la cantidad de oxihemoglobina está relacionada con la coloración roja de la sangre, siendo ésta más fuerte cuánto más oxihemoglobina contiene la sangre, y más tenue cuanto menos oxihemoglobina hay presente. La desoxigenación de la sangre causa absorción creciente en la banda roja y decreciente en la banda infrarroja. Estas direcciones opuestas en la absorción de los dos colores al variar la oxigenación contribuyen a que haya cambios ópticos apreciables más fáciles de medir, lográndose así más precisión (21). Debido a que la absorción de luz de los tejidos y de la sangre venosa es constante, cualquier cambio en la absorción de la luz, entre un tiempo dado y uno posterior, se debe exclusivamente a la sangre arterial. Los pulsioxímetros miden la relación, en un intervalo de tiempo, entre las diferencias de absorción de las luces rojas e infrarrojas. Esta relación se vincula directamente con la saturación de la oxihemoglobina. Estos colores, son además, donde mayor eficiencia lumínica tienen los diminutos emisores de luz que usan los oxímetros lo cual permitió reducir substancialmente el tamaño del equipo(26,27,28,29,30). El oxímetro de pulso es un aparato que combina los principios de la oximetría por espectrofotometría y la pletismografía (31.32,33,34,35).
En la espectrofotometría clásica, el análisis se realiza en cubetas de vidrio en los cuales se deposita la muestra de sangre arterial. En cambio el oxímetro de pulso utiliza el dedo mismo del paciente como cubeta. Esto trae la complicación de que la sangre además de la arterial incluye la venosa y otros tejidos como huesos, uñas y la piel. Para distinguir la sangre arterial entre todos estos tejidos, el oxímetro de pulso utiliza la técnica descubierta en 1974 por el japonés Takuo Aoyagi: analiza únicamente la parte pulsátil de la señal óptica que se debe exclusivamente a la sangre arterial. Es por esto el énfasis que se hace en el nombre del oxímetro al agregarle de “PULSO” cuando nos referimos a él. Si no hay pulsación arterial el oxímetro no puede distinguir la sangre arterial que es el objeto de su análisis (36,37).
Los estudios del Dr Ayala (21) muestran la ausencia de diferencia significativa entre la determinación de la saturación arterial tomada por gasometría o por pulsioximetría. Encontraron que en 200 pacientes en los que se determino en 3 ocasiones la saturación arterial por ambos métodos, no encontraron diferencias entre ambas tecnicas con un porcentaje de confiabilidad del 99.47% y un rango diferencial de 0.52 (El rango de diferencial se usa para establecer la diferencia entre dos mediciones de un mismo fenómeno, pero cuyas mediciones, fueron hechas por diferentes tecnologías, métodos o personal humano. No debe exceder la unidad o sea debe ser menor de 1 para que se considere un rango adecuado; en este caso el valor fue de 0,52 que es un resultado adecuado). El porcentaje de confiabilidad se usa para evaluar el resultado de una medición realizada por un método nuevo o no convencional, se calcula tomando como referencia ideal (100% de confiabilidad) el resultado de la medición del mismo fenómeno pero realizado por el método convencional más efectivo, conocido y validado. Su resultado es fácil de interpretar puesto que su fórmula es una relación expresada en por cientos; o sea mientras más cerca del 100 se encuentre el resultado mayor será el porcentaje de confiabilidad, y por ende, más aceptable será la nueva forma de medición. En el estudio el por ciento de confiabilidad de la medición de la saturación de la hemoglobina obtenida por oximetría de pulso resultó ser del 99,47% (21).
Para la medición se precisa de un aparato de pulsioximetría, con un sensor en forma de pinza. En la pinza tiene un productor de luz que se refleja en la piel del pulpejo del dedo, este sensor (marcado como R1 en la Figura 3) mide la cantidad de luz absorbida por la oxihemoglobina circulante en el paciente(2).
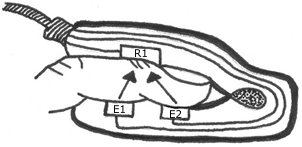
Figura 3. Funcionamiento del Saturímetro.
El principio de funcionamiento del sensor óptico viene determinado porque la absorción de la sangre a una determinada longitud de onda, es dependiente de la saturación de oxihemoglobina. En la parte contraria del sensor dactilar (finger sensor), encontramos a los dos emisores (E1 yE2 en la Figura 3) emitiendo una luz a esta longitud de onda a través del dedo y recibiendo la cantidad de luz que no fue absorbida en un receptor diametralmente opuesto al emisor. De esta manera logramos conocer la cantidad de luz absorbida por el dedo, debido a que esta luz es mayoritariamente absorbida por la sangre(2).
Una vez llegado a este punto, se presenta un problema, la sangre y por tanto la SaO2 es pulsátil, por tanto, al ser variable ésta, no se puede determinar a priori si la variación de la medida es debido a una variación de la variable misma o debido a la pulsatilidad del flujo sanguíneo. La mayor parte de la luz es absorbida por el tejido conectivo, piel, hueso y sangre venosa en una cantidad constante, produciéndose un pequeño incremento de esta absorción en la sangre arterial con cada latido, lo que significa que es necesaria la presencia del pulso arterial para que el aparato reconozca alguna señal.
Mediante la comparación de la luz, que absorbe durante la onda pulsátil, con respecto a la absorción basal, se calcula el porcentaje de oxihemoglobina. Sólo se mide la absorción neta durante una onda de pulso, lo que minimiza la influencia de tejidos, venas y capilares en el resultado. Es por esta razón que estos sensores contienen en realidad dos emisores a dos longitudes de diferentes y un receptor, como se puede ver en la Figura 3, de manera que a una de las longitudes de onda la absorción es muy dependiente de la SaO2, y a la otra longitud de onda la absorción teóricamente no varía con la SaO2, pero sí con la cantidad de sangre, es decir, varía con el pulso.
De esta manera se tiene una señal que varía con el pulso y con la SaO2, y una señal que varía solamente con el pulso, de tal manera que se puede modular la primera con la segunda y así, obtener una lectura permanente de la SaO2.
Como ya comentamos, se emiten dos longitudes de onda diferentes, una en el entorno del rojo del espectro visible, generalmente de 660nm, ésta es la que varía con la SaO2, y la otra longitud de onda en el rango del infrarrojo del espectro que es generalmente de 940nm. Estas longitudes de onda pueden tener alguna pequeña variación dependiendo del fabricante, pero son generalmente de este orden, el rojo está en el rango 630-660nm y el infrarrojo en el rango 800 -940nm
En algunas ocasiones se utilizan LEDs laser como emisores debido a su precisión en el espectro de emisión, dado que a longitudes de onda cercanas a las utilizadas hay otras sustancias en la sangre que cambian su emisión.
Se debe masajear el pulpejo del dedo del paciente (en mujeres interfiere la laca de uñas, recomendándose su retirada), luego se coloca la pinza con el sensor y se espera a recibir la información en una pantalla del aparato en la que aparecerá la siguiente información:
- Índice de saturación de oxígeno.
- Frecuencia cardiaca.
LIMITACIONES DE LA PULSIOXIMETRIA
- Alteraciones de la hemoglobina (MetHb o COHb).
- Colorantes y pigmentos en la zona de lectura (uñas pintadas).
- Fuentes de luz externa.
- Hipoperfusión periférica.
- Anemia.
- Aumento del pulso venoso.
- No detecta hiperóxia.
- No detecta hipoventilación.
Los aparatos actuales son muy fiables, cuando el paciente presenta saturaciones superiores al 80%. Las situaciones que pueden dar lugar a lecturas erróneas son:
- Anemia severa: la hemoglobina debe ser inferior a 5mg/dl para causar lecturas falsas.
- Interferencias con otros aparatos eléctricos.
- Contrastes intravenosos, pueden interferir si absorben luz de una longitud de onda similar a la de la hemoglobina.
- Luz ambiental intensa: xenón, infrarrojos, fluorescentes...
- Mala perfusión periférica por frío ambiental, disminución de temperatura corporal, hipotensión, vasoconstricción... Es la causa más frecuente de error ya que es imprescindible para que funcione el aparato, que exista flujo pulsátil. Puede ser mejorada con calor, masajes, terapia local vasodilatadora, quitando la ropa ajustada, no colocar el manguito de la tensión en el mismo lado que el transductor. Solamente hemos tenido que rechazar casos de desaturaciones, en deportistas con fenómenos de vasoconstricción periférica (Como la enfermedad de Raynaud), Ya que nos daban lecturas inapropiadas a lo largo d la prueba.
- La ictericia no interfiere.
- El pulso venoso: fallo cardíaco derecho o insuficiencia tricuspídea. El aumento del pulso venoso puede artefactar la lectura, se debe colocar el dispositivo por encima del corazón.
- Fístula arteriovenosa. No hay diferencia salvo que la fístula produzca isquemia distal.
- La hemoglobina fetal no interfiere.
- Obstáculos a la absorción de la luz: laca de uñas (retirar con acetona), pigmentación de la piel (utilizar el 4º dedo o el lóbulo de la oreja).
- Dishemoglobinemias: la carboxihemoglobina (intoxicación por monóxido de carbono) y la metahemoglobina absorben longitudes de onda similares a la oxihemoglobina. Para estas situaciones son necesarios otros dispositivos como CO-oxímetros (capnógrafos).
Ventajas respecto a la gasometría
- Proporciona una monitorización instantánea, continua y no invasiva.
- No requiere de un entrenamiento especial. Es fácil de usar.
- Es fiable en el rango de 80-100% de saturación, que es el más interesante en la práctica clínica.
- Además, informa sobre la frecuencia cardiaca y puede alertar sobre disminuciones en la perfusión de los tejidos.
- Es una técnica barata y existen aparatos portátiles muy manejables.
- La gasometría es una técnica cruenta, que produce dolor y nerviosismo durante a extracción, dando lugar a hiperventilación, lo que puede llevar a sobreestimación de la oxigenación.
- Asequible en las valoraciones médico-deportivas por su bajo costo.
Desventajas respecto a la gasometría
- La pulsioximetría no informa sobre el pH ni la PaCO2.
- No detecta hiperoxemia.
- No detecta hipoventilación (importante en pacientes respirando aire con concentración elevada de O2).
- Los enfermos críticos suelen tener mala perfusión periférica.
Recientemente diversos técnicas de entrenamiento de altitud están desarrollando sistemas como el GO2ALTITUDE, que simula las saturaciones de oxigeno encontradas a determinadas altitudes, afirmando que el entrenamiento con dichas saturaciones mejora el rendimiento físico, denominando a este sistema de entrenamiento, entrenamiento de altitud simulada, los fabricantes de este sistema afirman que este entrenamiento en hipoxia favorece tanto el entrenamiento físico como la aclimatación a la altura. Dicho sistema se basa en las desaturaciones encontradas en función de la altura a si según los estudios realizados por el fabricante de este sistema a los 600 metros la saturación arterial de oxigeno se encuentra en un 84% en reposo y en un 74% en actividad, a 8000 metros la saturación arterial en reposo es de 74%.
El aire ambiente esta compuesto de una mezcla de varios gases como nitrógeno (N2), oxígeno (O2), y argón (Ar). También está compuesto de una pequeña fracción de agua (H2O) and dióxido de carbono (CO2), y otros constituyentes menores. Cada molécula se encuentra en cierto porcentaje con relación a las otras en la mezcla de gases. Así el aire contiene 20.93% de oxígeno, 0.93% de argon, 0.03% de dióxido de carbono y 78.11% de nitrógeno. Este porcentaje se denomina la fracción del gas en le mezcla.
Se denómina presión barométrica a aquella ejercida por la columna de aire que se encuentra encima nuestro. Esto significa que a medida que aumenta la altitud, la presión barométrica desciende. Si bien es cierto que a medida que la altitud es mayor el aire se vuelve menos denso, las fracciones de los distintos gases permancecen constantes. Cada gas contribuye a la presión baromética de manera directamente proporcional a su fracción. El producto de la fracción de un gas por la presión atmosférica se utiliza para definir la presión parcial de ese gas. En el caso del aire inspirado la presión parcial del oxígeno sería equivalente a la fracción del oxígeno en el aire por la presión atmosférica. Es decir que la presión inspirada de oxígeno sería:
PIO2 = FIO2 • Patm
Debido a que el aire es humidificado en las vías aéreas se debe corregir la adición de la presión generada por el vapor de agua del tal forma que en realidad la Presión Inspirada de Oxígeno que llega al alvéolo sería igual a:
PIO2 = FIO2 • (Patm - PH2O)
Si tenemos en cuenta que la FIO2 en el aire ambiente es del 20.93%, la presión barométrica a nivel de mar es 760mmHg y la presión del vapor de agua a temperatura corporal es 47mmHg, podemos calcular la presión inspirada de oxígeno:
PIO2 = 20.93% * (760mmHg - 47mmHg)
Si hace los cálculos podrá comprobar que en este caso la presión inspirada de oxígeno es igual a 149mmHg.
Con base en esta ecuación se puede deducir como se modificará la presión inspirada de oxígeno con los cambios de altitud. También puede calcular como obtener una presión inspirada de oxígeno determinada con base en la fracción inspirada. En laboratorio podrá modificar la altitud y observar los cambios pulmonares.
La respiración pulmonar y el ejercicio físico (47)
Vamos a fijarnos en cuatro parámetros: La ventilación, El volumen espiratorio y la potencia del esfuerzo, aspectos reguladores durante el ejercicio . transporte y liberación de O2 durante el ejercicio.
1. La ventilación.¿Que ocurre con la ventilación pulmonar durante el ejercicio físico?. Evidentemente la ventilación aumenta. Aumenta la frecuencia y la profundidad respiratoria, por lo tanto aumenta el volumen corriente nº litros/min. Además este aumento va a ser directamente proporcional a ala intensidad del esfuerzo.2. Volumen respiratorio y Potencia de esfuerzo. Para trabajos ligeros y moderados existe una relación lineal entre el volumen minuto respiratorio y el aumento de cargas, pero a partir de una intensidad de trabajo moderada alta se pierde esta linealidad. ¿Cual sería la interpretación de esta pérdida de la linealidad?. En primer lugar toda la primera parte de la curva es lineal y esto se explica por el mecanismo del CO2. Como consecuencia de del ejercicio físico se produce un aumento del metabolismo muscular, por lo cual habrá un aumento de la producción de CO2 (por vía oxidativa) y esto a su vez provocará un aumento de la ventilación pulmonar para eliminar el CO2 y captar O2. La curva se rompe cuando además de lo anterior hay una producción extra de CO2 por el tamponamiento de los Hidrogeniones que se produce como consecuencia de la participación del metabolismo energético anaeróbico. que produce lactato (Sistema de tamponamiento de PH).
CO2 + H2O ==> CO3H2 ==> CO3H- + H+
Los hidrogeniones son tamponados por aniones (proteínas, etc..). Esta ecuación se encuentra en equilibrio, por lo que si hay un aumento de CO2 la ecuación se desplazará hacia la derecha y si por el contrario hay un aumento de hidrogeniones (Lactosis) va a ver una aumento consiguiente de la producción de CO2 (la ecuación se desplazará a la izquierda), que a su vez a producir una estimulación extra del centro respiratorio vulvar para eliminar el CO2 a través de los pulmones. Esta es una de las maneras para estimar el punto de umbral anaeróbico de las personas.. El ejercicio lleva implícito una mejor ventilación de aquellas zonas que están poco ventiladas, y esta mayor ventilación viene acompañado por un aumento de la perfusión pulmonar, por lo que aumentará el gasto cardiaco, además de aumentar los mecanismos de difusión alveolo-capilar.
3. Aspectos reguladores durante el ejercicio. Es difícil explicar la regulación de la respiración haciendo solo referencia a la presión del O2 y del CO2 por lo que tienen que existir algunos mecanismo que puedan explicar además de los primeros (factores puramente químicos) la Hipernea o hiperventilación. La 1ª hipótesis hace referencia que con el ejercicio hay un aumento en la sangre de catecolaminas a cuenta de las aminas simpáticas (adrenalina, noradrenalina, etc..) que aumentarán la sensibilidad de los quimioreceptores que intervienen en la regulación de la ventilación, de forma que pequeños cambios en los niveles de CO2 harán que produzcan una mayor cantidad de hidrogeniones y por lo tanto una mayor ventilación. La 2ª hipótesis hace referencia que junto con las ordenes motoras que parten de la corteza cerebral en dirección a los músculos habrá una estimulación de unas neuronas que conectarán con las neuronas del centro respiratorio, de tal modo que se producirá una orden simultánea de movimiento voluntario motor y movimiento involuntario del sistema respiratorio. La 3ª nos dice que señales nerviosas de tipo periférico procedentes de las articulaciones, tendones, etc.. producirán la activación de centro respiratorio por activación de la musculatura. La 4ª nos dice que un aumento de la temperatura tiene un efecto estimulante del centro respiratorio. Ya que durante el ejercicio se da un aumento de la tª, es lógico pensar que se estimulara el centro respiratorio.4. Transporte y liberación de O2 durante el ejercicio. La hemoglobina saturada al 100% transporta 20ml. de O2 por cada 100ml. de sangre arterial. La hemoglobina en la sangre venosa está saturada al 75% y tiene por lo tanto 15ml. de O2, por lo que en los tejidos se queda 5ml. de O2 en condiciones normales. Durante el ejercicio físico la presión de O2 a nivel tisular baja mucho de 15ml., por lo tanto la saturación de O2 en la hemoglobina viene a quedarse en torno a valores del 20%. Por ello el 80% restante de O2 se va a quedar en los tejidos. Podemos decir que durante el ejercicio físico aumenta la necesidad de O2 por parte de los tejidos, que llegan a quedarse con un 80% del total de O2 que lleva la hemoglobina. A esta disminución de la presión parcial de O2 por consumo en los tejidos, se suma el desplazamiento hacia la derecha por aumento de la acidez, aumento de la temperatura, aumento de CO2 y del 2'3 difosfoglicerato de la curva de disociación Hb/O2, que facilita la liberación de O2 por la hemoglobina a nivel tisular. Este cambio es compensado por el efecto Böhr, es por ello que aumenta la liberación de O2 en los tejidos.
Adaptación de la respiración al entrenamiento. Durante el ejercicio se produce un aumento del equivalente respiratorio. Volumen respiratorio minuto: Consumo de O2 (VO2).
VO2 = al número de litros aire que un individuo puede consumir en un minuto de tiempo.
Este parámetro aumenta con la intensidad del ejercicio y en los individuos no entrenados aumenta con respecto a aquellos entrenados. El que el VO2 disminuya conlleva una serie de ventajas: Al disminuir el nº de litros de aire que necesita por cada litro de O2 que consume este individuo realiza un ahorro del trabajo ventilatorio y esto supone una mejora del rendimiento ya que el trabajo respiratorio es fundamentalmente muscular y se realiza a expensas del O2. A igualdad del volumen respiratorio minuto en individuo entrenado trabaja con frecuencias respiratorias menores. (Volumen corriente mayor). El aire por tanto estará más tiempo en los pulmones y se facilitará la difusión de O2 hacia la sangre a través de los alvéolos por cada litro de aire, pro tanto el aprovechamiento de aire será mayor.
Modificación de los parámetros expirométricos
Analizando sujetos con características antropométricas similares (edad, altura, superficie corporal), se compararon los distintos parámetros expirométricos y se llegó a la conclusión de que no existen diferencias significativas en ninguno de los dos grupos: el de control y de los maratonianos, por ello se puede decir que estos no se modifican con el entrenamiento. Si que existe diferencias entre deportistas que practican buceo y natación en su parámetros expirométricos. En general podríamos decir que los deportistas tienen una mejor función respiratoria ya que trabajan los músculos respiratorios con el entrenamiento.
MATERIAL Y METODOS
En el Servicio de Apoyo al Deportista del Centro de Tecnificación de Alicante, dependiente de la Conselleria de Cultura, Educació i Esport de la Generalitat Valenciana hemos valorado a 78 futbolistas de 2º B de la provincia de Alicante, entre Diciembre del 2003 y Febrero del 2005. Dichas valoraciones se han realizado en la ciudad costera de alicante que se sitúa al nivel del mar, aunque nuestro laboratorio se encuentra levemente elevado con respecto a este nivel. Hemos valorado la saturación durante una prueba de esfuerzo según los patrones descritos en artículos previos (1,2). Valorando las diferencias existentes entre los futbolistas y los deportistas de élite de nuestra provincia (2). Los datos de la población de referencia se basan en un estudio previo realizado con 221 deportistas. Dicha muestra estuvo compuesta por 149 varones (el 67.52%) y 71.mujeres (el 32.47%). Con una edad media de 20.27 y una desviación estándar de 5,77. Todos ellos pertenecientes a los listados de élite de la Generalitat Valenciana, que son publicados anualmente en el Dogv. La última resolución se publico en el Dogv número: 4744 del 03/05/04. Las normas actuales para entran a formar parte de estas listas se encuentran publicadas en el Dogv 4766 del 02/06/04.
Para la realización de la prueba de esfuerzo, se utilizó un analizador de gases Schiller cs- 200, realizando un calentamiento consistente en cinco minutos de estiramiento y una carrera aeróbica suave de cinco minutos. Tras los cuales el paciente desarrolló un protocolo de Wasserman, consistente en un incremento de velocidad de 1Km/hora cada minuto, partiendo de 7Km/hora, con una pendiente constante del 1% a lo largo de toda la prueba (esta pendiente simula las condiciones de viento y rozamiento de la pista.).
El final se determina cuando el paciente para por fatiga de miembros inferiores o por alcanzar un plateau en su volumen de oxígeno máximo (VO2max). Durante toda la prueba se realizó una monitorización continua de la saturación, mediante la toma en el 4º dedo de la mano izquierda con un pulsioxímetro portátil TuffSat de la marca Datex-Ohmeda. Se recogió la saturación al final de cada estadío del test de Wasserman. Los umbrales (VT1 y VT2) se calcularon usando los criterios descritos por Davis (3).
Uno de los elementos clave de nuestro estudio es la fijación del pulsioxímetro al dedo. Una buena fijación evitará que el sensor infraestime la saturación del deportista. Para ello la fijación se coloca en el cuarto dedo de la mano izquierda (1,2) (la mano puede cambiar si cambia la localización el receptor). Se utiliza el cuarto dedo por estar más “entablillado” entre el 5º y el 3º dedo, permitiendo al deportista correr con la mano cerrada. La fijación se realizó como se muestra en la Figura 3, para evitar vibraciones que aumenten el número de interferencias en la captación de la señal. La fijación consta de cuatro pasos:
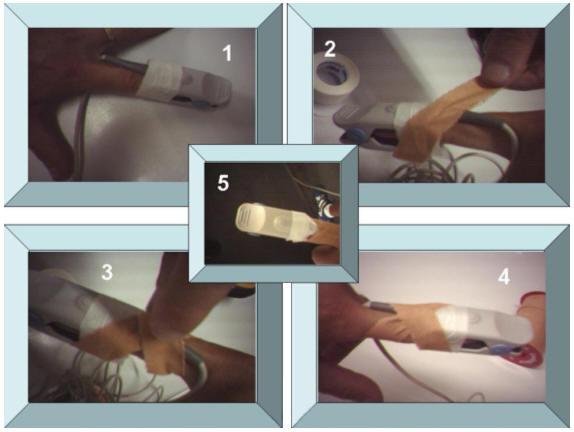
Figura 4. Fijación del Saturímetro al cuarto dedo.
Paso número 1: Colocación de una banda circular (banda blanca) en la parte distal del saturímetro (foto 1 de la Figura 4).
En el paso número 2: (foto 2 de la Figura 4) colocamos la banda de sujeción al dedo. Ésta comienza en la cara externa del saturímetro y progresa hacia la cara anterior del dedo, cruzando por encima y hacia atrás de la articulación interfalángica proximal, para llegar a la cara interna de la falange proximal del cuarto dedo.
En el paso número 3: (foto 3 de la Figura 4) la banda cruza la cara posterior de la falange proximal y se dirige hacia arriba por la cara externa de la falange proximal.
En el paso número 4: (foto 4 de la Figura 4) la banda cruza de nuevo por la articulación interfalángica proximal y acaba anclándose en la cara interna del saturímetro. Quedando el vendaje como se observa en la foto 5 de la gráfico 3.
La muestra estuvo compuesta (Tabla 2) por 78 varones de militantes en equipos de 2ª división B. Con una edad media de 22.37 y una desviación estándar de 5.56. Su peso fue de 73.23± 8.48 El VO2max/kg fue de 49.80±9.84 mientras que el VO2umb/kg fue de 37.63±8.28. La recogida de los datos se realizó en una base de datos de Access 97 y el análisis estadístico se realizó con el programa SPSS 11.01.
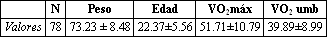
Tabla 2. Descripción de la muestra.
RESULTADOS

Tabla 3. Clasificación de las Desaturaciones.
Previamente a definir los patrones de desaturación vamos a clarificar unos conceptos previos. Vamos a clasificar las desaturaciones siguiendo a Dempsey (4), autor que clasificó las desaturaciones deportivas según la Tabla 3.
Así cuando hablemos de saturación normal siempre será superior a 95%, situando a las desaturaciones cuando los valores sean inferiores a 95%. Valoraremos como patrones de desaturación aceptables los calificados por Dempsey como leves. Y deberemos resaltar en nuestros informes sobre saturación las desaturaciones calificadas como moderados y graves.
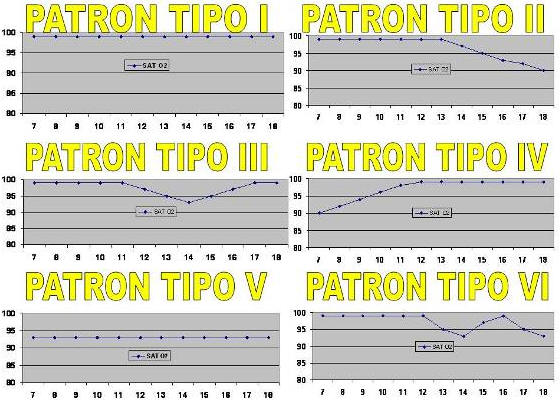
Figura 5. Patrones de Desaturación.
Patrón número I
En el primer patrón de desaturación (Figura 5) observamos deportistas cuya saturación se mantiene constante a lo largo de toda la prueba de esfuerzo (1,2). Consideramos este patrón siempre que la saturación esté constantemente por encima del 95%. Admitiendo pequeñas alteraciones en los registros que no pueden llegar a marcar tendencias. Esta es la mejor situación que podemos encontrar en un deportista. La frecuencia (Tabla 4) de este patrón en nuestro estudio es de un 20.51%. Siendo superior en numero al encontrado en la muestra de referencia (2) ya que en esta muestra de deportistas de alto nivel este patrón se produce en solo un 16.75%. Pero estas diferencias no son significativas al aplicamos la chi cuadrado.
Patrón número II
En este patrón (Figura 5) una vez que el deportista pasa el umbral y al acercarse al máximo comienza a presentar una desaturación progresiva (saturación menor de 95%) (1,2). El inicio de la desaturación puede ser postumbral, en la zona anaeróbica extensiva o en la zona anaeróbica intensiva; marcando las tres posibilidades de este patrón. En función de la proximidad al umbral la desaturación será más importante. Por tanto si la desaturación se produce próxima al umbral, este paciente desaturará más que si es en la última fase del anaeróbico intensivo. Es importante observar que la desaturación final no sea inferior a 88%, si se alcanza este nivel la desaturación deberá ser calificada como grave. Este es sin duda el patrón más frecuente de nuestro estudio (Tabla 4) con un 35.89% de los deportistas estudiados. Siendo superior el porcentaje de este patrón encontrado en los deportistas de la muestra de referencia(2) 46.60% Pero estas diferencias no son significativas al aplicamos la chi cuadrado.
Patrón número III
En este patrón (Figura 5) se produce una desaturación periumbral, que se recupera al final de la prueba de esfuerzo (1,2). Dicha desaturación forma los que denominaremos una cubeta de desaturación. Observamos como muchos deportistas tienen dificultades para mantener la saturación alrededor del umbral, recuperando rápidamente sus valores para acabar la prueba con valores de saturación normal (2). Este patrón en futbolistas solo alcanza un 6.48% el valor más bajo de los encontrados en nuestro estudio. Sin embargo este patrón es el tercero en frecuencia con un 13.58% de los deportistas de nuestra población de referencia (2). Encontrando diferencias significativas con una p<0.05. En muchas ocasiones este patrón esta relacionado con una inadecuada cadencia respiratoria. Se debe de aconsejar a estos deportistas que se fije en su cadencia respiratoria cuando realicen estas fases del ejercicio.
Patrón número IV
En este patrón (Figura 5) l deportista inicia la prueba con niveles bajos de saturación que va recuperando a lo largo de la prueba de esfuerzo. Estos deportistas arrancan la prueba con valores muy bajos de saturación y conforme avanza la prueba van recuperando a niveles normales (1,2). Acabando la prueba con niveles óptimos de saturación. Este patrón representa (Tabla 4) el 12.82% de los casos estudiados n futbolistas. Siendo el valor más pequeño que encontramos en los deportistas de la población de referencia(2) con solo un 6.33%. Encontrando diferencias significativas con una p<0.05.
Patrón número V
El deportista (Figura 5) mantiene saturaciones bajas a lo largo de toda la prueba de esfuerzo. Consideraremos valores bajos de saturación los inferiores al 95%. Si los valores son inferiores al 88% en este patrón, deberemos pensar en una patología médica que explique estas desaturaciones mantenidas a lo largo de la prueba de esfuerzo (1,2). Éste es el peor patrón espirométrico, que podemos encontrarnos en un deportista. Este patrón lo hemos encontramos con una frecuencia (Tabla 4) del 10.25% en nuestro estudio. Siendo un 9.50% para los deportistas de la muestra de referencia (2). No encontrando diferencias significativas entre ambas muestras. Posiblemente porque se asocie a una desadaptación al ejercicio.7.
Patrón número VI
El deportista (Figura 5) muestra una combinación de los patrones número II y número III: presentando una desaturación en el umbral y al final de la prueba de esfuerzo. Es decir en este patrón deben de existir al menos dos cubetas de desaturación Estos pacientes tienen dificultades para mantener la saturación durante el umbral y tras un periodo de recuperación vuelven a tener otra desaturación. Para no ser considerados dentro del patrón número II, la recuperación debe de alcanzar al menos el 95% (1,2). Este patrón (Tabla 4) se encuentra en el 14.10%% de los deportistas analizados en nuestro estudio. Siendo un 7.29% en la muestra de referencia(2) de nuestro estudio. Encontrando diferencias significativas con una p<0.05.
En la Tabla 4 mostramos la frecuencia de cada patrón de desaturación. En la segunda columna se muestran los valores de nuestra población, en la tercera los valores de los 221 deportistas de la población de referencia y en la tercera mostramos los casos en los que hemos encontrado diferencias significativas entre ambos grupos.
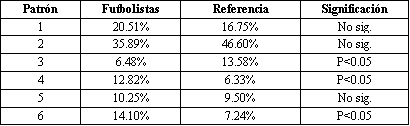
Tabla 4 . Frecuencia de cada patrón de saturación.
Creemos que los patrones 4, 5 y 6 se asocian a un mal estado de forma física, ya que se han observado en deportistas en las últimas fases de recuperación de lesiones. Lo que nos hace sospechar que la baja incidencia de estos patrones de desaturación se deba al buen estado físico del resto de la muestra. Vamos a comparar los dos grupos en función de si presentan los patrones de desaturación I,II o III ( como grupo con patrones de desaturación adecuados), con los resultados encontrado en los patrones de desaturación inadecuados IV, V o VI. En los futbolistas de nuestro estudios el porcentaje de patrones adecuados es del 62.82% mientras que los futbolistas que presenta patrones inadecuados representan un 37.18%. En el caso de los deportistas de la población de referencia (2), presenta un patrón de desaturación adecuado en un 76.92%, con solo un 23.08% de patrones de desaturación inadecuados. Es decir encontramos un mayor número de patrones inadecuados en los futbolistas. Encontrando diferencias significativas entre ambos grupos.
DISCUSION
Los estudios de Willians en 1986 (5) ya demostraron que los atletas con un entrenamiento adecuado producen desaturaciones a nivel del mar. Demostrando la relación inversa entre la saturación de oxigeno y el nivel de entrenamiento.
Según Mucci (6) el ejercicio induce una hipoxemia del 4% en la saturación de oxígeno medida con un analizador portátil. Este autor sobre 20 deportistas de nivel medio, con una edad media de 18 años. Son sometidos a un entrenamiento durante 8 semanas. Consiguió incrementos en el VO2máx del 10% en hombres y del 7,8% en mujeres). De los sujetos estudiados presentó una desaturación durante el ejercicio. Asociando este suceso a una inadecuada hiperventilación.
En el estudio de Miyachi (7) intentó comprender las variaciones de la saturación de oxígeno con el ejercicio intenso. Entrenó a 6 voluntarios durante 12 semanas. Asociando un grupo control de 5 sujetos no entrenados. Afirmando que los sujetos con menor acondicionamiento aeróbico, sufren desaturaciones de oxígeno al realizar ejercicios intensos. Concluyendo que la desaturación de oxígeno se relaciona con el valor del VO2máx y con el nivel de entrenamiento.
Otros autores como Dempsey (8) o Powers (9) han relacionado las desaturaciones de oxígeno a pacientes con una PaO2 disminuida sin hiperventilación. Dichos datos podrian explicar las cubetas de desaturación periumbrales.
En contraste con los estudios anteriores, otro autor como Hopkins (10) relaciona la desaturación a incrementos en la diferencia alveolo capilar de oxígeno.
Estudios posteriores (11,12.,13) dedujeron que la desaturación se producía por una parte por dificultades en la hiperventilación y por otra parte, por incrementos en la diferencia alveolo-capilar.
El mecanismo (14,15) por el cual las dificultades en la hiperventilación producen desaturaciones, aún no está aclarado.
Según los estudios previos (8,16,5) los incrementos en la diferencia alveolo capilar se deben a problemas primarios de difusión, causados por la velocidad de paso de los eritrocitos en los capilares pulmonares.
Tanto las dificultades en la hiperventilación como el incremento en la diferencia alveolo capilar, pueden ser superados al mejorar el entrenamiento aeróbico de nuestros deportistas (7).
Otros autores como Gore (17) han demostrado como los ciclistas de alto nivel también sufren desaturaciones. Achacando este fenómeno a dificultades en la diferencia alveolo capilar.
Queremos destacar también, la contribución de Henning (18). Quien demostró disminuir las desaturaciones de los deportistas, al aplicar bicarbonato. Realizando una asociación entre las desaturaciones y los cambios en el ph arterial.
El cuarto factor que influye en las desaturaciones es la temperatura (19) al favorecer la disociación del O2.
Powers (9) demostró que las desaturaciones se producen tanto en ejercicios que utilizan los miembros inferiores como los superiores, encontrando os mayores cambios en la saturación cuando los ejercicios superan 70% del VO2 máximo del sujeto.
Rice (20) opina que las desaturaciones de producen por causas intra y extrapulmonares, siendo estas el shunt arterio-venoso, la inadecuada ventilación perfusión pulmonar y las limitaciones en la difusión del oxigeno.
Woorons (43) estudio las desaturaciones ocurridas en mujeres que realizaban ejercicio a nivel del mar calificándolas en función del nivel de entrenamiento.. Demostrando como estas desaturaciones aumentaban al realizar ejercicio en altura. Y que estas desaturaciones eran más importantes cuanto menor era el nivel de entrenamiento de las participantes en su estudio.
Connes (44) ha encontrado una relación entre la viscosidad sanguínea y la saturación durante la prueba de esfuerzo, encontrando que los deportistas que tiene una mayor viscosidad sanguínea presentan mayores desaturaciones durante el ejercicio. Este autor especula con la posibilidad de que dichas desaturaciones se asocien a problemas en la difusión a nivel alveolo-pulmonar.
Stromvall (45) ha demostrado que los pacientes pediátricos con shunt cardiaco tienen una mayor desaturación durante el ejercicio. Confirmado la suposición de que el shunt izquierda- derecha condiciona la desaturación con respecto al ejercicio.
Guenette (46) Ha buscado la relación entre los cambios respiratorios agudos durante el ejercicio y las desaturación inducidas por el ejercicio. Al realizar un estudio con hombre y mujeres perfectamente entrenados a nivel del mar, no ha encontrando una relación entre las desaturaciones y la adaptación respiratoria al esfuerzo.
Las determinaciones e este estudio se han realizado en una ciudad situada a nivel del mar, pero debido a las diferencias gasométricas que se desprenden de la altitud, dichos diferencias deben de ser ponderadas a la hora de realizar estudios similares, dado que la saturación basal y los cambios debidos a su evolución en el ejercicio están claramente relacionados con la altura a la que se realiza la valoración funcional de deportista.
Si valoramos los patrones d desaturación en función de la edad (41) observamos como se aprecian diferencias entre los patrones encontrados en función de la edad. Esta claro que al igual que en la población no deportiva parte de estos cambios son debidos a las variaciones fisiopatológicas existentes a nivel pulmonar y circulatorio y como dichos parámetros varían en función de la edad. En este artículo los deportistas jóvenes y los deportistas de mayor edad tienen un mayor número de patrones inadecuados de saturación. Dichos cambios pueden estar relacionados con el nivel de entrenamiento.
Otro de los factores que pueden influir en los patrones de saturación encontramos como los valores pueden ser distintos en función del deporte, si comparamos los resultados obtenidos en este estudio realizado con futbolistas con los resultados obtenidos en jugadores de baloncesto (42) observamos como los futbolistas poseen mayor numero de patrones tipo I ( 20% en futbolistas, frente a 15% en jugadores de baloncesto), mientras que el patrón tipo II es más frecuente en jugadores de baloncesto (51% en básquet frente 47% en fútbol), El patrón tipo III es mas frecuente en fútbol (13% en futbolistas frente a 7% en jugadores de baloncesto). El patrón IV es levemente más frecuente en los jugadores de baloncesto, mientras que el patrón V es similar en cuanto a ambas muestras y el VI más frecuente en jugadores de baloncesto.
Si al comparar amas muestras lo hacemos en función de la adecuación o inadecuación de los patrones. El patrón adecuado (I, II, III) es los futbolistas (79.92%) más frecuente que en jugadores de baloncesto (73.58%), mientras que predomina esta patrón en los jugadores de básquet (26.41%) siendo solo un 23% en los futbolistas.
Ante esta situación nos encontramos ante dos preguntas. La primera es: Es el oxigeno un factor limitante del ejerció y segunda el trabajo con suplementación de oxigeno lograría ventajas en el deportista. El dr Grataloup (49) nos indica que en deportistas que sufren hipoxia inducida por el ejercicio, si se les administra oxigeno sufren un aumento en su rendimiento en comparación con los deportistas que no sufren esa hipoxia. Por tanto de este estudio se debe deducir que los deportista que sufren una hipoxia inducida por el ejercicio esta hipoxia puede ser el factor limitante y por tanto la mejoría de este factor altera la limitación a su ejercicio.
Otra de las grande preguntas que nos hacemos es si hay una correlación entre la desaturación detectada por el saturímetro y la desoxigenación a nivel muscular. Legrand (50) demostró que existe una correlación entre la hipoxia inducida por el ejercicio medida en función de la desaturación y la desoxigenación muscular. Es decir los deportistas que tiene desaturaciones durante la prueba de esfuerzo, tienen déficit de oxigenación a nivel muscular. Luego la desaturación tiene repercusiones a nivel del tejido muscular.
CONCLUSIONES
- Globalmente el patrón de desaturación que se repite en más ocasiones es el tipo II, tanto en los futbolistas como en los deportistas de referencia.
- Hay diferencias entre la frecuencia de presentación de los patrones de saturación entre los futbolistas y la población de referencia en el caso de los patrones numero III, IV y VI.
- Hay mayor número patrones de desaturación inadecuados en los futbolistas que en la población de referencia. Siendo estas diferencias significativas.
- No todas las desaturaciones de oxígeno se comportan igual con el esfuerzo. Encontrando claros patrones diferenciales entre deportistas y los futbolistas.
- Del conocimiento de estos parámetros y de sus posibles modificaciones, se pueden derivar nuevas estrategias de entrenamiento, que consigan mejorar el rendimiento de nuestros deportistas.
Referencias
1. Garrido Chamorro R.P., Gonzalez Lorenzo M., Garnes Ros A.F. Quiles Torregrosa, I (2003). Patrones de Desaturación durante la realización de una ergoespirometría. Revista Cubana de Medicina del Deporte y la Cultura Física
2. Davis J.A (1985). Anaerobic threshold: review of the concep and directions for future research. Med Sci Sport Exer; 17(1):6-21
3. Jerome A. Dempsey and Peter D (1999). WagnerExercise-induced arterial hypoxemia. J Appl Physiol; 87: 1997 - 2006
4. Williams JH, Powers SK, Stuart MK (1989). Hemoglobin desaturation in highly trained athletes at sea level. Eur J Appl Physiol 5:298-302
5. Mucci P, Blondel N, Fabre C, Nourry C, Berthoin S (2004). Evidence of exercise-induced O<sub>2</sub> arterial desaturation in non-elite sportsmen and sportswomen following high-intensity interval-training. Int J Sports Med.25(1):6-13
6. Miyachi M, Katayama K (1999). Effects of maximal interval training on arterial oxygen desaturation and ventilation during heavy exercise. Jpn J Physiol.49(5):401-7
7. Dempsey JA, Hanson PG, Henderson KS (1984). Exercise-induced arterial hypoxemia in hestlhy human sujets a sea level. J physol 355 161-175
8. Powers SK, Dodd S, Woodyard J, Beadle RE, Churh G (1984). Hemoglobin saturation during incremental arm and leg exercise. Br J Sport Med 18 212-216
9. Hopkins SR, Mckeney DC (1989). Hyposic ventilatory response and arterial desaturation during heavy exercise. J Appl Phisiol 67 1119-1124
10. Benoit H, Busso T, Castells J, Denis C, Geyssant A (1999). Influence of hypoxic ventilatory response on arterial O<sub>2</sub> saturation during maximal exercise in acute hypoxia. Eur J Appl Physiol 72 101-105,195
11. Harms CA Stager JM (1995). Low Chemoresponse and inadequate hyperventilation contribute to exercise induced hypoxemia. J Appl Physiol 79 575-580
12. Miyachi M, Tabaka I (1992). The relasionship between arterial oxygen desaturation during maximal exercise. J Appl Physiol 73 2588-2591
13. Norton KJ, Squires B, Norton LH, Craig NP, McGrath P, Olds TS (1995). Exercise Simulus increase ventilation from maximal to supramaximal intensity. Eur J Appl Physiol 70 115-125
14. Byrne-Quinn E, Weil JV, Sodal IE, Filley GF, Gover RF (1971). Ventilatory control in athlete. J Appl Physiol 30 91-98
15. Martin BJ Sparks KE Zwillich CW, Weill JV (1979). Low exercise ventilation in endurance. Atheletes Med Sci Sports 11 181-185
16. Dempsey JA (1986). Is the lung built for exercise?. Med Sci Sports Exerc 18,143-155
17. J. Gore, A. G. Hahn, G. C. Scroop, D. B. Watson, K. I. Norton, R. J. Wood, D. P. Campbell, and D. L (1996). EmonsonIncreased arterial desaturation in trained cyclists during maximal exercise at 580 m altitudeJ. Appl Physiol; 80: 2204 - 2210
18. Jerome A. Dempsey and Peter D (1999). WagnerExercise-induced arterial hypoxemia. J Appl Physiol; 87: 1997 - 2006
19. A. J. Rice, A. T. Thornton, C. J. Gore, G. C. Scroop, H. W. Greville, H. Wagner, P. D. Wagner, and S. R. Hopkins (1999). Pulmonary gas exchange during exercise in highly trained cyclists with arterial hypoxemia. J Appl Physiol; 87(5): 1802 - 1812
20. Moran RF, Clausen Jl, Ehrmeyer SS, Fiel M, Van Kessel Al (1990). Oxygen content, hemoglobin oxigen, saturation and related quantitics in blood. terminology, measurement and reporting, national committe for clinical Loboratory Satndards; 525-p. 10: 1-49
21. Schanapp LM, Cohen NH (1990). Pulse oximetry-uses and abuses. Chest; 98: 1244-1250
22. JP, De Cesare MS, Hess D (1990). Pulse Oximetry: instrumentation and clinical applications. Respir Care; 35: 584-601
23. Jubran A, Tobin MJ (1990). Relability of pulse oximetry in tritrating supplemental oxygen therapy in ventilator dependet patients. Chest; 97: 1420-1425
24. Task Force on Guidelines, Society of Critical Care Medicine (1991). Guideline for standards of care for patients with acute respiratory failure on mechanical ventilatory support. Crit Care Med; 19: 275-278
25. Misian DR, Meyerhoff ME, Collision ER (1990). Current and future directions in the technology relating to bedside testing of critically ill patients. Chest; 97: 2045-2145
26. Hannhart B, Michael H, Delomere N, Chaparro G, Pulo JM (1991). Reliability of six pulse oximetrs in chronic obstructive pulmonary disease. Chest; 99: 842-846
27. ECRI Health Devices Alert (1990). Plymouth Meeting. PA. ECRI
28. Chanan C, Decker MJ, Hoeckel OL, Strohl KP (1990). Agreement between noninvasive oximetric values for oxygen saturation. Chest; 97: 814-819
29. Hannhar B, Habberer JP, Saunier C, Laxenaire MC (1991). Accuracy and precision of fourteen pulse oximetrs. Eur Respir Care; 4: 115-119
30. Chelluri L, Snyder JV, Bird R (1991). Accuracy f pulse oximetry in patients winth hyperbilirubinemia. Respir Care; 36: 1383-1386
31. Ries AL (1990). Position paper of the American Association of cardiovascular and pulmonary rehabilitation. J Cardiopul Rehab; 10: 418-441
32. Zaloga GP (1990). Evaluation of bedside testing options for the critical care unit. Chest; 97: (5, Suppl): 1755-1905
33. (1996). Manual del usuario. Oxy 9800. Versión 3,2
34. The American Collage of Surgeons (1996). Curso avanzado de apoyo vital en trauma para médicos. Subcommite of ATLS. Commite of Trauma
35. (1996). Manual de usuario. Oxy 9800 versión 2.3
36. Severinghaus JW, Astrup PB (1986). History of blood gas analysis. VI.Oximetry.J Clin Monit; 2: 270-288
37. Millikan GA, Papenheimer JR, Rawson AJ (1941). Continuous measurement of oxygen saturation in man. Am J Physiolog; 133: 390
38. Tremper KK, Barker SJ (1989). Pulse oximetry.Anesthesiology.
39. Woorons X, Mollard P, Lamberto C, Letournel M, Richalet JP (2005). Effect of acute hypoxia on maximal exercise in trained and sedentary women. Med Sci Sports Exerc;37(1):147-54
40. Connes P, Bouix D, Durand F, Kippelen P, Mercier J, Prefaut C, Brun JF, Caillaud C (2005). Is hemoglobin desaturation related to blood viscosity in athletes during exercise?. Int J Sports Med;25(8):569-74
41. Stromvall-Larsson E, Eriksson BO, Holmgren D, Sixt R (2004). Pulmonary gas exchange during exercise in Fontan patients at a long-term follow-up. Clin Physiol Funct Imaging; 24(6):327-34
42. Guenette JA, Diep TT, Koehle MS, Foster GE, Richards JC, Sheel AW (2004). Acute hypoxic ventilatory response and exercise-induced arterial hypoxemia in men and women. Respir Physiol Neurobiol, 12;143(1):37-48
43. Jose Vicente Asensi (2005). Ventilación pulmonar y ejercicio físico. Visto en: http://html.rincondelvago.com/ventilacion-pulmonar-y-ejercicio-fisico.html
44. Wilmore and Costill (2004). Fisiología del esfuerzo y el deporte. ed Paidotribo 5º edición capitulo 8 pag 244-272
45. Grataloup O, Prieur F, Busso T, Castells J, Favier FB, Denis C, Benoit H (2005). Effect of hyperoxia on maximal O(2) uptake in exercise-induced arterial hypoxaemic subjects. Eur J Appl Physiol. 94(5-6):641-645
46. Legrand R, Ahmaidi S, Moalla W, Chocquet D, Marles A, Prieur F, Mucci P (2005). O2 arterial desaturation in endurance athletes increases muscle deoxygenation. Med Sci Sports Exerc. 37(5):782-8