Problemas digestivos en deportistas: abordaje desde la nutrición (parte I)
Publicado 20 de octubre de 2015, 15:33
Mata Ordoñez, Fernando; Carrera Bastos, Pedro; Picazo, Oscar.; Sánchez, Laura;Sánchez Oliver Antonio.J
Bill Rodgers, leyenda del maratón, ganador de la Maratón de New York y de Bostón durante cuatro años decía “Más maratones son perdidos en los baños portátiles que en la mesa de la cena”. Esta frase nos invita a entrar en una de las grandes problemáticas en los deportistas de resistencia: los problemas gastrointestinales.
Dependiendo de la metodología usada en el estudio, así como el tipo de evento, se estima que entre el 30-90% de los corredores de larga distancia experimenta síntomas gastrointestinales (sGI). Las complicaciones pueden variar en severidad e incluyen síntomas como nauseas, vómitos, dolor abdominal y diarrea con sangre. La prevalencia varia dependiendo del tipo de evento, de las condiciones ambientales y del nivel del atleta. Si bien, existe una alta correlación entre las complicaciones GI y la historia de sGI, indicando una mayor predisposición de algunas personas, lo que sugiere un elevado componente genético en estos problemas (Prado de Oliveria et al., 2014).
A la luz de los datos anteriores se ha observado como los problemas GI pueden tener un efecto importante sobre el rendimiento y la salud del deportista.
EFECTOS DEL EJERCICIO SOBRE LA FUNCIÓN GASTROINTESTINAL
Diferentes estudios señalan a la isquemia del tracto GI inferior como el principal responsable de la sGI en deportistas. Schaub et al.,1985 observó, a través de colonoscopia, los cambios que se producían en la superficie epitelial debidos a la isquemia en un triatleta tras el maratón.
En cuanto a las causas etiologías de los problemas GI, tradicionalmente se ha focalizado sobre la perfusión GI, si bien, también se producen cambios en la motilidad, función de la barrera intestinal y absorción.
La hipoperfusión esplácnica es inherente a la fisiología del ejercicio a intensidades elevadas. De esta forma, durante la práctica de ejercicio intenso, nuestro organismo redistribuye el flujo sanguíneo a merced de la demanda de los territorios activos como son el esquelético, la piel y el cerebro. Esa redistribución se encuentra mediada por la secreción de norepinefrina, la cual se une a receptores α-adrenérgicos del sistema nervioso simpático induciendo vasoconstricción. Esta vasoconstricción puede reducir el flujo sanguíneo hasta en un 80% durante el ejercicio intenso, provocando una isquemia de la mucosa intestinal, lo que puede resultar en un aumento de la permeabilidad (van Wijck K et al.,2012; Pals KL et al.,1997) y dando lugar a nauseas, vómitos, dolor abdominal y diarrea (de Oliveira EP et al.,2011, 2009), aunque es necesario un mayor grado de evidencia.
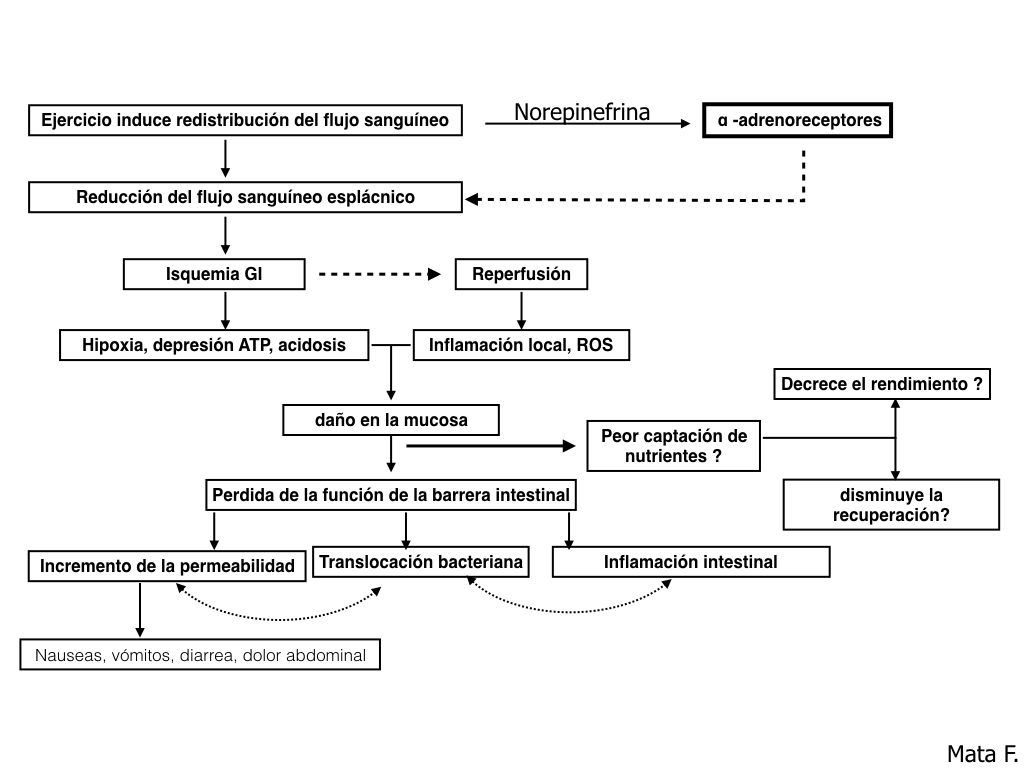
Figura 1. Efectos de la redistribución de flujo sanguíneo durante el ejercicio y la reducción del flujo sanguíneo esplácnico.
También se han observado cambios en la motilidad GI a diferentes niveles, disminuyendo la peristalsis esofágica y el tono del esfínter esofágico interior, lo que puede estar relacionado con reflujo gastroesofágico durante el ejercicio (Peters HP et al.,2000).
Sobre el vaciado gástrico, algunos estudios muestran que no existe efecto del ejercicio moderado, mientras que el ejercicio de alta intensidad o intermitente si lo puede afectar.
PERMEABILIDAD INTESTINAL
El epitelio intestinal es una sola capa de células que recubren el lumen intestinal y tiene dos funciones críticas. En primer lugar, actúa como una barrera para impedir el paso de entidades intraluminales nocivas, en particular antígenos extraños, microorganismos y sus toxinas. Su segunda función es la de actuar como un filtro selectivo que permite la translocación de nutrientes esenciales de la dieta, electrolitos y agua desde el lumen intestinal a la circulación.
El epitelio intestinal media la permeabilidad selectiva a través de dos rutas principales: vía transepitelial/transcelular y vía paracelular. La permeabilidad transcelular se asocia generalmente con el transporte de solutos a través de las células epiteliales y, predominantemente, regulado por los transportadores selectivos para aminoácidos, electrolitos, ácidos grasos de cadena corta y los azúcares. La permeabilidad paracelular está asociada con el transporte en el espacio existente entre las células epiteliales, y está regulada por complejos intercelulares localizadas en la unión a la membrana apical y lateral a lo largo de la membrana lateral. El contacto entre las células epiteliales intestinales incluye tres componentes identificados a nivel ultraestructural: desmosomas, las uniones adherentes (AJs) y las uniones estrechas (TJ), estas últimas son las responsables de sellar el espacio intercelular y la regulación de forma selectiva del transporte paracelular de solutos iónicos. Los complejos AJ y TJ también son importantes en la regulación de la proliferación celular, la polarización y la diferenciación.
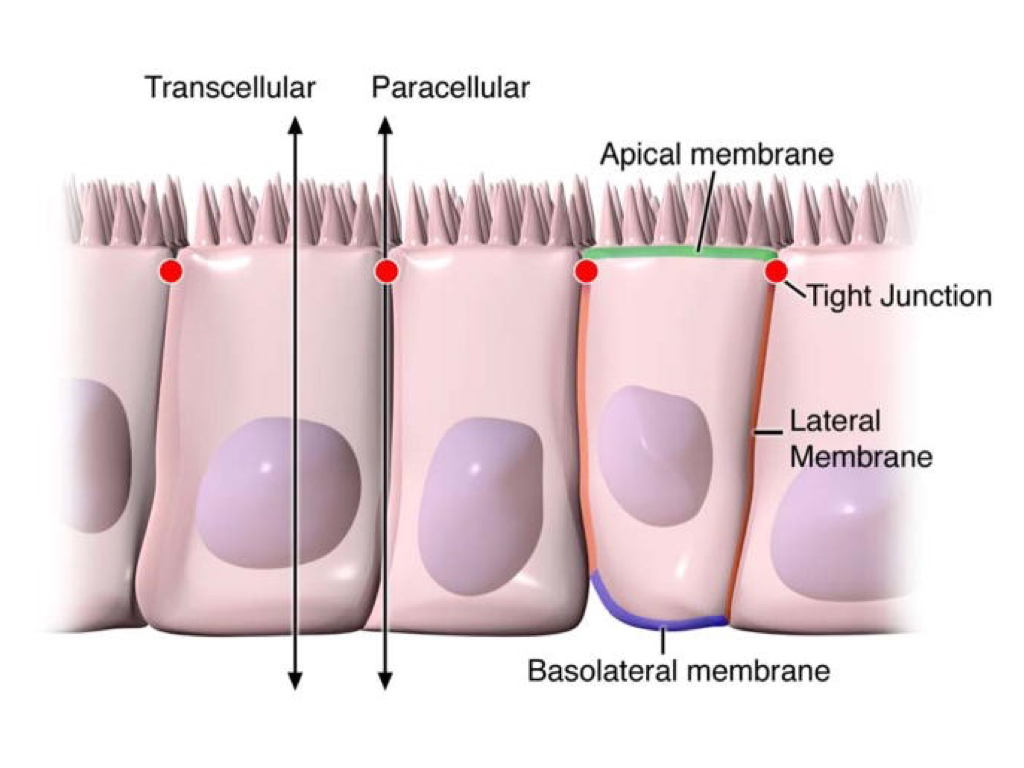
Figura 2. Diferentes uniones celulares. Tomando de Katherine R et al.,2009
Tal y como expresa el Dr. Fasano et al., 2012, “el intestino, más allá de la digestión, controla en el paso de agua, electrolitos y otros nutrientes a través de su pared, también es responsable del control del tráfico a antígenos ambientales”. Las TJ son responsables del trafico paracelular de macromoléculas y, por tanto, contribuyen al equilibrio entre la tolerancia y la respuesta inmune a los antígenos no propios. Consisten en proteínas especializadas, como ocludina, zona ocludens (ZO-1, ZO-2, ZO-3) y claudinas (Podolsky DK, 1999; Kuennen M et al.,2011) y se ha encontrado que constan de cuatro familias únicas de proteínas transmembrana: Ocludina, Claudins, moléculas de adhesión de unión (JAM) y tricellulin. Cuando las TJ se rompen o relajan, otras moléculas (> 4 Å) pueden pasar vía paracelular entre las células epiteliales intestinales a la circulación sistémica (Tunner et al.,2009). La importancia de la TJ fue demostrada por Raimondi et al 2008, quienes demostraron que cuando decrece la expresión de ocludina, se producen cambios en su estado de fosforilación y se altera su localización en la TJ, lo que incrementa la permeabilidad intestinal. Esto genera el paso de sustancias a través del epitelio, seguido de translocación bacteriana y de otros agentes y, por tanto, inflamación sistémica (Pape HC., et a.,1994; Berkes J., et al.,2003). Esto puede generar, entre otros problemas, el incremento en el riesgo de enfermedades crónicas (Lichtman SM et al.,2001; Petersen et al.,2005).
La integridad de la barrera intestinal esta regulada a través del estado de fosforilación en diferentes lugares de las TJ a través diferentes proteínas kinasas. Claudinas y ocludinas están reguladas a través de la fosforilación de varias proteínas como protein kinasa C (PKC), protein kinasa A (PKA), MAPK, etc. La fosforilación de las ocludinas por PKCc y tirosina kinasa ha sido demostrado disminuye el ensamblaje de TJ mientras que la fosforilación por la PKCn mejora la resistencia de las TJ. La fosforilación de las claudinas por PKCn promueve la formación de fibrillas y el ensamblaje de las TJ mientras que PKA tiene efectos opuestos.
Diferentes estímulos generan cambios en la TJ, por ejemplo, la activación de la bomba Na/K ATPasa, en respuesta a la alimentación, incrementa la permeabilidad de las TJ para la absorción de nutrientes; el incremento de volumen intersticial, seguido de un aumento de una presión (> 4mmHg) potencia la permeabilidad paracelular y la absorción de fluido; el ejercicio físico intenso y el estrés térmico dan lugar a un aumento de la permeabilidad intestinal.
El estrés térmico aumenta la permeabilidad intestinal
El ejercicio de larga duración o el ejercicio practicado en ambientes calientes, resulta en un aumento de la temperatura central por encima de los 39ºC. El organismo deriva la circulación arterial esplácnica y renal al lecho vascular cutáneo para incrementar así la perdida de calor. La vasoconstricción esplácnica provoca un aumento de temperatura en la zona. La hipertermia (>40ºC) ha sido demostrado que daña el epitelio intestinal causando descamación del epitelio, reducción de las vellosidades, edema y hemorragia masiva.
Se ha mostrado como la permeabilidad intestinal se incrementa en los corredores y células humanas epiteliales intestinales cultivadas a temperaturas por encima de 39ºC (Dokladny K.et al,2006). Estos autores realizaron un estudio en células epiteliales Caco-2 con un modelo in vitro de epitelio intestinal, donde evaluaron los efectos de la exposición a altas temperaturas en las uniones estrechas de la barrera intersticial. Encontraron que la exposición de las monocapas de células Caco-2 a un aumento de la temperatura, de los 39ºC a 41ºC, resultaba en un aumento de la permeabilidad de estas uniones y que este efecto era creciente en relación con al tiempo y la temperatura de estimulación de las células (p<0,001).
En un estudio reciente, Gill et al., 2015 determinaron la concentración de endotoxinas y perfil de citoquinas 19 corredores de ultramaratón frente a un grupo control (n=12) durante cinco etapas de un total de 230 Km (media + SD: 27h38min +- 3h5min) en condiciones de calor y humedad (30ºC a 40ºC y del 31% al 40% de humedad relativa). Se observó aumento en un 21% de endotoxinas en la etapa 5, PCR (↑889% en la etapa 3) TNF-α (↑168% ), IFN-α (↑102% en la etapa 5), IL-10 (↑1271%, etapa 3), IL-1ra (↑106% etapa 5) con respecto al grupo control. En cuanto al pre y post en el grupo que realizaron la ultramaratón también fueron observados cambios en la endotoxemia (↑22% etapa 3), PCR (↑25% en la etapa 1), IL-6 (↑238% en la etapa 1), IL-1B (↑64% etapa 1), TNF-α (↑101% en la etapa 1), IFN-ϒ (↑29% etapa 1), IL 10 (↑1100% etapa 1), IL-1ra (↑207% etapa 1). Por tanto, el ejercicio de ultramaratón resulta de una modesta endotoxemia acompañada de una pronunciada citoquinemia pro-inflamatoria después de la etapa 1.
El aumento de la permeabilidad inducida por la hipertermia conduce a la translocación de lipopolisacárido (LPS) en la circulación sanguínea, donde se une al TLR4 de los linfocitos, produciendo la liberación de citoquinas pro-inflamatorias, tales como el factor de necrosis tumoral α (TNF-α), IFN-ϒ, IL-1β o IL-TNF-α 63. TNF-α ha sido demostrado daña la bomba Na/K de la membrana basolateral, lo que resulta en una reducción de la absorción de agua, secreción de fluido del lecho vascular al lumen y diarrea (Musch et al., 2002).
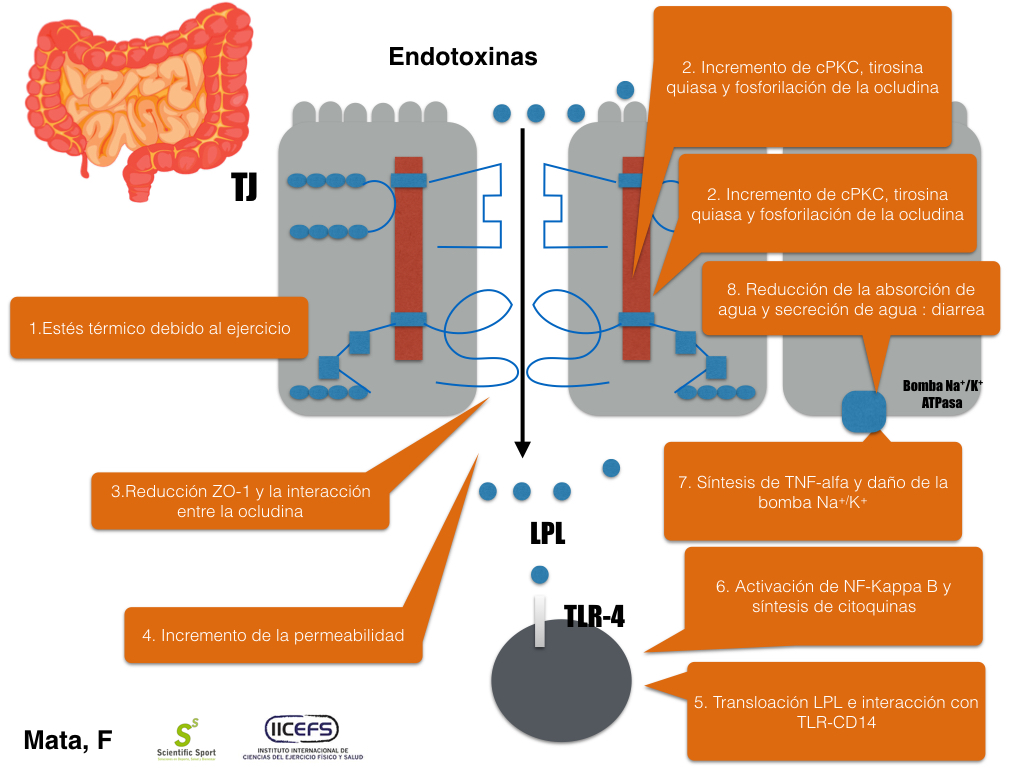
Figura 3. Efecto del estrés térmico sobre la permeabilidad intestinal
Por tanto, el estrés térmico condiciona un aumento de la permeabilidad de las TJ disminuyendo la interacción entre las ocludinas y claudinas con la zona ocludens (Dokladny K, et al.,2006; Ikari A et al.,2005). La activación de PKCc en la células del epitelio intestinal causa una disminución de la resistencia de TJ. Ello condiciona un aumento de la permeabilidad y, por tanto, un aumento de la translocación bacteriana, lo que da lugar a una respuesta inmunitaria mediada por los linfocitos T. INF-γ y TNF-α median contracción del citoesqueleto de actina, y apertura de TJ a través de kinasa de cadela ligera de miosina (MLCK) que fosforila dichas cadenas MLC
El ejercicio de alta intensidad aumenta la permeabilidad intestinal
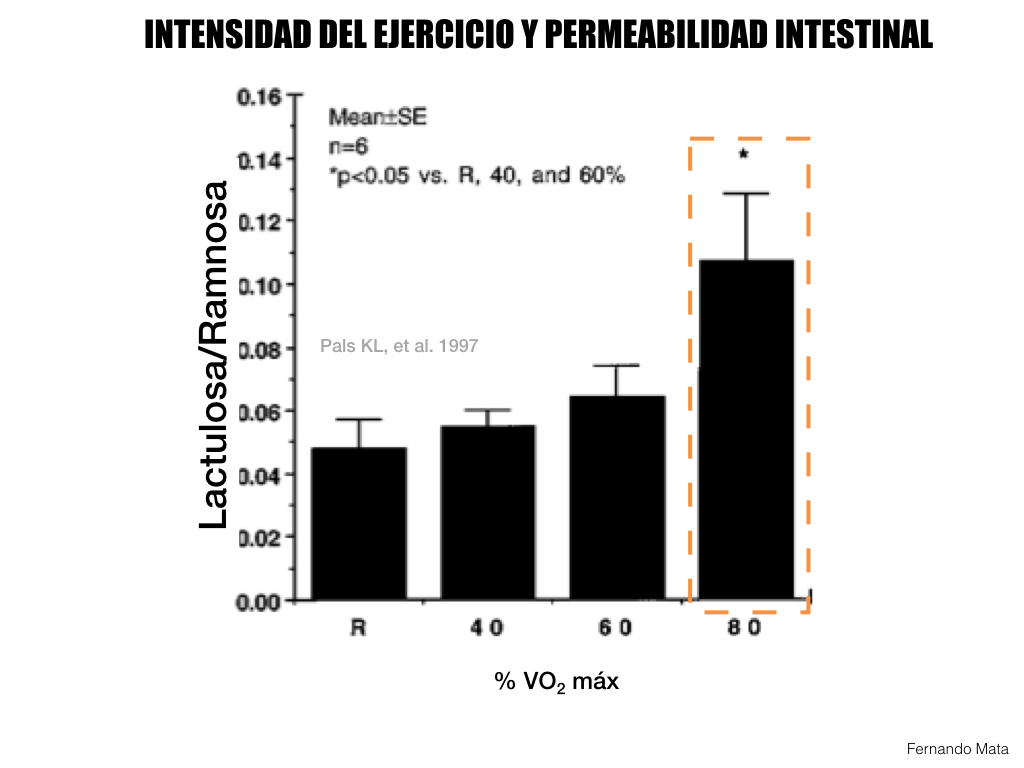
Diferentes estudios han evaluado el efecto del ejercicio de elevada intensidad sobre la permeabilidad intestinal. De esta forma, Pals et al., 1997 estudiaron atletas que corrían en un cinta por una 1h a diferentes intensidades de ejercicio, 40, 60 y 80% VO2máx. El objetivo era evaluar el efecto de la intensidad del ejercicio en la permeabilidad intestinal por medio del test de lactulosa/ramnosa. En una temperatura ambiente de 22ºC, a 80% VO2máx, los atletas presentaron permeabilidad intestinal, observándose un aumento significativo de la relación lactulosa/ramnosa debido a un aumento de la lactulosa. En reposo la media de la relación lactulosa/ramnosa era de 0,048% mientras que en el ejercicio al 80% la media fue de 0,107%.
Un estudio reciente de Van Houten et al.,2015, publicado en Medical Hypotheses, ofrece una relevante información sobre los nuevos hallazgos sobre el mecanismo de control homeostático de protección y de integridad intestinal. A este respecto, recientes estudios han visto como la actividad parasimpática (vagal) incrementa la expresión y localización de las TJ, decreciendo la permeabilidad intestinal. Los autores plantean la hipótesis de que la actividad parasimpática provee una función protectora y reparadora de la pared intestinal, a lo que contribuyen los beneficios terapéutico del ejercicio físico regular. La actividad vagal parece activar a las células gliales entéricas, las cuales se secretan GSNO, incrementando la expresión y localización adecuada de las TJ, disminuyendo la permeabilidad intestinal, la inflamación sistémica y las enfermedades crónicas. Si bien, la actividad vagal es reducida durante el ejercicio especialmente de alta intensidad o larga duración sin una adecuada recuperación, lo que puede afectar a la permeabilidad de la barrera GI.
La isquemia GI generada por el ejercicio de alta intensidad puede ser desencadenante del aumento de la permeabilidad intestinal. De esta forma, sabemos que la hipoxia del tejido da lugar a un amento de la hidrólisis de ATP a AMP, el cual, durante la reperfusión a través del ciclo de las xantinas es reducido a xantina por la enzima xantina oxidasa, lo que da lugar a la producción de peróxido de hidrógeno, potente radical libre que genera la disrupción de las TJ. El mecanismo parece estar mediado por la fosforilación de la ocludina por la enzima tirosina kinasa c-Src, causando la translocación de la ocludina dentro del espacio intracelular y reduciendo así la interacción con ZO-1. La hipoxia de las células epiteliales se ha demostrado activa a la PKC seguida de la fosforilación de las ocludinas y disminución de su integridad. El H2O2 activa a κB (NF- κB), lo cual controla la transcripción de citoquinas pro-inflamatorias (INF-γ, TNF-α, IL-6,IL-1Β) lo que produce un aumento de la permeabilidad.
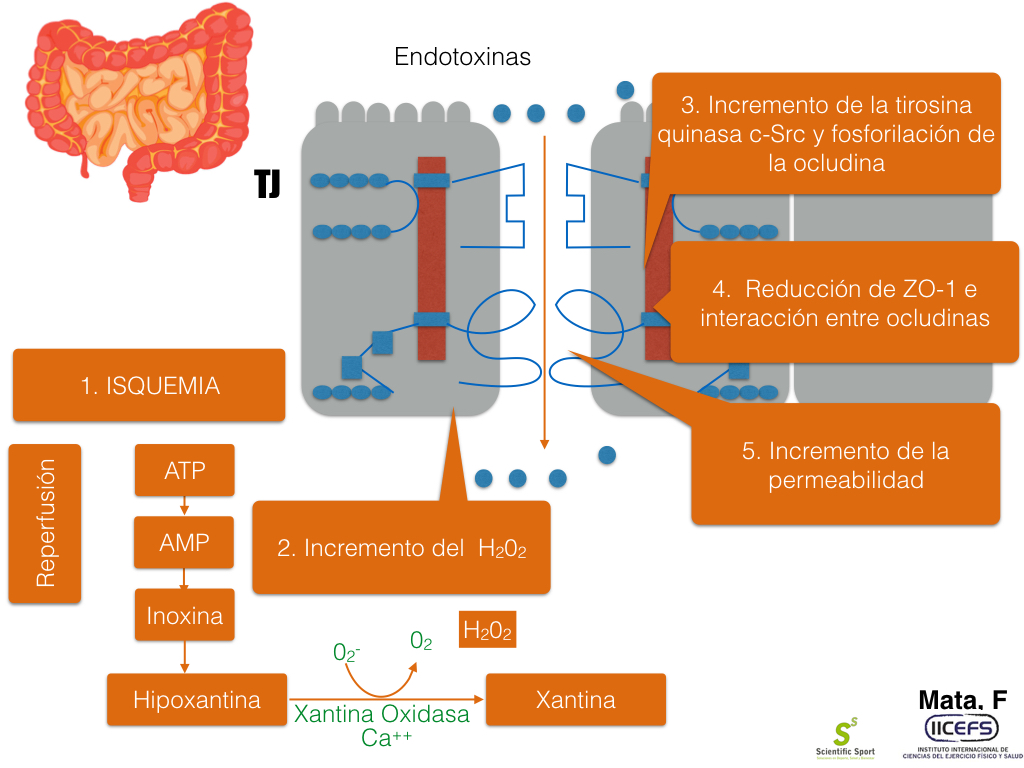
Figura 4. Efectos de la intensidad de ejercicio sobre la permeabilidad intestinal
El ejercicio de alta intensidad causa isquemia intestinal que incrementa la producción de peróxido de hidrógeno, el cual desestabiliza la barrera de dos maneras: 1. Mediantes la fosforilación de TJ. 2. Aumento de la producción de NF- κB y citoquina proinflamatorias.
Proteínas de choque térmico (HSP)
Un aspecto relevante en todo este proceso lo representan las proteínas de choque térmico (HSP). Se trata de chaperonas que asisten a la síntesis de proteínas y el mantenimiento celular, además de proteger a las células bajo ciertas condiciones de estrés. Algunos puntos destacados de su función son:
- Aumentan sus niveles intracelulares en células mononucleares plasmáticas de atletas después de un evento de resistencia y en atletas entrenados en respuesta al estrés impuesto por el ejercicio.
- Aumentan en respuesta a la aclimatización proporcionando mayor termotolerancia.
- Protegen frente enfermedades GI reduciendo el nivel de lesiones gástricas y síntomas de colon irritable.
- En el tracto GI, el incremento de HSP70 incrementa la expresión de fibras de actina lo que previene la ruptura de las ocludinas.
- Además se ha visto protege a las células intestinales del H2O2 y el daño producido por la hipoxia.
- HSP70 protege al epitelio intestinal bajo condiciones de hipertermia previniendo la activación de PKCc y reduce la fosforilación de MLC en la actina del citoesqueleto y las ocludinas.
- Reduce la activación de tirosinas kinasa durante la isquemia-reperfusión resultando en mayor interacción entre la ocludinas y ZO-1 y estabilidad de las TJ.
- Previene la translocación de NF-κB hasta el núcleo al epitelio intestinal reduciendo la síntesis de citoquinas proinflamatorias como TNF-α y manteniendo la estabilidad por tanto de TJ. (Dokladny K et al,2010)
CAUSAS MECÁNICAS.
Se encuentran relacionadas fundamentalmente con el impacto y la postura. Por ejemplo, algunos estudios muestran como los síntomas son mas comunes en corredores que en ciclistas siendo la posible causa el impacto repetitivo de la carrera y subsecuente daño sobre la pared intestinal. El impacto mecánico, junto con la isquémica, posiblemente sean la causa de la sangre en las heces (De Oliveria EP., 2009, Moses FM, et al.,1990). La postura también parece afectar a los síntomas gastrointestinales como se muestran por ejemplo en ciclistas, donde las sintomatología de problemas de tracto GI superior son mas prevalentes quizás por el incremento de presión de el abdomen resultado de la posición, particularmente en la “aero” (Waterman JJ et al.,2012).
Bibliografía
J.M. Van Houten, R.J. Wessells, H.L. Lujan, S.E. DiCarlo, My Gut Feeling Says Rest: Increased Intestinal Permeability Contributes to Chronic Diseases in High-Intensity Exercisers, Medical Hypotheses (2015
Berkes J, Viswanathan VK, Savkovic SD, Hecht G. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation. Gut 2003;52:439–51
de Oliveira EP, Burini RC, Jeukendrup A. Gastrointestinal complaints during exercise: prevalence, etiology, and nutritional recommendations. Sports Med. 2014
de Oliveira EP, Burini RC. Food-dependent, exercise-induced gastrointestinal distress. J Int Soc Sports Nutr. 2011;8:12.
de Oliveira EP, Burini RC. The impact of physical exercise on the gastrointestinal tract. Curr Opin Clin Nutr Metab Care. 2009;12:533–8
Dokladny K, Lobb R, Wharton W, et al. LPS-induced cytokine levels are repressed by elevated expression of HSP70 in rats: possible role of NF-kappaB. Cell Stress Chaperones 2010;15:153–63.
Dokladny K, Moseley PL, Ma TY. Physiologically relevant increase in temperature causes an increase in intestinal epithelial tight junction permeability. Am J Physiol Gastrointest Liver Physiol 2006;290:G204–12.
Dokladny K, Moseley PL, Ma TY. Physiologically relevant increase in temperature causes an increase in intestinal epithelial tight junction permeability. Am J Physiol Gastrointest Liver Physiol 2006;290:G204–12.
Dörfel MJ, Huber O. Modulation of tight junction structure and function by kinases and phosphatases targeting occludin. J Biomed Biotechnol 2012;807356:1–14.
Fordtran JS, Saltin B. Gastric emptying and intestinal absorption during prolonged severe exercise. J Appl Physiol. 1967;23:331–5.
Gloire G, Legrand-Poels S, Piette J. NF-kappaB activation by reactive oxygen species: fifteen years later. Biochem Pharmacol 2006;72:1493–505.
Groschwitz KR, Hogan SP. Intestinal barrier function: molecular regulation and disease pathogenesis. J Allergy Clin Immunol 2009;124:3–20.
Havasi A, Wang Z, Gall JM, et al. Hsp27 inhibits sublethal, Src-mediated renal epithelial cell injury. Am J Physiol Renal Physiol 2009;297:F760–8.
Ikari A, Nakano M, Suketa Y, et al. Reorganization of ZO-1 by sodium-dependent glucose transporter activation after heat stress in LLC-PK1 cells. J Cell Physiol 2005;203:471–8.
Jeukendrup AE, Vet-Joop K, Sturk A, et al. Relationship between gastro-intestinal complaints and endotoxaemia, cytokine release and the acute-phase reaction during and after a long-distance triathlon in highly trained men. Clin Sci (Lond). 2000;98:47–55.
Katherine R. Groschwitz, BS and Simon P. Hogan, Intestinal Barrier Function: Molecular Regulation and Disease PathogenesisJ Allergy Clin Immunol. 2009 July ; 124(1): 3–22.
Kuennen M, Gillum T, Dokladny K, et al. Thermotolerance and heat acclimation may share a common mechanism in humans. Am J Physiol 2011;301:R524–33.
Lambert GP, Lang J, Bull A, et al. Fluid restriction during running increases GI permeability. Int J Sports Med 2008;29:194–8.
Leiper JB, Prentice AS, Wrightson C, et al. Gastric emptying of a carbohydrate-electrolyte drink during a soccer match. Med Sci Sports Exerc. 2001;33:1932–8.
Lichtman SM. Bacterial translocation in humans. J Pediatr Gastroenterol Nutr 2001;33:1–10.
Marchbank T, Davison G, Oakes JR, et al. The nutriceutical bovine colostrum truncates the increase in gut permeability caused by heavy exercise in athletes. Am J Physiol Gastrointest Liver Physiol 2011;300:G477–84.
Moses FM. The effect of exercise on the gastrointestinal tract. Sports Med. 1990;9:159–72.
Musch MW, Clarke LL, Mamah D, et al. T cell activation causes diarrhea by increasing intestinal permeability and inhibiting epithelial Na+/K+-ATPase. J Clin Invest 2002;110:1739–47.
Musch MW, Sugi K, Straus D, et al. Heat-shock protein 72 protects against oxidant-induced injury of barrier function of human colonic epithelial Caco2/bbe cells. Gastroenterology 1999;117:115–22.
Oktedalen O, Lunde OC, Opstad PK, et al. Changes in the gas- trointestinal mucosa after long-distance running. Scand J Gas- troenterol. 1992;27:270–4.
Otte JA, Geelkerken RH, Oostveen E, et al. Clinical impact of gastric exercise tonometry on diagnosis and management of chronic gastrointestinal ischemia. Clin Gastroenterol Hepatol. 2005;3:660–6.
Pals KL, Chang RT, Ryan AJ, et al. Effect of running intensity on intestinal permeability. J Appl Physiol. 1997;82:571–6.
Pape H-C, Dwenger A, Regel G, Auf’m’Kolck M, Gollub F, Wisner D, et al. Increased gut permeability after multiple trauma. Br J Surg 1994;81:850–2.
Peters HP, Wiersma JW, Koerselman J, et al. The effect of a sports drink on gastroesophageal reflux during a run-bike-run test. Int J Sports Med. 2000;21:65–70.
Petersen AMW, Pedersen BK. The anti-inflammatory effect of exercise. J Appl Physiol 2005;98:1154–62.
Podolsky DK. Mucosal immunity and inflammation. V. Innate mechanisms of mucosal defense and repair: the best offense is a good defense. Am J Physiol 1999;277:G495–9. Rao R. Occludin phosphorylation in regulation of epithelial tight junctions. Ann N Y Acad Sci 2009;1165:62–8.
Raimondi F, Santoro P, Barone MV, Pappacoda S, Barretta ML, Nanayakkara M, et al. Bile acids modulate tight junction structure and barrier function of Caco-2 monolayers via EGFR activation. Am J Physiol - Gastrointest Liver Physiol 2008;294:G906–13.
Rudzki SJ, Hazard H, Collinson D. Gastrointestinal blood loss in triathletes: its etiology and relationship to sports anaemia. Aust J Sci Med Sport. 1995;27:3–8.
Sasaki M, Joh T. Oxidative stress and ischemia-reperfusion injury in gastrointestinal tract and antioxidant, protective agents. J Clin Chem Clin Biochem 2007;40:1–12
Schaub N, Spichtin HP, Stalder GA. Ischemic colitis as a cause of intestinal bleeding after marathon running. Schweiz Med Woc- henschr. 1985;115:454–7.
Stanley J, Peake JM, Buchheit M. Cardiac parasympathetic reactivation following exercise: implications for training prescription. Sports Med Auckl NZ 2013;43:1259–77.
Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol 2009;9:799–809.
Van Nieuwenhoven MA, Brouns F, Brummer RJ. Gastrointestinal profile of symptomatic athletes at rest and during physical exercise. Eur J Appl Physiol 2004;91:429–34.
van Wijck K, Lenaerts K, Grootjans J, et al. Physiology and pathophysiology of splanchnic hypoperfusion and intestinal injury during exercise: strategies for evaluation and prevention. Am J Physiol. 2012;303:G155–68.
Waterman JJ, Kapur R. Upper gastrointestinal issues in athletes. Curr Sports Med Rep. 2012;11:99–104.
Wijck K van, Lenaerts K, Grootjans J, Wijnands KAP, Poeze M, Loon LJC van, et al. Physiology and pathophysiology of splanchnic hypoperfusion and intestinal injury during exercise: strategies for evaluation and prevention. Am J Physiol - Gastrointest Liver Physiol 2012;303:G155–68.
Wright H, Collins M, Villiers RD, et al. Are splanchnic hemo- dynamics related to the development of gastrointestinal symptoms in ironman triathletes? A prospective cohort study. Clin J Sport Med. 2011;21:337–43.
Yang PC, He SH, Zheng PY. Investigation into the signal transduction pathway via which heat stress impairs intestinal epithelial barrier function. J Gastroenterol Hepatol 2007;22:1823–31.
