Problemas digestivos en deportistas: abordaje desde la nutrición (parte II)
Publicado 3 de noviembre de 2015, 15:42
Fernando Mata Ordóñez, Pedro Carrera Bastos, Laura Sánchez, Oscar Picazo, Antonio J. Sánchez Oliver
En la primera parte del blog, abordamos como el ejercicio de larga duración o intensidad, puede ser desencadenante de diferentes formas de síntomas gastro intestinales (sGI) en deportistas.
Teniendo todo esto como contexto, vamos a intentar mostrar en esta segunda parte del blog, los aspectos nutricionales a tener en cuenta en la mejora de problemas GI en deportistas.
CAUSAS NUTRICIONALES
Tal y como describe Oliveira et al.(2014) la nutrición puede tener una fuerte influencia sobre el distrés GI. De esta forma, la fibra, grasas, proteínas, hidratos de carbono y las soluciones concentradas se han asociado con un mayor riesgo de distrés GI durante el ejercicio.
Igualmente, la deshidratación también juega un papel destacado pudiendo exacerbar los síntomas influyendo sobre el aumento de la temperatura central (Lambert et al.,2008). Aunque queda mucho por saber en cuanto a la etiología de los problemas GI en deportistas, algunas manipulaciones nutricionales han sido sugeridas para reducir la severidad de los síntomas.
El consumo excesivo de bebidas hipertónicas está relacionado con distrés GI (Rehrer N.J et al.,1992). Por ejemplo, se ha visto que bebidas por encima de los 500 mOsm/L están asociadas con un incremento de la incidencia de síntomas (Oliveira et al.,2014). A este respecto se deben tener en cuenta numerosos factores como la concentración de CHO en la bebida, el tipo,la acidez de la bebida y la osmolaridad, siendo, el contenido de CHO la que más afecta a esta última. Y en realidad, la ingesta de CHO puede ser un factor importante a considerar en los problemas GI en deportistas que, bajo la creencia “más es mejor” y con el fin de retrasar la fatiga, toman elevadas cantidades de CHO, lo que puede dar lugar a distrés GI, como demostró Pfeiffer et al. (2009), al observar mayor prevalencia de náuseas después de la ingestión de una alta concentración de CHO (90 g / h), en comparación con cantidades más bajas (60 g / h) durante una carera de 16 km. En otro estudio sobre la flatulencia, esta se relacionó con el consumo de CHO (bebida deportiva) en comparación con la ingesta de agua. Todos estos datos sugieren que la ingesta de CHO puede aumentar el riesgo de náuseas y flatulencia durante el ejercicio (Van Nieuwenhoven et al.,2005), por lo que hay que encontrar soluciones que garanticen la maximización del rendimiento disminuyendo el distrés GI.
La ingesta de carbohidratos que usan diferentes transportadores intestinales, como por ejemplo glucosa (transportador SGLT-1) y fructosa (transportador GLUT-5), reduce los síntomas en comparación a la ingesta de la misma cantidad de un solo carbohidrato (glucosa), pues garantiza que más CHO sean absorbidos y que menos pasen al cólon y sean fermentados. Por ejemplo, Rowland et al. (2012) observaron menores molestias GI con el uso de carbohidratos con múltiples transportadores (maltodextrina + fructosa) en corredores de mountain bike en comparación con los que ingerían glucosa y maltodextrina, además de un aumento del rendimiento en el estudio realizado en condiciones de laboratorio.
En cuanto a la forma de la ingesta de carbohidratos se pueden dar, generalmente, que sea sólida, en gel o líquido. Los geles y bebidas que contienen CHO son la principal fuente de CHO durante las carreras, mientras que la forma sólida es menos utilizada, no habiendo diferencia en la oxidación de CHO exógenos entre las diferentes formas. Sin embargo, el consumo de CHO en forma solida aumenta la “sensación de llenado” en el estómago cuando se compara con gel y bebidas (Pfeiffer B.,2010a,b), debiéndose evitar en individuos con historia de problemas GI. Así mismo, un estudio reciente en triatletas, muestra mayor incidencia de malestar GI del gel frente al líquido, aunque ello no influyó sobre el rendimiento (Sareban et al.,2015)
NUTRIENTES QUE PROTEGEN NUESTRA BARRERA INTESTINAL: IMPORTANCIA DE LA PERMEABILIDAD INTESTINAL
Existe evidencia de cómo los diferentes compuestos presentes en los alimentos de forma natural y los aditivos alimentarios pueden generan cambios en la permeabilidad intestinal. Si bien no es el tema de desarrollo en este blog, tratándolo con mas detalle en algunos posteriores, es importante considerar el aumento marcado de enfermedades de tipo autoinmune que tienen como defecto primario la disfunción de las TJ. Ello se ha observado en enfermedades autoinmunes (EAI) como la colitis ulcerosa, enfermedad de Crohn, celiaquía, enfermedades inflamatorias articulares, espondilitis anquilosante, artritis juvenil, soriasis, diabetes mellitus tipo I, entre otras (Lerner et al.,2015). Igualmente cabe recordar que una de las posibles causas de los problemas GI en los deportista viene mediada por el aumento de esta permeabilidad intestinal.
¿Cómo evitar el aumento de la permeabilidad intestinal?
El epitelio intestinal constituye una barrera selectiva, lo que favorece el flujo de nutrientes, regula los movimientos de iones y agua y limita el contacto del hospedador con la carga intraluminal de antígenos de la dieta y los microbios. (Ménard et al., 2010). El paso transepitelial de pequeñas cantidades de antígenos derivados de los alimentos y microorganismos participan en la inducción de una respuesta inmune homeostática dominada por una tolerancia inmune a antígenos dietéticos y la producción local de inmunoglobulinas secretoras A (SIgA), previniendo así que patógenos y microbios comensales entren en compartimentos internos (Ménard et al., 2010).
Como destacamos en la primera parte del blog, las proteínas de shock térmico (HSP) tienen un importante papel en la integridad de las TJ. Diversos estudios están incidiendo en cómo diferentes nutrientes puede aumentar la expresión de HSPs de forma que las protejan a las TJ de agentes estresantes, como la enfermedad inflamatoria intestinal o el ejercicio. Se van a considerar sólo algunos de los suplementos y nutrientes que más se han estudiado con relación al deporte y la permeabilidad intestinal, si bien, y como se puede observar en la figura 1, deben ser considerados muchos otros.
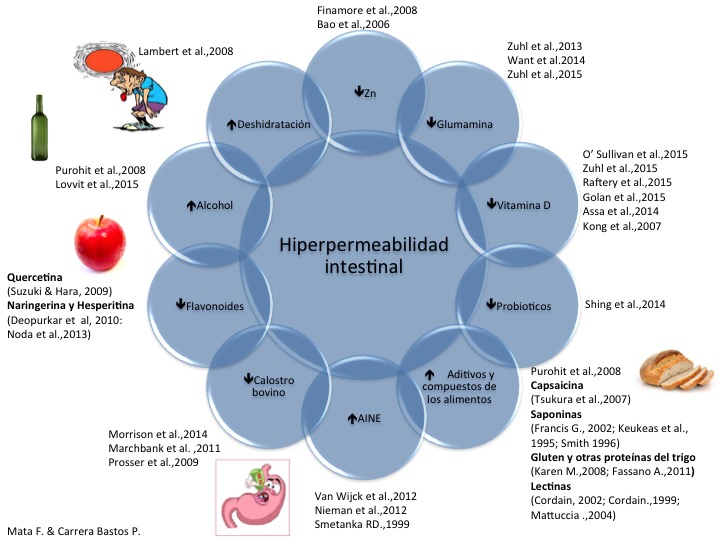
Figura 1. Factores alimentarios relacionados con el aumento o disminución de la permeabilidad intestinal
Estudios en animales muestran que la suplementación con calostro bovino (CB) puede ayudar a proteger el incremento de PI en respuesta al incremento de temperatura (Prosser et al,2004). En un estudio de Marchbank et al. (2011) llevado a cabo con 12 hombres sanos, ingirieron 20 g de CB o placebo durante dos semanas tras lo cual fueron sometidos a un programa de ejercicio. Se observó un incremento de la temperatura corporal media de 1,5ºC durante su realización. El estudio dio como resultado un aumento en la expresión de HSP70 en células intestinales humanas en respuesta a la suplementación en medios de cultivo de calostro bovino junto con una reducción de la permeabilidad intestinal en los sujetos que realizaron ejercicio después de 14 días de suplementación.
Bajas concentraciones de Zinc han sido, frecuentemente, asociadas con enfermedad inflamatoria intestinal (EII) e inflamación de la mucosa debido a la infección por Helicobacter pylori (Sturniolo GC et al., 2001; Sempertegui F.,2007). El Zn contribuye a la defensa del hospedador mediante el mantenimiento de la estructura y función de la barrera intestinal, la cual está de forma continua expuesta a patógenos y agentes nocivos (Bao et al., 2006; Rodriguez P. Et al.,1996). Recientes estudios muestran como la depleción de Zn, junto con citoquinas proinflamatorias potencia la degradación de E-caherina y β-catenina, proteínas del epitelio pulmonar (Bao et al.,2006).
En un estudio llevado a cabo por Finamore A. et al. (2008) estudiaron in vitro como la deficiencia de Zn podía afectar a la estructura de las TJ de la membrana intestinal. Para ello, tomaron tres cultivos diferentes de células Caco-2 (Caco-2 control, Caco-2 deficientes en Zn y unas terceras con un medio repleto en Zn). El estudio muestra como la deficiencia de Zn afecta fuertemente a la función e integridad de la barrera epitelial, así como induce un incremento en la transmigración de neutrófilos y de quimioquinas que intervienen en la migración de neutrófilos y desarrollo de inflamación. El estudio mostró como la depleción de Zn en células en cultivo causó fosforilación de los complejos de unión celular y desorganización del citoesqueleto, promoviendo migración de los neutrófilos. En pacientes con enfermedad inflamatoria intestinal y bajas concentración de Zn en la mucosa es común encontrar acumulación de neutrófilos en las criptas epiteliales y lumen intestinal, resultando en la formación de abscesos en las criptas. Un estudio reciente de Wang et al. (2013) muestran como el Zn altera la composición de las TJ y su función selectiva en células CACO-2 en cultivo. El estudio demuestra como la suplementación con Zn modifica la composición de las TJ del las células epiteliales en cultivo CACO-2, mejorando la función de la barrera.
La glutamina (gln) es el aminoácido más abundante el cuerpo humano, siendo esencial en neonatos y condicionalmente esencial para adultos (Rezaei et al., 2013; Wu et al.,2014). En la década pasada se acumulo evidencia de la importancia de la glutamina (Gln) en la función intestinal en humanos y otros animales (Wu et al.,2013). La Glu es oxidada en el ciclo de Krebs para producir ATP para la rápida división de las células (incluyendo enterocitos y linfócitos) (Wu et al.,1195;1996). Glutamina activa mTOR incrementando la síntesis de proteínas en el enterocito (Xi et al., 1995; Wu et al.,1996), promueve el desarrollo intestinal, regula la expresión de TJ e inmunidad intestinal, inhibe la apoptosis inducida por el estrés oxidativo y otros estímulos (Wu et al., 2013). Además, sirve como importante precursor para la síntesis de otras moléculas biologicamente activas, como glutation (antioxidante no enzimático más importante en el organismo), glutamato, prolina, arginina y síntesis de nucleotidos. (Wu et al., 2011). Ademas, la Gln es precursor de la sínteses de nucleotidos de purina y pirimidina, esencial para la sínteses de DNA y proliferación celular (Wu et al.,1998)
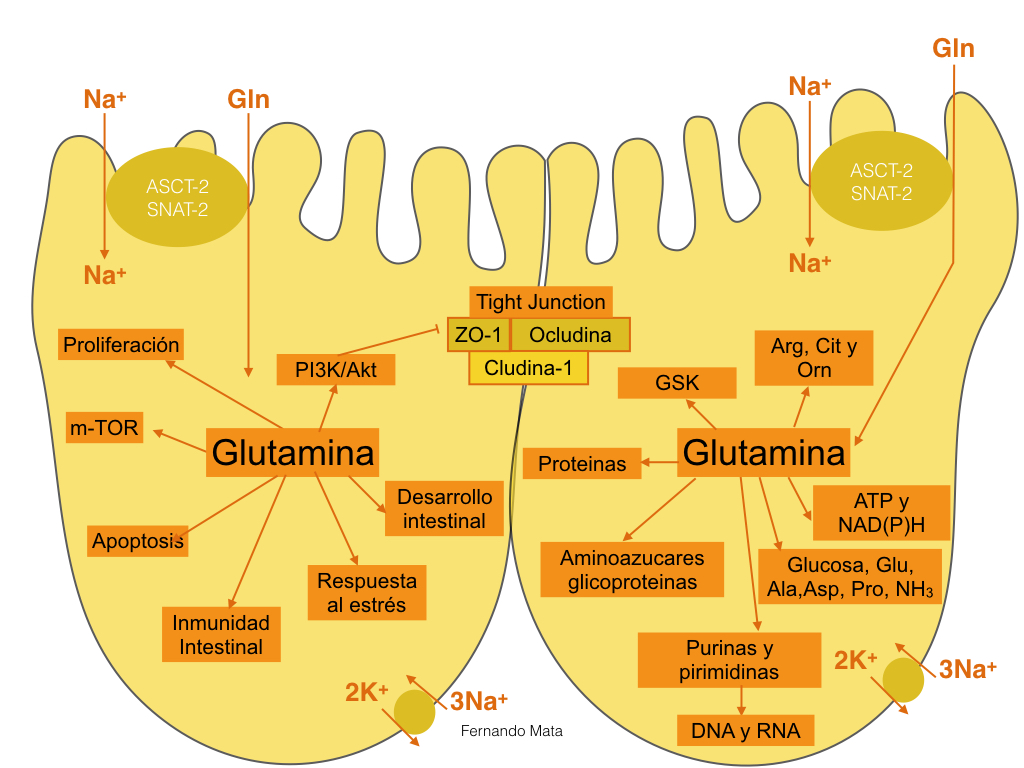
Imagen 2. Rol de la glutamina a nivel intestinal. Modificado de Wang et al.,2014
La privación de Gln o inhibición de la glutamina sintetasa conlleva una disminución de la resistencia transepitelial e incremento de la permeabilidad al igual que una reducción de las proteínas TJ, Claudina-1 u ocludina en células Caco-2 (De Marco et al., 2013: Li et al.,2004). Esto puede ser revertido añadiendo al medio Gln (De Marco et al., 2003). Molecularmente, la deprivación de Gln aumenta la expresión de PI3K/AKT, lo que a su vez, reduce la abundancia de Claudina 1, resultando en la ruptura de la barrera (Li and Neu.,2009).
En un reciente estudio, Noth et al.,2013, demuestran como la administración oral de Gln eleva la expresión de ocludina, reduciendo la permeabilidad intestinal y la apoptosis de las células de la cripta intestinal.
La glutamina, además, se ha comprobado puede mejorar el sistema inmunitario intestinal normalizando los valores de IgA, lo que resulta en una disminución de la adherencia de las bacterias al enterocito y, por tanto, una menor permeabilidad intestinal a las bacterias (Flip R., et al.,2007)
Estudios recientes muestran como la glutamina induce aumento en la proteína de choque térmico (HSP). En un estudio Zuhl et al. (2013) muestran que la suplementación con glutamina durante un protocolo de 7 días (0,9 g/ Kg masa libre de grasa) reduce la permeabilidad intestinal tras un ejercicio intenso (60 min de cinta de correr al 60-70%VO2). Los autores del estudio proponen dos vías para la disminución de las permeabilidad intestinal. La primera propone la activación de HFS-1 y HSP70, seguido de la estabilización de las ocluidas y disminución de la permeabilidad; En la segunda, la activación de HSP70 y IkBa en células mononucleares plasmáticas periféricas inactiva la vía proinflamatoria NF-kb.
En un estudio más reciente, Zulh et al. (2015), observaron la ingesta aguda pre-esfuerzo de Gln (0,9 g/Kg) en 7 sujetos sometidos a dos sesiones de carrera en cinta al 70% VO2máx y 30ºC. Los resultados del estudio muestran como la ingesta aguada de Gln previa al ejercicio disminuyen la permeabilidad intestinal y reduce la producción de citoquinas pro-inflamatorias. El efecto parece estar mediado por el aumento de HSP lo cual estabiliza las TJ previniendo la entrada de toxinas y por otro lado, mediante la supresión de NF-κB en leucitos periféricos.
Aunque la muestra de ambos estudios no es muy elevada y son necesarios más estudios, los resultandos señalan a un efecto positivo de la ingesta de glutamina en la prevención del aumento de la permeabilidad intestinal.
La glutamina también se ha visto juegan un papel importante en la vía arginina-oxido nítrico (ON), ya que puede ser transformado en citrulina, un precursor de la arginina. El ON produce vasodilatación, si bien, no se ha encontrado ningún estudio relacione directamente a la glutamina con un aumento del flujo GI en atletas. Sin embargo, Wijck et al. (2014) realizaron una prueba de bicicleta a diez hombres durante 60 min a una intensidad de 70% de su carga máxima después de la administración de L-citrulina (10 gr) o placebo (L-alanina). Se evaluó la mejora de la perfusión esplácnica y disminución de daño intestinal por el aumento de la biodisponibilidad de arginina tras la administración de citrulina, lo que mostró que la suplementación de L-citrulina aumenta la concentración plasmática de citrulina y arginina comparado con el placebo (p<0,0001). En el estudio concluyeron que la toma de L-citrulina plasmática, podría preservar la perfusión esplácnica y atenuar el daño intestinal durante el ejercicio en comparación con el placebo.
Existe evidencia de que los probioticos mejoran la función intestinal y potencian la integridad de las TJ. (Ohland et al.,2010). Se ha visto previenen la fosforilación de las ocludinas, incrementando la interacción entre ZO-1 (Ewaschuk JB et al.,2008) y el citoesqueleto de actina (Ait-Belganoui et al.,2006) en modelos de ratas experimentales con colitis.. Un estudio reciente de Shing et al.,2014 llevado a cabo en 10 sujetos a los que durante 4 semanas se les suplementó con probioticos encapsulados (45 billones de CFU de Lactobacillus, Bifidobacterium y Steptococcus) frente a placebo, seguido de la realización de ejercicio a una intensidad de la carrera hasta el agotamiento fijada en el 80% del umbral ventilatorio y una temperatura de 35ºC y 40% de humedad relativa. Los resultados del estudios mostraron que 4 semanas de suplementación con probioticos incremento el tiempo hasta la fatiga durante el ejercicio en condiciones de calor. Aunque los mecanismo no están claros, cambios en la integridad estructural gastrointestinal, translocación bacteriana y modulación inmunológica tras la suplementación con probioticos puede ser algunos. Si bien, la evidencia en humanos es limitada sobre su papel en la protección frentes al estrés térmico y la isquemia generada por el ejercicio haciendo falta aún más estudios.
Se ha visto que diferentes flavonoides contribuyen a la mejora de la permeabilidad intestinal, como por ejemplo la quercentina presente en algunos alimentos como la cebolla o la narigerina presente en la naranja.
En cuanto a aquellos agentes que elevan la permeabilidad intestinal, un estudio reciente de Lerner A. & Matthias T. (2015) analizan como diferentes aditivos alimentarios pueden afectar a las TJ y por ende a las EAI. Azúcar, sal, emulsionantes, surfactantes, solventes orgánicos, gluten, transglutaminasa microbiana, nanoparticulas, utilizados comúnmente en la industria alimentaria, parecen afectar a las TJ, aumentando la permeabilidad y endotoxemia, lo que se hipotetiza poder estar relacionados con enfermedades como por ejemplo las autoinmunes.
Por último, el uso de analgésicos en el deporte esta bastante extendido. La toma de antiinflamatorio no esteroideos (AINEs) está asociada con un riesgo de entre 3-5 veces mayor de complicaciones gastrointestinales, sangrado de mucosa y perforación en comparación a la no medicación (Gabriel SE.,et al.,1991)
Bibliografia
Bao S, Knoell DL. Zinc modulates cytokine-induced lung epithelial cell barrier permeability. Am J Physiol Lung Cell Mol Physiol. 2006; 291:L1132–41.
Chin AC, Parkos CA. Neutrophil transepithelial migration and epithelial barrier function in IBD: potential targets for inhibiting neutrophil trafficking. Ann N Y Acad Sci. 2006;1072:276–87.
Gabriel SE, Jaakkimainen L, Bombardier C. Risk for serious gastrointestinal complications related to use of nonsteroidal anti- inflammatory drugs. A meta-analysis. Ann Intern Med. 1991;115:787–96.
Jentjens RL, Achten J, Jeukendrup AE. High oxidation rates from combined carbohydrates ingested during exercise. Med Sci Sports Exerc. 2004;36:1551–8.
Jentjens RL, Underwood K, Achten J, et al. Exogenous carbohydrate oxidation rates are elevated after combined ingestion of glucose and fructose during exercise in the heat. J Appl Physiol. 2006;100:807–16.
Jentjens RL, Venables MC, Jeukendrup AE. Oxidation of exog- enous glucose, sucrose, and maltose during prolonged cycling exercise. J Appl Physiol. 2004;96:1285–91.
Jeukendrup AE, Moseley L, Mainwaring GI, et al. Exogenous carbohydrate oxidation during ultraendurance exercise. J Appl Physiol. 2006;100:1134–41.
Kucharzik T, Walsh SV, Chen J, Parkos CA, Nusrat A. Neutrophil transmigration in inflammatory bowel disease is associated with differential expression of epithelial intercellular junction proteins. Am J Pathol. 2001;159:2001–9.
Lambert GP, et al. Int J Sports Med. 2008 Mar;29(3):194-8
Pfeiffer B., Stellingwerff T., Hodgson A.B., Randell R., Pottgen K., Res P., Jeukendrup A.E. Nutritional intake and gastrointestinal problems during competitive endurance events. Med. Sci. Sports Exerc. 2012;44:344–351
Pfeiffer B., Stellingwerff T., Zaltas E., Jeukendrup A.E. CHO oxidation from a CHO gel compared with a drink during exercise.Med. Sci. Sports Exerc.2010;42:2038–2045.
Pfeiffer B., Stellingwerff T., Zaltas E., Jeukendrup A.E. Oxidation of solidversusliquid CHO sources during exercise.Med. Sci. Sports Exerc.2010;42:2030–2037.
Rehrer N.J., van Kemenade M., Meester W., Brouns F., Saris W.H. Gastrointestinal complaints in relation to dietary intake in triathletes. Int. J. Sport Nutr. 1992;2:48–59.
RodriguezP,DarmonN,ChappuisP,CandalhC,BlatonMA,Bouchaud C, Heyman M. Intestinal paracellular permeability during malnutrition in guinea pigs: effect of high dietary zinc. Gut. 1996;39:416–22.
Rowlands DS, Swift M, Ros M, et al. Composite versus single transportable carbohydrate solution enhances race and laboratory cycling performance. Appl Physiol Nutr Metab. 2012;37:425–36.
Sareban M, et al. Int J Sport Nutr Exerc Metab. 2015
Sempertegui F, Dı ́az M, Mejı ́a R, Rodrı ́guez-Mora OG, Renterı ́a E, Guarderas C, Estrella B, Recalde R, Hamer DH, et al. Low concentra- tions of zinc in gastric mucosa are associated with increased severity of Helicobacter pylori-induced inflammation. Helicobacter. 2007;12:43–8.
Smetanka RD, Lambert GP, Murray R, et al. Intestinal perme- ability in runners in the 1996 Chicago marathon. Int J Sport Nutr. 1999;9:426–33.
Sturniolo GC, Di Leo V, Ferronato A, D’Odorico A, D’Inca R. Zinc supplementation tightens ‘‘leaky gut’’ in Crohn’s disease. Inflamm Bowel Dis. 2001;7:94–8.
Sturniolo GC, Fries W, Mazzon E, Di Leo V, Barollo M, D’inca R. Effect of zinc supplementation on intestinal permeability in experimental colitis. J Lab Clin Med. 2002;139:311–5
Sturniolo GC, Mestriner C, Lecis PE, D’Odorico A, Venturi C, Irato P, Cecchetto A, Tropea A, Longo G, et al. Altered plasma and mucosal concentrations of trace elements and antioxidants in active ulcerative colitis. Scand J Gastroenterol. 1998;33:644–9.
Van Nieuwenhoven M.A., Brouns F., Kovacs E.M. The effect of two sports drinks and water on GI complaints and performance during an 18-km run. Int. J. Sports Med. 2005;26:281–285
van Wijck K, Lenaerts K, van Bijnen AA, et al. Aggravation of exercise-induced intestinal injury by Ibuprofen in athletes. Med Sci Sports Exerc. 2012;44:2257–62.
Wang X, Valenzano MC, Mercado JM, Zurbach EP, Mullin JM. Zinc supplementation modifies tight junctions and alters barrier function of CACO-2 human intestinal epithelial layers. Dig Dis Sci. 2013;58:77–87
