Readaptación funcional de lesiones deportivas: una visión neurocientífica.
Publicado 28 de junio de 2016, 20:47
Los procesos de recuperación después de sufrir una lesión deportiva se han basado tradicionalmente en el paradigma de la ‘patología estructural’. El foco de la rehabilitación a través del entrenamiento está basado en ir incrementando el estrés mecánico generado en los tejidos de manera gradual hasta que el deportista se encuentre en condiciones de volver a competir. Esta visión es completamente lógica pero, en cierto modo, incompleta.
Cuando se produce una lesión deportiva, además de los daños estructurales, es muy probable que se haya producido alteraciones en diferentes niveles del sistema nervioso central (SNC). Un claro ejemplo son los cambios producidos en las representaciones corticales relacionadas con la propiocepción, el movimiento y el espacio peripersonal. Es importante tener en cuenta todos estos cambios cerebrales si queremos optimizar la recuperación de los deportistas (Wallwork et al., 2015).
Los procesos de inflamación asociados a la lesión músculo-esquelética generan alteraciones en la transmisión y procesamiento de la información propioceptiva, además de cambios neuroplásticos en las propiedades y funciones de las neuronas en el córtex motor primario (M1) y córtex sensorial primario (S1) (Jo Nijs et al., 2012).
Todos estos cambios neurológicos se empiezan a producir rápidamente después de una lesión y tienen como principal objetivo la protección y curación de los tejidos. El problema es que, en muchas ocasiones, estos cambios neuroplásticos pueden persistir más tiempo del necesario y pueden contribuir a la limitación del rendimiento deportivo y/o la cronicidad de las lesiones (Pelletier et al., 2015).
Por tanto, la nueva hipótesis propuesta es que la reorganización del SNC es el mecanismo que subyace en el déficit neuromuscular que persiste después de una lesión, en particular, la debilidad muscular (Ward et al., 2015).
Pongamos un ejemplo con una lesión articular de rodilla durante un partido de fútbol (ver Figura Ward et al., 2015):
- Se puede producir una ‘desaferenciación’ en los mecanorreceptores resultado de esa lesión articular directa, generando un input aferente alterado hacia el SNC (Kapreli & Athanasopoulos, 2006).
- Este déficit en la información propioceptiva puede derivar en una reorganización estructural y funcional del SNC (Cramer et al., 2011).
- Además, M1 recibe un input clave desde S1 (Donoghue & Sanes, 1994). Teniendo en cuenta esta relación, es evidente que una alteración en la información propioceptiva desde la periferia afecte considerablemente al input hacia S1 y, por ende, a sus conexiones con M1. Esta situación afectará al output final hacia los músculos y, por tanto, al rendimiento.
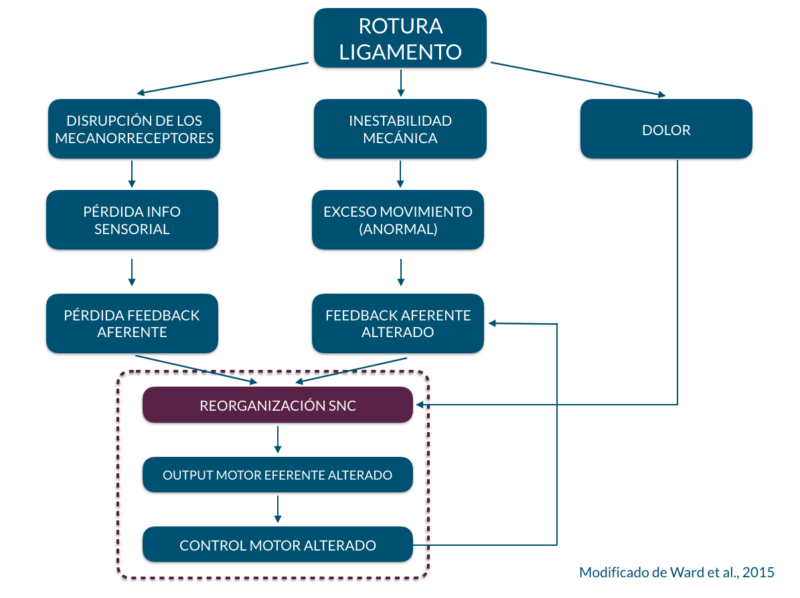
Como ya hemos dicho, estas alteraciones en el SNC pueden perdurar durante bastante tiempo debido a procesos neuroplásticos. De hecho, se sabe que algunas consecuencias neuromusculares después de este tipo de lesión son la disminución de la fuerza muscular y la alteración de la activación muscular (Ingersoll et al., 2008; Hart et al., 2010), con las implicaciones funcionales que esto conlleva. Se podrían producir alteraciones importantes en la biomecánica que, aunque beneficiosas a corto plazo, podrían generar daños a medio y largo plazo (Palmieri-Smith & Tomas, 2009; Palmieri-Smith et al., 2007).
El entrenamiento de fuerza únicamente puede no ser suficiente cuando este tipo de déficits neuromusculares están presentes debido a la alteración del SNC (Huang et al., 2008; Palmieri-Smith et al., 2008). Por ejemplo, el entrenamiento de fuerza convencional del cuádriceps no incrementará su activación en aquellos deportistas con este tipo de déficits de activación (Pietrosimone et al., 2011) ya que este estímulo puede que no sea suficiente para generar cambios en el SNC (Pietrosimone et al., 2009; Pietrosimone et al., 2008). En este sentido, Pietrosimone lleva realizando un gran trabajo de investigación a la hora de abordar diferentes herramientas que incrementen la efectividad del entrenamiento de fuerza para generar cambios neuroplásticos en el SNC.
Ante esta situación, se hace necesaria una mayor comprensión de los principios relacionados con los procesos de neuroplasticidad para intentar revertir estas alteraciones producidas en el SNC.
No obstante, el enfoque actual en los procesos de recuperación está principalmente relacionado con la prescripción de ejercicio basado en los protocolos investigados en ensayos clínicos sin tener muy en cuenta los procesos centrales cerebrales asociados con la neuroplasticidad (Snodgrass et al., 2014).
Teniendo todo esto en cuenta, de cara a un futuro, será interesante profundizar en los mecanismos neurofisiológicos que sustentan los cambios adaptativos sensoriomotores asociados con la disfunción musculoesquelética y los potenciales cambios neuroplásticos que se pueden llevar a cabo a través de nuestras intervenciones con ejercicio físico.
Me gustaría dejaros una reflexión en un artículo de Snodgrass y otros investigadores en 2014 sobre la importancia que tiene reconocer la neuroplasticidad en la recuperación de lesiones músculo-esqueléticas:
“Aunque los terapeutas estén trabajando con un cerebro no-lesionado en pacientes con disfunciones músculo-esqueléticas, las bases neuro-biológicas de la neuroplasticidad y el potencial de aprendizaje motor es el mismo que para personas con daño cerebral como el ictus”.
En este sentido, y para más información al respecto, recomendamos la lectura del artículo de Snodgrass et al., 2014. En próximas entradas seguiremos profundizando en este apasionante tema!
RICARDO MARTÍNEZ TOURAL - NEUROMECÁNICA LAB
www.neuromecanica.com
Facebook: http://bit.ly/25B7VZ1
REFERENCIAS
- Cramer SC, Sur M, Dobkin BH, O'Brien C, Sanger TD, Trojanowski JQ et al. Harnessing neuroplasticity for clinical applications. Brain 2011;134(6):1591-1609.
- Donoghue JP, Sanes JN. Motor areas of the cerebral cortex. J Clin Neurophysiol 1994;11(4):382-396.
- Hart J, Pietrosimone B, Hertel J, Ingersoll C. Quadriceps activation following knee injuries: A Systematic Review. Journal of Athletic Training 2010;45(1):87-97.
- Huang SC, Wei IP, Chien HL, et al. Effects of severity of degeneration on gait patterns in patients with medial knee osteoarthritis. Med Eng Phys. 2008;30(8):997-1003.
- Ingersoll C, Grindstaff T, Pietrosimone B, Hart J. Neuromuscular consequences of anterior cruciate ligament injury. Clin Sport Med 2008;27(3):383- 404.
- Kapreli E, Athanasopoulos S, Gliatis J, Papathanasiou M, Peeters R, Strimpakos N et al. Anterior cruciate ligament deficiency causes brain plasticity: A functional MRI study. Am J Sports Med 2009;37(12):2419-2426.
- Nijs J, Daenen L, Cras P, et al. Nociception affects motor output: a review on sensory-motor interaction with focus on clinical implications. Clin J Pain 2012;28:175–81.
- Palmieri-Smith R, Thomas A, Wojtys E. Maximizing quadriceps strength after ACL reconstruction. Clin Sports Med. 2008;27(3):405-425
- Palmieri-Smith R, Thomas A. A neuromuscular mechanism of posttraumatic osteoarthritis associated with ACL injury. Exerc Sport Sci Rev. 2009;37(3):147-153
- Palmieri-Smith RM, Kreinbrink J, Ashton-Miller JA, Wojtys EM. Quadriceps inhibition induced by an experimental knee joint effusion affects knee joint mechanics during a single-legged drop landing. Am J Sports Med. 2007;35(8):1269-1275.
- Pelletier R, Higgins J, Bourbonnais D. Is neuroplasticity in the central nervous system the missing link to our understanding of chronic musculoskeletal disorders? BMC Musculoskelet Disord 2015;16:1-13.
- Pietrosimone B, Saliba S, Hart J, Hertel J, Kerrigan D, Ingersoll C. Effects of TENS and therapeutic exercise on quadriceps activation in people with tibiofemoral osteoarthritis. J Orthop Sports Phys Ther. 2011;41(1):4-12.
- Pietrosimone BG, Hart JM, Saliba SA, Hertel J, Ingersoll CD. Immediate effects of transcutaneous electrical nerve stimulation and focal knee joint cooling on quadriceps activation. Med Sci Sports Exerc. 2009;41(6):1175-1181.
- Pietrosimone BG, Hopkins JT, Ingersoll CD. Therapeutic modalities: the role of disinhibitory modalities in joint injury rehabilitation. Athl Ther Today. 2008;13(6):2-5.
- Snodgrass SJ, Heneghan NR, Tsao H, Stanwell P, Rivett DA, van Vliet PM. Recognising neuroplasticity in musculoskeletal rehabilitation: a basis for greater collaboration between musculoskeletal and neurological physiotherapists. Man Ther. 2014;19:614–7.
- Wallwork SB, Bellan V, Catley MJ, Moseley GL. Neural representations and the cortical body matrix: implications for sports medicine and future directions. Br J Sports Med. 2015
- Ward S, Pearce AJ, Pietrosimone B, Bennell K, Clark R, Bryant AL. Neuromuscular deficits after peripheral joint injury: a neurophysiological hypothesis.Muscle Nerve. 2015; 51(3):327-32
